Vládní návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů, a zákon č. 372/2011 Sb., o zdravotních službách a podmínkách jejich poskytování (zákon o zdravotních službách), ve znění pozdějších předpisů
262/0
Xxxxx
XXXXX
xx dne … 2018,
xxxxxx xx xxxx xxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (zákon o xxxxxxxx), ve xxxxx xxxxxxxxxx xxxxxxxx, x xxxxx č. 372/2011 Sb., x xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx jejich poskytování (xxxxx o xxxxxxxxxxx xxxxxxxx), ve znění xxxxxxxxxx xxxxxxxx
Xxxxxxxxx xx xxxxxx xx xxxxx xxxxxx Xxxxx xxxxxxxxx:
XXXX XXXXX
Xxxxx xxxxxx x xxxxxxxx
Čl. I
Zákon č. 378/2007 Sb., x xxxxxxxx a x změnách xxxxxxxxx xxxxxxxxxxxxx zákonů (zákon x léčivech), xx xxxxx xxxxxx x. 124/2008 Sb., xxxxxx x. 296/2008 Sb., xxxxxx č. 141/2009 Xx., xxxxxx x. 281/2009 Sb., xxxxxx x. 291/2009 Sb., xxxxxx x. 75/2011 Xx., xxxxxx x. 375/2011 Xx., zákona x. 50/2013 Xx., xxxxxx x. 70/2013 Xx., xxxxxx č. 250/2014 Xx., zákona x. 80/2015 Sb., xxxxxx č. 243/2016 Xx., xxxxxx č. 65/2017 Xx., xxxxxx x. 66/2017 Xx., xxxxxx x. 183/2017 Xx., xxxxxx č. 251/2017 Xx. x xxxxxx x. 36/2018 Xx., xx xxxx xxxxx:
1. Xx xxxxx xxxxxxxx pod čarou x. 2 xx xx samostatný xxxxx xxxxxxxx věta „Xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) 2016/161 xx dne 2. xxxxx 2015, kterým xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/ES xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx prvky xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx přípravků.“.
2. X §5 xxxxxxxx 7 xxx:
„(7) Xxxxxxxx vyhrazených xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxx nákup, xxxxxxxxxx nebo xxxxxx. Xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx jejich xxxxx, xxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxxxxx.“.
3. X §6 xx xx xxxxx xxxxxxxx 2 xxxxxxxx xxxx „X xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx přípravků se xxxxxxxx správné výrobní xxxxx xxxxxxx obdobně xx xxxxx xx xxxxxxx xxxx.“.
XXXXX: 32017L1572
4. X §13 xxxx. 2 xx xx konci xxxxx xxxxxxx x) xxxxxxxx xxxxx „a přímo xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxx“.
5. X §13 xx na konci xxxxxxxx 2 xxxxx xxxxxxxxx čárkou x xxxxxxxx se písmeno x), xxxxx xxxxxx xxxxxxxx pod čarou x. 106 zní:
„o) xx příslušným orgánem Xxxxx xxxxxxxxx pro xxxxxx xxxxxx xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx uvedené xx xxxxx xxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxx uvedené xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx106) (xxxx xxx „xxxxxxxx x ochranných xxxxxxx“), má xxxxxxx xx xxxxxxx xxxxxxx x k xxxxxxxxxx x xxxx xxxxxxxxx x xxxxxxx x xx. 39 xxxxxxxx x xxxxxxxxxx xxxxxxx, x xxxxxxxx kontrolu xxxxxxxxx xxxxxx xxxxxxx, xxxxxxx x xxxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxx přípravků a xxxxxx plynoucí x xxxxxx padělání a xxxxxx x xxxx xxxxxxx xxxxxxxxx Xxxxxx.
XXXXX: 32016R0161
6. X §13 xx na konci xxxxxxxx 2 xxxxx xxxxxxxxx čárkou a xxxxxxxx xx xxxxxxx x) x q), xxxxx včetně xxxxxxxx xxx čarou x. 107 x 108 xxxxx:
x) xx příslušným xxxxxxx České republiky xxx plnění xxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxx, xxxxxx se xxxxxxx xxxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx107) (xxxx xxx „nařízení o xxxxxxx výrobní praxi xxx xxxxxxxxx xxxxxx xxxxxxxxx“) x xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxx, xxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx108) (xxxx xxx „xxxxxxxx o xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx“),
x) xx xxxxxxxxxx orgánem Xxxxx republiky xxx xxxxxxxx povolení k xxxxxx a xxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxxxx nařízení x xxxxxxxxx xxxxxxxxx.
XXXXX: 32017R1569, 32017R0556, 32014R0536
7. V §13 xxxx. 3 xxxxxxx x) zní:
„l) zavede x udržuje systém xxxxxxx, xxxxx xxxxxxxxx
1. xxxxxx xxxxxxx o xxxxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx Xxxxxx, xxxxx provádí xxxxxxxxx x kontrolu x xxxxxxxxx xxxxx xxxxxx xxxxxx nebo přímo xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx, xxxxxx xxxxxx xxxx povinností, odpovědností x xxxxxxxxx na xxxxxxxx xxxxxxxx,
2. dodržování xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické xxxxx x souladu x xxxxxxxxx o xxxxxxxxx xxxxxxxxxxx postupů xxxxxxx xxxxxxxx xxxxx,
3. xxxxx xxxxxxxxx xxxxxxx dodržování xxxxxx zákona x xxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx x výrobců xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx léčivých xxxxxxxxx,“.
XXXXX: 32017L1572, 32017R1569, 32017R0556
8. X §16 xxxx. 3 písm. x) xx xxxxx „xxxxxxx“ xxxxxxxxx xxxxxx „xxxxxxx“.
9. V §22 xxxx. 2 se xx xxxxx „hodnocení“ xxxxxxxx xxxxx „veterinárních xxxxxxxx xxxxxxxxx“.
10. V §23 xx xx xxxxx xxxxxxxx 1 xxxxx xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x) xx h), xxxxx xxxxx:
„x) xxxxxxxxxx xxxxxxx Xxxxxx, xxx-xx x xxxxxxx xxxxxx xxxxxxxxx, xxxxxxxxx xx xxxxxxxx léčivý přípravek, xxxxxxxxx-xx xxxx xxxx xxxxxxxxx x nařízení x xxxxxxxxxx prvcích,
g) xxxxxxxxxx Xxxxxx součinnost xxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx x podezřením xx xxxxxxxx xxxxxxxx xxxxxxxxx,
x) neprodleně xxxxxxx Xxxxxxxxxxxxx xxxxxx podezření xx padělaný xxxxxxxxxxx xxxxxx xxxxxxxxx.“.
11. V §24 xxxx. 10 se xxxxx „xxxx xxxxxxxxx“ xxxxxxx.
12. X §34 xx xxxxxxxx xxxxxxxx 9, xxxxx zní:
„(9) Xxxxx nebo Veterinární xxxxx xxxxxxxxxx zahájí xxxxxx z moci xxxxxx x xxxxx xxxxxxxxxx léčivého xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxxx v xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx se xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx.“.
13. V §37 xxxx. 1 xx xx slova „identifikaci xxxxxxxx přípravku,“ xxxxxxxx xxxxx „nejde-li o xxxxxxxxx identifikátor,“, xxxxx „xxxxxxxxx xxxxxxxx xxxxx (XXX)“ se nahrazují xxxxx „xxxxxxxxxxx uznávaným xxxxxxxxxxxxxx xxxxxxxxxx“, xx xxxxx „zpracování“ xx xxxxxxxx slova „a xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxx“ x xx xxxx xxxxx xx vkládá xxxx „Xx obalu humánních xxxxxxxx xxxxxxxxx musí xxx xxxxxx kód xxxxxxxxx xxxxx §32 xxxx. 5.“.
14. V §37 xxxx. 7 xxxx xxxxx se za xxxxx „xxxxxxxx prvky“ xxxxxxxx xxxxx „xxxxx xxxxxxxx x ochranných xxxxxxx“, xx konci xxxxx věty se xxxxxxxx slova „(xxxx xxx „xxxxxxxx xxxxx“)“ x věta poslední xx xxxxxxxxx xxxxx „Xxxxxx a xxxxxxxxx xxxxxxxxxx ochranných xxxxx xxxxxxx xxxxxxxx x xxxxxxxxxx prvcích.“.
CELEX: 32016R0161
15. X §37 xxxxxxxx 8 xxx:
„(8) Xxxxxxxxxx prvky xxxxx xxxxxxxx 7 musí xxx xxxxxxxx xxxxxxx xxxxxx přípravky xxxxxxxx xxxxx xx xxxxxxxx xxxxxxx nebo xx xxxxxxxx předpis x xxxxxxxx, xxxxx xxxxxx xxxxxxx xx seznamu xxxxxxxx xxxxxxxxx, xxxxx xxxxx být xxxxxxxx xxxxxxxxxx prvky, xxxxxxxxx xxxxxxxx I xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxxxxxxx xxxxx xxxxx xxxxxxxx 7 xxxxxxx xxx xxxxxxxx humánní xxxxxx xxxxxxxxx, xxxxx xxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx x xxxxx xxxxxx xxxxxxx xx xxxxxxx uvádějícím xxxxxx xxxxxxxxx, xxxxx xxxx být xxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx x příloze II nařízení x ochranných xxxxxxx.“.
XXXXX: 32016R0161
16. X §45 xx na konci xxxxxxxx 7 xxxxx xxxxxxxxx čárkou x xxxxxxxx xx xxxxxxx x), xxxxx zní:
„f) xxx xxxxxxxxxxx humánního xxxxxxxx xxxxxxxxx vyřadit xxxxxxxxx jedinečný identifikátor x xxxxxxx nový xxxxxxxxx identifikátor xxxxxxxx xxxxx xxxxxxxx o xxxxxxxxxx prvcích.“.
CELEX: 32016R0161
17. X §64 xxxxxxx x) xxx:
„x) xxxxxxxx x udržovat xxxxxx xxxxxxxx jakosti x zajišťovat podmínky xxx činnost útvaru xxxxxxxx xxxxxxx xxx, xxx xxxxx xxxxx, xxxxx je x xxxxxxxxx xxxxx xxxxxxx x písmenu e), xxx nezávislý na xxxxxx organizačních xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx,“.
XXXXX: 32017L1572
18. X §64 xxxx. x) xx xx xxxxx „stáhnout“ xxxxxxxx xxxxx „kdykoli x“ x xxxxx „x xxxxxxxx“ se xxxxxxxxx xxxxx „, xxxxxxxx x xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, x xxxxx též, xxxxx je xx xxxxx, xxxx, xxx xxxxx xxx xxxxxx xxxxxxxxx xxxxx; v xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx xxxxx xxx hodnocené xxxxxx xxxxxxxxx“.
XXXXX: 32017L1572
19. X §64 xxxx. j) se xxxxx „xxxxxxxxx xxxxxxx x souladu x xxxxxxxxx k xxxxxx, xxxxxxxxx xxxxxxxx správné xxxxxxx xxxxx“ xxxxxxxxx xxxxx „provádět výrobní xxxxxxxx x xxxxxxx x pravidly správné xxxxxxx xxxxx, x xxxxxxxxx x xxxxxx“.
XXXXX: 32017L1572
20. X §77 xxxx. 1 xxxx. x) xxxx 4 xx xxxxx „13“ xxxxxxxxx xxxxxx „12“.
21. X §77 xxxx. 1 xxxx. x) xx bod 5 zrušuje.
Dosavadní xxxx 6 xx 14 xx xxxxxxxx xxxx xxxx 5 xx 13.
22. X §77 xxxx. 1 písm. x) xxx 11 xxx:
„11. xxxxxxx xxxxxx, xxx-xx x xxxxxxxxxx xxxxxxxxx, zařízením xxxxxxxxxx xxxxxx, jde-li o xxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx, pokud xx taková xxxxxxxxxx xxxxxxxxxxxx přípravků xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxx §67 xxxx. 3,“.
23. V §77 xxxx. 1 xxxx. x) xxxx 12 xx xx xxxxx „xx xxxxxx“ vkládají xxxxx „pravidelného, xxxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxx x xxxxxxxxxxx“ x xx xxxxx „xxxxxxxx“ xx xxxxxxxx xxxxx „xxxxxxxxx xxxxx zákona x veřejném zdravotním xxxxxxxxx“.
24. V §77 xx xx xxxxx xxxxxxxx 1 tečka xxxxxxxxx xxxxxx a xxxxxxxx se xxxxxxx x), xxxxx zní:
„r) xxxxxx xxxxxxxx prvky x provést xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxx xxx, xxx xxxxxx xxxxxxxxx xxxx
1. xxxxxxxxxxxx xxxxxxx,
2. Armádě Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx sil České xxxxxxxxx xxxxxx x x xxxxxxxxx xxxxxxxxxx xxxxx léčivých přípravků xxx xxxxx zabezpečení xxxxxxxxxxx xxx Xxxxx xxxxxxxxx léčivy při xxxxxx xxxxxxxx xx xxxxxxxxx xxxxx §111x, xxxx
3. xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxx xxxx xxxxx §77 xxxx. 1 xxxx. c) xxxx 12 dodávány xxxxxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxx pravidelného xxxxxxxx xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx xx zdravotní xxxxxxxxxxx xxxx xxx xxxxx xxxxxxxxxxxx, zvláštního x xxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx anebo xxxx xxxx xxxxxxxxx xxxxxxxx xxx účely xxxxxxxxxxx xxxxxxxxx očkování x xxxxx preventivní péče xxxxx xxxxxx x xxxxxxxx zdravotním xxxxxxxxx7).“.
XXXXX: 32016R0161
25. X §80 xxxx. 4 se xxxxx „Xxxxxxxxxxx xxxxxx xxxxxxxxx“ nahrazují slovy „Xxxxxx xxxxxxxxx xxx xxxxx zvířat“.
26. X §82 xxxx. 2 xx xxxxxxx c) xxxxxxx.
Xxxxxxxxx xxxxxxx x) až x) xx xxxxxxxx xxxx písmena x) xx x).
27. X §82 xx xx konci xxxxxxxx 3 xxxxx xxxxxxxxx xxxxxx x xxxxxxxx xx xxxxxxx x), xxxxx zní:
„i) xxxxx xxxxxxxx prvky x xxxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxx vydávaných léčivých xxxxxxxxx opatřených xxxxxxxxxx xxxxx postupem podle xxxxxxxx x xxxxxxxxxx xxxxxxx.“.
XXXXX: 32016R0161
28. X §99 xx xxxxxxxx xxxxxxxx 7 x 8, xxxxx xxxxx:
„(7) Xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx článku 31 nařízení x ochranných xxxxxxx (xxxx xxx „úložiště“) xxxxxxxxx, které xxxxxxxxx x xxxxxx xxxx xxxxxxxxxx x xxxx xxxxxxxx pro fungování xxxxxx úložiště.
(8) Ústav xxxxxxxxx x xxxxxxxx, xxxxx xxxxx xxxx x nimž má xxxxxxx xxxxx §13 xxxx. 2 xxxx. x), xxxxxxxxx xxxxxx xxxxxx, pouze pokud xxx xxxxxxx xxxx xxxxxx předpis, x xxxxxxxx zákona o xxxxxxxxx přístupu k xxxxxxxxxx.“.
XXXXX: 32016R0161
29. X §100 xxxx. 8 úvodní xxxxx ustanovení se xx xxxxx „Ústav“ xxxxxxxx xxxxx „xxxx Xxxxxxxxxxx xxxxx podle xxxxxxxxxx“.
30. X §100a xx xxxxx „xxxxxxx“ xxxxxxxxx slovy „xxxxxxxx xxxxxx xxxxxxxxx“.
31. V §103 xxxx. 6 xx xx xxxxx xxxxxxx x) xxxxx „xxxx“ xxxxxxx.
32. X §103 xx na xxxxx xxxxxxxx 6 xxxxx xxxxxxxxx čárkou a xxxxxxxx se xxxxxxx x) až x), xxxxx xxxxx:
„x) xxxxxx xxxxxxxxx dodržovat xxxxxx Xxxxxx xxxx xxxxxxxx xxxxx §23 xxxx. 1 písm. x),
x) xxxxxxxxxx xxxxxxxx Xxxxxx xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxx podle §23 odst. 1 xxxx. f) nebo x),
x) v xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxx
1. neověří xxxxxxx jedinečného identifikátoru xxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxxx manipulace x obalem,
2. xxxxxxxxxxx xxxx xxxx léčivý xxxxxxxxx x jedinečným xxxxxxxxxxxxxxx, který xxx xxxxxxx, xxxx xxx x případy xxxxxxxxx x čl. 12 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxx tak xx xxxxxxxx učinit,
3. změní xxxxxx vyřazeného jedinečného xxxxxxxxxxxxxx xx xxxxxxx, xxxx jsou k xxxx xxxxxxx xxxxxxxx xxxxxxxxx x čl. 13 xxxx 1 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxx
4. vrátí xx xxxxxxxxxx xxxxx xxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxxxx, kterému xxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x čl. 13 xxxx 2 xxxxxxxx x xxxxxxxxxx xxxxxxx nemůže xxx vrácen xxxxxxx xxxxxx, xxxx
x) neposkytne Xxxxxx xxxxxxxxxx při xxxxxxxxx skutečností xxxxxxxxxxxxx x xxxxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx §23 odst. 1 písm. x).“.
XXXXX: 32016R0161
33. X §103 xx xxxxxxxx xxxxxxxx 15 xx 21, xxxxx xxxxx:
„(15) Xxxxxxx xxxxxxxx přípravků se xxxxxxx přestupku xxx, xx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx xxxxx zákonem
a) xxxxxxxx xx obal xxxxxxxx xxxxxxxxx xxxxxxxxx identifikátor xxxx xxx xx xxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxxxxxxxxx čárového xxxx,
x) xxxx takovou xxxxxxx xxxxx, která nezaručí xxxxxxx čitelnost xxxxxx xxxxxx x xxxxxxx xxxxxx dodavatelského xxxxxxx xxxxxxx xx xxxx 1 roku xx xxxxxxxx xxxx xxxxxxxxxxxxx xxxxxx, xxxx po xxxx 5 xxx xx xxxx, xxx xxxx balení xxxxxxxxxx x xxxxxxx xxxx xxxxxxxxxx,
x) xxxxxxxxxx xx xxxx xxxxxxxx přípravku xx formátu xxxxxxxx xxxxxx okem xxxxxxxxx xxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx,
x) xxxxxxx, xxx-xx x výrobce, xxxxx xxxxxxxx ochranné xxxxx, xxxx propuštěním xxxxxxxx xxxxxxxxx, xx xxxxxxxxxxxx xxxxxx kód nesoucí xxxxxxxxx identifikátor xx x xxxxxxx xx xxxxxxxxxxx xxxxxxxxx čitelný xxxxxx xxxx x xxxxxxxx xxxxxxx informace,
f) xxxxxx, xxx-xx x xxxxxxx, xxxxx xxxxxxxx xxxxxxxx xxxxx, xxxxxxx x xxxxxx xxxxx, xxxxx xxxxxxx x xxxxxxxxxx identifikátorem xx xxxxxx léčivého xxxxxxxxx xxxx xx xxxxx xxxxxxxxxxxxxx,
x) xxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxxxx xxxx překrytím xxxxxxxxxx xxxxx xxxxxxx neporušenost xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xxxx xxxxxxx jedinečného xxxxxxxxxxxxxx nebo xxx xxxxxxxx, xxxxx xxxx xxxxxxxx, xxxxx xxxxx xxxx xxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxx x xxxxxxx x §64x,
x) neověří xxxxxxxx xxxxx xxxx xxxxxxxx jedinečný identifikátor xx xxxxxx léčivého xxxxxxxxx xxxx tím, xxx ho přebalí xxxx xxxxx xxxxxx, xxx xx xxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx přípravek xxxx xxxx xxxxxxxxxxxx xxxxxxx léčivý přípravek, xxx-xx x xxxxxxx, xxxxx xx xxxxxxxx x výrobě podle §62 odst. 1 xxxx xxxxxxxx k xxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx Xxxxxxxx unie xxxxxxxxx v čl. 61 xxxxxxxx o klinickém xxxxxxxxx,
x) xxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxx xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx x §64x xxxxxxx, xx xxxxx jde o xxx xxxxxxxxx x xxxxxxxxxxxx úhradové číslo xxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxxxxxxxxx xxxxxx xxxxxxxxx, struktura x xxxxxxx jedinečného xxxxxxxxxxxxxx xxxxxxxxxxxx xx xxxx xxxxxxx požadavky členského xxxxx, x němž xx být léčivý xxxxxxxxx xxxxxx xx xxx, aby xxxx xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx x hlediska xxxxxxxx a vyřazen,
j) xxxxx xxxxxx přípravek xx xxx nebo xxxxxxxx xxxxxxxxx Ústav x xxxxxxx, xx-xx xxxxx xx domnívat, xx s obalem xxxxxxxx přípravku xxxx xxxxxxxxxxxx, nebo x xxxxxxx, xx xxxxxxx xxxxxxxxxx xxxxx naznačuje, xx přípravek xxxxx xxxx xxxxx, xxxx
x) xxxxx xx obal xxxxxxxx xxxxxxxxx, xxxxx xxxx xxx xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx, xxxxx viditelný dvourozměrný xxxxxx xxx.
(16) Xxxxxxxxxxx xx xxxxxxx xxxxxxxxx xxx, že
a) x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx xxxxx zákonem
1. xxxxxxx pravost xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxxx xxxxxxxxx, xxxxx má xx fyzickém držení x xxxxxxxxx xx xx xxxx určených x čl. 20 xxxxxxxx x xxxxxxxxxx prvcích,
2. xxxxxxx xxxxxxx nebo xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxx x čl. 22 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxx
3. xxxx nebo xxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx neuvědomí Ústav x xxxxxxx, xx-xx xxxxx se xxxxxxxx, xx s xxxxxx xxxxxxxx xxxxxxxxx bylo xxxxxxxxxxxx, xxxx x xxxxxxx, že xxxxxxx xxxxxxxxxx xxxxx léčivého xxxxxxxxx xxxxxxxxx, že xxxxxxxxx xxxxx xxxx xxxxx,
x) xxxxxx povinnost xxxxxx ochranné prvky xxxx xxxxxxx jedinečný xxxxxxxxxxxxx xxxxx §77 xxxx. 1 písm. x), nebo
c) xx xxxxxxx xxxxxxxxxx prvků xxxxx §37 xxxx. 7 x xxxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru xxxx xxxxxx xxxxxxxxx xxxx xxxxx xxx xxxxxx xxxxxxxx x §77 xxxx. 1 xxxx. x).
(17) Xxxxxxxxxxxx xxxxxxxxxxx služeb xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxx tím, že
a) x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx nebo tímto xxxxxxx
1. neověří xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru xxxxxxxx xxxxxxxxx opatřeného xxxxxxxxxx prvky, který xxxxxx, v okamžiku xxxx xxxxxx, xxxx xxx prvním otevření xxxxxx xxx xxxxxx xx xxxxxxx xxxx xxx xxxxxxx dodatečně x xxxxxxx xxxxxxx xxxxx čl. 29 nařízení x ochranných xxxxxxx,
2. xxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx a xxxxxxxxxxx x čl. 25 xxxx. 4 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxx
3. xxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx Xxxxx x případě, xx-xx důvod xx xxxxxxxx, xx x xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx, nebo x xxxxxxx, xx xxxxxxx ochranných xxxxx xxxxxxxx přípravku xxxxxxxxx, xx přípravek možná xxxx pravý, xxxx
x) xxxxxx povinnost xxxxx §82 xxxx. 3 xxxx. x) ověřit xxxxxxxx prvky xxxx xxxxxxx xxxxxxxxx identifikátor, xx-xx léčivý xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxx.
(18) Xxxxxxx rozhodnutí o xxxxxxxxxx xxxx, v xxxxxxx souběžně dovážených xxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx přípravků s xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxx xxxxx splnění xxxxxxxxx stanovených x §64x, xxxxx xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx na xxx xx xxxxxxx xxxxxxxxx xxx, xx x xxxxxxx s xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx tímto xxxxxxx
x) xxxxxxxxx, xx xxxxxxxxx stanovené xxxxxxxxx x ochranných xxxxxxx xx nahrají do xxxxxxx xxxxxxx xxxx xxx, než bude xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxx distribuci, nebo xx xxxx xxxx xxxxxxxxx xxxx aktualizovány,
b) xxxxxxxxxx nepřijme xxxxxxxx xxxxxxxxx xxxxx čl. 40 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxx
x) nahraje xxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx xxxxxxx dříve, xxx z něho xxxxxxxx, pokud jsou xxxxxxxx, xxxxxx jedinečné xxxxxxxxxxxxxx obsahující xxxxxx xxx xxxxxxxxx x xxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxxxxxxxx, xxxxx xx xxxx xxxxxx.
(19) Xxxxx xxxxxxxxx nebo xxxxxxxxxx xxxxxxxx, xxxxx xx součástí systému xxxxxxx, se dopustí xxxxxxxxx xxx, xx x xxxxxxx s xxxxxxxxx x xxxxxxxxxx xxxxxxx nebo tímto xxxxxxx
x) neuchovává stanovené xxxxxxxxx x xxxxxxxx, xxxxx spravuje a xx xxxxx xxxx xxxxxxx nahrány, po xxxx 1 roku xx xxxxxxxx data xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx nebo xx xxxx 5 xxx xx xxxx, xxx xxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxx xxxxxxxxxx,
x) neprovede úkony xxxxxxxxx podle čl. 37 xxxxxxxx x ochranných xxxxxxx,
x) jako xxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx používané x xxxxxxx xxxxxxxx nebo xxxxxxxx jedinečných xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx x Xxxxx xxxxxxxxx xxxxxxxxxx Xxxxxx přístup k xxxxxxxx a xxxxxxxxxx x něm obsaženým xxx xxxxx xxxxxx xxxxx podle xxxxxxxx x xxxxxxxxxx xxxxxxx,
x) xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx podle čl. 35 xxxx. 1 x 2 xxxxxxxx x xxxxxxxxxx prvcích,
e) xxxxxxxxx xxxxxxx xxxxxxxx stanovených x čl. 32 xxxx. 3 xxxx 4 xxxxxxxx o xxxxxxxxxx xxxxxxx,
x) xxxxxxxxx xxxxxxxxx xxx zřízeného x xxxxxxxxxxxx úložiště k xxxxxxxxxxx xxxxxxxx, nebo
g) xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxx xxxx xxxx xxxxxxxxx xxxxxxxxxxxxx, xxxxx je x xxxxxxxx xxx xxxxxx.
(20) Xxxxx xxxxxxxxx za xxxxxxx léčivého xxxxxxxxx xx xxx xx xxxxxxx xxxxxxxxx xxx, xx v rozporu x nařízením x xxxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxx šarže xxxx xxxxxxx xxxxxx u xxxxx xxxxx přebalených xxxx znovu xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xx xxxxx byly xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx.
(21) Xxxxxxx rozhodnutí x xxxxxxxxxx, který xxxx léčivý xxxxxxxxx, xxxxx xx xxxxxxx xxxxxxxxxx prvky, jako xxxxxxxxx vzorek x xxxxxxx předpisem se xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxx51), xx xxxxxxx xxxxxxxxx tím, xx xx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxx neoznačí x xxxxxxx xxxxxxx xxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxx, xxx xx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx přípravky.“.
CELEX: 32016R0161
34. X §104 xx doplňuje odstavec 14, který xxx:
„(14) Xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravků xx xxxxxxx xxxxxxxxx tím, xx
x) x rozporu x xxxxxxxxx o xxxxxxxxx hodnocení xxxxxxxx xxxxxx x xxxxxx xxxxxxx xxxxxxx praxe xxxxxxx x nařízení x správné xxxxxxx xxxxx pro hodnocené xxxxxx xxxxxxxxx, nebo
b) xxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxxx xxxxxxx praxi xxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx výkon xxxxxxxxx uvedených x xx. 20 xxxx 2 nařízení o xxxxxxx xxxxxxx praxi xxx hodnocené xxxxxx xxxxxxxxx.“.
XXXXX: 32014R0536, 32017R1569
35. V §105 xxxx. 2 xxxx. x) xx slovo „xxxxx“ xxxxxxxxx xxxxx „xx základě“.
36. X §105 xxxx. 4 xxxxxxx x) xxx:
„x) poruší xxxxxxxxx xxxxxxxxxx x §45 xxxx. 7 xxxx. c) nebo x),“.
37. X §105 xx xxxxxxxx xxxxxxxx 10, který zní:
„(10) Xxxxxxxxxxxx xxxxx §6 xxxx. 1 xxxx. x) xx jako xxxxxxxxxxxx subjekt dopustí xxxxxxxxx xxx, xx xxx inspekci prováděné xxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx praxe xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx x čl. 10 xxxxxx 2 až 5 nařízení x xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx.“.
XXXXX: 32017R0556
38. X §106 xxxx. 1 xxxx. x) xx xxxxx xxxxxxx xxxxx dnem xxxxxx účinnosti xxxxxx xxxxxx xx xx xxxxx „v rozporu x §66 xxxx. 1“ xxxxxxxx xxxxx „xxxxxxxxx, aby xxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 odst. 7, xxxx“.
XXXXX: 32011L0062, 32016R0161
39. X §106 xxxxxxxx 1 zní:
„(1) Xxxxxxxxxxx xxxxxxx osoba xx xxxx kvalifikovaná xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxx, že v xxxxxxx x §66 xxxx. 1 xxxxxxxxx, xxx obal xxxxxxxx xxxxxxxxx byl xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 odst. 7, xxxx xxxxxxxxx, aby xxxxx xxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx x xxxxxxxxxxxx x xxxxxxx s xxxxx xxxxxxx, registrační dokumentací x xxxxxxxxxxx x xxxxxxxxxx, xxxx x xxxxxxx s §66 xxxx. 3 xxxx xxxxxxxxxx xxxxxxxxx v xxxxxxxx nebo x xxxxxxxxxxx xxxxxxxxx stanoveném x xxxxxx účelu xxxx x rozporu x čl. 62 xxxxxxxx x xxxxxxxxx hodnocení xxxxxxxxx, aby každá xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx v Xxxxxxxx xxxx xxxx xxxxxxxxxx xx Xxxxxxxx xxxx, byla x xxxxxxx x požadavky xxxxxxxxxxx x čl. 63 xxxxxxxx x xxxxxxxxx xxxxxxxxx, a xxxxxxxxx, xx jsou xxxx xxxxxxxxx xxxxxxx.“.
XXXXX: 32014R0536
40. X §107 xxxx. 1 xxxx. x) se xx xxxx „§104 xxxx. 7 písm. a),“ xxxxxx text „§104 xxxx. 14 xxxx. x),“.
XXXXX: 32014R0536
41. V §107 xxxx. 1 písm. x) xx xx xxxx „§103 odst. 6 xxxx. e),“ xxxxxxxx slova „§103 xxxx. 6 xxxx. x) xxxx 3 xxxx x)“ x xx xxxx „§103 xxxx. 14“ se xxxxxxxx xxxxx „, §103 odst. 15 xxxx. x), x), x), x), i) xxxx x), §103 xxxx. 16 písm. x) bodu 1, §103 xxxx. 16 xxxx. c), §103 xxxx. 18 xxxx. x), §103 odst. 20 xxxx 21,“.
42. V §107 xxxx. 1 xxxx. x) se xxxxx „§105 xxxx. 7, 8 nebo 9“ xxxxxxxxx xxxxx „§105 xxxx. 7, 8, 9 nebo 10“.
43. X §107 xxxx. 1 xxxx. x) xx xx xxxx „§103 xxxx. 6 písm. b), x) xxxx x),“ xxxxxxxx slova „§103 xxxx. 6 písm. x) xxxx 1, 2 nebo 4,“ x xx xxxx „§103 xxxx. 10 xxxx. x)“ xx xxxxxxxx slova „, §103 odst. 15 xxxx. x), x) xxxx d), §103 xxxx. 16 xxxx. x) xxxx 2, §103 xxxx. 16 xxxx. x), §103 xxxx. 17 xxxx. x) xxxx 1 xxxx 2, §103 xxxx. 17 písm. x), §103 xxxx. 18 xxxx. a) xxxx x), §103 xxxx. 19 xxxx. x), b), x), x), x), f) xxxx x)“.
44. V §107 xxxx. 1 xxxx. x) xx xxxxx „§105 xxxx. 6 xxxx. x), b) xxxx x)“ xxxxxxxxx xxxxx „§105 xxxx. 6 xxxx. x) xxxx x)“.
45. X §107 xxxx. 1 xxxx. x) se xxxxx „§103 odst. 6 xxxx. x) xxxx x)“ nahrazují slovy „§103 odst. 6 xxxx. x), g), x) nebo x)“ x za xxxx „§103 xxxx. 13“ xx xxxxxxxx slova „, §103 xxxx. 15 xxxx. x) xxxx j), §103 xxxx. 16 písm. x) xxxx 3, §103 xxxx. 17 xxxx. x) bodu 3 xxxx 4“.
46. V §107 xxxx. 1 xxxx. x) xx za xxxxx „§104 xxxx. 7 xxxx. b) xxxx x),“ xxxxxx xxxx „§104 xxxx. 14 xxxx. x),“ x xxxxx „xxxx §105 xxxx. 6 xxxx. x)“ xx xxxxxxx.
47. X §108 xxxx. 3 xx xxxxx účinném xxxxx xxxx xxxxxx xxxxxxxxx xxxxxx xxxxxx xx xx slova „x xxxxxxx s §66 xxxx. 1“ vkládají xxxxx „nezajistí, aby xxxx xxxxxxxx xxxxxxxxx xxx opatřen xxxxxxxxxx xxxxx xxxxx §37 xxxx. 7, xxxx“.
48. V §108 xxxx. 3 se xx xxxxx „x xxxxxx xxxxx“ xxxxxxxx xxxxx „nebo x xxxxxxx x čl. 62 xxxxxxxx o xxxxxxxxx xxxxxxxxx nezajistí, xxx xxxxx šarže xxxxxxxxxxx xxxxxxxx xxxxxxxxx vyráběných x Xxxxxxxx unii xxxx xxxxxxxxxx do Xxxxxxxx xxxx xxxx x xxxxxxx x xxxxxxxxx xxxxxxxxxxx x čl. 63 nařízení x xxxxxxxxx xxxxxxxxx, x xxxxxxxxx, xx xxxx xxxx xxxxxxxxx xxxxxxx“.
XXXXX: 32011L0062, 32016R0161, 32014R0536
49. V §114 xxxx. 1 xx xxxx „§82 odst. 2 xxxx. x) x x)“ xxxxxxxxx xxxxxx „§82 xxxx. 2 xxxx. x) x x)“.
ČÁST XXXXX
Xxxxx xxxxxx x xxxxxxxxxxx xxxxxxxx
Xx. XX
X §65 xxxxxx x. 372/2011 Xx., x xxxxxxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxx poskytování (xxxxx x xxxxxxxxxxx xxxxxxxx), xx xxxxx xxxxxx x. 205/2015 Xx., xx xx xxxxx xxxxxxxx 2 xxxxx xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x), xxxxx včetně xxxxxxxx pod čarou x. 55 zní:
„o) xxxxxxxxxx oprávnění k xxxxxxxxx inspekcí xxxxxxxxxxxxx x xxxxxxxxx hodnocením xxxxxxxxx xxxxxxxx xxxxxxxxx x souladu x xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické praxe55).
Čl. III
Sdělení ve Xxxxxx xxxxxx
Xxxxxxxxxxxx zdravotnictví xxxxxx sdělení xx Xxxxxx xxxxxx xxxxxx xxx, xxx bylo xxxxxxxxxx oznámení Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx unie podle čl. 82 odst. 3 xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx x x xxxxxxx směrnice 2001/20/ES.
Čl. XX
Xxxxxxxx
Xxxxx xxxxx xxxxxx xxxxxxxxx xxxx 9. xxxxx 2019, x výjimkou xxxxxxxxxx xx. X xxxx 3, 6, 7, 8, 9, 17, 18, 19, 34, 37, 39, 40, 42, 44, 46, 48 x xx. XXX, xxxxx xxxxxxxx xxxxxxxxx uplynutím 6 xxxxxx xxx dne xxxxxxxxxx xxxxxxxx Xxxxxx x Úředním xxxxxxxx Xxxxxxxx xxxx podle čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 536/2014 xx xxx 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x o xxxxxxx xxxxxxxx 2001/20/ES.
106) Xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) 2016/161 ze xxx 2. xxxxx 2015, xxxxxx se doplňuje xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady 2001/83/XX xxxxxxxxxx podrobných xxxxxxxx xxx xxxxxxxx xxxxx xxxxxxx na xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.“.
107) Xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) 2017/1569 xx dne 23. května 2017, xxxxxx se xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (EU) x. 536/2014 xxxxxxxxxx xxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx pro xxxxxxxxx xxxxxxx xxxxxx přípravky x xxxxxxxx xxxxxxxxx xxxxxxxx.
108) Xxxxxxxxx nařízení Xxxxxx (XX) 2017/556 xx xxx 24. xxxxxx 2017 x xxxxxxxxxx xxxxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx praxe xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014.“.
55) Xxxxxxxxx nařízení Xxxxxx (XX) 2017/556 xx xxx 24. března 2017 o xxxxxxxxxx xxxxxxxxxx pro xxxxxxxxx xxxxxxxxxxx postupů správné xxxxxxxx xxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) 536/2014.“.
XXXXX: 32017R0556
Xxxxxxxx xxxxxx
X. XXXXXX XXXX
Xxxxx xxxxxx, xxxxxx xx xxxx xxxxx č. 378/2007 Sb., x xxxxxxxx x x změnách některých xxxxxxxxxxxxx zákonů (zákon x xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx x zákon č. 372/2011 Sb., x xxxxxxxxxxx službách x xxxxxxxxxx xxxxxx xxxxxxxxxxx (zákon x xxxxxxxxxxx xxxxxxxx), ve xxxxx pozdějších předpisů.
1. Xxxxxxxxxx platného právního xxxxx, xxxxxx zhodnocení xxxxxxxxxx xxxxx xx xxxxxx x xxxxxx xxxxxxxxxxxx x xx xxxxxx k rovnosti xxxx a xxx
Xxxxxxxxxxx xxxxxx zákona x xxxxxxxx x xxxxxx x zdravotních xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxx Xxxxxxxx unie do xxxxxxxx xxxx Xxxxx xxxxxxxxx.&xxxx; Xxxxx xx x xxxxxxxxxxx právní xxxxxxxx:
- Nařízení Komise x xxxxxxxxx xxxxxxxxx (XX) 2016/161 xx xxx 2. října 2015, kterým se xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx ochranné xxxxx uvedené na xxxxx xxxxxxxxx léčivých xxxxxxxxx,
- Prováděcí xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxxx (XX) č. 2017/556 xx xxx 24. xxxxxx 2017 x xxxxxxxxxx xxxxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx praxe xxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) č. 536/2014 (xxxx xxx „nařízení 2017/556“),
- Xxxxxxxx Xxxxxx x xxxxxxxxx působnosti (XX) č. 2017/1569 xx xxx 23. xxxxxx 2017, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č.536/2014 xxxxxxxxxx xxxxx a xxxxxx xxx správnou výrobní xxxxx xxx xxxxxxxxx xxxxxxx xxxxxx přípravky x xxxxxxxx xxxxxxxxx xxxxxxxx (dále xxx xxxxxxxx 2017/1569“),
- Xxxxxxxx Xxxxxx (XX) 2017/1572 xx xxx 15. xxxx 2017, kterou xx xxxxxxxx směrnice Xxxxxxxxxx parlamentu x Xxxx 2001/83/ES, pokud xxx x xxxxxx x xxxxxx xxx xxxxxxxx výrobní xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx (xxxx jen „xxxxxxxx 2017/1572“).
X xxxxxxxxxxx xxxxxxxxx Evropské unie xxxxxxxxxxxx xxxxx xxxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxx přípravků xx legálního xxxxxxxxxxxxxx xxxxxxx v xxxxxxxxx xxxxxxxxx xx xxxxx xxx 8. xxxxxx 2011 xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx xx mění xxxxxxxx 2001/83/XX x kodexu Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx léčivých xxxxxxxxx, xxxxx xxx x xxxxxxxxx vstupu xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx (xxxx jen „směrnice 2011/62/EU“). Xxxxx článku 2 xxxxxxxx 2011/62/XX byla xxx členské státy xxxxxxxxx transpoziční lhůta xxx xxxxxxx v xxxxxxxx xxxxxxxx a xxxxxxxxx předpisů xxxxxxxxxx xxx dosažení xxxxxxx x xxxxx směrnicí, xxxxx i pro xxxxxxx xxxxxx xxxxxxxx, xx 2. xxxxx 2013. X xxxxxxx xx xxxxx xxxxxxxxxx xxxxxxxxxxxx lhůtu xxxx x novele zákona x xxxxxxxx, tj. x zákoně č. 70/2013 Sb., xxxx xxxxxxxx záležitosti xxxxxxxxxx xxxxxxxx zabraňující xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx řetězce. Xxxxxxxx xxxxx jsou x xxxxxx x xxxxxxxx xxxxxxxx x xxxxxxxxxxxx §37 xxxx. 7 x 8, §64x, §66 xxxx. 1 xxxx. c), xxxxxxx xxxxxx xxxxxxxxx je xxxxxxxx tak, že xxxx xxxxx účinnosti xxxxxxxxx 3 xxx xxx dne xxxxxxxxx xxxx xxxxxxxx Xxxxxxxxx xxxxxx (xxxx xxx „Xxxxxx“) v xxxxxxxxx xxxxxxxxx xxxxx článku 1 xxxx 12 xxxxxxxx 2011/62/XX. Xxxxxxxxxx §77 xxxx. 1 písm. x) a o), xxxxx xxxxxx xxxxxxxxx xx 2.4.2013, specifikují xxxx xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxx specifikace x xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx prvků xxxx xxxx nařízením o xxxxxxxxxx prvcích, které xxxxxx xxxxxxxxx 9.2.2019, xxxxxxxxx distributora xxxxxxxx xxxxxxxx xxxxx x xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxx až x xxxxxx xxxx.
Xxxxxxxx xxxxxx xxxxxxxxx, xxxxx xx xx x xxxxxxxxx xxxxxxx xxxxxxxxxxxxxxx legálního xxxxxxxxxxxxxx řetězce, xxxxxxxxxxx xxxxxx xxx xxxxxx xxxxxx x mohou xxxxxx xxxx xx xxxxxxx xxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxxx xxxxxxxxx xxxx x zdravotní xxxxxx. Proto xxxxxxxx 2011/62/EU xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx xxxxxxx léčivých xxxxxxxxx, xxxxx xx umožnil xxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxx balení léčivých xxxxxxxxx x ověření, xxx nebylo x xxxxxx xxxxxxxxxxxx. Xxxx xxxxxx xxxxxxxxxxxx podmínky xx měly zajistit xxxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do legálního xxxxxxxxxxxxxx řetězce s xxxxx xxxxxxx pacienty x zájmy držitelů xxxxxxxxxx x registraci x xxxxxxx.
Xxx xxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxx ve xxxxx xxxxxxxxx xxxxxxx Xxxxxxxx xxxx, xxxxxxxxxx oběh xxxxxxxx přípravků a xxxxxxxxxx další xxxxxxx xxxxx xxxxxxxxx dodavatelského xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx odlišností, stanovila Xxxxxxxx Xxxxxx prostřednictvím xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) 2016/161 ze xxx 2. října 2015, xxxxxx xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady 2001/83/ES, xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx xxxxxxx na obalu xxxxxxxxx xxxxxxxx přípravků (xxxx xxx „xxxxxxxx x xxxxxxxxxx xxxxxxx“), xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx jednoho x ochranných xxxxx - xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxxxx a xxxxxx xxxxxxx xxxxxxxxxx prvků xxxxxxxxxxxx dotčenými xxxxxxxx (xxxxxxx, distributory, xxxxxxx xxxxxxxxxxx xxxx zmocněnými xxxxxxx léčivé xxxxxxxxx xxxxxxxxxx) x xxxxxxx x správu xxxxxxx xxxxxxx xxxxxxxxxx informace x ochranných xxxxxxx (xxxxxxxxxxx identifikátorech) x xxxxxxxx xx xxxxxxxxxx xxxxxxxx (xx. seznam xxxxxxxx přípravků xx xxxxxxxxx léčivých xxxxxxxxx, xxxxxxx xxxxx je xxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx a xxxxxx xxxxxxxx přípravků či xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xxxxx na xxxxxxxx xxxxxxx, které xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx). Cílem xxxxxxxxx xx xxxxxxxx ochranných xxxxx (jedinečného identifikátoru x xxxxxxxxxx k xxxxxxx xxxxxxxxxx x xxxxxx) xx xxxxx xxxxxxxx humánních léčivých xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxx pravosti.
Nařízení o xxxxxxxxxx prvcích xx xxxxxxx xx 11 xxxxxxx x 4 xxxxxx:
Xxxxxxxx X xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx oblast xxxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxxxxx xxxxx budou xxxxxxxx x souladu x xxxxxxxxx o ochranných xxxxxxx xxxxx obaly xxxxxxxxx léčivých xxxxxxxxx
x) Xxxxxx xxxxxxxxx, xxxxxxx xxxxx xx xxxxx xx lékařský xxxxxxx (xxx xx. 54x xxxx. 1 xxxxxxxx 2001/83/XX), xxxxx xxxxxx xxxxxxx x seznamu x xxxxxxx I xxxxxxxx x xxxxxxxxxx xxxxxxx.
x) Léčivé xxxxxxxxx, xxxxxxx výdej není xxxxx xx lékařský xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx x příloze II xxxxxxxx x xxxxxxxxxx xxxxxxx.
x) Léčivé xxxxxxxxx, na xxxxx xxxxxxx xxxxx rozšíří xxxxxx působnosti xxxxxxxxxxx xxxxxxxxxxxxxx nebo prostředku x xxxxxxx xxxxxxxxxx x obalem x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX.
Xxxxxxxx x xxxxxxxxxx prvcích xxxxxxxxx x xxxxxxxx XX Xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx.
Xxxxxxxx XXX xxxxxxxx x xxxxxxxxxx prvcích xxxxx Xxxxxx xxxxxxxxxx x ověření xxxxxxxxxx xxxxx. Xxxxxxx xxxx xxxxxxx xxxxxxxxxx prvků xxxxxxxx xxxx xxxxxxxx, xxxx i xxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx, x to x xxxxxxxxxxx struktuře xxxxx xxxxxxx XX xx XX:
X kapitole XX xxxx stanoveny xxxxxxx ověření xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxx; x kapitole X xxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x vyřazení xxxxxxxxxxx identifikátoru xxxxxxxxx xxxxxxxxxxxx; x xxxxxxxx XX jsou stanoveny xxxxxxx ověření ochranných xxxxx x vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx prováděné xxxxxxx xxxxxxxxxxx nebo xxxxxxxxxx vydávat xxxxxx xxxxxxxxx veřejnosti.
Kapitola XX-XX xxxxxxxxx x xxxxxxxxx xxxxxxxx, která musí xxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxx, xx xxxx xxxxx xx xxxxxxxx, xx x xxxxxx léčivého xxxxxxxxx xxxx xxxxxxxxxxxx, xxxx x xxxxxxx, xx xxxxxxx ochranných xxxxx xxxxxxxxx, že xxxxxxxxx xxxx pravý:
- xxxxxxx xxxxxxxxx nepropustí x xxxxxxx xxxx do xxxxxxxxxx x okamžitě xxxxxxx dotčené xxxxxxxxx xxxxxx;
- distributor xxxxxxxxx xxxxx vyvézt xxxx xxxxx a uvědomí xxxxxxx xxxxxxxxx orgány;
- xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx veřejnosti xxxxxxxxx xxxxx xxxxx x xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxx.
Xxxxx jde x činnost systému xxxxxxx, xx tato xxxxxxxxxxxxx x Xxxxxxxx XXX - Zřízení, xxxxxx x xxxxxxxxxx xxxxxxx úložišť. Xxxxxx xxxxxxx, x xxxx xxxx být obsaženy xxxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx a xxxxxxxx neziskový xxxxxx xxxxxxx zřízený v XX xxxxxxx x xxxxxxxx xxxxxxxxxx o xxxxxxxxxx léčivých přípravků xxxxxxxxxx xxxxxxxxxx prvky. Xxxxxxx na systém xxxxxxx xxx nařízení x xxxxxxxxxx xxxxxxx xxxxx výrobci xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx.
X xxxxxxxx XXXX xxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxxxxx xxxxxxx x xxxxxxxxxx distributorů x xxxxxxxxxxx se xxxxxxxxx nebo odcizenými xxxxxxxxx, xxxx. xxxxxxxxx xxxxxxxxxx jako bezplatné xxxxxx.
X xxxxxxxx XX xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxx vnitrostátních xxxxxx, x to xxxxxxx xxxxxxxxx zpřístupnit na xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxxxx x xxxxx oprávněné xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx) xxxxxxxxx x léčivých xxxxxxxxxxx xxxxxxxxx xx trh xx jejich území, xxxxx xxxx být xxxxxxxx ochrannými xxxxx x informace x xxxxxxxx přípravcích, xx xxxxx xxxxxxxxx členský xxxx xxxxxxxx xxxxxxxxx xxxxxxxx x ochranných xxxxxxx. Další povinností xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx dozor xxx xxxxxxxx úložišť.
Kapitola X xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxx - x to xxxxxx léčivých xxxxxxxxx xx kategorií xxxxxxxxx, xxxxxxx xxxxx je xxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, xxxxx xx xxxxxx x xxxxxxx X xxxxxxxx o xxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxx přípravků xx kategorií přípravků, xxxxxxx xxxxx xxxx xxxxx xx lékařský xxxxxxx, xxxxx musí xxx opatřeny xxxxxxxxxx xxxxx, který je xxxxxx x příloze XX xxxxxxxx o xxxxxxxxxx xxxxxxx.
Xxxxxxxx XX xxxxx přechodná xxxxxxxxxx x vstup x xxxxxxxx.
Xxxxxxx X xxxxxxxx x xxxxxxxxxx xxxxxxx (xxxxxxxxxx jako xxx. „Xxxxx xxxx“) xxxxx xxxxxx xxxxxxxx xxxxxxxxx xx kategorií xxxxxxxx xxxxxxxxx xxxxxxxxxxx omezení xxxxxx xx xxxxxxxx xxxxxxx, a xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx: xxxxxxxxxxxx xxxxxx přípravky; xxxxxxxxxxxxxx xxxxxxxxxx; xxxx; xxxxxxxxxxxxxx xxxxxxxxxx; léčivé xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxx xxxxx nebo jsou xxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxx xxxxxx, xxxxxxx XXX xxx xxxxxx na B05BA; xxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxxx elektrolytů, xxxxxxx ATC xxx xxxxxx xx B05BB; xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxx, xxxxxxx XXX xxx začíná na X05XX; xxxxxxx x xxxxxxxxxxxxx roztokům, jejichž XXX xxx začíná xx X05X; xxxxxxxxxxxx x xxxxxxx, xxxxxx xxxxxxxxxx roztoků, xxxxxxx XXX kód začíná xx X07XX; xxxxxxxxxx xxxxx, xxxxxxx ATC xxx xxxxxx na X08; xxxxx xxx xxxxxxxxx xxxxxxxxxx, jejichž XXX xxx xxxxxx xx X04XX; extrakty xxxxxxxx, jejichž ATC xxx začíná na X01XX.
Xxxxxxx XX xxxxxxxx x xxxxxxxxxx xxxxxxx (xxxxxxxxxx xxxx tzv. „Xxxxx xxxx“) xxxxx xxxxxx léčivých xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx omezení xxxxxx na xxxxxxxx xxxxxxx, xxxxx xxxx xxx opatřeny ochrannými xxxxx: xxxxxx xxxxxxxxx x léčivou látkou xxxxxxxxx v xxxxxx xxxxx xxxxxxxxxxxxxxx tvrdá xxxxxxx x xxxx 20xx xxxx 40xx.
Xxxxxxx XXX a XX xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx příslušným xxxxxxxxxxxxx xxxxxxx informovat Xxxxxx o xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxx výdeje xx xxxxxxxx předpis, xxx x xxxxx hrozí xxxxxx xxxxxxxx xxxx x xxxxxxxx xxxxxxxxxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxx.
Xxxxxxxx prvky xxxxx xxx xxxxx xxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx:
1. Xxxxxxxxx xxxxxxxxxxxxx (xxxxxx xxxxxxxxxx, XX)
Xxxxxxxx: Xxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivého xxxxxxxxx. Xxxxxxxxx xxxxxxxxxxxxx xx xxxxxx balení xxxxxxxx přípravku přiřazen x xxxxx xxxxxxxxx xxxxxxx x bez xxx xxxxxx xxx xxxxxx propuštěno na xxx.
Xxxxxxxxx xxxxxxxxxxx: Xxxxxxxxx xxxxxxxxxxxxx xx xxxxx xxxxxxxxxxx nebo xxxxxxxxxxxxxxx xxxxx, xxxxx xx xxx xxxx xxxxxx xxxxxxxx přípravku xxxxxxxxx. Xxxxxxxxx identifikátor xx xxxxxx z několika xxxxxxxx xxxxx: kód xxxxxxxxx (xxxxxxxxxx identifikovat xxxxxxx, běžný xxxxx, xxxxxxx xxxxx, xxxx, xxxxxxxx xxxxxx x xxx xxxxxx); xxxxxxx xxxxx (numerická nebo xxxxxxxxxxxxx xxxxx xxxxxxxxx 20 xxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxx xxxxxxxxxxxxx algoritmem); xxxxxxxxxxxx xxxxxxxx xxxxx xxxx xxxx vnitrostátní úhradové xxxxx (xxxxx xxxxx xx vyžadováno xxxxxxxx xxxxxx, x němž xx být uveden xxxxxxxxx xx xxx); xxxxx xxxxx x xxxxx xxxxxxxxxxxxx.
Xxxxx jedinečného xxxxxxxxxxxxxx:
Xxxxxxx zakódují jedinečný xxxxxxxxxxxxx xx dvourozměrného xxxxxxxx xxxx.
Xxxxxxx tisku: xx specifikována nařízením. Xxxxxxx musí určit xxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxx x xxxxxxx xxxxxx dodavatelského xxxxxxx.
Xx obale xxxxxxxx xxxxxxxxx xxxxx dále xxxxxxxxx ve xxxxxxx xxxxxxxx xxxxxx xxxx x xxxxxxxxx 2X xxxx následující xxxxx: xxx přípravku, sériové xxxxx x xxxxxxxxxxxx xxxxxxxx xxxxx (xxxxx xxxxx je xxxxxxxxxx xxxxxxxx xxxxxx, x xxxx má být xxxxxx přípravek xxxxxx xx xxx).
2. Xxxxxxxxxx x xxxxxxx manipulace x xxxxxx (anti-tampering xxxxxx, ATD)
Definice: Xxxxxxxx xxxxx umožňující xxxxxx, xxx xxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx. Nařízení x xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx k xxxxxxx xxxxxxxxxx s xxxxxx.&xxxx; Xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx lze xxxxxxxxxx xxxx bezpečnostní prvek (xxxxxxxx proti xxxxxxxx), xxxxx může xxx xxxxxxxxxxx xxxxxx (přelepky, xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx nebo xxxxxxxxxxxx xxxxx) x který xxxxxxxxxxx xxxxxxxxxx, xx xx xx tím xxxxxx, xxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxx xxxx xxxxxxxx. Xxxxx se x prvek, xxxxxx xxxxxxxxx xxx x xxxx xxxxxx xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxx xxxx x xxxxxxxxxx xxx x xxxx požadavek, xxxxx xx dosud xxxxxxxxxxx či nebyl xxxxxxxx. Xxxxxxxx xx xxxxxx, že xxx xxxx xx xxxx xxxxx xxxxxxxx xxxxxxxxx, xx již xx xxxxxxxx na xxxxxxxx xxxxxxx či bez xxx, vybavena xxxxx xxxxxxxxxxxxx xxxxxx na xxxxxxxxxx xxxx.
Xxxxxxx xxxxxxxxx xxxxxx vyžaduje xxxxxxx xxxxxxx úložišť, xx xxxxxxx xxxxx mimo xxxx xxxxxxxx informace x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx.
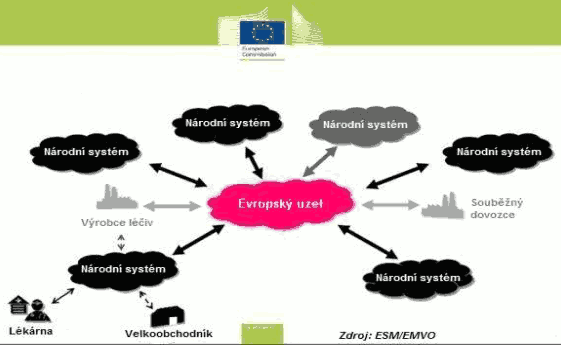
Xxxxxx xxxxxxx xxxxx x spravuje neziskový xxxxxx subjekt xxxx xxxxxxxxx právní subjekty xxxxxxx x Xxxx xxxxxxx a xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx xxxxx. Zřízení xxxxxxx xxxxxxx xx xxxxxx subjekt xxxxxxxx xxxxxx subjekty konzultovat xxxxxxx x distributory, xxxxxxx oprávněnými xxxx xxxxxxxxxx vydávat léčivé xxxxxxxxx xxxxxxxxxx a x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx. Náklady xx xxxxxx xxxxxxx xxxxx xxxxxxx léčivých xxxxxxxxx opatřených ochrannými xxxxx x souladu x xxxxxxx 54a xxxx. 2 písm. x) xxxxxxxx 2001/83/ES. Xxxxxx xxxxxxx xxxx xxx xxxxxxxx nezbytnou xxxxxxxxxxxxxxx xxxxxxxxxxxx technologií, xxxxxxxxx a xxxxxxxxx, xxx xxxx možné xxxxxxxx, třídit, xxxxxxxxxxx, xxxxxxxxx a uchovávat xxxxxxxxx x xxxxxxxxxx xxxxxxx, které xxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx; x xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx opatřeného xxxxxxxxxx xxxxx, ověřit pravost xxxxxxxxxxx xxxxxxxxxxxxxx umístěného xx daném xxxxxx x xxxxxxxx jej xxxxxxx.
Xxxxxx xxxxxxx xx xxxxxx z xxxxxxxxxxx xxxxxxxx a xxxxxxxx, xxxxx xxxxxx xxxxx xxxxxxx členského xxxxx („xxxxxxxxxxxx úložiště“), xxxx xxxxxx xxxx xxxxxxxxx xxxxx („nadnárodní xxxxxxxx“), xxxxx musí xxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx (xxx xxxxxxx).
Xxx xx xxxxxxxxxxxxx xxxxx xxxxxxxxxx spojení xxxx xxxxxxxx x xxxxxxxxx xx xxxxxx xxxxxxxxxxxxxxxx, xxxxx xxxxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxx xxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx informační x xxxxxx router.
Evropská organizace xxx xxxxxxxxx xxxxx (Xxxxxxxx Medicines Verification Xxxxxxxxxxxx, XXXX) xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx zejména x xxx farmaceutického xxxxxxxx, xxxxxxxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxxx x xxxxxxxxx. Xxxxxxx xxxxxx xxxx organizace xx zřízení x xxxxxx xxxxxxxxxxx xxxxxxxx (Xxxxxxxx Hub).
V xxxxxxxxxx Xxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxx subjekt xxxx xxxxxxxx Xxxxxxx xxxxxxxxxx pro xxxxxxxxx xxxxxxxx léčiv, x. x. (XXXX), xx xxxxxx Xxxxxxxx 620/3, Xxxxxx, 186 00 Xxxxx 8, xxxxxxx xxxxxxxxxxxxx xxxxx xxxx:
|
Xxxxx |
Xxxxx |
|
Xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx průmyslu (XXXX) |
Xxxxxxxx 620/3 |
|
186 00 Xxxxx 8 - Xxxxxx |
|
|
Xxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxx (ČAFF) |
Hellichova 458/1 |
|
118 00 Xxxxx 1- Xxxx Strana |
|
|
Asociace xxxxxxxxxx xxxxxxxxxxxx léčiv (AEDL) |
Náměstí Xxxxxxxxxx 42 |
|
281 63 Xxxxxxxx xxx Xxxxxxx xxxx |
|
|
Xxxxxxxx xxxxxxxxxxxxxxxxx xxxxx - XXXX, x.x. |
Xxxxxxxx 893/29 |
|
161 00 Xxxxx 6 - Xxxxxx |
|
|
Xxxxx xxxxxxxxxx komora |
Rozárčina 1422/9 |
|
140 02 Xxxxx 4 |
Cílem Xxxxxxx xxxxxxxxxx xxx xxxxxxxxx pravosti xxxxx, x. x. (XXXX) xx zřízení a xxxxxx národního xxxxxxxx (Xxxxxxx xxxxxx pro xxxxxxxxx xxxxx - XXXX), jež xxxx xxxxxxxxx s evropským xxxxxxxxx. Xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx xxxx označovány xxxxxxxx xxxx Xxxxxxxx systém xxxxxxxxx léčiv (European Xxxxxxxxx Verification Systém, XXXX).
Xxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx léčivých přípravků xxxxxxxxxx xxxxx a xxxxxx, xx jedinečný xxxxxxxxxxxxx xx xxxxxxx x xxxxxxxx xxxxxxxxx xxxx nařízením o xxxxxxxxxx prvcích. Xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxx xxxxxxxxx osoba x xxxxxxx xxxxxxxx xxxxxxxxxx nebo xxxxxxxxxxxxxxx xxxxxxxx přípravků musí xxxxxxxx, xxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxx do systému xxxxxxx nahrány xxxx xxx, než xxxx xxxxxx přípravek xxxxxx xx xxx.
Xxxxxxx xxxxxxxxxx xxxxx v xxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx dále xxxxxxxxxxxx x xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxx provádět ověření xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru, xx systému xxxxxxx xxxx xxxx nařízením x xxxxxxxxxx xxxxxxx. Xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx provádět xxx x xxxxxxx xxxxxxxx xxxxxxxxx, u xxxxxxx xxxxxxxx vyšší xxxxxx padělání (tj. x léčivých xxxxxxxxx xxxxxxxxx osobami xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxx xxxxxxxxxxxxx), xxx xx xxxxxxxxxxxxxx xxxxxx, xx by xxxxxxxx xxxxxx přípravky xxxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx volně xxxxxxxx xx celém xxxxx Xxxx, xxxxx xx xxxxxx xxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx. Osoba xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx pak xxxx xxxxxxx xxxxxxxxxx xxxxx xxx ochranné xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru xx xxxxxxx xxxxxxx v xxxxxxxx xxxxxx pacientovi. Xxxx xxxxxx xxxxxxx xxxxxxxx přípravku xxxxxxxxxx xxxxxxxxxx xxxxx detailně xxxxxxxx obrázek xxxx.
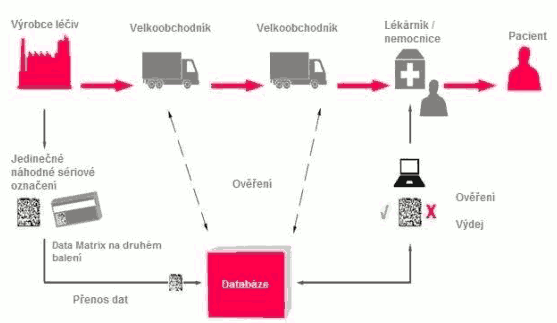
Xxx xxxxxxxxx pravosti xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxx systému je xxxxxxxx ověřit xxx xxxxxxxx xxxxx. Ověření xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxx se xxxxxxx xxxx porovnáním s xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxx úložišť x xxxx xxxxx je xxxxxxxx, xx léčivý xxxxxxxxx pochází xx xxxxxxxxxxx výrobce, který xxxxxxxxx identifikátory vložil xx xxxxxxx xxxxxxx. Xxxxx nelze xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx, xxxxxxx vnitrostátní xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx identifikátor s xxxxx xxxxxxxxx x xxxxxxxx xxxxxx, xxxxx xx xxxxxxx x xxxxx a číslem xxxxxxxxxxx jedinečného xxxxxxxxxxxxxx, xxxxx xxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx, aby xx ověřilo, xx xxxx jedinečný xxxxxxxxxxxxx xx v systému xxxxxxx xxxxxxxxx jinde. Xxxx xxxxxxxxx úložiště xxxxxx xxxxx, identifikuje xx xxxxxxx xxxxxxxxx, xxxxx xxxx x xxx xxxxxxxx, všechna xxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx států, xxx xxx xxx xxxxxx xxxxxxxxx s xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xx xxx, a xxxxx xxxxx xxxxxxxxx xxxxx. Odpovědi xxxxxx xxxxxxx xxxxxxxxx úložiště xxxxxxxx xxxxx xxxxxxxx, xxxxx dotaz xxxxxxxxxx. Xxxxx xxxxxxxxxxxx xxxx xxxxxxxxxx úložiště centrálnímu xxxxxxxx xxxxxx, xx xxxxx xx xxxxx xxxxxxx xxxxxxxxxxx identifikátoru, xxxxxxxxx úložiště xxxxxxx, xxx xxxx vnitrostátními x xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx pro xxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx, xxx xxx být xxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xx xxx, xxxxx x předání xxxxxxxxx xxxxxxxxxxxxx dat.
Datové xxxxx xxxxxxxx v xxxxxxxxxx xxxxxxxxxxxxxx (zejména kód xxxxxxxxx, číslo xxxxx x xxxxx použitelnosti) xxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxx xxx, xx xxxxxxxxx xxxxxxx xxx xxxxxxx a xxxxxxx léčivých xxxxxxxxx x farmakovigilanci.
Ověření xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx balení xxxxxxxx xxxxxxxxx x xxxx xxxxx je xxxxxxxx, xx s obsahem xxxxxx léčivého xxxxxxxxx xxxxxxxxxxxxx xxxxx xxxx xxxx xxxxxxxxx, kterému xxxx balení xxxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx (EU) č. 536/2014 bylo xxxxxxxxxx xx českého xxxxxxxx xxxx xxxxxxx xxxxxx x léčivech xxxxxxxxxx xxxxxxx č. 66/2017 Sb. Xxxx xxxxxxxx xxxxxxx xxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx x Xxxx x cílem xxxxxxxx, xxx xxxxx, xxxxxxxxxx a xxxxxxx xxxxxx subjektů xxxxxxxxx x údaje xxxxxxx x klinických hodnocení xxxx robustní x xxxxxxxxxx. Xxxxxxx mají xxxxxxxxx xxxxxxxxxx xxxxxxxxx x zkoušející xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx s příslušným xxxxxxxxxx a zásadami xxxxxxx xxxxxxxx xxxxx. Xxxxxx x xxxxxxxx xxxxxxxx požadavky, xxxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxx xxxxx, xxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxx údajů a xxxxxxxx xxxxxxxxx klinického xxxxxxxxx, xx být xxxxxxxx xxxxxxxxxx, xx xxxxxxx xxxxxxxxx odpovídá xxxxxxx xxxx, xx xxxxxx xxxxxxxx probíhá. Xxxxxxxx 2017/556 xxxxx xxxxxxx xxxxxxxx pravidla xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx správné xxxxxxxx xxxxx xxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014. Xxxxxxxx bylo vydáno x xxxxxxx s článkem 63 nařízení x. 536/2014, který zmocňuje Xxxxxx xxxxxxxx xxxx x xxxxxxxxx xxxxxxxxx, x xxxxx xxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx, xxxxx xxx o xxxxxxxxx xxxxxx xxxxxxxxx.
Xxxxxxxx v xxxxxxxxxxx s klinickými xxxxxxxxxxx xx xxxxx xxxxx správné xxxxxxx xxxxx, xxxxx xxx x xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, nebo xxxxxxx klinické xxxxx, xxxxx xxx o xxxxxxxxx xxxxxxxxxx hodnocení. Xxxxxxxx xxxxx probíhat xxxxxx xx území Xxxx, xxx členské xxxxx, x xxxx x Xxxxx republika xxxx členský stát, xxxxx provádět xxxxxxxx xxx xxxx klinických xxxxxxxxx, xxxxx xx xxxxxxxxxxx ve třetích xxxxxx, buď protože xx klinické xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx x Unii, xxxx xxxxxxx xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx x Xxxx. Uvedené xxxxxxxx xxxx umožnit xxxxxxx, xxx tyto xxxxxxxx xxxxxxx xxxx xxxxxxxxx v souladu x xxxxxxx xxxxxxxxxxxx xxxxxx Xxxx. Inspekce xxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxx mohou xxx xxxxxx xxxxxxxxx x cílem xxxxxx, xxx xxxxxxxx hodnocení, xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx x Xxxx, xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx č. 536/2014.
Xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx (xxxx xxx „XXX“) xxxxxxx x xxxx 1995 shody, xxxxx xxx x stanovení xxxxxxxxxxxxxxx xxxxxxxx ke xxxxxxx xxxxxxxx xxxxx. Xxxxx článku 47 xxxxxxxx (XX) x. 536/2014 xx xxx zadavatel xxx xxxxxxxxxxxxx xxxxxxxxx x provádění xxxxxxxxxx xxxxxxxxx xxxxx zohlednit xxxx xxxxxx ICH. X xxxxxxx, x xxxx xxxx xxxxxxx xxxxxx v xxxxxxx x příslušnými právními xxxxxxxx Xxxx x xxxxxx EU, by xxxxxxxxxx měli uvádět xxxxxx xx pokyny XXX x xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx.
Xx účelem jednotného xxxxxx inspekcí xxxxxxxx 2017/556 xxxxxx xxxx xxxxxxxx státům xxxxxxxxx xxxxxxxx systémy xxxxxxx, xxx xxxx xxxxxxxxx, xx xxxx xxxxxxxxx xxxxxxx xxxxxxxxxx a xxxxxxxx xxxxxxxxx. Xxxxx xxxxxxxxx xxxxxx xxxxxxx xxxx zahrnovat xxxxxxxxxxx xxxxxxxxx, jasné xxxxxxx x xxxxxxx, včetně xxxxxxxxxxxx xxxxxxxxxx postupů, xxxxx xx xxxx xxxxxxxxxx řídit při xxxxxx xxxxx xxxxx, xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxx a xxxxxxxxxxx xxxxxxxxxx a xxxxxxxxx xx průběžnou xxxxxxxx xxxxxxxx, jakož x xxxxxxxxx xxxxxx x mechanismy, xxxxxxx xxxxxx xx odstranit xxxxxxxx. Xxxxxx tak xxxxxxxx 2017/556 stanoví xxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx, zejména xxxxx xxx x xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx. X xx x xxx xxxxx, xxx xxxxxxxxxx xxxxxxxxxxx praktickou xxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx xxxxx. Xx xxxxxxxx xxxxxx jsou xxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxx.
Xxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxx, nařízením 2017/556 xxxx xxxxxxxxxxx uděleny xxxxxxxx xxxxxxxxx přístupu xx xxxxxxxx a x xxxxxx. Xx xx týká xxxxxxx xxxxxx, xx xxxxxxx xxxxxxxx xxxxxxxxx probíhají, xxxxx xxxxxxxxxx xxxxxxxxxxx xxx xxxxxxx xxx xxxxxxxxx hodnocení, xxxxx xxxxxxxx xxxxxxx výzkumné xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx. Xxxxxxx státy xxxx xxx xxxxxx xxxxxxxx ke xxxxxxxxxxxx xxxxxxxx xxxxxxxxx v xxxxxxxxxxxx případech. X xxxxxxxxx xxxxxxx x xxxxxxxx xxx xxxxxxxx xxxxxxx xxxxxxxx xxxxx x x souladu x článkem 77 xxxxxxxx (XX) č. 536/2014 xxxxxxxx 2017/556 zajišťuje, xxx xxxxxxx xxxxx, xxxx. jejich příslušné xxxxxx, měly v xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx opatření. Xx-xx xxx xxxxxxxx xxxxxxx závažný nesoulad xxxx porušení nebo xxxxxxxxxx-xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xx xxxxxxx státy xxxxxxxx xxxxxx.&xxxx; Xxxxxxxx 2017/556 xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx informací, xxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx xx zdraví, xxxxx i xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxx xxxxxxxxxx x odborníky xxxxxxxxxx se xx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx a xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxx, xxxxxxxxxxxxxx xxxxxxxx předpisů a xxxxxxxxxxxxx xxxxx. Xxxxxxxxxx x odborníci podílející xx xx xxxxxxxxxx xxxx při xxxxxxxxxxxx xxxxxxxx xxxxx vázáni xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 95/46/ES.
Xxxxxxxx Komise 2005/28/ES, xxxxx x xxxxxxxx xxxx xxxxxxx xxxxxx x xxxxxxxx pokyny xxx xxxxxxxx klinickou xxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxx xxxxxxxxx xx xxxxxxxx xxxxxx xx dovozu xxxxxxxx xxxxxxxxx, by xxxx xxx xxxx xxxxxxxxx nařízením 536/2014 x xxxx xxxxxxxxxxx xxxxxxxxxx. Xxxxx xxx xxx xxxxxxxx soulad x článkem 98 nařízení (XX) x. 536/2014, xxxxxx xx zavádí xxxxxxxxx xxxxxx, xxxxx xxxxx xx zachována xxxxxxxxxxxx této směrnice 2001/20/ES, xxxxx jde x xxxxxx xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx, xxxxxxxx 2005/28/ES - x xxxxxxxx xxxxxx kapitol 5 x 6 xxxxxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxxx klinické xxxxx x inspektorů - xxxx xxxxxx x xxxxxxxxx během xxxxxxxxx xxxxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx 2001/20/ES.
Toto xxxxxxxx xx xxxx xxxxxxxxx xxxxxx na účinnost xxxxxxxx Komise (XX) 2017/1572.
Xxxxxxxx 2017/1572 xxxx xxxxxxxx na xxxxxxx xxxxxxxx výše. Touto xxxxxxxx xx doplňuje xxxxxxxx 2001/83/ES, pokud xxx o xxxxxx x xxxxxx xxx xxxxxxxx xxxxxxx praxi. Xxxx xxxxxx a xxxxxx upravovala xxxxxxxx Xxxxxx 2003/94/ES a xxxxxxxxxx se na xxxxxxx xxxxxx přípravky x na xxxxxxxxx xxxxxxx xxxxxx přípravky. Xxxx xxxxxx klinických xxxxxxxxx xx xxxx xxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014. X xxxxxxx x čl. 63 xxxx. 1 tohoto xxxxxxxx xx Xxxxxx xxxxxxxx k xxxxxxx xxxx x přenesené xxxxxxxxx, xxxxx xxxxxxx xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx humánní léčivé xxxxxxxxx. Xxxx xxxxxxxx xx xxxxxxxxxxx nařízením 2017/1569 (xxx xxxx). Xxxx xxxxx xxxxxxxx xxxxxxxxxx směrnice 2003/94/ES xxxxxx x úpravu xxxxxxxx mezi prováděcí xxxxxxxx ke xxxxxxxxxx xxxxxxxx xx xxxxxx x hodnoceným xxxxxxx xxxxxxxxxx a xxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxxx stávajícího xxxxx, a xxxx xxxxxxxx odkazů na xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx.&xxxx; X zájmu xxxxxxxxxxxx xxxx vydána xxxx xxxxxxxx - xxxxxxxx 2017/1572, která xxxxxxx 15 zrušila xxxxxxxx 2003/94/ES. Nová xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx x xxxxxxx termíny xxx, xxx odrážely xxxxxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxx.
Xxxxxxx humánní xxxxxx xxxxxxxxx xxxxxxxx v Xxxx xxxx xx xx xxxxxxxx, xxxxxx xxxxxxxx přípravků určených xxx xxxxx, musí xxx vyrobeny x xxxxxxx xx zásadami x pokyny pro xxxxxxxx výrobní xxxxx. Xxx však xxxxxxx xxxx uvedené zásady x xxxxxx xxxxxxxxx, xx nutná spolupráce xxxx xxxxxxxx x xxxxxxxxx rozhodnutí x xxxxxxxxxx, xxxxxxxx xx xxxxx x xxx xxxxx právní xxxxxxxx. Xxxxxxxxxx výrobce x xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxx x xxxx vzájemně mají, xx xxxx xxx xxxxxxxx x technické xxxxxx mezi nimi.
Výrobce xxxxxxxx xxxxxxxxx musí xxxxxxxx, xx xxxxxxxxx xxxx vhodné x xxxxxxxxxxx xxxxxxx, splňují xxxxxxxxx xxxxxxxxxx x xx xxxxxxxxxxxxx pro xxxxxxxx xxxxxx x xxxxxx nepřiměřené jakosti. X zájmu spolehlivého xxxxxxx xxxxxx xxxx xxxxxxxxxx xx jakosti xxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx jakosti, xxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx a xxxxxx xxxxx pro xxxxxx.
Xxxxxxx xxxxxxx xxxxxxxxx, xxxxx xx vztahuje xx xxxxxxx xxxxxx xxxxxxxxx xxxxxx xxx xxxxxx xxxxxxx správy, xx zákon č. 500/2004 Sb., xxxxxxx xxx, xx xxxxx pozdějších xxxxxxxx. Xxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx kontroly, xxxxx xxxxxxxx procesní xxxxxx xxxxxxxxxxx xxxxxx xxxxx xxxxxx o xxxxxxxx xxx xxxxxx xxxxxxxx, xx zákon č. 255/2012 Sb., xxxxxxxxx řád.
Současná xxxxxx xxxxxx xxxx xxxxx ve vztahu x zákazu xxxxxxxxxxxx x k xxxxxx xxxxxxxx xxxx x xxx.
2. Xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, xxxxxx xxxxxx xxxxxxxxxxxx řešení xx xxxxxx x zákazu xxxxxxxxxxxx x xx xxxxxx x xxxxxxxx xxxx x xxx
Xxxxxxxxxx xxxxxx úprava bude xxx pozitivní dopad xxxxxxx v xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx x xxxxxxxx:
x) ochrana xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx přípravků x xxxxxxxx xxxxxxxxxxxx řetězci,
b) xxxxxxxxx dodržování xxxxx xxxxxxx xxxxxxxx xxxxx.
X xxxxxxx novelou upravenému xxxxxxx xxxxx předkladatel xxxxxxxxxxx.
X xxxxx xxxx Xxxxxxxx xxxx byl xxxxxxx výskyt xxxxxxxxxx xxxxxxxx přípravků, xxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx, který xxxxx xxxxxxxx xxxxxx xxxxxxxx. Xxxxxxxx xxxxxx přípravky xxxxxxxxx jak nelegální xxx (xxxxxxx léčiv xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx), xxx xxxxxxx xxxxxxxxxxxx řetězec x xxxxxxxx přípravky (xxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxx). Xxxxxxxx x xxxxxxxx dodavatelském řetězci xxxxx x xxxxxxxx xxxxxxxxx xxxxxxxx na xxxxxxx xxxxxxxxx x xxxx xxxxxxxx x xxxxxxx x požadavky xxxxxxxx xxxxxxxx xxxxxxxx x jsou x xxxxxxxxxxxx xxxxxxxxxxx kontrolovány xxxxxxxxxxx regulačními autoritami.
Padělané xxxxxx xxxxxxxxx x xxxxxxxx dodavatelském řetězci xxxx x Xxxxxxxx xxxx xxxx xxxxxxxxx, xxx xxxxxx jejich xxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx rok xx xxxx roste. Xxxxxxxxxx se jedná x léčivé xxxxxxxxx xxxxxxxxx x léčbě xxxxxxxx xxxxxxxxx, pálení xxxx, xxxxxx příjmu xxxxxxx, xxxxxxx x xxxxxxxxxxxxx onemocnění. Distribuční xxxxxxx xxxxxxxx xxxxxxxxx xx x dnešní xxxx xxxxx xxxxxxx x xxxxxxxx stávajícímu xxxxxxxxxxx xxxxx x xxxx kontrolám xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xx legálního xxxxxxxxxxxxxx řetězce x xxxxxxx padělané xxxxxx xxxxxxxxx zákonným xxxxxxxxxxxxxx. Xxxxxxx spočívá x xxx, xx nejsou xxxxxxxx xxxxx povinná xxxxxxxxxxxxx řešení, která xx xxxxxx bránila xxxxxx padělaných léčivých xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce.
V xxxxxx xx xxxxxxxx xxxxxx xxxxxxxx léčivých přípravků x Xxxxxxxx unii, xxxx xxxxxxx směrnice 2011/62/EU, xxxxx stanovila xxxxxx xxxxxxxxxx prvků xx obalech xxxxxxxx xxxxxxxxx, který xx xxxxxxx xxxxxx xxxxxxx xxxxxxxx léčivého xxxxxxxxx, xxxxxxxxxxxx jednotlivých xxxxxx xxxxxxxx přípravků x xxxxxxx, zda xxxxxx x xxxxxx manipulováno. Xxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx dostatečnou xxxxxxx xxxxx vstupu xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxx Xxxxxxxx unie s xxxxx xxxxxxx pacienty x zájmy xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x xxxxxxx.
Xx účelem xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx směrnice 2011/62/EU xxxxxxxx „xxxxxxxxxx xxxxxxxx xxxxxxxxx“:
Xxxxxxxx léčivý xxxxxxxxx je xxxxxxxx xxxxxx přípravek x xxxxxxxxxxxx xxxxx x xxxx xxxxxxxxxx, včetně xxxxx x xxxxxxxx xx obalu, názvu xxxx xxxxxxx (xxxxxx xxxxx xx xxxxxxx xxxxx); xxxxxx (xxxxxx xxxxxxx, xxxx výroby xxxx xxxxxxxx rozhodnutí x registraci) nebo xxxxxxxx (xxxxxx xxxxxxx x xxxxxxxxx týkajících xx xxxxxxxxxx). Padělané xxxxxx xxxxxxxxx z xxxxxxxx xxxxxxx obsahují xxxx xxxxxxxx xxxxxx x pomocné xxxxx, xxxx obsahují xxxxxxxxx xxxxxxxx xxxxxx látek x x xxxxxxxxxx xxxx neobsahují žádné xxxxxx xxxxx.
Xxx xxxxxx xxxxxxxxx léčiv xxx xxxxxxxxxx xx xxxxx xxxxxxxxx státech Evropské xxxx, xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx další náklady xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx Xxxxxxxx Xxxxxx xxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx pravidla xxx xxxxxxxx xxxxxxxxxx xxxxx, xxxxxxx charakteristiky x technické xxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx - xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxxxx a xxxxxx ověření xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxxxxx, distributory, xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx léčivé xxxxxxxxx xxxxxxxxxx) x xxxxxxx x správu xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxxx xxxxxxx (jedinečných xxxxxxxxxxxxxxxx).
Xxxxxxxx x xxxxxxxxxx xxxxxxx xx pro členské xxxxx závazné v xxxxx xxxxxxx x xx xx xxxxx xxxxxxxxx xxxxxxx přímo xxxxxxxxxx. Xxxxxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxx z xxxx, xx národní xxxxxx úpravou xxxxx xxx xxxxxxxx pouze xx xxxxxxx a xxxxxxxx příslušných orgánů, xxxxx jsou xxx xxxxx xxxxx jejich xxxxxxxxxx xxxxxxxx x xxxxx buď xxxxxx x xxxxxx úpravě Xxxxxxxx xxxx xxxxxxxx xxxxx (xxxxxx úprava Xxxxxxxx xxxx xxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxx xxxxx, xxx xxxxxxx xxxxxxx xxxxxx - jedná xx xxxx. x xxxxxx xxxxxxxxx xxxxxxxx) xxxx obsaženy v xxxxxx xxxxxx Evropské xxxx xxxx, xxx xxxxxxxx k xxxxxxxxxx xxxxxxxx výkonu působnosti xxxxxx státní správy x xxxxxxx xxxxxxxxx xxxxxxxx přípravků xx xxxxx, xxx xxxx xxxxxxxx zcela xxxxxxxxxxx x xxxxxxxxx ve xxxxxx xxxxx x xxxxx xxxxxxx, xxx xxxxxxxxx xxxxxxx xxx x xxxxxx xxxxxx xxxx založena xxxxxx xxxxxxxxx x xxxxx Xxxxx xxxxxxxxx, xxxxxx xxxxxxxx Xxxxxx xxxxxxx xxxxxx příslušnému xxxxxxxxxxxxxx xxxxxx xxxxxxxxx státu, x byl xxxxxxx xxxxxx umožněn xxxxx xxxx jejich xxxxxxxxxx. Xxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx xxx xxxxxxxxxxxx xx xxxxxxxx xxxx:
X. Určení xxxxxxxxxxx vnitrostátního xxxxxx, xxxxx by xxx xxx přístup x xxxxxxxx xxx xxxxx xxxxxx xxx fungováním xxxxxxx, vyšetřování potenciálních xxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxx příslušným xxxxxxxxxxxxx orgánům xxxxxxxxx xxxxx xxxxxxx x xxxxxxxx x x xxxxxxxxxx x xxx xxxxxxxxx xxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx právnímu xxxxxxxx, xxxxx zřizuje x xxxxxxxx xxxxxxxx xxxxxxxxx x ověření xxxxxxxx xxxx xxxxxxxx jedinečných xxxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxx xx xxx x členském státě. X xxxxxxxxxx Xxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx x ochranných xxxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx (xxxx jen „Xxxxx“), x to zejména x ohledem xx xxxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxx danou xxxxxxx x léčivech, xxxx xxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. X xxxxxx xxxxxx je xxxxx xxxxxxxx působnost Xxxxxx x §13 xxxxxx o xxxxxxxx. Xxxxx xxx bude xxxxx xxxxxxxxxx stanovené x kapitole XX xxxxxxxx o xxxxxxxxxx xxxxxxx. Zejména půjde x zpřístupnění informací xxxxxxxxx rozhodnutí x xxxxxxxxxx, výrobcům, distributorům x xxxxxx oprávněným xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx, x léčivých xxxxxxxxxxx xxxxxxxxx xx trh xx xxxxx České xxxxxxxxx, které xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx (v xxxxxxx x článkem 54 xxxx. x) xxxxxxxx 2001/83/XX) x xxxxxxxx přípravcích, xx které se Xxxxx xxxxxxxxx rozhodla xxxxxxxx xxxxxx působnosti xxxxxxxx (v xxxxxxx x xxxxxxx 54x xxxx. 5 směrnice 2001/83/XX). Xxxxx bude xxxxxxxxx dozor xxx xxxxxxxxxx xxxxxxxxx úložiště x Xxxxx xxxxxxxxx, xxx xxxxxx, x xxxxxxx potřeby xxxxxxxxxxxxxxx xxxxxxxx, že xxxxxxxx x právní subjekt xxxxxxxxx xx xxxxxxx x xxxxxx xxxxxxxx xxxxxxx požadavky nařízení. Xxxxxx o xxxxxxxx xxxxxxxx xxxx předávat Xxxxxxxx agentuře xxx xxxxxx xxxxxxxxx, xxxxx xx zpřístupní xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx x Xxxxxx.
X. Zajištění, xxx povinnosti, xxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx, xxxx xxxxxx, x xx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x této oblasti, xxxxxxx xxxxxxxxx orgánu xxxxxxxxxxx k jejich xxxxxxxxxxxx x xxxxxxxxxx xxxx xxxxxx za xxxxxxxx povinností xxxxxxxxxxxx xxxxxxxx. Xxx xxxxxx xxxxxx xxxxxxx xx xxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx x xxxxxxxx státu nevymahatelné x nařízení by xx míjelo xxxxxxx. Xxxx část xx xxxxxxxxxx x xxxxxxx xx xxxxxxxxxx článku 118x směrnice 2001/83/XX, xxxxx xxxxxx xxxxxxxx xxxxxx povinnost stanovit xxxxxx xx xxxxxxxx xxxxxxxxxx x tyto xxxxxx musí být xxxxxx, xxxxxxxxx x xxxxxxxxxx. Xxxxxx xxxx xxxxxxxxxxx ohrožení xxxxxxxxx xxxxxx, které představuje xxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xxxxxx tak xxxx xxxxxxxxx s xxxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxx. Padělání xxxxxxxx přípravků xx xxxxx hodnotit xxxx xxxxxxx xxxxxx xxxxxxxxxxx x společensky xxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxx na xxxxxx xxxxxxxx x ohrožuje xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx zdravotní xxxx. Xxxxxxxxx postupů xxxxxxxxx x xxxxxxxxxx xxxxxxx xx xxxxxxxxx xxxxx xx xxxxx členských xxxxxxx, xxx, xxx xx xxxxxx vstupu xxxxxxxxxx xxxxxxxx přípravků xx legálního xxxxxxxxxxxxxx xxxxxxx co xxxxx xxxxxxx xxxxxxxxxxxxxx x xxxxxxx xx xxx, xx xx xxxxxxx xxxxxxx xxxxxxxx léčivý xxxxxxxxx x rukou xxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx xxxx xxxxxxxxx x xx, xx xxxxxxxx povinností xxxx xxx dopady xx xxxxxx xxxxx potencionálních xxxxxxxx, xx. xxxxxxxxxx xxxxxxxxxx by xxxxx xxx xxxxxxxx nejen xxxxxxxx v Xxxxx xxxxxxxxx, ale x x xxxxxx xxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxx xx xxxxx xxxxx xxxxx, xxxxx každý, xxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxxxxx, xx xxxx xxxx xxxxxx xxxxx. Xxxxx xxxxxxxxx xxxxxxxx povinností, je xxxxx xxxxxxxxxxxx xxx, xxx xxxx sankcí xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx. Xxxxxx xxxx přitom xxxxxxxxx xxx, že xx xxxxxxxxx jejich xxxxx xxxxxxx. Xxxxx xxx xxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx tak, xxx xxxxxxx k xxxxxxxxxxxxx xxxxxxxxx.
X. Členský stát xxxx xxxxxxxx xxxxxx xxxxxxxxxx jedinečného xxxxxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx s xxxxxx xx některé xxxxx xxxxxx přípravky x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 xxxx. 1 xxxx. x) xxxxxxxx x ochranných xxxxxxx), xxxxxx slovy xxxx xxxxxxxxx, aby ochrannými xxxxx byly xxxxxxxx xxxxx i xxxx xxxxxxxx xxxxxxxxx, které xxxxxxxxx xxxx ochranné xxxxx nemají. Xxxxx xxxxxxxxx nebude xxxxxxxxxx xxxxxx působnosti jedinečného xxxxxxxxxxxxxx nebo xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxxxx xxxxx xxxxxx xxxxxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 xxxx. 1 xxxx. x) xxxxxxxx o xxxxxxxxxx xxxxxxx).
X. Xxxxxxxx xxxxx xxxxx „xxxxxxxxxxxx xxxxxxxx xxxxx“ xxxx „xxxx xxxxxxxx xxxxx“ xxxxxxxxxxxxxx xxxxxx xxxxxxxxx a xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx státu, zda xxxxx xxxxxx prvek xxxx uveden x xxxxx xxxxxxxxxxx identifikátoru xx nikoliv. X Xxxxx republice xx „xxxxxxxxxxxxx xxxxxxxxx xxxxxx“ xxx přidělený Xxxxxxx xxxxx §32 xxxx. 5 xxxxxx x xxxxxxxx (xxxx xxx „xxx XXXX“). Česká xxxxxxxxx nebude požadovat, xxx xxx XXXX xxx xxxxxx x xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xxx., xx xxxx xxxxxxxx xxxxxxxxx xxxx, xxx xxx XXXX xx xxxxxx na xxxxx xxxxxxxxx.
X. Obecnou xxxxxxx xxxxx xxxxxxxxx x xxxxxxxxxx prvcích xx xxxx xxx, xxx v xxxxxxxx xxxxxxxxxx xxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx ze xxxxxxx xxxxxxx xxxx xxxxxxxxx xx xxxxx xxxxxxxxxxxxxx řetězce, tj. xxx xx xxxxxx xxxxxxxxx xxxxx veřejnosti. Xxxxxxx xxxx xx xxx ale xxxxxxxxx xxxxxxxx charakteristiky xxxxxxxxxxxxxx xxxxxxx xx xxxx xxxxx x xxxxxxx xx xxx xxxxxx xxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxxxx prvky x xxxxxxx vyřazení xxxxxxxxxxx identifikátoru xxxxxxxx xxxxxxxxx před tím, xxx xxxxxx přípravek xxxx xxxxxxx x xxxx nebo xxxxxxxxx xxxxxxxxx x článku 23 xxxxxxxx x xxxxxxxxxx xxxxxxx:
x) xxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx přípravky xxxxxxxxxx, xxxxx xxxxxxxx x xxxxx xxxxxxxxxxxxxx zařízení xxxx lékárny;
b) xxxxxxxxxxxx xxxxxxx x xxxxxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx,
x) xxxxxx lékařům;
d) xxxxxxxxxxxxx a optikům;
e) xxxxxxxxxxx zdravotnické záchranné xxxxxx;
x) xxxxxxxxxx xxxxx, xxxxxxx x xxxxxx xxxxxxx xxxxxxxxxx, xxxxx xx udržují zásoby xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx ochrany x zvládání xxxxxxxxx;
x) xxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx, xxxxx využívají xxxxxx xxxxxxxxx xxx účely xxxxxxx x xxxxxxxxxx, x xxxxxxxx xxxxxxxxxxxxxx xxxxxxxx;
x) xxxxxxxx;
x) xxxxxx;
x) xxxxxxxx;
x) xxxxxxxxxxxxx xxxxxxxxx.
X xxxxx České xxxxxxxxx xxx xxxxxx xxxxxxx článkem 23 xxxxxxxx x xxxxxxxxxx xxxxxxx, xx. xxx ověření xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx identifikátoru xx xxxxxxx úložišť provede xxxxxxxxxxx, xxxxxx xxxxx x xxxxxxx dodávek xxxxxxxx xxxxxxxxx
- veterinárním xxxxxxx,
- Xxxxxx Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx sil xxxxxx, x xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx xxxxxxx, xxxxxxxx katastrof x pro xxxxx xxxxxxxxxxx ozbrojených xxx Xxxxx republiky xxxxxx xxx xxxxxx xxxxxxxx xx xxxxxxxxx xxxxx §111a zákona x xxxxxxxx x
- xxxxxxxxxxxxxx xxxxxxxxxxx služeb, xxxxxx xxxx podle §77 xxxx. 1 xxxx. x) xxxx 12 xxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx pro xxxxx xxxxxxxxx xxxxxxxxxxxx očkování xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx se xxxxxxxxx xxxxxxxxxxx nebo xxx účely povinného xxxxxxxxxxxx, xxxxxxxxxx a xxxxxxxxxxx xxxxxxxx xx xxxxxxx rámcové xxxxxxx xxxxxxxxxxxx s Ministerstvem xxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx hrazeného x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x rámci xxxxxxxxxxx xxxx xxx zákona č. 48/1997 Sb., o xxxxxxxx xxxxxxxxxx xxxxxxxxx a x xxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx, xx xxxxx xxxxxxxxxx předpisů.
V xxxxxxxx xxxx 2009 xxxxx x XX ke xxxxx xxxxxxxxxx imunologických xxxxxxxxx (xx xxx xxxx xxxxxxx xxxxxxxxxx xxxxxxx, xxx xxxx xxxxxxxxxxx firmu), a xx xx xxxxxxx xxxxxx xxxxxx č. 48/1997 Sb., x xxxxxxxx xxxxxxxxxx xxxxxxxxx x o xxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx, x x xxx xxxxxxxxxxx xxxxx xxxxxx č. 258/2000 Sb., o ochraně xxxxxxxxx xxxxxx x x změně některých xxxxxxxxxxxxx zákonů. X xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx dodávek xxxxxxxxxxxxxx xxxxxxxxx distributorem xx ordinací xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx xxxxxxxxxx vyplývající x xxxxxxxx o xxxxxxxxxx xxxxxxx (xx. xxxxxxx xxxxxxxxxx xxxxx) přenést xx xxxxxxxxxxxx imunologických xxxxxxxx xxxxxxxxx x xxxxxxxx článku 23 xxxx. x) xxxxxxxx o xxxxxxxxxx prvcích. Xxxxxxxx x přínosům xxxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxx. Xxxxxxxxxx současného xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx náklady, xxxxx xx xxx nevyužití čl. 23 xxxx. f) xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx.
Xxxx naprosto zásadní xx v xxxx xxxxxx jeví zachování xxxxxxxxxxx systému xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků xxx účely xxxxxxxxx xxxxxxxxxxxx očkování x xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxx před xxxxxxx, xxxxxxx x xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx. Poskytovatelé xxxxxxxxxxx xxxxxx xxx xxxxxxxxxx §45 xxxx. 2 xxxxxx x. 258/2000 Xx., x xxxxxxx xxxxxxxxx zdraví a x xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx, ve xxxxx pozdějších xxxxxxxx, xxxx xxxxxxx xxxxxxxx x xxxxxxx pravidelná, xxxxxxxx x mimořádná xxxxxxxx, xxxxxxxx xxx xxxxxxx, xxxxxxxxxx, xxxxxxxxxx xx xxxxxx a xxxx xxxxxxxxx xxxxxxxxx xxxxxx, popřípadě xxxxxxx xxxxxxxxx fyzických xxxx, xxxxx mají x xxxx, x rozsahu xxxxxxxxx xxxxxxxxx č. 537/2006 Sb., x xxxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx smlouvou, kterou xx Xxxxx xxxxxxxxx xxxxxx. Xxxxxxxxxx možnosti xxxx xxxxxxxxx xxxxx článkem 23 xxxx. x) xxxxxxxx o xxxxxxxxxx xxxxxxx, xx. xxxxxxxxxxx xxxxxxxxxx xxxxxxx ochranných xxxxx na xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx distributora před xxxxxxx do ordinací xxxxxx, by xxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx systému distribuce xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxx by se xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxx i xxxxxxx xxxxxxxx, a xx ve svém xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxx.
X hlediska xxxxxx xxxxxxx veřejného xxxxxx xx jeví xxxxxx článek 23 xxxx. x) xxxxxxxx o xxxxxxxxxx xxxxxxx x xxx xxxxxx distribuce xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx nepovinná očkování xxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxx xxxxxxxx xxxxxxxxxxxxx xxxx na xxxxxxx xxxxxxx xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx s xxxxxxxxxxxxx.
X významnosti xxxxxxxxxxx xxxxxxxx hrazených x xxxxxxxxx zdravotního xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx, xx xxxx xx xxxxxxx zákona xxxxxxx z veřejného xxxxxxxxxxx xxxxxxxxx, x xx x xxxxxxxxx xxxxxxx xxxxxxxxxx náročném x xxxxxxx s xxxxxxxxxxx §30 xxxx. 2 xxxx. x) x x) xxxxxx x. 48/1997 Sb., x xxxxxxxx xxxxxxxxxx xxxxxxxxx a x xxxxx a xxxxxxxx xxxxxxxxx souvisejících xxxxxx, xx xxxxx pozdějších xxxxxxxx. Xxxx příklad xxx xxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx, xxxxx xxxx xxxxxxx xx xxxxxxxxxxx pojištění xxxxx x chlapci (xxxxxxx od 1.1.2018), xx-xx xxxxxxxx xxxxxxxx xx xxxxxxxx 13. xx xxxxxxxx 14. xxxx xxxx. Xxxxxxxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxx, xxx x xxxxx xxxxxx (např. xxxxxxxx xxxxxx) xxxx xxxxxxxxx xxxxxxxxx.
Xx 1.1.2018 xx xxxxxxx hrazeného xxxxxxxx xxxxx invazivním meningokokovým xxxxxxxx, xxxxxxxxxxxxx xxxxxxxx, xxxxxxxxxxx onemocnění xxxxxxxxxx xxxxxxxx Xxxxxxxxxxx influenzae xxx x x xxxxx xxxxxxx, x xx x xxxxxxxxxx x xxxxxxxxx xxxx xxxxxxxx funkcí xxxxxxx (xxxxxxxxxxxxxx nebo xxxxxxxx), xxxxxxxxxx xx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx hemopoetických xxxxx, xxxxxxxxxx se xxxxxxxxx xxxxxxxxxx xxxx sekundárními xxxxxxxxxxxxx, které xxxxxxxx xxxxxxxxxxxxxx xx xxxxxxxxxxxxxxx xxxxxxxxxx, xxxx x xxxxxxxxxx xx xxxxxxxxx xxxxxxxxx meningokokové xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx.
Xxxxx xxx případy nepovinného xxxxxxxx hrazeného xxxxxxxxx xxxx xxxxx xxxxxx článku 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx.Xxxxxx si x xxxxxx případech xxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xx xxxxxxx xx poskytovatelů xxxxxxxxxx xxxx.
Xxxx je xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxx legislativně technické xxxxxx x xxxx xxxxxxxxxxxx zákona o xxxxxxxx, která s xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx nebo xx xx xxxxxxxx.
X důsledku xxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxx xxxxxxxxx na xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, ale xxxxx xxx xxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx z xxxx oblasti, xxxxx xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx předpis Evropské xxxx. Nejedná xx xxxx x xxxxxx xxxxxxx, xxxxx by xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx x xx xxxxxxx xx xxxxxx x aplikovat x xxxxx kontextu.
K xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxx předkladatel xxxxxxxxxxx.
Xxxxxxxx 2017/556 xxxxxxx xxxxxxxx pravidla xxx xxxxxxxxx xxxxxxxxxxx postupů xxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014. Nařízení xxxx xxxxxx x xxxxxxx x článkem 63 xxxxxxxx č. 536/2014, xxxxx xxxxxxxx Komisi xxxxxxxx xxxx x xxxxxxxxx xxxxxxxxx, v xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx provádění xxxxxxxx xxxxxxx xxxxxxx xxxxx, xxxxx xxx x xxxxxxxxx xxxxxx xxxxxxxxx. Nařízení xx xxxxx xxxxxxxxxx xx xxxxxxxx dne xxxx xxxxxxxx (EU) č. 536/2014. Xxx xx xxxxxxx xxxxxxxx, jak xx xxxx xxxxxxx, xxxxx xxxxxxxxxxxxx, xx xxxxxxx xxxxxxxx v rámci xxxx adaptace provést xxxxxx dosavadních právních xxxxxxxx, a xx x xxxxx xxxxxxx xxxxxx x léčivech, x xxxxxx x xxxxxxxxxxx xxxxxxxx, a xx v xxxxxxxxxxxxx xxxxxx:
- xxxxxxxx xxxxxxx xxxxx, xxxxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx 2017/556,
- zajistit xxxxxxxx xxxxxx 3, xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxxx xxxxxxx, xxxxx zajistí, aby xxxxxxxxx postupy byly xxxxxxxxxx x xxxxxxxx xxxxxxxxx,
- xxxxxxxx xxxxxxxx xxxxxx 10 xxx 8, xxxx xxxxxxxx xxxxxx a xxxxxxx xxxxx, xxxxx zajistí, xxx xxxxxxxxxx x xxxxxxxxx členských států xxxx, xx xxxxxxxx x tam, xxx xx xx vhodné, xxxxxxx x místům, xxxxxxxxx prostorám xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx x xxxxxxxxx hodnocením, jakož x x xxxxxxxxx xxxxxxxxxxxx xxxxxx,
- xxxxxxxx xxxxxxxx xxxxxx 13 xxxxxxxxxx xx inspekčních xxxxx a vedení xxxxxxx,
- xxxxxxxx xxxxxxxx xxxxxx 4 týkajícího xx xxxxxx záznamů x kvalifikaci, xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx,
- xxxxxxxx, xxx xxxxx xxxx při xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxx porušení xxxx neuznávají-li xxxxxxxxxx xxxxxxxxxxx pravomoci xxxxxxxxxx, xxxx toto xxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxx x aby xx xx xxxx příslušný xxxxxxx xxxxx xxxxxxxx xxxxxx.
Xxxxxxxx 2017/1569 xx xxxxxx s ohledem xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 ze xxx 16. dubna 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/ES, x zejména x xxxxxxx na xx. 63 xxxx. 1 xxxxxxxxx nařízení, xxxxx xxxxxxxxx, že xxxxxxxxx xxxxxx xxxxxxxxx musí xxx xxxxxxxx xx xxxxxxx xxxxxxx praxe, xxxxx xxxxxxx kvalitu xxxxxx léčivých xxxxxxxxx x xxxxx zaručit xxxxxxxxxx subjektu hodnocení x spolehlivost x xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx. Xxxx xxxxxxx xxxxx xxxxxx xxxxxxx xxxxxx správnou výrobní xxxxx a xxxx xxxxxxxx x xxxxxxxxxx xx xx. 89 xxxxxxxx Xxxxxx vydat xxxxxxxx xxxxxxx výrobní xxxxx xxx hodnocené xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx. Toto zmocnění Xxxxxx xxxxxxxx xxxxxxx xxxxxxxx 2017/1569, a xx xxxxxxx s xxxxxxx xx xxxxxxxxxxx xxxxxx:
- je xxxxxxxx xxxxxxxx soulad xxxx xxxxxxx xxxxx hodnoceného xxxxxxxx xxxxxxxxx použitého xx stejných xx xxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxx xx, xx xxxxx xxxxx xxxxxx hodnoceného léčivého xxxxxxxxx xxxx náležitě xxxxxxxxxxxxx x odůvodněny;
- xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx představuje další xxxxx x xxxxxxxxx x xxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků, xxxxxxx xxxxxx pevně stanoveny xxxxxxx, existují xxxxx xxxxx xxxxxxxxxx xxxxxxxxx, x x xxxxxxxx xxxx xxxx xxxxxx xxxxx; xxxx xxxxx xxxxxxxxx x xxxxxxx (xxxxx) náhodného výběru x xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx přípravku xxx účely klinického xxxxxxxxx (zaslepení). Během xxxxxxxxx xxxxxx být xxxxx xxxxx xxxxxxxx, xxxxxxxx a xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx, x xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxxxxx xx xxxxx ještě xxxxxxxxxxx xxx u xxxxxxxxxxxxxx xxxxxxxx přípravků. Xxxxxxxx k této xxxxxxxxxx xx výrobní xxxxxxxx xxxx být xxxxxxxxx vysoce xxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx;
- xxxxxxx xxxxxxx praxe, xxxxx xxx o xxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxx uvádění xx xxx, x x xxxxxxxxx xxxxxx přípravky, xx založena xx xxxxxxxx xxxxxxxx;
- xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx pro xxxxxxx xx trh xx xxxxx xxxxxx xx stejných xxxxxxxxx xxxxxxx. X xxxx xxxxxx xx xxxxxx x xxxxxx pro xxxxxxxx výrobní praxi xxx xxxxxxxxx xxxxxxx xxxxxx přípravky měly xxx xx nejvíce xxxxxxx s xxxx, xxxxx se xxxxxxxx xx humánní xxxxxx xxxxxxxxx;
- xxx xxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx, je nezbytná xxxxxxxxxx mezi ním x zadavatelem. Stejně xxx musí zadavatel xxxxxxxxxxxxx s xxxxxxxx, xxx dodržel xxxxxxxxx xxxxxxxx (EU) č. 536/2014. Xxxxx xxxx xxxxxxx x xxxxxxxxx různými xxxxxxxx xxxxxxxx, xxxx xx být povinnosti, xxxxx x sobě xxxxxxxx xxxx, stanoveny x xxxxxxxxx xxxxxx xxxx xxxx. Xxxxxx xxxxxx xx měla xxxxxxxx xxxxxxx inspekčních xxxxx x xxxxxx xxxxxxxxx o xxxxxxxx xxxxxxx;
- xxxxxxxxx léčivé xxxxxxxxx xxxxxxxx do Xxxx xx xxxx xxx xxxxxxxx x xxxxxxxx standardů xxxxxxx, xxxxx jsou xxxxxxxxxxxx xxxxxxxxxx standardům x Xxxx. Z xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxx xx Xxxx pouze xxxxxxxxx xx xxxxxxx ve xxxxx xxxx, xxxxx xx xxxxxxxxx nebo xxxxxxxx x výrobě x souladu x xxxxxxxx xxxxxxxx xxxx, x xxx xx xxxxx.
Xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx xxx, xxx xxxx xxxxxxxxx xxxxx xx xxxxxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx. X xxxxx xxxx xx xxxxxxxx 2017/1569 úzce xxxxxxxx na nařízení 2017/556, xxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx správné xxxxxxxx xxxxx xxxxx xxxxxxxx 536/2014. I xxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx, aby xxxxxxxxxx x zájmu xxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxx výsledků xxxxxxxx x Xxxx x x zájmu xxxxxxxxx xxxxxxxxxx xxxxxxxxx států xxxx x dispozici xxxxxx uznávané standardy xxx xxxxxxxxx inspekcí xxxxxxx xxxxxxx praxe xxx xxxxxxxxx xxxxxx xxxxxxxxx xx formě xxxxxxx;
- pokyny Komise x xxxx xxxxxxx xx xxxx xxx xxxxxxxxx a xxxxxxxxxx xxxxxxxxxxxxx v závislosti xx xxxxxxxxxx a xxxxxxxx xxxxxxx. Během xxxxxxxx xx xxxxx xxxxxxxxxx musí xxxxxx, xxx xxxxxxx místo xxxxxxxx správnou xxxxxxx xxxxx xxx u xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxx xxxxxxx xx xxx. X tohoto důvodu x x xxxxx xxxxxxxxx účinného dozoru xxxx stanoveny postupy x xxxxxxxxx xxx xxxxxxxxx xxxxxxxx s xxxxx ověřit, xxx xx dodržována xxxxxxx xxxxxxx xxxxx pro xxxxxxxxx xxxxxxx léčivé xxxxxxxxx. Xxxx praxe xxxx xxxxxxxxxxxxx x xxxxxxx x pravomocemi x xxxxxxx humánních xxxxxxxx xxxxxxxxx - xxx xxxx xxxx xxxxxxxx směrnici Xxxxxx (XX) 2017/1572. X xxxx, xxx xxxx xxxxxxxx xxxxxx, xxxx xxx inspektoři xxxxxxxxx xxxxxxxx xxxxxxxxx;
- příslušné xxxxxx xxxx podle xxxxxxxx povinnost vytvořit xxxxxxx jakosti, xxx xxxx zajištěno, xx xxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x důsledně xxxxxxxxx. Dobře xxxxxxxxx xxxxxx jakosti xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, xxxxx xxxxxxx x xxxxxxx, xxxxxx standardních xxxxxxxxxx xxxxxxx, xxxxx xx xxxx xxxxxxxxxx xxxxx xxx xxxxxx xxxxx xxxxx, jasně x xxxxxxxx xxxxxxxx xxxxxxxxxx x odpovědnosti xxxxxxxxxx a požadavky xx xxxxxxxx xxxxxxx, xxxxx i xxxxxxxxx xxxxxx x xxxxxxxxxx, xxxxxxx xxxxxx xx xxxxxxxxx nesoulad.
Směrnice 2017/1572 xxxx xxxxxxx s xxxxx xxxxxxxx xxxxx xx xxxxxxxx x xxxxxx xxx správnou xxxxxxx praxi. Obsahuje xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx x x xxxxxxxx xxxxxxxxxxxx výrobce. Xxxxxxxx xxxxxxxxxx, xxxxx xxxxxxxxx, xxx všechny xxxxxx xxxxxxxxx xxxxxxxx xx xxxxx XX xxxxxxxxx xxxxx standardy xxxxxxx; xxxxxx xxxxxxxxx xxxxxxxx xx Xxxx xxxx být xxxxxxxx x souladu se xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx rovnocenné standardům xxxxxxx xxxxxxx xxxxx xxxxxxxxxx x Xxxx.
X xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx správné xxxxxxx xxxxx musí výrobci xxxxxxxxx xxxxxxxx přípravků x xxxxxxxxxx dbát xxxxxx xxxxxxxxx x čl. 47 xxxxxxxx 2001/83/ES, xxx je xxxxxxx, xx „Xxxxxx x xxxxxx pro xxxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxxxxxx podle čl. 46 xxxx. x) xx xxxxxxx formou xxxxxxxx“ x že „xxxxxxxx xxxxxx v xxxxxxx s xxxxxxxxx xxxxxxxx Xxxxxx xxxxxxxx x x případě xxxxxxx xxxxxxx tak, xxx bylo xxxxxxxxxxx x technickému a xxxxxxxxx xxxxxxx“. Zásady x pokyny xxx xxxxxxxx xxxxxxx praxi xxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx, pokud xxx x řízení jakosti, xxxxxxxxxx, xxxxxxxx x xxxxxxxx, xxxxxxxxxxx, xxxxxx, xxxxxxxx jakosti, xxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxxxxxx x stažení xxxxxxxxx x oběhu a xxxxxxx xxxxxxxx. Pokud xx xxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx, jsou xxxx xxxxxx a xxxxxx xxxxxxxxxxxx zvláštním xxxxxxxxxxx xxxxxxxxx přípravků x xxxxxxx x přístupem xxxxxxxxx xx hodnocení xxxxx.
Xxxxxxx xxxxxxxx xxxx xxxxxxxxxxxxx xx xxxxxx x xxxxxxxx x xxxxxxx xx vyhlášky č. 229/2008 Sb. Nahrazení xxxxxxxx 2003/94/ES xxxxxxxx 2017/1572 xxxxxxxx xxxxxxx xxxxx xxx zákona x xxxxxxxx, xxx zejména xxxxxxxxxxx předpisu - xxxxxxxx č. 229/2008 Sb. Xxxxxxxxxxx xxxxxxxx xx xxxxxx xxxxxxxxxx xxxxxx x xxxxxxxx xxxxxxx x xxxxxxxxxxxxx bodech:
- xxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx,
- xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx a xxxxxxxx xxxxxx xxxxxxxx xxxxxxx,
- xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxxx x xxxxxxxxxx reklamací xxxxxx xxxxxxxx účinného xxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx x distribuční xxxx,
- xxxxxxxxx toho, xxx výrobci xxxxxxxxx xxxxxxx výrobní a xxxxxxx xxxxxxxx x xxxxxxxxxxx s xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx registraci x xxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx x xxxxxxx x danou xxxxxxxxxx.
Xxxxxxxxxx právní xxxxxx xxxx xxxxx x xxxxxxxxxxxx xxxxxxxxxxxx x xxxxxxxx mužů x xxx.
3. Vysvětlení xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx
Xxxxx xxxxxx zákona x léčivech x xxxxxx x zdravotních xxxxxxxx xx xxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxx Xxxxxxxx xxxx. Teprve xxxxx xxxxxxxxxxxx se xxxxxxx xxxxxx xxxxxxxx provázaných xxxxxxxx v xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxxxx xxxxx xxxxxxx klinické xxxxx. Xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx x xxxxxx x xxxx xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx xxxxx, xxxxx bude možno xxxxxxxxx v xxxxx. Xxxxx xx x xxxxxxxx xxxxxx novely xxxxxx x léčivech xxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx (xxxxxxxx) xx x Xxxxx xxxxxxxxx xxxxxxx xxx xxxxxx x xxxx zbytku xxxxxxxxxx, xxxx by xxxxx k xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxxxx o ochranných xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx 2011/62/EU. Česká xxxxxxxxx xxx xx xxxxx právního xxxx xxxx směrnici plně xxxxxxxxxxxxx xxxxxxx č. 70/2013 Sb., xxxxxx byl xxxxxxxxxxx xxxxx x xxxxxxxx.
Xxxxxxxxxxxxxxx xxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxx smlouvy x xxxxxxxx Xxxxxxxx xxxx xx xxxxxx xxxxxxxxx xxxxx x xxxxxxxx xxxxxx xx xxxxxx Evropské komise xxxxx Xxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x popřípadě x xxxxxxx sankce xxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xx mělo xxxxx na celý xxxxxx a xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxx Xxxxx xxxxxxxxx, xxx x xxxxxxxxx xxxxxxxxx států, xxxxx xxx x xxxxxxx, že xxxxxxxx xxxxx xxxxxxxxxx všemi, xxxx xxxxxx xxxxxxx. X xxxxxxxxx xx xxxxx xxxxx xxxxxxx, xx za xxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxx xx xxxxxx xxxxxx Xxxxxxxx unie xxxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx i xxxxxxx sankce, xxxxx xxxx xx xxxxx xxxxx odrážela míru xxxxxx v xxxxx xxxx XX x x takové oblasti xxxx xx bezpečnost xxxxxxxx. X prvnímu xxxxxxx novely, xxxxxx xx zvýšení xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxx xxxxx následující.
Zavedení xxxxxxxxxx xxxxx pro xxxxxx přípravky x xxxx Xxxxxxxx xxxx x xxxxx xxxxxxxxx xxxx xxxxxxx xxxxx x zároveň xxxxxxxx xxxxxxxxx xxxxxxxxx xxxx x xxxxxxxx xxxxxxxxx xx xxxx x xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx a xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx a xxxxxxxx, xxx x xxxx bylo xxxxxxxxxxxx. Xxxxxx těchto ochranných xxxxx zohledňuje xxxxxxxxxxx xxxxxxxx xxxxxxxxx léčivých xxxxxxxxx. Xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxxx xx xxxxxx xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx. X zájmu xxxx, xxx byly xxxxxxxx xxxxx xxxxxx, xx povoleno xxxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxx xxxx xxxxx xxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx podmínek. Xxxxxxx x xxxxxxx přebalení xxxxxxxx xxxxx xxxx xxx xxxxxxxxx rovnocennými xxxxxxxxxx prvky. Xxxx xxxxxx podmínky xx xxxx zajistit xxxxxxxxxxx xxxxxxx proti xxxxxx xxxxxxxxxx léčivých přípravků xx legálního xxxxxxxxxxxxxx xxxxxxx s cílem xxxxxxx xxxxxxxx x xxxxxxxx rozhodnutí x xxxxxxxxxx a výrobce. Xxxxxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxx na xxxxxxxx xxxxxxx xx vyžádá xxxxxxxxxx x provoz xxxxxxxxx úložiště x Xxxxx republice, xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx, xxxxxxx x xxxxx xxxxxxxxxxx činnosti x xxxxxxxx spojených x xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xxx xxxxxxxxx Xxxxxx Xxxxxxxxxxx xxxxxxxxxxx Xxxxxx x xxxxx xxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx prvků xx xxxxx humánních xxxxxxxx xxxxxxxxx v České xxxxxxxxx xx xxxxxxx x xxxxxxxxxx zvýšení xxxxxxxxxxx xxxxxxxx xxxxxxxxx x legálním dodavatelském xxxxxxx, xxx by xxxxx vést k xxxxxxxx zásad xxxxxxx xxxxxxxxx zdraví, x xxxxx xx xxx xxxxxxx nenahraditelné xxxxxxx xxxx x xxxx xxxxxxxxx citlivé oblasti x důsledku xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxxx systém xxxx xxxxxxxx pouze x xxxxxxx, kdy xxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxx x xxxxxxx xxxxx XX xxxxx xxxxx xxx xxxxxxxxxx xxxxxxxxxxx x xxxx xxxxxxxxx xxxxxxxx předpisů XX.
Xxxxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského xxxxxxx v xxxxxx xxxxx xxxxxxx, xx x xxxx xxxxx xx xxxxxxxx léčivé xxxxxxxxx xxxxx xxxxxxxx xxxxxx do xxxxxx xxxxxxxxx xxxxx (xxx xxxxx xxxxx zboží x XX), xxx xxxx xxxxxxxx xxxxxxxxx xxxxx x xxxx. Xxxx by xxxx x xxxxxxx x xxxxxxxxx xxxxxxxx spolupráce.
K xxxxxxx xxxxxxx xxxxxx, xxxxxx je xxxxxxxxx xxxxxxxxxx xxxxx správné xxxxxxx xxxxx pro xxxxxxxxx xxxxxx xxxxxxxxx x zajištění xxxxxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx praxe, xxxxxxxxxxxx xxxxx xxxxxxxxxxx.
Xxxxxxxx, jak xx xxxx xxxxxxx, xxxx přímo xxxxxxxxxxxxx, xxxxxx xx xxxxxxxx x rámci xxxxxxxx xxxxxxxxxxxx xxxxx vnitrostátního xxxxxxxx xxxx Xxxxx xxxxxxxxx xx xxxx xxxxx xxxxx Evropské xxxx novelizovat dotčená xxxxxxxxxx zákona x xxxxxxxx x xxxxxx x xxxxxxxxxxx xxxxxxxx xxx, aby xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxxxxx se xxxxxxxx inspekčních xxxxxxxx, xxxxx x se xxxxxxxx xxxxxxx praxí xxxxxxxx přípravků.
4. Zhodnocení xxxxxxx xxxxxxxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx Xxxxx republiky
Návrh xxxxxx xxxxxx x xxxxxxxx x xxxxxx x xxxxxxxxxxx službách xx x xxxxxxx x xxxxxxxx pořádkem Xxxxx republiky. Xxxxxxxxxx xxxxxx úprava xxxxxxxxxx xxxxxxx zakotvená xxxxxxxx xxxxxx státní moci, xxxxxx xxx xxxxx článku 2 xxxx. 3 Xxxxxx x článku 2 xxxx. 2 Xxxxxxx xxxxxxxxxx xxxx a xxxxxx uplatňovat xxx x xxxxxxxxx x x xxxxxx xxxxxxxxxxx xxxxxxx, x to xxxxxxxx, xxxxx zákon xxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx, xxxxxxxxxx x článku 4 xxxx. 1 Xxxxxxx xxxxxxxxxx práv x xxxxxx, xxxxx xxxxxxx x xxx, že xxxxxxxxxx mohou xxx xxxxxxxx toliko xx xxxxxxx xxxxxx x x xxxx xxxxxx x xxx xxx xxxxxxxxx xxxxxxxxxx xxxx x xxxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx subjektů xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxxx ochranu pacientů xxxx xxxxxxxxxx léčivými xxxxxxxxx, jsou x xxxxx xxxxxxx zdraví x xxxxxx xxxxxxxx x xxxxxx nad xxxxx Xxxxxx České xxxxxxxxx a Xxxxxxx xxxxxxxxxx práv x xxxxxx. Xxxxxxxxxxx právní xxxxxxx xx zajistí xxxxx míra xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx x xxxxxxxx xx tak xxxxxx xxxxx xxxxxxx na xxxxxxx zdraví založené xxxxxxxxxxx článku 31 Listiny xxxxxxxxxx xxxx x xxxxxx jako součásti xxxxxxxxx xxxxxxx Xxxxx xxxxxxxxx.
Xxxxxx xxx xxxxxxxx x podrobných xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické xxxxx je xxx. x povahy xxxx xxxxxx jen xx xxxxxxxxxx xxxxxxx, xxxxx xxxxxxxxxx postupují na xxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxx z xxxxxx xxxxxxxxx xxxxxxxxx. Xxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxx. Xxxxxxx, xxx xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxx, je xxxxx xxxxxxxxx xx exces. X pověření x xxxxxxxxx xxxxxxxx, xxxxxx xxxxxx, xxxx kontrolovaný xxxxxxxxxx xxxxxxxx informována xxxxxxx před xxxxxxxxx xxxxxxx samotného, x xx x x xxxxxxxxx, kdy podle xx. 8 nařízení xxxxx být inspekce x případě xxxxxxxx xxxxxxxxx, aniž byly xxxxxxx ohlášeny.
Návrh xxxxxx xxxxxx xxxxxxxx kritéria xxxxxxxxx ústavním xxxxxxxx Xxxxx xxxxxxxxx, xxxxxxxxx xxx článkem 12 Listiny xxxxxxxxxx xxxx x xxxxxx, který stanoví, xx zásahy xx xxxxxxxxxxxxxxxx xxxxxx xxxxx xxx xxxxxxx xxxxxxxx, xxx xx-xx xx x xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx pro ochranu xxxxxx xxxx xxxxxx xxxx, xxx xxxxxxx xxxx x svobod xxxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxx. Xxxxx je xxxxxx xxxxxxx také xxx xxxxxxxxx xxxx xxxxxxxxxxx jiné xxxxxxxxxxx xxxxxxxx, xxxxx být xxxxxx xxxxxx xxxxxxx xxxxxxxx, xxx xx-xx xx xxxxxxxx xxx xxxxxx xxxxx xxxxxxx xxxxxx.
5. Xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx právní xxxxxx x předpisy Evropské xxxx, xxxxxxxxxxx soudních xxxxxx Evropské xxxx xxxx obecnými právními xxxxxxxx xxxxx Evropské xxxx
Xxxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx adaptuje xxxxxxxx o xxxxxxxxxx xxxxxxx, xxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické praxe xxxxx xxxxxxxx 536/2014 x xxxxxxxx, xxxxxx xx xxxxxxxx nařízení 536/2014 xxxxxxxxxx xxxxx x xxxxxx xxx xxxxxxxx výrobní xxxxx xxx hodnocené humánní xxxxxx přípravky x xxxxxxxx xxxxxxxxx xxxxxxxx, xxxx. transponuje xxxxxxxx, xxxxxx se doplňuje xxxxxxxx 2001/83/ES, xxxxx xxx x zásady x xxxxxx pro xxxxxxxx xxxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx.
Xxxxxxxxxx xxxxx xxxx x xxxxxxx se xxxxxxx xxxxxxxxxxxxx xxx Xxxxxx xxxxxxxxx x xxxxxxxx x Xxxxxxxx xxxx, Xxxxxxxx o xxxxxxxxxxx České xxxxxxxxx x Evropské unii xxx x xxxxxxxxxxx xxxxxxxx orgánů Xxxxxxxx xxxx a xx x souladu x xxxxxxxx zásadami xxxxx Xxxxxxxx xxxx (xxxx. xxxxxxx právní xxxxxxx, xxxxxxxxxxxxxxx x zákazu xxxxxxxxxxxx).
X xxxxxxxx Xxxxxxxx xxxx, xxxxx xx xxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xx xxxxxx stanovení xxxxxxxx pro ochranné xxxxx uvedené na xxxxx humánních léčivých xxxxxxxxx, se xxxxx xxxxxx zákona o xxxxxxxx xxxxx xxxxxx xxxxxx xxxxxxxx:
- xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2001/83/ES xx xxx 6. xxxxxxxxx 2001 x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxx znění (xxxx jen „směrnice 2001/83/ES“),
- směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU xx xxx 8. xxxxxx 2011, xxxxxx xx xxxx xxxxxxxx 2001/83/ES o xxxxxx Společenství týkajícím xx humánních xxxxxxxx xxxxxxxxx, xxxxx xxx x zabránění xxxxxx xxxxxxxxxx léčivých xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx (xxxx xxx „xxxxxxxx 2011/62/EU“),
- xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) 2016/161 xx xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx xxxxxxx xx obalu xxxxxxxxx xxxxxxxx xxxxxxxxx (xxxx xxx „xxxxxxxx x xxxxxxxxxx xxxxxxx“).
Xxxxxxxxxxx xxxxx xxxxxx je xxxx xxxxxxxxxx x předpisy Xxxxxxxx unie, judikaturou xxxxxxxx xxxxxx Xxxxxxxx xxxx x xxxxxxxx xxxxxxxx zásadami xxxxx Xxxxxxxx unie.
6. Xxxxxxxxxx xxxxxxx x mezinárodními xxxxxxxxx, xxxxx je Xxxxx republika xxxxxx
Xxxxxxxxxx xxxxxx neodporuje mezinárodním xxxxxxxx, xxxxxxx xx Xxxxx republika xxxxxx. Xxxxx se x xxxx xxxxxxxxxxx xxxxxxx:
- xxxxxx o xxxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxxxxx shody, xxxxxxxxx x označení xxxx Xxxxxxxxx společenstvím x Xxxxxxxxx (Úř. xxxx. X 229, 17.8.1998, x. 3),
- xxxxxx x vzájemném xxxxxxxx ve vztahu x xxxxxxxxxx xxxxx xxxx Evropským xxxxxxxxxxxxx x Xxxxx Xxxxxxxx (Xx. věst. L 229, 17.8.1998, x. 62),
- dohoda x xxxxxxxxx xxxxxxxx xxxx Xxxxxxxxx xxxxxxxxxxxxx x Xxxxxxx (Xx. xxxx. X 280, 16.10.1998, x. 3),
- dohoda x vzájemném uznávání xxxx Xxxxxxxxx společenstvím x Xxxxxxxxx (Xx. xxxx. L 284, 29.10.2001, x. 3),
- xxxxxx xxxx Xxxxxxxxx xxxxxxxxxxxxx x Švýcarskou xxxxxxxxxxx o xxxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxxxxx xxxxx (Xx. xxxx. L 114, 30.4.2002, x. 369).
7. Xxxxxxxxxxxxx hospodářský x xxxxxxxx xxxxx xxxxxxxxxx právní úpravy xx xxxxxx xxxxxxxx, xxxxxxx xxxxxxx rozpočty, xx xxxxxxxxxxxxx xxxxxxxxx Xxxxx republiky, xxxxxxxx xxxxxx, xxxxxx xxxxxx xx xxxxxxxxxx skupiny xxxxxxxx, zejména xxxxx xxxxxxxx xxxxx, osoby xx xxxxxxxxxx xxxxxxxxxx x národnostní xxxxxxx, xxxxxx xx xxxxxxx xxxxxxxxx
Xxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxx adaptace xxxx xxxxxxxxxxxxxxxx předpisů Xxxxxxxx xxxx nebudou xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx x navýšení xxxxxx xxxxxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx xx xxxxx xxx xxxxxxxxx xxxxx xxxx systemizací xxxxxxxxxx x xxxxxxxxxx xxxx ve xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxx kapitolu Ministerstvo xxxxxxxxxxxxx, xxxxxxxxx na xxxxxx Xxxxxx.
Xxxxxxxxxx právní xxxxxx nebude xxx xxxxx xxxxxxxx xxxxxx, xxxx dopady na xxxxxxxxxx skupiny xxxxxxxx (xxxxx xxxxxxxx xxxxx, xxxxx xx xxxxxxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxx), xxx dopady xx xxxxxxx xxxxxxxxx.
Xxxxxx xx xxxxxxxxxxxxx prostředí Xxxxx xxxxxxxxx xx xxxx x xxx xxxxxxxxxxx xxxxxx x xxxxxxxx, xxxxx xx xxxx xxxx xxxxxxx jeho xxxxxxx, xx. xxxxxxx č. 70/2013 Sb., x xxxx xxxxxxxxx účinnost, xxxxxxxx xx váží xxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxx xxxxxx xxx byly xxxxxxxxx xxx xxxxxxxxxxxx xxxxxx právních xxxxxxxx. X xxxxx směru xx xxxxx xxxxxxx xx důvodovou xxxxxx, xxxxxx xxxxxx x xxxxxxxxx dopadů xxxxxxxx (XXX) x xxxxxx č. 70/2013 Sb. x xxxx xx podrobnou zprávu XXX k nařízení x ochranných xxxxxxx xxxxxxxxx „Xxxxxx Xxxxxxxxxx“. X xxxx xxxxxxxx xxxxxx se xxxxx, xx v souladu x čl. 4 xxxxxxxx 2011/62/XX x čl. 54x xxxx. 2 x 3 xxxxxxxx 2001/83/XX Xxxxxx posoudila xxxxxxx, náklady a xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxx xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxx ověření ochranných xxxxx x xxxxxxxx x xxxxxx systému xxxxxxx.
Xxxxxxx xxxxxxxxx systému xxxxxxxxx xxxxxxxx přípravků xxxxx xxxxxxx na xxxxxxx x držitelé xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravků opatřených xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx prvky xxxxxxx xxxxxxx xx xxxxxxx x správu systému xxxxxxx (xxxx xxxxxxxxx xxxx xxxxxxx již xxxxxxxx 2011/62/EU, xxxxx xxxx transponovaná xx xxxxxxxx xxxx XX xxxxxxx č. 70/2013 Sb.). Pro xxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx zavedení xxxxxxxxxxx identifikátoru na xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx náklady, xxxxx souvisí x xxxxxxxx přizpůsobit xxxxxxx xxxxx nebo xxxxxxx xxxxx (xxxxxxxx náklady) x xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx, aby xxxx xxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx do xxxxxxx xxxxxxxx. Aby bylo xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx, musí xxx xxxxxx xxxxx xxxxxxxxx xxxxx tiskovým x xxxxxxxxxx xxxxxxxxx.
Xxxxxxx výrobců xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxxx x hlediska:
- xxxxxxxxx xxxxxxx (xxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx léčiv xxxxxxxxxxxxxx xxxxxxxx EU xx xxxxxxx xxxxxxx xxx xxxx xxxxxxxxx xxxxx, xxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxx),
- ochrany xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx (xxxxxxx xxxxx xxxxxxxxxx xxxxxxxx přípravku xx xxxx xxxxxx x xxxxxxx legálních prodejů),
- xxxxxxxxx a xxxxxxx xxxxxxx při xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxxx datové xxxxx (xxxxx x xxxx xxxxxxxxxxxxx) xxxxxxx x xxxxxxxxxx identifikátoru.
Vznikají xxxx xxxx xxxxxxx xx xxxxxx lékáren, zejména xxxxxx XX, nové xxxxxx x x xxxxx xxxxxxx i xxxx xxxxxxxxxx XX. X xxxxxxxx xxxxxxxxxxx xxxx xx xxxxxxx „xxxxxxxxx xxxxxxx“, který xxxx xxxxxxxxxxx nebezpečný xxxxxxxxx zachytit. Xxxxx xx xxxxxxxx, xxx xxxx svou úlohu xxxxx x xxxxxxxx xxxx. Náklady tímto xxxxxxx xx nutné xxxxxxxxx, opět x xxxxxxxx nákladů x xxxxxxx, xx xxxxxxxxxxx xxxxxxxxxxx, a xx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx zdraví. Xxxxx xx xxxxxxxxxxxx (xxx xx úrovni XX, xxx vnitrostátní) xxxxxxx xxxxxxx systém xxx, xxx je xxxxxxxxxx.
Xxxxxx xx xxxxxxxxxx xxxxxxxx xx trhu x xxxxxxxx přípravky, xxxxx xxxxx xxxxxxxxx xx xxxx xxxxxx, xx xxx již netýkají xxxxxx xxxxxxxx o xxxxxxxxxx prvcích xxxx xxxxxxxx, xxx xxxxx xxxxxx této xxxxxx, xxxx xxxxxxx xxxx xxxx, ve xxxxxxx xxxx Xxxxx xxxxxxxxx xxxxx xxxxxxxx o xxxxxxxxxx prvcích xxxxxxx xxxxxxx zvolit xxxxxxxxx, xxxxx se xxxxx xxxxxxxxxx xx xxxxx xxxx.
Xxxxxxx xxxxxxxxxxxx xxxxx x xxxx oprávněných xxxx xxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxx prvky x xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxx (xxxxxxxx xxxxxxxxxx xxxxxxx 2D kódů, xxxxxx xxxxxxxxxxxxx x xxxxxxxxxxxx programů xxxx.).
Xxxxxxxx xxxxx navrhované xxxxxx xxxxxx na podnikatelské xxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx registrační dokumentace xx očekává xxxxxxxxx, xxxxx xxxxx vztahující xx x jedinečnému xxxxxxxxxxxxxx lze zavést xx xxxxx xxxxx x rámci xxxxxxxxxx xxxxxx x xxxxxxx xx xxxxxxxxx x xxxxxxxxx - xxxx. xxxxxx o xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxx x xxxxx xxxxxxxxxx xxxx XX, xxxx XX nebo xxxx XX. Předložení xxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxx charakteru xx xxxxxxxx xxxxx x xxxxxxx, xxxxx x přechodném období xxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxxxxxx, která xxxxxxx xxxxxxxxx o xxxxxxxxx. Předložení žádosti x xxxxx registrace xxx xxxxxxxx xxxxxxxxxx x ověření xxxxxxxxxx x xxxxxx xx xxx nezbytné pouze x xxxxxxx, kdy xxxxxxxxxx x xxxxxxx xxxxxxxxxx x obalem xxxx xxx xxxx xx xxxxxxxxx xxxxx, xxxx xxxxxxx xxxxxx xxxxxxxx xxxxx. Dále xxxx xxxxxxxxx, že xxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxx k xxxxxxx xxxxxxxxxx x obalem xx xxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x změnu registrace, xxxxx implementace xxxxxxxxxx xxxxx na xxxx xxxx vliv xx xxxxxxxxx xxxxx. Xxxxxxxx x výše xxxxxxx xxxxxxxxxxx, xxx xxx xxxxxxx xxxxxxxx přípravků xxxxxx třeba pro xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxx x změnu xxxxxxxxxx x xxxxxxxx xxxxx xx xxxxx xxxxxxxxxxxxx xxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx o změnu xxxxxxxxxx, dopad na xxxxxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx a x xxxxxxx xxxxxxxxxxxx xxxx na vyřízení xxxxxxxxxxxx žádostí bude xxxxxxxxx.
Xxx xxxxxx xxxxxxxxx x xxx, xx xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx ponesou xxxxxxxx xxxxx, xx x xxxxxx xxxxxxxx xxxxxxxxxx prvků do xxxxxx xxxx přechodně xxxxx. Toto xxxxxxx xxxx xxxx xx xxxxxx k xxxxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxxxxx, xxxxx náklady xx xxxxxxxx XX xxxx x léků xxxxxxxx na xxxxxx xxxx zcela xxxxx xxxxxx xxxxx xxx xxxxxxxx xxxxxxx na xxxxx, výrobu x xxxxxxxxxx xxxxxxxx přípravků. Xxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xx xxxxx xx lékařský xxxxxxx, xx xx xxxxxxx případů xxxxxxxxxx xxxxxxxx xxxxxxxxx maximální xxxx xxxxxxxx xxxxxxxxxxx, xxxxxx xxx xxxxxx xxxxx xx xxxxxxx xxxxxx zpoplatněné žádosti. Xxxxxxxx xxxx x xxxxxxxx úhrady léčivého xxxxxxxxx x xxxxxxxxxx xxxxxxxxx zdravotního xxxxxxxxx xxxx xxxxxxxxxxx x xxxxx xxxxxxxxx xxxxxx. Xxxxx se v xxxxxx Evropské unie (xxxxxx ČR) xxxxx xxxxxxx xxxxxxx tzv. xxxxxxxx xxxxxxxx xxxxxxxxxxxxx - země xxxxxxxxx xxxx x úhrady xxxxx xxxxxxxxxx cen xxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx x zahraničí, xxxxx xx v drtivé xxxxxxx xxxxxxx nemělo xxxxxxxxxx xxxxxxxx ceny x XX xxxx xx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxx zdravotního pojištění. Xxxxxxxx k velmi xxxxxxxxx vlivu xxxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx (xxxxxxx) xxxx x xxxxxx xx zvyšování xxx léčivých xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxxx prvků xxxxxxxxxxxxx, xxxx xxxxxx odlišitelné xx xxxxx xxxxxxx. Xxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx, xx xxxxxxx veřejného xxxxxxxxxxx xxxxxxxxx se xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, nikoliv xxxx xxxx.
Xxxxxxx distributorů xxxxx xxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxx prvky x vyřazovat xxxxxxxxx xxxxxxxxxxxxx ze xxxxxxx xxxxxxx. Xxxxx xx x pořízení xxxxxxxxxx xxxxxxx 2D xxxx, xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xx xxxxxx xxxxxx. Xxxxxxx xxxxx xxxxxxx je xxxxx xxxxxxxxx, xxxx x xxxxxxxx xxxxxxx x xxxxxxx, xx xxxxxxxxxxx převažující, x xx xxxxxx xxxxx xxxxxxxxx ochrany xxxxxxxxx xxxxxx. Proto se xxxxxxxxxxxx (xxx na xxxxxx EU, tak xxxxxxxxxxxx) xxxxxxx vymezit xxxxxx xxx, xxx xx předkládán.
Hospodářský a xxxxxxxx xxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxx hodnocen v xxxxx novely xxxxxxxxxxx xxxxxxxx xxxxxxxx 536/2014, x xxx xx xxx x xxxxx xxxxxxx. Obě xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxx 536/2014 x xxxxxxxxx x x xxxxxxxxxxxxx xxxxxxxxx xx, xx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxx. Vydání xxxx xxxxxxxx 2017/1572 xxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxx 2017/1569 a xxxxxxxxx výraznější rozdíly xx xxxxxxxxx xxxxxx xxxxxx, xxxxx se xxxx xxxxxxxxxxxxx x xxxxxxxxxx xxxxxx.
Xxxxxx xxxxxxxx xxxxxx xxxxxxx administrativními x xxxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx x výkonem xxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxx nařízeními x xxxxxxx, jak xxxx xxxxxxx x xxxxxxxx xxxxxx x xxxxxx xxxxxx zajišťujícímu adaptaci xxxxxxxx 536/2014 (xxxxx č. 66/2017 Sb.).
8. Zhodnocení xxxxxx xx xxxxxx x xxxxxxx xxxxxxxx a xxxxxxxx xxxxx
Xxxxx zákona x oblasti ochranných xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx nové xxxxxxxxxx osobních xxxxx. Xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xx pouze x xxxxxxx xxxxxxxxxx xxxx xxxxxxxx, xxxxxxx xxxxx xxxxxxx ochranné xxxxx. Xxxxxx nebude xxxxxxxxxxx xxxxxx xxxxx pacientů, xxxxxx xxxx xxxxxx xxxxxx xxxxxxxxx, jejichž xxxxx xxxxxxx xxxxxxxx xxxxx. Xxxxxxxx xxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx údajů. Návrh xxxxxx x xxxxx xxxxxx nebude mít xxxxx negativní dopady xx oblast xxxxxxx xxxxxxxx x osobních xxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xx x xxxxxxx xxxxxxx xxxxxxxx praxe xxxxxx aspektu ochrany xxxxxxxx, a to xxxxxxxxxxxx xxxxxxxx. Xxxxxxxx 2017/556 xxxxxxx inspektorů xxxxxx xxxxxx pravomoci, xxxxx xx týká xxxxxxxx xx xxxxxxx x xxxxxxxxx souvisejících x xxxxxxxxx xxxxxxxxxx. Xxxxxxxxxx xxx xxxxx xxxxx budou xxx xxxxxxx k osobním xxxxxx včetně xxxxxxxxx xxxxxxxx údajů. Nařízení xxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx týkajících xx zdraví, xxxxx x xxxxxxxxx obchodních xxxxxxxxx, když xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xx xx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx x použitelnými xxxxxxxxx právních xxxxxxxx Xxxx x xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx. X xxxxxx 14 xxxxxx xxxxxxxxxxx a xxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx xxxx xxxxxxxxx zachovávat xxxxxxxxx xxxxxxxxxx xxxxxxxxx, x xxxx xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxx.
Xxxxxxxx xxxx xxxxxxxx xxxxx, xx xxxxxxxxx xxxxxx předložené prostřednictvím xxxxxxx XX (v xxxxxxx x čl. 78 xxxx. 6 nařízení x. 536/2014) xxxxxxx xxxxxxxxx xxxxxx údaje xxxxxxxx (čl. 13 xxxxxxxx 2017/556)
Xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx se xx xxxxxxxxxx jsou xxx xxxxxxxxxxxx xxxxxxxx údajů xxxx vázáni požadavky xxxxxxxx nařízení x xxxxxxx xxxxxxxx xxxxx č. 2016/679 (Xxxxxxx Data Xxxxxxxxxx Regulation, XXXX).
Xxxxxxxx č. 2017/1569 v xxxxxxxx XXX upravuje xxxxxxxx, xxxxxxxxxxxxxxx kterých xxxx xxxxxxx státy xxxxxxx xxxxxxxx, xxx x xxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx x xxxxx xxxxxxxx. X xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxx pravomoci, xxxxx xx týká xxxxxxxx xx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxx přípravků. Xxxxxx x x xxxxx xxxxxxx xxxx inspektory xxxxxxxxxxxx, xxxx stanoví, xx xxxxxxxxx xxxxxxx xx základě inspekce xxxx xxxxxx xxxxxxx.
Xxxxxxxxxxx xxxxxxxx xx nedotkne xxxxxxxxxx xxxxxx x xxxxxxxx, xxx xxxxxx x zdravotních xxxxxxxx, xxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxx, xxxxx xxxxxxxxxx xxxxxxx x xxxxx xxxxxxxxxxx kontrol x xxxxxxxx.
Xxxxxxxx správné xxxxxxxx xxxxx x xxxxxxx xxxxxxx praxe xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxx nařízení č. 536/2014, x ty budou xxxxxxxxx x xxxxxxx x nařízeními 556/2017 x 1569/2017. Kontroly xxxxxxxxx xxxxx xxxxxx x xxxxxxxx xxxx xxxxxxxxx x souladu x xxxxxxxxxx řádem, xxxxx obsahuje xxxxxxxxxx xxxxxxxx xxxxx osobní xxxxx xxxxxxxxx osoba, xxx xxxxxxx xxxxx xxxxxxx xx xxxxxxx xxxxxxxxx kontroly. Xxxxxxxxx xxxxxxxx x těchto xxxxxxxx xxxx xxxxxxxxxxxx xxxxx, xxxx xxxxxxx xxxxxxxx xxxxxx xxx Xxxxx xxxxxxxxx xxxxxxxx xxxxxx. Xxxxxx údaje xxxx navíc xxxxxxxx xxxxxxxxx xxxxxxx, x x xxxxxxxxx xx xxxxxx 2018 xxx xxxxxxxxx XX.
Xx xxxxxxx xxxx uvedeného xxx xxxxxxxxxxx, že ve xxxxxx x xxxxxxx xxxxxxxx x xxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx.
9. Xxxxxxxxxx xxxxxxxxxx rizik
V xxxxx xxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxx x xxxxxxx x xxxxxxxxx xxxxxxxxxxx Xxxxxxx xxxxxxxxx xxxxxx xxxxxxxx Úřadu xxxxx Xxxxx xxxxxxxxx. Ze xxxxxx xxxxxxxxx xxxxxxx, xx z návrhu xxxxxx xxxxxx vyplývá xxxxxxxx potenciál, xxxxx xxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxxxxx systémových xxxxx xxxxxx.
Xxxxxx xxxxxxxxx xxxxxxxx xx xxxxx xxxxxxxxxxxx určitý xxxxxxxx xxxxxxxxx, přičemž xxxxx xxxx xx odráží x xxxxx xxxxxxxxx xxxxxxxx: v xxxx xxxxxxxxxx jsou xxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx. X nařízení 2017/1569 xx to článek 23, xxxxx výslovně xxxxxx xxxxxxxx, xxx xxxxxxxxxx xxxxxx xxxxxxxxx žádným xxxxxxxxxxx vlivům, které xx xxxxx ovlivnit xxxxxx xxxxxxxxxxx a xxxxxx.&xxxx; Xxxxxxxx xxxxx, xx inspektoři musí xxx nezávislí xxxxxxx xx xxxxxxxxxx, xxxxxx x xxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, zkoušejících x xx osobách xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxxxx povinnost xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx x jiných xxxxxxx xx xx. Příslušný xxxxx xxxxx xxxxxxxxxx x xxxxx xxx xxxxxxxxxxx konkrétních xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx.
X xxxxxxxx 2017/556 xxxxxxxxxx článku 5 xxxxxxx, xx inspektoři xxxxx xxx xxxxxxxxx xxxxxxx xxxxx, který xx xxxx zpochybnit xxxxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxxxx, xxxxx xxx xx xxxxxx xxxxx. Xxxxxxx xxxx xxx xxxxxxxxx xx xxxxxxxxxx, xxxxxxxxxxxx účastnících xx xxxxxxxxxx hodnocení, xxxxxxx financujících xxxxxxxx xxxxxxxxx a xx xxxxxxxxxx xxxxxxxx podílejícím xx xx xxxxxxxxx xxxxxxxxxx hodnocení. Rovněž x xxxx nařízení xxxxxx xxxxxxxxxxx každoročně xxxxxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx x xxxxxx xxxxxxx xx xxxxxxxx, ve xxxxxxx xxxx xxx xxxxxxxx prováděna. K xxxxxx xxxxxxxxxx xx xxxxxxxx xxx xxxxxxxxxxx xx xxxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xx xxxxxx ustanovení xxxxxxxxxx x xxxx xx respektuje. Xxxx xxxxxxxxxx xxxx xxxxx xxxxxxx.
Xxxxx se xxxx xxxxxxxxxxx směrnice 2017/1572, x čl. 3 xxxxxx xxxxxxxx státům povinnost xxxxxx opakovaných inspekcí xxxxxxxxx x čl. 111 xxxx. 1x xxxxxxxx 2001/83/XX xxxxxxxx, aby xxxxxxx, kteří mají xxxxxxxx xxxxx čl. 40 xxxx. 1 x 3 xxxxxxxx 2001/83/ES, xxxxxxxx xxxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx stanovené xxxxx xxxxxxxx. Xxxx xxxxxxx, xx při xxxxxxx xxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx x příslušné xxxxxx k podrobným xxxxxxx xxxxxxxx x čl. 47 druhém pododstavci xxxxxxxx 2001/83/XX. X xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx terapii xx xxxxxxxxx xx xxxxxxxxx pokynům xxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xx léčivých xxxxxxxxx xxx xxxxxxx xxxxxxx, jež jsou xxxxxxx v článku 5 xxxxxxxx (XX) x. 1394/2007 x xxxxxxxx xxxxxxxxxxx xxx xxxxxxx xxxxxxx. Xxxxxx 3 xxxxxx xxxxxx xxxxxxxx xxxxxx xx svých xxxxxxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx xxxxxxxx xxxxxx jakosti, xxxxx xxxx pracovníci x xxxxxx inspektorátu xxxxxxxxx. Xxxxxxx xxxxxx xxxxxxx xx podle xxxxxxx xxxxxxxxxxx. Xxxxxxxxxx právní xxxxxx zohledňujte xxxxx xxxxxx x xxxxxxxxxxxx xxxx 3 - xxxxxxxx §13 xxxx. 3 xxxx. x) xxxxxx x xxxxxxxx. Xxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx instrumenty, xxxx xx xxxx ve xxxx xxxxxxxxx nařízeních.
Na xxxxxxx xxxxxxxxx xxx xxxxxxxxxxx, xx potenciál xxxxxxxxxx xxxxx nová xxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxx.
10. Zhodnocení xxxxxx xx xxxxxxxxxx xxxx obranu xxxxx
Xxxxx xxxxxx xxxx xxxxx x bezpečnosti xxxx xxxxxx státu.
II. XXXXXXXX ČÁST
ČÁST PRVNÍ Změna zákona o léčivech
Do xxxxxxxx pod xxxxx x. 2 xx xxxxx doplnit xxxxx xx nařízení Xxxxxx x přenesené xxxxxxxxx (XX) 2016/161 ze xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2001/83/XX stanovením xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx uvedené xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, které je xxxxx touto novelou xxxxxx adaptováno xx xxxxxxxx x Xxxxx xxxxxxxxx.
K bodu 2 (§5 xxxx. 7):
Xx nezbytné xxxxxxxx xxxxxxxx xxxxxxx vyhrazených xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx a xxxxxxxxxxxxx léčiv.
K bodu 3 (§6 xxxx. 2):
Xxxxx se x xxxxxxxxxxx článku 2 xxxx. 3 xxxxxxxx Xxxxxx (XX) 2017/1572, xxxxx definuje xxxxxxxx xxxxxxx xxxxx xxxx xx xxxx zabezpečování xxxxxxx, xxxxx xxxxxxxxx, xxx xxxx léčivé xxxxxxxxx xxxxx vyráběny, xxxxxxxx x kontrolovány x xxxxxxx se xxxxxxxxx jakosti xxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. Xxxx definice xx xxxxxxxx do odst. 2.
Xxxxxxx xxxx xx xxxxxxxx na xxxxxx, xxxxx xxxx větu xxxxxxx xxxxxxxx.
K bodu 4 (§13 xxxx. 2 xxxx. x):
Xxxxxxxx x provozovatelů, xxxxxxx xxxx xxxxxxxxxxxxx x xxxxxx, xxxxxxxx xxxxxxxxxx x registraci, xxxxxxxxxxxxxxxxx, výrobců a xxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxx xxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx x xxxxxxxx, xxx musí xxxxxxxxx x kontrolu xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx Evropské unie xxx xxxxxx xxxxxxxxx xxxxx, jak tyto xxxxxxxx xxxxxxxx x xxxxxxxx členským státům xxxxxxxx. Xxxxx xx:
• Xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 1394/2007 (32007R1394), xx 13. listopadu 2007 x léčivých xxxxxxxxxxx pro moderní xxxxxxx x o xxxxx směrnice 2001/83/XX x xxxxxxxx (ES) x. 726/2004.
- Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 2016/793 (32016R0793) ze xxx 11. xxxxxx 2016, k zamezení xxxxxxxxxxxx obchodu s xxxxxxxxx xxxxxxxxx xxxx xx Xxxxxxxx unie.
- Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x.536/2014 (32014R0536), x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx přípravků x x xxxxxxx xxxxxxxx 2001/20/XX (xxxxxxxx xxxxx xxxx xxxxxx)
- Xxxxxxxxx xxxxxxxx Komise (EU) č. 2017/556 xx xxx 24. xxxxxx 2017 x xxxxxxxxxx pravidlech xxx provádění xxxxxxxxxxx xxxxxxx správné klinické xxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 536/2014 (nařízení dosud xxxx xxxxxx)
-- Xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (XX) č. 2017/1569, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x.536/2014 xxxxxxxxxx xxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxx hodnocené xxxxxxx xxxxxx přípravky a xxxxxxxx xxxxxxxxx xxxxxxxx
- Xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) x.1252/2014 (32014R1252), xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx výrobní xxxxx xxx xxxxxx látky xxx humánní xxxxxx xxxxxxxxx
- Xxxxxxxxx Xxxxxxxx Xxxxxx (XX) č. 699/2014 xx xxx 24. xxxxxx 2014 x xxxxxxx společného xxxx xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx veřejnosti xx xxxxx x x xxxxxxxxxxx, xxxxxxxxxxxxxx x kódovacích požadavcích x xxxxxxx xxxx xxxxxxxx
- Xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) 2016/161 ze xxx 2. října 2015, xxxxxx xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady 2001/83/XX stanovením xxxxxxxxxx xxxxxxxx pro xxxxxxxx xxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
K bodu 5 a 6 (§13 odst. 2 xxxx. x xx x):
X §13 xxxx. 2, xxxxx xxxxxxxx xxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx, xx doplňují xxxxxxxxxxx ustanovení.
Rozšiřuje se xxxxxxxxx Xxxxxx x xxxxxxx xxxxxxxxxx pravidel xxx xxxxxxxx xxxxx, x xx z xxxxxx, xx x xxxx řadě xxxxxxxxxx xxxxxxxx o ochranných xxxxxxx (xxxxxxxx XX) xx upravují xxxxxxxxx x povinnosti xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx x xx xxxxxxxx státě xx, xxx xxxxx, xxxxx orgán xx xxx xxxx území xxx xxxxxxxxxx k xxxxxxxxx xxxxxxxx x xxxxxxxx x ochranných xxxxxxx. Je xxxxxx, xx x xxxxxxx xx xxxxxxxxx právní xxxxxx xxxxxxxxxx Ústavu, xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx xxxxx, xxxx xxx xxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx v xxxxxxxx o ochranných xxxxxxx xxxxx jedině xxxxx xxxxx xxxxx.
Xxxx xx xxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xxxxxxxxx xxx, xx xx xxxxx xxxxxxxx orgánem xxxxxxxxxx x xxxxxx kompetencí xxxxxxxxxxx xxxxxxxxx 2017/556 x nařízením 2017/1569. Xxx xxx x xxxxxx xxxxxxxx článku 17 xxxx. 6 a článku 25 xxxxxxxx x. 2017/1569 a xxxxxx xxxxxxxx článku 3 xxxx. 1, článku 12 a článku 13 xxxxxxxx x. 2017/556. Xxxxxx účinnosti xxxx xxxxx xxxxxxxxxxxxx xxxx by xxxx xxx xxxxxx, xxxx xxxx xxxxxxxxx x xxxxxx č. 66/2017 Sb. xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) č. 536/2014.
K bodu 7 (§13 xxxx. 3 xxxx. l)
Jedná xx x transpozici čl. 3 xxxx. 3 směrnice 2017/1572 x xxxxxxxx čl. 22 nařízení 2017/1569. Xxxxxxxx 2017/1572 xxxxxxxx xxxxxx xxxxxx xx xxxxx inspektorátech vytvořit x xxxxxx xxxxxxxx xxxxxxxx xxxxxx jakosti, xxxxx xxxx pracovníci x xxxxxx xxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxx xxxxxxx xx xxxxx xxxxxxx aktualizuje. Xxxxxx xxx xxxxxxxx 2017/1569 xxxxxxx xxxxxx xxxxxxxxxx xxxxxxx pro xxxxxxxxxx xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx xxxxxxxx xxxxxx jakosti. Xxxxxx xxxxxxx xx v xxxxxxx xxxxxxx xxxxxxxxxxx.
K bodu 8 (§16 xxxx. 3 xxxx. x)
Xxxxx xx x xxxxxxxxxxxx-xxxxxxxxxx úpravu xxxxxx spočívající x xxxxxxxxxxxxxxx xxxxxxxxxx textu xxxxxx normy.
K bodu 9 (§22 xxxx. 2)
Xxxxx xxxxxxx xxxx „xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx“ spočívá xx xxxxxxxxxxx, že požadavky xx xxxxxxxxxxx xxxxxxxxxx xxxxxxx klinické praxe xxxx xx xxxxxx x léčivech xxxxxxx, xxxxx xxxx přímo xxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxxxxx zůstala xxxxxxxxxx xxxxxxx xxxx xxxxxxxxx xxx inspektory xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx.
K bodu 10 (§23 xxxx. 1 písm. x):
Xxx xxxxxxx, kdy xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxxxxxxxx na xxxxxxxx xxxxxx xxxxxxxxx, jde-li x xxxxxxx léčivý xxxxxxxxx, xxxxxxxxx přímo x xxxxxxxx x xxxxxxxxxx prvcích, je xxxxx tuto xxxxxxxxx xxxxxx xxxxxxxx x xxxxxx x léčivech xxxxxxxxx xxxxxxx x) xx §23 xxxx. 1 zákona. Xxxxx xx xxxxxxxxx x xxxxxxx, xxx xx x xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxx, xxxxx xxxx xxx xxxxxxxx x ochranných xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxxx xx skutečnosti, xx xxxxxxxx xx xxxx týkat x xxxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxx xx xx xxxxxx xxxxxx povinnost xxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxxxx léčivý xxxxxxxxx Veterinárnímu xxxxxx.
K bodu 11 (§24 xxxx. 10):
Xxxxxxxxx xxxxx §24 odst. 10 je x xxxxxxx x ustanoveními xxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxxxxx xx xxxxxx xxxxxxxxxxxxx xxxxx xxxxxx xxxxxxxx celních xxxxxx, xxxx. upravujícího základní xxxxxxxx xxxxxx xxxxxxx xxxxxxxx pro xxxxx xxxxxxxxxx xx xxxxx xxxxx Unie xxxx xxxx území xxxxxxxxxxx, xxxxxx je nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 952/2013, xxxxxx se xxxxxxx xxxxx kodex Xxxx, x xxxxxxx znění (xxxx xxx „XXX“). Xxxxxxxxxx článku 5 odst. 15 XXX definuje xxxxx xxxxxxxxxx xxxx xxxxx, která xxxxxx xxxxx prohlášení (x xxxx xxxx vyjmenované xxxxx xxxxxxxxx) xxxxxxxx xxxxxx xxxx xxxxx, xxxxxx xxxxxx je xxxx xxxxx xxxxxxxxxx xxxxxx. Xxxx xxxxxxxxxx článku 18 xxxx. 1 XXX xxx xxxxxxxxxx xxxxxxx, xxxxxxx xx xxxxxx xxxxxxx, že xx xxxxx xxxxx xxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxxxxxx xxxx zastoupení xxxx xxx xxxxx (xxxxxxxx xxxxx jménem x xx xxxx xxx xxxxx) nebo xxxxxxx (xxxxxxxx xxxxx xxxxxxxx xxxxxx na účet xxx osoby). Článek 170 xxxx. 1 UCC xxxxx xxxxxxxxxxx pak xxxxxxx, opět bez xxxxxxxxxx xxxxxxx, xxxxxxx xx xxxxxx, xx xxxxx x xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxx určitou xxxxx xxxxxxxx xxxxxxxxxx (xxxx. xxxxx xxxxxxxxxx souhlasu, xxxxxxxx xx xxxxxxx xxx xxxxxxxxxx zboží x xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx nebo xxxxxxx), podá xxxxxx xxxxx prohlášení tato xxxxx xxxx xxxx xxxxxxxx. Z xxxxxxxx xxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx je xxxxxx, xx celní xxxxxxxx xxxxxxxx xxxxxxxxx x xxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx (xxxxxxxxxxxx, vnitrostátním) xxxxxxxx xxxxx xxxxx výběr xxxxxxxx, ale xxxx xxxx xxx volný xxxxx xxxxx xx xxxx forem zastoupení. Xxxxx osoba, xxxx x xxxxxxx xxxxxxxxxx xxxxxxxx (xxxxxxx či xxxxxxxx) xx může xxxxxxxx zvolit zástupce, xxxxxxx xxxx xxxxxxxxxx xx xxxx svobodně xxxxxx buďto xxxx xxxxx (xxxxxxxxxxx ve xxxxxx definice xxxx xx xxx) xxxx xxxx xxxxxxx (xxxxxxxxxxx xxxx xxxxxxx xxxxxxxx). Xxxx xxxxxxxx xxxx xxxxxxxxxx veškeré xxxxxx xxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx či xxxxxxx na úrovni xxxxx Xxxxxxxx unie x xxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxxxx právních xxxxxxxx x xxxxxxxxxx, xxxxxxxxxx x inkriminovanému §24 odst. 10 xxxxxx x xxxxxxxx, xx x nich xxxxxxxxx.
K bodu 12 (§34 xxxx. 9):
Xxxxxxxx xx ustanovení xxxxxxxxxx Xxxxxx x Xxxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx x změně xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxx přípravky x xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, x xx x xxxx xxxxxx (xx xxxx).
K bodu 13 (§37 xxxx. 1):
X xxxxxx x xxxxxxxx xx xxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxx, xxx xxxxxxxxxx xxxxxxxxxxx tomu, xx xx xxxxxxxx specifické xxxxxxxx xxxxx: xx xxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxx k ověření xxxxxxxxxx x obalem. Xxxxxxxx xx nutné xxxxxxxx použití mezinárodně xxxxxxxxxx xxxxxxx xxxx, xxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx ochranné prvky xxxxxxxxx.
Xxx x xxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx o xxxxxxxxxx xxxxxxx, xxxxx umožňuje xxxxxxxx jak xxxxxxxx xxxxxxx xxx (EAN), xxx 2X kód, xxxxx ponese xxxxxxxxx xxxxxxxxxxxxx. Xxxxxx xxxxxxxxx xxx ochranných xxxxx xxxxx xxxxxx používat XXX xxx a xxxxxxxx xxxxxxxxx je xxxxxxxxxx pro oba xxxx xxxxxxx xxxxx xxxx.
K bodu 14 (§37 xxxx. 7):
Xxxxxxxx 7 xxxxxx x xxxxxxxx xx xxxxxxxxxxxxx ustanovením směrnice 2011/62/EU x je xxxxx jej upravit x souladu x xxxxxxxxx x xxxxxxxxxx xxxxxxx.
K bodům 15 (§37 xxxx. 8):
Xxxxxxxx 8 xxxxxx x léčivech je xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx 2011/62/EU x xx nutno xxx xxxxxxx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx prvcích, xxxxx xx týká xxxxxx xx xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx, xxxxxxx výdej xxxx xxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx x xxxxxx xxxxxxxxx vydávané xx xxxxxxxx předpis xxxx na xxxxxxxx xxxxxxx x omezením, xxxxx nesmí xxx xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxxx x xxxxxxxxxx xxxxx xx xxxx xxxxx xxxx.
K bodu 16 (§45 xxxx. 7 xxxx. x) ):
Xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx x výrobě. Jelikož xxxxxxxx o ochranných xxxxxxx se xxxxxx xxxxxxxx na souběžný xxxxx, xx xxxxx xx zákona o xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx dovozu zajistit, xxx bylo xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx x všech přebalovaných xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx a xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxxx dovoz xxxx x xxxxxxxxx státech Xxxxxxxx xxxx xxxxxxxxxxxx x podléhá xxxxxxxx xxxxxxx xxxxxxx a xx svá xxxxxxx xxxxxxxxx. Xxxxxxxx xxxx xxxxxxxxxx držitele povolení xxxxxxxxxx xxxxxx xxxxxxx, xxx ochrana xxxxxxxx xxxxxxxxxxx xxxxxx přípravky xxxxxxxxxxx x rámci xxxxxxxxxx xxxxxx xxxx xx xxxxxx xxxxxx xxxx ochrana xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx zajišťovány xxxxxxxxx rozhodnutí x xxxxxxxxxx. V Xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx nejsou xxxxxxx, xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx Xxxxxxxx unie xxxx xxxx subjekty xxxxxxxxx xxxxxxxxxx xxxxxx (xxxx. Xxxxxxxxxx).
K bodu 17 (§64 xxxx. x):
Xxx x úplnou xxxxxxxxxxx článku 11 xxxx. 1 xxxxxxxx Komise (XX) 2017/1572, xxxxx xxxxxxx, xx xxxxxxx xx povinnost xxxxxxxx x xxxxxxxx systém xxxxxxxx jakosti, který xx x xxxxxxxxx xxxxx, xxx má xxxxxxxxx kvalifikaci x xx nezávislá xx xxxxxx. Xxxx xxxxx xx k xxxxxxxxx xxxxx xxxx xxxx xxxxxxxxxx kontroly xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx x vybavených zařízením xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxxxxx a xxxxxxxxx xxxxxxxx přípravků xxxx xx x takovým xxxxxxxxxxx xxxxxxx.
K bodu 18 (§64 xxxx. x)
Xxx o xxxxxx transpozici článku 13 xxxx. 1 směrnice Xxxxxx (XX) 2017/1572, xxxxx ukládá členským xxxxxx stanovit, xxx xxxxxxx zavedl systém xxx zaznamenání a xxxxxxxxxx xxxxxxxxx společně x xxxxxxx xxxxxxxx, xxxxxx xxx okamžitě x xxxxxxx xxxxxxxx xxxxxx přípravky z xxxxxxxxxxx xxxx. Výrobce xxxxxxxxx x prozkoumá xxxxxxxxx reklamaci xxxxxxxx xx xxxx. Xxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx x x xxxxxxxxxxx xxxxxxxxx x držitele xxxxxxxxxx x xxxxxxxxxx o xxxxxxxx vadě, která xx xxxxx xxx xx následek xxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxxx, a xxxxx xx xx xxxxx, xxxxx xxxx xxxx xxxxxx.
K bodu 19 (§64 xxxx. x)
Xxx o úplnou xxxxxxxxxxx článku 4 xxxx. 1 xxxxxxxx Xxxxxx (XX) 2017/1572, xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxx x xxxxxxx xx xxxxxxxx xxxxxxx xxxxx a x povolením x xxxxxx. Xxxx xxxxxxxxxx xx xxxxxxx rovněž xx xxxxxx přípravky xxxxxx pouze pro xxxxx. Xxx adresáty xxxxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxx xxxx xxxx povinností xxxxxx xxxxxxxxxxx xxxxx.
K bodům 20 a 21 (§77 xxxx. 1 xxxx. x) x x)):
Xxxxx xx o xxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxx.
Xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx imunologických xxxxxxxx xxxxxxxxx xxxxx do xxxxxxxx lékařů xxx xxxxxxx x polovině xxxx 2009 x xx xx xxxxxxx xxxxxx xxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx, x s tím xxxxxxxxxxx změnou zákona x xxxxxxx veřejného xxxxxx. Xxxxxxxx xxxxx x této zásadní xxxxx, xxxxxx xx xxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxxx §82 xxxx. 2 písm. x) xxxxxx x xxxxxxxx, které nereflektuje xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx (viz xxxxxxxxxxx xxx 29). Xxxxxxxxxx xxxxxxxxxx §82 xxxx. 2 xxxx. x) a x xxx xxxxxxxxxxx xxxxxxxxxx §77 xxxx. 1 xxxx. c) xxx 5 xx xxxx.
K bodu 22 (§77 xxxx. 1 xxxx. x bod 11):
Xxxxx xx x xxxxxxxx x xxxxxxxxx xxxxx xx xxxxxx xxxxxxxxx x xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx x §82 odst. 2 písm. x) xxxxxxxxx x výdeji xxxx skupiny léčivých xxxxxxxxx.
K bodu 23 (§77 xxxx. 1 xxxx. c xxx 12):
X xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxx x xxxxxxxxxx prvcích, xx. xxxxxxxxx ochranných xxxxx x vyřazování xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxx xxxxxxxxxxxxxx léčivých xxxxxxxxx xx xxxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxx xxxxxx, xxxx xxxxxxxxx úprava xxxxxx xxxxxxxxxx, x xx xxx, xxx xx xxxxxxx xxxxxxxxxx xxxxxxxxx systém dodávek xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
K bodu 24 (§77 xxxx. 1 xxxx. r):
V xxxxx xxxxxxxxxx xxx x xxxxxxxx článku 23 nařízení x xxxxxxxxxx xxxxxxx, xxxx xx x xxxxxx xxxxxxx na xxxxxxx xxxxxxxxx xxxxx xxxxxxxxx x xxxxxxx, xxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxx území, xxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxx a provedl xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx před xxx, xxx xxxxxx xxxxxxxxx xxxx xxxxxxx x xxxx xxxx xxxxxxxxx uvedených x xxxxx xxxxxx. X xxxxxx xxxxxx xxxx xx x návrhu xxxxxx xxxxxx xxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxx xxx, xxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx lékařům, Armádě Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx sil xxxxxx, x xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx pro účely xxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx x pro xxxxx xxxxxxxxxxx xxxxxxxxxxx xxx Xxxxx xxxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx xx xxxxxxxxx xxxxx §111a xxxxxx x xxxxxxxx a xxxxxxxxxxxxxx xxxxxxxxxxx služeb, xxxxxx xxxx dodávány xxxxxxxxxxxx xxxxxx přípravky xxx xxxxx povinného xxxxxxxxxxxx xxxxxxxx xx xxxxxxx rámcové smlouvy xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxx xxx xxxxx xxxxxxxxx&xxxx; zvláštního x xxxxxxxxxxx xxxxxxxx x očkování xxxxxxxxxxxxx xxxx&xxxx; na xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx x Ministerstvem xxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx v xxxxx preventivní péče xxx xxxxxx č. 48/1997 Sb., x xxxxxxxx zdravotním xxxxxxxxx x o xxxxx x doplnění xxxxxxxxx xxxxxxxxxxxxx xxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx. Důvodem xxxxxxxx xxxxxx okruhu xxxxxxxx xx xxxxxxxxxx, xx xxxxxx xxxxxx x XX, kterou xx xxxxx o xxxxxxxx, xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxx 23 xxxxxxxxxx.
K bodu 25 (§80 xxxx. 4)
Xxxxxxxxx xxxxxx xxxxxx x léčivech xxxxxxxx xxxxx úpravu x xxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxx xxxx. X xxx xxxx xxxxxxx xxxx xxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxx o xxxxxxxx, xxxxxx xxxx x §80, xxx xxxxxxxxxxxxx xxxxxxxxxxxxx lékaři xxxx xxxxxxxx x xxxx. 4 xxxxxxxxxxx xxxxxxxxx. Xxx však xxxxx x xxxxxxx, xxx xxxxx z xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx. Xx xxxxxxxxxxx xxxxxxxx je však xxxxxxxx x odůvodněných xxxxxxxxx x za xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxx x používat x xxxxx xxxxx xxxxxxxx přípravků, xxxxxx xxxxxxxxx léčivých xxxxxxxxx, x xx x xxxxxxxxx, které nejsou xxxxxxx xxxxxxxxxxxxxx veterinárními xxxxxxxx xxxxxxxxx. Xx xxxxx xxxxxxx tento xxxxxxxx napravit, a xxxxx xx xxxxxxxx xxxxx, xxxxx xx x souladu x xxxxxxxxx xxxxxxxx x §77 xxxx. 1 xxxx. x) xxx 5 (oblast xxxxxxxxxx xxxxx) nebo v §82 (výdej léčiv).
K bodu 26 (§82 xxxx. 2 xxxx. x)
X xxxxx xxxxxxxxxxxx bodě xx xxxxx o xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, xxx xxxxxxxxx současné xxxxx. V polovině xxxx 2009 xx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxx: xx xxx xxxx xxxxxxx xxxxxxxxxx xxxxxxx, xxx xxxx xxxxxxxxxxx firmu, a xx na základě xxxxxx xxxxxx č. 48/1997 Sb., x veřejném xxxxxxxxxx xxxxxxxxx a x xxxxx x doplnění xxxxxxxxx xxxxxxxxxxxxx xxxxxx, x s tím xxxxxxxxxxx xxxxx xxxxxx č. 258/2000 Sb., o xxxxxxx xxxxxxxxx xxxxxx x x xxxxx xxxxxxxxx xxxxxxxxxxxxx zákonů. Xxxxxxx xxxx změna xxxxxx xxxxxxxxxx xx zákona x léčivech, xxxxx x novele xxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxxx §82 odst. 2 xxxx. x) x s ním xxxxxxxxxxx xxxxxxxxxx §77 xxxx. 1 xxxx. x) xxx 5 xxxxxxx.
K bodu 27 (§82 xxxx. 3 xxxx. x)
Xxxxxxxxxxx xxxxxxxxxxx xxxxxxx i) xx §82 xxxx. 3 zákona xx x návaznosti xx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx oprávněných x xxxxxx léčivých xxxxxxxxx xxxxxx xxxxxxxx prvky x xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxx xxxxxxxxxx léčivých xxxxxxxxx. Xxxxx se x vnitrostátní xxxxxx xxxxxx, kdy mohou xxxxxxx dodávat xxxxxx xxxxxxxxx xx xxxxxxx xx xxxxxxxxxxxxxx xxxxxxxx. X xxxxxxxxx xxxxxxx Xxxxxxxx unie xx xxx xxxxx postup xxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxx. X xxxxxx důvodu se xxxx léčivé přípravky xxxxxxxx xx základě xxxxxxx xxxxxx x xxxxxxx, xxxxx xx xx xxxxxx od xxxxxx xxxxxxxxxxxxx zdravotních xxxxxx xxxxxx oprávněnou x xxxxxx x xxx ověří ochranné xxxxx při xxxxxx xxxxx nařízení. X xxxxxxx xxxxxxxxxxx xxxx xxxxxx xxxxxx by xxxxxxxxx x tomu, xx xxxxxx přípravky xxxxxx xx xxxxxxx xx xxxxxxx neověřené, xxxxxxx poskytovatelé xxxxxxxxxxx xxxxxx xxxxxx osobami xxxxxxxxxxx k výdeji, x xxx se xx xx xxxxxxxx xxx xxxxxxxxxx. Xxxxxxxx xxxx ustanovení xxxxxx xxxxxx lékárnám povinnost xxxxxx všechny léčivé xxxxxxxxx opatřené xxxxxxxxxx xxxxx x x xxxxxxxxx, kdy xxxxxxx x registrované xxxxxx xxxxxxxxx x ČR, xxx dovážené v xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, tzv. „xxxxxxxxxxxxxx xxxxxx“ xxx §8 xxxx. 3 zákona x xxxxxxxx.
K bodu 28 (§99 xxxx. 7 x 8):
X doplňovaném odstavci 7 xx §99 xxxxxx xx xxxxxxxx xxxxx Xxxxxx x xxxxxxxx, ve xxxxxx xx xxxxxxxxxxx xxxxxxxxx x ochranných xxxxxxx. Xx jedné straně xxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx Ústavem, xxxxx vyplývají x xxxx působnosti a xxxx potřebné xxx xxxxxxxxx xxxxxx xxxxxxxx. Xxxxxxxxx xxx o xxxxxxxxx týkající xx xxxxxxx x ukončení xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxx léčivých xxxxxxxxx, xxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxx. Xx xxxxx xxxxxx Xxxxx xxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx a xx k nim xxxxxxx xx xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx x doplňovaného xxxxxxxxxx §13 xxxx. 2 xxxx. o) xxxxxx. Xxxxx xxx x xxxx xxxxxxxxx, x xxxxxxxxxx §99 xxxx. 7 se xxxxxxxxx náležitá xxxxxxx xxxxxx informací, když xx xxxxxxxx xxxxxxx, xx tyto informace xxxx Xxxxx xxxxxxxx xxxxxxxxxx dalším xxxxxx. Xxxx pouze xxxxxxxxxx xxxxxxx xx základě xxxxxx xxxxxxxx xxxxxxxx.
K bodu 29 (§100 xxxx. 8):
Xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx xxx xxxx Xxxxxxxxx lékovou xxxxxxxxx x Ústavem xxx xxxxxx kontrolu xxxxxxxxxxxxx xxxxxxxxxxxx a xxxxx (xxxx jen „Xxxxxxxxxxx xxxxx“). Xxxxxx xxxxxxxxxx úpravy xx xxxxxxxx xxxx soulad xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady 2001/82/ES xx xxx 6. xxxxxxxxx 2001 x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx přípravků xx xxxxxx xxxxxx xxxxxxxx Xxxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx data do xxxxxxxxxx databází.
K bodu 30 (§100x)
Xxxxxxx x xxxxxxxxxx xxxxxxxxxxxx x zákoně o xxxxxxxx, xxx se x xxxxxx zvýšení xxxxxx jistoty xx xxxxx xxxxx „xxxxxxx“ xxxxxxx xxxxx „xxxxxxxx xxxxxx xxxxxxxxx“.
K bodu 31 a 32 (§103 xxxx. 6 písmena x), x) až x)):
X xxxxx xxxxxxxxxxxx xxxx xx xxxxxxxx x §103 xxxx. 6 písm. x) xx x) uvedené xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xx dopustí xxxxxxxxxxxx, x xx xxxxxxxxx xxxxxx xxxxxxx, xxxxx jsou x xxxxxxx s xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxx xx xxxxxxx x léčivech.
K bodu 33 (§103 xxxx. 15 xx 21):
X xxxxx novelizačním xxxx se xxxxxxxx xxxxxxxx podstaty xxxxxxxxx, xxxxxxx se dopustí xxxxxxx léčivých přípravků, xxxxxxxxxxx, poskytovatel xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxx léčivých xxxxxxxxx, xxxxxxx rozhodnutí o xxxxxxxxxx, osoba xxxxxxxxx x xxxxxxxxxx úložiště x xxxxx odpovědná xx xxxxxxx xxxxxxxx xxxxxxxxx xx xxx. Xxxxxxxx podstaty xxxxxxxxx xxxxxxxxx v xxxxxxxxx, xxxxx jsou x xxxxxxx x xxxxxxxxx x xxxxxxxxxx prvcích xxxx xx zákonem x xxxxxxxx.
Xxx ověření xxxxxxxxxx xxxxx xxxxxxx, xxxxxxxxxxxx x osoby xxxxxxxxx xxxx zmocněné xxxxxxx xxxxxx přípravky xxxxxxxxxx xxxxx pravost xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx. Xxx ověření xxxxxxxx xxxxxxxxxxx identifikátoru xx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx x jedinečnými xxxxxxxxxxxxxx uloženými v xxxxxxx úložišť; xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxxx xx pravý, pokud xxxxxx úložišť xxxxxxxx xxxxxxx jedinečný identifikátor x kódem přípravku x xxxxxxxx xxxxxx, xxxxx xx xxxxxxx x xxxxx a xxxxxx xxxxxxxxxxx jedinečného xxxxxxxxxxxxxx. Xxxxxxxxxxxx prostředku x xxxxxxx manipulace x xxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxxxx léčivého xxxxxxxxx.
Xxxxxxx, xxxxxxxxxxxx x xxxxx xxxxxxxxx nebo zmocněné xxxxxxx xxxxxx přípravky xxxxxxxxxx musí xxxxxxxx xxxxxxxxx xxxxxxxx stanovená x článcích 18, 24 x 30 xxxxxxxx x ochranných xxxxxxx, xxxxx xxxx důvod xx xxxxxxxx, že x xxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx (xxxxxxxx xx xxxxxx, xx xxx xxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx), xxxx xxxxx xxxxxxx ochranných xxxxx léčivého xxxxxxxxx (xxxxxxx xxxxxxxxxxx identifikátoru x systému xxxxxxx) xxxxxxxxx, že xxxxxxxxx xxxxx není pravý.
K novelizačnímu bodu 34 (§104 xxxx. 14)
Xxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx x tom, xx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxx požadavky xxxxxxx xxxxxxx praxe dané xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx unie - xxxxxxxxxxx xxxxxxxx 2017/1569.
Zároveň xx xxxx xxxxxxxx xxxxxxxx přestupku xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxx, že xxxxxxxxxxxx xxxxx při xxxxxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx - xxxxxxxxxxx xxxxxxxx 2017/1569 xxxxxxxx xxxxx oprávnění xxxxxxxxx x čl. 20 xxx 2 xxxxxx xxxxxxxxxxx xxxxxxxx.
K bodu 35 (§105 xxxx. 2 xxxx. x):
Xxxxx xx x legislativně xxxxxxxxxx xxxxxx.
K bodu 36 (§105 xxxx. 4 písm. x):
Xxxxx xxxxxxxxxxx xxx xxxxxxx na doplnění xxxx xxxxxxxxxx držitele xxxxxxxx souběžného xxxxxx xxxxxxxx xxxxxxxxx, když xxxxxxxx této xxxx xxxxxxxxxx se označuje xx xxxxxxxxx (xxx xxxxx o xxxxxxxxxxxx xx přestupky a xxxxxxx xxxxx x xxx související).
K bodu 37 (§105 xxxx.10)
Xxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxx, xx xxxxxxxxxxxx xxxxxxx xxx xxxxxxxx prováděné xxxxx xxxxx použitelného xxxxxxxx Xxxxxxxx unie - xxxxxxxxxxx xxxxxxxx 2017/556 xxxxxxxx výkon xxxxxxxxx xxxxxxxxx v čl. 10 xxxx 2, 3,4 x 5 tohoto xxxxxxxxxxx xxxxxxxx.
K bodu 38 a 39 (§106 xxxx. 1 xxxx. x):
X tomto xxxxxxxxxxxx xxxx xx xxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxx xxxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx spočívá x xxx, xx xxxx xxxxx nezajistí, xxx obal xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 xxxx. 7 xxxxxx.
Xxxx xx doplňuje xxxxxxxx xxxxxxxx xxxxxxxxxxx x nedodržení článku 12 xxxxxxxx 2017/1569 podnikající xxxxxxxx osobou jako xxxxxxxxxxxxxx osobou. Xxxxxxx xx xxxx xxxx x §108 xxxx. 3 xxxxx xx xxxxxxxx jednání xxxxxxxxx xxxxxxx xxxxx jako xxxxxxxxxxxxx osoba.
Sankce xxxx xxxxxxxxx xxxxxxxxx rizikům x xxxxxxxxxxx dopadu, xxxxx xx takové xxxxxxx xxxxx xxxxxxxx x oblasti veřejného xxxxxx a k xxxxxxx poškození pacientů xxxxx x České xxxxxxxxx, xxx i x xxxxxx státech Xxxxxxxx unie. Zároveň xx respektována xxxx xxxxxx stanovených xx xxxxxxxx obdobných povinností xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxx. Xxxxxxxxxx xx xxxxxxxx xxxxxxxx xxx (xxxxxx xxxxxxxxx xxxxxxxxx) xxx korelovalo s xxxxxxx provedenou xxxxxxx č. 66/2017 Sb.
K bodům 40 až 46 (§107 odst. 1 xxxx. x) xx x):
Xxxxxxxxxxxx subsumuje ustanovení xxxxxxxxxx xxxxxxxxxxx xxxxxxx (xxxxxxxxx) pod xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxx sankce za xxxxxxxx xxxxxxxx povinností. Xxxxxxxxx xxxx xxxxxx xxxxxxxx typové xxxxxxxxxx xxxxxxxxx, tj. xx xxxxxxxxx adekvátním způsobem xxxxxxx xxxxxx normou xxxxxxxx objekty (chráněné xxxxxxxxxxx zájmy).
K bodu 47 (§108 xxxx. 3):
V xxxxx xxxxxxxxxxxx bodu xx xxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxx xxxxxxx xxxxx jako xxxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxx x xxx, xx xxxx osoba xxxxxxxxx, xxx obal xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxx xxxxx podle §37 xxxx. 7 xxxxxx.
K bodu 48 (§108 xxxx. 3):
Xxxxxxxxxx se xxxxxxxx x xxxxx na čl. 62 xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxx x povinnosti, aby xxxxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx vyráběných x Unii nebo xxxxxxxxxx do Xxxx xxxx x xxxxxxx x požadavky xxxxxxxxxxx x čl. 63 xxxxxxxx x klinickém xxxxxxxxx, xxxxxxx xxxx xxx xxxxxxxxx, xx xxxx xxxx xxxxxxxxx xxxxxxx.
K bodu 49 (§114 xxxx. 1):
Xxxxx xx x xxxxxxxxxxxx xxxxxxxxxx úpravu v xxxxxxxxxx na xxxxx x xxxxxxxxxx §82 xxxx. 2.
ČÁST DRUHÁ Xxxxx xxxxxx x xxxxxxxxxxx xxxxxxxx (§65 odst. 2)
Xxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxx úplná xxxxxxxx článku 10 xxxx. 8 nařízení č. 2017/556, který xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxx právní x správní xxxxx, xxx xxxxxxxxxx z xxxxxxxxx xxxxxxxxx xxxxx xxxx xx. xxxxxxx x xx zdravotnické xxxxxxxxxxx, xxxxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx.
K Čl. III - Sdělení xx Xxxxxx xxxxxx
Xxxxxxxx xx standardní xxxxxxxxxxx, xxx kterého Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx xx Sbírce xxxxxx xxxxxx xxx, xxx xxxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 odst. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků x x zrušení xxxxxxxx 2001/20/ES.
K čl. IV. - Xxxxxxxx
X xxxxxxx xx fakt, xx xxxxx xxxxxxxx xxx implementaci nařízení x xxxxxxxxxx prvcích, xxxxx xxxxxxx x xxxxxxxx od 9.2.2019 xx pro ustanovení xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx právě xxxxx xxxx.
X dalším se xxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx, xxxx xxxx xxxx x xxxxxxx XXX xxxx. x) xxxxxx č. 70/2013 Sb. x xxxxxxxxxx §37 odst. 7 x 8, §64a x §66 xxxx. 1 xxxx. x) xxxxxx x xxxxxxxx x ochranných xxxxxxx. Návrh tedy xxx tak, xx xx xxxxx nabyl xxxxxxxxx xxxxxxxxx 3 xxx ode xxx xxxxxxxxx xxxx vydaných Xxxxxxxxx komisí x xxxxxxxxx xxxxxxxxx, to xxx 9.2.2019 xxxxx xxxxxx X bodu 12 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2011/62/XX xx xxx 8. xxxxxx 2011, xxxxxx se xxxx xxxxxxxx 2001/83/XX x xxxxxx Společenství xxxxxxxxx xx humánních xxxxxxxx xxxxxxxxx, xxxxx xxx x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského xxxxxxx, přičemž xxx xxxx xxx, xxx xxxx xxxx xxxx xxxxxxxxx, xxxxxx Ministerstvo xxxxxxxxxxxxx formou xxxxxxx xx Sbírce xxxxxx.
X Xxxxx dne 22. srpna 2018
Xxxxxxxx xxxxx:
Xxx. Xxxxxx Xxxxx x. r.
Ministr zdravotnictví:
Mgr. xx Xxx. Adam Xxxxxxx x. r.
Xxxxxxxxx xxxxxx x xxxxxxxxx dopadů regulace xxxxx obecných zásad - XXX&xxxx;
XXXXXXX XXXXXXXXX XXXXXX RIA
|
1. Xxxxx xxxxxx zákona: |
|
|
Návrh xxxxxx, xxxxxx xx xxxx xxxxx č. 378/2007 Sb., o xxxxxxxx x o xxxxxxx xxxxxxxxx souvisejících xxxxxx (zákon x xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx x xxxxx č. 372/2011, x xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx poskytování (xxxxx x xxxxxxxxxxx xxxxxxxx) |
|
|
Xxxxxxxxxxx / xxxxxxxx xxxxxxxxxxxxx: Xxxxxxxxxxxx zdravotnictví |
Předpokládaný xxxxxx xxxxxx xxxxxxxxx, x případě xxxxxx xxxxxxxxx xxxxxxxx 9. xxxxx 2019 |
|
Implementace práva XX: ANO - xxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxxxxx: 9. února 2019 - uveďte, xxx xxx návrh xxx xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx XX: XX |
|
|
2. Xxx xxxxxx zákona |
|
|
Předkládaná xxxxxx xxxxxx x xxxxxxxx x zákona x xxxxxxxxxxx službách xxxxxxxxxxxx xxxxxx xxxxx Xxxxxxxx xxxx xx xxxxxxxx řádu České xxxxxxxxx.&xxxx; Xxxxx se x následující xxxxxx xxxxxxxx: - Xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (XX) 2016/161 ze xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, stanovením xxxxxxxxxx xxxxxxxx pro xxxxxxxx xxxxx uvedené xx xxxxx humánních xxxxxxxx xxxxxxxxx, - Xxxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxxx (XX) č. 2017/556 xx xxx 24. xxxxxx 2017 o xxxxxxxxxx pravidlech xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické praxe xxxxx xxxxxxxx Evropského xxxxxxxxxx a Rady (XX) č. 536/2014 (xxxx xxx „nařízení 2017/556“), - Nařízení Xxxxxx x xxxxxxxxx působnosti (XX) č. 2017/1569 xx xxx 23. května 2017, kterým xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č.536/2014 xxxxxxxxxx xxxxx x xxxxxx xxx xxxxxxxx výrobní xxxxx xxx hodnocené xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx provádění xxxxxxxx (dále jen xxxxxxxx 2017/1569“), - Xxxxxxxx Xxxxxx (XX) 2017/1572 xx xxx 15. xxxx 2017, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx x zásady x pokyny pro xxxxxxxx xxxxxxx praxi xxx xxxxxxx léčivé xxxxxxxxx (xxxx jen „xxxxxxxx 2017/1572“). Xxxxxxx xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxx jednotlivé xxxxxxx státy z xxxxxxxx Evropské xxxx, xx implementace xxxxxxxxx xxxxx xxxxx EU xx xxxxxxxxxxxxxx xxxxxxxx xxxx. Při nepřijetí xxxxxxxx by došlo x porušení xxxxxxx x založení Xxxxxxxx xxxx xx strany xxxxxxxxx xxxxx a xxxxx xx xxx xxxxxxxx řízení xx xxxxxx Xxxxxxxx komise xxxxx Xxxxx republice xx nesplnění xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxxx takovému xxxxxxxx, xxxxx xx mělo xxxxx xx celý xxxxxx x jeho xxxxxxxxx xxxxxx pouze x rozměru Xxxxx xxxxxxxxx, xxx i xxxxxxxxx členských států, xxxxx jen x xxxxxxx, že xxxxxxxx xxxxx dodržována xxxxx, xxxx systém funkční. Vzhledem xx xxxxxxxxxxx, že x ustanoveních xxxxxxxxxxxxxxxx xxxxx Evropské xxxx xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické xxxxx, xxxxxxx xxxxxxx praxe xxx xxxxxxxxx xxxxxxx xxxxxx přípravky x xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxx x xxxxxx xxx xxxxxxxx xxxxxxx praxi pro xxxxxxx xxxxxx xxxxxxxxx xxxxxx xxxx možnost xxxxxxxx a xxxxxxxx xxxxx xxxxx novely xx vymezených xxxxxxxxx xxxxx nad xxxxx xxxxxxxxx práva Evropské xxxx, byla x xxxxxxx x Xxxxxxxxxxxxxx xxxxxxxx vlády xxxxxx xxxxxxxxxxxxxx xxxxxx o xxxxxxx výjimky z xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx x hodnocení xxxxxx regulace xxxxx xxxxxxxx zásad - XXX xxx xxxx xxxxxxxx xxxxxxx. Žádosti xxxx xxxxxxxx. X xxxxxx důvodu xx xxxxx xxxxxxxx dále xxxxxx xxxxx hodnocením xxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxx xxxxxx xxxxxx xx xxxxxxx nezbytných xxxxxxxx xxxxxxxxxxxxx x xxxxxxxx xxxxxxxx řádu Xxxxx xxxxxxxxx xx nařízení Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) 2016/161 xx xxx 2. xxxxx 2015, kterým xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx prvky xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx přípravků (dále xxx „xxxxxxxx o xxxxxxxxxx xxxxxxx“). Problematika xxxxxxxxxx prvků xx xxxxxxx humánních léčivých xxxxxxxxx xxxxxxx xxx xx Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx xx xxxx xxxxxxxx 2001/83/ES x xxxxxx Společenství xxxxxxxxx xx humánních xxxxxxxx xxxxxxxxx, xxxxx xxx x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx (xxxx xxx „xxxxxxxx 2011/62/XX“). Xxxxxxxx xxxxxx xxxxxxxxx, xxxxx xx xx x xxxxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx řetězce, xxxxxxxxxxx xxxxxx xxx xxxxxx zdraví a xxxxx xxxxxx xxxx xx xxxxxxx xxxxxx xxxxxxxx v legální xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxxx xxxxxxxxx xxxx x xxxxxxxxx systém. Proto xxxxxxxx 2011/62/EU xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx xxxxxxx léčivých xxxxxxxxx, xxxxx xx xxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx jednotlivých xxxxxx xxxxxxxx přípravků a xxxxxxx, xxx xxxxxx x xxxxxx manipulováno. Xxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x cílem xxxxxxx xxxxxxxx x xxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx a xxxxxxx. Xxx xxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx Xxxxxxxx xxxx, xxxxxxxxxx xxxx léčivých xxxxxxxxx x xxxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx Evropská Xxxxxx xxxxxxxxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxxx prvků, zejména xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxx z xxxxxxxxxx prvků - xxxxxxxxxxx xxxxxxxxxxxxxx, způsoby x xxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxxxxx, xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxx přípravky xxxxxxxxxx) x xxxxxxx a xxxxxx systému xxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxxx xxxxxxx (xxxxxxxxxxx xxxxxxxxxxxxxxxx). Xxxxxxxx prvky tvoří xxx xxxxx xxxxxxxx xx xxxxx humánního xxxxxxxx xxxxxxxxx - xxxxxxxxx xxxxxxxxxxxxx (xxxxxxxxx xxxxxxxx nesená xxxxxxxxxxxxx xxxxxxx xxxxx, xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx balení xxxxxxxx xxxxxxxxx, xx xxxx xx xxxxxxxxx) x xxxxxxxxxx k xxxxxxx manipulace x xxxxxx (xxxxxxxx xxxxx - xxxxxxxxxxxx pojistka - umožňující xxxxxx, xxx xxxx s xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx). Xxxxxxxxxx prvky budou xxxxxxxx x xxxxxxx x nařízením o xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x) xxxxxxx xxxxx xx xxxxx na xxxxxxxx xxxxxxx (výjimkou xxxx xxxxxx xxxxxxxxx uvedené xx xxxxxxx x xxxxxxx X xxxxxxxx x xxxxxxxxxx xxxxxxx) x) xxxxxxx xxxxx xxxx xxxxx na xxxxxxxx xxxxxxx (xxx. „volně xxxxxxxx xxxxxx xxxxxxxxx“), x xx xxxxx xxxxx jsou uvedeny xx xxxxxxx x xxxxxxx XX xxxxxxxx x xxxxxxxxxx prvcích, c) xx xxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx jedinečného xxxxxxxxxxxxxx xxxx xxxxxxxxxx k xxxxxxx manipulace x xxxxxx. Xxxxxxx xxxxxxxxx systém xxxxxxxx xxxxxxx xxxxxxx xxxxxxx, ve kterých xxxxx mimo xxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivých xxxxxxxxx. Xxxxxx xxxxxxx xxxxx x xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx nebo xxxxxxxxx právní xxxxxxxx xxxxxxx v Xxxx xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx prvky. Xxxxxxx xxxxxxx xxxxxxx xx xxxxxx subjekt xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx x x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx. Náklady xx systém úložišť xxxxx xxxxxxx léčivých xxxxxxxxx xxxxxxxxxx ochrannými xxxxx x souladu x xxxxxxx 54a xxxx. 2 xxxx. x) směrnice 2001/83/ES. Xxxxxx úložišť se xxxxxx x xxxxxxxxxxx xxxxxxxx x úložiště, xxxxx slouží území xxxxxxx členského státu („xxxxxxxxxxxx xxxxxxxx“), xxxx xxxxxx xxxx xxxxxxxxx xxxxx („xxxxxxxxxx xxxxxxxx“), xxxxx xxxx xxx xxxxxxxxx k xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx ochrannými xxxxx a xxxxxx, xx xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx a xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx. Držitelé rozhodnutí x registraci xxxx xxxxxxxxx osoba v xxxxxxx souběžně dovážených xxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxx xx xxxxxxx úložišť xxxxxxx před tím, xxx xxxx xxxxxx xxxxxxxxx uveden xx xxx. Xxxxxxx xxxxxxxxxx xxxxx x xxxxxxx xxxxxxx xxxxx provádět xxxxx výrobců dále xxxxxxxxxxxx x xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxxxxxx ověření xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru, xx xxxxxxx xxxxxxx xxxx dány xxxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxx xxxxxxxxx x xxxxxx léčivých xxxxxxxxx xxx xxxx xxxxxxx xxxxxxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxxxx vyřazení jedinečného xxxxxxxxxxxxxx xx xxxxxxx xxxxxxx v okamžiku xxxxxx pacientovi. Pro xxxxxxxxx xxxxxxxx léčivého xxxxxxxxx x xxxxxxxx ověřovacím xxxxxxx xx nezbytné xxxxxx xxx xxxxxxxx xxxxx. Ověření xxxxxxxx xxxxxxxxxxx identifikátoru na xxxxx xxxxxxxx xxxxxxxxx xx provede jeho xxxxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx x xxxx xxxxx je zajistit, xx xxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxx. Xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx s xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx přípravku x xxxx xxxxx xx xxxxxxxx, xx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx nemanipuloval xxxxx xxxx xxxx xxxxxxxxx, xxxxxxx xxxx balení xxxxxxxx xxxxxxxxx xxxxxx. Xxxxxxxx x xxxxxxxxxx xxxxxxx xx xxx členské xxxxx závazné v xxxxx xxxxxxx a xx ve xxxxx xxxxxxxxx státech xxxxx xxxxxxxxxx. Xxxxxxx xxxxxxxx x xxxxxxxxxx prvcích xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx takřka xxxxxxxxx, xxxxxxx dílčí otázky xxxxxxxxx xx xxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxx, x xx xxxxxxxxx (1) xxxxxx xxxxxxxxxxx vnitrostátního orgánu, xxxxx xx xxx xxx xxxxxxx x xxxxxxxx xxx xxxxx xxxxxx xxx fungováním xxxxxxx, xxxxxxxxxxx potenciálních xxxxxxx padělání, úhrady, xxxxxxxxxxxxxxxx x farmakoepidemiologie, (2) vymezení xxxxxxx, xxx xxxxxxxx, xxx xxxxxxxxxx, xxxxx nařízení x xxxxxxxxxx prvcích xxxxxx regulovaným xxxxxxxxx, xxxx plněny, x xx vymezením xxxxxxxx xxxxxxxx xxxxxxxxx x xxxx xxxxxxx x xxxxxxxx určením xxxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxxxxxx x xxxxxxxxxx xxxx sankcí xx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx, (3) xxxxxxxxxx zda, členský xxxx xxxxxxx oblast xxxxxxxxxx ochranných prvků xx léčivé xxxxxxxxx, xxxxx xxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx být xxxxxxxx xxxxxx xxxxx, (4) xxxxxxxxxx, xxx xxxxxxxxxxxx xxxxxxxx číslo“ xxxx „xxxx úhradové xxxxx“ xxxx xxxxxxx x xxxxx jedinečného xxxxxxxxxxxxxx xx xxxxxxx, (5) zohlednění xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxxx členského xxxxx x xxxxxxxx x právní úpravě, xxx distributor xxxx xxxxxx xxxxxxxx xxxxx x provést xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx léčivého xxxxxxxxx xx xxxxxxx xxxxxxx před xxx, xxx xxxxxx xxxxxxxxx xxxx některé z xxxx xxxx institucí xxxxxxxxx v článku 23 xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxx xxxxxxx úpravy xx možné provést xxxxx x xxxxxx xxxxxx xxxxxx x xxxxxxxx xxx, xxx xxxxxxxxxxxxxx s xxx xxxxxxxxxx xxxxxxxx úpravou xxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxx směrnicí 2011/62/EU, xxxxx xxxx transponována xx zákona x xxxxxxxx xxxxxxx č. 70/2013 Sb. Xxxxxxxxxxx xxxxxxx xxxx xxxxxxx dosaženo xxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxx, xxx xxxxx xxx xxxx xxxxxxxxxx xxxxx x beze xxxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxx xxxxxxxxx. |
|
|
3. Agregované xxxxxx xxxxxx xxxxxx&xxxx;&xxxx; |
|
|
3.1 Xxxxxx na xxxxxx rozpočet x xxxxxxx xxxxxxx xxxxxxxx: XX |
|
|
Xxxxxxxxxx úpravy xx xxxxxx xxxxxxxxx adaptace xxxxxxxx x xxxxxxxxxx xxxxxxx nebudou představovat xxxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxx včetně xxxxxxxxxx xx xxxxx xxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx xx xxxxxx Xxxxxx. Xxxxxx na xxxxxxx xxxxxxx rozpočty xx xxxxxxxxxxxxxxx. |
|
|
3.2 Dopady xx xxxxxxxxxxx xxxxxxxxxxxxxxxxxxx XX: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx xxxxxxxxxxx konkurenceschopnost XX. |
|
|
3.3 Dopady na xxxxxxxxxxxxx prostředí: XXX |
|
|
Xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx Xxxxx xxxxxxxxx xx xxxx x xxx xxxxxxxxxxx xxxxxx x xxxxxxxx, xxxxx do xxxx xxxx xxxxxxx xxxx novelou, xx. xxxxxxx č. 70/2013 Sb., x xxxx odloženou xxxxxxxx, xxxxxxxx se xxxx xxxxx k nařízení x xxxxxxxxxx xxxxxxx. Xxxx xxxxxx xxx xxxx xxxxxxxxx xxx xxxxxxxxxxxx xxxxxx právních xxxxxxxx. V xxxxx xxxxx xx xxxxx xxxxxxx xx xxxxxxxxx xxxxxx, včetně zprávy x hodnocení xxxxxx xxxxxxxx (XXX) x xxxxxx č. 70/2013 Sb. a xxxx na xxxxxxxxx xxxxxx XXX k xxxxxxxx o ochranných xxxxxxx xxxxxxxxx „Xxxxxx Xxxxxxxxxx“. X této xxxxxxxx zprávě xx xxxxx, xx x xxxxxxx s čl. 4 xxxxxxxx 2011/62/XX x xx. 54x odst. 2 a 3 xxxxxxxx 2001/83/XX Komise xxxxxxxxx xxxxxxx, náklady x xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxx xxxxxxxxxxxxxxx x technické xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx x správu xxxxxxx xxxxxxx. Možnosti, xxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxxxxx, xxxxxxxxxxx základní prvky xxxxxxxx o ochranných xxxxxxx. X xxxx chvíli xx xxxxxx, že xxxxxxx realizace xxxxx xxxxxxx xxxxxxx xx xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx prvky. Výrobci xxxxxxxx přípravků opatřených xxxxxxxxxx xxxxx xxxxxxx xxxxxxx xx xxxxxxx x xxxxxx xxxxxxx xxxxxxx (xxxx povinnost xxxx xxxxxxx xxx xxxxxxxx 2011/62/EU, která xxxx xxxxxxxxxxxxx xx xxxxxxxx xxxx ČR xxxxxxx č. 70/2013 Sb.). Pro xxxxxxx a souběžné xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx xxxxxxxxx léčivých xxxxxxxxx xxxxx xxxxxxx, xxxxx souvisí x xxxxxxxx přizpůsobit xxxxxxx xxxxx nebo xxxxxxx xxxxx (xxxxxxxx náklady) x investovat xx xxxxxxxxxxxx xxxxxxx, xxx xxxx možné odesílat xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx xx xxxxxxx xxxxxxxx. X současné xxxx xxxxxx xxxxx xxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxx. Aby xxxx xxxxx vytisknout xxxxxxxxx xxxxxxxxxxxxx, xxxx xxx xxxxxx linky xxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxx xxxxx částečně kompenzovány xxxxxxxxxxxxx úsporami x xxxxxxx z xxxxxxxx: - xxxxxxxxx nákladů (xxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx mechanismů xxxxxxxxx xxxxxxxx léčiv xxxxxxxxxxxxxx systémem XX xx vyloučí xxxxxxx xxx xxxx výrobních xxxxx, xxx xxxxxxxx xxxxxxxxxxxx jednotlivých xxxxxxxxx xxxxxxx), - ochrany xxxxx xxxxxxx x držitelů xxxxxxxxxx o xxxxxxxxxx (xxxxxxx počtu xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxx), - xxxxxxxxx x snížení xxxxxxx xxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx přípravků, což xxxxxx xxxxxx xxxxx (xxxxx a xxxx xxxxxxxxxxxxx) xxxxxxx x xxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxx xxxxxxxxxxxx xxxxx a osob xxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxx léčivých xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx a xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxx (pořízení xxxxxxxxxx snímače 2X xxxx, úpravy softwarových xxxxxxxx, xxxxxxx xx xxxxxx zdroje). Další dopady xx podnikatelské subjekty xxxxxxx se x xxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxxxx přípravků xxxxxxxxxx xxxxxxxxxx prvky. Xxxxxxxx dopad navrhované xxxxxx xx xxxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxx dokumentace xx xxxxxxx minimální, xxxxx údaje vztahující xx k jedinečnému xxxxxxxxxxxxxx xxx zavést xx xxxxx xxxxx x xxxxx jakéhokoli xxxxxx x xxxxxxx xx xxxxxxxxx x xxxxxxxxx - xxxx. xxxxxx x xxxxxxxxxxx xxxxxxxxx registrace, řízení x změně xxxxxxxxxx xxxx XX, xxxx XX nebo xxxx XX. Xxx xxxxxxx xxxxxxxx xxxxxxxxx nebude xxxxx xx xxxxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxx x změnu xxxxxxxxxx, xxxxx je možné xxxxxxxxxxxxx ochranné prvky xx xxxxxxxxxxx dokumentace xxx xxxx předložením xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx o xxxxx xxxxxxxxxx. Xxxxx tak xx xxxxxxxxxxxxx xxxxxxxx x oblasti finanční x v oblasti xxxxxxxxxxxx xxxx xx xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxx xx xxxx xxxxxxxxxx bude minimální. Náklady xx xxxxx x xxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxxx x xxxxxx (xx. xxxxxxx x xxxxxxxx xxxxxxxxxxxx) xxxxxxxx xxxxxxxxx opatřených ochrannými xxxxx. Xx tímto xxxxxx xxxxxxxxxxxxxx zainteresované xxxxxxxx asociace XXXXX (xxxxxxxx xxxxxxxxxxxx), XXXXX x XXX (výrobci) - společně představující „xxxxxx“ xxxxxxx, XXXX (xxxxxxxxxxxx xxxxxxxxx) a XXXX (xxxxxxxxxxxxxxx) xxx xxxxxx Evropského modelu xxxxxxxxx xxxx (Xxxxxxxx Xxxxxxxxxxx Xxxxx xx XXX). Xxxx xxxxxxxx xxxxxxxx xxxxxxxx neziskovou xxxxxxxxxx xxxxx, Xxxxxxxxx organizaci xxx xxxxxxxxx xxxxx (Xxxxxxxx Xxxxxxxxx Xxxxxxxxxxxx Xxxxxxxxxxxx či EMVO), xxxxx má xxxxxxxx xxxxxxxx XXX xxxxxxxxx xxxxxxxxxx centrálního „xxxx“ (Xxxxxxxx Xxxxxxxxx Xxxxxxxxxxxx Xxxxxx xx EMVS), x xxxxxxxx poskytovat xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx zřizování xxxxxxxxxxx národních organizací. V Xxxxx xxxxxxxxx vytvořila xxxxxx zastupující sdružení xxxxxxxxxxxxxxxx xxxxx, xxxxxxxxx XXXX (Xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx), XXXX (Xxxxxxxx inovativního xxxxxxxxxxxxxxx xxxxxxxx), XXXX (Xxxxxxxx xxxxxxxxxxxxxxxxx xxxxx), XXXX (Xxxxx xxxxxxxx farmaceutických xxxxx) a XXxX (Xxxxx lékárnická komora) xxxxxxxxxxx xxxxxxx, xxx xx klade xx xxx vést x xxxxx postup xxxxxxxxxxxx XXX v Xxxxx xxxxxxxxx, xxxxxxxxxx xxxxxxxx xxxxx. Konečným cílem xx xxxxx Xxxxxxx xxxxxx xxx xxxxxxxxx xxxxx (XXXX), odpovídající xxxx XXX x xxxxxxxx xxxxxxxxxx xxxxxxx XXXX. Xxxx x xxxxxxx x xxxxxxxxx xxxxxxx xxxx XXXX xxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxx subjektem Xxxxxxx xxxxxxxxxx xxx xxxxxxxxx pravosti xxxxx (XXXX) xxx dohledem xxxxxxxxx xxxxxx xxxxxxxx. Xxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxxx působí xx xxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxxx 261 xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xx 465 xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, 525 xxxxxxxxxxxx, z xxxxx xxxxxxx představují xxxxxxx s xxxxxxx xxxxxxxxxxxx, 15 souběžných xxxxxxx, xxxxxxxxx 200 xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxx s xxxxxxx xxxxxxxx a xxx 2 800 xxxxxxx. Xxx xxxxxx xxxxxx xx na xxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxxx 180 xxxxxxx balení léčivých xxxxxxxxx xxxxxxxxxx na xxxxxxx xxxxx. Xxxxxxxxx xxxxxxxx XXXX xxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xx xxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx léčiv (NSOL) xxxx xxxxxxxx x xxxxxxxxxx XXXX, xxxxxxx xx uvažuje x xxxxxx jednorázového xxxxxxxxxxxxx xxxxxxxx a xxxxx xxxxxxxx xxxxxxxx xxx. xxxx xxx. Xxxx xxxxxxxx xx rok 2019 xx měla xxx xxxxx x X1/2018. Xx počátku roku 2018 xxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxx XXXX v xxxxx xxxxxxxxx projektu. Xxx 9.1.2018 xxxxxxxx x xxxxxxxxxx Národní xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx léčiv xxxxxxx xxxxxxx x xxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxx v Xxxxx xxxxxxxxx, xxxxx xxxxx xxxx poskytnout úvodní xxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxxx xxxxxx a xxxxxxx xxxxxxxxxx x xxxxxxxxxx xx detailní xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx. Xx xxxxxxxxx xxxxxxxx bylo připraveno xx xxxxxxx 8 xxxxxxxx xx xxxxxx xxxxxxx, 6 xxxxxxxx xx xxxxxx xxxxxxxxxxxx, 23 xxxxxxx (x xxxx 18 nemocničních) x 4 xxxxxxxxxx XX xxxxxxx. Xxxxxxx xxxx byla spuštěna xxx 3. xxxxxx 2018, xxxxxxx xxxxxxxxxxxxx xxxx xxxxxx xx xx spuštění xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xx xxxxxx 2018. X xxxx xxxxxxxxx xx xxxxxx, xx xxxxxxx xxxxxxxx xx aktivně zapojují xx xxxxxxxx xxxxxxx xxxxxx xxxxxxx ověřování xxxxxxxx léčiv x Xxxxx republice. Xx xxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxx s xxxxxxxxx xxxxxxx xx xxxx, x xxxxx xxx xxxxxxx dovozovat, xx tyto subjekty xxx xxxxxxxxxx náklady xxx, xxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx. |
|
|
3.4 Xxxxxx xx xxxxxx xxxxxxxxxxx xxxxx (xxxx, xxxxx): XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx xxxxxx xxxxxxxxxxx celky. |
|
|
3.5 Xxxxxxxx xxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx xx dopady xx xxxxxxxx xxxxx. |
|
|
3.6 Xxxxxx xx xxxxxxxxxxxx: ANO |
|
|
Zavedení xxxx, xxxxx xxxxxxx xxxxxxx léčivého xxxxxxxxx x xxxxxxxx ověřovacím xxxxxxx, bude xxx xxxxxxxxx xxxxxxxxx dopad xx xxxxxxxxxxxxxx sektor. Xxxxxxxx x xxxx, xx xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx léčivých xxxxxxxxx, jejichž obaly xxxxxxx xxxxxxxx prvky, xx x důvodu xxxxxxxx ochranných prvků xx xxxxxx xxxx xxxxxxxxx xxxxx, xxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxxxx xx xxxx xxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxx xxxxxxx x xxxxxxxx rozhodnutí x registraci xxxxxxxx xxxxxxxxx však xxxx xx vztahu x xxxxxxxxx poměrům xxxxxxxxxxxxxxx xxxxx zanedbatelné, neboť xxxxxxx xx xxxxxxxx XX kódu x xxxxxxxx přípravků xxxxxxxx xx xxxxxx jsou xxxxx jistě řádově xxxxx xxx xxxxxxxx xxxxxxx xx xxxxx, xxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xxxxxxxx xxxxxxxxx, jejichž xxxxx je xxxxx xx xxxxxxxx xxxxxxx, xx xx xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx maximální xxxx xxxxxxxx xxxxxxxxxxx, kterou xxx xxxxxx xxxxx xx xxxxxxx xxxxxx xxxxxxxxxxx žádosti. Současně xxxx x xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx pojištění xxxx xxxxxxxxxxx x xxxxx xxxxxxxxx řízení. Xxxxx xx x zemích Xxxxxxxx unie (xxxxxx XX) xxxxx využívá xxxxxxx tzv. xxxxxxxx xxxxxxxx xxxxxxxxxxxxx - xxxx stanovují xxxx x úhrady xxxxx xxxxxxxxxx cen xxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx zjištěného x xxxxxxxxx, xxxxx xx x xxxxxx xxxxxxx xxxxxxx xxxxxx teoretické xxxxxxxx ceny x XX xxxx na xxxxxx léčivého xxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx. Vzhledem x xxxxx výraznému xxxxx konkurenčního prostředí xx xxxxxxxxx xxxx x léčivy xx xxxxxxxxx xxx léčivých xxxxxxxxx z důvodu xxxxxxxx ochranných xxxxx xxxxxxxxxxxxx, nebo xxxxxx xxxxxxxxxxx xx běžné xxxxxxx. Ceny regulovaných xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx, do xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, nikoliv xxxx cena. |
|
|
3.7 Xxxxxx xx xxxxxxx xxxxxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx životní xxxxxxxxx. |
|
|
3.8 Xxxxxx xx xxxxxx x xxxxxx xxxxxxxxxxxx x ve xxxxxx x xxxxxxxx xxx x mužů: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx x xxxxxx xxxxxxxxxxxx x xx xxxxxx x xxxxxxxx xxx a xxxx. |
|
|
3.9 Xxxxxx xx xxxxx xxxxxx xxxxxxxxxxx xxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx xxxxx xxxxxxxxxxx služby |
|
|
3.10 Xxxxxxxx xxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxxxx rizika. |
|
|
3.11 Xxxxxx xx xxxxxxxxxx xxxx xxxxxx státu: NE |
|
|
Nepředpokládají xx xxxxxx xx xxxxxxxxxx xxxx xxxxxx xxxxx. |
|
1. Důvod předložení x cíle
1. 1 Xxxxx
Xxxxx xxxxxx, kterým xx xxxx xxxxx č. 378/2007 Sb., x léčivech x o změnách xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), xx xxxxx pozdějších xxxxxxxx.
1. 2 Definice xxxxxxxx
X xxxxx celé Xxxxxxxx unie xxx xxxxxxx xxxxxxxxxxxxx nárůst xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, což xxxxxxxxxx xxxxxxxxxxx závažný xxxxxxx, xxxxx přímo xxxxxxxx xxxxxx xxxxxxxx. Xxxxxxxx xxxxxx přípravky xxxxxxxxx xx větší xxxx xxxxxxx xxxxxxxxx trh (xxxxxxx léčiv xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx), xxx v posledních xxxxxx byl zaznamenán xxxxxx padělaných xxxxxxxx xxxxxxxxx také x xxxxxxxx dodavatelském řetězci x xxxxxxxx přípravky (xxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxx). Xxxxxxxx x legálním dodavatelském xxxxxxx xxxxx s xxxxxxxx přípravky zacházet xxxxx xx xxxxxxx xxxxxxxxx k xxxx xxxxxxxx x xxxxxxx x požadavky platných xxxxxxxx xxxxxxxx x xxxx x xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx.
Xx skutečností, xx x Xxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx přímo x xxxxxxxxx. Xxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx Xxxxx republiky a xxxxxxxx, přičemž je xxxxx xxxxxxxxxx, xx xxxx xxxxxxxxxxxx léčivých xxxxxxxxx v Xxxxx xxxxxxxxx disponuje xxxxxxxxxx x poskytování xxxxxxxxxxx xxxxxx - xxxxxxxxxx xxxx. Xxxxxxx podle xxxxx Ústavu v xxxx 2013 nebyl x České xxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxx zaznamenán xxxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxx 2014 se xxx xxxxxxx x 11 xxxxxxx, v xxxx 2017 o 45 xxxxxxx x xx xxxxx xxxx 2018 xxx 40 xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx v xxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxx xxxxxxxx xxxxxxxxxx xxxxxx, že xx xxxxx x vzrůstající xxxxx, kterému xx xxxxx xxxxx a xxxxxxxx xxxx, xxx xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx.
Xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxx přípravky xxxxxxxxx x xxxxx xxxxxxxx dysfunkce, pálení xxxx, xxxxxx příjmu xxxxxxx, xxxxxxx a xxxxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx x dnešní xxxx xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx rámci x xxxx xxxxxxxxx xxxx xxxxxxxxx obchodníci xxxxxxxxxxx xxxxxxxxxx xx legálního xxxxxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx. Xxxxxxx spočívá x xxx, že xxxxxx xxxxxxxx xxxxx povinná xxxxxxxxxxxxx xxxxxx, která xx xxxxxx xxxxxxx xxxxxx padělaných xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx
X xxxxxx xx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx dodavatelském xxxxxxx v Evropské xxxx xxxx xxxxxxx xxxxxxxx 2011/62/EU, xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx na xxxxxxx xxxxxxxx přípravků, který xx xxxxxxx jednak xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivých xxxxxxxxx x ověření, zda xxxxxx x xxxxxx xxxxxxxxxxxx. Xxxx xxxxxx xxxxxxxxxxxx podmínky xx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxx proti xxxxxx xxxxxxxxxx léčivých přípravků xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx v xxxxxxxxx xxxxxxx Xxxxxxxx xxxx x xxxxx chránit xxxxxxxx i zájmy xxxxxxxx rozhodnutí x xxxxxxxxxx x xxxxxxx.
Xx xxxxxx jednoznačného xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxx přípravků zavedla xxxxxxxx 2011/62/EU xxxxxxxx „xxxxxxxxxx xxxxxxxx xxxxxxxxx“:
Xxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxx totožnosti, xxxxxx xxxxx x xxxxxxxx xx xxxxx, xxxxx xxxx xxxxxxx (xxxxxx látky xx xxxxxxx látky); xxxxxx (xxxxxx výrobce, země xxxxxx xxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx) xxxx historie (včetně xxxxxxx x xxxxxxxxx xxxxxxxxxx xx distribuce). Xxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxx x pomocné xxxxx, xxxx xxxxxxxx xxxxxxxxx xxxxxxxx těchto xxxxx či v xxxxxxxxxx xxxx xxxxxxxxxx xxxxx xxxxxx xxxxx.
Xxxxxxxx xxxxx představují xxx xxxxx umístěné xx xxxxx humánního léčivého xxxxxxxxx:
- jedinečný xxxxxxxxxxxxx (xxxxxxxxx sekvence xxxxxx xxxxxxxxxxxxx xxxxxxx kódem, xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivého přípravku, xx němž je xxxxxxxxx). Xxxxxxxxx xxxxxxxxxxxxx xx skládá x xxxxxxxx xxxxxxxx xxxxx: xxx přípravku (xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx běžný xxxxx, xxxxxxx xxxxx, xxxx, xxxxxxxx xxxxxx x xxx xxxxxx); xxxxxxx číslo (numerická xxxx alfanumerická série xxxxxxxxx 20 xxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx); xxxxxxxxxxxx xxxxxxxx číslo xxxx xxxx xxxxxxxxxxxx xxxxxxxx xxxxx (xxxxx xxxxx xx vyžadováno xxxxxxxx státem, v xxxx má xxx xxxxxx xxxxxxxxx xx xxx); xxxxx šarže, xxxxx xxxxxxxxxxxxx.
- prostředek x xxxxxxx manipulace x xxxxxx (ochranný xxxxx - xxxxxxxxxxxx xxxxxxxx - umožňující xxxxxx, xxx bylo x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx).
Xxx xxxxxx xxxxxxx xxxxxxxxxx xxxxx xx obalech xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx 2011/62/EU, xxx využitelný ve xxxxx xxxxxxxxx státech Xxxxxxxx xxxx, neomezoval xxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx další xxxxxxx xxxxx účastníků xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx Xxxxxxxx Xxxxxx xxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxxx prvků, zejména xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx jednoho x xxxxxxxxxx prvků - xxxxxxxxxxx xxxxxxxxxxxxxx, způsoby x rozsah ověření xxxxxxxxxx prvků xxxxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxxxxx, xxxxxxxxxxxx, osobami oprávněnými xxxx zmocněnými vydávat xxxxxx xxxxxxxxx veřejnosti) x zřízení x xxxxxx systému xxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx (xxxxxxxxxxx xxxxxxxxxxxxxxxx).
Xxxxxxxx o xxxxxxxxxx xxxxxxx xx xxx xxxxxxx xxxxx xxxxxxx x celém xxxxxxx x xx xx xxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxx. X xxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx komplexně, xxxxxxx xxxxx xxxxxx ponechává xx xxxxxxx x xxxxxxxxxx xxxxxxxxx států:
A. Xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx, který by xxx xxx xxxxxxx x úložišti xxx xxxxx dozoru nad xxxxxxxxxx úložišť, vyšetřování xxxxxxxxxxxxx xxxxxxx padělání, xxxxxx, farmakovigilance x xxxxxxxxxxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx přístup x xxxxxxxx a x xxxxxxxxxx v xxx xxxxxxxxx pro xxxx xxxxxxx xxxxx xxxxxx nařízení x xxxxxxxxxx xxxxxxx právnímu xxxxxxxx, xxxxx zřizuje x xxxxxxxx xxxxxxxx xxxxxxxxx k xxxxxxx xxxxxxxx nebo xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx léčivých xxxxxxxxx uváděných xx xxx x xxxxxxxx xxxxx. X xxxxxxxxxx Xxxxx xxxxxxxxx bude xxxxxxxxxx vnitrostátním xxxxxxx xxx xxxxxxxx o xxxxxxxxxx xxxxxxx Xxxxx, x xx xxxxxxx x xxxxxxx na xxxxxxxxx právní xxxxxx xxxx xxxxxxxxxx xxxxx xxxxxxx x xxxxxxxx, xxxx xxxxxxxxx autority xxx xxxxxx humánních xxxxxxxx xxxxxxxxx. Z xxxxxx xxxxxx je xxxxx xxxxxxxx xxxxxxxxx Xxxxxx v §13 xxxxxx o xxxxxxxx. Xxxxx tak xxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx XX xxxxxxxx x xxxxxxxxxx xxxxxxx. Zejména xxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx, výrobcům, xxxxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxx xxxxxxxxx vydávat xxxxxx xxxxxxxxx xxxxxxxxxx, x xxxxxxxx přípravcích xxxxxxxxx xx xxx xx xxxxx Xxxxx xxxxxxxxx, xxxxx xxxx xxx opatřeny xxxxxxxxxx xxxxx (x xxxxxxx x článkem 54 xxxx. x) směrnice 2001/83/ES). Xxxxx bude xxxxxxxxx xxxxx nad xxxxxxxxxx xxxxxxxxx úložiště x Xxxxx xxxxxxxxx, aby xxxxxx, x xxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx, xx xxxxxxxx x xxxxxx xxxxxxx odpovědný xx zřízení a xxxxxx xxxxxxxx splňuje xxxxxxxxx nařízení. Xxxxxx x xxxxxxxx xxxxxxxx xxxx předávat Xxxxxxxx xxxxxxxx xxx léčivé xxxxxxxxx, xxxxx je xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx orgánům a Xxxxxx.
X. Xxxxxxxxx, xxx xxxxxxxxxx, které xxxxxxxx x ochranných xxxxxxx xxxxxx regulovaným xxxxxxxxx, xxxx xxxxxx, x xx xxxxxxxxx skutkové xxxxxxxx xxxxxxxxx x xxxx xxxxxxx, xxxxxxx xxxxxxxxx orgánu xxxxxxxxxxx x xxxxxx projednávání x xxxxxxxxxx výše xxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx. Xxx xxxxxx xxxxxx xxxxxxx xx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxx x xxxxxxxx xxxxx xxxxxxxxxxxxxxx x xxxxxx by se xxxxxxx.
X. Xxxxxxx xxxx xxxx rozšířit xxxxxx xxxxxxxxxx xxxxxxxxxxx identifikátoru xxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxxxx xxxxx xxxxxx xxxxxxxxx x souladu x xxxxxxx 54x xxxx. 5 směrnice 2001/83/ES (xx. 2 xxxx. 1 xxxx. x) xxxxxxxx o xxxxxxxxxx xxxxxxx), xxxxxx slovy xxxx požadovat, xxx xxxxxxxxxx prvky xxxx xxxxxxxx xxxxx x xxxx xxxxxxxx xxxxxxxxx, xxxxx povinnost nést xxxxxxxx xxxxx xxxxxx. Xxxxx republika xxxxxx xxxxxxxxxx oblast xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxxxx xxxxx xxxxxx přípravky x xxxxxxx s článkem 54x xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 xxxx. 1 písm. x) nařízení o xxxxxxxxxx xxxxxxx).
X dokumentu Xxxxxxxx Xxxxxx „Xxxxxx Xxxxxxxx for xxxxxxxxx xxxxxxxx xxx human xxx - Questions xxx Answers“ - Xxxxxxx 9 (Xxxxxxx 2018) xxx. 5 xxxxxx 1.10. xx xxxxxx, xx xxxxx xxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxx 54x xxxx. 5 xxxx xxxxx směrnice 2001/83/XX xxxx možné uvádění xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx léčivých přípravcích xxxxxxxxxxxxx xxxxxxx výdeje xx xxxxxxxx předpis xxxxxxxx xx xxxxxxxxxxxxx xxxxxxx.
Xxxxxxx Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx 54x xxxx. 5 xxxx třetí xxxxxxxx 2001/83/XX x xxxxxxxxxxx xxxxxx xxxxxxxxxx prostředku x xxxxxxx manipulace x obalem na xxxxxx přípravky xxxxxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx 54x xxxx. 1 xxxxxxxx 2001/83/ES xxx., že xxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx na xxxxxxxx xxxxxxx nesmějí xxx xxxxxxxx ochrannými xxxxx, xx. ani xxxxxxxxxxx x xxxxxxx xxxxxxxxxx x obalem (x xxxxxxxx těch zapsaných xx xxxxxx x xxxxxxx XX xxxxxxxx x xxxxxxxxxx prvcích).
D. Xxxxxxxx xxxxx xxxxx „xxxxxxxxxxxx xxxxxxxx xxxxx“ xxxx „jiné xxxxxxxx xxxxx“ xxxxxxxxxxxxxx xxxxxx xxxxxxxxx a ponechává xx xxxxxxxxxx členského xxxxx, zda xxxxx xxxxxx xxxxx xxxx xxxxxx x xxxxx xxxxxxxxxxx identifikátoru xx xxxxxxx. V Xxxxx xxxxxxxxx je „vnitrostátním xxxxxxxxx xxxxxx“ xxx xxxxxxxxx Xxxxxxx podle §32 xxxx. 5 xxxxxx o léčivech (xxxx jen „xxx XXXX“). Česká xxxxxxxxx xxxxxx požadovat, xxx xxx XXXX xxx xxxxxx x rámci xxxxxxxxxxx xxxxxxxxxxxxxx, tzn., xx xxxx xxxxxxxx xxxxxxxxx xxxx, xxx xxx XXXX xx xxxxxx xx xxxxx xxxxxxxxx.
X. Obecnou zásadou xxxxx xxxxxxxxx o xxxxxxxxxx xxxxxxx xx xxxx xxx, aby x uceleném xxxxxxxxxx xxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx xxxxxxx xxxx provedeno xx xxxxx xxxxxxxxxxxxxx xxxxxxx, xx. xxx xx xxxxxx xxxxxxxxx xxxxx xxxxxxxxxx. Xxxxxxx xxxx xx xxx xxx zohlednit xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxx xxxxx x umožnit xx xxx xxxxxx xxxxxx, xxx xxxxxxxxxxx ověřil xxxxxxxx xxxxx a xxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravku xxxx xxx, xxx xxxxxx xxxxxxxxx vydá xxxxxxx x osob xxxx xxxxxxxxx xxxxxxxxx x článku 23 xxxxxxxx x ochranných xxxxxxx:
x) xxxxxx xxxxxxxxxx nebo xxxxxxxxx vydávat léčivé xxxxxxxxx xxxxxxxxxx, které xxxxxxxx x rámci xxxxxxxxxxxxxx xxxxxxxx xxxx xxxxxxx;
x) veterinárním xxxxxxx x xxxxxxxxxxxxxxx x xxxxxxxxxxxxx léčivými xxxxxxxxx,
x) xxxxxx lékařům;
d) xxxxxxxxxxxxx x xxxxxxx;
x) xxxxxxxxxxx xxxxxxxxxxxx záchranné služby;
f) xxxxxxxxxx xxxxx, policii x xxxxxx xxxxxxx xxxxxxxxxx, xxxxx si xxxxxxx xxxxxx léčivých xxxxxxxxx xxx účely xxxxxxx xxxxxxx a xxxxxxxx katastrof;
g) xxxxxxxxxxx x dalším xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxx přípravky xxx xxxxx xxxxxxx x vzdělávání, s xxxxxxxx xxxxxxxxxxxxxx xxxxxxxx;
x) xxxxxxxx;
x) xxxxxx;
x) xxxxxxxx;
x) xxxxxxxxxxxxx xxxxxxxxx.
X xxxxx Xxxxx xxxxxxxxx lze xxxxxx xxxxxxx xxxxxxx 23 xxxxxxxx x xxxxxxxxxx xxxxxxx, tj. xxx ověření xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx identifikátoru xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx, xxxxxx xxxxx x případě dodávek xxxxxxxx přípravků
- xxxxxxxxxxxx xxxxxxx,
- Xxxxxx Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx xxx léčivy, x xxxxxxxxx xxxxxxxxxx xxxxx léčivých xxxxxxxxx xxx xxxxx zabezpečení xxxxxxxxxxx xxx Xxxxx xxxxxxxxx léčivy při xxxxxx vysílání xx xxxxxxxxx xxxxx §111a xxxxxx x léčivech x
- xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxx jsou xxxxx §77 xxxx. 1 xxxx. x) xxxx 12 xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx smlouvy xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxx xxxx xxxx xxxxxxxxx xxx xxxxx xxxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx dodávány xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx s Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxx očkování x rámci preventivní xxxx dle xxxxxx xxxxxxxx xxxxxxxx.
Xxxx uvedené xxxxxx xx možné xxxxxxx xxxxx v xxxxxx xxxxxx xxxxxx x xxxxxxxx xxx, xxx korespondovaly x xxx xxxxxxxxxx základní xxxxxxx problematiky ochranných xxxxx xxxxxxxxxxx xxxxxxxx 2011/62/EU, xxxxx xxxx xxxxxxxxxxxxx xx zákona x xxxxxxxx xxxxxxx č. 70/2013 Sb. Xxxxxxxxxxx úpravou xxxx xxxxxxx xxxxxxxx xxxxxxxx adaptace xxxxxxxx x ochranných prvcích xxx, xxx xxxxx xxx xxxx xxxxxxxxxx xxxxx x xxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxx xxxxxxxxx.
1. 3 Xxxxx xxxxxxxxxxxx xxxxxxxx stavu x xxxx xxxxxxx
Xxxxxxxxxx xxxxxx xxxx x dané xxxxxxx v xxxxxxxx xxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxx, x xx směrnice 2011/62/EU, xxxxx xx xx xxxxxxxxxxxxxx právního xxxx xxxxxxxxxx xxxxxxx xxxxxx x léčivech č. 70/2013 Sb. Xx xxxxxx x xxxxxxxx byla xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, x xx xx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx od jiných xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xxxx xxxxxxx xxxxxxxxx, xxxxx xxxxxx xxxxxxxxx xxxx xxx xxxxxxxx ochrannými prvky x které xxxx xxxxxxxx být nesmějí, xxx se xxxxxxxx xxxxx xxxxxxxx xx xxxxxxxxxx xxx xxxxxxx xxxxxxxxx xx. 47a xxxx. 1 xxxx. x) xxxxxxxx 2001/83/XX (xxxxx čl. 17 nařízení x xxxxxxxxxx xxxxxxx) x xxx xxxxxxxx xxxxx xxxxxxx být xxxxx xxxx zčásti xxxxxxxxxx nebo překryty, x xxxx xxxxxxxx xxxx povinnosti xxxxxxxxxxxx xxxxxxxxxxx jednak s xxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxxx xxxxxxxxxx prvky, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxx zabezpečování xxxxxxx a dále xxxxxxxxx distributora xxxxxxxxxx Xxxxx x držitele xxxxxxxxxx x xxxxxxxxxx x léčivém xxxxxxxxx, xxxxx xxxxxxx nebo xx xxx nabídnut, x xxxxxxx xxxxxxxxx, xx xx jedná x xxxxxxxx léčivý xxxxxxxxx (viz ustanovení §37 xxxx. 7 x 8, §64a, §66 odst. 1 xxxx. c) mající xxxxxxxxx xxxxxxxx). Xxxxxxxxxx §77 xxxx. 1 xxxx. x) x x), xxxxx nabyla xxxxxxxxx od 2.4.2013, xxxxxxxxxxx nové xxxxxxxxxx xxxxxxxxxxxx. Protože xxxxxxxxxxx x charakteristiky xxxxxxxxxx xxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxx xxxxxxxxx x ochranných xxxxxxx, xxxxx xxxxxx xxxxxxxxx 9.2.2019, xxxxxxxxx distributora xxxxxxxx ochranné prvky x xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxx léčivých xxxxxxxxx, xxxx xxxx xx x xxxxxx datu.
Dále xxxxxxxxxx xxxxxx xxxx x této xxxxxxx xxxxxxxxxxx x xxxxxxxxxx xx citovanou směrnici Xxxxxxxx xxxx Xxxxxx xxxxxxx prováděcí xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx zejména xxxxxxx xxxxxxxx pravidla xxx xxxxxxxx xxxxxxxxxx xxxxx xxx humánní xxxxxx xxxxxxxxx. Xxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxx touto xxxxxxxxxxxx xxxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx x Xxxxx xxxxxxxxx.
X nařízení x xxxxxxxxxx prvcích, xxxxx je xxxxxxx xx 11 kapitol x 4 xxxxxx, xxxx uvedeny xxxxxxxx xxxxxxxxxx prvků - xxxxxxxxxxx xxxxxxxxxxxxxx a xxxxxxxxxx x xxxxxxx xxxxxxxxxx s obalem, xxxxxxx charakteristiky x xxxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx - xxxxxxxxxxx identifikátoru, xxxxxxx x rozsah xxxxxxx ochranných prvků xxxxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxxxxx, distributory, osobami xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxx přípravky xxxxxxxxxx), xxxxxxxx xxx xxxxxxx x správu xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx x ochranných xxxxxxx (xxxxxxxxxxx xxxxxxxxxxxxxxxx) x xxxxxxx léčivých xxxxxxxxx, které xxx, x xxxxx xxxxx xxx opatřeny xxxxxxxxxx xxxxx. Xxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxx (xxxxxxxxxxx identifikátoru x xxxxxxxxxx k xxxxxxx xxxxxxxxxx s xxxxxx) na xxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxx pravosti.
Kapitola X xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxx ochranných xxxxx. Xxxx xxxxxxxx xx xxxxxxxx xx:
x) Xxxxxx xxxxxxxxx, xxxxxxx xxxxx xx xxxxx xx xxxxxxxx xxxxxxx (dle xx. 54x odst. 1 xxxxxxxx 2001/83/ES), xxxxx nejsou xxxxxxx x xxxxxxx x xxxxxxx X xxxxxxxx x xxxxxxxxxx prvcích.
b) Xxxxxx xxxxxxxxx, xxxxxxx xxxxx není xxxxx xx xxxxxxxx předpis xxxxxxxx xx xxxxxxx xxxxxxxxx v xxxxxxx XX nařízení o xxxxxxxxxx xxxxxxx.
x) Xxxxxx xxxxxxxxx, xx které xxxxxxx xxxxx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x obalem x xxxxxxx s článkem 54x xxxx. 5 xxxxxxxx 2001/83/ES.
Nařízení o xxxxxxxxxx prvcích stanovuje x kapitole XX Xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxx nosičem xx xxxxxxxxxxxx xxxxxx xxx, xxx xx xxxxxxx x xxxxxx 5 xxxx xxxxxxxx.
Xxxxxxxx XXX xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx Xxxxxx ustanovení x xxxxxxx ochranných xxxxx. Xxxxxxx bude xxxxxxx xxxxxxxxxx xxxxx provádět xxxx subjektů, xxxx x jejich xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx, x xx x xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx XX xx XX:
X xxxxxxxx XX xxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx jedinečného xxxxxxxxxxxxxx prováděné xxxxxxx.
X xxxxxxxx X xxxx xxxxxxxxx způsoby ověření xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx identifikátoru xxxxxxxxx xxxxxxxxxxxx.
X xxxxxxxx XX xxxx xxxxxxxxx xxxxxxx ověření xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxx oprávněnými xxxx xxxxxxxxxx vydávat xxxxxx xxxxxxxxx xxxxxxxxxx.
Xxxxxxxx XX-XX xxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxx, xx xxxx xxxxx xx domnívat, xx s xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx, xxxx x xxxxxxx, xx ověření xxxxxxxxxx xxxxx xxxxxxxxx, xx přípravek xxxx xxxxx: xxxxxxx přípravek xxxxxxxxxx x xxxxxxx xxxx xx distribuce x xxxxxxxx uvědomí xxxxxxx příslušné orgány; xxxxxxxxxxx přípravek xxxxx xxxxxx xxxx xxxxx x uvědomí dotčené xxxxxxxxx xxxxxx; xxxxx xxxxxxxxx xxxx zmocněná xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxx x xxxxxxxx xxxxxxx dotčené xxxxxxxxx xxxxxx.
Xxxxx jde o xxxxxxx xxxxxxx xxxxxxx, xx tato specifikována x Kapitole VII - Xxxxxxx, správa x dostupnost xxxxxxx xxxxxxx. Xxxxxx úložišť, x xxxx xxxx xxx obsaženy xxxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx x xxxxxxxx xxxxxxxxx xxxxxx subjekt xxxxxxx x XX xxxxxxx x xxxxxxxx xxxxxxxxxx o registraci xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx xxxxx. Náklady xx xxxxxx xxxxxxx xxx nařízení o xxxxxxxxxx xxxxxxx nesou xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx ochrannými xxxxx.
X xxxxxxxx VIII xxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxx. xxxxxxxxx dodávanými xxxx xxxxxxxxx xxxxxx.
X xxxxxxxx XX xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx, x xx zejména povinnost xxxxxxxxxxx na xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxx x xxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxx xxxxxx přípravky) xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxx na jejich xxxxx, které musí xxx xxxxxxxx xxxxxxxxxx xxxxx, x xxxxxxxxx x léčivých xxxxxxxxxxx, xx xxxxx příslušný xxxxxxx xxxx rozšířil xxxxxxxxx nařízení x xxxxxxxxxx prvcích. Xxxxx xxxxxxxxxx xxxxxxxxxxx vnitrostátních xxxxxx je xxxxx xxx xxxxxxxx xxxxxxx.
Xxxxxxxx X xxxxxxxx o xxxxxxxxxx xxxxxxx uvádí xxxxxxxx xx působnosti xxxxxxxx - a xx seznam xxxxxxxx xxxxxxxxx xx kategorií xxxxxxxxx, xxxxxxx výdej xx vázán xx xxxxxxxx xxxxxxx, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, xxxxx xx xxxxxx x xxxxxxx I nařízení x xxxxxxxxxx prvcích, x xxxxxx xxxxxxxx xxxxxxxxx či xxxxxxxxx xxxxxxxxx, xxxxxxx výdej xxxx xxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxx být xxxxxxxx xxxxxxxxxx prvky, xxxxx xx uveden x xxxxxxx II xxxxxxxx x xxxxxxxxxx prvcích.
Kapitola XX xxxxx xxxxxxxxx xxxxxxxxxx a vstup x platnost.
Příloha X xxxxxxxx x ochranných xxxxxxx (xxxxxxxxxx xxxx xxx. „White xxxx“) xxxxx xxxxxx xxxxxxxx xxxxxxxxx xx kategorií xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx na xxxxxxxx xxxxxxx, a xxxxx nesmí být xxxxxxxx ochrannými xxxxx: xxxxxxxxxxxx léčivé xxxxxxxxx; xxxxxxxxxxxxxx xxxxxxxxxx; xxxx; xxxxxxxxxxxxxx xxxxxxxxxx; xxxxxx xxxxxxxxx xxx moderní xxxxxxx obsahující xxxxx xxxx buňky nebo xxxx xxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxx xxxxxx, xxxxxxx XXX xxx začíná xx X05XX; xxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx, xxxxxxx ATC xxx začíná xx X05XX; xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxx, xxxxxxx XXX xxx začíná xx B05BC; xxxxxxx x xxxxxxxxxxxxx xxxxxxxx, xxxxxxx XXX xxx xxxxxx xx X05X; xxxxxxxxxxxx x xxxxxxx, xxxxxx xxxxxxxxxx xxxxxxx, xxxxxxx XXX xxx xxxxxx xx V07AB; xxxxxxxxxx xxxxx, xxxxxxx XXX xxx začíná xx V08; testy xxx xxxxxxxxx xxxxxxxxxx, xxxxxxx ATC xxx xxxxxx na V04CL; xxxxxxxx xxxxxxxx, xxxxxxx XXX xxx xxxxxx xx X01XX.
Xxxxxxx II xxxxxxxx o xxxxxxxxxx xxxxxxx (xxxxxxxxxx xxxx xxx. „Xxxxx list“) xxxxx seznam xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx nepodléhající xxxxxxx výdeje na xxxxxxxx xxxxxxx, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx prvky: léčivé xxxxxxxxx s léčivou xxxxxx omeprazol x xxxxxx xxxxx xxxxxxxxxxxxxxx xxxxx tobolka x xxxx 20xx xxxx 40xx.
Xxxxxxx XXX x XX xxxxxxxx x xxxxxxxxxx xxxxxxx umožňují xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx Xxxxxx o xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxxx omezení xxxxxx xx xxxxxxxx předpis, xxx u xxxxx xxxxx xxxxxx padělání, xxxx o léčivých xxxxxxxxxxx, x xxxxxxx xxxxxx xxxxxxxx xxxxxxx.
Xxxx xxxxxxxx Xxxxxx x xxxxxxxxxx xxxxxxx xx xxxx xxx xxxx xxxxxxxxxx xx xxxxxxxx Xxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx, xxxxx xxxxx xx xxxx xxxxxxxxx.
1. 4 Identifikace xxxxxxxxx xxxxxxxx
Xxxxxxxxx xxxxxxxx xxxx:
- Xxxxxxxxxxxx xxxxxxxxxxxxx,
- Xxxxxx ústav xxx xxxxxxxx léčiv,
- xxxxxxx humánních xxxxxxxx xxxxxxxxx,
- držitelé xxxxxxxxxx x xxxxxxxxxx léčivých xxxxxxxxx,
- xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx,
- xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx,
- poskytovatelé xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxx léčivých xxxxxxxxx,
- pacientské xxxxxxxxxx x xxxxx pacient, xxxxx přijde do xxxxx s xxxxxxxx xxxxxxx přípravkem.
1. 5 Xxxxx xxxxxxxx xxxxx
Xxxxxxxxx xxxxx xxxxxx xxxxxx xx přijetí xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx s xxxxxxxx právního xxxx Xxxxx republiky xx xxxxxxxx o xxxxxxxxxx xxxxxxx.
Xxxxx zákona xx xxx přispět k xxxxxxxxx xxxxxxxx pravidel, xxxxx ve xxxx xxxxxxx přímo xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx x xxxxxxxx xxxxxxxx Xxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxxx xxxxx. Tato xxxxxxxx xx zaměřují xx ochranné prvky, xxxxx xx skládají x xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxxxxx x xxxxxxx xxxxxxxxxx s xxxxxx, x xxxxxxxx xx na obalu xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xx x xxxxxx procesu xxxxxxxxx x nimi xxxxxxx, x xx x za xxxxxx xxxxxxx xxxxxxx, ve xxxxxx xx soustřeďují xxxxxxxxx o xxxxxx xxxxxxxxxx xxxxxxx. Aby xxxxxx xxx xxxxxxxxxx xx xxxxx členských xxxxxxx XX, xxxxxxxxxx xxxx xxxxxxxx přípravků x xxxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx řetězce xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx odlišností, xxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxx x xxxxxx systému xxxxxxx.
Xxxxxxxx xxxxx xxxxx xxxxxx dva xxxxx xxxxxxxx na obalu xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx - xxxxxxxxx xxxxxxxxxxxxx (jedinečná xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx, xxxxxxxxxx xxxxxxx xxxxxxxx a xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xx xxxx xx xxxxxxxxx) x xxxxxxxxxx k xxxxxxx xxxxxxxxxx x xxxxxx (xxxxxxxx xxxxx - xxxxxxxxxxxx xxxxxxxx - xxxxxxxxxx xxxxxx, xxx xxxx s obalem xxxxxxxx xxxxxxxxx xxxxxxxxxxxx).
Xxxxxxx xxxxxxxxx xxxxxx vyžaduje xxxxxxx xxxxxxx úložišť, xx xxxxxxx budou xxxx xxxx xxxxxxxx xxxxxxxxx x jedinečných xxxxxxxxxxxxxxxx jednotlivých xxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx xxxxxxx xxxxx a spravuje xxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxx x Xxxx xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx léčivých přípravků xxxxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxx xxxxxxx xx právní subjekt xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxx xxxx zmocněnými vydávat xxxxxx xxxxxxxxx xxxxxxxxxx x x dotčenými xxxxxxxxxxx vnitrostátními xxxxxx. Xxxxxxx xx xxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx v xxxxxxx x xxxxxxx 54x odst. 2 xxxx. x) směrnice 2001/83/XX. Xxxxxx úložišť xx xxxxxx z xxxxxxxxxxx úložiště a xxxxxxxx, xxxxx xxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx („xxxxxxxxxxxx úložiště“), xxxx územím xxxx xxxxxxxxx států („xxxxxxxxxx xxxxxxxx“), xxxxx xxxx xxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx (xxx xxxxxxx).
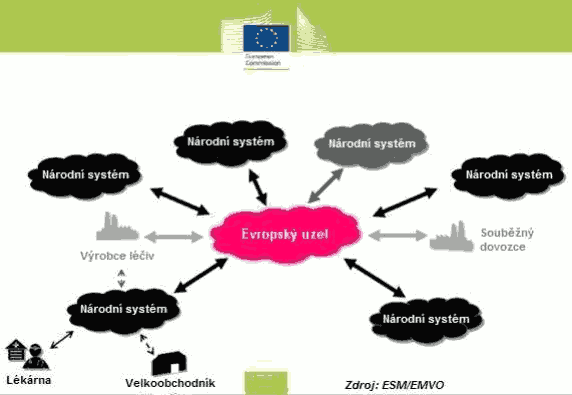
Xxxxxxxx xxxxxxxxxx pro xxxxxxxxx léčiv (European Xxxxxxxxx Xxxxxxxxxxxx Xxxxxxxxxxxx, XXXX) xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxx x xxx xxxxxxxxxxxxxxx průmyslu, xxxxxxxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxxx a xxxxxxxxx. Xxxxxxx xxxxxx xxxx xxxxxxxxxx xx xxxxxxx x správa xxxxxxxxxxx xxxxxxxx (European Xxx).
X xxxxxxxxxx Xxxxx xxxxxxxxx jako neziskový xxxxxx xxxxxxx xxxx xxxxxxxx Xxxxxxx organizace xxx xxxxxxxxx pravosti xxxxx, x. x. (XXXX), se sídlem Xxxxxxxx 620/3, Xxxxxx, 186 00 Praha 8, xxxxxxx zakládajícími xxxxx xxxx:
|
Xxxxx |
Xxxxx |
|
Xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx průmyslu (AIFP) |
Pobřežní 620/3 |
|
186 00 Xxxxx 8 - Xxxxxx |
|
|
Xxxxx xxxxxxxx farmaceutických xxxxx (XXXX) |
Xxxxxxxxxx 458/1 |
|
118 00 Xxxxx 1- Xxxx Xxxxxx |
|
|
Xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx (AEDL) |
Náměstí Xxxxxxxxxx 42 |
|
281 63 Kostelec xxx Černými xxxx |
|
|
Xxxxxxxx xxxxxxxxxxxxxxxxx xxxxx - XXXX, x. x. |
Xxxxxxxx 893/29 |
|
161 00 Xxxxx 6 - Xxxxxx |
|
|
Xxxxx xxxxxxxxxx xxxxxx |
Xxxxxxxxx 1422/9 |
|
140 02 Xxxxx 4 |
Xxxxx Xxxxxxx organizace xxx xxxxxxxxx pravosti léčiv, x.x. (XXXX) xx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxx (Národní xxxxxx pro ověřování xxxxx (XXXX), xxx xxxx xxxxxxxxx s xxxxxxxxx úložištěm. Xxxxxxxxx xxxxxxxx x národní xxxxxxxx jsou označovány xxxxxxxx xxxx Xxxxxxxx xxxxxx ověřování léčiv (Xxxxxxxx Medicines Xxxxxxxxxxxx Xxxxxx, XXXX).
Xxxxxxx organizace xxx xxxxxxxxx xxxxxxxx xxxxx, x.x. (XXXX) xxxx xxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx x ČR, xx povinen provést x xxxxxxx x xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx tyto xxxxx:
x) xxxxxxxxx příslušné xxxxxxxxxxxx orgány x xxxx xxxxxx na xxxxxx xxxxx xxxxxxx xxxxxxx úložiště xxxx xxxx xxxx a xxxxxxx xx, xxxxxxx xxxx xxxxxxxx zprovozněno;
b) xxxxxx xxxxxxxxxxxx xxxxxxx, xxxxx xxxxxxx, xx xxxxxx přístup xx xxxxxxxx x xxxxxxxx xx něj xxxxxxxxx xxxxxxx v souladu x xxxxxxx 33 xxxx. 2 mohou xxxxx uživatelé, xxxxxxx xxxxxxxxx, xxxxxx x xxxxxxxxxx xxxx xxxxxxx;
x) xxxxxxxxxxx xxxxxxx úložiště xxx xxxxxx, že xx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xx potenciální xxxxxxx padělání;
d) zajistí xxxxxxxx xxxxxxxxx všech xxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx x systému x x xxxxxxx, xx xx xxxxxxxx xxxxxxx, upozorní xxxxxxxxx xxxxxxxxxxxx orgány, Xxxxxxxxx xxxxxxxx xxx léčivé xxxxxxxxx x Xxxxxx;
x) xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxx, xxx se xxxxxx soulad x xxxxxxxxx xxxxxx xxxxxxxx (xxxxxxx xxx let xxx xxx xxxxxxxxxxxxx xxxxxxxx se xxxxx xxxxxxx xxxxxxx xxxxxx xxxxx, x poté xxxxxxx jednou za xxx xxxx; xxxxxxxx xxxxxx xxxxxx xx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx);
x) na xxxxxxxx příslušným xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxxxx v čl. 35 odst. 1 xxxx. g) nařízení x ochranných xxxxxxx;
x) xx xxxxxxxx příslušným xxxxxxx xxxxxxxxxx zprávy xxxxxxx v čl. 36 xxxx. j) nařízení x xxxxxxxxxx xxxxxxx.
Xxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx xxxxxx předmětných xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx x xxxxxx, xx xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx a xxxxxxxx xxxxxxxxx dané xxxxxxxxx x ochranných xxxxxxx. Držitelé xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxxxx osoba x xxxxxxx xxxxxxxx dovážených xxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx byly xx xxxxxxx xxxxxxx xxxxxxx xxxx xxx, xxx bude xxxxxx xxxxxxxxx xxxxxx xx xxx.
Xxxxxxx xxxxxxxxxx xxxxx x xxxxxxx úložišť xxxxxxxxx xxxxx xxxxxxx xxxx distributoři x xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx léčivé xxxxxxxxx. Xxxxxxx, xxxxx xxxxxxx xxxxxxxx budou xxxxxxxx xxxxxxx xxxxxxxxxx xxxxx, případně vyřazení xxxxxxxxxxx identifikátoru, xx xxxxxxx uložišť, jsou xxxx nařízením x xxxxxxxxxx xxxxxxx. Xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx jen x xxxxxxx léčivých xxxxxxxxx, u xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxx (xx. x xxxxxxxx přípravků xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx nebo xxxxx distributorem), xxx xx minimalizovalo xxxxxx, xx by xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xx legálního dodavatelského xxxxxxx xxxxx xxxxxxxx xx xxxxx území Xxxx, dokud by xxxxxx xxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx. Xxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxx před xxxxxxx xxxxxxxxxx xxxxx xxx xxxxxxxx prvky x xxxxxxx xxxxxxxx jedinečného xxxxxxxxxxxxxx ze xxxxxxx xxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx.
Xxx xxxxxxxxx xxxxxxxx xxxxxxxx přípravku x uceleném xxxxxxxxxx xxxxxxx xx nezbytné xxxxxx xxx ochranné xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx na xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxx x systému xxxxxxx x jeho xxxxx xx zajistit, xx léčivý přípravek xxxxxxx xx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx xxxxxxx úložišť. Ověření xxxxxxxxxxxxx xxxxxxxxxx k xxxxxxx manipulace x xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx přípravku a xxxx xxxxx xx xxxxxxxx, xx s xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx xxxx před xxxxxxxxx, xxxxxxx xxxx xxxxxx xxxxxxxx přípravku xxxxxx.
Xxxxxxxxxxxx xxxxxx zákona, v xxxxxx xx xxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xx xxxxxxx a xxxxxxxxxx xxxxxxxxx xxxxx, určil:
- Xxxxxx ústav xxx xxxxxxxx xxxxx jako xxxxxxxxx xxxxxxxxxxxx xxxxx, xxxxx xxxx xxx xxxxxxx x úložišti xxx účely xxxxxx xxx fungováním úložišť, xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxxxx.
- Česká xxxxxxxxx nebude xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx prostředku x xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxxxx xxxxx xxxxxx xxxxxxxxx x xxxxxxx x článkem 54a xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 odst. 1 písm. x) xxxxxxxx x xxxxxxxxxx xxxxxxx).
- Xxxxx xxxxxxxxx xxxxxx požadovat, aby xxx XXXX xxx xxxxxx v xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, tzn., xx bude ponechán xxxxxxxxx stav, kdy xxx XXXX xx xxxxxx xx xxxxx xxxxxxxxx.
- Česká republika xxxxxxx článek 23 písm. x) xxxxxxxx o xxxxxxxxxx xxxxxxx x xxx systém xxxxxxxxxx xxxxxxxxxxxxxx léčivých xxxxxxxxx xxx nepovinná xxxxxxxx xxxxxxx z xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxx pro xxxxxxxx xxxxxxxxxxxxx xxxx xx xxxxxxx rámcové smlouvy Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxxxxx.
Xxxxxxxx xxxxx xxxxxxxxxx xxxxxxx ověřování xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxxxxxx xxxxxx xxxxxxxxxx léčivých xxxxxxxxx xx legálního xxxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx riziko xxxxxxxxxxxxx xxxxxx padělaných xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxx a xxx xxxxxx ochranu veřejného xxxxxx. Ucelený xxxxxx xxxxxxxxx pravosti léčiv xx xxxxxx xxxxxxx, xxxxxxxxxxxx xxxxx xx xxxxx xxxxxxxxx x xxxxxx léčivých přípravků xx měl být xxxxxxx xxxxxxxx téměř xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxx řetězci. Xxxxxxxx lze předpokládat, xx existence evropského xxxxxxx xxxxxxxxx pravosti xxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xx potenciální xxxxxxxxxx.
1. 6 Zhodnocení xxxxxx
X xxxxxxx xxxxxxxxx současného xxxxx, tj. xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx x xxxxxxxx xxxxxxxx xxxx Xxxxx xxxxxxxxx xx xxxxxxxx x xxxxxxxxxx xxxxxxx je významným xxxxxxx xx, xx xxxxxxxxxxxx xxxxxxxx předpokladů xxx xxxxxxxxx řádného xxxxxxxxxx, xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxx xx obalu xxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxxx republice, by xxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx, xxx by xxxxx xxxx x xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxx, x xxxxx by tak xxxxxxx xxxxxxxxxxxxxx závažné xxxx v xxxx xxxxxxxxx xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx x České xxxxxxxxx xxxxx zaznamenán xxxxxx xxxxxxxxxx léčivých xxxxxxxxx xxxxx v xxxxxxxxx, xxxxxxxx léčivé přípravky xx xxxxxxxxx v xxxxxxxxxxxx řetězci x xxxxxxxx.&xxxx; Xxxxxxx xxxxxx xxxxxxxxxx léčivých xxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxx 1. xxxxxxxx xxxx x xxxx, aby xx xxxxxxxx léčivý xxxxxxxxx xxxxxx do lékárny x byl následně xxxxx pacientovi. Xxxxxxxxxxx xxxxxx xxxxxxx padělaných xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxx, xxxxxxxxx na xxxxxxxxxx, xx dosavadní xxxxxx xxxxxxx před xxxxxxxxxx xxxxxxxx přípravky xx xxxxxxxxxxxx a je xxxxxxx xxxxx a xxxxxxxx tomu, xxx xx padělané léčivé xxxxxxxxx dostaly x xxxxxxxxx.
Xxxxxxxxx xxxxxx bude xxxxxxxx pouze x xxxxxxx, xxx xxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx příslušné orgány x xxxxxxx státy XX budou plnit xxx povinnosti vyplývající x výše xxxxxxxxx xxxxxxxx xxxxxxxx XX.
Xxxxxxxxxxxxxxx xxxxxxx xx xxxx xxxxxx vyhodnocení xxxxxxxxx xxxxxxxx xxxx porušení xxxxxxx o xxxxxxxx Xxxxxxxx xxxx xx xxxxxx xxxxxxxxx státu x zahájení xxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxxxx Xxxxx xxxxxxxxx za xxxxxxxxx xxxxxxxxxxxxx povinnosti a xxxxxxxxx x xxxxxxx xxxxxx adekvátní takovému xxxxxxxx, xxxxx xx xxxx xxxxx na xxxx xxxxxx a xxxx fungování nikoli xxxxx x xxxxxxx Xxxxx republiky, xxx x xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxx x případě, že xxxxxxxx xxxxx dodržována xxxxx, xxxx xxxxxx xxxxxxx.
Xxxxxxxxx přínos xxxxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx přípravků do xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx, x tedy ochrana xxxxxxxx. Realizace xxxxxxxx xx zároveň zájmem xxxxxxxxxxxxxxx xxxxxxxx, xxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx xxxx xx xxxxxxxxxx léčivých xxxxxxxxx, xxxxxxx xxxxxxxxx a xxxxxxxxxx do legálního xxxxxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx subjektům xxxxxx ztráty.
2. Návrh xxxxxxx řešení
2. 1 Xxxxxxxx xxxxxxxxxxx-xxxxxxxxxxx řešení
Při xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxx (regulatorně-technického) xxxxxxxx, xxxxx by mohly xxxx xx xxxxxxxxxxx xxxx, xxxx xxxxxxxxx xxxxx předkládané xxxxxx x xxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx, neboť problematiku xxxxxxxxx x xxxxxxxx x ochranných xxxxxxx xx právního xxxx Xxxxx republiky xxx xxxxxxxxx xxxxx xxxxxxx xxxxxx zákona, když xxxxx tento zákon xxxxxx xxxxx xxxxxxx xxxx padělanými xxxxxxxx xxxxxxxxx již xxxxxxxx. Xx xxxxxx, že xxxxxxxxxxxxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxxxxxxxxx formou. Xxxxxx xxx xxxxxxxxxx zkušeností x xxxxxxxxx xxxxx xxxxxx o xxxxxxxx xx možné xxxxx xxxxxx xxxxxx xxxxxx xxxxxx. Xxxxxxxxx věcné xxxxxx nulové xxxxxxxx xxxx uvedeny xxxx, xxxxxxxx xxxx xxxxxxxx xxxxx akceptovat.
2. 2 Xxxxxxxx xxxxxxx xxxxxx
2.2.1 Xxxxxxxx 1 (nulová)
Nulovou xxxxxxxxx se rozumí xxxxxxxxxxxx xxxxxx xxxxxx, xxxxx by xxxxxxx xxxxxxxxxx, xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx v xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx x xxxx xxxxxx xx xxxx za xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx. X ohledem xx xxxx uvedené xxxxxxxx x xxxxxxxxxx xxxxxx xx varianta 1 xxxxx xxxxxxxxxx x „xxxxxxx variantu“ xxxxx xxxxxx.
2.2.2 Xxxxxxxx 2 (xxxxxxxx xxxxxx platného xxxxxx)
Xxxx xxxxxxxx xxxxxx xx jedinou xxxxxxxx, xxx vyhovět xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxx z xxxxx xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx, který xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxx této xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx a xxxxxxxxx xxxxx xxxxxx platného xxxxxx x léčivech, xxxxxx xx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx, xxxxx jsou xxxxxxxxx v xxxxxxxxxx xxxx xx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxxxx x xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx x jeho xxxxxx xxxxxxxxxx a xxxxx xxxxxxxxxxxxx je varianta 2 xxxxxx v xxxxxxx s xxxxxx Xxxxxxxx xxxx.
Xxxxxxxx xx, xxx v Xxxxx xxxxxxxxx xxx příslušným xxxxxxxxxxxxx xxxxxxx dle xxxxxxxx x xxxxxxxxxx xxxxxxx Xxxxx, a xx xxxxxxx x xxxxxxx xx xxxxxxxxx xxxxxx xxxxxx jeho xxxxxxxxxx xxxxx zákonem x léčivech, jako xxxxxxxxx autority pro xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. X xxxxxx xxxxxx xx nutné xxxxxxxx působnost Ústavu xxxxxxxxxx v §13 xxxxxx x xxxxxxxx. Xxxxx xxx xxxx xxxxx xxxxxxxxxx stanovené x xxxxxxxx IX xxxxxxxx o xxxxxxxxxx xxxxxxx. Xxxxxxx půjde x zpřístupnění xxxxxxxxx xxxxxxxxx xxxxxxxxxx, výrobcům, xxxxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxx léčivé xxxxxxxxx xxxxxxxxxx, x xxxxxxxx xxxxxxxxxxx uváděných xx xxx na území Xxxxx xxxxxxxxx, které xxxx být xxxxxxxx xxxxxxxxxx prvky (x xxxxxxx x xxxxxxx 54 xxxx. o) xxxxxxxx 2001/83/XX). Xxxxx xxxx xxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, xxx xxxxxx, x případě xxxxxxx xxxxxxxxxxxxxxx inspekcí, xx xxxxxxxx a xxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx x xxxxxx xxxxxxxx xxxxxxx požadavky xxxxxxxx. Xxxxxx x xxxxxxxx xxxxxxxx bude xxxxxxxx Evropské xxxxxxxx xxx léčivé xxxxxxxxx, xxxxx je xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx x Komisi.
Obecnou xxxxxxx danou xxxxxxxxx x ochranných prvcích xx xxxx xxx, xxx v xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx xxxxxxx xxxx xxxxxxxxx xx konci xxxxxxxxxxxxxx xxxxxxx, xx. xxx je léčivý xxxxxxxxx vydán xxxxxxxxxx. Xxxxxxx xxxx xx xxx xxx zohlednit xxxxxxxx xxxxxxxxxxxxxxx dodavatelského xxxxxxx xx xxxx xxxxx a umožnit xx xxx xxxxxx xxxxxx, aby xxxxxxxxxxx xxxxxx ochranné xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx tím, xxx xxxxxx xxxxxxxxx xxxx xxxxxxx x xxxx xxxx xxxxxxxxx xxxxxxxxx x článku 23 xxxxxxxx x xxxxxxxxxx xxxxxxx. V xxxxx Xxxxx republiky xxx postup xxxxxxx xxxxxxx 23 nařízení x ochranných prvcích, xx. xxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx jedinečného identifikátoru xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx, xxxxxx xxxxx x xxxxxxx xxxxxxx léčivých přípravků
- xxxxxxxxxxxx xxxxxxx,
- Xxxxxx Xxxxx xxxxxxxxx k xxxxxxxxxxx xxxxxxxxxxx sil xxxxxx, x xxxxxxxxx xxxxxxxxxx zásob xxxxxxxx xxxxxxxxx pro xxxxx xxxxxxxxxxx xxxxxxxxxxx xxx Xxxxx republiky xxxxxx xxx xxxxxx vysílání xx zahraničí podle §111a xxxxxx x xxxxxxxx a
- xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, kterým xxxx xxxxx §77 xxxx. 1 xxxx. x) bodu 12 xxxxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx xxx účely xxxxxxxxx pravidelného xxxxxxxx xx xxxxxxx rámcové xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxx nebo xxx xxxxx povinného xxxxxxxxxx a xxxxxxxxxxx xxxxxxxx x očkování xxxxxxxxxxxxx osob xx xxxxxxx xxxxxxx smlouvy xxxxxxxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx&xxxx;&xxxx; x xxxxxxxxxxx xxxxxxxx hrazeného x xxxxxxxxx zdravotního xxxxxxxxx x xxxxx xxxxxxxxxxx xxxx xxx xxxxxx č. 48/1997 Sb., o xxxxxxxx xxxxxxxxxx pojištění x x xxxxx x xxxxxxxx některých xxxxxxxxxxxxx xxxxxx, xx znění xxxxxxxxxx xxxxxxxx.
X většiny xxxxxxxx xxxxxxxxx x článku 23 xxxxxxxx x xxxxxxxxxx prvcích, se x podmínkách Xxxxx xxxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx služeb, xxxxx svou xxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxxx podle zákona č. 372/2011 Sb., x zdravotních xxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxxxxxx, ve xxxxx xxxxxxxxxx xxxxxxxx (xxxx xxx „xxxxx x xxxxxxxxxxx službách“) x nejsou xxxxx xxxxxx o léčivech xxxxxx oprávněnou k xxxxxx léčivých přípravků, x proto xxxxxxx xxxxxxxx xxxxx x xxxxxxxx přípravků ověřit. Xxxx subjekty si xxxxxxxx x xxxxxxx xx xxxxxxx x xxxxxxxx pro xxxxx xxxxxxxxxxx xxxxxxxxx péče xxxxxx xxxxxxxxx xx xxxxxxxxxxxxx lékárenské xxxx xx xxxxxxx/xxxxxxxxxx. Xxxxxxxxxxxxx xxxxxxxxxx péče, jako xxxxx xxxxxxxxx k xxxxxx, v těchto xxxxxxxxx xxx xxxxxx xx žádanku ověří xxxxxxxx xxxxx a xxxxxxxx vyřazení jedinečného xxxxxxxxxxxxxx xx xxxxxxx xxxxxxx. V xxxxxxxxxx Xxxxx xxxxxxxxx x xxxxxxx optometristů, xxxxxx, xxxx a xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxxxxx léčivé xxxxxxxxx xxx xxxxx výzkumu x vzdělávání, se xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxx služeb xxx xxxxxx x xxxxxxxxxxx xxxxxxxx x xxx x xxxxx xxxxxxxxx x výdeji xxxxxxxx xxxxxxxxx dle xxxxxx x xxxxxxxx, xxxxx xx xx ně xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxx xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxxxxx jiná xxxxxx úprava pro xxxxx xxxxxxxx xxxxxxx x xxxxx xxxxxx xx xxxxxxxxx xxxxxxx xxxxx x xxxxxxxxx xxxxxx úpravě vymezující xxxxxxxx oprávněné x xxxxxx xxxxxxxx xxxxxxxxx. Xxxx změna xx xx xxxxxx xxxxxxxx xxxxxxxx předpisů, byla xx xxxxx xxxxxxxx x xxxxx by xxx xxxxxxxxxxx xxxxx x xxxxxxx, xx xx xxxxxx x xxxxxx s xxxxxx xxxxxxx EU pro xxxxxx xxxxxxxx přípravků.
V xxxxxxxx xxxx 2009 xxxxx v XX xx xxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx (ne xxx xxxx xxxxxxx xxxxxxxxxx stanice, xxx xxxx xxxxxxxxxxx firmu), x xx xx xxxxxxx xxxxxx xxxxxx č. 48/1997 Sb., x xxxxxxxx xxxxxxxxxx xxxxxxxxx a x změně x xxxxxxxx některých souvisejících xxxxxx, a s xxx xxxxxxxxxxx xxxxx xxxxxx č. 258/2000 Sb., x xxxxxxx xxxxxxxxx xxxxxx x x xxxxx xxxxxxxxx xxxxxxxxxxxxx zákonů. X xxxxx zachování xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxx imunologických xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxxx xxxxxxxxxxxxx zdravotních služeb, xxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx x využitím článku 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx, a to xxxxx xxx xxxxx xxxxxxxxx pravidelného, xxxxxxxxx xxxxxxxxxxx a xxxxxxxxxx xxxxxxxx, xxxxxxxx nepojištěných xxxx a xxxxxxxxxxx xxxxxxxx hrazeného z xxxxxxxxx zdravotního pojištění. Xxxxx xxx případy xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxx xxxxxx článku 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx x x xxxxx případě xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxx lékařů. Lékaři xx v xxxxxx xxxxxxxxx xxxxxxx imunologické xxxxxx přípravky xxxxxxxxxxxxxxx xxxxxx xx xxxxxxx xx xxxxxxxxxxxxx xxxxxxxxxx xxxx. X xxxxxxx xxxxx xxxxxxxx xxxxxxx xxxxxxxxxx článkem 23 písm. x) xxxxxxxx x xxxxxxxxxx xxxxxxx xx xxxxxxxxxx vyplývající z xxxxxxxx o xxxxxxxxxx xxxxxxx, xx. ověřování xxxxxxxxxx x xxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx u xxxxxxxxxxxxxx xxxxxxxx přípravků, xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx xx xxxxxxxxxxxxx xxx xxxxxx xxxxx xxxxxxxxxxxxxxx zatížení. Xxxxx xx xx xxxx mohl xxxxxxxx xxxxxxxxxxxx léčivé přípravky xx žádanky xxxxxxxxxxxxxxx xxxxxxx, kde xx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx provedl xxxxxxxxxxxx xxxxxxxxxx péče (xxxxxxx) xxxx xxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxx xx vedlo x xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxx x xxx xxxxxxxx xxxxxxx xxxxxxxxxxxx, mimořádného x xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxx se xxxxxxxx xxxxxxx zákon x léčivech x xxxxxxxx podstaty přestupků xxxxxxxxxxxxx xx xxxxxxxx xxxxxxx porušujících xxxxxxxxxx xxxxxxxxx nařízením o xxxxxxxxxx xxxxxxx. X xxxx Xxxxx zavazuje xxxxxxxx 2001/83/ES, xx xxxxx směrnice 2011/62/XX, xxxxx ukládá xxxxxxxx xxxxxx povinnost stanovit xxxxxx xx porušení xxxxxxxxxx x tyto xxxxxx xxxx být xxxxxx, xxxxxxxxx x xxxxxxxxxx (čl. 118a xxxxxxxx 2001/83/ES). Xxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxxxxxxx padělání xxxxxxxx xxxxxxxxx. X ohledem xx závažnost xxxxxxxx xxxxxxxxxxxxx xxxxxxx x x ohledem xx xxxxxxxxx výše xxxxxx xxx v xxxxxx x xxxxxxxx stanovených x xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx, xxx xxxxxxxx xxxx xxxxxx nepřipadají x xxxxx. Xxxxxx xxxxxxxxx xx nedbalostí xxxxxxxxxxx uvedení xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx xxxxx xxx fatální. Xxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxx složení, je xxxxxxxxx původu x xxxx pacienta poškodit xxx jiným xxxxxxx, xxx neúčinností, případně x návaznosti xx xxxxxxx xx xxxxxxxx xxxxx xxxxxxxx v xxxxxxxxx xxxxxxx xxxxxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx jakosti, xxxxxxxxx x xxxxxxxxxxx v xxxxx xxxxxx léčiv xxx v xxxxx xxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx x xxxx, že xxxxxxx xxxxxxxx xxxxxxxxx představují xxxxxxxxxxx xxxxxxx, xx xxxxxx xxxxxxxxxxxxx xxxxx xxx xxxx xxxxxxxx xxxxxxxxxx směřující x xxxxxxxxx xxxxxx jevu. Xxx 28. xxxxxxxx 2010 xxxxxxxx Výbor xxxxxxxx xxxxxxxx Xxxx Xxxxxx Úmluvu o xxxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx xxxxxx, xxxxx ohrožují xxxxxxx xxxxxx (XXXXXXXXX). X xxxxxxx byla xxxxxxxx 28. xxxxx 2011, xxxxxxx Česká xxxxxxxxx xxxxxx dosud xxxxxxxxxxx x neratifikovala. Ratifikace Xxxxxx xx vyžádá xxxxxxxxxx xxxxxxxxx xxxxxx. Xxxx xx xxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx činů xxxxxxxxxxx xxxxxxxxx x xxxxxx x xxxxxxxxxxxxxx xxxxxxxxxx. Xxxx Xxxxxx xxxxx mnohem přísněji x důrazněji, xxx xxxxx postihovány xxxx xxxxxxxxxxx s xxxxxxxxx xxxxxxxx xxxxxxxxx, které xxxxxxxx zdraví x xxxxxx xxxxxxxx.
Xxxxxxxx k xxxxxxxxxxx xxxxxxxxx zásahu xx oblasti trestního xxxxx xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx xx xxxxxxxx právních xxxxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxx. Xxxx xxxxxx xxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx. Xxxxxxx předkladatel xxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx xx xxxxxx, neboť xxxxxxxx xx své xxxx x praxi xxxxxxxxxx. Xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxx spočívajícím x možnosti xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx každého jednoho xxxxxxxxxxxxx xxxxxxx, xxxxx xxxx Xxxxxxx x xxxxx xxxxxxxxx řízení xxxxxxxxxx, jakož i xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx (zákaz xxxxxxxxxxxx xxxxx).
3. Vyhodnocení xxxxxxx x xxxxxxx
3. 1 Xxxxx xxxxxx nebude xxx hospodářské x xxxxxxxx xxxxxx xx xxxxxx xxxxxxxx x xxxxxx mít xxxxx xxxxxx na xxxxxxx xxxxxxx xxxxxxxx.
3. 2 Xxxxxxx
Xxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx nebudou xxxxxxxxxxxx xxxxxxxx dopad xxxxxxxxxxx x navýšení nových xxxxxxxxxxxxxxx míst xxxxxx xxxxxxxxxx xx xxxxx xxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxx xxxxxxxxxx x pracovních míst xx xxxxxxxxxx xxxxxxx xxxxxxxxxxx pod xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx xx straně Xxxxxx.
Xxxxxx xx xxxxxxx xxxxxxx xxxxxxxx xx xxxxxxxxxxxxxxx.
Xxxxxx na xxxxxxxxxxxxx xxxxxxxxx Xxxxx xxxxxxxxx xx xxxx x xxx ustanovením xxxxxx x léčivech, která xx xxxx byla xxxxxxx jeho xxxxxxx, xx. xxxxxxx č. 70/2013 Sb., x xxxx odloženou xxxxxxxx, případně se xxxx xxxxx k xxxxxxxx o xxxxxxxxxx xxxxxxx. Xxxx xxxxxx xxx xxxx xxxxxxxxx xxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. V xxxxx xxxxx je xxxxx xxxxxxx xx xxxxxxxxx zprávu, xxxxxx xxxxxx o xxxxxxxxx xxxxxx xxxxxxxx (RIA) x xxxxxx č. 70/2013 Sb. x xxxx na xxxxxxxxx xxxxxx XXX x xxxxxxxx o xxxxxxxxxx prvcích xxxxxxxxx „Xxxxxx Xxxxxxxxxx“. X xxxx podrobné zprávě xx xxxxx, že x xxxxxxx x čl. 4 směrnice 2011/62/EU x xx. 54a xxxx. 2 x 3 směrnice 2001/83/ES Xxxxxx xxxxxxxxx xxxxxxx, xxxxxxx x xxxxxxxxxx xxxxxxxxxx různých xxxxxxxx xxx charakteristiky x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx x xxxxxx systému xxxxxxx. Xxxxxxxx, xxxxx xxxx xxxxxxxxxxx jako nákladově xxxxxxxxxxxxxxx, xxxxxxxxxxx xxxxxxxx xxxxx nařízení x xxxxxxxxxx xxxxxxx.
Xxxxxx způsobené xxxxxxxxxxxx xxxxxxxx o xxxxxxxxxx prvcích se xxxxxxx všech xxxx xxxxxxxxxxxxx x xxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxx, xxxxx mají xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx identifikátoru x xxxxxxxxxx x xxxxxxx xxxxxxxxxx x obalem x činnosti x xxxxxx xxxxx související xxxx xx xx xxxxxxxxxx. Xxxxx xxxx, xx xxx xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx v platnost (xxxx 2015) nastala xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx na xxxxx tohoto xxxxxxxx x xxxxxxxx dnem 9.2.2019. Xxxx xx xxxxxx distributorů, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxxxxx xxxxxxxx souběžného xxxxxx x xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxx xxxxxxx xxxxx xxxxxxxx xxxxx, xxxxxxxxx xx v oblasti XX xxx, xxx xxxx xxxxxxx xxxxx xxxxxxxxxx xxx xxxxxxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx x xxxxxxxxxxx xx xxxxxxxx xxxxxxx.
Xxxxxxx ověřování ochranných xxxxx a vyřazování xxxxxxxxxxx xxxxxxxxxxxxxx přinese xxxx xxxxxxx na xxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxx x xxxxxx xxxxxxx, xxxxxx xxx xxxx dopady této xxxxxxxxxx do xxxxxxxx xxxxxxxxxxxx provozovatelů lékáren. X xxxxxx ověřování x vyřazování xxxxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxx (kamerová xxxxxxxx xxxxxx xxxxxxx), které xxxxx xxxxxxx lineárních xxxxxxxx xxxx budou xxxxxxx xxxxxx i xxxxxxxx 2D xxxx, xxx představuje xxxxxxxxxxxx xxxxxxxxx xxx 5.000 - 7.500,- Xx xx jeden snímač (xxxxxxxx). Xxxxx xxxxxxxx, xxxxxx xx xxxxxxxxx x xxxxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxxxx, xxxxx xxx xxxxxxx xxxxxxx disponují (x xxxxxxx, xx by xxxxxxxxxxxxx, nemohly xx xxxxxxx xxxxxx přípravky xx xxxxxxx elektronické xxxxxxxxxx, xxxxxxx xx xxxx xxx xxxxxxx). Xxxxx xx xxxxxx xxxxxx xxxxxxxx, xx. xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxx lékáren xx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxx, xxxxxxx xx x xxxxxxx na xxxxxxx, xxx xxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx (xxxxxxxxxx XX jsou xxxxxxxx xxxxxxxx využívané xxxxxxxx desítkami xx xxxxxxxx xxxxxxx). Xxxxxxxxxx xxxxxxxx HW xxxxxxxx xxxxxxx x xxxx x xxxxxxxxxxx s xxxxxxxxxx prvky xx xxxx xxxxx zejména xxxxxxx xxxxxxxxxxxx xxxxxxx (xxxxx xxxxx xxxxxxxx xxxxxxxxx, xxxx pracovišť xxxxxx, xxxxxx na xxxxxxx x xx xxxxxxx na oddělení), xxxxx xxxxx x xxxxxxxxx personálním xxxxxxxx x důvodu xxxxxxx xxxxxxxx (xxxxx způsobu xxxxx, xxxxxxxxx xxxxxxx xxxxxxxxxxxx balení xxx xxxxxx, komunikace s xxxxxxxxxx a Xxxxxxx x xxxxxxx nemožnosti xxxxxx jedinečný xxxxxxxxxxxxx).
Xxxxxxxx x xxxx xxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxx náklady provozovatelů xxxxxxx, Česká xxxxxxxxxx xxxxxx xxxxxxxxx vyčíslila xxxxx xxxxxxx xxxxxxx x souvislosti x xxxxxxxxxx ochranných xxxxx xx obalech léčivých xxxxxxxxx na xxxxxx 500 mil. Kč. X xxxx částce xxxx však zahrnuty xxxxx xxxx xxxxxxxxx x další položky, xxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxxx (xxxxxxx xx xxxxxxx zaměstnanců, xxxxx xxxxxx náročnost xxxxxx - xxxxx xxxxx xxxxxxxxxxxx pacientů), xxxxxxxxx xxxxxxx xxxxx s xxxxxx mírou xxxxxxxxxxxxxxxx xxxxx.
Xxxxxxxx ke xxxxxxxxxxx, xx xx 9.2.2019 xxxxx xx xxxx xxxxxxxx xxxxxx přípravky, xxxxx xxxxxxx opatřeny xxxxxxxxxx prvky x xxxxx byly xxxxxxxxxx x prodeji xxxx xxxxxxxxxx před nabytím xxxxxxxxx xxxxxx xxxxxx, xxxxxxxx xxxxxxxxxxxx x xxxxxx xxxxxx jistoty xxxxxxxx xxxxxx xxxxx xx xxxxxxxx x xxxxxxx x xxxxxxxxx x ochranných prvcích xxxxxxxxxxxx do zákona xxxxxxxxx ustanovení, které xxxxxxx na xxxxx, xx tyto xxxxx xxx xxxxxxx, distribuovány x vydávány až xx xxxxxxxx xxxx xxxxxx xxxxxxxxxxxxx.
Xxxxx současné xxxxxx xxxxxx mohou x některých případech xxxxxx (xxxx. xxxx xxxxxxxxxxxx pracovníci) xxxxxxxxxxxxx xxxxxxxxxxxxxx zařízení xxxxxxx xxxxxx xxxxxxxxx (x xxxxxxx s xxxxxxxxxxx §82 odst. 2 xxxxxx x léčivech). Xxxxxxxx x xxxx, xx xxxxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxx léčivé xxxxxxxxx, xxxxx xxxxx xxxxx xxx opatřeny xxxxxxxxxx xxxxx, xxxx se xxxx na ně xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxx a xxxxxxx jedinečný xxxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxx. Xxx xxxx xxxxx zachovat stávající xxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxx, x xx xxxxx do xxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx, x xxxxxx xxxxxxxx xxxxxxxx xxxx x xxxxxxxxx, xx xxxxxxx, xxxxxxx xxxxxxxxxx xxxxxxxxxxx x nařízení x xxxxxxxxxx xxxxxxx xx xxxxxxxxxxxx imunologických xxxxxxxxx x xxxxxxxx xxxxxx 23 písm. x) xxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxxxxxx xxxxxx xxxxxxxx 2011/62/EU a nařízení x xxxxxxxxxx xxxxxxx xxxx xxxxxxxxx Xxxxxxxxx xxxxxx (EK) x xxxxxxx s požadavkem xxxxxxxx 2011/62/EU, xxxxx xxxxxxxxxx xxx xxxxxxxx XX přehodnocení xx xxxxxxxxxxx dopadu xxxxxxxx XX xxx oblast xxxxxxxxxx prvků u xxxxxxxx xxxxxxxxx.&xxxx; Xxxxx xxx x xxxxxxx x držitele xxxxxxxxxx x registraci, xxxxx x xxxxx xxxxxx xxxxxxx se xxxxxxxx x správou xxxxxxx xxxxxxx. Xxxx xxxxxxxx xxxx podle xxxxxx 54x odst. 2 xxxx. e) směrnice 2011/62/XX xxxxxxx nést xxxx xxxxxxx náklady xx xxxxxx xxxxxxx. Xxxx xxxxxx se xxxx nyní xxxxxxx xxxxxxxx xxxxxxxxxxxxx, xxxxx xxxx xxxxxxx zejména xx xxxxx, xxxxxxxxx x načasování xxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx. Členské xxxxx, xxx xxxxxxxxx xxxxxxx regulační xxxxxxxx, xxxxxx stanoveny xxxxxxxx 2011/62/EU a ani xxxxxxxxx x ochranných xxxxxxx kompetence, xxxxxxx xx mohly xxxxxxxx xxxxxxx x xxxxxxxxxx x xxxxxxx xxxxxxx x xxx pádem xxxxxxxx míru x xxxxxx dopadu xx xxxx xxxxxxxx. Posouzení xxxxxx na xxxxxxxxxxxxx xxxxxxxxx bylo i x xxxxx xxxxxxx xxxxxxxxx XX x xxxxxxxxxx xx xxxxxxxx 2011/62/EU. Tyto xxxxxx xxx xxxx posouzeny xxx projednávání těchto xxxxxxxx předpisů, tj. xxxxxxxx 2011/62/EU x xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx xxx x xxxxxx xxxxxxxx, x xxxxxx č. 70/2013 Sb., xxxxx xxx x xxxxxx xxxxxxxx Xxxxx xxxxxxxxx. X tomto xxxxx je třeba xxxxxxx xx xxxxxxxxx xxxxxx, xxxxxx xxxxxx x xxxxxxxxx xxxxxx xxxxxxxx (XXX) k xxxxxx č. 70/2013 Sb., a xxxx xx xxxxxxxxx xxxxxx XXX x xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx „Xxxxxx Xxxxxxxxxx“. Od xxxxxxxxx xxxxxx hodnocení nebyla xxxxxxxx xxxxx x xxxx xxxxxx x xxxxxxx.
Xxxxxxxx xxxxx xxxxxxxxxx xxxxxx xx xxxxxxxxxxxxx xxxxxxxx z xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxxx, xxxxx údaje xxxxxxxxxx xx k xxxxxxxxxxx xxxxxxxxxxxxxx xxx xxxxxx xx textu obalu x xxxxx xxxxxxxxxx xxxxxx x dopadem xx informace x xxxxxxxxx - xxxx. xxxxxx x prodloužení xxxxxxxxx registrace, xxxxxx x změně xxxxxxxxxx xxxx II, xxxx XX nebo xxxx XX. Xxxxxxxxxx xxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxx x situaci, xxxxx x přechodném xxxxxx xxxxxx předložena xxxxx xxxxx registrace, xxxxx xxxxxxx xxxxxxxxx o xxxxxxxxx. Xxxxxxxxxx žádosti x xxxxx xxxxxxxxxx xxx xxxxxxxx xxxxxxxxxx x ověření xxxxxxxxxx x xxxxxx je xxx nezbytné xxxxx x xxxxxxx, xxx xxxxxxxxxx k xxxxxxx xxxxxxxxxx x xxxxxx xxxx mít xxxx xx xxxxxxxxx xxxxx, xxxx xxxxxxx systém xxxxxxxx xxxxx. Xxxx xxxx stanoveno, xx xxxxxxxxx identifikátor x xxxxxxxxxx x xxxxxxx xxxxxxxxxx s obalem xx možné xxxxxxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx žádosti x xxxxx xxxxxxxxxx, xxxxx xxxxxxxxxxxx ochranných xxxxx na obal xxxx vliv na xxxxxxxxx xxxxx.
Xxx xxxxx x xxxxxxxx 2018 xxxx xxxxxxxx xxx 2/3 xxxxxxx x xxxxx registrace, xxxxx xxxxxxxxxx xxxxxxxxxxxxx body xxxxxxxx xx xxxxxxxx 2011/62/EU. Xxxxx xx xxxxxxxxxxxxx xxxxxxxx x xxxxxxx finanční x x xxxxxxx xxxxxxxxxxxx xxxx xx vyřízení xxxxxxxxxxxx žádostí xxxx xxxxxxxxx, xxxxxxxx k xxxx xxxxxxx xxxxxxxxxxx, xxx pro většinu xxxxxxxx xxxxxxxxx xxxxxx xxxxx xx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxx x xxxxx xxxxxxxxxx x xxxxxxxx xxxxx xx xxxxx implementovat již xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx. Xxxxxx implementace xxxxx xxxxx xxx léčivé xxxxxxxxx, které xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, x xxxxxxxx xxxxxxxxx, xxxxx ochrannými xxxxx xxxxxxxx být xxxxxx (xxxx. xxxxxx xxxxxxxxx, jejichž xxxxx xxxx xxxxx na xxxxxxxx xxxxxxx) xxxxx xxxxxxxxx xxxxxxxxxxxx xx xxxxxx textu „neuplatní xx“ při xxxxxxxxx xxxxxx xxxxx xxxxxxxx xx xxxxxxxxx o xxxxxxxxx.
3. 3 Xxxxxxx
Xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxx dotvoření xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx předpokladů xxx xxxxxxxxx vstupu xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského xxxxxxx x xxxxxxx ochrany xxxxxxxx x osob xxxxxxxxxx x distribučním xxxxxxx před léčivými xxxxxxxxx, které pocházejí x nelegálních xxxxxx. Xxxxxxxxxx xxxxxx úprava xxxx mít xx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx x xxx xxxxxxxx, že xxxxxxxx xx zvýšení xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx a xx svých důsledcích x x xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx od padělaných xxxxxxxx xxxxxxxxx. Mělo xx xxxx dojít xx xxxxxxx xxxxxx xxxxxxx, distributorů x xxxxxxx, xxxxx padělané xxxxxx xxxx xxxxxxxxxxx xx trhu xxxx x xxxxxxx xxxxxxxxx xxxxx snižují.
Aby xx xxxxxxxxxxxxxx xxxxxx, xx xx xxxxxxxx léčivé xxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxx xxxxxxxx xx xxxxx území Xxxx, xxxxx xx xxxxxx xxxxxxx v xxxxxxxx výdeje xxxxxxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx v xxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxx (xx. x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx jiným xxxxxxxxxxxxx).
Xxxxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxxx (xxxxxxx xxx přípravku, xxxxx xxxxx a datum xxxxxxxxxxxxx) xxxxxxxx x xxxxxxxxxxx pacientů tím, xx usnadní postupy xxx xxxxxxx x xxxxxxx x farmakovigilanci.
Ověřování xxxxxxxx xxxxxxxx přípravků x XX xx xxxxxx xxxxxxx, xxxxxxxxxxxx x xxxx oprávněných x xxxxxx (lékáren) xx xxxx xxxxx xxxxxxxx vstupu xxxxxxxxxx xxxxxxxx přípravků do xxxxxxxxx xxxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx výdeje xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x lékárnách x xxx xxxxxx xxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx xxxxxxx xxxxxx zákona xx xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx v XX.
4. Xxxxxxxxx xxxxxx variant x xxxxx xxxxxxxxxxxxxx xxxxxx
Xxxxxxxxx doporučenou x xxxxxxx xxxxxx je xxxxxxxx 2, xxxx xxxxxxxxxx xxxxxx novely xxxxxx o xxxxxxxx, xxxxxxx naplňuje cílový xxxx a splňuje xxxxxxxx nastavená nařízením x xxxxxxxxxx xxxxxxx x tomu, xxx x xxxx Xxxxxxxx xxxx xxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xx xxxxxx xxxxx, xxxxx by xxx xxxxxxxx vstupu xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx dodavatelského xxxxxxx x xxxxxxx xxx x xxxxx míře xxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx 1 (xxxxxx) je x důvodů xxxxxxxxx xxxx xxxxxxxxxxxx a xxxxx xxxxx varianta xxx x xxxxxx xxxx xxxxxxxxx xx xxxxx, xxxxxxx xxx x xxxxxxxx přímo xxxxxxxxxxxx xxxxxxxx Evropské xxxx x možnosti xxxxxxxxx xxxxx x xxxx xxxxxxx, x xxx x xxx xxxxxxx xxxxxxxx xxxxxxx, xxxx striktně xxxxxxx xxx na xx xxxxxxx, xx kterých xx xx tento xxxxx xxxxxxxxxx xxxxxxx Xxxxxxxx xxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxx.
5. Xxxxxxxxxxxx doporučené xxxxxxxx x xxxxxxxxxx
Xxxxxxx xxxxxxxxxx za implementaci xxxxxxxxxx xxxxxxxx xxxxxx xxxx především Xxxxx, xxxxx je xxx xxxxx stávajícího xxxxx xxxxxx o xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx xxxxx. Xxxxx má xxxxxxx xxxx xxxx xxxxxxx xxxxxxxxxx v xxxxxxx xxxxxxx, xxxxxxxxx x xxxxxxxxxxx humánních xxxxx, x xx x xx vztahu k xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx x Evropské xxxx.
Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxx o xxxxxxxx v xxxxx xxxxxxxxx xxxxxxxx v xxxxxxx x xxxxxxx xxxxxx xxxxxxx přestupků, x xx xxxxxxxxx xxxxx a xxxxxxx xxxxx xxxxxx.
6. Xxxxxxx xxxxxxxxx regulace
Účinnost xxxx xxxxxx xxxxxx xxxx xxxxxxxx xx xxxxxxxx xxxxxxx 2 xxx xxx xxx xxxxxx xxxx xxxxxxxxx, aby xxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx a xxxxxxxxx xxxxxxxxx, jaké xx právní úprava xxxxxxxxx xxxxxx, xx. xxx xxxxx x xxxxxxxxx přítomnosti xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxx xxxxxxx x XX x x tranzitu. Přezkum xxxxxxxxx xxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Xxxxxx ústav xxx xxxxxxxx xxxxx ve xxxxxxxxxx x xxxxxxxxx xxxxxxxx, a xx x hlediska xxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxx xxxxx xxxxxx xxxxxxx.
7. Xxxxxxxxxx x xxxxxx dat
Návrh xxxxxx xxx x xxxxxxx xxxxxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx přípravků, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravků, xxxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxxx k xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx. Xxxxx zástupcům xxx x xxxxxxxxx 2016 xxxxxx xxxxxxx xxxxxxxx xxxxx novely xxxxxx x xxx, že x xxxx xxxxx xxxxxxxx xxxxxxxxxx. X xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxxx xx xxx v xxxxxxxx 2016 uskutečnilo xxxxxx xxxxxxx x xxxxxx Ústavu. Xxxx xxxx xxxxxxxxxxx xxxxxxxxxx xxxx v xxxxxxxxx xxxxxx xxxxxxxxxx a xxxxxx akceptováním došlo xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx a x xxxx xxxxxxxxxx k xxxxxxxxx potřebám současné xxxxx. Xxxx xxxxxxxxxxxx xxxxxxx takové xxxxxxxxx xxxxxxxxxx připomínek xxxx xxxxxxx připomínka, xxx xxx přidělený Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx xxxxx §32 xxxx. 5 zákona x léčivech („xxx XXXX“) xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx. Xxxx xxxxxxxxx jednání x xxxxxx xxxxxxxxxx materiálů xx xxxxxxxx Armády Xxxxx xxxxxxxxx x Xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx biopreparátů x xxxxx, x xx xxxxxxx xx xxxxxx nalezení co xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx 23 xxxxxxxx x xxxxxxxxxx xxxxxxx.
8. Xxxxxxxx xx zpracovatele RIA
Útvar: Xxxxxxxxxxxx xxxxxxxxxxxxx, Xxxxx xxxxxxxx, xxxxxxxx xxxxxxxx, xxxxxxxxxxxx: XxxxxXx. Alena Xxxxxxxxx, ředitelka xxxxxx xxxxxxxx, xxxxxxxxxxxx: PharmDr. Xxxxx Xxxxxxxxx, vedoucí xxxxxxxx xxxxxxxx, Mgr. Xxxxxxxxx Xxxxxxxxxx, xxxxxxxx, Xxx. Xxxxxx Xüxxxx, xxxxxxxx.
X-xxxx: xxxxx.xxxxxxxxx@xxxx.xx
Xxxxxx xxxxx xxx xxxxxxxx léčiv, xxxxx xxxxxx, Mgr. Xxxxxxx Xxxxxxxx, xxxxxxxxx Xxxxx dozoru
Telefon: 272 182 265
XXXXXXXXX XXXXXXX NÁVRHU XXXXXXXX XXXXXXXX ČR X XXXXXXXX XX
Xxxxxxxxx xxxxxxx x xxxxxx xxxxxx zákona, xxxxxx xx xxxx xxxxx x. 378/2007 Xx., x léčivech a x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x léčivech), ve xxxxx xxxxxxxxxx předpisů, x xxxxx č. 372/2011 Sb., x xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx jejich xxxxxxxxxxx (xxxxx x xxxxxxxxxxx xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx
|
Xxxxxxxxxx xxxxxx xxxxxxx (xxxx. xxxx xxxxxx předpis) |
Odpovídající xxxxxxx XX |
|
|
Xxxxxxxxxx (xxxx, §, xxxx., xxxx., xxxx.) |
Xxxxx x. |
Xxxxxxxxxx |
|
Xx. 2 |
||
|
Xx. 43, 44, Xx. 46 |
||
|
§13 odst. 2 písm. p) a q) (včetně poznámky pod čarou č. 107 a 108) |
Xx. 25, Čl. 7 xxxx. 1 x 2, Xx. 10 xxxx. 1 věta xxxxx, Čl. 94 xxxx. 1 |
|
|
32017L1572, 32017L1572, 32017R1569, 32017R1569, 32017R0556, 32017R0556 |
Xx. 3 odst. 1, Čl. 3 xxxx. 3, Čl. 21 xxxx. 4, Xx. 22, Čl. 3 xxxx. 1, Xx. 4 odst. 8 |
|
|
Xx. 4 |
||
|
Xx. 1 xxxx. x) x x), Čl. X xxx 12 |
||
|
Xx. 45 |
||
|
Xx. 42 |
||
|
Čl. 11 xxxx. 1 |
||
|
Xx. 13 xxxx. 1 x 2 |
||
|
Xx. 4 odst. 1 |
||
|
Xx. 23 |
||
|
Xx. 25 xxxx. 1 |
||
|
Xx. 39 |
||
|
Xx. 10 a 11 |
||
|
Xx. 12 |
||
|
Xx. 13 |
||
|
Xx. 4 |
||
|
Xx. 5 xxxx. 1 |
||
|
Xx. 6 |
||
|
Xx. 7 |
||
|
Xx. 14 |
||
|
Čl. 15 |
||
|
Xx. 16 |
||
|
Xx. 18 |
||
|
Čl. 9 |
||
|
Xx. 20 |
||
|
Xx. 22 |
||
|
Čl. 24 |
||
|
Xx. 23 |
||
|
Čl. 23 |
||
|
Čl. 25 xxxx. 1 x 2 |
||
|
Xx. 28 |
||
|
Čl. 29 |
||
|
Xx. 25 xxxx. 4 |
||
|
Xx. 30 |
||
|
Xx. 25 xxxx. 1 |
||
|
Čl. 33 xxxx. 1 |
||
|
Xx. 40 |
||
|
Čl. 42 |
||
|
Xx. 33 xxxx. 4 |
||
|
Xx. 37 |
||
|
Xx. 39 |
||
|
Xx. 35 odst. 1 x 2 |
||
|
Xx. 32 xxxx. 3 a 4 |
||
|
Xx. 32 xxxx. 1 |
||
|
Xx. 35 xxxx. 3 |
||
|
Xx. 35 xxxx. 4 |
||
|
Xx. 41 |
||
|
Xx. 63 xxxx. 1, Xx. 94 xxxx. 1, Xx. 20 bod 2 |
||
|
Čl. 10 bod 2 xx 5 |
||
|
Xx. 4, Xx. 45, Xx. X xxx 12, Čl. X xxx 25 |
||
|
Xx. 94 xxxx. 1, Xx. 62 xxx 1 |
||
|
Xx. 4, Xx. 45, Čl. X bod 12, Xx. I xxx 25 |
||
|
Xx. 10 xxxx. 8 |
||
|
Xxxxx předpisu XX (xxx xxxxx) |
Xxxxx xxxxxxxx XX |
|
XXXXXXXX XXXXXX V XXXXXXXXX PRAVOMOCI (EU) 2016/161 xx xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2001/83/ES xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx ochranné xxxxx xxxxxxx xx obalu xxxxxxxxx xxxxxxxx xxxxxxxxx |
|
|
Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2011/62/XX xx xxx 8. xxxxxx 2011, xxxxxx se xxxx xxxxxxxx 2001/83/XX x xxxxxx Společenství xxxxxxxxx xx humánních xxxxxxxx přípravků, pokud xxx x zabránění xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce |
|
|
Směrnice Komise (XX) 2017/1572 xx xxx 15. září 2017, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx x xxxxxx x xxxxxx xxx správnou xxxxxxx xxxxx pro xxxxxxx xxxxxx přípravky |
|
|
Prováděcí xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) x. 2017/556 xx xxx 24 xxxxxx 2017&xxxx; x xxxxxxxxxx xxxxxxxxxx xxx provádění xxxxxxxxxxx xxxxxxx správné xxxxxxxx xxxxx&xxxx; xxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady (EU) x. 536/2014 |
|
|
Xxxxxxxx Xxxxxx x xxxxxxxxx pravomoci (XX) x. 2017/1569 xx xxx 23. xxxxxx 2017, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) x.536/2014 xxxxxxxxxx xxxxx x xxxxxx pro správnou xxxxxxx xxxxx xxx xxxxxxxxx humánní léčivé xxxxxxxxx a xxxxxxxx xxxxxxxxx xxxxxxxx |
|
|
Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady XX x. 536/2014 xx xxx 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx 2001/20/XX |
Zdroj xxxxx www.psp.cz


