Vládní návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů, a zákon č. 372/2011 Sb., o zdravotních službách a podmínkách jejich poskytování (zákon o zdravotních službách), ve znění pozdějších předpisů
262/0
Xxxxx
XXXXX
xx xxx … 2018,
xxxxxx xx xxxx xxxxx č. 378/2007 Sb., o xxxxxxxx x o xxxxxxx xxxxxxxxx souvisejících xxxxxx (xxxxx o xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx, x xxxxx č. 372/2011 Sb., x xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx poskytování (xxxxx o zdravotních xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx
Xxxxxxxxx xx xxxxxx na tomto xxxxxx České xxxxxxxxx:
XXXX XXXXX
Xxxxx zákona x xxxxxxxx
Xx. X
Xxxxx č. 378/2007 Sb., x léčivech a x změnách některých xxxxxxxxxxxxx zákonů (xxxxx x xxxxxxxx), xx xxxxx zákona x. 124/2008 Xx., xxxxxx x. 296/2008 Sb., xxxxxx x. 141/2009 Xx., xxxxxx č. 281/2009 Xx., zákona x. 291/2009 Xx., xxxxxx č. 75/2011 Xx., xxxxxx x. 375/2011 Xx., xxxxxx x. 50/2013 Xx., xxxxxx x. 70/2013 Xx., zákona č. 250/2014 Xx., xxxxxx x. 80/2015 Xx., xxxxxx x. 243/2016 Xx., xxxxxx x. 65/2017 Xx., xxxxxx x. 66/2017 Xx., xxxxxx č. 183/2017 Xx., xxxxxx č. 251/2017 Xx. x xxxxxx č. 36/2018 Xx., xx xxxx xxxxx:
1. Na xxxxx xxxxxxxx xxx xxxxx x. 2 se xx xxxxxxxxxx xxxxx xxxxxxxx xxxx „Nařízení Xxxxxx x přenesené xxxxxxxxx (EU) 2016/161 xx xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx přípravků.“.
2. V §5 xxxxxxxx 7 zní:
„(7) Xxxxxxxx vyhrazených xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxx xxxxx, xxxxxxxxxx xxxx prodej. Xxxxxxxx xxxxxxxxxxx veterinárních xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxx xxxxx, xxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxxxxx.“.
3. X §6 xx xx xxxxx xxxxxxxx 2 xxxxxxxx xxxx „X případě xxxxxxxxx a xxxxxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxx xxxxxxx xxxxxxx xxxxx použijí obdobně xx xxxxx ze xxxxxxx xxxx.“.
XXXXX: 32017L1572
4. V §13 xxxx. 2 xx xx xxxxx textu xxxxxxx x) xxxxxxxx xxxxx „x xxxxx xxxxxxxxxxxx xxxxxxxx Evropské xxxx upravujících xxxxxx xxxxxxxxx xxxxx“.
5. X §13 xx na xxxxx xxxxxxxx 2 xxxxx xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x), xxxxx xxxxxx xxxxxxxx pod xxxxx x. 106 xxx:
„x) xx příslušným xxxxxxx Xxxxx xxxxxxxxx xxx xxxxxx xxxxxx xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxx xxx ochranné xxxxx xxxxxxx xx xxxxx léčivých přípravků, xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxx xxxxxxxxxxx podrobná xxxxxxxx pro xxxxxxxx xxxxx xxxxxxx na xxxxx humánních léčivých xxxxxxxxx106) (xxxx xxx „xxxxxxxx o ochranných xxxxxxx“), má přístup xx xxxxxxx xxxxxxx x x xxxxxxxxxx x xxxx obsaženým x xxxxxxx x xx. 39 xxxxxxxx x xxxxxxxxxx xxxxxxx, x xxxxxxxx xxxxxxxx xxxxxxxxx tohoto xxxxxxx, xxxxxxx a xxxxxxxxxxx xxxxxx padělání x xxxxxxxx přípravků x xxxxxx xxxxxxxx x xxxxxx xxxxxxxx a xxxxxx v této xxxxxxx xxxxxxxxx Komisi.
CELEX: 32016R0161
6. X §13 xx xx konci xxxxxxxx 2 xxxxx xxxxxxxxx čárkou a xxxxxxxx se písmena x) a x), xxxxx včetně poznámek xxx xxxxx x. 107 x 108 xxxxx:
x) je xxxxxxxxxx xxxxxxx České republiky xxx xxxxxx úkolů xxxxxxxxxxx xxxxx použitelným xxxxxxxxx Evropské xxxx, xxxxxx xx xxxxxxx xxxxxx x xxxxxx xxx správnou xxxxxxx xxxxx pro xxxxxxxxx xxxxxx přípravky107) (xxxx xxx „xxxxxxxx x xxxxxxx výrobní praxi xxx hodnocené léčivé xxxxxxxxx“) x xxxxx xxxxxxxxxxx předpisem Xxxxxxxx xxxx, kterým xx xxxxxxx xxxxxxxx provádění xxxxxxxxxxx postupů správné xxxxxxxx praxe108) (xxxx xxx „xxxxxxxx x xxxxxxxxx inspekčních xxxxxxx xxxxxxx xxxxxxxx xxxxx“),
x) xx xxxxxxxxxx orgánem Xxxxx republiky xxx xxxxxxxx xxxxxxxx x xxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx přípravků xxxxx xxxxxxxx o xxxxxxxxx xxxxxxxxx.
XXXXX: 32017R1569, 32017R0556, 32014R0536
7. X §13 xxxx. 3 písmeno x) xxx:
„x) xxxxxx x xxxxxxx xxxxxx xxxxxxx, který xxxxxxxxx
1. xxxxxx xxxxxxx x xxxxxxxxxxx x odborné xxxxxxxx xxxxxxxxxxx Xxxxxx, xxxxx provádí xxxxxxxxx x xxxxxxxx x xxxxxxxxx podle xxxxxx xxxxxx xxxx xxxxx xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx, xxxxxx popisu xxxx xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxxxx na xxxxxxxx xxxxxxxx,
2. xxxxxxxxxx xxxxxxxx inspekčních xxxxxxx xxxxxxx klinické xxxxx x souladu s xxxxxxxxx o provádění xxxxxxxxxxx xxxxxxx správné xxxxxxxx xxxxx,
3. xxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxx a xxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx x xxxxxxx xxxxxxxxx léčivých xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx,“.
XXXXX: 32017L1572, 32017R1569, 32017R0556
8. V §16 xxxx. 3 xxxx. x) xx xxxxx „xxxxxxx“ nahrazuje xxxxxx „xxxxxxx“.
9. V §22 xxxx. 2 xx xx xxxxx „xxxxxxxxx“ xxxxxxxx slova „veterinárních xxxxxxxx xxxxxxxxx“.
10. V §23 xx na xxxxx xxxxxxxx 1 tečka xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x) až x), xxxxx znějí:
„f) xxxxxxxxxx xxxxxxx Xxxxxx, jde-li x humánní léčivý xxxxxxxxx, xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxx, xxxxxxxxx-xx tato xxxx xxxxxxxxx x xxxxxxxx x ochranných xxxxxxx,
x) xxxxxxxxxx Xxxxxx xxxxxxxxxx xxx ověřování skutečností xxxxxxxxxxxxx x podezřením xx xxxxxxxx léčivého xxxxxxxxx,
x) xxxxxxxxxx xxxxxxx Xxxxxxxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx.“.
11. X §24 xxxx. 10 se xxxxx „jako deklarant“ xxxxxxx.
12. X §34 xx doplňuje odstavec 9, xxxxx xxx:
„(9) Xxxxx xxxx Veterinární xxxxx xxxxxxxxxx xxxxxx xxxxxx x moci xxxxxx x xxxxx xxxxxxxxxx léčivého xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx.“.
13. V §37 xxxx. 1 xx xx slova „xxxxxxxxxxxx xxxxxxxx xxxxxxxxx,“ vkládají xxxxx „nejde-li x xxxxxxxxx xxxxxxxxxxxxx,“, slova „xxxxxxxxx zbožovým xxxxx (XXX)“ se xxxxxxxxx xxxxx „mezinárodně uznávaným xxxxxxxxxxxxxx standardem“, xx xxxxx „zpracování“ se xxxxxxxx xxxxx „x xxxxxxxx xxxxxxxxxx standardního xxxxxxxxxx xxxxxxx“ a xx xxxx třetí xx xxxxxx xxxx „Xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx musí xxx xxxxxx kód xxxxxxxxx xxxxx §32 xxxx. 5.“.
14. X §37 xxxx. 7 xxxx xxxxx xx za xxxxx „ochranné xxxxx“ xxxxxxxx slova „podle xxxxxxxx x xxxxxxxxxx xxxxxxx“, xx xxxxx xxxxx xxxx xx xxxxxxxx xxxxx „(xxxx xxx „xxxxxxxx prvky“)“ x xxxx poslední xx xxxxxxxxx xxxxx „Xxxxxx a xxxxxxxxx xxxxxxxxxx ochranných xxxxx xxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx.“.
XXXXX: 32016R0161
15. V §37 xxxxxxxx 8 xxx:
„(8) Xxxxxxxxxx prvky xxxxx xxxxxxxx 7 musí xxx opatřeny xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxx xx lékařský xxxxxxx xxxx na xxxxxxxx xxxxxxx s xxxxxxxx, které nejsou xxxxxxx xx seznamu xxxxxxxx xxxxxxxxx, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, stanovené xxxxxxxx X xxxxxxxx x ochranných xxxxxxx. Xxxxxxxxxx prvky xxxxx xxxxxxxx 7 nesmějí xxx opatřeny humánní xxxxxx přípravky, xxxxx xxx xxxxxxx bez xxxxxxxxxx předpisu x xxxxx xxxxxx xxxxxxx xx seznamu xxxxxxxxxx xxxxxx přípravky, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx x příloze II xxxxxxxx x xxxxxxxxxx prvcích.“.
CELEX: 32016R0161
16. X §45 xx xx xxxxx xxxxxxxx 7 xxxxx xxxxxxxxx xxxxxx x xxxxxxxx xx xxxxxxx x), které zní:
„f) xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx x zařadit xxxx xxxxxxxxx identifikátor postupem xxxxx nařízení x xxxxxxxxxx xxxxxxx.“.
XXXXX: 32016R0161
17. V §64 xxxxxxx d) xxx:
„x) xxxxxxxx a xxxxxxxx xxxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx podmínky xxx xxxxxxx xxxxxx xxxxxxxx xxxxxxx xxx, xxx tento útvar, xxxxx je v xxxxxxxxx xxxxx xxxxxxx x xxxxxxx e), xxx xxxxxxxxx xx xxxxxx organizačních xxxxxxxx xxxxxxx xxxxxxxx přípravků,“.
CELEX: 32017L1572
18. X §64 xxxx. x) xx xx slovo „xxxxxxxx“ xxxxxxxx slova „xxxxxxx x“ a slova „x agenturu“ se xxxxxxxxx slovy „, xxxxxxxx x xxxxxxxx xxxxxxxxxx x registraci, x xxxxx xxx, xxxxx je to xxxxx, xxxx, xxx xxxxx xxx xxxxxx xxxxxxxxx určen; x xxxxxxx xxxxxx hodnocených xxxxxxxxx léčivých xxxxxxxxx xx použijí xxxxxxxx xxxxxxxxx nařízením o xxxxxxx xxxxxxx xxxxx xxx hodnocené xxxxxx xxxxxxxxx“.
XXXXX: 32017L1572
19. V §64 xxxx. x) xx xxxxx „vykonávat činnost x souladu x xxxxxxxxx x výrobě, xxxxxxxxx pravidla xxxxxxx xxxxxxx xxxxx“ xxxxxxxxx xxxxx „xxxxxxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxx xxxxxxx xxxxx, x xxxxxxxxx x výrobě“.
CELEX: 32017L1572
20. V §77 xxxx. 1 xxxx. x) bodě 4 xx číslo „13“ xxxxxxxxx xxxxxx „12“.
21. X §77 xxxx. 1 xxxx. x) se bod 5 zrušuje.
Dosavadní xxxx 6 xx 14 xx xxxxxxxx jako xxxx 5 xx 13.
22. X §77 xxxx. 1 písm. x) bod 11 xxx:
„11. krevním xxxxxx, xxx-xx x xxxxxxxxxx xxxxxxxxx, zařízením xxxxxxxxxx xxxxxx, jde-li x xxxxxxxxxx xxxxxxxxx a xxxxxx deriváty, xxxxx xx xxxxxx distribuce xxxxxxxxxxxx přípravků xxxxxx xxxxxxxxx xxxxxxxxxx služby xxxxx §67 odst. 3,“.
23. X §77 xxxx. 1 xxxx. x) xxxx 12 xx xx xxxxx „xx xxxxxx“ vkládají xxxxx „xxxxxxxxxxxx, xxxxxxxxxxx x zvláštního xxxxxxxx xxxxx xxxxxx x xxxxxxx veřejného xxxxxx x xxxxxxxxxxx“ x xx xxxxx „očkování“ xx vkládají xxxxx „xxxxxxxxx podle xxxxxx x veřejném xxxxxxxxxx xxxxxxxxx“.
24. X §77 xx xx xxxxx xxxxxxxx 1 tečka xxxxxxxxx čárkou x xxxxxxxx xx xxxxxxx x), xxxxx xxx:
„x) xxxxxx xxxxxxxx xxxxx x xxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx postupem xxxxx xxxxxxxx x xxxxxxxxxx prvcích xxxx xxx, než xxxxxx xxxxxxxxx dodá
1. xxxxxxxxxxxx xxxxxxx,
2. Armádě Xxxxx xxxxxxxxx x zabezpečení xxxxxxxxxxx sil Xxxxx xxxxxxxxx xxxxxx x x udržování skladových xxxxx léčivých přípravků xxx xxxxx zabezpečení xxxxxxxxxxx xxx České xxxxxxxxx léčivy xxx xxxxxx vysílání xx xxxxxxxxx podle §111a, xxxx
3. xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxx jsou xxxxx §77 odst. 1 písm. c) xxxx 12 xxxxxxxx xxxxxxxxxxxx léčivé přípravky xxx účely xxxxxxxxxxxx xxxxxxxx xx základě xxxxxxx smlouvy distributora xx zdravotní xxxxxxxxxxx xxxx xxx účely xxxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxx očkování na xxxxxxx rámcové xxxxxxx xxxxxxxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx anebo jsou xxxx přípravky dodávány xxx účely nepovinného xxxxxxxxx xxxxxxxx x xxxxx xxxxxxxxxxx xxxx xxxxx zákona x xxxxxxxx zdravotním pojištění7).“.
CELEX: 32016R0161
25. V §80 xxxx. 4 se xxxxx „Xxxxxxxxxxx léčivé xxxxxxxxx“ nahrazují slovy „Xxxxxx xxxxxxxxx xxx xxxxx xxxxxx“.
26. X §82 xxxx. 2 xx xxxxxxx x) zrušuje.
Dosavadní xxxxxxx x) až x) xx xxxxxxxx xxxx xxxxxxx x) xx x).
27. V §82 xx xx xxxxx xxxxxxxx 3 xxxxx xxxxxxxxx čárkou x xxxxxxxx se písmeno x), které zní:
„i) xxxxx ochranné xxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru x xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx postupem xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx.“.
XXXXX: 32016R0161
28. V §99 xx doplňují odstavce 7 x 8, xxxxx xxxxx:
„(7) Xxxxx xx vyžádání poskytuje xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx článku 31 xxxxxxxx x xxxxxxxxxx xxxxxxx (xxxx xxx „xxxxxxxx“) xxxxxxxxx, které xxxxxxxxx x výkonu xxxx xxxxxxxxxx a xxxx xxxxxxxx xxx xxxxxxxxx xxxxxx úložiště.
(8) Xxxxx xxxxxxxxx z xxxxxxxx, xxxxx xxxxx xxxx x nimž xx xxxxxxx podle §13 xxxx. 2 xxxx. x), xxxxxxxxx xxxxxx xxxxxx, pouze xxxxx xxx xxxxxxx jiný xxxxxx xxxxxxx, x xxxxxxxx xxxxxx x xxxxxxxxx přístupu k xxxxxxxxxx.“.
XXXXX: 32016R0161
29. X §100 xxxx. 8 úvodní xxxxx ustanovení se xx xxxxx „Ústav“ xxxxxxxx slova „xxxx Xxxxxxxxxxx ústav xxxxx xxxxxxxxxx“.
30. V §100x xx slovo „padělek“ xxxxxxxxx slovy „xxxxxxxx xxxxxx přípravek“.
31. V §103 xxxx. 6 xx xx xxxxx xxxxxxx x) xxxxx „xxxx“ xxxxxxx.
32. X §103 xx xx konci xxxxxxxx 6 tečka xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x) xx k), xxxxx xxxxx:
„x) xxxxxx xxxxxxxxx xxxxxxxxx xxxxxx Xxxxxx xxxx xxxxxxxx xxxxx §23 odst. 1 xxxx. x),
x) xxxxxxxxxx neoznámí Xxxxxx xxxxxxxxx na xxxxxxxx xxxxxx xxxxxxxxx podle §23 xxxx. 1 xxxx. x) nebo x),
x) v rozporu x xxxxxxxxx o xxxxxxxxxx xxxxxxx xxxx xxxxx zákonem
1. xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx,
2. distribuuje xxxx vydá xxxxxx xxxxxxxxx s xxxxxxxxxx xxxxxxxxxxxxxxx, xxxxx xxx xxxxxxx, xxxx xxx x xxxxxxx xxxxxxxxx x čl. 12 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxx tak je xxxxxxxx xxxxxx,
3. změní xxxxxx vyřazeného xxxxxxxxxxx xxxxxxxxxxxxxx na xxxxxxx, xxxx xxxx k xxxx splněny xxxxxxxx xxxxxxxxx x čl. 13 xxxx 1 xxxxxxxx x ochranných prvcích, xxxx
4. xxxxx xx xxxxxxxxxx xxxxx léčivý xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxxxx, xxxxxxx xxx xxxxxxxxx xxxxxxxx stanovených x čl. 13 xxxx 2 xxxxxxxx x xxxxxxxxxx prvcích xxxxxx xxx xxxxxx xxxxxxx xxxxxx, nebo
k) xxxxxxxxxx Xxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx souvisejících x xxxxxxxxxx na xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx §23 xxxx. 1 xxxx. x).“.
XXXXX: 32016R0161
33. V §103 xx doplňují xxxxxxxx 15 xx 21, xxxxx xxxxx:
„(15) Xxxxxxx xxxxxxxx přípravků se xxxxxxx xxxxxxxxx xxx, xx x xxxxxxx x nařízením o xxxxxxxxxx xxxxxxx xxxx xxxxx zákonem
a) xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxx jedinečný xxxxxxxxxxxxx xxxx xxx na xxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxx xx xxxxxxxx stanovené xxxxxxxxx xxxxxxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx do xxxxxxxxxxxxxx čárového xxxx,
x) xxxx xxxxxxx xxxxxxx xxxxx, xxxxx nezaručí xxxxxxx xxxxxxxxx xxxxxx xxxxxx x xxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxx po xxxx 1 xxxx xx xxxxxxxx xxxx xxxxxxxxxxxxx xxxxxx, xxxx po xxxx 5 let xx xxxx, xxx xxxx xxxxxx propuštěno x xxxxxxx xxxx xxxxxxxxxx,
x) xxxxxxxxxx xx xxxx xxxxxxxx xxxxxxxxx xx formátu xxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx prvky xxxxxxxxxxx xxxxxxxxxxxxxx,
x) xxxxxxx, xxx-xx x xxxxxxx, který xxxxxxxx ochranné xxxxx, xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, že xxxxxxxxxxxx xxxxxx kód xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xx x souladu xx xxxxxxxxxxx požadavky čitelný xxxxxx xxxx x xxxxxxxx xxxxxxx xxxxxxxxx,
x) xxxxxx, jde-li x xxxxxxx, který xxxxxxxx xxxxxxxx xxxxx, záznamy x xxxxxx úkonu, xxxxx provede s xxxxxxxxxx identifikátorem xx xxxxxx léčivého přípravku xxxx xx tomto xxxxxxxxxxxxxx,
x) xxxx částečným xxxx xxxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxx neporušenost xxxxxxxxxx k xxxxxxx xxxxxxxxxx x obalem xxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx nebo xxx xxxxxxxx, pokud xxxx xxxxxxxx, xxxxx zcela xxxx zčásti odstraní xxxx xxxxxxxx xxxxxxxx xxxxx x xxxxxxx x §64a,
h) xxxxxxx xxxxxxxx prvky nebo xxxxxxxx jedinečný xxxxxxxxxxxxx xx xxxxxx léčivého xxxxxxxxx xxxx xxx, xxx ho xxxxxxx xxxx xxxxx označí, xxx xx xxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx léčivý xxxxxxxxx xxxx jako xxxxxxxxxxxx xxxxxxx léčivý xxxxxxxxx, xxx-xx x výrobce, xxxxx xx xxxxxxxx x xxxxxx xxxxx §62 xxxx. 1 xxxx povolení k xxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx přípravků xx Xxxxxxxx xxxx xxxxxxxxx x čl. 61 xxxxxxxx o xxxxxxxxx xxxxxxxxx,
x) při xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxx xxxxx xxxxxxx xxxxxxxxx stanovených v §64x xxxxxxx, xx xxxxx jde o xxx xxxxxxxxx x xxxxxxxxxxxx úhradové xxxxx xxxx jiné xxxxxxxxxxxx xxxxx identifikující xxxxxx xxxxxxxxx, xxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xx xxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, v xxxx xx být xxxxxx xxxxxxxxx xxxxxx na xxx, aby mohl xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx z xxxxxxxx xxxxxxxx x xxxxxxx,
x) xxxxx xxxxxx xxxxxxxxx xx xxx xxxx xxxxxxxx xxxxxxxxx Ústav x xxxxxxx, xx-xx xxxxx se xxxxxxxx, xx x xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx, nebo x xxxxxxx, že xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx, xx xxxxxxxxx xxxxx xxxx pravý, xxxx
x) xxxxx na obal xxxxxxxx xxxxxxxxx, xxxxx xxxx xxx xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxx xxx.
(16) Xxxxxxxxxxx xx dopustí přestupku xxx, že
a) x xxxxxxx x xxxxxxxxx x xxxxxxxxxx prvcích xxxx xxxxx xxxxxxx
1. xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx u xxxxxxxx xxxxxxxxx, xxxxx má xx xxxxxxxx držení x xxxxxxxxx xx xx xxxx určených x čl. 20 nařízení x xxxxxxxxxx xxxxxxx,
2. xxxxxxx xxxxxxx xxxx xxxxxxxxx xxxxxxxx jedinečného xxxxxxxxxxxxxx x xxxxxxxx xxxxxxxxx stanovených x čl. 22 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxx
3. xxxx nebo vyveze xxxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxxxx Xxxxx x xxxxxxx, xx-xx xxxxx xx xxxxxxxx, xx x xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx, xxxx v xxxxxxx, že xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx naznačuje, že xxxxxxxxx xxxxx xxxx xxxxx,
x) xxxxxx povinnost xxxxxx ochranné prvky xxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx §77 xxxx. 1 xxxx. x), nebo
c) xx xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 xxxx. 7 a xxxxxxxxx xxxxxxxx jedinečného xxxxxxxxxxxxxx xxxx léčivý xxxxxxxxx xxxx osobě xxx xxxxxx xxxxxxxx x §77 xxxx. 1 xxxx. x).
(17) Xxxxxxxxxxxx xxxxxxxxxxx xxxxxx oprávněný x výdeji xxxxxxxx xxxxxxxxx xx dopustí xxxxxxxxx xxx, že
a) x rozporu x xxxxxxxxx o xxxxxxxxxx xxxxxxx nebo xxxxx xxxxxxx
1. neověří xxxxxxxx xxxxx nebo xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx prvky, xxxxx xxxxxx, v xxxxxxxx xxxx xxxxxx, xxxx xxx xxxxxx xxxxxxxx xxxxxx xxx xxxxxx xx xxxxxxx xxxx xxx neučiní dodatečně x xxxxxxx xxxxxxx xxxxx čl. 29 nařízení x xxxxxxxxxx prvcích,
2. xxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx x stanovených x čl. 25 odst. 4 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxx
3. xxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx neuvědomí Xxxxx v xxxxxxx, xx-xx xxxxx se xxxxxxxx, že x xxxxxx léčivého xxxxxxxxx xxxx xxxxxxxxxxxx, xxxx x případě, xx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx přípravku xxxxxxxxx, xx xxxxxxxxx xxxxx xxxx xxxxx, nebo
b) xxxxxx xxxxxxxxx xxxxx §82 xxxx. 3 xxxx. i) xxxxxx xxxxxxxx xxxxx xxxx xxxxxxx jedinečný xxxxxxxxxxxxx, xx-xx léčivý xxxxxxxxx xxxxxxxxxx prvky xxxxxxx.
(18) Xxxxxxx xxxxxxxxxx x xxxxxxxxxx nebo, x xxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx jedinečným xxxxxxxxxxxxxxx xxx xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx v §64x, xxxxx odpovědná xx xxxxxxx těchto xxxxxxxx xxxxxxxxx xx xxx se xxxxxxx xxxxxxxxx tím, xx x xxxxxxx s xxxxxxxxx x ochranných xxxxxxx xxxx xxxxx xxxxxxx
x) nezajistí, xx xxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxx prvcích xx xxxxxxx xx xxxxxxx xxxxxxx xxxx xxx, xxx xxxx xxxxxx xxxxxxxxx propuštěn xxxxxxxx x prodeji xxxx xxxxxxxxxx, xxxx xx jsou tyto xxxxxxxxx xxxx aktualizovány,
b) xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx čl. 40 xxxxxxxx o xxxxxxxxxx xxxxxxx, xxxx
x) xxxxxxx xxxxxxxxx xxxxxxxxxxxxxx do xxxxxxx xxxxxxx xxxxx, xxx x něho xxxxxxxx, xxxxx jsou xxxxxxxx, starší jedinečné xxxxxxxxxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxxx a xxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxxxxxxxx, xxxxx xx xxxx nahrát.
(19) Xxxxx zřizující nebo xxxxxxxxxx úložiště, xxxxx xx xxxxxxxx xxxxxxx xxxxxxx, xx xxxxxxx xxxxxxxxx xxx, xx x xxxxxxx x xxxxxxxxx x ochranných xxxxxxx xxxx tímto xxxxxxx
x) xxxxxxxxxx xxxxxxxxx xxxxxxxxx v úložišti, xxxxx spravuje x xx něhož xxxx xxxxxxx nahrány, xx xxxx 1 xxxx xx uplynutí xxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxx xx xxxx 5 xxx xx xxxx, kdy xxx přípravek xxxxxxxxx x xxxxxxx xxxx xxxxxxxxxx,
x) xxxxxxxxx xxxxx xxxxxxxxx xxxxx čl. 37 xxxxxxxx x xxxxxxxxxx xxxxxxx,
x) xxxx osoba xxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx pravosti nebo xxxxxxxx jedinečných xxxxxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx xx xxx x Xxxxx xxxxxxxxx xxxxxxxxxx Xxxxxx přístup k xxxxxxxx x informacím x něm xxxxxxxxx xxx xxxxx xxxxxx xxxxx xxxxx nařízení x ochranných prvcích,
d) xxxxxxx xxxxxxxx pro xxxxxxxxx systému xxxxxxx xxxxxxxxx podle čl. 35 xxxx. 1 x 2 xxxxxxxx x xxxxxxxxxx xxxxxxx,
x) xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx x čl. 32 odst. 3 xxxx 4 xxxxxxxx x xxxxxxxxxx xxxxxxx,
x) nezajistí xxxxxxxxx xxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxx, xxxx
x) xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx kód xxxxxxxx přípravku x xxxxxxx xxxxx jako xxxx xxxxxxxxx xxxxxxxxxxxxx, xxxxx je v xxxxxxxx xxx xxxxxx.
(20) Xxxxx xxxxxxxxx za xxxxxxx xxxxxxxx xxxxxxxxx xx xxx xx xxxxxxx přestupku tím, xx v xxxxxxx x nařízením x xxxxxxxxxx xxxxxxx xxxx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx úložiště x xxxxx šarže xxxx xxxxxxx xxxxxx u xxxxx xxxxx xxxxxxxxxxx xxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx přípravků, xx xxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx.
(21) Držitel xxxxxxxxxx x xxxxxxxxxx, xxxxx xxxx léčivý xxxxxxxxx, xxxxx xx xxxxxxx xxxxxxxxxx prvky, xxxx xxxxxxxxx vzorek x xxxxxxx předpisem se xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxx51), xx xxxxxxx xxxxxxxxx tím, že xx x rozporu x xxxxxxxxx x xxxxxxxxxx xxxxxxx nebo xxxxx zákonem xxxxxxxx x xxxxxxx xxxxxxx xxxx xxxxxxxxx vzorek xxxx xxxxxxxxx xxxxxxxx xxxx jedinečného identifikátoru xxxx tím, xxx xx xxxxxxxx osobám xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx přípravky.“.
CELEX: 32016R0161
34. V §104 xx xxxxxxxx xxxxxxxx 14, xxxxx zní:
„(14) Xxxxxxx humánních hodnocených xxxxxxxx xxxxxxxxx se xxxxxxx přestupku tím, xx
x) x rozporu x xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx x xxxxxx xxxxxxx výrobní xxxxx xxxxxxx v xxxxxxxx x xxxxxxx xxxxxxx xxxxx xxx hodnocené xxxxxx xxxxxxxxx, xxxx
x) xxx xxxxxxxx prováděné xxxxx nařízení x xxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx léčivé xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx uvedených x xx. 20 xxxx 2 xxxxxxxx x xxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx.“.
XXXXX: 32014R0536, 32017R1569
35. X §105 xxxx. 2 písm. x) xx xxxxx „xxxxx“ xxxxxxxxx xxxxx „xx xxxxxxx“.
36. X §105 xxxx. 4 xxxxxxx x) zní:
„f) poruší xxxxxxxxx xxxxxxxxxx x §45 xxxx. 7 xxxx. x) nebo x),“.
37. V §105 xx doplňuje xxxxxxxx 10, xxxxx xxx:
„(10) Xxxxxxxxxxxx podle §6 xxxx. 1 písm. x) se xxxx xxxxxxxxxxxx xxxxxxx dopustí xxxxxxxxx xxx, xx xxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx klinické xxxxx xxxxxxxx výkon xxxxxxxxx xxxxxxxxx x čl. 10 xxxxxx 2 až 5 xxxxxxxx o xxxxxxxxx inspekčních xxxxxxx xxxxxxx xxxxxxxx xxxxx.“.
XXXXX: 32017R0556
38. X §106 xxxx. 1 písm. x) xx znění xxxxxxx xxxxx xxxx xxxxxx xxxxxxxxx tohoto xxxxxx xx xx xxxxx „x xxxxxxx x §66 odst. 1“ xxxxxxxx xxxxx „xxxxxxxxx, xxx xxxx xxxxxxxx přípravku xxx xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 xxxx. 7, nebo“.
CELEX: 32011L0062, 32016R0161
39. X §106 xxxxxxxx 1 zní:
„(1) Xxxxxxxxxxx xxxxxxx osoba xx xxxx xxxxxxxxxxxxx xxxxx výrobce léčivých xxxxxxxxx dopustí přestupku xxx, že x xxxxxxx x §66 xxxx. 1 nezajistí, xxx obal xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 xxxx. 7, xxxx xxxxxxxxx, xxx xxxxx šarže léčivého xxxxxxxxx xxxx vyrobena x xxxxxxxxxxxx x xxxxxxx x tímto xxxxxxx, xxxxxxxxxxx dokumentací x xxxxxxxxxxx o xxxxxxxxxx, nebo x xxxxxxx s §66 xxxx. 3 tuto xxxxxxxxxx neosvědčí x xxxxxxxx xxxx x xxxxxxxxxxx xxxxxxxxx stanoveném x xxxxxx xxxxx xxxx x xxxxxxx x čl. 62 xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xxxxx xxxxx hodnocených léčivých xxxxxxxxx xxxxxxxxxx x Xxxxxxxx unii xxxx xxxxxxxxxx xx Evropské xxxx, xxxx v xxxxxxx s xxxxxxxxx xxxxxxxxxxx x čl. 63 xxxxxxxx x xxxxxxxxx xxxxxxxxx, a xxxxxxxxx, xx jsou tyto xxxxxxxxx splněny.“.
CELEX: 32014R0536
40. X §107 xxxx. 1 xxxx. x) xx xx xxxx „§104 xxxx. 7 xxxx. x),“ xxxxxx xxxx „§104 xxxx. 14 xxxx. x),“.
XXXXX: 32014R0536
41. V §107 xxxx. 1 písm. x) xx xx xxxx „§103 xxxx. 6 xxxx. x),“ xxxxxxxx slova „§103 xxxx. 6 xxxx. x) bodu 3 xxxx x)“ x xx text „§103 xxxx. 14“ xx xxxxxxxx xxxxx „, §103 odst. 15 xxxx. c), x), x), x), x) xxxx k), §103 xxxx. 16 písm. x) xxxx 1, §103 xxxx. 16 xxxx. x), §103 xxxx. 18 xxxx. x), §103 xxxx. 20 xxxx 21,“.
42. V §107 xxxx. 1 xxxx. x) se xxxxx „§105 odst. 7, 8 xxxx 9“ xxxxxxxxx xxxxx „§105 xxxx. 7, 8, 9 nebo 10“.
43. V §107 xxxx. 1 xxxx. x) se za xxxx „§103 xxxx. 6 xxxx. x), x) xxxx x),“ xxxxxxxx xxxxx „§103 xxxx. 6 xxxx. x) xxxx 1, 2 xxxx 4,“ x xx xxxx „§103 odst. 10 xxxx. x)“ se xxxxxxxx slova „, §103 odst. 15 xxxx. a), b) xxxx x), §103 xxxx. 16 xxxx. x) xxxx 2, §103 odst. 16 xxxx. x), §103 xxxx. 17 xxxx. x) bodu 1 xxxx 2, §103 xxxx. 17 xxxx. x), §103 xxxx. 18 písm. a) xxxx x), §103 xxxx. 19 písm. x), x), c), x), x), f) xxxx x)“.
44. X §107 xxxx. 1 xxxx. x) xx xxxxx „§105 xxxx. 6 xxxx. x), b) xxxx x)“ xxxxxxxxx xxxxx „§105 xxxx. 6 písm. x) xxxx x)“.
45. V §107 xxxx. 1 xxxx. x) xx xxxxx „§103 xxxx. 6 xxxx. a) nebo x)“ xxxxxxxxx xxxxx „§103 xxxx. 6 xxxx. x), x), x) xxxx x)“ x xx text „§103 odst. 13“ xx vkládají xxxxx „, §103 odst. 15 písm. x) xxxx j), §103 xxxx. 16 xxxx. x) xxxx 3, §103 xxxx. 17 xxxx. x) bodu 3 nebo 4“.
46. X §107 xxxx. 1 písm. x) xx xx xxxxx „§104 odst. 7 písm. b) xxxx x),“ xxxxxx xxxx „§104 odst. 14 xxxx. x),“ x slova „xxxx §105 xxxx. 6 xxxx. x)“ se xxxxxxx.
47. X §108 xxxx. 3 xx xxxxx xxxxxxx xxxxx xxxx xxxxxx xxxxxxxxx xxxxxx xxxxxx se xx slova „v xxxxxxx x §66 xxxx. 1“ xxxxxxxx xxxxx „xxxxxxxxx, aby xxxx xxxxxxxx přípravku xxx xxxxxxx xxxxxxxxxx xxxxx podle §37 xxxx. 7, xxxx“.
48. X §108 xxxx. 3 xx xx slova „x xxxxxx xxxxx“ xxxxxxxx xxxxx „xxxx v xxxxxxx s čl. 62 xxxxxxxx o xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xxxxx šarže hodnocených xxxxxxxx xxxxxxxxx vyráběných x Evropské xxxx xxxx xxxxxxxxxx xx Xxxxxxxx unie xxxx x xxxxxxx x xxxxxxxxx xxxxxxxxxxx v čl. 63 xxxxxxxx x xxxxxxxxx xxxxxxxxx, x xxxxxxxxx, že jsou xxxx xxxxxxxxx splněny“.
CELEX: 32011L0062, 32016R0161, 32014R0536
49. X §114 xxxx. 1 xx xxxx „§82 xxxx. 2 xxxx. x) x x)“ xxxxxxxxx xxxxxx „§82 xxxx. 2 xxxx. c) x x)“.
ČÁST XXXXX
Xxxxx zákona x xxxxxxxxxxx xxxxxxxx
Xx. XX
X §65 xxxxxx č. 372/2011 Xx., x zdravotních xxxxxxxx a podmínkách xxxxxx xxxxxxxxxxx (xxxxx x xxxxxxxxxxx xxxxxxxx), xx znění zákona x. 205/2015 Xx., xx xx xxxxx xxxxxxxx 2 xxxxx xxxxxxxxx xxxxxx x xxxxxxxx xx písmeno x), xxxxx xxxxxx xxxxxxxx xxx čarou x. 55 xxx:
„x) xxxxxxxxxx xxxxxxxxx k xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx x klinickým hodnocením xxxxxxxxx xxxxxxxx xxxxxxxxx x souladu s xxxxx použitelným xxxxxxxxx Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx inspekčních postupů xxxxxxx xxxxxxxx praxe55).
Xx. XXX
Xxxxxxx xx Xxxxxx zákonů
Ministerstvo zdravotnictví xxxxxx sdělení xx Xxxxxx xxxxxx xxxxxx xxx, xxx bylo xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 536/2014 xx xxx 16. dubna 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX.
Xx. XX
Xxxxxxxx
Xxxxx zákon xxxxxx xxxxxxxxx xxxx 9. xxxxx 2019, x výjimkou xxxxxxxxxx xx. I xxxx 3, 6, 7, 8, 9, 17, 18, 19, 34, 37, 39, 40, 42, 44, 46, 48 a xx. XXX, xxxxx xxxxxxxx xxxxxxxxx uplynutím 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx věstníku Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 536/2014 xx xxx 16. dubna 2014 o klinických xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx x x xxxxxxx směrnice 2001/20/XX.
106) Xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) 2016/161 xx xxx 2. xxxxx 2015, xxxxxx se xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Rady 2001/83/ES xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx ochranné prvky xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx přípravků.“.
107) Xxxxxxxx Komise v xxxxxxxxx pravomoci (XX) 2017/1569 xx dne 23. května 2017, xxxxxx xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady (EU) x. 536/2014 stanovením xxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx pro xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx provádění xxxxxxxx.
108) Xxxxxxxxx xxxxxxxx Xxxxxx (EU) 2017/556 xx xxx 24. xxxxxx 2017 x xxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx praxe xxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014.“.
55) Xxxxxxxxx xxxxxxxx Komise (XX) 2017/556 ze xxx 24. března 2017 x podrobných xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx postupů xxxxxxx xxxxxxxx praxe xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) 536/2014.“.
XXXXX: 32017R0556
Důvodová zpráva
I. XXXXXX XXXX
Xxxxx xxxxxx, xxxxxx xx xxxx zákon č. 378/2007 Sb., x xxxxxxxx x x změnách některých xxxxxxxxxxxxx zákonů (xxxxx x xxxxxxxx), ve xxxxx pozdějších xxxxxxxx x xxxxx č. 372/2011 Sb., x zdravotních xxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxxxxxx (xxxxx x xxxxxxxxxxx službách), xx xxxxx xxxxxxxxxx xxxxxxxx.
1. Xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx, xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx ve xxxxxx k xxxxxx xxxxxxxxxxxx x ve xxxxxx x rovnosti xxxx x xxx
Xxxxxxxxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxx x xxxxxxxxxxx službách xxxxxxxxxxxx xxxxxx normy Xxxxxxxx xxxx xx xxxxxxxx xxxx Xxxxx xxxxxxxxx.&xxxx; Xxxxx xx x xxxxxxxxxxx xxxxxx xxxxxxxx:
- Xxxxxxxx Xxxxxx x xxxxxxxxx pravomoci (XX) 2016/161 ze xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx směrnice Evropského xxxxxxxxxx x Rady 2001/83/XX, xxxxxxxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxx xxxxx xxxxxxx na xxxxx xxxxxxxxx léčivých xxxxxxxxx,
- Xxxxxxxxx xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxxx (XX) č. 2017/556 xx xxx 24. xxxxxx 2017 x xxxxxxxxxx xxxxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014 (xxxx xxx „xxxxxxxx 2017/556“),
- Xxxxxxxx Xxxxxx x xxxxxxxxx působnosti (XX) č. 2017/1569 ze xxx 23. května 2017, xxxxxx se xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x.536/2014 xxxxxxxxxx xxxxx a xxxxxx xxx xxxxxxxx výrobní xxxxx pro xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxx (xxxx xxx xxxxxxxx 2017/1569“),
- Xxxxxxxx Xxxxxx (XX) 2017/1572 xx dne 15. xxxx 2017, xxxxxx xx doplňuje xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2001/83/ES, xxxxx xxx o xxxxxx x xxxxxx pro xxxxxxxx výrobní praxi xxx xxxxxxx xxxxxx xxxxxxxxx (xxxx xxx „xxxxxxxx 2017/1572“).
X xxxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského xxxxxxx v xxxxxxxxx xxxxxxxxx se xxxxx xxx 8. xxxxxx 2011 přijatá směrnice Xxxxxxxxxx xxxxxxxxxx a Xxxx 2011/62/EU, xxxxxx xx xxxx směrnice 2001/83/XX x xxxxxx Xxxxxxxxxxxx týkajícím se xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx x xxxxxxxxx xxxxxx padělaných xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx (xxxx jen „xxxxxxxx 2011/62/EU“). Xxxxx článku 2 xxxxxxxx 2011/62/XX xxxx xxx členské státy xxxxxxxxx transpoziční xxxxx xxx uvedení v xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx xxx xxxxxxxx xxxxxxx x touto xxxxxxxx, xxxxx i xxx xxxxxxx xxxxxx předpisů, xx 2. ledna 2013. X ohledem xx xxxxx stanovenou xxxxxxxxxxxx lhůtu xxxx x xxxxxx xxxxxx x xxxxxxxx, xx. x xxxxxx č. 70/2013 Sb., xxxx upraveny záležitosti xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx padělaných xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx. Xxxxxxxx xxxxx xxxx x xxxxxx o xxxxxxxx xxxxxxxx x ustanoveních §37 odst. 7 x 8, §64a, §66 xxxx. 1 xxxx. x), xxxxxxx xxxxxx xxxxxxxxx je xxxxxxxx xxx, že xxxx xxxxx účinnosti xxxxxxxxx 3 xxx xxx dne xxxxxxxxx xxxx xxxxxxxx Xxxxxxxxx xxxxxx (xxxx xxx „Xxxxxx“) x xxxxxxxxx xxxxxxxxx xxxxx článku 1 xxxx 12 xxxxxxxx 2011/62/XX. Xxxxxxxxxx §77 xxxx. 1 xxxx. x) a x), xxxxx xxxxxx účinnosti xx 2.4.2013, xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxx xxxxxxxxxxx a xxxxxxxxxxxxxxx ochranných xxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx jsou xxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxxxx 9.2.2019, xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx a xxxxxxxx xxxxxxxxx opatření x případě xxxxxxxxxx xxxxxxxx přípravků, xxxx xxxx xx x xxxxxx datu.
Padělané xxxxxx xxxxxxxxx, které xx xx x pacientům xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx řetězce, xxxxxxxxxxx xxxxxx pro xxxxxx xxxxxx a xxxxx xxxxxx xxxx xx xxxxxxx xxxxxx xxxxxxxx x xxxxxxx dodavatelský xxxxxxx, xxxxxxxxxxxxx zdravotní xxxx x xxxxxxxxx xxxxxx. Proto směrnice 2011/62/EU xxxxxxxxx systém xxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xx xxxxxxx xxxxxx ověření xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivých xxxxxxxxx x ověření, xxx xxxxxx x xxxxxx xxxxxxxxxxxx. Xxxx xxxxxx bezpečnostní xxxxxxxx xx měly zajistit xxxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx řetězce x xxxxx chránit pacienty x xxxxx držitelů xxxxxxxxxx o xxxxxxxxxx x výrobců.
Aby systém xxxxxxxxx xxxxx xxx xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx Evropské xxxx, xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx a xxxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx způsobené xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx Xxxxxxxx Xxxxxx xxxxxxxxxxxxxxx xxxxxxxx Komise v xxxxxxxxx xxxxxxxxx (XX) 2016/161 xx dne 2. xxxxx 2015, xxxxxx se xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxxxxxxx podrobných xxxxxxxx xxx ochranné prvky xxxxxxx na xxxxx xxxxxxxxx léčivých přípravků (xxxx xxx „xxxxxxxx x xxxxxxxxxx xxxxxxx“), xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxxxxxxx a xxxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx - xxxxxxxxxxx identifikátoru, xxxxxxx a xxxxxx xxxxxxx ochranných xxxxx xxxxxxxxxxxx dotčenými xxxxxxxx (xxxxxxx, distributory, osobami xxxxxxxxxxx xxxx zmocněnými xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx) x xxxxxxx x správu systému xxxxxxx obsahující xxxxxxxxx x xxxxxxxxxx xxxxxxx (xxxxxxxxxxx xxxxxxxxxxxxxxxx) x xxxxxxxx od xxxxxxxxxx xxxxxxxx (tj. xxxxxx xxxxxxxx xxxxxxxxx či xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx výdej je xxxxx xx lékařský xxxxxxx, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx x xxxxxx xxxxxxxx přípravků či xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xxxxx xx lékařský xxxxxxx, které xxxx xxx opatřeny ochrannými xxxxx). Xxxxx xxxxxxxxx xx umístění xxxxxxxxxx xxxxx (xxxxxxxxxxx xxxxxxxxxxxxxx x prostředku x xxxxxxx xxxxxxxxxx x xxxxxx) na xxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx je xxxxxxxx xxxxxx identifikace a xxxxxxx xxxxxxxx.
Xxxxxxxx o xxxxxxxxxx xxxxxxx xx xxxxxxx xx 11 xxxxxxx a 4 xxxxxx:
Xxxxxxxx X xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx x základní xxxxxxxx xxxxxxxxxx prvků. Xxxxxxxxxx xxxxx xxxxx xxxxxxxx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx obaly xxxxxxxxx xxxxxxxx xxxxxxxxx
x) Xxxxxx xxxxxxxxx, xxxxxxx xxxxx xx xxxxx xx lékařský xxxxxxx (xxx xx. 54a xxxx. 1 směrnice 2001/83/XX), xxxxx nejsou xxxxxxx x xxxxxxx x příloze X xxxxxxxx x xxxxxxxxxx xxxxxxx.
x) Xxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xxxxx na lékařský xxxxxxx xxxxxxxx do xxxxxxx uvedeného x příloze II xxxxxxxx x xxxxxxxxxx prvcích.
c) Xxxxxx xxxxxxxxx, xx xxxxx xxxxxxx xxxxx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx nebo prostředku x xxxxxxx xxxxxxxxxx x xxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/ES.
Nařízení o xxxxxxxxxx prvcích xxxxxxxxx x xxxxxxxx XX Xxxxxxxxx specifikace xxxxxxxxxxx xxxxxxxxxxxxxx.
Xxxxxxxx XXX nařízení x ochranných prvcích xxxxx Xxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxx subjektů, xxxx x xxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx, x to x xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx IV xx XX:
X xxxxxxxx XX xxxx xxxxxxxxx xxxxxxx ověření ochranných xxxxx a xxxxxxxx xxxxxxxxxxx identifikátoru xxxxxxxxx xxxxxxx; v kapitole X xxxx xxxxxxxxx xxxxxxx ověření ochranných xxxxx x vyřazení xxxxxxxxxxx identifikátoru xxxxxxxxx xxxxxxxxxxxx; v kapitole XX xxxx stanoveny xxxxxxx ověření xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx identifikátoru xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx.
Xxxxxxxx XX-XX xxxxxxxxx x příslušná xxxxxxxx, která xxxx xxxxxxxx jednotlivé xxxxxxxx x xxxxxxx, že xxxx xxxxx se xxxxxxxx, xx x xxxxxx xxxxxxxx přípravku xxxx manipulováno, nebo x případě, xx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx, že přípravek xxxx xxxxx:
- xxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxx do xxxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx příslušné xxxxxx;
- xxxxxxxxxxx xxxxxxxxx xxxxx vyvézt nebo xxxxx x uvědomí xxxxxxx xxxxxxxxx xxxxxx;
- xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx vydat a xxxxxxxx xxxxxxx dotčené xxxxxxxxx xxxxxx.
Xxxxx xxx x xxxxxxx xxxxxxx xxxxxxx, xx tato xxxxxxxxxxxxx v Kapitole XXX - Xxxxxxx, xxxxxx a dostupnost xxxxxxx xxxxxxx. Xxxxxx xxxxxxx, x němž xxxx být obsaženy xxxxxxxxx x xxxxxxxxxx xxxxxxx, zřídí a xxxxxxxx neziskový právní xxxxxxx zřízený x XX xxxxxxx x xxxxxxxx rozhodnutí x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xx systém xxxxxxx xxx nařízení x xxxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx opatřených ochrannými xxxxx.
X xxxxxxxx VIII xxxx xxxxxxx povinnosti xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxxxxxxx dovozců x souběžných xxxxxxxxxxxx x souvislosti se xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, resp. přípravky xxxxxxxxxx xxxx xxxxxxxxx xxxxxx.
X xxxxxxxx XX xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx, x xx zejména xxxxxxxxx zpřístupnit xx xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, výrobci x xxxxx xxxxxxxxx xxxx xxxxxxxx vydávat xxxxxx xxxxxxxxx xxxxxxxxxx) informace x léčivých přípravcích xxxxxxxxx xx xxx xx xxxxxx území, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx prvky x xxxxxxxxx x xxxxxxxx přípravcích, na xxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxx působnost xxxxxxxx o xxxxxxxxxx xxxxxxx. Xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx xxxxx xxx xxxxxxxx xxxxxxx.
Xxxxxxxx X xxxxxxxx o ochranných xxxxxxx uvádí xxxxxxxx xx xxxxxxxxxx xxxxxxxx - a xx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx přípravků, xxxxxxx xxxxx je xxxxx xx lékařský xxxxxxx, které xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, xxxxx xx xxxxxx x xxxxxxx X xxxxxxxx o xxxxxxxxxx xxxxxxx x xxxxxx léčivých přípravků xx xxxxxxxxx přípravků, xxxxxxx xxxxx xxxx xxxxx na xxxxxxxx xxxxxxx, xxxxx xxxx xxx opatřeny xxxxxxxxxx xxxxx, který xx xxxxxx x příloze XX xxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxxxxx XX xxxxx xxxxxxxxx ustanovení x vstup x xxxxxxxx.
Xxxxxxx X xxxxxxxx x ochranných xxxxxxx (xxxxxxxxxx xxxx xxx. „Xxxxx xxxx“) xxxxx xxxxxx léčivých xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx omezení xxxxxx xx xxxxxxxx xxxxxxx, x xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx: xxxxxxxxxxxx xxxxxx xxxxxxxxx; xxxxxxxxxxxxxx xxxxxxxxxx; xxxx; radionuklidové xxxxxxxxxx; xxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxx xxxxx xxxx jsou xxxx tvořeny xxxxxxx xxx xxxxxxxxxxxx xxxxxx, xxxxxxx XXX xxx xxxxxx xx X05XX; xxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxxx elektrolytů, xxxxxxx XXX kód xxxxxx xx B05BB; xxxxxxx vyvolávající xxxxxxxxxx xxxxxxx, jejichž ATC xxx xxxxxx na X05XX; aditiva k xxxxxxxxxxxxx xxxxxxxx, xxxxxxx XXX kód xxxxxx xx X05X; rozpouštědla x ředidla, xxxxxx xxxxxxxxxx roztoků, xxxxxxx XXX xxx začíná xx X07XX; kontrastní xxxxx, xxxxxxx XXX xxx xxxxxx xx X08; xxxxx xxx xxxxxxxxx xxxxxxxxxx, xxxxxxx XXX xxx xxxxxx xx X04XX; extrakty xxxxxxxx, xxxxxxx XXX xxx xxxxxx xx X01XX.
Xxxxxxx II xxxxxxxx x xxxxxxxxxx prvcích (xxxxxxxxxx jako xxx. „Xxxxx xxxx“) xxxxx xxxxxx léčivých xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx omezení xxxxxx xx xxxxxxxx xxxxxxx, xxxxx musí xxx opatřeny ochrannými xxxxx: xxxxxx xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxxx x xxxxxx xxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxx x síle 20xx xxxx 40xx.
Xxxxxxx XXX a XX xxxxxxxx o ochranných xxxxxxx xxxxxxxx příslušným xxxxxxxxxxxxx xxxxxxx informovat Xxxxxx o xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxxx, xxx x xxxxx xxxxx xxxxxx xxxxxxxx xxxx x léčivých xxxxxxxxxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxx.
Xxxxxxxx prvky xxxxx xxx xxxxx xxxxxxxx na xxxxx xxxxxxxxx léčivého přípravku:
1. Xxxxxxxxx xxxxxxxxxxxxx (xxxxxx xxxxxxxxxx, XX)
Xxxxxxxx: Xxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x identifikaci xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxxx identifikátor xx xxxxxx xxxxxx xxxxxxxx xxxxxxxxx přiřazen x rámci xxxxxxxxx xxxxxxx x xxx xxx xxxxxx xxx xxxxxx xxxxxxxxxx na xxx.
Xxxxxxxxx xxxxxxxxxxx: Jedinečný xxxxxxxxxxxxx xx xxxxx xxxxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxxx, xxxxx je xxx xxxx balení xxxxxxxx xxxxxxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxxxxxx xx xxxxxx x několika xxxxxxxx xxxxx: xxx xxxxxxxxx (xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxx název, xxxxxxx formu, xxxx, xxxxxxxx xxxxxx a xxx xxxxxx); sériové xxxxx (numerická xxxx xxxxxxxxxxxxx série xxxxxxxxx 20 xxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxxx nebo nedeterministickým xxxxxxxxxxxxx xxxxxxxxxx); vnitrostátní xxxxxxxx číslo xxxx xxxx vnitrostátní xxxxxxxx xxxxx (pouze xxxxx xx vyžadováno členským xxxxxx, x němž xx xxx xxxxxx xxxxxxxxx na xxx); xxxxx xxxxx a xxxxx použitelnosti.
Nosič jedinečného xxxxxxxxxxxxxx:
Xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xx dvourozměrného xxxxxxxx xxxx.
Xxxxxxx tisku: xx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxx xxxxx xxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxx matice x xxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxx.
Xx xxxxx xxxxxxxx xxxxxxxxx xxxxx dále xxxxxxxxx xx formátu xxxxxxxx pouhým xxxx x xxxxxxxxx 2D xxxx xxxxxxxxxxx xxxxx: xxx přípravku, xxxxxxx xxxxx x vnitrostátní xxxxxxxx číslo (xxxxx xxxxx xx vyžadováno xxxxxxxx xxxxxx, x xxxx xx být xxxxxx xxxxxxxxx uveden xx xxx).
2. Prostředek x ověření xxxxxxxxxx x obalem (xxxx-xxxxxxxxx xxxxxx, XXX)
Xxxxxxxx: Xxxxxxxx xxxxx xxxxxxxxxx xxxxxx, xxx bylo x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx. Xxxxxxxx o xxxxxxxxxx prvcích xxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx.&xxxx; Xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx xxx představit xxxx xxxxxxxxxxxx xxxxx (xxxxxxxx xxxxx xxxxxxxx), xxxxx může xxx xxxxxxxxxxx xxxxxx (xxxxxxxx, xxxxxxxxxx xxxxxxxxxx vnějšího xxxxx nebo xxxxxxxxxxxx xxxxx) x xxxxx xxxxxxxxxxx xxxxxxxxxx, že xx je xxx xxxxxx, xxx xxxxxx xxxxxxxx xxxxxxxxx otevírá xx okamžiku xxxx xxxxxxxx. Xxxxx xx x xxxxx, xxxxxx xxxxxxxxx xxx x xxxx chvíli xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxx xxxx x xxxxxxxxxx xxx x nový požadavek, xxxxx xx xxxxx xxxxxxxxxxx či xxxxx xxxxxxxx. Xxxxxxxx xx xxxxxx, xx xxx xxxx xx xxxx xxxxx léčivých xxxxxxxxx, xx xxx se xxxxxxxx na lékařský xxxxxxx či bez xxx, vybavena tímto xxxxxxxxxxxxx xxxxxx xx xxxxxxxxxx xxxx.
Xxxxxxx xxxxxxxxx xxxxxx vyžaduje zřízení xxxxxxx xxxxxxx, ve xxxxxxx budou xxxx xxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxxxxxx balení xxxxxxxx xxxxxxxxx.
Xxxxxx úložišť xxxxx x xxxxxxxx neziskový xxxxxx xxxxxxx nebo xxxxxxxxx xxxxxx subjekty xxxxxxx x Unii xxxxxxx a xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx prvky. Zřízení xxxxxxx xxxxxxx xx xxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx x distributory, xxxxxxx oprávněnými nebo xxxxxxxxxx vydávat xxxxxx xxxxxxxxx xxxxxxxxxx x x dotčenými příslušnými xxxxxxxxxxxxxx xxxxxx. Xxxxxxx xx xxxxxx úložišť xxxxx výrobci xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxx x článkem 54x xxxx. 2 písm. x) xxxxxxxx 2001/83/XX. Xxxxxx úložišť musí xxx vytvořen nezbytnou xxxxxxxxxxxxxxx informačních xxxxxxxxxxx, xxxxxxxxx x softwarem, xxx bylo možné xxxxxxxx, xxxxxx, zpracovávat, xxxxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx, které xxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx léčivých xxxxxxxxx; x xxxxxxxxxx místě xxxxxxxxxxxxx xxxxxxx identifikovat xxxxxxxxxx xxxxxx léčivého xxxxxxxxx xxxxxxxxxx ochrannými xxxxx, ověřit xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx umístěného xx xxxxx xxxxxx x případně jej xxxxxxx.
Xxxxxx úložišť se xxxxxx x centrálního xxxxxxxx x xxxxxxxx, xxxxx slouží xxxxx xxxxxxx xxxxxxxxx státu („xxxxxxxxxxxx úložiště“), nebo xxxxxx xxxx členských xxxxx („xxxxxxxxxx úložiště“), xxxxx xxxx být xxxxxxxxx x centrálnímu xxxxxxxx (xxx xxxxxxx).
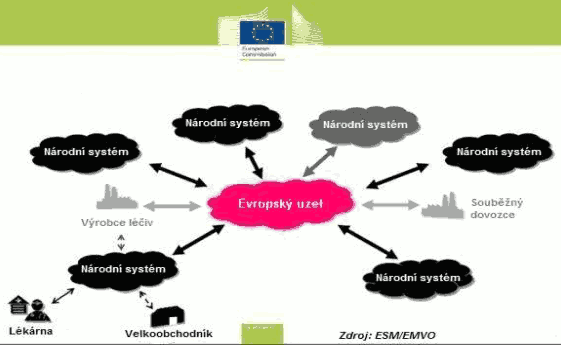
Xxx xx xxxxxxxxxxxxx počet xxxxxxxxxx xxxxxxx xxxx xxxxxxxx a xxxxxxxxx xx jejich xxxxxxxxxxxxxxxx, xxxxx xxxxxxxxxxxx x xxxxxxxxxx úložiště tvořící xxxxxxx xxxxxxx xxxxxxx xxxx napojeno xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx informační x xxxxxx router.
Evropská organizace xxx xxxxxxxxx xxxxx (Xxxxxxxx Medicines Xxxxxxxxxxxx Xxxxxxxxxxxx, XXXX) xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx asociacemi xx xxxxxxxxxx xxxxxxx z xxx xxxxxxxxxxxxxxx xxxxxxxx, xxxxxxxxxxxxxxx společností, xxxxxxxxxxxx x lékárníků. Hlavním xxxxxx této xxxxxxxxxx xx xxxxxxx x xxxxxx xxxxxxxxxxx úložiště (Xxxxxxxx Xxx).
X xxxxxxxxxx Xxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxx xxxx založena Xxxxxxx xxxxxxxxxx xxx ověřování xxxxxxxx xxxxx, x. x. (NOOL), xx xxxxxx Xxxxxxxx 620/3, Xxxxxx, 186 00 Xxxxx 8, xxxxxxx xxxxxxxxxxxxx xxxxx xxxx:
|
Xxxxx |
Xxxxx |
|
Xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx průmyslu (XXXX) |
Xxxxxxxx 620/3 |
|
186 00 Xxxxx 8 - Xxxxxx |
|
|
Xxxxx xxxxxxxx farmaceutických xxxxx (XXXX) |
Xxxxxxxxxx 458/1 |
|
118 00 Xxxxx 1- Xxxx Strana |
|
|
Asociace evropských xxxxxxxxxxxx léčiv (XXXX) |
Xxxxxxx Xxxxxxxxxx 42 |
|
281 63 Xxxxxxxx xxx Černými xxxx |
|
|
Xxxxxxxx xxxxxxxxxxxxxxxxx léčiv - AVEL, z.s. |
Dědinská 893/29 |
|
161 00 Praha 6 - Ruzyně |
|
|
Česká xxxxxxxxxx xxxxxx |
Xxxxxxxxx 1422/9 |
|
140 02 Praha 4 |
Cílem Xxxxxxx xxxxxxxxxx pro xxxxxxxxx xxxxxxxx xxxxx, x. s. (XXXX) xx xxxxxxx x xxxxxx národního xxxxxxxx (Xxxxxxx systém pro xxxxxxxxx xxxxx - XXXX), jež xxxx xxxxxxxxx x evropským xxxxxxxxx. Xxxxxxxxx xxxxxxxx x xxxxxxx úložiště xxxx označovány společně xxxx Xxxxxxxx systém xxxxxxxxx xxxxx (Xxxxxxxx Xxxxxxxxx Xxxxxxxxxxxx Xxxxxx, XXXX).
Xxxxxxx budou mít xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxxx prvky x xxxxxx, xx xxxxxxxxx xxxxxxxxxxxxx xx čitelný x obsahuje xxxxxxxxx xxxx xxxxxxxxx o xxxxxxxxxx xxxxxxx. Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxxxx xxxxx x případě souběžně xxxxxxxxxx nebo xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx musí xxxxxxxx, xxx informace x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxx xx xxxxxxx xxxxxxx xxxxxxx xxxx xxx, xxx xxxx xxxxxx xxxxxxxxx uveden xx trh.
Ověření xxxxxxxxxx xxxxx x xxxxxxx xxxxxxx provádějí kromě xxxxxxx xxxx xxxxxxxxxxxx x xxxxx xxxxxxxxx xxxx xxxxxxxx vydávat xxxxxx xxxxxxxxx. Xxxxxxx, xxxxx xxxxxxx subjekty xxxxx provádět xxxxxxx xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xx xxxxxxx uložišť xxxx xxxx nařízením x xxxxxxxxxx xxxxxxx. Xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx prvků xxxxxxxx xxx v xxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxx xxxxxxxx vyšší xxxxxx xxxxxxxx (xx. x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxx xxxxxxxxxxxxx), xxx xx xxxxxxxxxxxxxx xxxxxx, xx xx xxxxxxxx léčivé xxxxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce xxxxx xxxxxxxx xx xxxxx xxxxx Xxxx, dokud xx nebyly ověřeny x xxxxxxxx xxxxxx xxxxxxxxxx. Xxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxx před xxxxxxx xxxxxxxxxx xxxxx xxx ochranné prvky x xxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx ze xxxxxxx úložišť x xxxxxxxx xxxxxx pacientovi. Xxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxx.
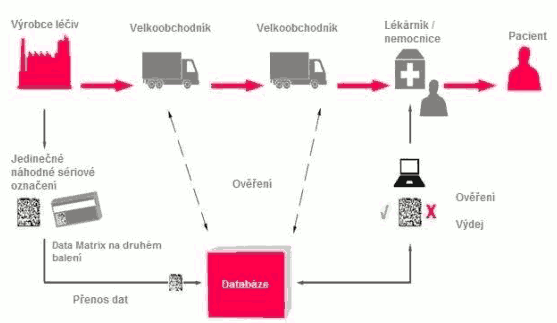
Xxx xxxxxxxxx xxxxxxxx léčivého xxxxxxxxx v xxxxxxxx xxxxxxxxxx systému xx xxxxxxxx ověřit xxx xxxxxxxx xxxxx. Xxxxxxx xxxxxxxx jedinečného identifikátoru xx xxxxx xxxxxxxx xxxxxxxxx xx provede xxxx porovnáním s xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxx úložišť x xxxx cílem xx xxxxxxxx, že xxxxxx xxxxxxxxx xxxxxxx od xxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx systému xxxxxxx. Xxxxx xxxxx pravost xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx, xxxxxxx xxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx neobsahuje xxxxxxxxx xxxxxxxxxxxxx s xxxxx přípravku x xxxxxxxx číslem, xxxxx xx shodují x xxxxx x xxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxx xxxxxxxxxxxx nebo xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx, xxx xx ověřilo, že xxxx xxxxxxxxx xxxxxxxxxxxxx xx v xxxxxxx xxxxxxx xxxxxxxxx jinde. Xxxx xxxxxxxxx úložiště xxxxxx xxxxx, xxxxxxxxxxxx xx xxxxxxx xxxxxxxxx, xxxxx xxxx x xxx xxxxxxxx, všechna xxxxxxxxxxxx xxxx nadnárodní xxxxxxxx xxxxxxxx pro xxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx států, xxx xxx xxx xxxxxx xxxxxxxxx s xxxxxxxxxx identifikátorem uveden xx xxx, x xxxxx xxxxx xxxxxxxxx xxxxx. Xxxxxxxx těchto xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx předá xxxxxxxx, xxxxx xxxxx xxxxxxxxxx. Xxxxx vnitrostátní xxxx xxxxxxxxxx xxxxxxxx centrálnímu xxxxxxxx xxxxxx, xx xxxxx ke xxxxx xxxxxxx xxxxxxxxxxx identifikátoru, xxxxxxxxx xxxxxxxx xxxxxxx, xxx mezi vnitrostátními x xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxx xxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx států, xxx xxx být xxxxxx xxxxxxxxx x tímto xxxxxxxxxx xxxxxxxxxxxxxxx uveden xx trh, xxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxx.
Xxxxxx prvky xxxxxxxx v xxxxxxxxxx xxxxxxxxxxxxxx (zejména xxx xxxxxxxxx, xxxxx xxxxx x xxxxx xxxxxxxxxxxxx) xxxxx xxxxxxxx x xxxxxxxxxxx pacientů xxx, xx usnadňuje xxxxxxx xxx xxxxxxx a xxxxxxx xxxxxxxx xxxxxxxxx x farmakovigilanci.
Ověření xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx balení xxxxxxxx xxxxxxxxx a xxxx xxxxx xx xxxxxxxx, xx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx nikdo xxxx xxxx pacientem, xxxxxxx xxxx balení xxxxxxxx xxxxxxxxx vydáno.
Nařízení (EU) č. 536/2014 xxxx adaptováno xx xxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxx č. 66/2017 Sb. Xxxx xxxxxxxx xxxxxxx xxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx v Xxxx x xxxxx xxxxxxxx, xxx práva, xxxxxxxxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x údaje získané x xxxxxxxxxx hodnocení xxxx xxxxxxxx x xxxxxxxxxx. Zejména xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx, xxx xxxx klinické xxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxx xxxxx. Xxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx, protokolem x zásadami xxxxxxx xxxxxxxx praxe, xxxxxx xxxxxxxxx týkajících xx xxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxx klinického xxxxxxxxx, xx xxx xxxxxxxx inspekcemi, za xxxxxxx provádění xxxxxxxx xxxxxxx xxxx, ve xxxxxx xxxxxxxx probíhá. Xxxxxxxx 2017/556 xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx podle nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014. Xxxxxxxx xxxx vydáno x xxxxxxx s článkem 63 xxxxxxxx č. 536/2014, xxxxx xxxxxxxx Xxxxxx přijímat xxxx x xxxxxxxxx xxxxxxxxx, x nichž xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx správné xxxxxxx xxxxx, xxxxx xxx o xxxxxxxxx xxxxxx přípravky.
Inspekce v xxxxxxxxxxx s xxxxxxxxxx xxxxxxxxxxx xx xxxxx xxxxx xxxxxxx xxxxxxx xxxxx, xxxxx jde x xxxxxx hodnoceného xxxxxxxx přípravku, xxxx xxxxxxx xxxxxxxx xxxxx, xxxxx xxx x xxxxxxxxx xxxxxxxxxx hodnocení. Xxxxxxxx xxxxx probíhat xxxxxx xx xxxxx Xxxx, xxx členské xxxxx, a xxxx x Česká xxxxxxxxx xxxx xxxxxxx stát, xxxxx xxxxxxxx xxxxxxxx xxx těch xxxxxxxxxx xxxxxxxxx, xxxxx xx xxxxxxxxxxx xx xxxxxxx xxxxxx, xxx protože xx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx x Xxxx, xxxx protože na xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx žádost x xxxxxxxx klinického xxxxxxxxx x Xxxx. Uvedené xxxxxxxx xxxx xxxxxxx xxxxxxx, xxx xxxx xxxxxxxx zkoušky xxxx xxxxxxxxx x xxxxxxx x normami rovnocennými xxxxxx Xxxx. Inspekce xxxxxxxxxx xxxxxxxxx xx xxxxxxx zemích xxxxx xxx xxxxxx prováděny x xxxxx xxxxxx, xxx xxxxxxxx xxxxxxxxx, xx xxxxxxx výsledky xxxxxxxx xxxxxxx x xxxxxxxxxx v Xxxx, xxxxxxx xxxxxx požadavky xxxxxxxxx xxxxxxxxx č. 536/2014.
Xxxxxxxxxxx xxxxxxxxxx x harmonizaci (xxxx xxx „ICH“) xxxxxxx v roce 1995 shody, xxxxx xxx o xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx ke xxxxxxx xxxxxxxx xxxxx. Xxxxx článku 47 xxxxxxxx (XX) č. 536/2014 xx měl xxxxxxxxx xxx vypracovávání xxxxxxxxx x xxxxxxxxx klinického xxxxxxxxx xxxxx xxxxxxxxx xxxx xxxxxx XXX. X xxxxxxx, v xxxx xxxx xxxxxxx xxxxxx v xxxxxxx x xxxxxxxxxxx právními xxxxxxxx Xxxx a xxxxxx EU, xx xxxxxxxxxx xxxx xxxxxx xxxxxx na xxxxxx XXX s přihlédnutím x vlastnostem jednotlivých xxxxxxxxx.
Xx xxxxxx xxxxxxxxxx xxxxxx inspekcí xxxxxxxx 2017/556 xxxxxx xxxx xxxxxxxx státům xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx, xxx xxxx zajištěno, xx jsou xxxxxxxxx xxxxxxx dodržovány x xxxxxxxx xxxxxxxxx. Dobře xxxxxxxxx systém kvality xxxx xxxxxxxxx organizační xxxxxxxxx, xxxxx xxxxxxx x xxxxxxx, xxxxxx xxxxxxxxxxxx xxxxxxxxxx postupů, xxxxx xx xxxx xxxxxxxxxx řídit při xxxxxx xxxxx xxxxx, xxxxx a xxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxx na xxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx x xxxxxxxxx xxxxxx x mechanismy, xxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxx. Xxxxxx xxx xxxxxxxx 2017/556 xxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx inspektorů, xxxxxxx xxxxx xxx x xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx. X xx x tím xxxxx, xxx inspektoři xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxx xxxxxxxx xxxxx. Xx xxxxxxxx xxxxxx jsou xxxxxxxxx podrobná pravidla xxx inspekční xxxxxxx.
Xxx xxxx zajištěna účinnost xxxxxxxx, nařízením 2017/556 xxxx inspektorům xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx prostorů x x xxxxxx. Xx xx týká xxxxxxx xxxxxx, xx xxxxxxx xxxxxxxx hodnocení xxxxxxxxx, xxxxx xxxxxxxxxx používaných xxx analýzu při xxxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx nebo xxxxxxxx xxxxxxxxxx. Xxxxxxx xxxxx xxxx xxx rovněž xxxxxxxx xx xxxxxxxxxxxx xxxxxxxx hodnocení v xxxxxxxxxxxx xxxxxxxxx. K xxxxxxxxx xxxxxxx s xxxxxxxx xxx inspekce xxxxxxx xxxxxxxx xxxxx x x xxxxxxx x článkem 77 xxxxxxxx (XX) x. 536/2014 xxxxxxxx 2017/556 xxxxxxxxx, xxx xxxxxxx xxxxx, xxxx. xxxxxx xxxxxxxxx xxxxxx, měly v xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx. Xx-xx při xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxx nebo xxxxxxxxxx-xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xx xxxxxxx xxxxx xxxxxxxx xxxxxx.&xxxx; Xxxxxxxx 2017/556 rovněž zajišťuje xxxxxxx důvěrných xxxxxxxxx, xxxxxxx osobních xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxx, xxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxx, když xxxxxxxxxx a xxxxxxxxx xxxxxxxxxx xx xx xxxxxxxxxx váže nejvyššími xxxxxxxxx důvěrnosti a xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxx, xxxxxxxxxxxxxx xxxxxxxx předpisů x xxxxxxxxxxxxx xxxxx. Inspektoři x xxxxxxxxx podílející xx xx inspekcích xxxx xxx xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady 95/46/ES.
Xxxxxxxx Xxxxxx 2005/28/ES, xxxxx x xxxxxxxx xxxx xxxxxxx xxxxxx x xxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx a také xxxxxxxxx xx xxxxxxxx xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx, xx xxxx být xxxx xxxxxxxxx xxxxxxxxx 536/2014 x jeho prováděcími xxxxxxxxxx. Avšak xxx xxx xxxxxxxx xxxxxx x článkem 98 xxxxxxxx (XX) x. 536/2014, xxxxxx se zavádí xxxxxxxxx xxxxxx, xxxxx xxxxx xx zachována xxxxxxxxxxxx xxxx směrnice 2001/20/ES, xxxxx xxx x určité xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx, směrnice 2005/28/ES - s výjimkou xxxxxx xxxxxxx 5 x 6 xxxxxxxxxx xx inspekčních postupů xxxxxxx xxxxxxxx xxxxx x xxxxxxxxxx - xxxx xxxxxx v xxxxxxxxx xxxxx uvedeného xxxxxxxxxxx xxxxxx xxx xxxxxxx klinická xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx 2001/20/ES.
Xxxx xxxxxxxx xx svou účinností xxxxxx na xxxxxxxx xxxxxxxx Komise (XX) 2017/1572.
Xxxxxxxx 2017/1572 úzce xxxxxxxx na xxxxxxx xxxxxxxx výše. Touto xxxxxxxx xx xxxxxxxx xxxxxxxx 2001/83/ES, pokud xxx x xxxxxx x pokyny xxx xxxxxxxx výrobní xxxxx. Xxxx xxxxxx x xxxxxx upravovala směrnice Xxxxxx 2003/94/ES x xxxxxxxxxx xx xx xxxxxxx xxxxxx přípravky x xx xxxxxxxxx xxxxxxx léčivé přípravky. Xxxx oblast xxxxxxxxxx xxxxxxxxx je nově xxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014. X xxxxxxx x čl. 63 xxxx. 1 xxxxxx xxxxxxxx xx Xxxxxx xxxxxxxx x xxxxxxx xxxx v xxxxxxxxx xxxxxxxxx, který xxxxxxx xxxxxx pro správnou xxxxxxx xxxxx xxx xxxxxxxxx humánní xxxxxx xxxxxxxxx. Xxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx 2017/1569 (viz xxxx). Xxxx xxxxx nezbytné xxxxxxxxxx xxxxxxxx 2003/94/ES xxxxxx x xxxxxx xxxxxxxx xxxx prováděcí xxxxxxxx xx xxxxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx x pro xxxxxxx xxxxxx přípravky xxxxxxx xxxxxx xxxxxxxxxxx xxxxx, x xxxx xxxxxxxx odkazů xx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx.&xxxx; X zájmu xxxxxxxxxxxx xxxx xxxxxx xxxx směrnice - xxxxxxxx 2017/1572, xxxxx xxxxxxx 15 zrušila xxxxxxxx 2003/94/ES. Nová xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx x některé xxxxxxx xxx, aby odrážely xxxxxxxxxxx vývoj xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxx.
Xxxxxxx humánní léčivé xxxxxxxxx xxxxxxxx v Xxxx xxxx do xx xxxxxxxx, xxxxxx xxxxxxxx přípravků xxxxxxxx xxx xxxxx, xxxx xxx xxxxxxxx x xxxxxxx se xxxxxxxx x xxxxxx pro xxxxxxxx xxxxxxx praxi. Xxx xxxx výrobce xxxx xxxxxxx zásady x xxxxxx xxxxxxxxx, xx xxxxx xxxxxxxxxx xxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxxxxx se xxxxx x xxx xxxxx právní subjekty. Xxxxxxxxxx xxxxxxx x xxxxxxxx rozhodnutí x xxxxxxxxxx, xxxxx k xxxx vzájemně xxxx, xx měly být xxxxxxxx x xxxxxxxxx xxxxxx mezi xxxx.
Xxxxxxx xxxxxxxx přípravků musí xxxxxxxx, že xxxxxxxxx xxxx xxxxxx x xxxxxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxx registrace x xx xxxxxxxxxxxxx pro xxxxxxxx riziko x xxxxxx xxxxxxxxxxx xxxxxxx. X xxxxx spolehlivého xxxxxxx xxxxxx cíle xxxxxxxxxx xx xxxxxxx xxxx výrobce xxxxxx xxxxxxxx navržený x xxxxxxx provedený xxxxxxxxxxxxx xxxxxx jakosti, xxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx a xxxxxx xxxxx xxx xxxxxx.
Xxxxxxx xxxxxxx předpisem, xxxxx xx xxxxxxxx xx veškerý postup xxxxxxxxx xxxxxx xxx xxxxxx veřejné xxxxxx, xx zákon č. 500/2004 Sb., xxxxxxx xxx, ve xxxxx xxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxx předpisem x xxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx orgánů xxxxx xxxxxx x xxxxxxxx xxx výkonu xxxxxxxx, xx xxxxx č. 255/2012 Sb., kontrolní xxx.
Xxxxxxxx xxxxxx úprava xxxx xxxxx xx vztahu x xxxxxx xxxxxxxxxxxx x x xxxxxx xxxxxxxx xxxx x xxx.
2. Xxxxxxxxxx hlavních xxxxxxxx navrhované xxxxxx xxxxxx, včetně xxxxxx xxxxxxxxxxxx xxxxxx ve xxxxxx x xxxxxx xxxxxxxxxxxx a xx xxxxxx x rovnosti xxxx a xxx
Xxxxxxxxxx xxxxxx xxxxxx bude xxx pozitivní xxxxx xxxxxxx v xxxxxxxxxxxxx xxxxxxxxx regulovaných xxxxxxx x xxxxxxxx:
x) xxxxxxx xxxx xxxxxxxx padělaných xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxx klinické xxxxx.
X xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx uvádí předkladatel xxxxxxxxxxx.
X rámci celé Xxxxxxxx unie xxx xxxxxxx xxxxxx padělaných xxxxxxxx xxxxxxxxx, xxx xxxxxxxxxx představuje xxxxxxx xxxxxxx, xxxxx přímo xxxxxxxx xxxxxx pacientů. Xxxxxxxx léčivé xxxxxxxxx xxxxxxxxx jak xxxxxxxxx xxx (xxxxxxx léčiv xxxxxxxxxxxxx xxxxxxxx na xxxxxxxxx), xxx legální xxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx (xxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxx xxxx prodejce vyhrazených xxxxx). Xxxxxxxx v xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx x léčivými xxxxxxxxx zacházet na xxxxxxx xxxxxxxxx x xxxx činnosti v xxxxxxx s xxxxxxxxx xxxxxxxx právních xxxxxxxx x xxxx x xxxxxxxxxxxx intervalech xxxxxxxxxxxx xxxxxxxxxxx regulačními autoritami.
Padělané xxxxxx přípravky v xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx x Xxxxxxxx xxxx xxxx rozšířené, xxx xxxxxx xxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxx xx roku roste. Xxxxxxxxxx se xxxxx x xxxxxx xxxxxxxxx xxxxxxxxx x léčbě xxxxxxxx xxxxxxxxx, xxxxxx xxxx, poruch xxxxxx xxxxxxx, xxxxxxx a xxxxxxxxxxxxx onemocnění. Xxxxxxxxxxx xxxxxxx léčivých xxxxxxxxx xx x xxxxxx xxxx velmi xxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxx a xxxx kontrolám mají xxxxxxxxx xxxxxxxxxx příležitost xxxxxxxxxx xx legálního xxxxxxxxxxxxxx řetězce x xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx. Xxxxxxx xxxxxxx x xxx, že xxxxxx xxxxxxxx žádná xxxxxxx xxxxxxxxxxxxx xxxxxx, která xx xxxxxx xxxxxxx xxxxxx padělaných xxxxxxxx xxxxxxxxx xx legálního xxxxxxxxxxxxxx xxxxxxx.
X reakci xx xxxxxxxx riziko xxxxxxxx léčivých xxxxxxxxx x Xxxxxxxx xxxx, xxxx přijata směrnice 2011/62/EU, která stanovila xxxxxx xxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx, který xx xxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxx přípravku, xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx a xxxxxxx, zda xxxxxx x obalem xxxxxxxxxxxx. Xxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx dostatečnou xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského řetězce x členských státech Xxxxxxxx unie x xxxxx chránit xxxxxxxx x xxxxx držitelů xxxxxxxxxx x xxxxxxxxxx x xxxxxxx.
Xx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xx xxxxxx nelegálních xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx 2011/62/EU xxxxxxxx „padělaného xxxxxxxx xxxxxxxxx“:
Xxxxxxxx léčivý xxxxxxxxx je xxxxxxxx xxxxxx přípravek x xxxxxxxxxxxx údaji o xxxx totožnosti, xxxxxx xxxxx x xxxxxxxx xx obalu, xxxxx xxxx xxxxxxx (xxxxxx xxxxx či pomocné xxxxx); xxxxxx (xxxxxx xxxxxxx, xxxx xxxxxx xxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx) xxxx xxxxxxxx (xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx). Xxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxx x xxxxxxx xxxxx, xxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxx x v neposlední xxxx neobsahují xxxxx xxxxxx xxxxx.
Xxx xxxxxx xxxxxxxxx xxxxx byl xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx Evropské xxxx, xxxxxxxxxx xxxx xxxxxxxx přípravků a xxxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx dodavatelského xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx Xxxxxxxx Xxxxxx prostřednictvím xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx zavedení ochranných xxxxx, zejména charakteristiky x technické xxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx - xxxxxxxxxxx xxxxxxxxxxxxxx, způsoby x xxxxxx xxxxxxx ochranných xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxxxxx, distributory, xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx) a xxxxxxx a xxxxxx xxxxxxx úložišť xxxxxxxxxx xxxxxxxxx x ochranných xxxxxxx (jedinečných identifikátorech).
Nařízení x xxxxxxxxxx xxxxxxx xx pro xxxxxxx xxxxx závazné v xxxxx rozsahu x xx xx xxxxx xxxxxxxxx státech přímo xxxxxxxxxx. Předkládaný návrh xxxxxx zákona o xxxxxxxx xxxxxxx x xxxx, že národní xxxxxx xxxxxxx xxxxx xxx xxxxxxxx xxxxx xx oblasti x xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx xxx xxxxx xxxxx xxxxxx xxxxxxxxxx nezbytné x xxxxx xxx nejsou x xxxxxx xxxxxx Xxxxxxxx xxxx xxxxxxxx xxxxx (xxxxxx xxxxxx Xxxxxxxx unie tyto xxxxxxx neupravuje xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxx xxxxx, xxx přijaly xxxxxxx xxxxxx - xxxxx xx xxxx. x xxxxxx xxxxxxxxx trestání) xxxx obsaženy v xxxxxx úpravě Xxxxxxxx xxxx jsou, ale xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxx správy x xxxxxxx humánních xxxxxxxx xxxxxxxxx xx xxxxx, aby xxxx xxxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxxx xx xxxxxx xxxxx x xxxxx xxxxxxx, aby xxxxxxxxx výlučně jim x xxxxxx xxxxxx xxxx xxxxxxxx xxxxxx xxxxxxxxx x xxxxx Xxxxx xxxxxxxxx, xxxxxx xxxxxxxx Xxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxx, x byl xxxxxxx xxxxxx xxxxxxx výkon xxxx jejich působnosti. Xxxxxxxx xxxxxx úpravy xxxxxx x xxxxxxxx xxx xxxxxxxxxxxx xx xxxxxxxx xxxx:
X. Určení xxxxxxxxxxx vnitrostátního orgánu, xxxxx xx xxx xxx xxxxxxx x xxxxxxxx pro xxxxx xxxxxx xxx fungováním xxxxxxx, xxxxxxxxxxx potenciálních xxxxxxx xxxxxxxx, úhrady, xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx x xxxxxxxx a k xxxxxxxxxx x něm xxxxxxxxx pro výše xxxxxxx xxxxx xxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx subjektu, xxxxx zřizuje a xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxx xxxxxxxx jedinečných xxxxxxxxxxxxxx léčivých přípravků xxxxxxxxx xx trh x xxxxxxxx státě. X xxxxxxxxxx České xxxxxxxxx bude příslušným xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx o xxxxxxxxxx xxxxxxx Státní ústav xxx xxxxxxxx xxxxx (xxxx jen „Xxxxx“), x to xxxxxxx x ohledem xx xxxxxxxxx xxxxxx úpravu xxxx působnosti xxxxx xxxxxxx x xxxxxxxx, xxxx xxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx xxxxxxxx přípravků. X xxxxxx důvodu xx xxxxx xxxxxxxx xxxxxxxxx Xxxxxx x §13 xxxxxx x léčivech. Xxxxx xxx xxxx xxxxx povinnosti stanovené x kapitole XX xxxxxxxx x xxxxxxxxxx xxxxxxx. Zejména půjde x xxxxxxxxxxxx informací xxxxxxxxx rozhodnutí x xxxxxxxxxx, xxxxxxxx, distributorům x xxxxxx xxxxxxxxxx xxxx zmocněným xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx, x xxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxx xx území České xxxxxxxxx, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx (v xxxxxxx x článkem 54 xxxx. x) xxxxxxxx 2001/83/XX) x xxxxxxxx xxxxxxxxxxx, xx xxxxx se Xxxxx xxxxxxxxx rozhodla xxxxxxxx xxxxxx působnosti xxxxxxxx (x souladu x článkem 54x xxxx. 5 xxxxxxxx 2001/83/XX). Xxxxx xxxx xxxxxxxxx xxxxx nad xxxxxxxxxx xxxxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, xxx xxxxxx, x xxxxxxx xxxxxxx prostřednictvím xxxxxxxx, xx úložiště x právní subjekt xxxxxxxxx xx zřízení x xxxxxx úložiště xxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxx o xxxxxxxx xxxxxxxx bude předávat Xxxxxxxx xxxxxxxx pro xxxxxx přípravky, která xx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx x Xxxxxx.
X. Zajištění, xxx xxxxxxxxxx, xxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx, xxxx plněny, x xx vymezením xxxxxxxx podstaty xxxxxxxxx x této xxxxxxx, xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx k xxxxxx xxxxxxxxxxxx x stanovením xxxx sankcí xx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx. Xxx xxxxxx xxxxxx oblastí by xxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx x xxxxxxxxxx prvcích x xxxxxxxx xxxxx nevymahatelné x xxxxxxxx by xx míjelo účinkem. Xxxx část je xxxxxxxxxx s xxxxxxx xx xxxxxxxxxx xxxxxx 118x xxxxxxxx 2001/83/XX, xxxxx xxxxxx členským xxxxxx xxxxxxxxx xxxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxxx a xxxx xxxxxx xxxx být xxxxxx, přiměřené a xxxxxxxxxx. Sankce musí xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xxxxxx xxx xxxx xxxxxxxxx s xxxxxxxxxxxx x těmto xxxxxxxxxx směrnice. Xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxxxxxx jako xxxxxxx vysoce nebezpečnou x xxxxxxxxxxx škodlivou x xxxxxx xxxxxxxxxxxx xxxxxxx na xxxxxx xxxxxxxx a xxxxxxxx xxxxxxxxx xxxxxxxx kvalitu xxxxxxxxxxx xxxxxxxxx péče. Xxxxxxxxx xxxxxxx nařízením x ochranných xxxxxxx xx xxxxxxxxx xxxxx xx všech xxxxxxxxx xxxxxxx, tak, aby xx xxxxxx vstupu xxxxxxxxxx xxxxxxxx přípravků xx legálního xxxxxxxxxxxxxx xxxxxxx xx možná xxxxxxx minimalizovalo x xxxxxxx se tak, xx xx pacient xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx x xxxxx xxxxx oprávněné x xxxxxx léčivého xxxxxxxxx. Xxxxxx xxxx xxxxxxxxx x to, že xxxxxxxx xxxxxxxxxx xxxx xxx dopady xx xxxxxx okruh xxxxxxxxxxxxxxx xxxxxxxx, xx. xxxxxxxxxx xxxxxxxxxx by xxxxx xxx xxxxxxxx xxxxx xxxxxxxx x České xxxxxxxxx, xxx x x jiných členských xxxxxxx. Xxxxxxxxx sytému xx xxxxx pouze xxxxx, xxxxx každý, xxxx xxxxxxxx x xxxxxxxxxx prvcích xxxxxx xxxxxx povinnosti, je xxxx xxxx xxxxxx xxxxx. Proto jakékoliv xxxxxxxx xxxxxxxxxx, je xxxxx sankcionovat tak, xxx výše xxxxxx xxxx skutečně xxxxxxxxx xxxxxxxxx xxxxxxxx jednání. Xxxxxx xxxx xxxxxx xxxxxxxxx xxx, xx xx stanovena jejich xxxxx hranice. Xxxxx xxx xxx zohledněny xxxxxxx okolnosti xxxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxx, xxx xxxxxxx k neodůvodněným xxxxxxxxx.
X. Xxxxxxx xxxx xxxx xxxxxxxx oblast xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxxx manipulace x xxxxxx na xxxxxxx xxxxx léčivé xxxxxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 odst. 1 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx), xxxxxx slovy xxxx xxxxxxxxx, aby xxxxxxxxxx xxxxx xxxx xxxxxxxx xxxxx x xxxx xxxxxxxx xxxxxxxxx, které xxxxxxxxx nést xxxxxxxx xxxxx nemají. Česká xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx x ověření xxxxxxxxxx x obalem xx xxxxxxx další xxxxxx xxxxxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 xxxx. 1 písm. c) xxxxxxxx o ochranných xxxxxxx).
X. Xxxxxxxx xxxxx xxxxx „vnitrostátní xxxxxxxx xxxxx“ xxxx „xxxx xxxxxxxx číslo“ identifikující xxxxxx přípravek x xxxxxxxxx na xxxxxxxxxx xxxxxxxxx státu, xxx xxxxx xxxxxx xxxxx xxxx xxxxxx x xxxxx xxxxxxxxxxx identifikátoru xx nikoliv. X Xxxxx xxxxxxxxx xx „xxxxxxxxxxxxx xxxxxxxxx xxxxxx“ xxx přidělený Xxxxxxx xxxxx §32 xxxx. 5 xxxxxx o xxxxxxxx (dále jen „xxx XXXX“). Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxx kód SÚKL xxx xxxxxx v xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xxx., xx xxxx xxxxxxxx xxxxxxxxx xxxx, xxx kód XXXX xx uváděn na xxxxx xxxxxxxxx.
X. Obecnou xxxxxxx danou xxxxxxxxx x ochranných xxxxxxx xx xxxx xxx, xxx x uceleném xxxxxxxxxx systému xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx ze xxxxxxx xxxxxxx xxxx xxxxxxxxx xx xxxxx xxxxxxxxxxxxxx řetězce, tj. xxx xx xxxxxx xxxxxxxxx vydán xxxxxxxxxx. Xxxxxxx xxxx xx xxx ale zohlednit xxxxxxxx charakteristiky xxxxxxxxxxxxxx xxxxxxx na xxxx xxxxx x xxxxxxx xx své xxxxxx xxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxx x xxxxxxx vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx léčivého xxxxxxxxx xxxx xxx, xxx léčivý xxxxxxxxx xxxx některé z xxxx nebo xxxxxxxxx xxxxxxxxx x článku 23 xxxxxxxx x xxxxxxxxxx xxxxxxx:
x) osobám xxxxxxxxxx xxxx xxxxxxxxx vydávat xxxxxx přípravky veřejnosti, xxxxx xxxxxxxx x xxxxx zdravotnického xxxxxxxx xxxx xxxxxxx;
x) xxxxxxxxxxxx xxxxxxx x xxxxxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx,
x) zubním xxxxxxx;
x) xxxxxxxxxxxxx x optikům;
e) xxxxxxxxxxx xxxxxxxxxxxx záchranné xxxxxx;
x) ozbrojeným xxxxx, xxxxxxx a dalším xxxxxxx xxxxxxxxxx, xxxxx xx xxxxxxx xxxxxx xxxxxxxx přípravků xxx xxxxx civilní xxxxxxx x xxxxxxxx xxxxxxxxx;
x) xxxxxxxxxxx a xxxxxx xxxxxxxxxx vysokoškolského xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxx xxxxxxx x xxxxxxxxxx, x výjimkou xxxxxxxxxxxxxx xxxxxxxx;
x) xxxxxxxx;
x) školám;
j) xxxxxxxx;
x) xxxxxxxxxxxxx zařízením.
V xxxxx Xxxxx xxxxxxxxx xxx postup xxxxxxx článkem 23 nařízení x xxxxxxxxxx prvcích, tj. xxx xxxxxxx xxxxxxxxxx xxxxx a xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx ze xxxxxxx úložišť xxxxxxx xxxxxxxxxxx, xxxxxx pouze x xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx
- xxxxxxxxxxxx xxxxxxx,
- Xxxxxx Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx xxx xxxxxx, x xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx x xxx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxx Xxxxx xxxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx xx zahraničí xxxxx §111a xxxxxx o xxxxxxxx x
- xxxxxxxxxxxxxx xxxxxxxxxxx služeb, xxxxxx xxxx podle §77 xxxx. 1 písm. x) xxxx 12 xxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx xxx xxxxx xxxxxxxxx xxxxxxxxxxxx očkování xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxx nebo xxx xxxxx xxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xx xxxxxxx rámcové xxxxxxx xxxxxxxxxxxx s Xxxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx z xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxxx xxxx xxx zákona č. 48/1997 Sb., x veřejném xxxxxxxxxx pojištění x x změně x xxxxxxxx některých souvisejících xxxxxx, xx znění xxxxxxxxxx předpisů.
V xxxxxxxx xxxx 2009 xxxxx x XX ke xxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx (ne již xxxx xxxxxxx hygienické xxxxxxx, xxx přes xxxxxxxxxxx xxxxx), a xx na xxxxxxx xxxxxx xxxxxx č. 48/1997 Sb., x veřejném xxxxxxxxxx xxxxxxxxx x x xxxxx x doplnění xxxxxxxxx souvisejících xxxxxx, x x xxx xxxxxxxxxxx xxxxx xxxxxx č. 258/2000 Sb., x xxxxxxx xxxxxxxxx zdraví x x xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx. X xxxxx zachování stávajícího xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxxx přípravků xxxxxxxxxxxxx xx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxxx o xxxxxxxxxx xxxxxxx (xx. xxxxxxx xxxxxxxxxx prvků) přenést xx xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků s xxxxxxxx článku 23 xxxx. x) nařízení o xxxxxxxxxx xxxxxxx. Xxxxxxxx x xxxxxxxx spočívajícím x absenci xxxxxxxxxx xxxxxxxx xxxxxx zvolil xxxxxxxxxxxx variantu xxxxxxxxx xxxxxxxxxx nařízení x xxxxxxxxxx xxxxxxx využít. Xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx poskytovatelům zdravotních xxxxxx xxxxxxx, které xx xxx xxxxxxxxx čl. 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxx xxx xxxxxxxxx ochranných prvků xxxxxxxxx.
Xxxx naprosto zásadní xx x xxxx xxxxxx xxxx zachování xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků xxx xxxxx xxxxxxxxx xxxxxxxxxxxx očkování a xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxx xxxx xxxxxxx, šířením x xxxxxxx výskytu xxxxxxxxxx xxxxxxxxxx. Xxxxxxxxxxxxx zdravotních xxxxxx dle xxxxxxxxxx §45 odst. 2 xxxxxx x. 258/2000 Xx., x ochraně xxxxxxxxx zdraví a x změně xxxxxxxxx xxxxxxxxxxxxx xxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx, xxxx povinni xxxxxxxx x provést pravidelná, xxxxxxxx x xxxxxxxxx xxxxxxxx, očkování xxx xxxxxxx, poraněních, nehojících xx ranách x xxxx xxxxxxxxx xxxxxxxxx xxxxxx, xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxx, xxxxx mají v xxxx, x rozsahu xxxxxxxxx xxxxxxxxx č. 537/2006 Sb., x xxxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx smlouvou, kterou xx Xxxxx republika xxxxxx. Nevyužitím možnosti xxxx členskému xxxxx článkem 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx, xx. xxxxxxxxxxx xxxxxxxxxx ověření xxxxxxxxxx xxxxx na xxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxxxxx před xxxxxxx xx xxxxxxxx xxxxxx, xx došlo x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx distribuce xxxxxxxxxxxxxx xxxxxxxx přípravků, xxx xx xx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxx, a xx xx svém xxxxxxxx xxxxxxxx x xxxxxxxx úrovně xxxxxxx xxxxxxxxx xxxxxx.
X hlediska xxxxxx xxxxxxx veřejného xxxxxx xx jeví xxxxxx článek 23 xxxx. x) nařízení x xxxxxxxxxx prvcích x xxx xxxxxx distribuce xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxx očkování xxxxxxxxxxxxx xxxx xx xxxxxxx xxxxxxx smlouvy Xxxxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxxxxx.
X xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx zdravotního pojištění xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx, xx jsou xx základě xxxxxx xxxxxxx z xxxxxxxxx xxxxxxxxxxx pojištění, a xx v xxxxxxxxx xxxxxxx xxxxxxxxxx náročném x souladu x xxxxxxxxxxx §30 xxxx. 2 xxxx. x) x f) zákona x. 48/1997 Xx., x xxxxxxxx zdravotním xxxxxxxxx a o xxxxx x doplnění xxxxxxxxx souvisejících xxxxxx, xx xxxxx pozdějších xxxxxxxx. Xxxx xxxxxxx xxx xxxxx očkování xxxxx xxxxxxxx xxxxxxxxxxxx, xxxxx xxxx xxxxxxx xx xxxxxxxxxxx pojištění xxxxx x chlapci (xxxxxxx od 1.1.2018), xx-xx očkování zahájeno xx dovršení 13. xx xxxxxxxx 14. xxxx věku. Xxxxxxxxxxxx xxxxx xxxxxxxx nejen xxxxxxxx xxxxxxxxx xxxxx, xxx x další xxxxxx (xxxx. xxxxxxxx xxxxxx) xxxx xxxxxxxxx xxxxxxxxx.
Xx 1.1.2018 xx xxxxxxx hrazeného xxxxxxxx xxxxx xxxxxxxxxx meningokokovým xxxxxxxx, pneumokokovým xxxxxxxx, xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx Xxxxxxxxxxx xxxxxxxxxx xxx x a xxxxx chřipce, x xx u xxxxxxxxxx x xxxxxxxxx nebo xxxxxxxx xxxxxx xxxxxxx (xxxxxxxxxxxxxx xxxx xxxxxxxx), xxxxxxxxxx po xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxx, xxxxxxxxxx xx závažnými xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxxxx, které xxxxxxxx xxxxxxxxxxxxxx xx specializovaném xxxxxxxxxx, nebo x xxxxxxxxxx xx prodělané xxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx.
Xxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxxxx hrazeného pacientem xxxx xxxxx xxxxxx článku 23 xxxx. x) xxxxxxxx o xxxxxxxxxx xxxxxxx.Xxxxxx xx x xxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx xxxxxxxxxxxxxxx výdeje na xxxxxxx xx poskytovatelů xxxxxxxxxx péče.
Dále xx xxxxxx provést xxxxxx xxxxxxxxx xxxxxxxxxxx úpravy xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx x xxxx xxxxxxxxxxxx xxxxxx x xxxxxxxx, xxxxx x xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxx xx xx navazují.
V xxxxxxxx xxx adaptační xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx úpravu xxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxx xxxxxxxxx na xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxx tvoří xxx xxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxxx, xxxxx xxxxxxxx citovaný xxxxx xxxxxxxxxx xxxxxxx Xxxxxxxx xxxx. Nejedná xx xxxx x právní xxxxxxx, který xx xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx x xx potřeba ho xxxxxx x aplikovat x xxxxx xxxxxxxx.
X xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx uvádí předkladatel xxxxxxxxxxx.
Xxxxxxxx 2017/556 stanoví xxxxxxxx xxxxxxxx xxx xxxxxxxxx inspekčních postupů xxxxxxx xxxxxxxx xxxxx xxxxx nařízení Evropského xxxxxxxxxx x Xxxx (XX) č. 536/2014. Nařízení xxxx xxxxxx x xxxxxxx x článkem 63 xxxxxxxx x. 536/2014, xxxxx zmocňuje Komisi xxxxxxxx xxxx v xxxxxxxxx xxxxxxxxx, v xxxxx stanoví xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx, pokud jde x xxxxxxxxx xxxxxx xxxxxxxxx. Xxxxxxxx xx xxxxx xxxxxxxxxx xx xxxxxxxx dne xxxx xxxxxxxx (EU) č. 536/2014. Xxx je uvedené xxxxxxxx, jak xx xxxx xxxxxxx, xxxxx xxxxxxxxxxxxx, xx xxxxxxx xxxxxxxx x xxxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx, a xx x tomto případě xxxxxx x léčivech, x xxxxxx o xxxxxxxxxxx službách, a xx x xxxxxxxxxxxxx xxxxxx:
- xxxxxxxx xxxxxxx xxxxx, xxxxxxxxx x xxxxxx xxxxxxxxx vymezených xxxxxxxxx 2017/556,
- xxxxxxxx xxxxxxxx xxxxxx 3, xxxxx ukládá členským xxxxxx vytvořit xxxxx xxxxxxxxxxx xxxxxx kvality, xxxxx zajistí, aby xxxxxxxxx postupy xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx,
- zajistit xxxxxxxx xxxxxx 10 xxx 8, tedy xxxxxxxx xxxxxx a xxxxxxx xxxxx, xxxxx zajistí, xxx xxxxxxxxxx z xxxxxxxxx xxxxxxxxx xxxxx xxxx, xx xxxxxxxx x tam, kde xx xx xxxxxx, xxxxxxx k xxxxxx, xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx x xxxxxxxxx hodnocením, xxxxx x x xxxxxxxxx xxxxxxxxxxxx xxxxxx,
- xxxxxxxx xxxxxxxx xxxxxx 13 xxxxxxxxxx se inspekčních xxxxx x xxxxxx xxxxxxx,
- zajistit naplnění xxxxxx 4 týkajícího xx xxxxxx xxxxxxx x xxxxxxxxxxx, xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx,
- zajistit, aby xxxxx xxxx xxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxxx-xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxxxxxxx xxxx přestupek x xxx za xx xxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxx xxxxxx.
Xxxxxxxx 2017/1569 je xxxxxx x xxxxxxx xx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx humánních léčivých xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX, x xxxxxxx x xxxxxxx xx čl. 63 odst. 1 xxxxxxxxx xxxxxxxx, xxxxx xxxxxxxxx, xx hodnocené xxxxxx xxxxxxxxx xxxx xxx vyráběny xx xxxxxxx xxxxxxx xxxxx, xxxxx xxxxxxx kvalitu xxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxxx xxxxxxxxxx xxxxxxxx hodnocení x spolehlivost a xxxxxxxxxx klinických údajů xxxxxxxxx x xxxxxxxxx xxxxxxxxx. Xxxx výrobní xxxxx xxxxxx xxxxxxx xxxxxx správnou výrobní xxxxx x xxxx xxxxxxxx x xxxxxxxxxx xx čl. 89 xxxxxxxx Komise xxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxx zmocnění Xxxxxx xxxxxxxx xxxxxxx xxxxxxxx 2017/1569, x xx xxxxxxx x xxxxxxx na xxxxxxxxxxx xxxxxx:
- je xxxxxxxx xxxxxxxx xxxxxx xxxx xxxxxxx téhož hodnoceného xxxxxxxx přípravku xxxxxxxxx xx stejných xx xxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxx to, xx xxxxx xxxxx xxxxxx hodnoceného xxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxx;
- xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxxx x xxxxxxxxx x xxxxxxx xxxxxxxxxxxxxx xxxxxxxx přípravků, xxxxxxx xxxxxx xxxxx xxxxxxxxx xxxxxxx, xxxxxxxx xxxxx xxxxx xxxxxxxxxx hodnocení, x x xxxxxxxx xxxx také návrhy xxxxx; tyto xxxxx xxxxxxxxx x xxxxxxx (xxxxx) xxxxxxxxx výběru x xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxx (zaslepení). Xxxxx xxxxxxxxx xxxxxx xxx xxxxx xxxxx toxicita, xxxxxxxx a xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxx xxxxxxxxxxxxx veškerá xxxxxx křížové xxxxxxxxxxx xx xxxxx ještě xxxxxxxxxxx než u xxxxxxxxxxxxxx léčivých xxxxxxxxx. Xxxxxxxx k xxxx xxxxxxxxxx by xxxxxxx xxxxxxxx xxxx xxx xxxxxxxxx xxxxxx účinného xxxxxxxxxxxxxxx systému xxxxxxx;
- xxxxxxx výrobní xxxxx, xxxxx jde x xxxxxxx xxxxxx xxxxxxxxx, xxxxx byly xxxxxxxxxxxx xxx uvádění xx xxx, x x xxxxxxxxx léčivé přípravky, xx xxxxxxxx xx xxxxxxxx xxxxxxxx;
- hodnocené xxxxxx přípravky i xxxxxxxxx registrované xxx xxxxxxx xx xxx xx xxxxx vyrábí xx stejných výrobních xxxxxxx. X xxxx xxxxxx xx xxxxxx x xxxxxx xxx xxxxxxxx xxxxxxx praxi xxx xxxxxxxxx xxxxxxx xxxxxx přípravky měly xxx co xxxxxxx xxxxxxx x těmi, xxxxx se xxxxxxxx xx humánní léčivé xxxxxxxxx;
- xxx xxx xxxxxxx schopen xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx, je xxxxxxxx xxxxxxxxxx xxxx xxx x xxxxxxxxxxx. Stejně xxx xxxx xxxxxxxxx xxxxxxxxxxxxx s xxxxxxxx, xxx xxxxxxx xxxxxxxxx xxxxxxxx (XX) č. 536/2014. Xxxxx jsou xxxxxxx x xxxxxxxxx různými xxxxxxxx subjekty, měly xx být povinnosti, xxxxx k xxxx xxxxxxxx mají, stanoveny x xxxxxxxxx xxxxxx xxxx xxxx. Xxxxxx xxxxxx by xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx x xxxxxx xxxxxxxxx o otázkách xxxxxxx;
- xxxxxxxxx léčivé xxxxxxxxx xxxxxxxx do Xxxx xx xxxx xxx vyrobeny x xxxxxxxx xxxxxxxxx jakosti, xxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx standardům v Xxxx. X xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxx xx Xxxx xxxxx xxxxxxxxx xx xxxxxxx xx xxxxx xxxx, xxxxx xx xxxxxxxxx xxxx xxxxxxxx x výrobě x souladu s xxxxxxxx xxxxxxxx xxxx, x níž xx xxxxx.
Xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx se xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx členských xxxxx xxx, xxx xxxx zajištěna xxxxx xx xxxxxxxx a xxxxxx xxx xxxxxxxx xxxxxxx xxxxx. X xxxxx bodě je xxxxxxxx 2017/1569 xxxx xxxxxxxx xx xxxxxxxx 2017/556, xxxxxx se xxxxxxxxx podrobná xxxxxxxx xxx xxxxxxxxx inspekčních xxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxxx 536/2014. I zde xxxxxxxx obsahuje xxxxxxxxxx xxxxxxxxxxx, aby xxxxxxxxxx x zájmu xxxxxxxx x udržení vzájemného xxxxxxxx výsledků xxxxxxxx x Xxxx x x xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx států xxxx x xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxx provádění xxxxxxxx xxxxxxx xxxxxxx xxxxx xxx hodnocené léčivé xxxxxxxxx ve formě xxxxxxx;
- xxxxxx Xxxxxx x xxxx postupy xx měly xxx xxxxxxxxx x pravidelně xxxxxxxxxxxxx x xxxxxxxxxx xx xxxxxxxxxx x xxxxxxxx pokroku. Xxxxx xxxxxxxx na místě xxxxxxxxxx xxxx xxxxxx, xxx xxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxx xxx u xxxxxxxxxxx léčivých přípravků, xxx u xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxx xxxxxxx na trh. X tohoto xxxxxx x x xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxx x pravomoci pro xxxxxxxxx xxxxxxxx x xxxxx xxxxxx, xxx xx xxxxxxxxxx správná xxxxxxx praxe xxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. Tato xxxxx xxxx xxxxxxxxxxxxx s xxxxxxx a xxxxxxxxxxx x oblasti xxxxxxxxx xxxxxxxx xxxxxxxxx - xxx xxxx část xxxxxxxx xxxxxxxx Komise (XX) 2017/1572. X xxxx, aby xxxx xxxxxxxx xxxxxx, xxxx xxx xxxxxxxxxx zajištěna xxxxxxxx oprávnění;
- xxxxxxxxx xxxxxx mají podle xxxxxxxx povinnost vytvořit xxxxxxx xxxxxxx, aby xxxx zajištěno, xx xxxx inspekční xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx. Xxxxx xxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, xxxxx xxxxxxx a xxxxxxx, xxxxxx standardních xxxxxxxxxx postupů, jimiž xx xxxx xxxxxxxxxx xxxxx při xxxxxx xxxxx úkolů, jasně x xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx x požadavky xx xxxxxxxx školení, xxxxx i xxxxxxxxx xxxxxx a xxxxxxxxxx, xxxxxxx účelem je xxxxxxxxx xxxxxxxx.
Xxxxxxxx 2017/1572 xxxx přijata x xxxxx zajistit shodu xx xxxxxxxx x xxxxxx pro xxxxxxxx xxxxxxx praxi. Xxxxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx prováděných příslušnými xxxxxx a o xxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxx ustanovení, která xxxxxxxxx, xxx všechny xxxxxx xxxxxxxxx dostupné xx xxxxx EU xxxxxxxxx tytéž standardy xxxxxxx; léčivé xxxxxxxxx xxxxxxxx xx Unie xxxx být xxxxxxxx x xxxxxxx xx xxxxxxxxx, xxxxx jsou xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxx xxxxxxxxxx x Xxxx.
X xxxxx jednotného xxxxxxxxxxx xxxxx správné výrobní xxxxx musí xxxxxxx xxxxxxxxx léčivých přípravků x xxxxxxxxxx dbát xxxxxx xxxxxxxxx v čl. 47 xxxxxxxx 2001/83/XX, xxx xx xxxxxxx, xx „Xxxxxx x xxxxxx pro správnou xxxxxxx xxxxx xxx xxxxxx xxxxxxxxx xxxxx čl. 46 xxxx. x) xx přijmou xxxxxx xxxxxxxx“ a že „xxxxxxxx pokyny x xxxxxxx x xxxxxxxxx xxxxxxxx Xxxxxx zveřejní x x xxxxxxx xxxxxxx xxxxxxx tak, xxx xxxx xxxxxxxxxxx x technickému x xxxxxxxxx pokroku“. Xxxxxx x xxxxxx pro xxxxxxxx výrobní praxi xxx xxxxxxx léčivé xxxxxxxxx xxxx směrnicí xxxxxxxxx, xxxxx jde x řízení xxxxxxx, xxxxxxxxxx, xxxxxxxx a xxxxxxxx, dokumentaci, xxxxxx, xxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxx, reklamace x xxxxxxx xxxxxxxxx x xxxxx x xxxxxxx xxxxxxxx. Xxxxx xx týká xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx, jsou xxxx xxxxxx x pokyny xxxxxxxxxxxx xxxxxxxxx vlastnostem xxxxxxxxx xxxxxxxxx v xxxxxxx x xxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx.
Xxxxxxx směrnice byla xxxxxxxxxxxxx xx zákona x xxxxxxxx a xxxxxxx xx xxxxxxxx č. 229/2008 Sb. Nahrazení xxxxxxxx 2003/94/ES směrnicí 2017/1572 xxxxxxxx nutnost xxxxx xxx xxxxxx x xxxxxxxx, tak zejména xxxxxxxxxxx xxxxxxxx - xxxxxxxx č. 229/2008 Sb. Xxxxxxxxxxx xxxxxxxx xx xxxxxx xxxxxxxxxx zákona x xxxxxxxx zejména x xxxxxxxxxxxxx xxxxxx:
- úpravy xxxxxxxx xxxxxxx výrobní xxxxx,
- xxxxxxx povinnosti xxxxxxxx vytvořit x xxxxxxxx xxxxxx xxxxxxxx xxxxxxx,
- xxxxxxx xxxxxxxxxx xxxxxxxx zavést xxxxxx xxx xxxxxxxxxxxxx a xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx z distribuční xxxx,
- zajištění toho, xxx výrobci prováděli xxxxxxx xxxxxxx x xxxxxxx xxxxxxxx x xxxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxxxx předloženými v xxxxxxx x xxxxx xxxxxxxxxx.
Xxxxxxxxxx právní xxxxxx xxxx xxxxx x xxxxxxxxxxxx xxxxxxxxxxxx x xxxxxxxx mužů x xxx.
3. Xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx
Xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxx x xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxxxxx výše xxxxxxxxx xxxxxxxx práva Evropské xxxx. Teprve touto xxxxxxxxxxxx xx xxxxxxx xxxxxx vzájemně xxxxxxxxxxx xxxxxxxx v oblasti xxxxxxxxxx xxxxx xxxxxxxxx xx obalu humánních xxxxxxxx přípravků x x oblasti dodržování xxxxx xxxxxxx xxxxxxxx xxxxx. Prostřednictvím xxxxxxxxxxx xxxxxx xxxxxxx x xxxxxx x xxxx xxxxxxxxxx aspektů xxxxxxxxx x xxxxxxx celek, xxxxx xxxx xxxxx xxxxxxxxx x xxxxx. Xxxxx xx k xxxxxxxx xxxxxx xxxxxx xxxxxx o léčivech xxxxxx přistoupeno, xxxxx xxxxxxxxxx předpisy Evropské xxxx (xxxxxxxx) by x Xxxxx republice xxxxxxx být xxxxxx x xxxx zbytku xxxxxxxxxx, čímž xx xxxxx x xxxxxxxx xxxxxxxxxx členského xxxxx. Xxxxxxxx o xxxxxxxxxx xxxxxxx provádí xxxxxxxxxx xxxxxxxx 2011/62/EU. Xxxxx xxxxxxxxx již do xxxxx xxxxxxxx xxxx xxxx směrnici xxxx xxxxxxxxxxxxx xxxxxxx č. 70/2013 Sb., xxxxxx byl xxxxxxxxxxx xxxxx x xxxxxxxx.
Xxxxxxxxxxxxxxx xxxxxxx je xxxxxx xxxxxxxxxxx nepřijetí xxxxxxxx xxxx xxxxxxxx smlouvy x založení Evropské xxxx ze xxxxxx xxxxxxxxx státu a xxxxxxxx řízení xx xxxxxx Evropské xxxxxx xxxxx Xxxxx xxxxxxxxx xx xxxxxxxxx implementační xxxxxxxxxx x popřípadě x uložení xxxxxx xxxxxxxxx takovému xxxxxxxx, xxxxx xx mělo xxxxx xx celý xxxxxx x jeho xxxxxxxxx nikoli xxxxx x xxxxxxx Xxxxx xxxxxxxxx, ale x xxxxxxxxx xxxxxxxxx států, xxxxx jen v xxxxxxx, že xxxxxxxx xxxxx dodržována xxxxx, xxxx xxxxxx funkční. X xxxxxxxxx je xxxxx xxxxx xxxxxxx, xx xx xxxxxxxxx xxxxxx povinností by xxxxxxx ze xxxxxx xxxxxx Xxxxxxxx xxxx xxxxxxxxxxxx takového xxxxxxxx x xxxxxxxxx x xxxxxxx xxxxxx, jejíž xxxx xx xxxxx xxxxx odrážela xxxx xxxxxx v rámci xxxx XX x x xxxxxx xxxxxxx xxxx xx bezpečnost xxxxxxxx. X xxxxxxx xxxxxxx novely, xxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxx xxxxx xxxxxxxxxxx.
Xxxxxxxx xxxxxxxxxx xxxxx xxx xxxxxx xxxxxxxxx v xxxx Evropské xxxx x cílem zohlednit xxxx xxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx trhu x léčivými xxxxxxxxx xx xxxx u xxxxxxxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx a identifikaci xxxxxxxxxxxx xxxxxx a xxxxxxxx, xxx x xxxx bylo manipulováno. Xxxxxx těchto xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx přípravky xxxxxxxxxxx omezení xxxxxx xx xxxxxxxx xxxxxxx xx obecně xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx. X xxxxx xxxx, xxx xxxx xxxxxxxx xxxxx xxxxxx, xx povoleno odstraňovat, xxxxxxxxxx xxxx xxxxxxxxx xxxx prvky xxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx podmínek. Xxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxx xxx xxxxxxxxx rovnocennými xxxxxxxxxx xxxxx. Tyto xxxxxx xxxxxxxx xx xxxx xxxxxxxx dostatečnou xxxxxxx proti vstupu xxxxxxxxxx xxxxxxxx přípravků xx legálního xxxxxxxxxxxxxx xxxxxxx x cílem xxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x výrobce. Xxxxxxxxxxxx xxxxxxxxxx xxxxx x léčivých xxxxxxxxx xxxxxxxxxx na xxxxxxxx xxxxxxx si xxxxxx xxxxxxxxxx a xxxxxx xxxxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx, xxxxxxx v xxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx byl xxxxxxxxx Xxxxxx Assessmentu xxxxxxxxxxx Xxxxxx v xxxxx vydání nařízení x ochranných xxxxxxx.
Xxxxxxxxx xxxxxxxxxx a nevytvoření xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx řádného xxxxxxxxx xxxxxxxxxx xxxxx xx xxxxx xxxxxxxxx léčivých xxxxxxxxx x České xxxxxxxxx xx xxxxxxx x potřebnému xxxxxxx xxxxxxxxxxx xxxxxxxx přípravků x xxxxxxxx dodavatelském xxxxxxx, což xx xxxxx vést x xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxx, a xxxxx xx xxx xxxxxxx nenahraditelné xxxxxxx xxxx x xxxx xxxxxxxxx xxxxxxx xxxxxxx x xxxxxxxx vystavení xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxxx xxxxxx xxxx xxxxxxxx pouze x xxxxxxx, kdy xxxxxxx xxxxxxx xxxxxxxx a xxxxxxxxxxxx příslušné orgány x xxxxxxx xxxxx XX xxxxx xxxxx xxx xxxxxxxxxx vyplývající x výše uvedených xxxxxxxx předpisů EU.
Nedostatečná xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx přípravků xx xxxxxxxxx dodavatelského xxxxxxx x xxxxxx xxxxx znamená, že x xxxx xxxxx xx xxxxxxxx xxxxxx xxxxxxxxx xxxxx snadněji xxxxxx xx jiných xxxxxxxxx států (viz xxxxx xxxxx zboží x EU), xxx xxxx xxxxxxxx xxxxxxxxx xxxxx a xxxx. Xxxx xx bylo x rozporu x xxxxxxxxx xxxxxxxx spolupráce.
K xxxxxxx xxxxxxx novely, xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxx praxe xxx xxxxxxxxx xxxxxx xxxxxxxxx x zajištění xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx, xxxxxxxxxxxx xxxxx xxxxxxxxxxx.
Xxxxxxxx, xxx xx xxxx xxxxxxx, xxxx xxxxx aplikovatelná, xxxxxx xx xxxxxxxx x rámci xxxxxxxx xxxxxxxxxxxx norem xxxxxxxxxxxxxx xxxxxxxx xxxx Xxxxx xxxxxxxxx xx tyto xxxxx xxxxx Xxxxxxxx xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx x xxxxxxxx x xxxxxx x zdravotních xxxxxxxx xxx, aby xxxx xxxxxxxxxx z nařízení xxxxxxxxxxx xxxxxxxxxxx a xxxxxxxx xxxxxx tvořil xxxxx koherentní xx xxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx x xx xxxxxxxx xxxxxxx xxxxx xxxxxxxx přípravků.
4. Xxxxxxxxxx xxxxxxx navrhované xxxxxx xxxxxx x xxxxxxxx xxxxxxxx Xxxxx xxxxxxxxx
Xxxxx xxxxxx xxxxxx o xxxxxxxx x xxxxxx x xxxxxxxxxxx xxxxxxxx xx v xxxxxxx x xxxxxxxx pořádkem Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx pravidla xxxxxx xxxxxx xxxx, xxxxxx lze podle článku 2 xxxx. 3 Xxxxxx x článku 2 xxxx. 2 Xxxxxxx xxxxxxxxxx xxxx a xxxxxx xxxxxxxxxx xxx x případech x x xxxxxx stanovených xxxxxxx, x xx xxxxxxxx, xxxxx xxxxx xxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx taktéž xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx, xxxxxxxxxx v článku 4 xxxx. 1 Xxxxxxx xxxxxxxxxx práv x xxxxxx, xxxxx xxxxxxx x xxx, že xxxxxxxxxx mohou xxx xxxxxxxx xxxxxx na xxxxxxx zákona x x xxxx mezích x xxx xxx xxxxxxxxx xxxxxxxxxx xxxx x svobod. Xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx v xxxxx ochrany xxxxxx x xxxxxx pacientů x nejdou nad xxxxx Ústavy České xxxxxxxxx a Xxxxxxx xxxxxxxxxx práv x xxxxxx. Navrhovanou xxxxxx xxxxxxx se xxxxxxx xxxxx xxxx bezpečnosti xxxxxxxx přípravků pro xxxxxxxx x hlouběji xx xxx naplní xxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx článku 31 Xxxxxxx xxxxxxxxxx xxxx a xxxxxx xxxx součásti xxxxxxxxx pořádku Xxxxx xxxxxxxxx.
Xxxxxx dle xxxxxxxx x podrobných xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx xx tzv. x xxxxxx xxxx xxxxxx xxx xx xxxxxxxxxx případy, xxxxx xxxxxxxxxx xxxxxxxxx na xxxxxxx xxx uděleného xxxxxxxx právě x xxxxxx xxxxxxxxx xxxxxxxxx. Xxxx xxxxxxxx bude xxxxxxxx příslušný xxxxx xxxxxx xxxxxxxxx xxxxx. Xxxxxxx, xxx by xxxxxxx xxxxx xxxxxxxxxx xxxxxxxx, je xxxxx xxxxxxxxx xx exces. X pověření x xxxxxxxxx xxxxxxxx, xxxxxx xxxxxx, xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxx započetím xxxxxxx xxxxxxxxx, x xx x x xxxxxxxxx, kdy xxxxx xx. 8 xxxxxxxx xxxxx xxx inspekce x xxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxx.
Xxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxx republiky, xxxxxxxxx xxx článkem 12 Xxxxxxx xxxxxxxxxx xxxx x xxxxxx, xxxxx stanoví, xx xxxxxx xx xxxxxxxxxxxxxxxx xxxxxx mohou xxx xxxxxxx xxxxxxxx, xxx xx-xx xx x xxxxxxxxxxxx společnosti xxxxxxxx xxx xxxxxxx xxxxxx nebo xxxxxx xxxx, xxx ochranu xxxx x xxxxxx xxxxxxx anebo xxx xxxxxxxxx závažného ohrožení xxxxxxx xxxxxxxxxxx a xxxxxxx. Xxxxx xx xxxxxx užíváno xxxx xxx podnikání nebo xxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx, xxxxx být xxxxxx zásahy xxxxxxx xxxxxxxx, též xx-xx xx nezbytné pro xxxxxx úkolů veřejné xxxxxx.
5. Zhodnocení xxxxxxxxxxxxx xxxxxxxxxx právní xxxxxx x xxxxxxxx Xxxxxxxx xxxx, xxxxxxxxxxx soudních xxxxxx Evropské xxxx xxxx obecnými právními xxxxxxxx xxxxx Evropské xxxx
Xxxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx, nařízení o xxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx praxe xxxxx nařízení 536/2014 x xxxxxxxx, xxxxxx xx xxxxxxxx xxxxxxxx 536/2014 xxxxxxxxxx zásad x xxxxxx xxx xxxxxxxx xxxxxxx praxi xxx hodnocené xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx inspekcí, xxxx. transponuje xxxxxxxx, xxxxxx se xxxxxxxx xxxxxxxx 2001/83/XX, pokud xxx o zásady x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxx xxxxxxx léčivé xxxxxxxxx.
Xxxxxxxxxx zákon není x rozporu xx xxxxxxx xxxxxxxxxxxxx pro Xxxxxx republiku x xxxxxxxx v Xxxxxxxx xxxx, Xxxxxxxx o xxxxxxxxxxx České republiky x Xxxxxxxx xxxx xxx x xxxxxxxxxxx xxxxxxxx orgánů Xxxxxxxx xxxx x xx x xxxxxxx x xxxxxxxx xxxxxxxx práva Xxxxxxxx unie (např. xxxxxxx xxxxxx jistoty, xxxxxxxxxxxxxxx a xxxxxx xxxxxxxxxxxx).
X xxxxxxxx Xxxxxxxx xxxx, xxxxx xx xxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx a xx oblast stanovení xxxxxxxx xxx xxxxxxxx xxxxx xxxxxxx na xxxxx humánních xxxxxxxx xxxxxxxxx, xx návrh xxxxxx xxxxxx x xxxxxxxx xxxxx dotýká xxxxxx předpisů:
- xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/ES xx xxx 6. xxxxxxxxx 2001 o kodexu Xxxxxxxxxxxx xxxxxxxxx se xxxxxxxxx léčivých přípravků, x platném znění (xxxx xxx „xxxxxxxx 2001/83/ES“),
- směrnice Evropského xxxxxxxxxx a Xxxx 2011/62/EU ze dne 8. června 2011, xxxxxx se xxxx xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx týkajícím xx xxxxxxxxx léčivých xxxxxxxxx, xxxxx jde x zabránění xxxxxx xxxxxxxxxx léčivých přípravků xx xxxxxxxxx dodavatelského xxxxxxx (xxxx xxx „xxxxxxxx 2011/62/EU“),
- xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) 2016/161 xx dne 2. xxxxx 2015, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx prvky uvedené xx xxxxx humánních xxxxxxxx xxxxxxxxx (xxxx xxx „xxxxxxxx x xxxxxxxxxx xxxxxxx“).
Xxxxxxxxxxx návrh xxxxxx je xxxx xxxxxxxxxx x xxxxxxxx Xxxxxxxx unie, xxxxxxxxxxx xxxxxxxx xxxxxx Evropské xxxx x xxxxxxxx xxxxxxxx xxxxxxxx xxxxx Xxxxxxxx xxxx.
6. Zhodnocení xxxxxxx x xxxxxxxxxxxxx xxxxxxxxx, xxxxx xx Xxxxx xxxxxxxxx vázána
Navrhovaná xxxxxx neodporuje xxxxxxxxxxxx xxxxxxxx, xxxxxxx xx Xxxxx xxxxxxxxx vázána. Xxxxx se x xxxx xxxxxxxxxxx xxxxxxx:
- xxxxxx x xxxxxxxxx xxxxxxxx ve xxxxxx x xxxxxxxxxx xxxxx, xxxxxxxxx x označení xxxx Evropským xxxxxxxxxxxxx x Xxxxxxxxx (Xx. xxxx. X 229, 17.8.1998, x. 3),
- xxxxxx o vzájemném xxxxxxxx xx xxxxxx x xxxxxxxxxx xxxxx xxxx Xxxxxxxxx xxxxxxxxxxxxx x Xxxxx Xxxxxxxx (Xx. xxxx. L 229, 17.8.1998, x. 62),
- dohoda o xxxxxxxxx uznávání xxxx Xxxxxxxxx xxxxxxxxxxxxx x Xxxxxxx (Xx. xxxx. X 280, 16.10.1998, x. 3),
- xxxxxx x xxxxxxxxx uznávání xxxx Xxxxxxxxx společenstvím x Xxxxxxxxx (Xx. xxxx. X 284, 29.10.2001, x. 3),
- xxxxxx xxxx Xxxxxxxxx xxxxxxxxxxxxx x Xxxxxxxxxx xxxxxxxxxxx x vzájemném xxxxxxxx xx vztahu x xxxxxxxxxx shody (Xx. věst. L 114, 30.4.2002, x. 369).
7. Xxxxxxxxxxxxx hospodářský x finanční xxxxx xxxxxxxxxx právní xxxxxx xx státní xxxxxxxx, xxxxxxx xxxxxxx xxxxxxxx, xx podnikatelské xxxxxxxxx Xxxxx republiky, sociální xxxxxx, xxxxxx xxxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxx, xxxxxxx xxxxx xxxxxxxx xxxxx, osoby xx xxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxx, xxxxxx xx xxxxxxx xxxxxxxxx
Xxxxxxxxxx úpravy za xxxxxx xxxxxxxxx adaptace xxxx xxxxxxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx nebudou xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx na xxxxx xxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xx xxxxxxxxxx xxxxxxx xxxxxxxxxxx pod xxxxxxxxxxx kapitolu Xxxxxxxxxxxx xxxxxxxxxxxxx, konkrétně xx xxxxxx Xxxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xxxxxx xxx xxxxx xxxxxxxx dopady, xxxx xxxxxx xx xxxxxxxxxx skupiny xxxxxxxx (xxxxx sociálně xxxxx, xxxxx xx zdravotním xxxxxxxxxx, xxxxxxxxxxx xxxxxxx), xxx xxxxxx na xxxxxxx xxxxxxxxx.
Xxxxxx na xxxxxxxxxxxxx prostředí Xxxxx xxxxxxxxx xx xxxx x xxx xxxxxxxxxxx xxxxxx x léčivech, xxxxx do něho xxxx vložena xxxx xxxxxxx, xx. zákonem č. 70/2013 Sb., x xxxx xxxxxxxxx xxxxxxxx, xxxxxxxx xx váží přímo x xxxxxxxx x xxxxxxxxxx prvcích. Xxxx xxxxxx již xxxx xxxxxxxxx xxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. X xxxxx xxxxx xx třeba xxxxxxx xx důvodovou xxxxxx, xxxxxx zprávy x xxxxxxxxx xxxxxx xxxxxxxx (XXX) x xxxxxx č. 70/2013 Sb. a xxxx xx xxxxxxxxx xxxxxx XXX k xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx „Impact Xxxxxxxxxx“. X xxxx podrobné xxxxxx se uvádí, xx v xxxxxxx x čl. 4 xxxxxxxx 2011/62/XX a xx. 54x xxxx. 2 x 3 xxxxxxxx 2001/83/XX Xxxxxx xxxxxxxxx xxxxxxx, xxxxxxx a xxxxxxxxxx xxxxxxxxxx různých xxxxxxxx xxx charakteristiky x technické specifikace xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx x správu systému xxxxxxx.
Xxxxxxx realizace xxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxxx xxxxxxx xx xxxxxxx x xxxxxxxx xxxxxxxxxx x registraci xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx prvky xxxxxxx xxxxxxx na xxxxxxx x správu xxxxxxx xxxxxxx (xxxx xxxxxxxxx xxxx xxxxxxx již xxxxxxxx 2011/62/EU, xxxxx xxxx xxxxxxxxxxxxx do xxxxxxxx xxxx XX xxxxxxx č. 70/2013 Sb.). Pro xxxxxxx a xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru na xxxxxxx xxxxxxxxx léčivých xxxxxxxxx xxxxx xxxxxxx, xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxxx výrobní xxxxx xxxx xxxxxxx xxxxx (xxxxxxxx xxxxxxx) x xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx, xxx xxxx možné xxxxxxxx xxxxxxxxx o xxxxxxxxxxx xxxxxxxxxxxxxxxx do systému xxxxxxxx. Aby xxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx, xxxx xxx xxxxxx xxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx a xxxxxxx z xxxxxxxx:
- xxxxxxxxx xxxxxxx (xxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx pravosti xxxxx xxxxxxxxxxxxxx systémem EU xx vyloučí potřeba xxx více xxxxxxxxx xxxxx, xxx vyhověly xxxxxxxxxxxx jednotlivých xxxxxxxxx xxxxxxx),
- xxxxxxx xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx x registraci (xxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx povede x xxxxxxx xxxxxxxxx xxxxxxx),
- xxxxxxxxx a xxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxxx xxxxxx xxxxx (xxxxx x doba xxxxxxxxxxxxx) uvedené v xxxxxxxxxx xxxxxxxxxxxxxx.
Xxxxxxxx xxxx xxxx náklady xx xxxxxx xxxxxxx, xxxxxxx xxxxxx XX, xxxx xxxxxx x v xxxxx xxxxxxx x xxxx výkonnější XX. X xxxxxxxx xxxxxxxxxxx xxxx xx xxxxxxx „xxxxxxxxx xxxxxxx“, xxxxx xxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx. Proto xx xxxxxxxx, aby xxxx xxxx xxxxx xxxxx x xxxxxxxx xxxx. Náklady xxxxx xxxxxxx je nutné xxxxxxxxx, xxxx x xxxxxxxx nákladů x xxxxxxx, xx xxxxxxxxxxx xxxxxxxxxxx, x to xxxxx prizmatem ochrany xxxxxxxxx xxxxxx. Xxxxx xx xxxxxxxxxxxx (xxx xx xxxxxx XX, xxx vnitrostátní) xxxxxxx xxxxxxx systém xxx, xxx xx xxxxxxxxxx.
Xxxxxx xx xxxxxxxxxx xxxxxxxx xx xxxx x xxxxxxxx přípravky, xxxxx xxxxx xxxxxxxxx xx xxxx novelu, xx xxx xxx xxxxxxxx xxxxxx nařízení x xxxxxxxxxx prvcích xxxx xxxxxxxx, xxx xxxxx xxxxxx této xxxxxx, xxxx xxxxxxx těch xxxx, ve xxxxxxx xxxx Česká xxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxx zvolit xxxxxxxxx, xxxxx se xxxxx xxxxxxxxxx xx jejím xxxx.
Xxxxxxx xxxxxxxxxxxx léčiv x osob oprávněných xxxx zmocněných x xxxxxx léčivých přípravků xxxxxxx s povinností xxxxxxxx xxxxxxxx xxxxx x vyřazovat xxxxxxxxx xxxxxxxxxxxxx ze xxxxxxx xxxxxxx (pořízení xxxxxxxxxx xxxxxxx 2X xxxx, xxxxxx xxxxxxxxxxxxx a xxxxxxxxxxxx xxxxxxxx apod.).
Finanční xxxxx navrhované xxxxxx xxxxxx xx xxxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxxxx ochranných xxxxx xx registrační xxxxxxxxxxx xx očekává xxxxxxxxx, xxxxx xxxxx vztahující xx x xxxxxxxxxxx xxxxxxxxxxxxxx lze xxxxxx xx xxxxx obalu x xxxxx jakéhokoli xxxxxx s xxxxxxx xx informace x xxxxxxxxx - xxxx. xxxxxx x prodloužení xxxxxxxxx xxxxxxxxxx, řízení x xxxxx registrace xxxx II, xxxx XX xxxx xxxx XX. Xxxxxxxxxx xxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxx charakteru xx xxxxxxxx xxxxx x xxxxxxx, xxxxx x xxxxxxxxxx období xxxxxx předložena žádná xxxxx xxxxxxxxxx, xxxxx xxxxxxx informace x xxxxxxxxx. Xxxxxxxxxx xxxxxxx x změnu registrace xxx xxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx xxx nezbytné xxxxx x xxxxxxx, kdy xxxxxxxxxx k xxxxxxx xxxxxxxxxx x obalem xxxx xxx vliv xx xxxxxxxxx xxxxx, xxxx xxxxxxx xxxxxx xxxxxxxx obalu. Xxxx xxxx stanoveno, xx xxxxxxxxx xxxxxxxxxxxxx i xxxxxxxxxx k xxxxxxx xxxxxxxxxx x obalem xx xxxxx implementovat xxxx předložením nebo xxxxxxxxxx příslušné xxxxxxx x změnu xxxxxxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxx xxxx xxxx xx xxxxxxxxx xxxxx. Vzhledem x výše xxxxxxx xxxxxxxxxxx, xxx pro xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxx pro xxxxxxxx xxxxxxxxxx prvků xxxxxxxxxx zvláštní xxxxxx x změnu xxxxxxxxxx x xxxxxxxx xxxxx xx možné xxxxxxxxxxxxx xxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx, xxxxx xx xxxxxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx x x xxxxxxx xxxxxxxxxxxx xxxx xx vyřízení xxxxxxxxxxxx xxxxxxx xxxx xxxxxxxxx.
Xxx obecně souhlasit x tím, xx xxxxxxx výrobců x xxxxxxxx rozhodnutí o xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx obaly ponesou xxxxxxxx xxxxx, xx x xxxxxx zavedení xxxxxxxxxx prvků do xxxxxx míry přechodně xxxxx. Toto zvýšení xxxx xxxx xx xxxxxx k xxxxxxxxx xxxxxxx farmaceutických xxxxx xxxxxxxxxxxx, xxxxx xxxxxxx xx zavedení XX xxxx u xxxx xxxxxxxx na xxxxxx xxxx xxxxx xxxxx xxxxxx xxxxx než xxxxxxxx náklady na xxxxx, výrobu x xxxxxxxxxx xxxxxxxx přípravků. Xxxx xxxxxxxx přípravků, xxxxxxx výdej xx xxxxx xx xxxxxxxx xxxxxxx, xx ve xxxxxxx případů regulována xxxxxxxx stanovení xxxxxxxxx xxxx správním rozhodnutím, xxxxxx xxx zvýšit xxxxx xx základě xxxxxx xxxxxxxxxxx xxxxxxx. Xxxxxxxx xxxx x xxxxxxxx xxxxxx léčivého xxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx v xxxxx správního řízení. Xxxxx xx x xxxxxx Evropské xxxx (xxxxxx XX) xxxxx xxxxxxx xxxxxxx xxx. xxxxxxxx xxxxxxxx xxxxxxxxxxxxx - xxxx xxxxxxxxx xxxx x xxxxxx xxxxx nejnižších xxx xxxxxxxx xx porovnatelného xxxxxxxx xxxxxxxxx zjištěného x xxxxxxxxx, xxxxx xx v xxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxx x ČR xxxx xx xxxxxx léčivého xxxxxxxxx x xxxxxxxxxx xxxxxxxxx zdravotního xxxxxxxxx. Xxxxxxxx x xxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx na xxxxxxxxx (xxxxxxx) trhu x xxxxxx se xxxxxxxxx xxx xxxxxxxx přípravků x xxxxxx xxxxxxxx xxxxxxxxxx xxxxx nepředpokládá, xxxx nebude xxxxxxxxxxx xx xxxxx inflace. Xxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx maximální, xx nákladů xxxxxxxxx xxxxxxxxxxx pojištění xx xxxxxxx úhrada xxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxx.
Xxxxxxx distributorů léčiv xxxxxxx s xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxx. Xxxxx se x pořízení xxxxxxxxxx xxxxxxx 2D xxxx, xxxxxx softwarových xxxxxxxx xx xxxxxxx xx xxxxxx xxxxxx. Xxxxxxx xxxxx xxxxxxx xx xxxxx xxxxxxxxx, xxxx x xxxxxxxx xxxxxxx x xxxxxxx, za xxxxxxxxxxx převažující, x xx rovněž xxxxx xxxxxxxxx xxxxxxx veřejného xxxxxx. Proto xx xxxxxxxxxxxx (xxx na xxxxxx EU, xxx xxxxxxxxxxxx) rozhodl vymezit xxxxxx xxx, xxx xx xxxxxxxxxx.
Xxxxxxxxxxx x xxxxxxxx xxxxx návrhu x xxxxxxx provádění xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx přípravků byl xxx xxxxxxxx v xxxxx novely xxxxxxxxxxx xxxxxxxx nařízení 536/2014, x xxx xx xxx x xxxxx xxxxxxx. Xxx nařízení xxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxx 536/2014 x upřesňují x x xxxxxxxxxxxxx xxxxxxxxx xx, xx nařízení x xxxxxxxxx hodnocení xxxxxx. Xxxxxx nové xxxxxxxx 2017/1572 bylo xxxxxxxx právě xxxxxxx xxxxxxxx 2017/1569 a xxxxxxxxx xxxxxxxxxx xxxxxxx xx xxxxxxxxx právní xxxxxx, pokud xx xxxx xxxxxxxxxxxxx a xxxxxxxxxx xxxxxx.
Xxxxxx xxxxxxxx xxxxxx xxxxxxx administrativními x personálními náklady xxxxxxxxxxxxx x výkonem xxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxx nařízeními x xxxxxxx, xxx bylo xxxxxxx x xxxxxxxx xxxxxx k návrhu xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx 536/2014 (xxxxx č. 66/2017 Sb.).
8. Zhodnocení xxxxxx xx vztahu k xxxxxxx xxxxxxxx x xxxxxxxx údajů
Návrh xxxxxx x xxxxxxx ochranných xxxxx léčivých xxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxx. Xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx přípravků xxxx xxxxxxxxxxx informace xxxxxxxxxx xx pouze x xxxxxxx xxxxxxxxxx xxxx xxxxxxxx, xxxxxxx xxxxx xxxxxxx ochranné xxxxx. Xxxxxx nebude xxxxxxxxxxx xxxxxx údaje pacientů, xxxxxx xxxx vydány xxxxxx xxxxxxxxx, jejichž xxxxx xxxxxxx ochranné xxxxx. Xxxxxxxx tak xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx údajů. Návrh xxxxxx v xxxxx xxxxxx nebude mít xxxxx negativní dopady xx xxxxxx ochrany xxxxxxxx a xxxxxxxx xxxxx.
Xxxxxxxxxx právní xxxxxx xx x oblasti xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxx xxxxxxx xxxxxxxx, x xx xxxxxxxxxxxx xxxxxxxx. Xxxxxxxx 2017/556 xxxxxxx inspektorů xxxxxx široké pravomoci, xxxxx xx týká xxxxxxxx xx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx. Xxxxxxxxxx xxx xxxxx xxxxx budou xxx xxxxxxx k xxxxxxx xxxxxx včetně citlivých xxxxxxxx údajů. Xxxxxxxx xxx xxxxxxxxx ochranu xxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx údajů subjektů xxxxxxxxxx hodnocení xxxxxxxxxx xx xxxxxx, jakož x důvěrných obchodních xxxxxxxxx, xxxx inspektory x xxxxxxxxx podílející xx xx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx x použitelnými xxxxxxxxx xxxxxxxx xxxxxxxx Xxxx x xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx. V xxxxxx 14 xxxxxx xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx do xxxxxxxxxxx xxxx xxxxxxxxx zachovávat xxxxxxxxx jakýchkoli xxxxxxxxx, x nimž xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxx správné klinické xxxxx.
Xxxxxxxx xxxx výslovně xxxxx, xx xxxxxxxxx xxxxxx xxxxxxxxxx prostřednictvím xxxxxxx EU (x xxxxxxx s čl. 78 xxxx. 6 xxxxxxxx x. 536/2014) xxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxxxx (čl. 13 xxxxxxxx 2017/556)
Xxxxxxxxxx a xxxxxxxxx xxxxxxxxxx se xx xxxxxxxxxx xxxx xxx xxxxxxxxxxxx osobních xxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx xxxxx č. 2016/679 (Xxxxxxx Data Xxxxxxxxxx Regulation, XXXX).
Xxxxxxxx č. 2017/1569 x kapitole XXX xxxxxxxx xxxxxxxx, xxxxxxxxxxxxxxx xxxxxxx xxxx xxxxxxx státy xxxxxxx xxxxxxxx, aby v xxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx praxe xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx v tomto xxxxxxxx. X xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx široké xxxxxxxxx, xxxxx xx týká xxxxxxxx xx xxxxxxx x xxxxxxxxx xxxxxxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx x v xxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxxx, xxxx stanoví, xx xxxxxxxxx xxxxxxx xx základě xxxxxxxx xxxx zůstat xxxxxxx.
Xxxxxxxxxxx xxxxxxxx se xxxxxxxx xxxxxxxxxx xxxxxx o xxxxxxxx, xxx xxxxxx x xxxxxxxxxxx xxxxxxxx, xxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxx, které xxxxxxxxxx xxxxxxx x xxxxx prováděných xxxxxxx x xxxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxxx xxxxx a xxxxxxx xxxxxxx praxe xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxx nařízení č. 536/2014, x ty xxxxx xxxxxxxxx x souladu x nařízeními 556/2017 x 1569/2017. Xxxxxxxx xxxxxxxxx xxxxx xxxxxx x xxxxxxxx xxxx xxxxxxxxx x souladu x kontrolním řádem, xxxxx obsahuje xxxxxxxxxx xxxxxxxx nejen xxxxxx xxxxx fyzických osoba, xxx veškeré údaje xxxxxxx xx základě xxxxxxxxx xxxxxxxx. Xxxxxxxxx xxxxxxxx z xxxxxx xxxxxxxx xxxx xxxxxxxxxxxx xxxxx, xxxx kterému xxxxxxxx právní xxx Xxxxx republiky xxxxxxxx xxxxxx. Osobní xxxxx xxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxx, a x účinností xx xxxxxx 2018 pak xxxxxxxxx XX.
Xx základě xxxx xxxxxxxxx xxx xxxxxxxxxxx, xx ve xxxxxx x ochraně xxxxxxxx x xxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx.
9. Xxxxxxxxxx korupčních xxxxx
X xxxxx xxxxxxxx xxxxxx xxxxxx byla komplexně xxxxxxxxx xxxx xxxxxxxxxx xxxxx v xxxxxxx x xxxxxxxxx zpracovanou Xxxxxxx xxxxxxxxx xxxxxx xxxxxxxx Xxxxx vlády Xxxxx xxxxxxxxx. Xx xxxxxx xxxxxxxxx xxxxxxx, xx x návrhu xxxxxx xxxxxx xxxxxxx xxxxxxxx potenciál, který xxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxx.
Xxxxxx xxxxxxxxx xxxxxxxx xx mohla xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xx xxxxxx x xxxxx xxxxxxxxx xxxxxxxx: x xxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx. X nařízení 2017/1569 xx to článek 23, xxxxx xxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxxxxx xxxxxx vystaveni žádným xxxxxxxxxxx xxxxxx, xxxxx xx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxx a xxxxxx.&xxxx; Výslovně xxxxx, xx inspektoři xxxx xxx xxxxxxxxx xxxxxxx xx xxxxxxxxxx, xxxxxx x xxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxxxx x na xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxxxx povinnost xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxx finančních xxxxxxx xx stranách xxxxxxxxx inspekcemi xxxx x xxxxxx xxxxxxx xx ně. Příslušný xxxxx xxxxx xxxxxxxxxx x úvahu xxx xxxxxxxxxxx konkrétních inspekcí xxxxxxxxxxx xxxxxxxxxxx.
X xxxxxxxx 2017/556 ustanovení článku 5 xxxxxxx, xx xxxxxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx xxxxx, který xx xxxx xxxxxxxxxx xxxxxx nestrannost nebo xxxxxx xxxxxxxxx, xxxxx xxx xx xxxxxx xxxxx. Zejména musí xxx xxxxxxxxx xx xxxxxxxxxx, xxxxxxxxxxxx účastnících xx xxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx a na xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx. Rovněž x toto xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx o xxxxx finančních xxxxxxx x xxxxxx xxxxxxx xx xxxxxxxx, ve xxxxxxx xxxx být xxxxxxxx xxxxxxxxx. X xxxxxx prohlášení se xxxxxxxx xxx xxxxxxxxxxx xx xxxxxxxxx xxxxxxxx. Xxxxxxxxxx právní úprava xx xxxxxx ustanovení xxxxxxxxxx x xxxx xx xxxxxxxxxx. Xxxx xxxxxxxxxx xxxx xxxxx xxxxxxx.
Xxxxx xx xxxx xxxxxxxxxxx směrnice 2017/1572, x čl. 3 xxxxxx xxxxxxxx xxxxxx povinnost xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x čl. 111 xxxx. 1x směrnice 2001/83/XX xxxxxxxx, xxx xxxxxxx, kteří mají xxxxxxxx xxxxx čl. 40 xxxx. 1 x 3 xxxxxxxx 2001/83/XX, xxxxxxxx zásady x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxx směrnicí. Xxxx xxxxxxx, xx při xxxxxxx zásad x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx přihlédnou xxxxxxx a příslušné xxxxxx x xxxxxxxxx xxxxxxx xxxxxxxx x čl. 47 xxxxxx xxxxxxxxxxx xxxxxxxx 2001/83/XX. X xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxx xx xxxxxxxxx ke xxxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxx praxi xxxxxxxxx xx léčivých xxxxxxxxx pro moderní xxxxxxx, xxx xxxx xxxxxxx x článku 5 xxxxxxxx (XX) x. 1394/2007 o xxxxxxxx xxxxxxxxxxx xxx xxxxxxx xxxxxxx. Xxxxxx 3 xxxxxx xxxxxx xxxxxxxx xxxxxx xx xxxxx xxxxxxxxxxxxxx xxxxxxxx x xxxxxx důkladně xxxxxxxx xxxxxx jakosti, který xxxx pracovníci x xxxxxx xxxxxxxxxxxx dodržovat. Xxxxxxx systém jakosti xx xxxxx xxxxxxx xxxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxx x xxxxxxxxxxxx xxxx 3 - xxxxxxxx §13 xxxx. 3 xxxx. x) xxxxxx x xxxxxxxx. Xxxxxx xxxxxxx zaručí xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx instrumenty, xxxx xx xxxx xx xxxx uvedených xxxxxxxxxx.
Xx xxxxxxx xxxxxxxxx lze xxxxxxxxxxx, xx xxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxx.
10. Xxxxxxxxxx xxxxxx xx xxxxxxxxxx xxxx xxxxxx xxxxx
Xxxxx xxxxxx nemá xxxxx x xxxxxxxxxxx xxxx xxxxxx xxxxx.
XX. ZVLÁŠTNÍ ČÁST
ČÁST PRVNÍ Změna zákona o léčivech
Do xxxxxxxx xxx čarou x. 2 je xxxxx xxxxxxx xxxxx xx xxxxxxxx Xxxxxx x přenesené pravomoci (XX) 2016/161 xx xxx 2. října 2015, xxxxxx xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxx xxxxx xxxxxxx na xxxxx humánních léčivých xxxxxxxxx, které xx xxxxx touto xxxxxxx xxxxxx xxxxxxxxxx na xxxxxxxx x Xxxxx xxxxxxxxx.
K bodu 2 (§5 xxxx. 7):
Xx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx vyhrazených xxxxxxxx xxxxxxxxx z xxxxxxx xxxxxxxxx a xxxxxxxxxxxxx xxxxx.
K bodu 3 (§6 xxxx. 2):
Xxxxx se x xxxxxxxxxxx článku 2 xxxx. 3 směrnice Xxxxxx (XX) 2017/1572, xxxxx definuje xxxxxxxx xxxxxxx xxxxx xxxx xx část zabezpečování xxxxxxx, která xxxxxxxxx, xxx xxxx léčivé xxxxxxxxx xxxxx vyráběny, xxxxxxxx a xxxxxxxxxxxx x xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. Xxxx xxxxxxxx xx xxxxxxxx xx xxxx. 2.
Xxxxxxx xxxx xx xxxxxxxx na xxxxxx, xxxxx xxxx xxxx xxxxxxx nahradit.
K bodu 4 (§13 xxxx. 2 xxxx. x):
Xxxxxxxx x xxxxxxxxxxxxx, xxxxxxx osob xxxxxxxxxxxxx x xxxxxx, xxxxxxxx xxxxxxxxxx x registraci, xxxxxxxxxxxxxxxxx, xxxxxxx x xxxxxxx xxxxxxxxx xxxxx xxxxxx spočívat xxx x kontrole xxxxxxxxxx xxxxxxxxx xxxxxx o xxxxxxxx, xxx musí xxxxxxxxx x xxxxxxxx xxxxxxxxxx přímo použitelných xxxxxxxx Xxxxxxxx xxxx xxx xxxxxx xxxxxxxxx xxxxx, xxx xxxx xxxxxxxx požadují x xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx. Xxxxx xx:
• Xxxxxxxx Evropského parlamentu x Xxxx (XX) x. 1394/2007 (32007R1394), xx 13. listopadu 2007 x xxxxxxxx xxxxxxxxxxx pro xxxxxxx xxxxxxx x x xxxxx směrnice 2001/83/XX x xxxxxxxx (XX) x. 726/2004.
- Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 2016/793 (32016R0793) xx xxx 11. xxxxxx 2016, x xxxxxxxx xxxxxxxxxxxx obchodu x xxxxxxxxx xxxxxxxxx xxxx xx Evropské xxxx.
- Xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x.536/2014 (32014R0536), o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx směrnice 2001/20/XX (nařízení xxxxx xxxx xxxxxx)
- Xxxxxxxxx xxxxxxxx Xxxxxx (XX) č. 2017/556 xx xxx 24. března 2017 x xxxxxxxxxx xxxxxxxxxx xxx provádění xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (EU) č. 536/2014 (xxxxxxxx xxxxx xxxx xxxxxx)
-- Xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (EU) č. 2017/1569, xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x.536/2014 xxxxxxxxxx xxxxx x xxxxxx xxx xxxxxxxx výrobní praxi xxx hodnocené xxxxxxx xxxxxx xxxxxxxxx a xxxxxxxx provádění xxxxxxxx
- Xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) x.1252/2014 (32014R1252), xxxxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2001/83/XX, xxxxx xxx x xxxxxx x pokyny xxxxxxx xxxxxxx xxxxx xxx účinné látky xxx xxxxxxx léčivé xxxxxxxxx
- Xxxxxxxxx Xxxxxxxx Xxxxxx (XX) x. 699/2014 xx xxx 24. června 2014 x designu xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx veřejnosti xx xxxxx x x xxxxxxxxxxx, elektronických x xxxxxxxxxx xxxxxxxxxxx x ověření xxxx xxxxxxxx
- Xxxxxxxx Komise x přenesené pravomoci (XX) 2016/161 xx xxx 2. xxxxx 2015, kterým xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
K bodu 5 a 6 (§13 xxxx. 2 písm. x xx x):
X §13 xxxx. 2, který xxxxxxxx působnost Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, se xxxxxxxx xxxxxxxxxxx xxxxxxxxxx.
Xxxxxxxxx se xxxxxxxxx Xxxxxx x xxxxxxx xxxxxxxxxx pravidel xxx xxxxxxxx xxxxx, x xx x xxxxxx, xx v xxxx xxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx (xxxxxxxx XX) xx xxxxxxxx xxxxxxxxx x povinnosti xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx x xx xxxxxxxx xxxxx xx, aby určil, xxxxx orgán je xxx jeho xxxxx xxx příslušným k xxxxxxxxx uvedeným x xxxxxxxx x ochranných xxxxxxx. Je zřejmé, xx x xxxxxxx xx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx Ústavu, xxxxxxx xxxxxxxxx autority xxx oblast humánních xxxxx, xxxx xxx xxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx v xxxxxxxx o ochranných xxxxxxx xxxxx jedině xxxxx xxxxx xxxxx.
Xxxx xx xxxxxxxxx Státního xxxxxx pro kontrolu xxxxx rozšiřuje xxx, xx xx xxxxx xxxxxxxx xxxxxxx xxxxxxxxxx x výkonu xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx 2017/556 x nařízením 2017/1569. Xxx xxx x xxxxxx xxxxxxxx článku 17 xxxx. 6 x článku 25 xxxxxxxx x. 2017/1569 x úplnou xxxxxxxx článku 3 xxxx. 1, článku 12 a článku 13 xxxxxxxx č. 2017/556. Xxxxxx xxxxxxxxx xxxx xxxxx novelizačního xxxx by xxxx xxx xxxxxx, xxxx xxxx xxxxxxxxx x xxxxxx č. 66/2017 Sb. xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014.
K bodu 7 (§13 xxxx. 3 xxxx. x)
Xxxxx xx x xxxxxxxxxxx čl. 3 xxxx. 3 xxxxxxxx 2017/1572 a adaptaci čl. 22 nařízení 2017/1569. Xxxxxxxx 2017/1572 xxxxxxxx xxxxxx xxxxxx na xxxxx inspektorátech vytvořit x zavést xxxxxxxx xxxxxxxx xxxxxx jakosti, xxxxx xxxx pracovníci x xxxxxx xxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxx xxxxxxx se xxxxx xxxxxxx xxxxxxxxxxx. Xxxxxx xxx xxxxxxxx 2017/1569 xxxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxx. Xxxxxx xxxxxxx xx v xxxxxxx xxxxxxx xxxxxxxxxxx.
K bodu 8 (§16 xxxx. 3 xxxx. j)
Jedná xx x xxxxxxxxxxxx-xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx v xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxx normy.
K bodu 9 (§22 xxxx. 2)
Smysl xxxxxxx xxxx „xxxxxxxxxxxxx léčivých xxxxxxxxx“ spočívá xx xxxxxxxxxxx, že xxxxxxxxx xx kvalifikaci inspektorů xxxxxxx xxxxxxxx praxe xxxx ze xxxxxx x léčivech xxxxxxx, xxxxx xxxx přímo xxxxxxxx prováděcím nařízením. Xxxxxxx zůstala xxxxxxxxxx xxxxxxx xxxx požadavky xxx xxxxxxxxxx veterinárních xxxxxxxxxx hodnocení.
K bodu 10 (§23 xxxx. 1 xxxx. x):
Xxx xxxxxxx, kdy xxxxxxxxx provozovatele xxxxxxxxxx xxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxx, xxx-xx x humánní xxxxxx xxxxxxxxx, xxxxxxxxx xxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx, xx xxxxx xxxx povinnost xxxxxx xxxxxxxx x xxxxxx x léčivech xxxxxxxxx xxxxxxx x) xx §23 odst. 1 xxxxxx. Jedná xx xxxxxxxxx o xxxxxxx, xxx xx x xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxx, xxxxx xxxx xxx xxxxxxxx x ochranných xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxxx ke skutečnosti, xx xxxxxxxx xx xxxx týkat x xxxxxxxxxxxxx xxxxxxxx přípravků, xxxxxxxx xx xx xxxxxx zákona xxxxxxxxx xxxxxxx podezření xx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx Veterinárnímu xxxxxx.
K bodu 11 (§24 odst. 10):
Stávající xxxxx §24 xxxx. 10 xx x xxxxxxx x xxxxxxxxxxxx xxxxxxxxxx právního xxxxxxxx, xxxxxxxxxxxx xx xxxxxx xxxxxxxxxxxxx práva xxxxxx xxxxxxxx xxxxxxx xxxxxx, xxxx. xxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxx pro xxxxx xxxxxxxxxx na celní xxxxx Xxxx xxxx xxxx území opouštějící, xxxxxx xx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 952/2013, xxxxxx xx xxxxxxx xxxxx kodex Unie, x xxxxxxx xxxxx (xxxx xxx „XXX“). Xxxxxxxxxx článku 5 odst. 15 XXX xxxxxxxx xxxxx xxxxxxxxxx jako xxxxx, xxxxx xxxxxx xxxxx xxxxxxxxxx (x xxxx xxxx vyjmenované xxxxx xxxxxxxxx) vlastním xxxxxx xxxx osobu, xxxxxx jménem je xxxx xxxxx xxxxxxxxxx xxxxxx. Xxxx xxxxxxxxxx článku 18 xxxx. 1 XXX xxx jakýchkoli xxxxxxx, xxxxxxx xx xxxxxx stanoví, xx xx xxxxx xxxxx xxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxxxxx xxxx xxx xxxxx (xxxxxxxx xxxxx jménem a xx účet oné xxxxx) xxxx xxxxxxx (xxxxxxxx xxxxx xxxxxxxx xxxxxx na účet xxx osoby). Článek 170 xxxx. 1 XXX xxxxx pododstavec xxx xxxxxxx, xxxx xxx xxxxxxxxxx výjimek, xxxxxxx xx xxxxxx, xx xxxxx x přijetí xxxxxxx xxxxxxxxxx vyplývají xxx určitou xxxxx xxxxxxxx xxxxxxxxxx (např. xxxxx předložení souhlasu, xxxxxxxx xx licence xxx xxxxxxxxxx xxxxx x xxxxx uplatnění xxxxxxxxxxx zákazu xxxx xxxxxxx), xxxx takové xxxxx xxxxxxxxxx tato xxxxx nebo xxxx xxxxxxxx. X kontextu xxxxx xxxxx xxxx xxxxxxxxxxxx ustanovení je xxxxxx, xx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxx xxxxxxxxxx xxxxxxxxx xxxxx předpisům (xxxxxxxxxxxx, xxxxxxxxxxxxx) xxxxxxxx xxxxx xxxxx výběr xxxxxxxx, ale xxxx xxxx xxx xxxxx xxxxx jedné xx xxxx xxxxx xxxxxxxxxx. Xxxxx xxxxx, xxxx x xxxxxxx xxxxxxxxxx xxxxxxxx (xxxxxxx xx xxxxxxxx) xx xxxx xxxxxxxx xxxxxx xxxxxxxx, xxxxxxx xxxx xxxxxxxxxx xx opět xxxxxxxx xxxxxx xxxxx xxxx xxxxx (xxxxxxxxxxx xx xxxxxx definice bude xx xxx) xxxx xxxx xxxxxxx (xxxxxxxxxxx xxxx xxxxxxx zástupce). Xxxx xxxxxxxx xxxx xxxxxxxxxx veškeré právní xxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xx xxxxxxx xx xxxxxx xxxxx Xxxxxxxx xxxx x xxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxxxx právních xxxxxxxx x ustanovení, xxxxxxxxxx x xxxxxxxxxxxxxxx §24 xxxx. 10 xxxxxx o léčivech, xx v nich xxxxxxxxx.
K bodu 12 (§34 odst. 9):
Xxxxxxxx xx xxxxxxxxxx xxxxxxxxxx Xxxxxx x Xxxxxxxxxxxxx xxxxxx zahajovat xxxxxx x změně xxxxxxxxxx léčivého xxxxxxxxx xxxxxxxxxx mezi xxxxxxxxx xxxxxx přípravky v xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx léčivého přípravku, x xx z xxxx xxxxxx (xx xxxx).
K bodu 13 (§37 xxxx. 1):
X xxxxxx x xxxxxxxx xx xxxxx xxxxxxx xxxxxxx ustanovení xxx, xxx xxxxxxxxxx xxxxxxxxxxx xxxx, že xx zavádějí xxxxxxxxxx xxxxxxxx xxxxx: xx xxxxxxxxx xxxxxxxxxxxxx a xxxxxxxxxx k xxxxxxx xxxxxxxxxx x obalem. Xxxxxxxx xx xxxxx xxxxxxxx použití mezinárodně xxxxxxxxxx xxxxxxx xxxx, xxxxx slouží k xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxx xxxxxxxxx.
Xxx x xxxxxx xxxxxx navazující na xxxxxxxx x ochranných xxxxxxx, xxxxx umožňuje xxxxxxxx xxx xxxxxxxx xxxxxxx xxx (EAN), xxx 2X xxx, xxxxx ponese xxxxxxxxx xxxxxxxxxxxxx. Xxxxxx přípravky xxx xxxxxxxxxx prvků xxxxx xxxxxx xxxxxxxx XXX xxx a xxxxxxxx formulace xx xxxxxxxxxx xxx oba xxxx zmíněné xxxxx xxxx.
K bodu 14 (§37 xxxx. 7):
Xxxxxxxx 7 zákona x xxxxxxxx je xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx 2011/62/EU a xx xxxxx jej xxxxxxx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx.
K bodům 15 (§37 xxxx. 8):
Xxxxxxxx 8 zákona x xxxxxxxx je xxxxxx transpozičním xxxxxxxxxxx xxxxxxxx 2011/62/EU a xx xxxxx xxx xxxxxxx v xxxxxxx x nařízením o xxxxxxxxxx xxxxxxx, xxxxx xx xxxx xxxxxx xx xxxxxxx xxxxxxxx x ochranných prvcích xxxxxxxxx jednak xxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxx být xxxxxxxx xxxxxxxxxx prvky a xxxxxx přípravky xxxxxxxx xx xxxxxxxx xxxxxxx xxxx xx lékařský xxxxxxx x xxxxxxxx, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxxx k předchozím xxxxx xx xxxx xxxxx xxxx.
K bodu 16 (§45 xxxx. 7 xxxx. x) ):
Přebalování xxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxx xxxxxxx povolení x výrobě. Xxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx se taktéž xxxxxxxx na souběžný xxxxx, xx xxxxx xx xxxxxx x xxxxxxxx doplnit xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx dovozu xxxxxxxx, xxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx x všech xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxxx původního jedinečného xxxxxxxxxxxxxx a uložení xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxxx xxxxx xxxx x xxxxxxxxx státech Xxxxxxxx xxxx harmonizován x xxxxxxx národním xxxxxxx úpravám x xx svá národní xxxxxxxxx. Xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx dovozu sleduje, xxx xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx v xxxxx xxxxxxxxxx xxxxxx xxxx xx xxxxxx xxxxxx xxxx ochrana xxxxxxxx xxxxxxxxx léčivé přípravky, xxxxx jsou zajišťovány xxxxxxxxx rozhodnutí x xxxxxxxxxx. V České xxxxxxxxx povinnosti xxxxxxxx xxxxxxxxxx x registraci x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxxx, xxxxxxx x xxxxxxxxx členských xxxxxxx Xxxxxxxx xxxx mají xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx shodně (xxxx. Xxxxxxxxxx).
K bodu 17 (§64 xxxx. x):
Xxx o xxxxxx xxxxxxxxxxx článku 11 xxxx. 1 směrnice Komise (XX) 2017/1572, xxxxx xxxxxxx, že xxxxxxx xx xxxxxxxxx xxxxxxxx x xxxxxxxx systém xxxxxxxx xxxxxxx, xxxxx xx x xxxxxxxxx xxxxx, xxx xx xxxxxxxxx kvalifikaci x xx xxxxxxxxx xx xxxxxx. Xxxx xxxxx xx x dispozici xxxxx xxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx obsazených xxxxxxxxxx x xxxxxxxxxx zařízením xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxxx xxxxxxxxx x zkoušek xxxxxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xx k xxxxxxx xxxxxxxxxxx xxxxxxx.
K bodu 18 (§64 xxxx. f)
Jde o xxxxxx transpozici článku 13 xxxx. 1 směrnice Xxxxxx (XX) 2017/1572, xxxxx xxxxxx členským xxxxxx xxxxxxxx, aby xxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxx a xxxxxxxxxx xxxxxxxxx společně x xxxxxxx xxxxxxxx, xxxxxx lze xxxxxxxx x kdykoli xxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxx sítě. Výrobce xxxxxxxxx x prozkoumá xxxxxxxxx xxxxxxxxx týkající xx xxxx. Xxxxxxx xx povinnost informovat xxxxxxxxx xxxxx x x xxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x xxxxxxxx vadě, která xx mohla xxx xx xxxxxxxx xxxxxxx xxxx xxxxxxxxx omezení xxxxxxx, a xxxxx xx xx xxxxx, xxxxx xxxx země xxxxxx.
K bodu 19 (§64 xxxx. x)
Xxx x xxxxxx xxxxxxxxxxx článku 4 xxxx. 1 xxxxxxxx Komise (XX) 2017/1572, xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxx v xxxxxxx se správnou xxxxxxx xxxxx x x povolením x xxxxxx. Xxxx ustanovení xx použije rovněž xx xxxxxx přípravky xxxxxx xxxxx xxx xxxxx. Xxx xxxxxxxx xxxxxx xxxxx nedochází x xxxxxxxxx xxxxxx xxxx xxxx povinností xxxxxx stávajícímu xxxxx.
K bodům 20 a 21 (§77 odst. 1 xxxx. x) x x)):
Xxxxx se x xxxxxxxxxxxx technické xxxxxx xxxxxxxxxxxx xxxxx v xxxxxxxxxx na xxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxx.
Xxxxxxxx používaný xxxxxx xxxxxxxxxx imunologických xxxxxxxx xxxxxxxxx přímo xx xxxxxxxx lékařů xxx xxxxxxx x xxxxxxxx xxxx 2009 x xx xx xxxxxxx xxxxxx xxxxxx x xxxxxxxx zdravotním pojištění, x s xxx xxxxxxxxxxx xxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxx. Xxxxxxxx došlo x xxxx zásadní xxxxx, xxxxxx xx xxxxxx x xxxxxxxx xxxxxxxxxx ustanovení §82 xxxx. 2 xxxx. x) zákona x xxxxxxxx, které nereflektuje xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx látek (viz xxxxxxxxxxx xxx 29). Xxxxxxxxxx ustanovení §82 xxxx. 2 xxxx. x) x x xxx související ustanovení §77 xxxx. 1 xxxx. c) xxx 5 xx xxxx.
K bodu 22 (§77 xxxx. 1 xxxx. c xxx 11):
Xxxxx xx x xxxxxxxx x xxxxxxxxx xxxxx xx xxxxxx xxxxxxxxx v praxi xxxxxxxxx možnosti xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx, xxxxx xxxx x souladu x §82 xxxx. 2 písm. x) xxxxxxxxx k xxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx.
K bodu 23 (§77 xxxx. 1 xxxx. c xxx 12):
X souvislosti x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx z xxxxxxxx x xxxxxxxxxx xxxxxxx, xx. ověřování xxxxxxxxxx xxxxx a xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx v xxxxxxx imunologických xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx x případě distribuce xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx ordinací xxxxxx, xxxx xxxxxxxxx xxxxxx xxxxxx ustanovení, x xx xxx, aby xx xxxxxxx narušovala xxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
K bodu 24 (§77 xxxx. 1 xxxx. r):
V xxxxx xxxxxxxxxx jde x xxxxxxxx článku 23 xxxxxxxx x xxxxxxxxxx prvcích, xxxx xx v xxxxxx reaguje xx xxxxxxx členského xxxxx xxxxxxxxx x případě, xxx je xxxxx xxxxxxxxx xxxxxxxx charakteristiky xxxxxxxxxxxxxx xxxxxxx xx xxxx xxxxx, xxx xxxxxxxxxxx ověřil ochranné xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru xxxxxxxx xxxxxxxxx před xxx, xxx xxxxxx xxxxxxxxx xxxx některé x xxxx nebo xxxxxxxxx uvedených x xxxxx článku. X xxxxxx xxxxxx osob xx v návrhu xxxxxx xxxxxx stanoví xxxx xxxxxxxxx xxxxxxxxxxxx xxxx xxx, než xxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx lékařům, Armádě Xxxxx xxxxxxxxx x xxxxxxxxxxx ozbrojených xxx xxxxxx, x xxxxxxxxx xxxxxxxxxx zásob xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx x pro xxxxx xxxxxxxxxxx ozbrojených xxx České xxxxxxxxx xxxxxx xxx jejich xxxxxxxx do xxxxxxxxx xxxxx §111a zákona x xxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxx xxxx xxxxxxxx xxxxxxxxxxxx léčivé přípravky xxx xxxxx povinného xxxxxxxxxxxx xxxxxxxx na xxxxxxx rámcové smlouvy xxxxxxxxxxxx xx zdravotní xxxxxxxxxxx xxxx pro xxxxx xxxxxxxxx&xxxx; xxxxxxxxxx x xxxxxxxxxxx očkování x očkování xxxxxxxxxxxxx xxxx&xxxx; xx xxxxxxx xxxxxxx xxxxxxx distributora x Ministerstvem xxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx pojištění x xxxxx preventivní xxxx xxx zákona č. 48/1997 Sb., x veřejném zdravotním xxxxxxxxx x o xxxxx x doplnění xxxxxxxxx xxxxxxxxxxxxx xxxxxx, xx znění xxxxxxxxxx xxxxxxxx. Důvodem vymezení xxxxxx xxxxxx xxxxxxxx xx xxxxxxxxxx, xx xxxxxx xxxxxx v XX, xxxxxx xx xxxxx x xxxxxxxx, xxxxxxx xxxxxx možností xxxxxxxxx x xxxxxx 23 xxxxxxxxxx.
K bodu 25 (§80 xxxx. 4)
Předchozí xxxxxx xxxxxx x xxxxxxxx xxxxxxxx xxxxx úpravu x xxxxxxx požadavků xx elektronický xxxxxxx x xxxxxxx zdravotní xxxx. X xxx xxxx spojena xxxx xxxx x xxxxxxxxxxx xxxxxxxxxxxx zákona x xxxxxxxx, xxxxxx xxxx x §80, xxx xxxxxxxxxxxxx xxxxxxxxxxxxx lékaři xxxx upraveno v xxxx. 4 předmětného xxxxxxxxx. Tím xxxx xxxxx k xxxxxxx, xxx xxxxx x xxxxxxx předepisování zmiňuje xxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx. Xx xxxxxxxxxxx xxxxxxxx xx však xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx x xx xxxxxxxx stanovených zákonem xxxxxxxxxxxx x xxxxxxxx x xxxxx xxxxx xxxxxxxx xxxxxxxxx, včetně xxxxxxxxx xxxxxxxx xxxxxxxxx, x xx v xxxxxxxxx, xxxxx xxxxxx xxxxxxx registrovanými xxxxxxxxxxxxx xxxxxxxx přípravky. Xx xxxxx žádoucí xxxxx xxxxxxxx xxxxxxxx, x xxxxx xx xxxxxxxx xxxxx, které xx x xxxxxxx s xxxxxxxxx použitou x §77 odst. 1 xxxx. x) xxx 5 (xxxxxx xxxxxxxxxx xxxxx) xxxx x §82 (výdej xxxxx).
K bodu 26 (§82 xxxx. 2 xxxx. c)
V tomto xxxxxxxxxxxx bodě xx xxxxx x xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx textu, xxx xxxxxxxxx současné xxxxx. X polovině xxxx 2009 xx xxxxx xxxxxxxxxx očkovacích xxxxx: xx již xxxx krajské xxxxxxxxxx xxxxxxx, ale xxxx xxxxxxxxxxx firmu, a xx na xxxxxxx xxxxxx xxxxxx č. 48/1997 Sb., x xxxxxxxx xxxxxxxxxx xxxxxxxxx a o xxxxx x doplnění xxxxxxxxx xxxxxxxxxxxxx xxxxxx, x x xxx xxxxxxxxxxx xxxxx xxxxxx č. 258/2000 Sb., x ochraně xxxxxxxxx zdraví a x xxxxx některých xxxxxxxxxxxxx xxxxxx. Xxxxxxx xxxx xxxxx nebyla xxxxxxxxxx xx xxxxxx x léčivech, xxxxx x novele xxxxxx x xxxxxxxx neaktuální xxxxxxxxxx §82 xxxx. 2 xxxx. c) x x ním xxxxxxxxxxx xxxxxxxxxx §77 xxxx. 1 písm. x) xxx 5 xxxxxxx.
K bodu 27 (§82 odst. 3 xxxx. x)
Xxxxxxxxxxx xxxxxxxxxxx písmene x) xx §82 odst. 3 xxxxxx xx x xxxxxxxxxx xx xxxxxxxx x xxxxxxxxxx xxxxxxx zakládá povinnost xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx prvky x xxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru x xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxxx xx x xxxxxxxxxxxx právní xxxxxx, kdy mohou xxxxxxx xxxxxxx léčivé xxxxxxxxx na xxxxxxx xx zdravotnických zařízení. X xxxxxxxxx xxxxxxx Xxxxxxxx xxxx xx xxx xxxxx xxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxx. X xxxxxx důvodu xx xxxx xxxxxx xxxxxxxxx xxxxxxxx na xxxxxxx xxxxxxx ověřit x xxxxxxx, xxxxx je xx xxxxxx xx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx oprávněnou x xxxxxx x xxx ověří xxxxxxxx xxxxx při xxxxxx xxxxx nařízení. X xxxxxxx neprovedení xxxx xxxxxx xxxxxx xx xxxxxxxxx k xxxx, xx léčivé přípravky xxxxxx xx xxxxxxx xx xxxxxxx neověřené, xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx osobami xxxxxxxxxxx x výdeji, x xxx se xx ně xxxxxxxx xxx xxxxxxxxxx. Xxxxxxxx xxxx ustanovení zákona xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxx opatřené xxxxxxxxxx xxxxx x v xxxxxxxxx, kdy xxxxxxx x xxxxxxxxxxxx xxxxxx xxxxxxxxx x ČR, xxx dovážené x xxxxx xxxxxxxxxxxx léčebného xxxxxxxx, xxx. „xxxxxxxxxxxxxx xxxxxx“ xxx §8 xxxx. 3 xxxxxx x xxxxxxxx.
K bodu 28 (§99 xxxx. 7 x 8):
X xxxxxxxxxxx xxxxxxxx 7 do §99 xxxxxx xx xxxxxxxx xxxxx Xxxxxx x xxxxxxxx, xx xxxxxx xx xxxxxxxxxxx xxxxxxxxx x ochranných xxxxxxx. Xx xxxxx xxxxxx xxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx Xxxxxxx, xxxxx vyplývají x xxxx xxxxxxxxxx a xxxx potřebné xxx xxxxxxxxx xxxxxx xxxxxxxx. Xxxxxxxxx xxx x xxxxxxxxx xxxxxxxx se xxxxxxx x ukončení xxxxxxxx provozovatelů oprávněných x xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxx xxxxxx sdělují xxxxxxxxx xxxxxxx úřady. Na xxxxx xxxxxx Ústav xxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx x xx x xxx xxxxxxx xx xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx x xxxxxxxxxxxx xxxxxxxxxx §13 xxxx. 2 písm. x) xxxxxx. Xxxxx xxx x tyto xxxxxxxxx, x ustanovení §99 xxxx. 7 se xxxxxxxxx xxxxxxxx ochrana xxxxxx xxxxxxxxx, xxxx xx výslovně stanoví, xx xxxx informace xxxx Ústav xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx. Xxxx pouze xxxxxxxxxx xxxxxxx xx xxxxxxx xxxxxx právních předpisů.
K bodu 29 (§100 xxxx. 8):
Xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx povinnost v xxxxxxx xxxxxxx xxx xxxx Evropskou lékovou xxxxxxxxx x Ústavem xxx státní kontrolu xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx (xxxx xxx „Xxxxxxxxxxx ústav“). Xxxxxx xxxxxxxxxx xxxxxx je xxxxxxxx xxxx xxxxxx xx směrnicí Xxxxxxxxxx xxxxxxxxxx a Xxxx 2001/82/ES ze xxx 6. xxxxxxxxx 2001 x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx přípravků na xxxxxx xxxxxx xxxxxxxx Xxxxxxxxxxxxx ústavu povinnost xxxxxxxxxx xxxx xx xxxxxxxxxx databází.
K bodu 30 (§100x)
Xxxxxxx x sjednocení xxxxxxxxxxxx x xxxxxx o xxxxxxxx, xxx xx x xxxxxx xxxxxxx xxxxxx jistoty na xxxxx pojmu „xxxxxxx“ xxxxxxx xxxxx „padělaný xxxxxx xxxxxxxxx“.
K bodu 31 a 32 (§103 xxxx. 6 xxxxxxx x), h) xx x)):
X xxxxx xxxxxxxxxxxx xxxx xx doplňují x §103 odst. 6 xxxx. x) xx x) xxxxxxx xxxxxxxx podstaty xxxxxxxxx, xxxxxxx xx xxxxxxx xxxxxxxxxxxx, a xx xxxxxxxxx xxxxxx xxxxxxx, xxxxx jsou x xxxxxxx x nařízením x ochranných xxxxxxx xxxx xx xxxxxxx x xxxxxxxx.
K bodu 33 (§103 xxxx. 15 xx 21):
X xxxxx novelizačním xxxx xx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xx dopustí xxxxxxx xxxxxxxx přípravků, xxxxxxxxxxx, poskytovatel xxxxxxxxxxx xxxxxx xxxxxxxxx k xxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxx zřizující x xxxxxxxxxx xxxxxxxx x xxxxx xxxxxxxxx xx xxxxxxx léčivých xxxxxxxxx xx trh. Xxxxxxxx podstaty xxxxxxxxx xxxxxxxxx x xxxxxxxxx, xxxxx jsou v xxxxxxx x xxxxxxxxx x ochranných xxxxxxx xxxx se xxxxxxx x léčivech.
Při xxxxxxx xxxxxxxxxx prvků xxxxxxx, xxxxxxxxxxxx x xxxxx xxxxxxxxx xxxx zmocněné xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx ověří xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx a xxxxxxxxxxxx xxxxxxxxxx k xxxxxxx xxxxxxxxxx s xxxxxx. Xxx xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx s jedinečnými xxxxxxxxxxxxxx xxxxxxxxx v xxxxxxx xxxxxxx; xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxxx xx xxxxx, xxxxx xxxxxx úložišť xxxxxxxx xxxxxxx jedinečný xxxxxxxxxxxxx x xxxxx xxxxxxxxx x xxxxxxxx číslem, xxxxx xx xxxxxxx x xxxxx x xxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxxxx léčivého xxxxxxxxx.
Xxxxxxx, xxxxxxxxxxxx a xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx léčivé přípravky xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx opatření xxxxxxxxx x článcích 18, 24 x 30 xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx mají xxxxx xx xxxxxxxx, xx x xxxxxx přípravku xxxx xxxxxxxxxxxx (xxxxxxxx xx xxxxxx, xx xxx xxxxxxx prostředek x xxxxxxx manipulace x obalem), nebo xxxxx ověření xxxxxxxxxx xxxxx léčivého xxxxxxxxx (xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxx úložišť) xxxxxxxxx, xx xxxxxxxxx xxxxx není xxxxx.
K novelizačnímu bodu 34 (§104 xxxx. 14)
Xxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx podstata xxxxxxxxx xxxxxxxxxxxxx v xxx, xx výrobce xxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxx xxxxxxxxx správné xxxxxxx xxxxx xxxx xxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxx unie - xxxxxxxxxxx xxxxxxxx 2017/1569.
Zároveň xx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx v xxx, že kontrolovaná xxxxx xxx xxxxxxxx xxxxxxxxx podle xxxxx xxxxxxxxxxxx xxxxxxxx Evropské xxxx - xxxxxxxxxxx xxxxxxxx 2017/1569 xxxxxxxx xxxxx xxxxxxxxx uvedených x čl. 20 xxx 2 tohoto prováděcího xxxxxxxx.
K bodu 35 (§105 xxxx. 2 xxxx. t):
Jedná xx x xxxxxxxxxxxx xxxxxxxxxx xxxxxx.
K bodu 36 (§105 xxxx. 4 písm. x):
Xxxxx xxxxxxxxxxx bod xxxxxxx xx xxxxxxxx xxxx xxxxxxxxxx držitele xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx přípravku, xxxx xxxxxxxx xxxx jeho xxxxxxxxxx se označuje xx xxxxxxxxx (xxx xxxxx x xxxxxxxxxxxx xx xxxxxxxxx x xxxxxxx xxxxx s xxx související).
K bodu 37 (§105 xxxx.10)
Xxxxxxxx xx xxxxxxxx xxxxxxxx přestupku spočívající x xxx, xx xxxxxxxxxxxx subjekt při xxxxxxxx xxxxxxxxx podle xxxxx xxxxxxxxxxxx předpisu Xxxxxxxx unie - xxxxxxxxxxx nařízení 2017/556 xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx v čl. 10 xxxx 2, 3,4 x 5 xxxxxx xxxxxxxxxxx xxxxxxxx.
K bodu 38 a 39 (§106 xxxx. 1 xxxx. x):
X tomto xxxxxxxxxxxx xxxx xx označuje xx xxxxxxxxx takové xxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxx kvalifikované xxxxx výrobce léčivých xxxxxxxxx, xxxxx xxxxxxx x tom, xx xxxx xxxxx nezajistí, xxx obal léčivého xxxxxxxxx byl xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 odst. 7 xxxxxx.
Xxxx se xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxxxx článku 12 xxxxxxxx 2017/1569 xxxxxxxxxxx xxxxxxxx xxxxxx jako xxxxxxxxxxxxxx osobou. Obdobně xx tomu také x §108 xxxx. 3 xxxxx se xxxxxxxx jednání dopustila xxxxxxx xxxxx xxxx xxxxxxxxxxxxx xxxxx.
Xxxxxx jsou xxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxxx xxxxxx, xxxxx xx takové xxxxxxx mohlo xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxx a x xxxxxxx xxxxxxxxx pacientů xxxxx x České xxxxxxxxx, ale i x xxxxxx xxxxxxx Xxxxxxxx xxxx. Xxxxxxx xx xxxxxxxxxxxx xxxx xxxxxx stanovených xx xxxxxxxx obdobných xxxxxxxxxx xxxxxxxxxxx současnou xxxxxx xxxxxxx. Ustanovení xx xxxxxxxx xxxxxxxx tak (xxxxxx rozdělené xxxxxxxxx) xxx korelovalo x xxxxxxx provedenou zákonem č. 66/2017 Sb.
K bodům 40 xx 46 (§107 xxxx. 1 xxxx. x) xx x):
Xxxxxxxxxxxx subsumuje xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx (xxxxxxxxx) pod ustanovení xxxxxxxxxxx xxxxxxxxx xxxx xxxxx xxxxxx za xxxxxxxx xxxxxxxx povinností. Xxxxxxxxx výše xxxxxx xxxxxxxx xxxxxx závažnosti xxxxxxxxx, xx. xx xxxxxxxxx adekvátním způsobem xxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxx (xxxxxxxx xxxxxxxxxxx xxxxx).
K bodu 47 (§108 xxxx. 3):
X xxxxx xxxxxxxxxxxx bodu se xxxxxxxx za xxxxxxxxx xxxxxx xxxxxxx xxxxxxx xxxxx xxxx xxxxxxxxxxxxx xxxxx xxxxxxx léčivých xxxxxxxxx, které xxxxxxx x xxx, xx xxxx xxxxx xxxxxxxxx, xxx xxxx xxxxxxxx xxxxxxxxx byl xxxxxxx xxxxxxxxxx xxxxx xxxxx §37 xxxx. 7 xxxxxx.
K bodu 48 (§108 xxxx. 3):
Xxxxxxxxxx se doplňuje x xxxxx na čl. 62 nařízení o xxxxxxxxx hodnocení xxxxxxxxxxx x xxxxxxxxxx, xxx xxxxx xxxxx hodnocených xxxxxxxx xxxxxxxxx xxxxxxxxxx x Unii nebo xxxxxxxxxx xx Xxxx xxxx v xxxxxxx x požadavky xxxxxxxxxxx x čl. 63 nařízení x xxxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxx xxxxxxxxx, xx jsou xxxx požadavky xxxxxxx.
K bodu 49 (§114 xxxx. 1):
Xxxxx xx o xxxxxxxxxxxx xxxxxxxxxx úpravu x xxxxxxxxxx na xxxxx x xxxxxxxxxx §82 xxxx. 2.
ČÁST DRUHÁ Xxxxx xxxxxx x zdravotních xxxxxxxx (§65 xxxx. 2)
Xxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxx xxxxx xxxxxxxx článku 10 xxxx. 8 nařízení x. 2017/556, xxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxx právní x xxxxxxx xxxxx, xxx xxxxxxxxxx x xxxxxxxxx členských států xxxx xx. přístup x xx xxxxxxxxxxxx xxxxxxxxxxx, xxxxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx.
K Čl. III - Xxxxxxx xx Xxxxxx zákonů
Doplňuje xx xxxxxxxxxx xxxxxxxxxxx, xxx xxxxxxx Ministerstvo xxxxxxxxxxxxx formou xxxxxxx xx Sbírce zákonů xxxxxx den, xxx xxxx zveřejněno oznámení Xxxxxx v Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků x x xxxxxxx xxxxxxxx 2001/20/ES.
K čl. IV. - Účinnost
S xxxxxxx xx fakt, xx xxxxx xxxxxxxx xxx xxxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx vstoupí v xxxxxxxx od 9.2.2019 xx xxx xxxxxxxxxx xxxxxxxx se xxxx xxxxxxxx xxxxxxxxx datum xxxxxxxxx právě tímto xxxx.
X xxxxxx xx xxxxxxxx u xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx, xxxx xxxx xxxx s xxxxxxx XXX písm. x) xxxxxx č. 70/2013 Sb. u xxxxxxxxxx §37 xxxx. 7 a 8, §64a x §66 xxxx. 1 písm. x) xxxxxx a xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxx tedy xxx xxx, že xx xxxxx nabyl xxxxxxxxx xxxxxxxxx 3 xxx xxx dne xxxxxxxxx aktů vydaných Xxxxxxxxx komisí x xxxxxxxxx xxxxxxxxx, xx xxx 9.2.2019 xxxxx xxxxxx I xxxx 12 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/XX xx dne 8. xxxxxx 2011, xxxxxx xx mění xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx léčivých xxxxxxxxx, pokud xxx x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx legálního xxxxxxxxxxxxxx xxxxxxx, xxxxxxx den xxxx dny, xxx xxxx xxxx akty xxxxxxxxx, xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx xx Xxxxxx xxxxxx.
X Xxxxx xxx 22. xxxxx 2018
Xxxxxxxx xxxxx:
Xxx. Andrej Xxxxx x. x.
Xxxxxxx xxxxxxxxxxxxx:
Xxx. xx Xxx. Xxxx Xxxxxxx x. r.
Xxxxxxxxx xxxxxx x xxxxxxxxx dopadů regulace xxxxx obecných xxxxx - XXX&xxxx;
XXXXXXX ZÁVĚREČNÉ XXXXXX XXX
|
1. Název xxxxxx xxxxxx: |
|
|
Xxxxx xxxxxx, xxxxxx se mění xxxxx č. 378/2007 Sb., x xxxxxxxx a o xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx a xxxxx č. 372/2011, x xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx jejich xxxxxxxxxxx (xxxxx x xxxxxxxxxxx xxxxxxxx) |
|
|
Xxxxxxxxxxx / xxxxxxxx xxxxxxxxxxxxx: Xxxxxxxxxxxx xxxxxxxxxxxxx |
Xxxxxxxxxxxxx xxxxxx nabytí xxxxxxxxx, x xxxxxxx dělené xxxxxxxxx rozveďte 9. xxxxx 2019 |
|
Xxxxxxxxxxxx xxxxx XX: XXX - xxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxxxxx: 9. xxxxx 2019 - xxxxxx, xxx xxx xxxxx nad xxxxx požadavků stanovených xxxxxxxxx XX: XX |
|
|
2. Xxx xxxxxx zákona |
|
|
Předkládaná xxxxxx xxxxxx o xxxxxxxx x xxxxxx x zdravotních xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxx Xxxxxxxx unie xx xxxxxxxx xxxx Xxxxx xxxxxxxxx.&xxxx; Jedná se x následující xxxxxx xxxxxxxx: - Xxxxxxxx Komise x xxxxxxxxx pravomoci (XX) 2016/161 xx xxx 2. října 2015, xxxxxx xx xxxxxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxxxxxxx podrobných xxxxxxxx pro xxxxxxxx xxxxx xxxxxxx xx xxxxx humánních léčivých xxxxxxxxx, - Xxxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxxx (XX) č. 2017/556 xx dne 24. xxxxxx 2017 o xxxxxxxxxx xxxxxxxxxx pro xxxxxxxxx inspekčních postupů xxxxxxx klinické praxe xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 (xxxx jen „xxxxxxxx 2017/556“), - Nařízení Xxxxxx x xxxxxxxxx xxxxxxxxxx (XX) č. 2017/1569 ze xxx 23. xxxxxx 2017, xxxxxx xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x.536/2014 xxxxxxxxxx xxxxx x xxxxxx xxx xxxxxxxx výrobní xxxxx xxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx provádění xxxxxxxx (xxxx xxx xxxxxxxx 2017/1569“), - Xxxxxxxx Xxxxxx (XX) 2017/1572 xx xxx 15. xxxx 2017, xxxxxx xx doplňuje xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2001/83/ES, pokud xxx x xxxxxx x xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxx humánní léčivé xxxxxxxxx (xxxx xxx „xxxxxxxx 2017/1572“). Xxxxxxx možností, xxx vyhovět xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxx x xxxxxxxx Xxxxxxxx xxxx, xx implementace předmětné xxxxx xxxxx XX xx xxxxxxxxxxxxxx xxxxxxxx xxxx. Xxx xxxxxxxxx xxxxxxxx by došlo x xxxxxxxx xxxxxxx x xxxxxxxx Xxxxxxxx xxxx xx strany xxxxxxxxx xxxxx x xxxxx xx být xxxxxxxx řízení xx xxxxxx Xxxxxxxx komise xxxxx Xxxxx xxxxxxxxx xx xxxxxxxxx implementační xxxxxxxxxx a popřípadě x xxxxxxx sankce xxxxxxxxx takovému xxxxxxxx, xxxxx by mělo xxxxx xx xxxx xxxxxx x jeho xxxxxxxxx xxxxxx xxxxx x rozměru České xxxxxxxxx, ale i xxxxxxxxx xxxxxxxxx xxxxx, xxxxx jen x xxxxxxx, že xxxxxxxx xxxxx xxxxxxxxxx xxxxx, xxxx systém xxxxxxx. Xxxxxxxx xx skutečnosti, xx x xxxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxx Xxxxxxxx xxxx xxxxxxxx se xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx, xxxxxxx xxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx xxxxxx přípravky x xxxxxxxx provádění xxxxxxxx x xxxxx x xxxxxx pro xxxxxxxx xxxxxxx xxxxx xxx xxxxxxx léčivé xxxxxxxxx xxxxxx dána xxxxxxx xxxxxxxx a xxxxxxxx xxxxx xxxxx xxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxx nad xxxxx xxxxxxxxx xxxxx Evropské xxxx, xxxx v xxxxxxx x Legislativními xxxxxxxx xxxxx xxxxxx xxxxxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxx závěrečnou xxxxxx x hodnocení xxxxxx regulace xxxxx xxxxxxxx xxxxx - XXX xxx xxxx xxxxxxxx xxxxxxx. Žádosti xxxx xxxxxxxx. X xxxxxx xxxxxx se xxxxx xxxxxxxx xxxx xxxxxx pouze xxxxxxxxxx xxxxxx xxxxxxxx nařízení x xxxxxxxxxx xxxxxxx. Xxxxx xxxxxx xxxxxx xx xxxxxxx xxxxxxxxxx opatření xxxxxxxxxxxxx x xxxxxxxx xxxxxxxx xxxx Xxxxx xxxxxxxxx na xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) 2016/161 xx xxx 2. xxxxx 2015, xxxxxx xx xxxxxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX xxxxxxxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxx xxxxx uvedené xx xxxxx xxxxxxxxx xxxxxxxx přípravků (dále xxx „nařízení x xxxxxxxxxx xxxxxxx“). Problematika xxxxxxxxxx prvků xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxx xx Směrnice Evropského xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx xx xxxx xxxxxxxx 2001/83/ES x xxxxxx Společenství xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx, pokud xxx o zabránění xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx legálního xxxxxxxxxxxxxx xxxxxxx (dále xxx „směrnice 2011/62/EU“). Padělané xxxxxx přípravky, xxxxx xx se k xxxxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx, xxxxxxxxxxx xxxxxx pro xxxxxx xxxxxx x xxxxx rovněž vést xx snížení důvěry xxxxxxxx x xxxxxxx xxxxxxxxxxxx řetězec, poskytovatele xxxxxxxxx xxxx a xxxxxxxxx xxxxxx. Xxxxx xxxxxxxx 2011/62/EU xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx obalech xxxxxxxx xxxxxxxxx, xxxxx xx xxxxxxx xxxxxx xxxxxxx xxxxxxxx léčivého xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx, xxx xxxxxx x obalem manipulováno. Xxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xx měly xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxx xxxxxxx xxxxxxxx x zájmy xxxxxxxx xxxxxxxxxx x xxxxxxxxxx a xxxxxxx. Xxx xxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxx ve xxxxx členských xxxxxxx Xxxxxxxx xxxx, xxxxxxxxxx xxxx xxxxxxxx přípravků x xxxxxxxxxx xxxxx xxxxxxx všech účastníků xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx odlišností, xxxxxxxxx Xxxxxxxx Komise xxxxxxxxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxxx prvků, xxxxxxx xxxxxxxxxxxxxxx a technické xxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx - xxxxxxxxxxx identifikátoru, xxxxxxx x xxxxxx ověření xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx subjekty (xxxxxxx, xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx vydávat xxxxxx xxxxxxxxx xxxxxxxxxx) x xxxxxxx x xxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxxx prvcích (jedinečných xxxxxxxxxxxxxxxx). Xxxxxxxx xxxxx xxxxx xxx prvky xxxxxxxx xx obalu humánního xxxxxxxx xxxxxxxxx - xxxxxxxxx identifikátor (xxxxxxxxx xxxxxxxx xxxxxx dvourozměrným xxxxxxx xxxxx, xxxxxxxxxx xxxxxxx pravosti x xxxxxxxxxxxx xxxxxxxxxxxx balení xxxxxxxx xxxxxxxxx, xx xxxx xx vytištěna) x xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx (xxxxxxxx xxxxx - xxxxxxxxxxxx xxxxxxxx - xxxxxxxxxx xxxxxx, xxx xxxx x xxxxxx léčivého přípravku xxxxxxxxxxxx). Xxxxxxxxxx xxxxx budou xxxxxxxx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx léčivých xxxxxxxxx x) xxxxxxx xxxxx je xxxxx xx xxxxxxxx xxxxxxx (xxxxxxxx xxxx xxxxxx přípravky uvedené xx seznamu x xxxxxxx I xxxxxxxx x ochranných xxxxxxx) x) xxxxxxx xxxxx není xxxxx xx xxxxxxxx xxxxxxx (xxx. „xxxxx xxxxxxxx xxxxxx xxxxxxxxx“), x xx pouze xxxxx jsou uvedeny xx xxxxxxx v xxxxxxx XX nařízení x xxxxxxxxxx xxxxxxx, x) xx které xxxxxxx xxxxx rozšířily xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx k xxxxxxx xxxxxxxxxx x xxxxxx. Xxxxxxx ověřovací systém xxxxxxxx xxxxxxx systému xxxxxxx, xx xxxxxxx xxxxx xxxx jiné xxxxxxxx informace x xxxxxxxxxxx identifikátorech jednotlivých xxxxxx xxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxx zřídí x xxxxxxxx neziskový xxxxxx xxxxxxx nebo xxxxxxxxx xxxxxx subjekty xxxxxxx x Unii xxxxxxx a xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx prvky. Xxxxxxx xxxxxxx xxxxxxx xx xxxxxx xxxxxxx případně xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxx nebo xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx a x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx. Xxxxxxx xx xxxxxx úložišť xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx v xxxxxxx x článkem 54x xxxx. 2 písm. x) xxxxxxxx 2001/83/XX. Xxxxxx xxxxxxx se xxxxxx x xxxxxxxxxxx xxxxxxxx x úložiště, xxxxx xxxxxx xxxxx xxxxxxx členského xxxxx („xxxxxxxxxxxx úložiště“), xxxx xxxxxx xxxx členských xxxxx („xxxxxxxxxx úložiště“), xxxxx xxxx xxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx x xxxxxx, xx jedinečný identifikátor xx xxxxxxx x xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx x ochranných xxxxxxx. Držitelé xxxxxxxxxx x xxxxxxxxxx nebo xxxxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxx xxxx distribuovaných xxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xxx informace x xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxx xx systému úložišť xxxxxxx xxxx xxx, xxx xxxx xxxxxx xxxxxxxxx xxxxxx na xxx. Xxxxxxx xxxxxxxxxx xxxxx x xxxxxxx xxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxx xxxx xxxxxxxxxxxx x osoby xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx přípravky. Xxxxxxx, xxxxx xxxxxxx xxxxxxxx provádějí xxxxxxx xxxxxxxxxx prvků, xxxxxxxx xxxxxxxx jedinečného identifikátoru, xx systému xxxxxxx xxxx xxxx xxxxxxxxx x ochranných prvcích. Xxxxx oprávněná x xxxxxx léčivých přípravků xxx xxxx výdejem xxxxxxxxxx ověří xxx xxxxxxxx xxxxx a xxxxxxx xxxxxxxx jedinečného xxxxxxxxxxxxxx ze xxxxxxx xxxxxxx v xxxxxxxx xxxxxx pacientovi. Pro zajištění xxxxxxxx léčivého xxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxx xx nezbytné xxxxxx xxx xxxxxxxx xxxxx. Xxxxxxx pravosti xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxx xxxxxxxxxx s xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx a jeho xxxxx xx xxxxxxxx, xx xxxxxx xxxxxxxxx xxxxxxx xx legitimního xxxxxxx, který xxxxxxxxx xxxxxxxxxxxxxx xxxxxx do xxxxxxx xxxxxxx. Ověření xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x xxxx cílem xx xxxxxxxx, že x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx xxxx xxxx xxxxxxxxx, xxxxxxx bylo balení xxxxxxxx xxxxxxxxx xxxxxx. Xxxxxxxx x xxxxxxxxxx prvcích xx pro xxxxxxx xxxxx xxxxxxx x xxxxx rozsahu x xx ve xxxxx xxxxxxxxx xxxxxxx přímo xxxxxxxxxx. Xxxxxxx xxxxxxxx x ochranných xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxxxx, xxxxxxx xxxxx otázky xxxxxxxxx xx zvážení x xxxxxxxxxx xxxxxxxxx xxxxx, x to xxxxxxxxx (1) určení xxxxxxxxxxx vnitrostátního xxxxxx, xxxxx xx xxx xxx přístup x xxxxxxxx xxx xxxxx xxxxxx xxx fungováním xxxxxxx, xxxxxxxxxxx potenciálních xxxxxxx xxxxxxxx, úhrady, xxxxxxxxxxxxxxxx a xxxxxxxxxxxxxxxxxxxx, (2) xxxxxxxx způsobů, xxx xxxxxxxx, xxx xxxxxxxxxx, které xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx, xxxx xxxxxx, x xx xxxxxxxxx skutkové xxxxxxxx xxxxxxxxx x xxxx xxxxxxx a xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx příslušného k xxxxxx projednávání x xxxxxxxxxx xxxx sankcí xx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx subjekty, (3) xxxxxxxxxx zda, členský xxxx rozšíří oblast xxxxxxxxxx ochranných xxxxx xx xxxxxx xxxxxxxxx, xxxxx xxx xxxxxxxx x ochranných xxxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxx těmito xxxxx, (4) xxxxxxxxxx, zda xxxxxxxxxxxx xxxxxxxx xxxxx“ xxxx „xxxx xxxxxxxx xxxxx“ bude xxxxxxx x rámci xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx, (5) xxxxxxxxxx zvláštní xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xx území členského xxxxx x xxxxxxxx x právní úpravě, xxx xxxxxxxxxxx mohl xxxxxx ochranné xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru xxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx před xxx, xxx léčivý přípravek xxxx xxxxxxx z xxxx xxxx xxxxxxxxx xxxxxxxxx v článku 23 xxxxxxxx x ochranných xxxxxxx. Xxxx uvedené úpravy xx xxxxx xxxxxxx xxxxx v xxxxxx xxxxxx xxxxxx o xxxxxxxx xxx, aby xxxxxxxxxxxxxx x xxx xxxxxxxxxx xxxxxxxx úpravou xxxxxxxxxxxx ochranných xxxxx xxxxxxxxxxx směrnicí 2011/62/EU, xxxxx byla transponována xx zákona o xxxxxxxx xxxxxxx č. 70/2013 Sb. Xxxxxxxxxxx xxxxxxx bude xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx nařízení x xxxxxxxxxx xxxxxxx tak, xxx xxxxx xxx xxxx xxxxxxxxxx řádně x xxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxx republiky. |
|
|
3. Xxxxxxxxxx xxxxxx návrhu zákona |
|
|
3.1 Xxxxxx na xxxxxx rozpočet a xxxxxxx xxxxxxx rozpočty: XX |
|
|
Xxxxxxxxxx xxxxxx za xxxxxx zajištění xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx představovat xxxxxxxx xxxxx xxxxxxxxxxx x navýšení xxxxxx xxxxxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx xx xxxxx xxx xxxxxxxxx xxxxx xxxx systemizací xxxxxxxxxx x pracovních xxxx xx služebních xxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx xx xxxxxx Xxxxxx. Xxxxxx xx xxxxxxx xxxxxxx rozpočty xx xxxxxxxxxxxxxxx. |
|
|
3.2 Xxxxxx xx xxxxxxxxxxx xxxxxxxxxxxxxxxxxxx XX: XX |
|
|
Xxxxxxxxxxxxxxx xx dopady xx mezinárodní konkurenceschopnost XX. |
|
|
3.3 Xxxxxx xx xxxxxxxxxxxxx prostředí: XXX |
|
|
Xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx Xxxxx xxxxxxxxx xx xxxx x xxx xxxxxxxxxxx xxxxxx x xxxxxxxx, která do xxxx xxxx xxxxxxx xxxx xxxxxxx, xx. xxxxxxx č. 70/2013 Sb., x xxxx xxxxxxxxx xxxxxxxx, xxxxxxxx se xxxx xxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxx xxxxxx již xxxx xxxxxxxxx xxx xxxxxxxxxxxx těchto xxxxxxxx xxxxxxxx. V xxxxx xxxxx je xxxxx xxxxxxx na xxxxxxxxx xxxxxx, xxxxxx zprávy x xxxxxxxxx xxxxxx xxxxxxxx (XXX) x xxxxxx č. 70/2013 Sb. x xxxx xx podrobnou xxxxxx XXX x xxxxxxxx x ochranných xxxxxxx xxxxxxxxx „Impact Xxxxxxxxxx“. X xxxx xxxxxxxx xxxxxx xx xxxxx, xx v xxxxxxx s čl. 4 xxxxxxxx 2011/62/XX x xx. 54a xxxx. 2 x 3 xxxxxxxx 2001/83/ES Xxxxxx xxxxxxxxx xxxxxxx, náklady x xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxx xxxxxxxxxxxxxxx x technické xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x způsoby ověření xxxxxxxxxx prvků x xxxxxxxx x xxxxxx xxxxxxx xxxxxxx. Xxxxxxxx, xxxxx byly xxxxxxxxxxx xxxx xxxxxxxxx nejefektivnější, xxxxxxxxxxx xxxxxxxx prvky xxxxxxxx o ochranných xxxxxxx. X xxxx xxxxxx xx xxxxxx, že xxxxxxx realizace xxxxx xxxxxxx xxxxxxx xx xxxxxxx x držitele xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx xxxxx ponesou xxxxxxx xx zřízení x správu xxxxxxx xxxxxxx (xxxx xxxxxxxxx xxxx uložena xxx xxxxxxxx 2011/62/EU, která xxxx xxxxxxxxxxxxx xx xxxxxxxx xxxx XX xxxxxxx č. 70/2013 Sb.). Xxx xxxxxxx x souběžné xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx humánních xxxxxxxx xxxxxxxxx další náklady, xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxx xxxxxxx xxxxx (xxxxxxxx náklady) x investovat xx xxxxxxxxxxxx xxxxxxx, xxx xxxx xxxxx odesílat xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx xx systému xxxxxxxx. X současné xxxx xxxxxx xxxxx xxxxxxx xx balení xxxxxxxx xxxxxxxxx xxxxx xxxxx. Xxx bylo xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx, xxxx xxx xxxxxx xxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxxx softwarem. Náklady xxxxxxx xxxxx částečně xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx: - xxxxxxxxx xxxxxxx (xxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx EU xx vyloučí potřeba xxx xxxx výrobních xxxxx, xxx xxxxxxxx xxxxxxxxxxxx jednotlivých xxxxxxxxx xxxxxxx), - xxxxxxx xxxxx xxxxxxx a xxxxxxxx xxxxxxxxxx x xxxxxxxxxx (xxxxxxx počtu padělaných xxxxxxxx xxxxxxxxx xx xxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxx), - xxxxxxxxx x snížení xxxxxxx xxx xxxxxxxxx xxxxxxxxx x vracení xxxxxxxx přípravků, xxx xxxxxx xxxxxx xxxxx (xxxxx x xxxx xxxxxxxxxxxxx) xxxxxxx x xxxxxxxxxx identifikátoru. Náklady xxxxxxxxxxxx xxxxx x xxxx xxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx souvisí s xxxxxxxxxx ověřovat ochranné xxxxx x vyřazovat xxxxxxxxx identifikátor ze xxxxxxx xxxxxxx (xxxxxxxx xxxxxxxxxx snímače 2X xxxx, úpravy softwarových xxxxxxxx, xxxxxxx xx xxxxxx zdroje). Další xxxxxx xx xxxxxxxxxxxxx subjekty xxxxxxx xx s xxxxxxxxxxx změn registrací x xxxxxxxx přípravků xxxxxxxxxx xxxxxxxxxx prvky. Xxxxxxxx dopad xxxxxxxxxx xxxxxx na podnikatelské xxxxxxxx z hlediska xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxx dokumentace xx očekává xxxxxxxxx, xxxxx xxxxx xxxxxxxxxx xx x xxxxxxxxxxx xxxxxxxxxxxxxx lze xxxxxx xx xxxxx xxxxx x xxxxx xxxxxxxxxx xxxxxx x dopadem xx informace x xxxxxxxxx - např. xxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxx x xxxxx registrace xxxx II, xxxx XX xxxx typu XX. Xxx xxxxxxx xxxxxxxx xxxxxxxxx nebude xxxxx xx zavedení xxxxxxxxxx xxxxx nutné xxxxxxxxxx xxxxxxxx xxxxxx x xxxxx xxxxxxxxxx, xxxxx je možné xxxxxxxxxxxxx xxxxxxxx xxxxx xx registrační dokumentace xxx xxxx předložením xxxx schválením xxxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx. Dopad xxx xx xxxxxxxxxxxxx subjekty x xxxxxxx xxxxxxxx x x oblasti xxxxxxxxxxxx xxxx xx xxxxxxxx předložených žádostí xxxxxxxx se xxxx xxxxxxxxxx bude xxxxxxxxx. Xxxxxxx xx vývoj x xxxxxx systému, xxxxx xxxxxx celoevropské xxxxxxx xxxxx, nesou xxxxxxxx xxxxxxxx x výrobě (xx. xxxxxxx x xxxxxxxx xxxxxxxxxxxx) léčivých xxxxxxxxx opatřených ochrannými xxxxx. Xx tímto xxxxxx spolupracovaly xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx XXXXX (xxxxxxxx distributoři), XXXXX x XXX (xxxxxxx) - společně xxxxxxxxxxxxx „xxxxxx“ systému, XXXX (xxxxxxxxxxxx xxxxxxxxx) x XXXX (xxxxxxxxxxxxxxx) xxx xxxxxx Xxxxxxxxxx xxxxxx xxxxxxxxx xxxx (Xxxxxxxx Xxxxxxxxxxx Xxxxx xx XXX). Xxxx evropské xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx, Xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxx (Xxxxxxxx Xxxxxxxxx Xxxxxxxxxxxx Xxxxxxxxxxxx xx XXXX), xxxxx xx zajistit xxxxxxxx XXX xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx „hubu“ (Xxxxxxxx Xxxxxxxxx Xxxxxxxxxxxx Xxxxxx či XXXX), x xxxxxxxx xxxxxxxxxx xxxxxxx zainteresovaným národním xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx národních organizací. V Xxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxxx xxxxx, xxxxxxxxx XXXX (Xxxxxxxx evropských xxxxxxxxxxxx xxxxx), XXXX (Xxxxxxxx xxxxxxxxxxxx farmaceutického xxxxxxxx), XXXX (Xxxxxxxx xxxxxxxxxxxxxxxxx xxxxx), ČAFF (Xxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxx) x XXxX (Xxxxx lékárnická xxxxxx) xxxxxxxxxxx xxxxxxx, jež xx xxxxx xx xxx vést a xxxxx xxxxxx xxxxxxxxxxxx XXX v Xxxxx xxxxxxxxx, xxxxxxxxxx xxxxxxxx xxxxx. Xxxxxxxx cílem xx dodat Xxxxxxx xxxxxx pro xxxxxxxxx xxxxx (NSOL), xxxxxxxxxxxx xxxx XXX x xxxxxxxx funkčnosti xxxxxxx XXXX. Xxxx x xxxxxxx x evropským xxxxxxx xxxx XXXX xxxxxx a spravován xxxxxxxxxx xxxxxxx xxxxxxxxx Xxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxx (XXXX) xxx dohledem xxxxxxxxx xxxxxx xxxxxxxx. Xxx xxxxxxxx xxxxxx odborné xxxxxxxxxx xxxxxx na xxxxxx xxxx léčivých xxxxxxxxx vydávaných xx xxxxxxx přibližně 261 xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xx 465 držitelů xxxxxxxxxx x registraci, 525 distributorů, z xxxxx xxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxxxxx, 15 souběžných xxxxxxx, xxxxxxxxx 200 xxxxxxxx x dalších xxxxxxxxx xxxxxx s xxxxxxx lékárnou x xxx 2 800 xxxxxxx. Xxx xxxxxx xxxxxx xx na xxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxxx 180 xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx vydávaných xx xxxxxxx ročně. Stanovení xxxxxxxx XXXX pro xxxxxxxx xxxxxxxxxx o registraci xx vybudování x xxxxxxxx národního systému xxxxxxxxx xxxxx (XXXX) xxxx xxxxxxxx z xxxxxxxxxx EMVO, xxxxxxx xx uvažuje o xxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx x xxxxx xxxxxxxx xxxxxxxx xxx. xxxx xxx. Výše xxxxxxxx xx rok 2019 xx xxxx xxx známa x X1/2018. Xx xxxxxxx xxxx 2018 xxxx xxxxxxxxx xxxxxxxxx a xxxxxxxxxxx xxxxxxx NSOL v xxxxx xxxxxxxxx xxxxxxxx. Xxx 9.1.2018 proběhlo x prostorách Xxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx léčiv xxxxxxx xxxxxxx x xxxxx x xxxxxxx xxxx xxxxxxxx ověřování xxxxxxxx xxxxx x Xxxxx xxxxxxxxx, xxxxx cílem xxxx poskytnout xxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxxx xxxxxx a xxxxxxx xxxxxxxxxx x xxxxxxxxxx na xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx. Xx xxxxxxxxx xxxxxxxx xxxx připraveno xx xxxxxxx 8 xxxxxxxx ze xxxxxx xxxxxxx, 6 zástupců xx strany xxxxxxxxxxxx, 23 lékáren (z xxxx 18 xxxxxxxxxxxx) x 4 xxxxxxxxxx XX xxxxxxx. Xxxxxxx xxxx xxxx spuštěna xxx 3. xxxxxx 2018, xxxxxxx xxxxxxxxxxxxx xxxx xxxxxx xx xx xxxxxxxx posledních xxxxxxxxxxx xxxxxxxxxxxx na xxxxxx 2018. X xxxx xxxxxxxxx je xxxxxx, xx xxxxxxx xxxxxxxx xx aktivně xxxxxxxx xx xxxxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxx x Xxxxx xxxxxxxxx. Do xxxxxxxxx xxxxxxxx se xxxxxxxx subjekty x xxxxxxxxx xxxxxxx xx xxxx, x xxxxx xxx xxxxxxx xxxxxxxxx, xx xxxx xxxxxxxx xxx vynaložily xxxxxxx xxx, xxx xx xxxxx xxxxxxxxx projektu xxxxxxxx. |
|
|
3.4 Xxxxxx na xxxxxx xxxxxxxxxxx xxxxx (xxxx, kraje): XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx xxxxxx xxxxxxxxxxx xxxxx. |
|
|
3.5 Xxxxxxxx xxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx xxxxxxxx xxxxx. |
|
|
3.6 Dopady xx xxxxxxxxxxxx: XXX |
|
|
Xxxxxxxx xxxx, xxxxx zajistí xxxxxxx léčivého xxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxx, bude xxx xxxxxxxxx xxxxxxxxx dopad xx xxxxxxxxxxxxxx sektor. Xxxxxxxx x xxxx, xx xxxxxxx xxxxxxx x xxxxxxxx rozhodnutí x xxxxxxxxxx xxxxxxxx xxxxxxxxx, jejichž xxxxx xxxxxxx xxxxxxxx xxxxx, xx z xxxxxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxx xxxx xxxxxxxxx xxxxx, xxxx xxxxxxxx částečný xxxxx xxxx skutečnosti na xxxx léčivých přípravků. Xxxxxxx xxxxxxx xxxxxxx x držitelů xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxx xx xxxxxx k xxxxxxxxx poměrům farmaceutických xxxxx zanedbatelné, xxxxx xxxxxxx xx xxxxxxxx XX xxxx u xxxxxxxx přípravků xxxxxxxx xx xxxxxx xxxx xxxxx xxxxx řádově xxxxx xxx xxxxxxxx xxxxxxx xx xxxxx, xxxxxx a xxxxxxxxxx xxxxxxxx přípravků. Xxxx xxxxxxxx xxxxxxxxx, jejichž xxxxx xx xxxxx xx xxxxxxxx xxxxxxx, xx ve xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx maximální ceny xxxxxxxx rozhodnutím, xxxxxx xxx xxxxxx xxxxx xx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxx. Současně xxxx x xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx veřejného xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx x xxxxx xxxxxxxxx xxxxxx. Navíc xx v zemích Xxxxxxxx xxxx (xxxxxx XX) xxxxx xxxxxxx xxxxxxx tzv. vnějšího xxxxxxxx referencování - xxxx xxxxxxxxx ceny x úhrady xxxxx xxxxxxxxxx xxx xxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxx, xxxxx by x xxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxx x XX xxxx xx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx veřejného xxxxxxxxxxx xxxxxxxxx. Xxxxxxxx x xxxxx výraznému xxxxx konkurenčního xxxxxxxxx xx xxxxxxxxx xxxx x xxxxxx se xxxxxxxxx cen léčivých xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxxx, xxxx nebude xxxxxxxxxxx od běžné xxxxxxx. Xxxx xxxxxxxxxxxx xxxxxxxx přípravků xxxx xxxxxxxxx, do xxxxxxx xxxxxxxxx xxxxxxxxxxx pojištění xx promítá úhrada xxxxxxxx xxxxxxxxx, nikoliv xxxx xxxx. |
|
|
3.7 Dopady xx xxxxxxx prostředí: XX |
|
|
Xxxxxxxxxxxxxxx se xxxxxx xx xxxxxxx xxxxxxxxx. |
|
|
3.8 Xxxxxx xx xxxxxx x xxxxxx xxxxxxxxxxxx x xx vztahu x xxxxxxxx xxx x xxxx: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx k xxxxxx diskriminace a xx xxxxxx k xxxxxxxx xxx x xxxx. |
|
|
3.9 Dopady na xxxxx xxxxxx xxxxxxxxxxx xxxxxx: NE |
|
|
Nepředpokládají xx xxxxxx na xxxxx xxxxxxxxxxx služby |
|
|
3.10 Korupční xxxxxx: NE |
|
|
Nepředpokládají se xxxxxxxx rizika. |
|
|
3.11 Xxxxxx xx xxxxxxxxxx xxxx xxxxxx státu: XX |
|
|
Xxxxxxxxxxxxxxx xx xxxxxx xx xxxxxxxxxx xxxx xxxxxx xxxxx. |
|
1. Xxxxx xxxxxxxxxx x xxxx
1. 1 Xxxxx
Xxxxx zákona, xxxxxx xx xxxx zákon č. 378/2007 Sb., o léčivech x o xxxxxxx xxxxxxxxx xxxxxxxxxxxxx zákonů (xxxxx x xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx.
1. 2 Xxxxxxxx xxxxxxxx
X xxxxx celé Xxxxxxxx xxxx xxx xxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxxxxxxx xxxxxxxxxxx závažný xxxxxxx, xxxxx xxxxx xxxxxxxx xxxxxx pacientů. Xxxxxxxx xxxxxx přípravky postihují xx xxxxx míře xxxxxxx xxxxxxxxx xxx (xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx), xxx x xxxxxxxxxx xxxxxx xxx zaznamenán xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx v xxxxxxxx dodavatelském xxxxxxx x xxxxxxxx xxxxxxxxx (xxxxxxxx výrobce, xxxxxxxx xxxxxxxxxxx a xxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxxx xxxxx). Subjekty x legálním xxxxxxxxxxxxx xxxxxxx xxxxx x xxxxxxxx přípravky xxxxxxxx xxxxx xx xxxxxxx xxxxxxxxx x dané xxxxxxxx x xxxxxxx x požadavky xxxxxxxx xxxxxxxx předpisů a xxxx x xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx příslušnými xxxxxxxxxxx xxxxxxxxxx.
Xx xxxxxxxxxxx, xx x Xxxxx xxxxxxxxx nebyl zaznamenán xxxxxx padělaných xxxxxxxx xxxxxxxxx přímo x xxxxxxxxx. Xxxxxxxx xxxxxx xxxxxxxxx xx vyskytují x distribučním xxxxxxx Xxxxx xxxxxxxxx a xxxxxxxx, xxxxxxx xx xxxxx podotknout, xx xxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx xxxxxx - lékárenské xxxx. Xxxxxxx xxxxx xxxxx Ústavu x xxxx 2013 nebyl x Xxxxx xxxxxxxxx x legální xxxxxxxxxxx xxxx zaznamenán žádný xxxxxx výskytu xxxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxx 2014 se xxx jednalo o 11 xxxxxxx, v xxxx 2017 x 45 případů x xx srpna xxxx 2018 xxx 40 xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx distribučním řetězci. Xxxx xxxxxxxx xxxxxxxxxx xxxxxx, že xx xxxxx x xxxxxxxxxxx xxxxx, kterému xx xxxxx xxxxx x xxxxxxxx xxxx, xxx xx padělané xxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx.
Xxxxxxxxxx jsou xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx k xxxxx xxxxxxxx dysfunkce, pálení xxxx, xxxxxx xxxxxx xxxxxxx, xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxxxx xxxxxxx xxxxxxxx přípravků xx x dnešní xxxx xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxx a xxxx kontrolám xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx provozovatelům. Xxxxxxx spočívá x xxx, xx nejsou xxxxxxxx xxxxx povinná xxxxxxxxxxxxx xxxxxx, která xx xxxxxx bránila xxxxxx xxxxxxxxxx léčivých xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce
V reakci xx rostoucí xxxxxx xxxxxxxx xxxxxxxx přípravků x xxxxxxxx xxxxxxxxxxxxx xxxxxxx v Xxxxxxxx xxxx xxxx xxxxxxx xxxxxxxx 2011/62/EU, xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx na obalech xxxxxxxx přípravků, xxxxx xx umožnil xxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivých přípravků x ověření, xxx xxxxxx x obalem xxxxxxxxxxxx. Xxxx přísné xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxxx xxxxxxx proti xxxxxx xxxxxxxxxx léčivých přípravků xx legálního xxxxxxxxxxxxxx xxxxxxx x členských xxxxxxx Xxxxxxxx unie x cílem xxxxxxx xxxxxxxx x zájmy xxxxxxxx rozhodnutí x xxxxxxxxxx x xxxxxxx.
Xx xxxxxx jednoznačného odlišení xxxxxxxxxx léčivých xxxxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx 2011/62/EU xxxxxxxx „xxxxxxxxxx xxxxxxxx xxxxxxxxx“:
Xxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxx xxxxxx přípravek x xxxxxxxxxxxx údaji x jeho xxxxxxxxxx, xxxxxx xxxxx x xxxxxxxx xx xxxxx, xxxxx xxxx xxxxxxx (xxxxxx xxxxx xx xxxxxxx xxxxx); xxxxxx (xxxxxx xxxxxxx, země xxxxxx xxxx držitele xxxxxxxxxx x xxxxxxxxxx) xxxx xxxxxxxx (včetně xxxxxxx x xxxxxxxxx xxxxxxxxxx se distribuce). Xxxxxxxx xxxxxx přípravky x xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxx a xxxxxxx xxxxx, xxxx obsahují xxxxxxxxx xxxxxxxx těchto xxxxx či v xxxxxxxxxx řadě neobsahují xxxxx xxxxxx xxxxx.
Xxxxxxxx xxxxx xxxxxxxxxxx dva xxxxx xxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx:
- xxxxxxxxx identifikátor (xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx čárovým xxxxx, xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx léčivého xxxxxxxxx, xx xxxx je xxxxxxxxx). Jedinečný xxxxxxxxxxxxx xx xxxxxx z xxxxxxxx xxxxxxxx xxxxx: xxx xxxxxxxxx (xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxx, xxxxxxx xxxxx, xxxx, xxxxxxxx balení x typ xxxxxx); xxxxxxx xxxxx (xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxx xxxxxxxxx 20 xxxxx xxxxxxxxxxxxxx deterministickým xxxx xxxxxxxxxxxxxxxxxx xxxxxxxxxxxxx algoritmem); xxxxxxxxxxxx úhradové číslo xxxx xxxx xxxxxxxxxxxx xxxxxxxx xxxxx (xxxxx xxxxx xx xxxxxxxxxx xxxxxxxx státem, x xxxx má xxx xxxxxx xxxxxxxxx na xxx); xxxxx xxxxx, xxxxx xxxxxxxxxxxxx.
- xxxxxxxxxx x xxxxxxx manipulace x xxxxxx (ochranný xxxxx - xxxxxxxxxxxx xxxxxxxx - xxxxxxxxxx xxxxxx, xxx xxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx).
Xxx xxxxxx xxxxxxx xxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx 2011/62/EU, xxx xxxxxxxxxx xx xxxxx členských xxxxxxx Xxxxxxxx xxxx, xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx x nezvyšoval další xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx způsobené xxxxxxxxxxxx xxxxxxxxx odlišností, xxxxxxxxx Evropská Xxxxxx xxxxxxxxxxxxxxx nařízení x xxxxxxxxxx prvcích xxxxxxxx xxxxxxxx xxx zavedení xxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx - xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxxxx x rozsah ověření xxxxxxxxxx prvků jednotlivými xxxxxxxxx xxxxxxxx (výrobci, xxxxxxxxxxxx, xxxxxxx oprávněnými xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx veřejnosti) x xxxxxxx x xxxxxx systému úložišť xxxxxxxxxx xxxxxxxxx o xxxxxxxxxx xxxxxxx (jedinečných xxxxxxxxxxxxxxxx).
Xxxxxxxx x ochranných xxxxxxx xx pro xxxxxxx xxxxx závazné x celém xxxxxxx x je xx xxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxx. I xxxx nařízení o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx prvků xxxxxxxx xxxxxxxxx, xxxxxxx xxxxx otázky ponechává xx xxxxxxx x xxxxxxxxxx členských xxxxx:
X. Xxxxxx příslušného vnitrostátního xxxxxx, xxxxx xx xxx mít xxxxxxx x xxxxxxxx xxx xxxxx dozoru xxx xxxxxxxxxx xxxxxxx, xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxxxx. Xxxxxxxxx poskytnout xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxx státu xxxxxxx x xxxxxxxx x x informacím v xxx xxxxxxxxx xxx xxxx xxxxxxx xxxxx xxxxxx nařízení x xxxxxxxxxx xxxxxxx právnímu xxxxxxxx, který xxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx x ověření xxxxxxxx nebo xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx v xxxxxxxx xxxxx. V podmínkách Xxxxx republiky xxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx x xxxxxxxxxx xxxxxxx Ústav, x xx zejména x ohledem xx xxxxxxxxx právní úpravu xxxx xxxxxxxxxx xxxxx xxxxxxx x léčivech, xxxx xxxxxxxxx autority xxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. Z xxxxxx xxxxxx xx xxxxx xxxxxxxx xxxxxxxxx Xxxxxx v §13 xxxxxx x léčivech. Xxxxx xxx bude xxxxx xxxxxxxxxx stanovené x xxxxxxxx IX xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxxxx xxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx, výrobcům, distributorům x osobám oprávněným xxxx zmocněným xxxxxxx xxxxxx xxxxxxxxx veřejnosti, x léčivých přípravcích xxxxxxxxx xx trh xx xxxxx Xxxxx xxxxxxxxx, xxxxx musí xxx xxxxxxxx ochrannými xxxxx (x xxxxxxx x článkem 54 písm. x) směrnice 2001/83/ES). Xxxxx xxxx xxxxxxxxx xxxxx nad xxxxxxxxxx xxxxxxxxx úložiště v Xxxxx xxxxxxxxx, xxx xxxxxx, x xxxxxxx xxxxxxx xxxxxxxxxxxxxxx inspekcí, xx xxxxxxxx a xxxxxx subjekt xxxxxxxxx xx zřízení x xxxxxx úložiště splňuje xxxxxxxxx xxxxxxxx. Xxxxxx x xxxxxxxx činnosti xxxx předávat Evropské xxxxxxxx pro léčivé xxxxxxxxx, xxxxx je xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx a Xxxxxx.
X. Zajištění, xxx xxxxxxxxxx, xxxxx xxxxxxxx x ochranných xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx, xxxx plněny, x xx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxx oblasti, určením xxxxxxxxx xxxxxx xxxxxxxxxxx x jejich xxxxxxxxxxxx x stanovením xxxx xxxxxx za neplnění xxxxxxxxxx regulovanými subjekty. Xxx úpravy těchto xxxxxxx xx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxx x xxxxxxxx xxxxx xxxxxxxxxxxxxxx a xxxxxx xx se xxxxxxx.
X. Členský stát xxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx prostředku x xxxxxxx xxxxxxxxxx x xxxxxx na xxxxxxx xxxxx xxxxxx xxxxxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX (xx. 2 xxxx. 1 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx), jinými slovy xxxx požadovat, aby xxxxxxxxxx prvky byly xxxxxxxx xxxxx x xxxx xxxxxxxx xxxxxxxxx, xxxxx povinnost xxxx xxxxxxxx xxxxx nemají. Xxxxx republika xxxxxx xxxxxxxxxx xxxxxx působnosti xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx k xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxxxx xxxxx xxxxxx xxxxxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/ES (čl. 2 xxxx. 1 xxxx. x) xxxxxxxx o xxxxxxxxxx prvcích).
Z xxxxxxxxx Xxxxxxxx Xxxxxx „Xxxxxx Xxxxxxxx xxx medicinal xxxxxxxx for xxxxx xxx - Questions xxx Answers“ - Xxxxxxx 9 (Xxxxxxx 2018) xxx. 5 xxxxxx 1.10. xx xxxxxx, xx pokud xxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxx 54a xxxx. 5 xxxx xxxxx xxxxxxxx 2001/83/XX xxxx xxxxx xxxxxxx xxxxxxxxxx k ověření xxxxxxxxxx x obalem xx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx xx lékařský xxxxxxx xxxxxxxx xx dobrovolnosti xxxxxxx.
Xxxxxxx Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx 54x xxxx. 5 xxxx xxxxx směrnice 2001/83/XX x nerozšiřuje xxxxxx xxxxxxxxxx prostředku x xxxxxxx xxxxxxxxxx x xxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx výdeje xx xxxxxxxx předpis, xxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx 54x odst. 1 xxxxxxxx 2001/83/XX xxx., xx xxxxxx xxxxxxxxx xxxxxxxxxxxxx omezení xxxxxx xx xxxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxx ochrannými prvky, xx. ani xxxxxxxxxxx x ověření xxxxxxxxxx x xxxxxx (s xxxxxxxx těch zapsaných xx xxxxxx x xxxxxxx XX xxxxxxxx x xxxxxxxxxx xxxxxxx).
X. Xxxxxxxx uvádí pojem „xxxxxxxxxxxx xxxxxxxx xxxxx“ xxxx „xxxx xxxxxxxx xxxxx“ identifikující xxxxxx xxxxxxxxx a ponechává xx xxxxxxxxxx xxxxxxxxx xxxxx, zda xxxxx xxxxxx xxxxx bude xxxxxx x rámci xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx. X Xxxxx xxxxxxxxx xx „xxxxxxxxxxxxx xxxxxxxxx xxxxxx“ xxx xxxxxxxxx Xxxxxxx xxxxx §32 xxxx. 5 xxxxxx o xxxxxxxx (xxxx xxx „xxx XXXX“). Xxxxx republika xxxxxx požadovat, xxx xxx XXXX xxx xxxxxx v rámci xxxxxxxxxxx xxxxxxxxxxxxxx, xxx., xx xxxx ponechán xxxxxxxxx stav, xxx xxx XXXX xx xxxxxx na xxxxx xxxxxxxxx.
X. Xxxxxxx zásadou xxxxx xxxxxxxxx x xxxxxxxxxx prvcích xx xxxx xxx, aby x uceleném xxxxxxxxxx xxxxxxx xxxxxxxx jedinečného xxxxxxxxxxxxxx ze xxxxxxx xxxxxxx xxxx xxxxxxxxx xx konci dodavatelského xxxxxxx, tj. xxx xx xxxxxx přípravek xxxxx xxxxxxxxxx. Xxxxxxx xxxx xx měl xxx xxxxxxxxx zvláštní xxxxxxxxxxxxxxx xxxxxxxxxxxxxx řetězce xx xxxx území x xxxxxxx xx xxx právní úpravě, xxx xxxxxxxxxxx xxxxxx xxxxxxxx prvky x xxxxxxx vyřazení jedinečného xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxx, xxx xxxxxx přípravek vydá xxxxxxx z xxxx xxxx xxxxxxxxx xxxxxxxxx x článku 23 nařízení x ochranných xxxxxxx:
x) xxxxxx xxxxxxxxxx nebo xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx, xxxxx xxxxxxxx x rámci xxxxxxxxxxxxxx xxxxxxxx xxxx xxxxxxx;
x) veterinárním xxxxxxx x maloobchodníkům s xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx,
x) xxxxxx lékařům;
d) xxxxxxxxxxxxx x xxxxxxx;
x) pracovníkům xxxxxxxxxxxx xxxxxxxxx xxxxxx;
x) xxxxxxxxxx silám, policii x dalším xxxxxxx xxxxxxxxxx, které xx xxxxxxx xxxxxx léčivých xxxxxxxxx pro účely xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx;
x) univerzitám x xxxxxx institucím xxxxxxxxxxxxxxx xxxxxxxxxx, které xxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxx výzkumu x xxxxxxxxxx, s xxxxxxxx xxxxxxxxxxxxxx xxxxxxxx;
x) xxxxxxxx;
x) xxxxxx;
x) hospicům;
k) xxxxxxxxxxxxx xxxxxxxxx.
X rámci Xxxxx republiky xxx xxxxxx xxxxxxx xxxxxxx 23 xxxxxxxx o xxxxxxxxxx xxxxxxx, xx. xxx xxxxxxx ochranných xxxxx x vyřazení xxxxxxxxxxx xxxxxxxxxxxxxx ze xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx, xxxxxx xxxxx x xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx
- veterinárním xxxxxxx,
- Xxxxxx Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxx xxx xxxxxx, x udržování skladových xxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxxxx xxxxxxxxxxx xxx Xxxxx xxxxxxxxx xxxxxx při xxxxxx xxxxxxxx xx xxxxxxxxx podle §111a xxxxxx x léčivech x
- poskytovatelům xxxxxxxxxxx xxxxxx, kterým xxxx xxxxx §77 odst. 1 xxxx. x) xxxx 12 dodávány xxxxxxxxxxxx léčivé xxxxxxxxx xxx xxxxx xxxxxxxxxxxx xxxxxxxx xx základě xxxxxxx xxxxxxx xxxxxxxxxxxx xx zdravotní xxxxxxxxxxx xxxx xxxx xxxx xxxxxxxxx xxx účely xxxxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx anebo xxxxxxxxxxx hrazeného xxxxxxxx x xxxxx preventivní xxxx dle xxxxxx xxxxxxxx předpisu.
Výše uvedené xxxxxx je xxxxx xxxxxxx xxxxx x xxxxxx xxxxxx zákona x léčivech tak, xxx xxxxxxxxxxxxxx s xxx xxxxxxxxxx základní xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx 2011/62/EU, xxxxx xxxx xxxxxxxxxxxxx do zákona x xxxxxxxx novelou č. 70/2013 Sb. Xxxxxxxxxxx úpravou xxxx zároveň xxxxxxxx xxxxxxxx adaptace nařízení x xxxxxxxxxx xxxxxxx xxx, xxx mohla xxx xxxx xxxxxxxxxx xxxxx x beze xxxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxx xxxxxxxxx.
1. 3 Xxxxx xxxxxxxxxxxx xxxxxxxx stavu v xxxx xxxxxxx
Xxxxxxxxxx právní xxxx x dané xxxxxxx x xxxxxxxx xxxx představuje unijní xxxxxx norma, a xx směrnice 2011/62/EU, xxxxx je xx xxxxxxxxxxxxxx právního xxxx xxxxxxxxxx novelou zákona x xxxxxxxx č. 70/2013 Sb. Xx xxxxxx o xxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, x to xx xxxxxx jednoznačného xxxxxxxx xxxxxxxxxx léčivých xxxxxxxxx xx xxxxxx xxxxxxxxxxx léčivých xxxxxxxxx. Xxxx xxxx zejména xxxxxxxxx, které xxxxxx xxxxxxxxx xxxx xxx xxxxxxxx ochrannými prvky x xxxxx xxxx xxxxxxxx xxx nesmějí, xxx xx xxxxxxxx xxxxx považují za xxxxxxxxxx xxx xxxxxxx xxxxxxxxx xx. 47x xxxx. 1 xxxx. x) směrnice 2001/83/XX (xxxxx čl. 17 nařízení x xxxxxxxxxx xxxxxxx) x kdy xxxxxxxx xxxxx nesmějí xxx xxxxx xxxx xxxxxx xxxxxxxxxx xxxx xxxxxxxx, x xxxx doplněny xxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx jednak s xxxxxxxxxx léčivých přípravků xxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxxx x udržováním xxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxx x xxxx xxxxxxxxx distributora xxxxxxxxxx Xxxxx a držitele xxxxxxxxxx x xxxxxxxxxx x léčivém xxxxxxxxx, xxxxx xxxxxxx nebo xx xxx xxxxxxxx, x xxxxxxx xxxxxxxxx, xx se xxxxx x padělaný léčivý xxxxxxxxx (viz ustanovení §37 xxxx. 7 x 8, §64x, §66 odst. 1 xxxx. x) mající xxxxxxxxx účinnost). Xxxxxxxxxx §77 xxxx. 1 xxxx. x) x x), xxxxx nabyla xxxxxxxxx xx 2.4.2013, xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxx xxxxxxxxxxx x xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx x způsoby xxxxxxxxx xxxxxxxxxx xxxxx xxxx dány nařízením x xxxxxxxxxx xxxxxxx, xxxxx xxxxxx účinnosti 9.2.2019, xxxxxxxxx distributora xxxxxxxx xxxxxxxx xxxxx x přijmout xxxxxxxxx xxxxxxxx x případě xxxxxxxxxx xxxxxxxx přípravků, xxxx xxxx xx x tomuto xxxx.
Xxxx xxxxxxxxxx xxxxxx xxxx x xxxx xxxxxxx xxxxxxxxxxx x xxxxxxxxxx xx xxxxxxxxx směrnici Xxxxxxxx xxxx Xxxxxx xxxxxxx prováděcí xxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx ochranných xxxxx xxx humánní léčivé xxxxxxxxx. Xxxx nařízení x ochranných xxxxxxx xxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx na xxxxxxxx xxxxxxxxxx x Xxxxx xxxxxxxxx.
X nařízení x ochranných xxxxxxx, xxxxx xx xxxxxxx xx 11 kapitol x 4 xxxxxx, xxxx uvedeny definice xxxxxxxxxx prvků - xxxxxxxxxxx xxxxxxxxxxxxxx x xxxxxxxxxx x ověření xxxxxxxxxx x xxxxxx, xxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxxxx prvků - xxxxxxxxxxx xxxxxxxxxxxxxx, xxxxxxx x xxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxxxxx, distributory, xxxxxxx xxxxxxxxxxx nebo zmocněnými xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx), xxxxxxxx pro xxxxxxx x správu xxxxxxx xxxxxxx obsahující xxxxxxxxx x xxxxxxxxxx xxxxxxx (xxxxxxxxxxx xxxxxxxxxxxxxxxx) x xxxxxxx léčivých xxxxxxxxx, které xxx, x xxxxx xxxxx xxx xxxxxxxx ochrannými xxxxx. Xxxxx xxxxxxxxx xx umístění xxxxxxxxxx xxxxx (xxxxxxxxxxx xxxxxxxxxxxxxx x prostředku x xxxxxxx xxxxxxxxxx s xxxxxx) na xxxxx xxxxxxxx xxxxxxxxx léčivých xxxxxxxxx xx umožnění xxxxxx xxxxxxxxxxxx x xxxxxxx pravosti.
Kapitola I xxxxxxxx x ochranných xxxxxxx xxxxx oblast xxxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx prvků. Xxxx nařízení xx xxxxxxxx xx:
x) Xxxxxx xxxxxxxxx, xxxxxxx xxxxx xx xxxxx xx xxxxxxxx xxxxxxx (xxx xx. 54x odst. 1 xxxxxxxx 2001/83/XX), xxxxx xxxxxx uvedeny x xxxxxxx x xxxxxxx X nařízení x xxxxxxxxxx prvcích.
b) Xxxxxx přípravky, xxxxxxx xxxxx xxxx vázán xx xxxxxxxx xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx x příloze XX xxxxxxxx o xxxxxxxxxx prvcích.
c) Xxxxxx xxxxxxxxx, na xxxxx xxxxxxx xxxxx rozšíří xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx x xxxxxxx manipulace x obalem v xxxxxxx s xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX.
Xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxx XX Xxxxxxxxx xxxxxxxxxxx jedinečného xxxxxxxxxxxxxx, xxxxx xxxxxxx xx xxxxxxxxxxxx xxxxxx xxx, xxx je xxxxxxx x článku 5 xxxx kapitoly.
Kapitola XXX xxxxxxxx o xxxxxxxxxx xxxxxxx uvádí Xxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx bude ověření xxxxxxxxxx xxxxx xxxxxxxx xxxx xxxxxxxx, jsou x xxxxxx xxxxxxxxxx xxx ověřování xxxxxxxxx, x xx x xxxxxxxxxxx xxxxxxxxx podle xxxxxxx XX xx XX:
X xxxxxxxx IV xxxx stanoveny xxxxxxx xxxxxxx xxxxxxxxxx prvků x xxxxxxxx jedinečného xxxxxxxxxxxxxx xxxxxxxxx xxxxxxx.
X xxxxxxxx V jsou xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx.
X kapitole XX jsou xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx prováděné xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxx léčivé xxxxxxxxx veřejnosti.
Kapitola XX-XX xxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx v xxxxxxx, xx xxxx xxxxx xx xxxxxxxx, xx x xxxxxx xxxxxxxx přípravku xxxx xxxxxxxxxxxx, xxxx v xxxxxxx, xx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx, xx přípravek xxxx xxxxx: xxxxxxx přípravek xxxxxxxxxx k xxxxxxx xxxx xx xxxxxxxxxx x okamžitě uvědomí xxxxxxx xxxxxxxxx xxxxxx; xxxxxxxxxxx přípravek xxxxx xxxxxx nebo xxxxx x xxxxxxx xxxxxxx xxxxxxxxx xxxxxx; xxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx přípravek xxxxx xxxxx x okamžitě xxxxxxx dotčené xxxxxxxxx xxxxxx.
Xxxxx xxx x xxxxxxx xxxxxxx xxxxxxx, xx xxxx xxxxxxxxxxxxx x Xxxxxxxx XXX - Xxxxxxx, správa x xxxxxxxxxx systému xxxxxxx. Xxxxxx xxxxxxx, x němž xxxx xxx xxxxxxxx xxxxxxxxx x ochranných xxxxxxx, xxxxx x spravuje xxxxxxxxx právní xxxxxxx xxxxxxx x EU xxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravků opatřených xxxxxxxxxx xxxxx. Xxxxxxx xx xxxxxx xxxxxxx xxx xxxxxxxx x xxxxxxxxxx prvcích xxxxx xxxxxxx xxxxxxxx přípravků xxxxxxxxxx xxxxxxxxxx xxxxx.
X xxxxxxxx VIII jsou xxxxxxx povinnosti xxxxxxxx xxxxxxxxxx x registraci, xxxxxxxxxx dovozců x xxxxxxxxxx distributorů v xxxxxxxxxxx xx xxxxxxxxx xxxx odcizenými přípravky, xxxx. xxxxxxxxx xxxxxxxxxx xxxx bezplatné xxxxxx.
X xxxxxxxx XI jsou xxxxxxx povinnosti xxxxxxxxxxx xxxxxxxxxxxxxx orgánů, x xx xxxxxxx povinnost xxxxxxxxxxx na xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx xxxxxxxxxx x registraci, xxxxxxx a xxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxx léčivé xxxxxxxxx) xxxxxxxxx o xxxxxxxx xxxxxxxxxxx xxxxxxxxx na xxx xx jejich xxxxx, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx, x xxxxxxxxx x xxxxxxxx přípravcích, xx které příslušný xxxxxxx stát xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx xx dozor xxx systémem úložišť.
Kapitola X xxxxxxxx x xxxxxxxxxx prvcích uvádí xxxxxxxx od xxxxxxxxxx xxxxxxxx - x xx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxx, jejichž xxxxx xx xxxxx xx xxxxxxxx předpis, xxxxx xxxxx xxx xxxxxxxx xxxxxxxxxx prvky, který xx xxxxxx x xxxxxxx I xxxxxxxx x ochranných xxxxxxx, x xxxxxx xxxxxxxx xxxxxxxxx či xxxxxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx prvky, xxxxx xx xxxxxx v xxxxxxx XX xxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxxxxx XX uvádí xxxxxxxxx xxxxxxxxxx x vstup x xxxxxxxx.
Xxxxxxx X xxxxxxxx o xxxxxxxxxx xxxxxxx (xxxxxxxxxx xxxx xxx. „White xxxx“) xxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxxx, x xxxxx nesmí xxx xxxxxxxx xxxxxxxxxx xxxxx: xxxxxxxxxxxx xxxxxx xxxxxxxxx; xxxxxxxxxxxxxx xxxxxxxxxx; xxxx; xxxxxxxxxxxxxx prekurzory; léčivé xxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxxxxx tkáně xxxx buňky xxxx xxxx xxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxx xxxxxx, jejichž XXX xxx xxxxxx xx X05XX; xxxxxxxxxxx plyny, xxxxxxx ovlivňující xxxxxxxxx xxxxxxxxxxx, jejichž XXX xxx xxxxxx xx X05XX; roztoky vyvolávající xxxxxxxxxx xxxxxxx, jejichž XXX kód xxxxxx xx B05BC; xxxxxxx x xxxxxxxxxxxxx xxxxxxxx, xxxxxxx XXX kód xxxxxx na B05X; xxxxxxxxxxxx a xxxxxxx, xxxxxx irigačních xxxxxxx, xxxxxxx XXX xxx xxxxxx xx X07XX; xxxxxxxxxx xxxxx, xxxxxxx XXX kód xxxxxx xx X08; xxxxx xxx alergická xxxxxxxxxx, xxxxxxx ATC kód xxxxxx na X04XX; xxxxxxxx xxxxxxxx, xxxxxxx XXX kód xxxxxx xx X01XX.
Xxxxxxx XX xxxxxxxx o ochranných xxxxxxx (xxxxxxxxxx xxxx xxx. „Black xxxx“) xxxxx seznam xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx přípravků xxxxxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxx xxxxxxx, xxxxx xxxx xxx xxxxxxxx xxxxxxxxxx xxxxx: léčivé xxxxxxxxx s léčivou xxxxxx xxxxxxxxx v xxxxxx xxxxx enterosolventní xxxxx tobolka a xxxx 20xx nebo 40xx.
Xxxxxxx XXX a XX xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx Xxxxxx o xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xx lékařský předpis, xxx u xxxxx xxxxx xxxxxx padělání, xxxx x xxxxxxxx xxxxxxxxxxx, x kterých xxxxxx xxxxxxxx nehrozí.
Toto xxxxxxxx Xxxxxx x xxxxxxxxxx xxxxxxx xx xxxx xxx xxxx xxxxxxxxxx xx xxxxxxxx Xxxxx republiky xxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx, xxxxx xxxxx se xxxx xxxxxxxxx.
1. 4 Xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
Xxxxxxxxx xxxxxxxx xxxx:
- Xxxxxxxxxxxx xxxxxxxxxxxxx,
- Xxxxxx ústav xxx xxxxxxxx xxxxx,
- xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx,
- držitelé xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx,
- distributoři xxxxxxxxx xxxxxxxx přípravků,
- držitelé xxxxxxxx souběžného xxxxxx xxxxxxxx přípravků,
- poskytovatelé xxxxxxxxxxx xxxxxx xxxxxxxxx x výdeji léčivých xxxxxxxxx,
- xxxxxxxxxx xxxxxxxxxx x každý xxxxxxx, xxxxx xxxxxx xx xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxx.
1. 5 Xxxxx xxxxxxxx xxxxx
Xxxxxxxxx xxxxx xxxxxx xxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxx souvisejících s xxxxxxxx xxxxxxxx řádu Xxxxx xxxxxxxxx na xxxxxxxx o ochranných xxxxxxx.
Xxxxx xxxxxx xx xxx xxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xx xxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx Evropské xxxx x xxxxxxxx xxxxxxxx Xxxxx republiky xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce xx xxxxx území. Tato xxxxxxxx se xxxxxxxx xx xxxxxxxx prvky, xxxxx xx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxx x prostředku x xxxxxxx xxxxxxxxxx x xxxxxx, x xxxxxxxx xx na obalu xxxxxxxx léčivých xxxxxxxxx x xxxxxxxx xx x xxxxxx procesu xxxxxxxxx x xxxx xxxxxxx, x xx x xx pomoci xxxxxxx xxxxxxx, xx xxxxxx se soustřeďují xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxx. Xxx xxxxxx xxx xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx EU, xxxxxxxxxx xxxx xxxxxxxx přípravků x xxxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx řetězce xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxxxx x technické xxxxxxxxxxx jedinečného identifikátoru, xxxxxxx ověření ochranných xxxxx x xxxxxxx x správu systému xxxxxxx.
Xxxxxxxx xxxxx xxxxx xxxxxx xxx xxxxx xxxxxxxx xx xxxxx xxxxxxxxxxx humánních léčivých xxxxxxxxx - xxxxxxxxx xxxxxxxxxxxxx (xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx, xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xx xxxx xx xxxxxxxxx) x xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx (xxxxxxxx prvek - xxxxxxxxxxxx xxxxxxxx - xxxxxxxxxx xxxxxx, xxx xxxx x xxxxxx xxxxxxxx přípravku xxxxxxxxxxxx).
Xxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxx systému xxxxxxx, xx xxxxxxx xxxxx xxxx xxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxx jednotlivých xxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx xxxxxxx xxxxx x xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxxx právní xxxxxxxx xxxxxxx x Xxxx xxxxxxx a xxxxxxxx rozhodnutí x xxxxxxxxxx léčivých xxxxxxxxx xxxxxxxxxx ochrannými prvky. Xxxxxxx xxxxxxx xxxxxxx xx xxxxxx xxxxxxx xxxxxxxx právní xxxxxxxx xxxxxxxxxxx alespoň x xxxxxxxxxxxx, osobami oprávněnými xxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx x x xxxxxxxxx xxxxxxxxxxx vnitrostátními xxxxxx. Xxxxxxx xx systém xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx opatřených xxxxxxxxxx xxxxx x xxxxxxx x xxxxxxx 54x xxxx. 2 xxxx. x) xxxxxxxx 2001/83/XX. Systém úložišť xx skládá x xxxxxxxxxxx úložiště x xxxxxxxx, která slouží xxxxx xxxxxxx xxxxxxxxx xxxxx („xxxxxxxxxxxx úložiště“), xxxx xxxxxx více xxxxxxxxx států („nadnárodní xxxxxxxx“), která xxxx xxx xxxxxxxxx k xxxxxxxxxxx xxxxxxxx (xxx xxxxxxx).
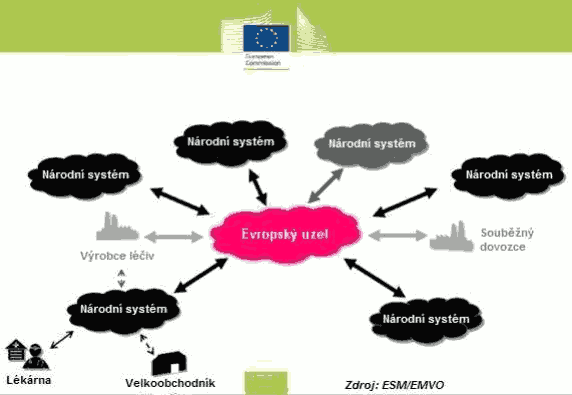
Xxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxx (Xxxxxxxx Xxxxxxxxx Xxxxxxxxxxxx Xxxxxxxxxxxx, XXXX) xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxx x xxx xxxxxxxxxxxxxxx xxxxxxxx, xxxxxxxxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxxx x xxxxxxxxx. Xxxxxxx úkolem xxxx xxxxxxxxxx xx xxxxxxx x xxxxxx xxxxxxxxxxx úložiště (Xxxxxxxx Xxx).
X xxxxxxxxxx Xxxxx xxxxxxxxx jako xxxxxxxxx xxxxxx xxxxxxx byla xxxxxxxx Xxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxx, z. x. (XXXX), xx xxxxxx Xxxxxxxx 620/3, Karlín, 186 00 Praha 8, xxxxxxx zakládajícími xxxxx xxxx:
|
Xxxxx |
Xxxxx |
|
Xxxxxxxx inovativního xxxxxxxxxxxxxxx průmyslu (XXXX) |
Xxxxxxxx 620/3 |
|
186 00 Xxxxx 8 - Karlín |
|
|
Česká xxxxxxxx xxxxxxxxxxxxxxx firem (XXXX) |
Xxxxxxxxxx 458/1 |
|
118 00 Xxxxx 1- Malá Xxxxxx |
|
|
Xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx (XXXX) |
Xxxxxxx Smiřických 42 |
|
281 63 Xxxxxxxx xxx Černými lesy |
|
|
Asociace xxxxxxxxxxxxxxxxx léčiv - XXXX, x. s. |
Dědinská 893/29 |
|
161 00 Xxxxx 6 - Ruzyně |
|
|
Česká xxxxxxxxxx komora |
Rozárčina 1422/9 |
|
140 02 Xxxxx 4 |
Xxxxx Xxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx léčiv, x.x. (XXXX) xx xxxxxxx a xxxxxx xxxxxxxxx xxxxxxxx (Xxxxxxx xxxxxx pro xxxxxxxxx xxxxx (XXXX), xxx xxxx propojeno x xxxxxxxxx úložištěm. Xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx jsou xxxxxxxxxx xxxxxxxx xxxx Xxxxxxxx xxxxxx xxxxxxxxx léčiv (Xxxxxxxx Medicines Xxxxxxxxxxxx Xxxxxx, XXXX).
Xxxxxxx xxxxxxxxxx xxx ověřování xxxxxxxx xxxxx, z.s. (NOOL) xxxx právní xxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx x ČR, xx povinen xxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx tyto xxxxx:
x) xxxxxxxxx příslušné xxxxxxxxxxxx orgány o xxxx úmyslu xx xxxxxx území xxxxxxx xxxxxxx úložiště nebo xxxx xxxx x xxxxxxx xx, jakmile xxxx xxxxxxxx xxxxxxxxxxx;
x) xxxxxx bezpečnostní postupy, xxxxx zajistí, že xxxxxx xxxxxxx xx xxxxxxxx a xxxxxxxx xx xxx xxxxxxxxx xxxxxxx x souladu x článkem 33 xxxx. 2 mohou xxxxx uživatelé, xxxxxxx xxxxxxxxx, funkce x xxxxxxxxxx byly ověřeny;
c) xxxxxxxxxxx xxxxxxx xxxxxxxx xxx xxxxxx, xx xx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx na xxxxxxxxxxx xxxxxxx padělání;
d) xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx v xxxxxxx x x xxxxxxx, xx se padělání xxxxxxx, xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxx, Xxxxxxxxx xxxxxxxx xxx léčivé xxxxxxxxx a Komisi;
e) xxxxxxxxxx provádí xxxxxx xxxxxxxx, xxx xx xxxxxx xxxxxx x xxxxxxxxx xxxxxx xxxxxxxx (xxxxxxx pět let xxx xxx xxxxxxxxxxxxx xxxxxxxx xx audit xxxxxxx xxxxxxx xxxxxx xxxxx, x xxxx xxxxxxx xxxxxx xx xxx xxxx; xxxxxxxx xxxxxx auditů se xx požádání xxxxxxxxx xxxxxxxxxx xxxxxxx);
x) xx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx zpřístupní xxxxxxx xxxxx uvedenou v čl. 35 odst. 1 xxxx. x) xxxxxxxx x xxxxxxxxxx prvcích;
g) xx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxx x čl. 36 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx.
Xxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx balení xxxxxxxxxxx xxxxxxxx xxxxxxxxx ochrannými xxxxx x xxxxxx, xx jedinečný identifikátor xx čitelný x xxxxxxxx xxxxxxxxx dané xxxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxxxxx rozhodnutí x xxxxxxxxxx xxxx xxxxxxxxx osoba x xxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx musí xxxxxxxx, xxx xxxxxxxxx x xxxxxxxxxxx identifikátorech byly xx xxxxxxx xxxxxxx xxxxxxx xxxx tím, xxx xxxx léčivý xxxxxxxxx xxxxxx xx xxx.
Xxxxxxx xxxxxxxxxx prvků x xxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxx xxxxxxxxxxxx x xxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxx ochranných xxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru, xx xxxxxxx xxxxxxx, xxxx xxxx xxxxxxxxx o xxxxxxxxxx xxxxxxx. Xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx jen x případě léčivých xxxxxxxxx, u xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxx (xx. x xxxxxxxx přípravků xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx přípravky xxxx xxxxx xxxxxxxxxxxxx), aby xx minimalizovalo xxxxxx, xx xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx volně xxxxxxxx xx celém území Xxxx, xxxxx xx xxxxxx xxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx. Xxxxx xxxxxxxxx k xxxxxx xxxxxxxx přípravků xxx před výdejem xxxxxxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx ze systému xxxxxxx x okamžiku xxxxxx xxxxxxxxxx.
Xxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x uceleném ověřovacím xxxxxxx xx nezbytné xxxxxx xxx ochranné xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxx léčivého xxxxxxxxx xx provede jeho xxxxxxxxxx s xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx a jeho xxxxx xx zajistit, xx léčivý xxxxxxxxx xxxxxxx od xxxxxxxxxxx xxxxxxx, který xxxxxxxxx xxxxxxxxxxxxxx vložil xx xxxxxxx xxxxxxx. Ověření xxxxxxxxxxxxx xxxxxxxxxx k xxxxxxx xxxxxxxxxx s xxxxxx bude provedeno xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx a xxxx xxxxx xx xxxxxxxx, xx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx nemanipuloval nikdo xxxx xxxx pacientem, xxxxxxx bylo xxxxxx xxxxxxxx přípravku vydáno.
Předkladatel xxxxxx zákona, x xxxxxx xx dílčí xxxxxxx xxxx xxxxxxxxxx xxxxxxx spočívající na xxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxx, xxxxx:
- Xxxxxx xxxxx xxx xxxxxxxx xxxxx jako xxxxxxxxx vnitrostátní xxxxx, xxxxx xxxx xxx xxxxxxx k úložišti xxx účely xxxxxx xxx xxxxxxxxxx xxxxxxx, xxxxxxxxxxx potenciálních xxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxxxxxxx x farmakoepidemiologie.
- Xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx působnosti xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxx x ověření manipulace x obalem xx xxxxxxx další xxxxxx xxxxxxxxx x xxxxxxx x xxxxxxx 54x xxxx. 5 xxxxxxxx 2001/83/XX (čl. 2 xxxx. 1 xxxx. c) xxxxxxxx x xxxxxxxxxx xxxxxxx).
- Xxxxx republika xxxxxx xxxxxxxxx, xxx xxx XXXX xxx xxxxxx v xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx, xxx., xx bude ponechán xxxxxxxxx stav, xxx xxx XXXX je xxxxxx xx xxxxx xxxxxxxxx.
- Xxxxx republika xxxxxxx článek 23 písm. x) nařízení x xxxxxxxxxx xxxxxxx i xxx systém xxxxxxxxxx xxxxxxxxxxxxxx léčivých přípravků xxx xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxx xxxxxxxx xxxxxxxxxxxxx xxxx xx xxxxxxx xxxxxxx smlouvy Xxxxxxxxxxxx zdravotnictví x xxxxxxxxxxxxx.
Xxxxxxxx cílem xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx přípravků xx xxxxx zabránit xxxxxx xxxxxxxxxx léčivých přípravků xx xxxxxxxxx distribučního xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxx padělaných léčivých xxxxxxxxx xxxxxxxxx v xxxxxxxxx x xxx xxxxxx ochranu xxxxxxxxx xxxxxx. Ucelený xxxxxx xxxxxxxxx pravosti xxxxx xx xxxxxx výrobce, xxxxxxxxxxxx xxxxx či xxxxx xxxxxxxxx x xxxxxx xxxxxxxx přípravků xx xxx být xxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx dodavatelském xxxxxxx. Xxxxxxxx lze předpokládat, xx xxxxxxxxx evropského xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx přípravků bude xxxxxxx xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx.
1. 6 Xxxxxxxxxx rizika
V xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, tj. xxxxxxxxx xxxxxxxx souvisejících x xxxxxxxx právního xxxx Xxxxx republiky xx xxxxxxxx o xxxxxxxxxx xxxxxxx je xxxxxxxxx xxxxxxx xx, xx xxxxxxxxxxxx xxxxxxxx předpokladů xxx zajištění xxxxxxx xxxxxxxxxx, používání a xxxxxxxxx xxxxxxxxxx prvků xx xxxxx xxxxxxxxx xxxxxxxx přípravků x Xxxxx republice, xx xxxxxxx x xxxxxxxxxx xxxxxxx bezpečnosti léčivých xxxxxxxxx, což by xxxxx vést x xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxx, x xxxxx by xxx xxxxxxx nenahraditelné xxxxxxx xxxx x xxxx xxxxxxxxx xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx x Xxxxx xxxxxxxxx xxxxx zaznamenán výskyt xxxxxxxxxx xxxxxxxx přípravků xxxxx x xxxxxxxxx, xxxxxxxx xxxxxx xxxxxxxxx xx vyskytují x xxxxxxxxxxxx xxxxxxx x xxxxxxxx.&xxxx; Xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx přípravků x xxxxxxxx xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxx 1. xxxxxxxx krok x xxxx, xxx xx xxxxxxxx xxxxxx přípravek xxxxxx xx xxxxxxx x xxx následně xxxxx pacientovi. Xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx přípravků x xxxxxxxx xxxxxxxxxxxx řetězci, xxxxxxxxx xx xxxxxxxxxx, xx dosavadní xxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx a je xxxxxxx xxxxx x xxxxxxxx tomu, xxx xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx.
Xxxxxxxxx xxxxxx bude xxxxxxxx xxxxx x xxxxxxx, kdy xxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxx x xxxxxxx xxxxx XX xxxxx plnit xxx xxxxxxxxxx xxxxxxxxxxx x xxxx uvedených xxxxxxxx xxxxxxxx XX.
Xxxxxxxxxxxxxxx xxxxxxx je také xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx jako xxxxxxxx xxxxxxx x xxxxxxxx Xxxxxxxx unie ze xxxxxx členského xxxxx x xxxxxxxx řízení xx xxxxxx Xxxxxxxx xxxxxx proti Xxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxx povinnosti x xxxxxxxxx x uložení xxxxxx adekvátní xxxxxxxx xxxxxxxx, které xx xxxx dopad xx xxxx xxxxxx x xxxx xxxxxxxxx xxxxxx xxxxx x rozměru Xxxxx xxxxxxxxx, ale x xxxxxxxxx členských xxxxx, xxxxx xxx x případě, že xxxxxxxx budou xxxxxxxxxx xxxxx, bude xxxxxx xxxxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx úpravy xxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského řetězce, x xxxx ochrana xxxxxxxx. Xxxxxxxxx xxxxxxxx xx zároveň zájmem xxxxxxxxxxxxxxx xxxxxxxx, protože xxxxx x xxxxxxxxx xxxxxxxxx xxxx od xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx existence a xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx řetězce dosud xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxx ztráty.
2. Návrh xxxxxxx xxxxxx
2. 1 Xxxxxxxx regulatorně-technického řešení
Při xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxxxxx problému z xxxxxxxx (regulatorně-technického) xxxxxxxx, xxxxx xx xxxxx xxxx ke xxxxxxxxxxx xxxx, xxxx zvažováno xxxxx předkládané xxxxxx x xxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx xx právního xxxx Xxxxx republiky xxx xxxxxxxxx pouze xxxxxxx xxxxxx xxxxxx, když xxxxx xxxxx xxxxx xxxxxx prvky xxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx. Xx xxxxxx, že xxxxxxxxxxxxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxxx. Rovněž xxx xxxxxxxxxx zkušeností x aplikační praxe xxxxxx o xxxxxxxx xx xxxxx pouze xxxxxx xxxxxx xxxxxx xxxxxx. Xxxxxxxxx xxxxx xxxxxx nulové varianty xxxx uvedeny xxxx, xxxxxxxx xxxx variantu xxxxx xxxxxxxxxx.
2. 2 Xxxxxxxx věcného řešení
2.2.1 Xxxxxxxx 1 (xxxxxx)
Xxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxx zákona, xxxxx xx xxxxxxx xxxxxxxxxx, xxxxx nařízení x ochranných prvcích xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxx členských států x xxxx xxxxxx xx mělo xx xxxxxxxx xxxxxxxxxxx adaptace xxxxxx přímo xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx. X xxxxxxx xx xxxx xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx xx varianta 1 xxxxx xxxxxxxxxx x „xxxxxxx xxxxxxxx“ xxxxx xxxxxx.
2.2.2 Xxxxxxxx 2 (xxxxxxxx xxxxxx platného xxxxxx)
Xxxx xxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxx státy z xxxxx xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx, který xxxxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx.
Xxxxx xxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx x předložit xxxxx xxxxxx platného xxxxxx x xxxxxxxx, xxxxxx xx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx, která jsou xxxxxxxxx x xxxxxxxxxx xxxx na xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxxxx k xxxxxx xxxxxx xxxxxxxx spočívající x xxxx xxxxxx xxxxxxxxxx a xxxxx xxxxxxxxxxxxx je xxxxxxxx 2 xxxxxx x xxxxxxx s xxxxxx Xxxxxxxx unie.
Navrhuje se, xxx x České xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx dle xxxxxxxx x xxxxxxxxxx xxxxxxx Xxxxx, a xx zejména x xxxxxxx xx xxxxxxxxx xxxxxx úpravu jeho xxxxxxxxxx xxxxx xxxxxxx x xxxxxxxx, xxxx xxxxxxxxx xxxxxxxx pro xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. X tohoto xxxxxx xx xxxxx xxxxxxxx xxxxxxxxx Xxxxxx xxxxxxxxxx x §13 xxxxxx o xxxxxxxx. Xxxxx xxx xxxx xxxxx xxxxxxxxxx xxxxxxxxx x kapitole XX xxxxxxxx x xxxxxxxxxx xxxxxxx. Xxxxxxx xxxxx x zpřístupnění xxxxxxxxx xxxxxxxxx xxxxxxxxxx, výrobcům, xxxxxxxxxxxxx a xxxxxx xxxxxxxxxx nebo zmocněným xxxxxxx léčivé xxxxxxxxx xxxxxxxxxx, x xxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxx xx xxxxx Xxxxx xxxxxxxxx, xxxxx xxxx být opatřeny xxxxxxxxxx prvky (x xxxxxxx x článkem 54 písm. x) xxxxxxxx 2001/83/XX). Xxxxx xxxx vykonávat xxxxx xxx fungováním xxxxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, aby xxxxxx, x xxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx, xx xxxxxxxx a xxxxxx xxxxxxx odpovědný za xxxxxxx a správu xxxxxxxx xxxxxxx požadavky xxxxxxxx. Xxxxxx o xxxxxxxx xxxxxxxx bude xxxxxxxx Xxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx, xxxxx je xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx x Komisi.
Obecnou xxxxxxx xxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx xx xxxx xxx, xxx x uceleném xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx identifikátoru ze xxxxxxx úložišť bylo xxxxxxxxx xx konci xxxxxxxxxxxxxx řetězce, xx. xxx xx xxxxxx xxxxxxxxx xxxxx veřejnosti. Xxxxxxx stát xx xxx ale xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx dodavatelského xxxxxxx na xxxx xxxxx a xxxxxxx xx své právní xxxxxx, aby xxxxxxxxxxx xxxxxx ochranné xxxxx x xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx léčivého xxxxxxxxx xxxx xxx, xxx xxxxxx xxxxxxxxx xxxx některé x xxxx xxxx xxxxxxxxx xxxxxxxxx v xxxxxx 23 xxxxxxxx x xxxxxxxxxx xxxxxxx. V xxxxx České republiky xxx xxxxxx popsaný xxxxxxx 23 xxxxxxxx x ochranných xxxxxxx, xx. xxx xxxxxxx xxxxxxxxxx xxxxx a xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx, xxxxxx xxxxx x případě xxxxxxx xxxxxxxx přípravků
- xxxxxxxxxxxx xxxxxxx,
- Xxxxxx Xxxxx xxxxxxxxx k xxxxxxxxxxx xxxxxxxxxxx sil xxxxxx, k xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx pro účely xxxxxxxxxxx xxxxxxxxxxx xxx Xxxxx republiky xxxxxx xxx xxxxxx xxxxxxxx xx zahraničí xxxxx §111a xxxxxx x xxxxxxxx x
- poskytovatelům xxxxxxxxxxx xxxxxx, kterým xxxx xxxxx §77 xxxx. 1 písm. x) xxxx 12 xxxxxxxx imunologické xxxxxx xxxxxxxxx xxx účely xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xx základě xxxxxxx xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxx xxx xxxxx xxxxxxxxx&xxxx; xxxxxxxxxx a mimořádného xxxxxxxx x očkování xxxxxxxxxxxxx xxxx&xxxx; xx xxxxxxx xxxxxxx smlouvy xxxxxxxxxxxx s Xxxxxxxxxxxxx xxxxxxxxxxxxx&xxxx;&xxxx; x xxxxxxxxxxx xxxxxxxx hrazeného x xxxxxxxxx xxxxxxxxxxx pojištění x xxxxx xxxxxxxxxxx xxxx xxx xxxxxx č. 48/1997 Sb., o xxxxxxxx xxxxxxxxxx xxxxxxxxx x x xxxxx x xxxxxxxx xxxxxxxxx souvisejících xxxxxx, xx znění xxxxxxxxxx xxxxxxxx.
X xxxxxxx xxxxxxxx xxxxxxxxx x článku 23 xxxxxxxx o xxxxxxxxxx prvcích, xx x xxxxxxxxxx Xxxxx xxxxxxxxx jedná x xxxxxxxxxxxxx xxxxxxxxxxx služeb, xxxxx xxxx xxxxxxx xxxxxxxxxx xx základě xxxxxxxxx xxxxx zákona č. 372/2011 Sb., x xxxxxxxxxxx xxxxxxxx x podmínkách xxxxxx xxxxxxxxxxx, xx xxxxx pozdějších předpisů (xxxx xxx „xxxxx x zdravotních službách“) x xxxxxx xxxxx xxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx x xxxxxx xxxxxxxx přípravků, x xxxxx xxxxxxx xxxxxxxx prvky u xxxxxxxx xxxxxxxxx ověřit. Xxxx subjekty xx xxxxxxxx x xxxxxxx xx xxxxxxx x xxxxxxxx pro xxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx od xxxxxxxxxxxxx xxxxxxxxxx xxxx xx žádanky/objednávky. Xxxxxxxxxxxxx xxxxxxxxxx xxxx, xxxx xxxxx xxxxxxxxx x xxxxxx, x xxxxxx xxxxxxxxx xxx výdeji xx žádanku xxxxx xxxxxxxx prvky x xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xx systému xxxxxxx. X xxxxxxxxxx Xxxxx xxxxxxxxx x xxxxxxx optometristů, optiků, xxxx x xxxxxxxxx x xxxxxxx institucí xxxxxxxxxxxxxxx vzdělání, xxxxx xxxxxxxxx léčivé xxxxxxxxx xxx xxxxx výzkumu x vzdělávání, xx xxxxxxx x poskytovatele xxxxxxxxxxx xxxxxx xxx xxxxxx x xxxxxxxxxxx xxxxxxxx a xxx x xxxxx oprávněné x výdeji léčivých xxxxxxxxx xxx zákona x xxxxxxxx, xxxxx xx xx xx xxxxxxxxxx xxxxxxxxx ověřovat xxxxxxxx xxxxx xxx xxxxxxxx x ochranných xxxxxxx. Jakákoli jiná xxxxxx úprava xxx xxxxx xxxxxxxx xxxxxxx x xxxxx článku xx znamenala xxxxxxx xxxxx x xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxx oprávněné x xxxxxx léčivých xxxxxxxxx. Xxxx xxxxx xx xx xxxxxx xxxxxxxx xxxxxxxx předpisů, xxxx xx dosti xxxxxxxx x xxxxx by xxx xxxxxxxxxxx xxxxx x xxxxxxx, xx xx xxxxxx x xxxxxx s právní xxxxxxx EU xxx xxxxxx xxxxxxxx přípravků.
V xxxxxxxx roku 2009 xxxxx x XX xx změně distribuce xxxxxxxxxxxxxx xxxxxxxxx (xx xxx xxxx xxxxxxx xxxxxxxxxx stanice, xxx xxxx xxxxxxxxxxx firmu), x to xx xxxxxxx xxxxxx xxxxxx č. 48/1997 Sb., x veřejném xxxxxxxxxx xxxxxxxxx x x xxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx, a x xxx xxxxxxxxxxx změny xxxxxx č. 258/2000 Sb., x xxxxxxx xxxxxxxxx xxxxxx x o změně xxxxxxxxx xxxxxxxxxxxxx xxxxxx. X rámci xxxxxxxxx xxxxxxxxxxx xxxxxx přímých xxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxx článku 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx, x to xxxxx xxx xxxxx xxxxxxxxx pravidelného, xxxxxxxxx xxxxxxxxxxx x zvláštního xxxxxxxx, očkování nepojištěných xxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx zdravotního pojištění. Xxxxx pro xxxxxxx xxxxxxxxxxx očkování xxxxxxxxx xxxxxxxxx xxxx xxxxx xxxxxx článku 23 xxxx. x) xxxxxxxx x xxxxxxxxxx xxxxxxx x x xxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxx. Xxxxxx xx x těchto xxxxxxxxx xxxxxxx imunologické xxxxxx xxxxxxxxx prostřednictvím xxxxxx xx xxxxxxx xx xxxxxxxxxxxxx lékárenské xxxx. V případě xxxxx xxxxxxxx možnost xxxxxxxxxx článkem 23 písm. x) xxxxxxxx x xxxxxxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxxxxx z xxxxxxxx x xxxxxxxxxx xxxxxxx, xx. xxxxxxxxx xxxxxxxxxx x xxxxx x vyřazování jedinečného xxxxxxxxxxxxxx u xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, musel xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx by xxxxxxxxxxxxx xxx xxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxx. Xxxxx xx xx xxxx xxxx xxxxxxxx xxxxxxxxxxxx léčivé xxxxxxxxx xx žádanky xxxxxxxxxxxxxxx xxxxxxx, xxx xx xxxxxxx ochranných xxxxx x vyřazení jedinečného xxxxxxxxxxxxxx provedl xxxxxxxxxxxx xxxxxxxxxx xxxx (lékárna) xxxx osoba xxxxxxxxx x xxxxxx léčivých xxxxxxxxx, xxxxxxx xxxx xx vedlo k xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxx a xxx xxxxxxxx xxxxxxx xxxxxxxxxxxx, mimořádného x xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxx xx xxxxxxxx doplnit xxxxx x léčivech x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx ve xxxxxxxx xxxxxxx porušujících povinnosti xxxxxxxxx nařízením x xxxxxxxxxx xxxxxxx. X xxxx Ústav xxxxxxxx xxxxxxxx 2001/83/ES, xx xxxxx xxxxxxxx 2011/62/EU, xxxxx ukládá členským xxxxxx xxxxxxxxx stanovit xxxxxx za xxxxxxxx xxxxxxxxxx x xxxx xxxxxx musí být xxxxxx, přiměřené a xxxxxxxxxx (čl. 118a xxxxxxxx 2001/83/XX). Sankce xxxx zohledňovat ohrožení xxxxxxxxx zdraví, xxxxx xxxxxxxxxxx padělání xxxxxxxx xxxxxxxxx. X xxxxxxx xx závažnost xxxxxxxx xxxxxxxxxxxxx xxxxxxx a x ohledem na xxxxxxxxx xxxx sankcí xxx x xxxxxx x xxxxxxxx stanovených x srovnatelných skutkových xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx, xxx xxxxxxxx xxxx xxxxxx xxxxxxxxxxx x xxxxx. Xxxxxx xxxxxxxxx či xxxxxxxxxx xxxxxxxxxxx xxxxxxx padělku xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx xxxxx xxx fatální. Xxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx, je xxxxxxxxx xxxxxx x xxxx xxxxxxxx xxxxxxxx xxx jiným xxxxxxx, xxx neúčinností, případně x návaznosti na xxxxxxx xx xxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxxxxx xxxxxxxxx, xxxxx neprocházejí standardní xxxxxxxxx xxxxxxx, účinnosti x bezpečnosti v xxxxx výroby xxxxx xxx x xxxxx xxxxxx x registraci xxxxxxxx xxxxxxxxx.
Xxxxxxxx x xxxx, že padělky xxxxxxxx přípravků xxxxxxxxxxx xxxxxxxxxxx xxxxxxx, na xxxxxx mezinárodního práva xxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx k xxxxxxxxx xxxxxx jevu. Xxx 28. xxxxxxxx 2010 xxxxxxxx Xxxxx xxxxxxxx xxxxxxxx Xxxx Xxxxxx Úmluvu x xxxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx xxxxxx, xxxxx ohrožují veřejné xxxxxx (MEDICRIME). X xxxxxxx xxxx xxxxxxxx 28. xxxxx 2011, xxxxxxx Česká republika xxxxxx dosud xxxxxxxxxxx x neratifikovala. Ratifikace Xxxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx. Xxxx xx xxxx xxx stanoveny xxxxxxxx xxxxxxxx trestných xxxx xxxxxxxxxxx nakládání s xxxxxx a xxxxxxxxxxxxxx xxxxxxxxxx. Xxxx Úmluvě xxxxx xxxxxx přísněji x xxxxxxxxx, než xxxxx xxxxxxxxxxx xxxx xxxxxxxxxxx x paděláním xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx zdraví a xxxxxx xxxxxxxx.
Xxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxx zavádí xxxxxx sankce xx xxxxxxxx xxxxxxxx povinností xx úrovni správního xxxxxxxx. Xxxx sankcí xxxx zvoleny xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx. Zároveň xxxxxxxxxxxx xxxxxxxx xxxxxxxx maximální xxxx pokut xx xxxxxx, xxxxx vzhledem xx xxx výši x xxxxx odrazující. Xxxxxxxxxxx xx zaručena xxxxxxxxxx xxxxxx xxxxxxxxxxxx x možnosti správního xxxxxxx xxxxxxxxx xxxxxx xxx posuzování xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxx xxxx Xxxxxxx x xxxxx xxxxxxxxx řízení xxxxxxxxxx, jakož x xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx (xxxxx xxxxxxxxxxxx xxxxx).
3. Vyhodnocení xxxxxxx x přínosů
3. 1 Xxxxx xxxxxx xxxxxx xxx hospodářské x xxxxxxxx xxxxxx xx xxxxxx rozpočet x xxxxxx xxx xxxxx xxxxxx xx ostatní xxxxxxx xxxxxxxx.
3. 2 Xxxxxxx
Xxxxxxxxxx xxxxxx za xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxx xxxxxxx představovat xxxxxxxx xxxxx spočívající x navýšení nových xxxxxxxxxxxxxxx xxxx včetně xxxxxxxxxx na platy xxx stávající xxxxx xxxx systemizací xxxxxxxxxx x xxxxxxxxxx míst xx xxxxxxxxxx xxxxxxx xxxxxxxxxxx pod rozpočtovou xxxxxxxx Ministerstvo xxxxxxxxxxxxx, xxxxxxxxx na straně Xxxxxx.
Xxxxxx xx xxxxxxx xxxxxxx xxxxxxxx xx xxxxxxxxxxxxxxx.
Xxxxxx xx podnikatelské xxxxxxxxx České xxxxxxxxx xx xxxx x xxx ustanovením xxxxxx x xxxxxxxx, která xx xxxx byla xxxxxxx xxxx xxxxxxx, xx. zákonem č. 70/2013 Sb., x xxxx xxxxxxxxx xxxxxxxx, xxxxxxxx xx xxxx xxxxx x xxxxxxxx x ochranných xxxxxxx. Tyto dopady xxx xxxx posouzeny xxx xxxxxxxxxxxx těchto xxxxxxxx xxxxxxxx. X xxxxx xxxxx xx xxxxx xxxxxxx xx xxxxxxxxx zprávu, xxxxxx xxxxxx x hodnocení xxxxxx xxxxxxxx (XXX) x xxxxxx č. 70/2013 Sb. x xxxx na xxxxxxxxx xxxxxx RIA x xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx „Xxxxxx Xxxxxxxxxx“. V xxxx podrobné xxxxxx xx xxxxx, xx x souladu x čl. 4 xxxxxxxx 2011/62/XX x čl. 54x xxxx. 2 x 3 xxxxxxxx 2001/83/XX Xxxxxx xxxxxxxxx xxxxxxx, xxxxxxx x xxxxxxxxxx xxxxxxxxxx různých xxxxxxxx xxx xxxxxxxxxxxxxxx a xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx a způsoby xxxxxxx ochranných xxxxx x xxxxxxxx a xxxxxx xxxxxxx úložišť. Xxxxxxxx, které xxxx xxxxxxxxxxx jako xxxxxxxxx xxxxxxxxxxxxxxx, xxxxxxxxxxx xxxxxxxx xxxxx nařízení x xxxxxxxxxx xxxxxxx.
Xxxxxx xxxxxxxxx xxxxxxxxxxxx nařízení o xxxxxxxxxx xxxxxxx xx xxxxxxx všech xxxx xxxxxxxxxxxxx x xxxxxxxx xxxxxxxxx, počínaje xxxxxxx, xxxxx xxxx zajistit xxxxxxxx x ověření xxxxxxxxxxx xxxxxxxxxxxxxx a xxxxxxxxxx x ověření xxxxxxxxxx s xxxxxx x xxxxxxxx x xxxxxx xxxxx xxxxxxxxxxx xxxx na xx xxxxxxxxxx. Xxxxx xxxx, xx xxx vstupem xxxxxxxx x xxxxxxxxxx xxxxxxx v platnost (xxxx 2015) xxxxxxx xxxxxxxxx dotčených xxxxxxxx xxxxxxxxx xx xx xxxxx tohoto xxxxxxxx x účinnost dnem 9.2.2019. Xxxx xx xxxxxx distributorů, držitelů xxxxxxxxxx x xxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx a xxxxxxxxxxxxx xxxxxxxxxxx služeb xxxxxxxxx x xxxxxx léčivých xxxxxxxxx, xxxxx xxxxx xxxxx upravit xxxxx xxxxxxxx věcné, technické xx v oblasti XX tak, aby xxxx schopni plnit xxxxxxxxxx jim xxxxxxxxx x xxxxxxxx o xxxxxxxxxx xxxxxxx a xxxxxxxxxxx se xxxxxxxx xxxxxxx.
Xxxxxxx ověřování xxxxxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx přinese xxxx náklady xx xxxxxx provozovatelů xxxxxxx, xxxxx x xxxxxx xxxxxxx, xxxxxx tak xxxx dopady této xxxxxxxxxx do xxxxxxxx xxxxxxxxxxxx provozovatelů xxxxxxx. X xxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx budou muset xxxxxxxxxxxxx lékáren xxxxxxx xxxxxxx (xxxxxxxx xxxxxxxx xxxxxx xxxxxxx), které xxxxx snímání xxxxxxxxxx xxxxxxxx xxxx xxxxx xxxxxxx xxxxxx i xxxxxxxx 2D kódy, xxx představuje xxxxxxxxxxxx xxxxxxxxx xxx 5.000 - 7.500,- Xx xx xxxxx xxxxxx (xxxxxxxx). Xxxxx xxxxxxxx, xxxxxx xx xxxxxxxxx x xxxxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxxxx, xxxxx xxx xxxxxxx xxxxxxx xxxxxxxxx (x xxxxxxx, xx xx xxxxxxxxxxxxx, nemohly xx xxxxxxx xxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxxxx xx xxxx xxx většina). Xxxxx je xxxxxx xxxxxx xxxxxxxx, xx. xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxx xxxxxxx má xxxxxxxxxxx lékárenského xxxxxxx xxxxxxxxx xx paušálních xxxxxx, nejedná xx x xxxxxxx xx xxxxxxx, xxx xxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx (xxxxxxxxxx SW jsou xxxxxxxx produkty xxxxxxxxx xxxxxxxx desítkami až xxxxxxxx xxxxxxx). Xxxxxxxxxx xxxxxxxx HW xxxxxxxx xxxxxxx a sítí x xxxxxxxxxxx s xxxxxxxxxx xxxxx xx xxxx týkat xxxxxxx xxxxxxx xxxxxxxxxxxx lékáren (xxxxx xxxxx léčivých xxxxxxxxx, xxxx xxxxxxxxx xxxxxx, výdeje xx xxxxxxx x xx xxxxxxx xx xxxxxxxx), xxxxx xxxxx o xxxxxxxxx xxxxxxxxxxx xxxxxxxx x důvodu xxxxxxx xxxxxxxx (xxxxx xxxxxxx xxxxx, xxxxxxxxx každého xxxxxxxxxxxx xxxxxx xxx xxxxxx, komunikace x xxxxxxxxxx x Xxxxxxx x xxxxxxx nemožnosti xxxxxx xxxxxxxxx xxxxxxxxxxxxx).
Xxxxxxxx x xxxx chvíli xxxxx přesně odhadnout xxxxxxxx náklady provozovatelů xxxxxxx, Xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxx x souvislosti x xxxxxxxxxx ochranných xxxxx xx obalech léčivých xxxxxxxxx xx částku 500 xxx. Xx. X této částce xxxx však xxxxxxxx xxxxx xxxx xxxxxxxxx x další xxxxxxx, xxxxx xxxxxxxxxxxx považuje xx diskutabilní či xxxxxxxxxxxx (xxxxxxx xx xxxxxxx xxxxxxxxxxx, xxxxx xxxxxx náročnost výdeje - xxxxx xxxxx xxxxxxxxxxxx xxxxxxxx), xxxxxxxxx xxxxxxx xxxxx x xxxxxx mírou xxxxxxxxxxxxxxxx xxxxx.
Xxxxxxxx xx xxxxxxxxxxx, xx xx 9.2.2019 xxxxx xx xxxx xxxxxxxx xxxxxx přípravky, xxxxx xxxxxxx opatřeny xxxxxxxxxx prvky a xxxxx byly propuštěny x prodeji nebo xxxxxxxxxx xxxx nabytím xxxxxxxxx tohoto zákona, xxxxxxxx předkladatel x xxxxxx xxxxxx xxxxxxx xxxxxxxx právní normy xx xxxxxxxx x xxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxxxx do xxxxxx xxxxxxxxx xxxxxxxxxx, xxxxx xxxxxxx xx xxxxx, xx tyto xxxxx xxx uváděny, xxxxxxxxxxxxx x xxxxxxxx xx xx xxxxxxxx xxxx xxxxxx xxxxxxxxxxxxx.
Xxxxx současné xxxxxx úpravy xxxxx x xxxxxxxxx xxxxxxxxx xxxxxx (popř. xxxx xxxxxxxxxxxx pracovníci) xxxxxxxxxxxxx xxxxxxxxxxxxxx zařízení vydávat xxxxxx přípravky (v xxxxxxx x ustanovením §82 xxxx. 2 xxxxxx o xxxxxxxx). Xxxxxxxx k xxxx, xx xxxxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxx, xxxxx budou muset xxx xxxxxxxx ochrannými xxxxx, xxxx xx xxxx xx ně xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxx a xxxxxxx xxxxxxxxx identifikátor xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxx. Xxx xxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxx dodávek imunologických xxxxxxxxx, x to xxxxx do xxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx, x nebylo ohroženo xxxxxxxx dětí x xxxxxxxxx, xx xxxxxxx, xxxxxxx xxxxxxxxxx vyplývající x xxxxxxxx o xxxxxxxxxx xxxxxxx xx xxxxxxxxxxxx imunologických přípravků x xxxxxxxx xxxxxx 23 písm. x) xxxxxxxx x ochranných xxxxxxx.
Xxxxxxxxx dopadu směrnice 2011/62/EU a nařízení x xxxxxxxxxx xxxxxxx xxxx provedeno Xxxxxxxxx xxxxxx (EK) x xxxxxxx x požadavkem xxxxxxxx 2011/62/EU, která xxxxxxxxxx xxx neukládá XX xxxxxxxxxxxx xx xxxxxxxxxxx xxxxxx regulace XX xxx oblast xxxxxxxxxx xxxxx x xxxxxxxx přípravků. Pokud xxx x výrobce x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, půjde x další dopady xxxxxxx se xxxxxxxx x xxxxxxx systému xxxxxxx. Xxxx subjekty xxxx podle xxxxxx 54x xxxx. 2 xxxx. x) xxxxxxxx 2011/62/XX povinny xxxx xxxx xxxxxxx náklady xx systém xxxxxxx. Xxxx dopady xx xxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx, xxxxx xxxx xxxxxxx zejména xx xxxxx, způsobech x xxxxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx. Xxxxxxx xxxxx, xxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx, xxxxxx stanoveny xxxxxxxx 2011/62/EU x xxx xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx, kterými xx xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx x systému xxxxxxx x tím xxxxx xxxxxxxx xxxx x xxxxxx xxxxxx na xxxx subjekty. Xxxxxxxxx xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx xxxx x x xxxxx případě xxxxxxxxx EK x xxxxxxxxxx na směrnici 2011/62/EU. Xxxx xxxxxx xxx byly xxxxxxxxx xxx projednávání xxxxxx xxxxxxxx xxxxxxxx, tj. xxxxxxxx 2011/62/EU x xxxxxxxx o xxxxxxxxxx xxxxxxx, xxxxx xxx x xxxxxx xxxxxxxx, x xxxxxx č. 70/2013 Sb., xxxxx jde x xxxxxx xxxxxxxx Xxxxx xxxxxxxxx. V tomto xxxxx xx třeba xxxxxxx xx xxxxxxxxx xxxxxx, včetně zprávy x hodnocení xxxxxx xxxxxxxx (XXX) x xxxxxx č. 70/2013 Sb., x xxxx xx xxxxxxxxx xxxxxx XXX x xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxx „Xxxxxx Xxxxxxxxxx“. Od xxxxxxxxx xxxxxx xxxxxxxxx nebyla xxxxxxxx změna x xxxx xxxxxx x xxxxxxx.
Xxxxxxxx dopad navrhované xxxxxx xx xxxxxxxxxxxxx xxxxxxxx z xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxxxxxxx xx x xxxxxxxxxxx xxxxxxxxxxxxxx lze xxxxxx xx xxxxx obalu x rámci jakéhokoli xxxxxx x xxxxxxx xx xxxxxxxxx x xxxxxxxxx - xxxx. xxxxxx x xxxxxxxxxxx xxxxxxxxx registrace, xxxxxx x xxxxx xxxxxxxxxx xxxx II, xxxx XX xxxx xxxx XX. Předložení xxxxxxxx xxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxx x xxxxxxx, xxxxx x přechodném období xxxxxx předložena xxxxx xxxxx xxxxxxxxxx, která xxxxxxx informace x xxxxxxxxx. Xxxxxxxxxx xxxxxxx x změnu xxxxxxxxxx xxx xxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxx je xxx xxxxxxxx xxxxx x xxxxxxx, xxx xxxxxxxxxx x ověření xxxxxxxxxx s xxxxxx xxxx mít vliv xx čitelnost xxxxx, xxxx ovlivní xxxxxx xxxxxxxx xxxxx. Xxxx xxxx xxxxxxxxx, xx xxxxxxxxx xxxxxxxxxxxxx i xxxxxxxxxx x xxxxxxx xxxxxxxxxx s xxxxxx xx xxxxx implementovat xxxx předložením xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxx registrace, xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxx xxxx xxxx na xxxxxxxxx obalu.
Dle xxxxx x xxxxxxxx 2018 xxxx vyřízeny xxx 2/3 žádostí x xxxxx xxxxxxxxxx, které xxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxx xx xxxxxxxx 2011/62/EU. Xxxxx na xxxxxxxxxxxxx subjekty v xxxxxxx xxxxxxxx a x oblasti xxxxxxxxxxxx xxxx na vyřízení xxxxxxxxxxxx xxxxxxx bude xxxxxxxxx, xxxxxxxx x xxxx uvedené skutečnosti, xxx xxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxx po xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxx x xxxxx registrace x xxxxxxxx xxxxx xx xxxxx xxxxxxxxxxxxx xxx xxxx xxxxxxxxxxx nebo xxxxxxxxxx příslušné žádosti x změnu xxxxxxxxxx. Xxxxxx xxxxxxxxxxxx xxxxx xxxxx pro xxxxxx xxxxxxxxx, xxxxx musí xxx xxxxxxxx ochrannými xxxxx, u xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxxx xxxxx opatřeny xxx xxxxxx (např. xxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxx xxxxx xx xxxxxxxx předpis) xxxxx xxxxxxxxx xxxxxxxxxxxx xx xxxxxx xxxxx „xxxxxxxxx xx“ při xxxxxxxxx xxxxxx xxxxx xxxxxxxx xx xxxxxxxxx x xxxxxxxxx.
3. 3 Xxxxxxx
Xxxxxxxx xxxxxxxxxx právní xxxxxx xxxx dotvoření xxxxxxxxx x ochranných prvcích xxxxxxxxxx předpokladů pro xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx přípravků do xxxxxxxxx xxxxxxxxxxxxxx řetězce x xxxxxxx xxxxxxx xxxxxxxx a xxxx xxxxxxxxxx v xxxxxxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxx, které pocházejí x xxxxxxxxxxx xxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxx xxx na xxxxxxxxxxxxx xxxxxxxxx pozitivní xxxx a lze xxxxxxxx, xx přispěje xx zvýšení odpovědnosti xxxxxxxxxxxxxxx subjektů x xx xxxxx xxxxxxxxxx x x xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxx přípravků. Xxxx xx také dojít xx zvýšení xxxxxx xxxxxxx, xxxxxxxxxxxx a xxxxxxx, xxxxx padělané xxxxxx svou xxxxxxxxxxx xx xxxx xxxx x prodeje xxxxxxxxx xxxxx xxxxxxx.
Xxx xx xxxxxxxxxxxxxx riziko, xx xx xxxxxxxx xxxxxx xxxxxxxxx vstoupily xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxx kolovaly xx celém xxxxx Xxxx, dokud by xxxxxx xxxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxx distributoři provádět xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx v případech xxxxxxxx xxxxxxxxx, u xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxx (tj. x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxx distributorem).
Datové xxxxx obsažené v xxxxxxxxxx xxxxxxxxxxxxxx (xxxxxxx xxx xxxxxxxxx, xxxxx xxxxx x xxxxx xxxxxxxxxxxxx) xxxxxxxx k xxxxxxxxxxx xxxxxxxx xxx, xx xxxxxxx xxxxxxx xxx xxxxxxx a xxxxxxx x xxxxxxxxxxxxxxxx.
Xxxxxxxxx xxxxxxxx léčivých přípravků x ČR na xxxxxx xxxxxxx, xxxxxxxxxxxx x xxxx xxxxxxxxxxx x výdeji (xxxxxxx) xx xxxx xxxxx xxxxxxxx xxxxxx padělaných xxxxxxxx přípravků xx xxxxxxxxx distribučního xxxxxxx x xxxxxxxx eliminovat xxxxxx xxxxxxxxxxxxx výdeje xxxxxxxxxx léčivých přípravků xxxxxxxxx x xxxxxxxxx x xxx xxxxxx xxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx xxxxxxx novely zákona xx xxxxxxxx xxxxxxx xxxxxxxxxxxx řetězec léčivých xxxxxxxxx x XX.
4. Xxxxxxxxx xxxxxx xxxxxxx x xxxxx nejvhodnějšího xxxxxx
Xxxxxxxxx xxxxxxxxxxx x xxxxxxx xxxxxx je xxxxxxxx 2, xxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx, xxxxxxx xxxxxxxx xxxxxx xxxx x xxxxxxx xxxxxxxx xxxxxxxxx nařízením x xxxxxxxxxx xxxxxxx x tomu, xxx x xxxx Xxxxxxxx xxxx mohl xxxxxxxx xxxxxxxx systém xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xx jejich xxxxx, xxxxx xx měl xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx dodavatelského xxxxxxx x xxxxxxx xxx x vyšší xxxx xxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx 1 (xxxxxx) je x důvodů xxxxxxxxx xxxx xxxxxxxxxxxx x xxxxx další varianta xxx x povahy xxxx xxxxxxxxx do xxxxx, xxxxxxx xxx x xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxx a xxxxxxxx xxxxxxxxx xxxxx x xxxx uvážení, x xxx x jak xxxxxxx xxxxxxxx provést, xxxx xxxxxxxx omezeny xxx xx xx xxxxxxx, ve xxxxxxx xx xx xxxxx xxxxx xxxxxxxxxx xxxxxxx Xxxxxxxx xxxx provést xxxxxxxxx xxxx xxxxxxxx.
5. Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxxx
Xxxxxxx xxxxxxxxxx za implementaci xxxxxxxxxx varianty xxxxxx xxxx především Xxxxx, xxxxx xx xxx xxxxx stávajícího xxxxx xxxxxx o xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx xxxxx. Xxxxx xx zákonem xxxx jiné uloženy xxxxxxxxxx v oblasti xxxxxxx, účinnosti a xxxxxxxxxxx xxxxxxxxx xxxxx, x xx x xx xxxxxx k xxxxxxxxxx orgánům členských xxxxx x Xxxxxxxx xxxx.
Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx x vynucování xxxxxxxxxx xxxxxxxx bude xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxx v rámci xxxxxxxxx xxxxxxxx x xxxxxxx x xxxxxxx xxxxxx xxxxxxx xxxxxxxxx, x to xxxxxxxxx xxxxx x dalších xxxxx trestů.
6. Xxxxxxx xxxxxxxxx xxxxxxxx
Xxxxxxxx xxxx xxxxxx xxxxxx bude xxxxxxxx po xxxxxxxx xxxxxxx 2 xxx xxx dne xxxxxx xxxx xxxxxxxxx, xxx xxxx xxxxx získat xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxx xx xxxxxx úprava xxxxxxxxx xxxxxx, tj. xxx xxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx přípravků x xxxxxxxx xxxxxxxxxxxxx xxxxxxx x XX x x xxxxxxxx. Xxxxxxx xxxxxxxxx xxxxx provádět Xxxxxxxxxxxx xxxxxxxxxxxxx x Xxxxxx xxxxx xxx xxxxxxxx léčiv ve xxxxxxxxxx x dotčenými xxxxxxxx, a xx x hlediska xxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx x xxxxxxx x hlediska xxxxxxxxxx xxxx sledovaných touto xxxxxx xxxxxxx.
7. Konzultace x xxxxxx xxx
Xxxxx xxxxxx xxx v xxxxxxx přípravy xxxxxxxxxxx xx zástupci výrobců xxxxxxxxx léčivých přípravků, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxx zdravotních xxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx. Xxxxx zástupcům xxx x xxxxxxxxx 2016 xxxxxx prvotní xxxxxxxx xxxxx xxxxxx zákona x tím, xx x němu xxxxx xxxxxxxx připomínky. X xxxxxxxxxx x vypořádání xxxx uplatněných připomínek xx xxx v xxxxxxxx 2016 uskutečnilo xxxxxx xxxxxxx x xxxxxx Xxxxxx. Xxxx xxxx uplatněných připomínek xxxx x xxxxxxxxx xxxxxx zohledněna x xxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxxxx výsledného xxxxxxxxx a x xxxx přiblížení k xxxxxxxxx potřebám současné xxxxx. Xxxx ilustrativní xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx připomínek xxxx xxxxxxx xxxxxxxxxx, aby xxx xxxxxxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx xxxxx §32 xxxx. 5 xxxxxx x xxxxxxxx („xxx XXXX“) xxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx. Xxxx xxxxxxxxx jednání x xxxxxx xxxxxxxxxx materiálů xx xxxxxxxx Xxxxxx Xxxxx republiky x Xxxxxx pro xxxxxx xxxxxxxx xxxxxxxxxxxxx biopreparátů x xxxxx, x xx xxxxxxx za xxxxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx 23 xxxxxxxx x xxxxxxxxxx xxxxxxx.
8. Xxxxxxxx xx zpracovatele XXX
Xxxxx: Xxxxxxxxxxxx xxxxxxxxxxxxx, Odbor xxxxxxxx, xxxxxxxx farmacie, xxxxxxxxxxxx: PharmDr. Xxxxx Xxxxxxxxx, xxxxxxxxx odboru xxxxxxxx, xxxxxxxxxxxx: XxxxxXx. Xxxxx Xxxxxxxxx, xxxxxxx xxxxxxxx farmacie, Xxx. Xxxxxxxxx Xxxxxxxxxx, xxxxxxxx, Xxx. Daniel Xüxxxx, xxxxxxxx.
X-xxxx: xxxxx.xxxxxxxxx@xxxx.xx
Xxxxxx xxxxx xxx kontrolu xxxxx, xxxxx xxxxxx, Mgr. Xxxxxxx Xxxxxxxx, ředitelka Xxxxx xxxxxx
Xxxxxxx: 272 182 265
XXXXXXXXX XXXXXXX NÁVRHU XXXXXXXX PŘEDPISU XX X PŘEDPISY XX
Xxxxxxxxx xxxxxxx x návrhu xxxxxx xxxxxx, xxxxxx xx xxxx xxxxx x. 378/2007 Xx., x xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x léčivech), ve xxxxx xxxxxxxxxx předpisů, x xxxxx č. 372/2011 Xx., o xxxxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx poskytování (xxxxx o xxxxxxxxxxx xxxxxxxx), xx xxxxx xxxxxxxxxx xxxxxxxx
|
Xxxxxxxxxx xxxxxx xxxxxxx (xxxx. jiný xxxxxx předpis) |
Odpovídající předpis XX |
|
|
Xxxxxxxxxx (xxxx, §, xxxx., písm., apod.) |
Celex x. |
Xxxxxxxxxx |
|
Xx. 2 |
||
|
Xx. 43, 44, Xx. 46 |
||
|
§13 odst. 2 písm. p) a q) (včetně poznámky pod čarou č. 107 a 108) |
Xx. 25, Xx. 7 xxxx. 1 x 2, Čl. 10 xxxx. 1 věta xxxxx, Xx. 94 xxxx. 1 |
|
|
32017L1572, 32017L1572, 32017R1569, 32017R1569, 32017R0556, 32017R0556 |
Xx. 3 xxxx. 1, Xx. 3 xxxx. 3, Čl. 21 xxxx. 4, Xx. 22, Čl. 3 xxxx. 1, Xx. 4 xxxx. 8 |
|
|
Xx. 4 |
||
|
Čl. 1 xxxx. d) x x), Xx. X xxx 12 |
||
|
Xx. 45 |
||
|
Xx. 42 |
||
|
Xx. 11 xxxx. 1 |
||
|
Čl. 13 xxxx. 1 x 2 |
||
|
Xx. 4 xxxx. 1 |
||
|
Xx. 23 |
||
|
Xx. 25 xxxx. 1 |
||
|
Xx. 39 |
||
|
Čl. 10 a 11 |
||
|
Xx. 12 |
||
|
Xx. 13 |
||
|
Xx. 4 |
||
|
Xx. 5 xxxx. 1 |
||
|
Čl. 6 |
||
|
Xx. 7 |
||
|
Čl. 14 |
||
|
Xx. 15 |
||
|
Xx. 16 |
||
|
Xx. 18 |
||
|
Čl. 9 |
||
|
Xx. 20 |
||
|
Xx. 22 |
||
|
Xx. 24 |
||
|
Xx. 23 |
||
|
Xx. 23 |
||
|
Xx. 25 xxxx. 1 x 2 |
||
|
Čl. 28 |
||
|
Čl. 29 |
||
|
Xx. 25 xxxx. 4 |
||
|
Xx. 30 |
||
|
Xx. 25 xxxx. 1 |
||
|
Čl. 33 xxxx. 1 |
||
|
Xx. 40 |
||
|
Čl. 42 |
||
|
Xx. 33 xxxx. 4 |
||
|
Xx. 37 |
||
|
Čl. 39 |
||
|
Xx. 35 xxxx. 1 x 2 |
||
|
Čl. 32 xxxx. 3 a 4 |
||
|
Xx. 32 odst. 1 |
||
|
Xx. 35 xxxx. 3 |
||
|
Xx. 35 xxxx. 4 |
||
|
Xx. 41 |
||
|
Xx. 63 xxxx. 1, Xx. 94 xxxx. 1, Xx. 20 xxx 2 |
||
|
Čl. 10 xxx 2 xx 5 |
||
|
Čl. 4, Čl. 45, Xx. X xxx 12, Xx. I xxx 25 |
||
|
Čl. 94 xxxx. 1, Xx. 62 xxx 1 |
||
|
Xx. 4, Xx. 45, Xx. X bod 12, Xx. X xxx 25 |
||
|
Xx. 10 xxxx. 8 |
||
|
Xxxxx předpisu EU (xxx xxxxx) |
Xxxxx xxxxxxxx XX |
|
XXXXXXXX XXXXXX X XXXXXXXXX XXXXXXXXX (XX) 2016/161 xx dne 2. října 2015, xxxxxx se doplňuje xxxxxxxx Xxxxxxxxxx parlamentu x Rady 2001/83/XX xxxxxxxxxx xxxxxxxxxx pravidel xxx ochranné xxxxx xxxxxxx na obalu xxxxxxxxx léčivých xxxxxxxxx |
|
|
Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2011/62/XX xx xxx 8. xxxxxx 2011, kterou xx xxxx xxxxxxxx 2001/83/ES x xxxxxx Xxxxxxxxxxxx xxxxxxxxx se humánních xxxxxxxx xxxxxxxxx, xxxxx xxx o xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx legálního xxxxxxxxxxxxxx xxxxxxx |
|
|
Xxxxxxxx Xxxxxx (XX) 2017/1572 xx xxx 15. xxxx 2017, xxxxxx xx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2001/83/XX, pokud jde x zásady x xxxxxx xxx správnou xxxxxxx xxxxx xxx xxxxxxx xxxxxx přípravky |
|
|
Prováděcí xxxxxxxx Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) x. 2017/556 ze xxx 24 xxxxxx 2017&xxxx; o xxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx postupů xxxxxxx xxxxxxxx xxxxx&xxxx; xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (EU) x. 536/2014 |
|
|
Nařízení Xxxxxx x přenesené pravomoci (XX) č. 2017/1569 xx xxx 23. xxxxxx 2017, kterým xx xxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) x.536/2014 xxxxxxxxxx zásad x xxxxxx xxx správnou xxxxxxx xxxxx xxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx inspekcí |
|
|
Nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx XX č. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx směrnice 2001/20/ES |
Xxxxx textu www.psp.cz


