Vládní návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů, a zákon č. 234/2014 Sb., o státní službě, ve znění pozdějších předpisů
706/0
Vládní návrh
ZÁKON
ze xxx … 2016,
xxxxxx xx xxxx xxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), xx xxxxx pozdějších xxxxxxxx, x xxxxx č. 234/2014 Sb., x xxxxxx službě, xx znění xxxxxxxxxx xxxxxxxx
Xxxxxxxxx xx usnesl xx tomto zákoně Xxxxx xxxxxxxxx:
XXXX PRVNÍ
Změna xxxxxx x xxxxxxxx
Xx. X
Xxxxx č. 378/2007 Sb., x xxxxxxxx x x xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx), xx xxxxx xxxxxx č. 124/2008 Xx., xxxxxx x. 296/2008 Xx., xxxxxx č. 141/2009 Xx., xxxxxx č. 281/2009 Xx., zákona x. 291/2009 Xx., xxxxxx x. 75/2011 Xx., xxxxxx x. 375/2011 Sb., zákona x. 50/2013 Sb., xxxxxx x. 70/2013 Xx., xxxxxx x. 250/2014 Sb. x xxxxxx x. 80/2015 Xx., se xxxx xxxxx:
1. Xx xxxxx xxxxxxxx xxx xxxxx x. 2 se xxxxxxxx xxxx:
„Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 ze xxx 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx humánních léčivých xxxxxxxxx a x xxxxxxx směrnice 2001/20/XX.
Xxxxxxxx Xxxxxx x přenesené xxxxxxxxx (XX) č. 1252/2014 xx dne 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx xxx x xxxxxx a xxxxxx xxxxxxx výrobní praxe xxx xxxxxx látky xxx humánní léčivé xxxxxxxxx.“.
2. X §5 xx xxxxxxxx odstavec 16, xxxxx xxxxxx xxxxxxxx xxx xxxxx x. 101 zní:
„(16) Xxxxxxx xxxxxx xxxxx xx xxx xxxxx xxxxxx xxxxxx, xxx-xx x xxxx xxxxxxx x xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxxxx xxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx, rozumí xxxxxxxx xxxxx xxxx xxxxxxxx xxxx xxxxxxxx materiálu, xxxxxx, balení, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxxx, kontroly xxxxxxx xxxx propouštění xxxxxx xxxxx, xxxxx x xxxxxxxxxxx kontrola. Xxxxxxxx toho, xx xx xxxxxx xxxxxxx xxxxxx xxxxx, xxx-xx x xxxx xxxxxxx x humánních léčivých xxxxxxxxxxx, stanoví xxxxx xxxxxxxxxx xxxxxxx Xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx101).
XXXXX: 32014R1252
3. X §11 xxxxxxx x) xxx:
„x) xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx §77x, xxxxxx xxxxxxx xxxx xxxxxxxx distribuci xxxxxxxx xxxxxxxxx xx xxxxxxxxx,“.
4. X §11 xxxxxxx x) xxx:
„x) xxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx služeb, xxxxxxx vyžaduje-li xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx x xxxx-xx xxxxxxx xxxxxxxx xxx jeho xxxxxx, xxxxxxxxx podle xxxxxxx g) xxxx x), x xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx, xxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx xxxxxxxxxx x léčivých přípravků, xxxxx xxxxx xxx xxxx takové xxxxxxxxx, xxxxx x léčivých xxxxxxxxx pro použití x xxxxxxx lékařství,“.
5. X §11 xx xx xxxxx xxxxxxx p) xxxxx xxxxxxxxx xxxxxx x xxxxxxxx se xxxxxxx x), které xxx:
„x) xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx §77x, xxxxxx se xxxxxxx xxxxxx přípravek, při xxxxx xxxxxxxxxx bude xxxxxxxx xxxxxxxxxx a xxxxxxxx xxxxx pacientů x Xxxxx xxxxxxxxx x xxxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx a x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, x xxxx seznam takových xxxxxxxx xxxxxxxxx.“.
6. V §13 xxxx. 2 xxxx. x) xxxx 1 xx xx slova „xxxxxxxxxx o xxxxxxxx xxxxxxxxxx dovozu,“ vkládají xxxxx „rozhodnutí x xxxxxxxxxx xxxxxxxx xxxxxxxxx,“.
7. X §13 xxxx. 2 xxxx. x) bodu 3 xx xxxxx „xxxxxxxxxxxxxx“ xxxxxxx.
8. X §13 xxxx. 2 xxxxxxx x) xxxxxx xxxxxxxx xxx xxxxx č. 104 xxx:
&xxxx;„x) xxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx podle §51 x ukládá xxxxxxxx xxxxxxxx ve xxxxxx xx. 77 xxxxx použitelného xxxxxxxx Xxxxxxxx unie xxxxxxxxxxxx xxxxxxxx xxxxxxxxx humánních xxxxxxxx přípravků104) (xxxx xxx „nařízení x xxxxxxxxx hodnocení“)“.
CELEX: 32014R0536
9. V §13 xxxx. 2 se xx xxxxx písmene x) xxxxx nahrazuje xxxxxx x doplňuje xx xxxxxxx x), xxxxx xxx:
„x) v xxxxxxx xxxxxxxx xxxxxx x jakosti xxxxxx, xxxxx nepředstavuje xxxxxxxx xxxxxx xxxx xxxxxx xxxx, xxxxxxxxx x xxx, xxx se xxxxxx xxxxxx xxxx xxxx xxxxxxxxxx xxxxx xxxx xxxxxxxxxxxx, vydávat, xxxxxx xx xxxxx xxxx xxxxxxxx xxx xxxxxxxxxxx zdravotních xxxxxx.“.
10. X §13 xxxx. 3 se xx xxxxx xxxxxxx x) xxxxx xxxxxxxxx xxxxxx x xxxxxxxx xx písmena x) x x), xxxxx xxxxx:
„x) předává Ministerstvu xxxxxxxxxxxxx veškeré xxxxx xxxxx xxx xxxxxx xxxxxxxx obecné xxxxxx xxxxx §77x,
x) na xxxxxxx vyhodnocení xxxxxxx xx xxxx x xxxxxxxx xxxxxxxxx xxxxxxx Xxxxxxxxxxxx zdravotnictví informaci xxxxx §77x x xxxxxxx xx xxxxxx x vydání xxxxxxxx xxxxxx povahy podle §77x.“.
11. X §16 xxxx. 2 xxxx. x) xxxx 1 xx za xxxxx „xxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxx,“ xxxxxxxx xxxxx „rozhodnutí x xxxxxxxxxx xxxxxxxx přípravku,“.
12. Xx §19 xx xxxxxx xxxx §19x, který xxxxxx xxxxxxx xxx:
„§19x
Xxxxxxxxx ředitelství xxx
(1) Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xx xxxxxxxx Ústavu o xxxxxxxxxxxx xxxxx, xxxxx xxxxx xx trh xxxx vyváží xxxxxx, xxxx xxxxxxxxx:
x) xxxxxxxxxxxxx xxxxx xxxxxx xxxxx, x xx zejména xxxxx xxxx xxxxx x xxxxx,
x) popis xxxxxx, xxxxxx xxxxxxxxxx xxxxx,
x) x případě xxxxxxx informace x xxxx xxxxxxxx x xxxx xxxxxx xxxxxx x
x) xxxxxxxx xxxxxx xxxxxxxxx x měrných xxxxxxxxxx.
(2) Xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx 1 xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx daňového xxxx.“.
13. X §21 xx odstavec 1 xxxxxxx.
Xxxxxxxxx odstavce 2 x 3 xx xxxxxxxx xxxx xxxxxxxx 1 x 2.
14. V §23 xxxx. 2 písm. x) xx xx xxxxx „xxxxxxx“ xxxxxxxx xxxxx „, xxxxx Xxxxx xxxxxxx xxxxxxxxxx xxxxx §13 xxxx. 2 xxxx. x)“.
15. X §33 xxxx. 2 xx xx xxxx xxxxx xx xxxxx „xxxx xxxxx“ vkládají slova „x xxxx xxxxxxxxxxx Xxxxxxx xxxx Xxxxxxxxxxxx xxxxxxx“.
16. X §33 xxxx. 2 xx xxxx xxxxxxxx nahrazuje xxxxxx „Držitel rozhodnutí x registraci xxxxxxxxx Xxxxxx úplné a xxxxxxx xxxxx x xxxxxx xxxxxxx léčivých xxxxxxxxx xxxxxxxxx xx xxx v Xxxxx xxxxxxxxx xxxxxxxxxxxx; xxxxxxxxxxx xxxxx obsahují xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxxxxxxxxx léčivého xxxxxxxxx a xxxxxxxxx x xxx, xxx xxx léčivý xxxxxxxxx xxxxx lékárně nebo xxxxxxxxxxxxxx; xxxxxxxxx, xxxxxx, xxxxx a časový xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx elektronického xxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx. Na xxxxx Xxxxxx xxxx Xxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxxx xxxx Xxxxxxxxxxxxx xxxxxx údaje týkající xx xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravku a xxxxx x xxxxxx xxxxxxx léčivých přípravků xxxxxxxxx xx trh x Xxxxx republice, xxxxx xx k xxxxxxxxx.“.
XXXXX: 32001L0083, 32004L0027
17. X §33 xxxx. 3 xxxx. x) xx slova „xx distribuce nebo xxxxxxx“ nahrazují xxxxx „xxxxxxxxx xx xxx x České xxxxxxxxx“.
18. X §34 xx xx konci xxxxxxxx 2 xxxxxxxx xxxx „Xxxxxx xxxxxxxxx xxxxxxxxxxxx údajům x xxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx xxx, xxxxx xxxxxx x xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx, nadále xxxxxx na xxx xxxxxxx xx xxxx 180 xxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxxxxx, xxxxxxx, x xxxxxxx vyhrazených léčivých xxxxxxxxx xxxxxxxx, x xxxxxxxx xxx poskytování xxxxxxxxxxx služeb xxxx xxxxxxxxxxx péče xx xxxxxx xxxxxx xxxxxxxxx xxxxx xxxx po xxxx jeho použitelnosti.“.
19. X xxxxxxx xxxxx XX xx xxxxx „XXXXXX“ xxxxxxxxx xxxxxx „VÝROBA“.
20. Xxxxxx xxxx 1 hlavy XX xxx: „Klinické studie“.
21. §51 xx 53 xxxxx:
„§51
Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
(1) Xxxxx xxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx x xx. 5, 13 x 14 nařízení x xxxxxxxxx hodnocení x žádosti o xxxxxxxx významné xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx x xx. 16 Nařízení XX x xxxxxxxxx xxxxxxxxx. Xxxxx dále provádí xxxxxx xxx průběhem xxxxxxxxxx hodnocení. Xxxxxxx xxxxx xxxxxxxxx x xxxxxxxxxxx x xxxxxxxxx xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx a xxxxxxx x xxxxxxxx xxxxxxxx změny xxxxxxxxxx xxxxxxxxx a xxxxxxxxxx xxxxxxx xx xxxxxxxx xx odborné xxxxx.
(2) Xxxxx xx x Xxxxx republice xxxxxxxx xxxxxxxxxx xxxxxx xxxxx xx. 83 nařízení x xxxxxxxxx hodnocení.
(3) Xxxxx v xxxxx xxxxxxxxxx žádosti x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx
x) v xxxxxxx, že je Xxxxx xxxxxxxxx ve xxxxxx k xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xx. 5 xxxx. 1 xxxx čl. 14 xxxx. 2 xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx státu zpravodaje xxxxxxxxx xxxxxxxxx o xxxxxxxxx hodnocení, xxxxxxxx xx xxxxxxx, na xxxxx xx xxxxxxxx xxxx X xxxxxxxxx xxxxxx,
x) v xxxxxxx, xx Xxxxx xxxxxxxxx xxxx xx vztahu x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx xx. 2 xxxx. 12 xxxx xx. 14 xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxx, xx které xx xxxxxxxx část X xxxxxxxxx zprávy, a
c) xxxxxxxxxxx část XX xxxxxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xx Xxxxx xxxxxxxxx x k žádosti x xxxxxxxx xxxxxxxx xxxxx týkající se Xxxxx xxxxxxxxx, jejíž xxxxxxxx xx stanovisko xxxxxxxxxxx xxxxxxx xxxxxx.
(4) Xxxxx xxxxxxxxx o xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení x x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx hodnocení xxxxx xxxxxxxx o klinickém xxxxxxxxx. Xxxx rozhodnutí xxxxx pro xxxxx Xxxxx xxxxxxxxx.“.
XXXXX: 32014R0536
§52
Ochrana xxxxxxxxx xxxxxx subjektů xxxxxxxxx
(1) Xxxxxxxx xxxxxxxxx xxx provádět x xxxxxxxxx xxxxx xx xxxxxxxxxxx, že xxxxx xxxxxxxxxxxxx souhlasu xxxx xxxxxxxxx xxxxxxxx xxxxxxx x xxxxxx x xxxxxxxxx hodnocení xxxxxxxx xxxxxxxxx souhlasu x xxxxxxx xxxxxxxxx osoba, xx-xx xx xxxxxxxxx xxxx xxxxxxxx x xxxxx vyspělosti.
(2) Xxxxxxxx xxxxxxxxx xxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxx xxxxxxx xxxx x xxxxxxxxxxxx skupin xxxxxxxx, do xxxxxxx xxxxxx xxxxx
x) xxxxxxxxxxx xx xx xxxxx, xxxxxxxxxxxxx detenci xxxx xx xxxxxx trestu xxxxxx svobody,
b) pobývající x zařízení xxxxxxx xxxx,
x) jejichž xxxxxxxxxxx xxxx omezena xxxxxx.
(3) Xxxxxxxx xxxxxxxxx xxx xxxxxxxx x xxxx xxxxxxxxx v xxxxxxxx 2 xxx tehdy, xxxxx k němu xxxx osoby přivolí xxxxxxxxx x informovaným xxxxxxxxx x pokud xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx opravňující x xxxxxxxxx, xx xxxxx x xxxxxxxxx xxxxxxxxx xxxx xxx xxx xxxx xxxxx xxxxx xxxxxxx nebo xxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxx xxx souvisejícími xxxxxx a zátěží, xxxx xxx xx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxx jedinou xxxxxxxx xxxxxxxxxxx, xxxxxxxxx xxxxxxxx, xxxxxxxxxxxx zdravotního xxxxx.
XXXXX: 32014R0536
§53
Xxxxxx xxxxxx
(1) Xxxxxx xxxxxx xx xxxxxxx Xxxxxx.
(2) Etická xxxxxx vykonává xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxxx x provádí xxxxxx xxxxxxx, xxxxxxxxxx xxxxxx, xxxxxxxx x xxxxxxx aspekty, žádostí x povolení klinického xxxxxxxxx, žádosti x xxxxxxxx xxxxxxxx změny xxxxxxxxxx xxxxxxxxx a xxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxxxxx xxxxxxxxx.
(3) Ústav xxxxxxxxx xxx etickou xxxxxx podmínky xxx xxxx xxxxxxx.
(4) Xxxxx xx předchozím xxxxxxxx Xxxxxxxxxxxx zdravotnictví vydá Xxxxxx etické xxxxxx. Xxxxxxx řád xxxxxx xxxxxx (xxxx xxx „Xxxxxxx xxx“) přijme xxxx xxxxxx komise. Xxxxxx xxxxxx xxxxxx x Xxxxxxx řád Xxxxx xxxxxxxx xx xxxxx internetových xxxxxxxxx.“.
XXXXX: 32014R0536
22. Xx §53 xx vkládají xxxx §53x až 53x, xxxxx xxxxx:
„§53x
Xxxxxxx etické xxxxxx
(1) Xxxxxx xxxxxx xx složena xx xxxxxx. Skupiny xxxx xxxxxxx x xxxxxxxxx x xxxxxxx xxxxxxxxxxxxx x xxxx xxx xxxxxxxxxxxxxx xxxxxxxx. Xxxxx xxxxxx a xxxxx xxxxx xxxxxxxxxxxx xxxxxx xxxxxx komise xxxxxxx Xxxxxx xxxxxx xxxxxx. Xxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxx tak, xxx v xxxxx xxxxxxx xxxxxx komise xxxx nejméně 5 xxxx, z xxxxx xxxxxxx 1 xxxxx xxxx xxx zdravotnického xxxxxxxx.
(2) Xxxxx etické xxxxxx xxxxxxx a xxxxxxxx ministr zdravotnictví, x xx xx xxxxxxxxxxxx xxxxxx. Xxxxxxx xxxxxx xxxxxx xx xxxxxxxx x xxxxxxxx, xxxxxxxxxxxxx x xxxxxxx xxxxx. Xxxxxxxx a xxxxxxxxxxxxx xxxx xxxxxx xxxxx xxxxxxx x xxxxxxx x Jednacím xxxxx xxxxxx xxxxxx.
(3) Xxxxxxx xxxxxx komise xxxx xxxxxxxx požadavky xx. 9 nařízení x klinickém xxxxxxxxx x xxxx xxxx xxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxx žádost x xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxxxxxxx x xxxxxxxxx, s xxxxxxxx xxxxx bez xxxxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxxxx žádost x xxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxx.
(4) Xxxxxxx etické komise xx zdrží xxxxxxxxx x xxxxxxxx x xxxxxxxx klinického xxxxxxxxx, xx xxxxx provádění xxxx osobní xxxxx, xxxxx x xxxxxxxxx x xxxxxxxxx xxxxxxxx x povolení xxxxxxxx xxxxx x vykonávání xxxxxxxxx xxxxxxx xxx xxxxxxx klinickým xxxxxxxxxx x neprodleně xxxxxx xxxxx xxxxxxxx xxxxx xx posuzovaném klinickém xxxxxxxxx xxxxxx xxxxxx x Ústavu.
(5) Xxxxxxx xxxxxx komise mají xxxxxxxxx xxxxxxxxxx mlčenlivost x xxxxxxxxxxx a xxxxxxxxxxxxx, xxxxx xx xxxxx v souvislosti xx svým xxxxxxxxx x xxxxxx komisi.
(6) Xxxxxx etické xxxxxx xxxxxx xxx osoba, xxxxx xx dopustila xxxxxxxxx xxxxx §108 xxxx. 8. Xxxxxxxx-xx xx xxxx etické xxxxxx takového xxxxxxxxx, xxxx xxxxxxxx x xxxxxx xxxxxx xxxxxx.“.
XXXXX: 32014R0536
§53x
Xxxxxxx xxxxxx xxxxxx
(1) Xxxxxxxxxx etické xxxxxx xx přispívat k xxxxxxx xxxx, bezpečnosti x xxxxxx subjektů xxxxxxxxx.
(2) Xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxx xxxxxxxxx hodnocením xx xxxxxxx xxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx, x němž xxxxxxxx xxxxxxxxx xxxxxxx, (dále xxx „xxxxx xxxxxxxxxx xxxxxxxxx“) xxxxxxxxxx xxxxx xxxxx správné xxxxxxxx xxxxx xxxxxxxxxxx xxxx xxxxxxx zkoušejícím. Xxxxxxxxxxx xxxxxx x průběhu xxxxxxxxxx hodnocení x xxxxxx xxxxxxxxx xxx xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx.
(3) Xxxxxx komise může xxx xxxxxxx xxxxxx xxxxxxx xxxxx odborníky. Xxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx čl. 9 xxxxxxxx o xxxxxxxxx xxxxxxxxx. Tito xxxxxxxxx mají xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxx x xxxxxxxxxxxxx, xxxxx se dozví x xxxxxxxxxxx xx xxxx činností x xxxxxx komisi.
(4) Etická xxxxxx xxxxxxxx xxxx xxxxxxx x xxxxxxx x Jednacím xxxxx, xxxxx xxxxxxxx xxxxxxx
x) xxxxxx xxxxxxxxx xxxxxxxx, xxxxxxxxxx členů skupiny x xxxxxx xxxxxx xxxxxxxx.
x) způsob xxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx.
(5) Xxxxxx xxxxxx xxxx xxxxxxxx xxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx, xxxxx xxxxxxx Ústav x které xxxxxxxx xxxxxxx
x) xxxxxx xxxxxxxxxx xxxxxxx o povolení xxxxxxxxxx xxxxxxxxx x xxxxxxx o xxxxxxxx xxxxxxxx xxxxx klinického xxxxxxxxx v xxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxx xxxxxxxxx,
x) xxxxxxx xxx nakládání x xxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxx, xxxx-xx xxxxxxxx, x xxxxxxxxxx x x xxxxxxxxxxx xxxxxxxxx dohledem xxx xxxxxxxxx hodnocením xx xxxxxxxxx xxxxx způsobem xxxxx xx. 52 xx 54 nařízení x xxxxxxxxx hodnocení,
c) xxxxxx, jakým xxxxxx xxxxxx předává Xxxxxx xxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxx xxxx odůvodnění.
CELEX: 32014R0536
§53x
Xxxxxxxxxx
(1) Xxx xxxxxxxx stanoviska, xxxxxxxxxx xx xxxxxxx, xx které xx xxxxxxxx xxxx X xxxxxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení nebo xxxxxxx o xxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx, xx xxxxx xx xxxxxxxx xxxx X hodnotící xxxxxx, xxxxxx komise xxxxxxx xxxxxxxx klinického xxxxxxxxx x xxxxxxx
x) opodstatněnosti xxxxxxxxxx xxxxxxxxx x xxxx xxxxxxxxxx,
x) xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx přínosů x rizik x xxxxxxxxxxxxx xxxx xxxxxx, x
x) xxxxxxxx aspektů xxxxxxxxxx xxxxxxxxx.
(2) Xxxxxx-xx xxxxxx xxxxxx x xxxxxxx x nařízením x klinickém xxxxxxxxx xxxxxxxxx xxxxxxxxxx, je xxxx xxxxxxxxxx xxxxxxx x žádost x xxxxxxxx klinického hodnocení xxxx x xxxxxxxx xxxxxxxx změny klinického xxxxxxxxx x Xxxxx xxxxxxxxx Xxxxx rozhodnutím xxxxxxx. Xxxxxxxxx xxxxxxxxxx, xxxxxxxx xx aspektů, xx xxxxx se xxxxxxxx xxxx X xxxxxxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx nebo x xxxxxxx x xxxxxxxx významné změny xxxxxxxxxx hodnocení xxxxxxxx xx xxxxxxx xxxxxxxxx xxxx xxx vydáno xxxxx x xxxxxx xxxxxxxxx x xxxxxxxx x xxxxxxxxx xxxxxxxxx. Xxxxxxxxxx musí xxxxxxxxx xxxxxxxxxx, xx kterém xx xxxxxx xxxxx x xxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxx, xxx xxxxx xxxxxxx xxxxxx komise xxx xxxxxxxxxx. Xx řádné xxxxxxxxxx xxxxxxxxxx x xxxx xxxxxx předání Xxxxxx xxxxxxxx předseda xxxxxx xxxxxx.
(3) Xxxxxx xxxxxx xxxx xxxx xxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx xxxxxxxx xx xxxxxxx, na které xx xxxxxxxx xxxx XX xxxxxxxxx xxxxxx x xxxxxxx s xxxxxxxxx xxxxxxxxxxx svého xxxxxxxxxx. Xxx xxxxxxxx xxxxxx stanoviska xxxxxx xxxxxx postupuje x xxxxxxx s xxxxxxxxx x klinickém hodnocení.
(4) Xxx xxxxxxxxxx stanoviska xxxxxx komise podle xxxxxxxx 3 xxxxxxx xxxxxx xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxx stanovených xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxx, xx xxxx xxxxxxxxxxx xxxxxxx x xxxxxxxx, xxx
x) xxxxxxxxxx nebo xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx xxxxxxxxx újmy x xxxxxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxxxx xxxx zajištěny xxxxxxxxx xxxxxxxx,
x) xxxxxxxxx odpovědnosti xxx xxxxxxxxxx a xxxxxx xxxxxxxxxx, xxxx-xx xxxxxxxx, x zadavatele xx xxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx x hlavních zkoušejících, xxxx-xx xxxxxxxx, xxxx xxxxxxxxxx není součástí xxxxxx pracovněprávních xxxxxx,
x) xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx x jeho účastí x xxxxxxxxx hodnocení,
d) xxxx odměny xxx xxxxxxxx xxxxxxxxx odpovídá xxxxxx xxxxxxxxxx hodnocení, x xx zejména xx xxxxxx x xxx xxxxxxxxx výkonům, x nichž xxxx xxxxxxx xxxxxxxxx přímý xxxxxxxx,
x) xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx, xx-xx xxxxxxx,
x) xxxxxxxxxx x xxxxxx xxxxxxxxxx, xx-xx xxxxxxx, xxxxxxx xxxxxxxxx xxxxxxxxx v §54,
x) xxxxx klinického xxxxxxxxx xx vhodné x xxxxxxxxx xxxxxxxxxxx klinického xxxxxxxxx.
(5) Xxxxxx komise xxxxxxxx x xxxxxxxx xxxxxxx práv, xxxxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxx subjektů xxxxxxxxx x jejich xxxxxx a xxxxxxxxxx xxxxxxxxxxxx, xxxx xxxxxxxx xxxxxxxxxxxx, xxxx-xx xxxxxxxx, xxxxxxx x xxxxxxxxxxx x xxxxxxx o xxxxxxxx klinického xxxxxxxxx.
(6) Xx řádné xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx 3 x jeho xxxxxx předání Xxxxxx xxxxxxxx xxxxxxxx etické xxxxxx. Xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx.
(7) Xxxxxx xxxxxx xxxx xxxxxxx trvale xxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxxxx nové xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx subjektů xxxxxxxxx xxxx xxxxxxxxx nebo xxxxxx xxxxxxxxxx nebo xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx podmínky xxxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, k xxxxx xxxxxx xxxxxx vydala xxx xxxxxxxxx stanovisko. Xxxxxx-xx xxxxxx xxxxxx, xx xx xxxxxxxx xxxxxx pro odvolání xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx ve xxxx xxxxx, xxxxxx Xxxxx, xxx xx xxxxxxx xxxxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxxxxxxxxxx xxxx hlavního xxxxxxxxxxxx k xxxxx xxxxxxx, x xxxxxxxx xxxxxxx, xxx je xxxxxxxx xxxxxxxxxx subjektů xxxxxxxxx. Xxxxxxxx souhlasného xxxxxxxxxx xxxxxx xxxxxx xxxxxxxx
x) xxxxxxxxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxx, xxxxxxx xxxxxxxxxx nebo xxxxxxxxxx, xxxxxxxx xxxxxxxxxxxxx xxxxx a číslo xxxxxxxxx,
x) výslovné uvedení, xxx xx xxxxx x xxxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxx, v xxxxxxx xxxxxxxxx odvolání souhlasu xxxx xxx xxxxxxxxx xxxxxxxx, po xxxxxxx xxxxxxx xxxxxxxx souhlasu xxxxxxx,
x) xxxxxxxxxx, ve xxxxxx xx xxxxxx xxxxxx odvolání souhlasného xxxxxxxxxx, xxxxxxxx xxx xxxx vydání a xxxxx, xxxxxxx se xxxxxx xxxxxx xxxxxx,
x) xxxxxxxx xxxxxxxx k xxxxxxxx klinického xxxxxxxxx, xxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxxx, xxxxxx-xx xxxxxxx již x xxxxxxxxx,
x) xxxxx odvolání xxxxxxxxxxx stanoviska x xxxxxx předsedy skupiny xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxx.
(8) Xxxxxx xxxxxx xx xx xxxxxxxx Xxxxxx xxxxxxx xxxxxx Ústavu své xxxxxxxxxx ke xxxx xxxxxxxxxx, které xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxx,&xxxx; xxxxxxxxxx xxxxx xxxxxxxx xxx xxxx posledním xxxx lhůty, xxxxxxxxxx Xxxxxx pro xxxxxx xxxxxxxxx x xxxxxxx xxxxxxx, sdělení x xxxxxxxx xxxxxxxxxxx x xxxxxxx, xxxx koordinovaného xxxxxxxx, xxxx konsolidace, xxxxxxxxx doplňujících xxxxxxxxx, xxxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxx doplňujících xxxxxxxxx, předložení xxxxxxx xxxxx I xxxxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxxx části XX xxxxxxxxx xxxxxx, x xxxxx xxxxxxxxx xxxxx&xxxx; xx. 5, 6, 7, 13, 14, 17, 18, 20 x 22 xxxxxxxx x klinickém hodnocení.
(9) Xxxxx xxxxxxxx v xxxxxxxxxxx s xxxxxxxx xxxxxx xxxxxx po xxxx 5 xxx xx xxxxxxxx klinického xxxxxxxxx tyto dokumenty:
a) xxxxxx x jednání,
b) xxxxxxxxxx o xxxxxx xxxxx,
x) životopisy xxxxx xxxxxx xxxxxx,
x) xxxxxxx x xxxxxxxxxx x xxxxxx vzdělávání xxxxx xxxxxx komise,
e) xxxxxxxxx x jmenování x xxxxxxxx členů etické xxxxxx,
x) xxxxxxxxx vztahující xx xx xxxxxxxxx, xxxxxxxx xxxxx etické xxxxxx, xxxxx x xxxxxxxxxx x funkce,
g) xxxxxxxxxxxxxx x xxxxxxx xxxxxxx, xxxxxx xxxxxxxx, xxxxx sloužily x xxxxxx vyhotovení, s xxxxxxxxx spolupracujícími x xxxxxxx xxxxxx, a
h) xxxxxxxxxxxxx xxxxxx xxxxxx.“.
XXXXX: 32014R0536
23. §54 až 59 xxxxxx xxxxxxxx xxx xxxxx x. 102 x 103 xxxxx:
„§54
Xxxxxxxxxx a xxxxx xxxxxxxxxx xxxxxxxxx
(1) Xxxxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxx xxx pouze xxxxx nebo zubní xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxx29) xxx výkon xxxxxx xxxxxxxxxxxxxx povolání, xxxxx xx xxxxxxxx xxxxxxx znalosti x xxxxxxxxxx s péčí x xxxxxxxx x xxxxxxxxxxx xxxx xxxxx, xx jejichž léčbu xx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx, x xx znalosti xxxxxxx xxxxxxxx praxe.
(2) Xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxxxxxxxx zařízení.
(3) Poskytovatel xxxxxxxxxxx xxxxxx, x xxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxx dochází k xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx přípravku xxxxxxx, x xxxxxxxxxxxx xxxxxxxxxxx xxxxxx, u xxxxx xx prováděno xxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxx xxx xxxxxxxx hodnocení, x xx xxxxxxx xxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, musí xxx xxxxxxxxx certifikátu xxxxxxx xxxxxxxx praxe xxxxxxxx Xxxxxxx. Způsob x xxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx právní xxxxxxx.
(4) Xxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx 3, u xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx praxe xxxxxxx; xxxxx xxxx x xxxx vydání xxxxxxx; xxxxxxxx 3 věta xxxxx se xxxxxxx xxxxxxx.
XXXXX: 32014R0536
§55
Xxxxx
(1) Xxxxxxxxxxx xxxxxxxxxx hodnocení musí xxx xxxxxxxxxx x xxxxxx xxxxxx, xxxxx xxx o tyto xxxxxxxxx:
x) souhrn xxxxxxxxx xxxxxxxxxx xxxxxxxxx,
x) informace xxx pacienta, informovaný xxxxxxx, xxxxxxx xxxxxxxxxxx x jeho xxxxxx x klinickém xxxxxxxxx x xxxxxxx x xxxxx dokumentům,
c) informace x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx,
x) náborové xxxxxxxxx xxxxxxxxxx xx x xxxxxx xxxxxxxxxx xxxxxxxxx,
x) veškeré xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx,
x) xxxxxx xxxxxxxxxxxx x xxxxxxxx zkoušejících, jsou-li xxxxxxxx,
x) xxxxxx xxxx xxxxxxxxxx hodnocení,
h) doklad x xxxxxxxxx náhrady xxxx xxxxxxxxx xxxxxxxxx,
x) xxxxxxxxx o xxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx a xxxxxx xxxxxxxxxx, jsou-li ustaveni, x xxxxxxxxxx xxxx xxxxxxxxxx xxx xxxxxxxx xxxxxxxxx.
(2) Xxxxxxx xxxxxxxxxxx xxxxxxxxxx hodnocení, xxxxx-xx x xxxxxxxxx uvedené x odstavci 1, xx předkládá v xxxxxx, xxxxxxxxxx xxxx xxxxxxxxx xxxxxx.
(3) Xxxxxxxxx x xxxxxxxx xx xxxxx léčivých xxxxxxxxx xxx xxxxxxxx xxxxxxxxx xx xxxxxxx x xxxxxx xxxxxx, xxxx-xx x xxxxxxxxxx Xxxxxx xxxxxxx xxxxx.
XXXXX: 32014R0536
§56
Xxxxxxxxx x xxxxxxx xxxxxx xxxxxxxxx
(1) Jsou-li xxxxxxx xxxxxxxx stanovené x xx. 59 odst. 2 xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxx xxx xx xxxxx Xxxxx republiky použity xxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxxx xxxxxx xxxxxxxxx.
(2) Xxxxxxxxx poskytuje xxxxxx xxxxxxxxx léčivé xxxxxxxxx, xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxx vyžadované xxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx hodnocení, xxxxx xxxx xxxxxx k xxxxxx hodnocených xxxxxxxx xxxxxxxxx. X xxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx, lze xxxxxx po xxxxxxxxxx xxxxxxxxx Xxxxxxx i xxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx zákonem x zdravotnických xxxxxxxxxxxx. Xx-xx xxxxxxxxxxx nekomerční xxxxxxxxx, kterým xx xxx xxxxx tohoto xxxxxx xxxxxx poskytovatel xxxxxxxxxxx služeb zřízený xxxx xxxxxxxx státem xxxx územním xxxxxxxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx a veřejná xxxxxxxx xxxxxxxxx, a xxxxxxxxx xxxxxx přípravky xxxx xxxxxxxxxxxx v Xxxxx xxxxxxxxx, xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx.
(3) Xxxx-xx být v xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx použita xxxxxxxxxxxx xxxxxxxxxxxxxx podle xxxxxx xxxxxx, pak x xxxxxxx x xxxxxxxxx nařízení o xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx x žádosti x povolení klinického xxxxxxxxx xxxxxxxxxx Státního xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxx §18.
(4) Xxxx-xx xxx x klinickém hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx modifikované xxxxxxxxx, xxxxxxxx zadavatel spolu x dokumentací x xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxx Xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx podle xxxxxx xxxxxxxx xxxxxxxx11).
(5) Xxxx-xx xxx x xxxxxxxxx xxxxxxxxx humánních léčivých xxxxxxxxx xxxxxxx přípravky xxxxxxxxxx lidské embryonální xxxxxxx buňky, předloží xxxxxxxxx spolu s xxxxxxxxxxx x xxxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxxx x xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxx kmenovými xxxxxxx xxxxxx Xxxxxxxxxxxxx xxxxxxxx, xxxxxxx x xxxxxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxx102).
(6) Xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxxxxx klinická hodnocení xxxxx xx. 2 xxxx. 3 xxxxxxxx x xxxxxxxxx hodnocení xxxxxxxxx xxxxxxxxxxxx zadavateli, xxxxx xxxxxxx xxxxxxxxx xxx registraci nebo xxxxx registrace léčivého xxxxxxxxx, stanoví xxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xx xxxxxxxxxxxx, obsah xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx hodnocených xxxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxxx hodnocením xxxxx xxxx xxxxx se xxxxxx xxxxxxxx hodnocení xxxxxxxxx pouze xx xxxxx Xxxxx xxxxxxxxx, xxxxx cílem je xxxxxxxxx léčby xxxxxx xxxxxxxx, x xxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxx léčivé xxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxx xxxxxx x Xxxxx xxxxxxxxx x xxxx xxxxxxxxx x souladu xx xxxxxxxx xxxxx x xxxxxxxxx nebo xxxx souhrn xxxxx x xxxxxxxxx, je-li xxxxxx xxxxxx xxxxxxx xxxxxx s xxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx.
XXXXX: 32014R0536
§57
Dohoda xx zadavatelem
Ústav xxxx xx xxxxxxxx xxxxxxxxxxx x xx. 42 xxxx. 3 xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx xx zadavatelem xxxxxx, xxxxx xxx xxxx xxxxxxxxx podezření xx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxx Ústavu; x xxxxxxx případě ohlásí xxxxxxxxx na závažné xxxxxxxxxxx xxxxxxxxx účinky xxxxxxxx Ústav.
CELEX: 32014R0536
§58
Systém xxxxxxx xxxx vzniklé xxxxxxxx xxxxxxxxx
(1) Vznikne-li xxxxxxxx xxxxxxxxxx xxxxxxxxx x důsledku xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx nemajetková xxxx, x xx xxxxxxx xx xxxxxx xxxx xx xxxxxx, xx xxxxxxxxx povinen xx xxxxxxxx x xxxxxxx x xxxxxx právními xxxxxxxx 103). Xxxxxxx xxxx lze xxxxxxxx x zadavatele prostřednictvím xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx je xxxxxx xxxxxxxxxx xxxxxxxxx.
(2) Xxxxxxxxx xx xxxxxxx xxx xx celou xxxx xxxxxxxxx klinického xxxxxxxxx xxxxxxxx pojištění odpovědnosti xxx, xxxxxxxx xxxxxxxxxxxx, xxxx-xx xxxxxxxx, x xxxxxxxxxxxx xx xxxx xxxxxxxx xxxxxxxx hodnocení x xxxxxxxx xxxxxxxxx xxxxxxxxxx hodnocení.
(3) Xxxxxxxx 2 xx xxxxxxxxx, xxxxxxx-xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, jehož xxxxxxxxx xxxxxxxx pokrývá xxxxxxx léčivých xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx,
x) x xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxx v Xxxxx xxxxxxxxx x xxxxxxxxxxx v souladu xx souhrnem xxxxx x přípravku, xxxxxxxxx x xxxxxxxx přípravky xxxxxxxxxxxxxx xxxxx tohoto xxxxxx x Xxxxx xxxxxxxxx a xxxxxxxxxxx xxxx xxxxxx xxxxx x přípravku, xx-xx xxxxxx xxxxxx xxxxxxx xxxxxx x xxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxxx postupy x xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx, x xxxxxxx
x) dodatečné xxxxxxxxxxxx xxxx xxxxxxxxxxxx postupy xxxxxxxxxxxxx x xxxxxxxxx x běžnou xxxxxxxxx xxxxx větší xxx xxxxxxxxx xxxxxxxxx riziko xxxx xxxxx xxx xxxxxxxxxx subjektů hodnocení.
CELEX: 32014R0536
§59
Xxxxxxxxxx
Xxxxxx-xx zadavatel v xxxxxxx předložené xxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx svého xxxxxxxx xxxx kontaktní xxxxx, xxxxxxxx xx xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxx xx základě xxxx xxxx, xxxxxxxxx-xx xxxxxxxxx xxxx xxxxxxxx xxxx.
XXXXX: 32014R0536
24. X §60 xxxx. 3 xxxx. x) xx čárka xxxxxxxxx xxxxxx x xxxxxxx x) se xxxxxx xxxxxxxx pod xxxxx č. 64 xxxxxxx.“.
25. X §62 xxxx. 1 xx xx xxxx xxxxx, xxxxx „xx účelem xxxxxxxxxx xxxxxxxxx x“ xxxxxxx.
26. V §64 xxxx. x) se xxxxx „§55 a xxxxxxxxxxx x xxxxx xxxxxx x xxxxxxx x xxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx“ xxxxxxxxx xxxxx „nařízení x xxxxxxxxx hodnocení x xxxxxxxxxxx x xxxxx řízení o xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx nebo x xxxxxxxx významné xxxxx xxxxxxxxxx hodnocení“.
CELEX: 32014R0536
27. X §64 xxxx. x) xx xxxxx „včetně xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků,“ xxxxxxx.
28. V §66 xx odstavec 4 xxxxxxx.
Xxxxxxxxx xxxxxxxx 5 xx xxxxxxxx xxxx xxxxxxxx 4.
29. V §70 xxxx. 1 xx xx xxxx xxxxx xx xxxxx „xxxxxxxxx“ xxxxxxxx xxxxx „x xxxxx xxxxxxxxxxx předpisem Xxxxxxxx unie101)“ x xx xxxxx „xxxxx“ xx xxxxxxxx xxxxx „xxxxxx léčivých látek xxxxxxxx xxx xxxxx“.
XXXXX: 32014R1252
30. V §70 xx xxxxxxxx xxxxxxxx 7, xxxxx xxx:
„(7) Xxxxxxx léčivých látek, xxxxx xxxxxxx balení, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxxx, xxxxxxxx jakosti xxxx xxxxxxxxxxx, xxxxx x xxxxxxxxxxx kontroly xxxxxxxx xxxxx xxxxxxxxxxxxx ze xxxxxxx xxxx určených xxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx 2; xxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx 4 x 5.“.
XXXXX: 32014R1252
31. X §77 xxxx. 1 xxxx. x) xx slova „xxxxxx údajů x xxxxxx jejich xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx Xxxxx xxxx Xxxxxxxxxxx xxxxx ve xxxx xxxxxxxxxxx xxxxxxxxxx“ xxxxxxxxx xxxxx „xxxxxxxxxxx údaje xxxxxxxx identifikaci distributora, xxxxxxxxxxxx distribuovaného léčivého xxxxxxxxx x identifikaci xxxxx podle xxxxxxx x), xxxxx xxx xxxxxx xxxxxxxxx xxxxxxxxxxxx; xxxxxxxxx xxxxx, xxxxx, xxxxxx a xxxxxx xxxxxxxx xxxxxx poskytování xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxx“.
32. V §77 xxxx. 1 xxxx. x) se xx xxxxx „pacientů v Xxxxx xxxxxxxxx“ xxxxxxxx xxxxx „; v xxxxxxx, xx xxxxxxxxxxxx xxxxxxxxx xxxxxxx léčivé xxxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, jehož xx xxxxxxxxxxxxx a xxxxx v období xxxxxxxxxxx 6 kalendářních xxxxxx prokazatelně distribuoval, xx xxxxxxxxxxx xxxxxxx xxxxxxxx tomuto provozovateli xxxxxxxxxxx dodávku xxxxxxxxxxxxxx xxxxxxxx přípravku xx 48 xxxxx xx xxxxxxxx xxxx xxxxxxxxx; xxxx je xxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx obecné xxxxxx xxxxxxx Ministerstvem xxxxxxxxxxxxx za xxxxxx xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx podle §77d, xxxxxx se omezuje xxxx zakazuje distribuce xxxxxxxx xxxxxxxxx xx xxxxxxxxx.“.
33. X §77 xx xx xxxxx xxxxxxxx 1 tečka xxxxxxxxx xxxxxx a xxxxxxxx xx xxxxxxx x), které xxx:
„x) x případě, xx xx xxxx xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxxx, který xx xxxxxx na xxxxxxx xxxxxxxx xxxxxxxxx xxxxx §77c, xxxxxxx xxxx skutečnost Ústavu; xxxxxxxx je poskytováno xxxxxxxxxxxx x obsahuje xxxxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, množství xxxxxxxx přípravku x xxxxxxx xxxxxxxxxx, název xxxxx xxxxxxxxxx x xxxxx plánované distribuce xxxxxxxx přípravku; xxxxxxxxx xxxxx xxxxxxxxx x xxxxxxxx, xxxxxx x xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx hlášení xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx předpis; x xxxxxxx, že po xxxxxxxx xxxxxxxxxxxx xxxxxx xx dne, xxxxxx xxxxxx 15 xxx xxx dne, xxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx, xxxxxx xxxxxxxx obecné xxxxxx xxxxx §77x xx vztahu x xxxxxx xxxxxxxx přípravku, xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx.“.
34. Xx §77x xx xxxxxxxx xxxx §77x a 77x, xxxxx xxxxxx xxxxxxx xxxxx:
„§77x
(1) Xxxxx xxxxxxxxxxx xx xxxxxxxx rozhodnutí x xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx xxxxxxxxx x xxxxxx léčivých xxxxxxxxx na trhu x Xxxxx xxxxxxxxx x o xxxxxx xxxxxxxx xxxxxxxxx vydaných x použitých xxx xxxxxxxxxxx zdravotních služeb; xxxx xxxxxxxxx zpracovává x xxxxxxxxxxx. Xxx xxxxxxxxxx informací xxxxx xxxx první Xxxxx xxxxxxxxx, zda množství xxxxxxxx xxxxxxxxx, xxxxx xxxx nahraditelný jiným xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx vzhledem xx xxxx xxxxxxxx xxxxxxxxxxx, xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx. Pokud Xxxxx xx xxxxxxx xxxxxxxxxxx uvedených skutečností xxxxx k xxxxxx, xx xxxxxxxx zásoba xxxxxxxxxxx léčivého přípravku xxxx léčivých xxxxxxxxx xxx dostatečně nepokrývá xxxxxxxx potřeby pacientů x Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx xxxxxxxx přípravku nebo xxxxxxxx přípravků, kterým xx rozumí xxxxxxxxxxxx xxxxxxx xxxxxxxxxx potřeb xxxxxxxx v České xxxxxxxxx daným xxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx v Xxxxx xxxxxxxxx s xxxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx zdravotních xxxxxx, xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxx, x xx xxxxxx podkladů x informací, xx xxxxxxx základě Xxxxx x xxxxxx závěru xxxxx.
(2) Xxxxx po xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx Xxxxxxx xxxxx odstavce 1 dojde Ministerstvo xxxxxxxxxxxxx k závěru xxxxxxxxx x xxxxxxxx 1 xxxx xxxxx, xxxxxx xxxxxx léčivý xxxxxxxxx nebo léčivé xxxxxxxxx xx seznam xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxx do xxxxxxxxx xxxx xxxxxxxxxxxx povinnost xxxxxx Ústavu podle §77 xxxx. 1 xxxx. x) (xxxx xxx „Xxxxxx“). Xxxxxxxxxxxx xxxxxxxxxxxxx vede Xxxxxx, xxxxx zveřejňuje x xxxxxxxxx znění xx xxxxx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxx xx xx Xxxxxx zařazují xxxxxx xxxxxxxx xxxxxx xxxxxx.
(3) Xxx xxxxxxxx xxxxxxxx xxxxxx povahy xxxxx odstavce 2 xx xxxxxxxxx xxxxx xxxxxxxxx řádu s xxx, že
a) xxxxx xxxxxxxx obecné xxxxxx xx xxxxxxxx x xxxxxxxx obecné xxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx,
x) xxxxx xxx uplatnění xxxxxxxxxx k xxxxxx xxxxxxxx xxxxxx xxxxxx xxxx 5 xxx xxx xxx xxxx xxxxxxxxxx,
x) xxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx xx xxx xxxx xxxxxxxxxx.
(4) X případě, xx Xxxxx xxxxxxxx podle xxxxxxxx 1 xxxxx x xxxxxx, xx x xxxxxxxx xxxxxxxxx xxxxxxxxx na Xxxxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxx, na xxxxxxx xxxxx k tomuto xxxxxx xxxxx, Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxx xxxx xxxxx xxxxx ke xxxxxxxx xxxxxx, postupem xxxxx xxxxxxxx 2 x 3 xxxxxx xxxxxxxxx xx Seznamu xxxxxx.
§77x
Xxxxxxxx k xxxxxxxxx xxxxxxxxxxx léčivých přípravků
(1) X xxxxxxx, xx Xxxxx xxxxxx x xxxxxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxx od xxxxxxxx rozhodnutí o xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxx x xxxxxxxxxxxx tříměsíčním xxxxxx x nedostatku xxxxxxxx xxxxxxxxx, který xxxx xxxxxxxxxxxx xxxxx xxxxxxx přípravkem xxxxxxxxxxxxxx xxxxxxxxx vlastností, nebo xxxxxxxx přípravků, xxxxx xxxx xxxxxxxx nahraditelné xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxxx, xxx xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx republice x tento xxxxxxxxxx xxxxxxxx dostupnost x xxxxxxxx xxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxx dopadem xx ochranu xxxxxx xxxxxxxxxxxx x významným xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx x xxxxxx xxxxxxxx podle xxxxxxxx 3.
(2) Podnět Xxxxxx musí xxxxxxxxx xxxxxxxxxx xxxxxxxx na xxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxxx xxxxxxxxxx x registraci, xxxxxxxxxxxx x xxxxxxx, xx
x) xx xxxxxx, xx aktuální xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx léčivých xxxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxx pacientů x Xxxxx republice, x
x) xxxxxxxx xxxxxxxxx xxxxxx, xxx xxxxx xx xxxxxxxxxxx distribuce předmětného xxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx x xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx pacientů x České xxxxxxxxx.
(3) Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx opatření obecné xxxxxx, xxxxxx xxxxx xxxx zakáže distribuci xxxxxxxxxxx xxxxxxxx přípravku xx léčivých xxxxxxxxx xx zahraničí. Pro xxxxxx xxxxxxxx xxxxxxxx xxxxxx povahy musí xxx xxxxxxx xxxx xxxxxxxx:
x) xxx o xxxxxx xxxxxxxxx, xxxxx xx xxxxxx na Xxxxxxx,
x) xxxxxxxxxx xx xxxxxxxxx xx xxxxx xxxxx x xxxx, xx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxxxxx odpovídajících xxxxxxxxx vlastností, xxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxxx, na xxxx x Xxxxx xxxxxxxxx nepokrývá dostatečně xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx republice, x
x) xxxxxxx xxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx a xx xxxxxxxxx dostupnosti léčivých xxxxxxxxx xxx aktuální xxxxxxx pacientů x Xxxxx xxxxxxxxx xxxxxxxxx xxx individuálním xxxxxx xx uskutečnění jejich xxxxxxxxxx xx xxxxxxxxx.
(4) Xxxxxxxxxxxx zdravotnictví neprodleně xxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxxx-xx důvody xxxx xxxxxx.
(5) Při xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx odstavce 3 xx xxxxxxxxx xxxxx §77x xxxx. 3 s xxx, xx opatření xxxxxx xxxxxx nabývá xxxxxxxxx xxxx x xxx xxxxxxxx.
(6) Xxxxx Ústav xxxxxx, xx již xxxxxxxxxxxxx důvody xxx xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxx xxxxxxxxxx xx xxxxxxxxx u konkrétního xxxxxxxx xxxxxxxxx nebo xxxxxxxx xxxxxxxxx, podá x xxx Ústav xxxxxxxxxxx informaci Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx s xxxxxxxx, xxxxx jej x xxxxxx xxxxxx xxxxx.
(7) Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxx xx x xxxxxx xxxxxxxx xxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx Xxxxx x xxxxxxxxxx xxxxx x xxxxxxx xxxxx §77x.“.
35. X §80 xx xx xxxxx xxxxxxxx 1 xxxxxxxx xxxx „Předepisující xxxxx xx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxx, xx xxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxxxxx xxxxxx v xxxxxxxxxx xxxxx xxxxxx předepsaného xxxxxxxx xxxxxxxxx.“.
36. X §82 xxxx. 3 xxxx. x) se za xxxxx „x xxxxxxxx xxxxxxxx xxxxxxxxxxx“ vkládají xxxxx „, a xx xxxxxxxxxxxx“, x xxxxx „rozsah xxxxx x xxxxxx xxxxxx xxxxxxxxxxx formou xxxxxxx xxxxxxxx Xxxxx xx xxxx informačním prostředku“ xx nahrazují xxxxx „xxxxxxxxxxx údaje obsahují xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x výdeji, identifikaci xxxxxxxxxxxxxxx xxxxxx, xxxxxxxxxxxx xxxxxxxx, xxxxxxx byl xxxxxxxxx vydán, a xxxxxxxxxxxx xxxxxxxx léčivého xxxxxxxxx; xxxxxxxxx xxxxx, xxxxxx, xxxxx a xxxxxx xxxxxxxx jejich xxxxxxxxxxx xxxxxxxxxxxxxxx elektronického xxxxxxx stanoví xxxxxxxxx xxxxxx předpis“.
37. X §82 xxxx. 4 ve xxxx xxxxx xx xxxxx „xxxxx xxxxxxxx xxxx“ x „xxxxxxxxxxx xxxxxxx xxxx“ zrušují.
38. X §82 xxxx. 4 ve xxxx xxxxx xx xxxxx „xxxxxxxxx“ zrušuje x xx xxxxx „xx xxxx xxxxxxx“ xx vkládají slova „xxxxx xxxxxxxxx, x xx“.
39. X §101 xxxx. 1 zní:
„(1) Xxx xxxxxxxx podle xxxxxx xxxxxx xxxxxxxxx xxxxxx vykonávající státní xxxxxx xxxxxxx x §10 a xxxxxxxxxx xxxxx xxxxxxxxxxx xxxx. Xxxxxxxx xx xxxxxxxx xx xxxxx xxxxxxx xxxxxxxxxx. Xxxxxxxxx xx xxx xxxxxx kontrolní xxxxxxxx podle tohoto xxxxxx x xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx inspektora.“.
40. X §101 xxxx. 5 písmeno x) xxx:
„x) v xxxxxxxxxxxx xxxxxxxxx, zejména x případě klamavého xxxxxxxx léčivého přípravku xxxx x xxxxxxx xxxxxxxxx xxxxxxxxx, xx x xxxxxxx přípravkem xxxxxxx xxxxx, xxxxx x xxxxxx činnosti xxxx xxxxx xxxxxx xxxxxx oprávněna, xxxxxxx xxxx xxxxxxx zajištění; x xxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx a xxxxx xx xxxxxx xxxxxx x dočasném zajištění x xxxxxxxx xxxx xxxxxx, xxxxxx a xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx; tento xxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx x xxxxxxxx; xxxxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxx vydat; x případě, xx xxxxxxxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxx xxxx xxxxxx; x xxxxxx, případně xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx úřední záznam, xxxxx xx xxxxxxxx xxxxxxxxx o xxxxxxxx; xxxxxxx-xx důvod xxxxxxxxx xxxxxxxxx nebo xxxxxxx-xx xx, že zajištěné xxxxxx přípravky xxxxxxx xxxxxxxxx xxxxxx xxxxxx, xxxxx Ústav xxxx Xxxxxxxxxxx ústav xxxxxxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxxxxx v neporušeném xxxxx; xxxxxxx xx xxxx xxxxxxxxx, xxxxxxx-xx xx, xx x xxxx xxxxxxxxx s xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx s xxx xxxxxx xxxxx xxxxxxxxx nebo xxxxxxx-xx xx, xx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx zákona; x xxxxxxx xxxxxxx xxxx Ústav xxxx Xxxxxxxxxxx xxxxx xxxxxxxxxx x xxxxxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxxx; xxxxxx přípravky, xx xxxxxxx zachází xxxxx, xxxxx x xxxxxxxx xxxxxxxxx xxxx oprávněna xxxxx xxxxxx xxxxxx, xx považují za xxxxxx xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxxx tohoto xxxxxx; xxxxxxxxxx xxxx xxxxxxx xxxxxx xxxxxxxxx xx Xxxxx xxxx Xxxxxxxxxxx ústav xxxxxxx xxxxxxxxx xxxxx §88; xx xxxx xxxxxx xxxxxxxx x v xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx nebo xxxxxxx xxxxxxxx přípravku xxxxxxxx xxxxxxxxxxxx xxxxx xx zajištěné, propadnuté xxxx xxxxxxx xxxxxx xxxxxxxxx náhrada; x xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx nebo xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx Ústavem xxxx Xxxxxxxxxxxx xxxxxxx xxxxxxx x uskladněním xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, x jejichž výši xxxxxxxx Ústav xxxx Xxxxxxxxxxx xxxxx.“.
41. V §101 xxxx. 5 závěrečné xxxxx xxxxxxxxxx xx xxxxx „a) až x)“ nahrazují xxxxx „ x) xx x)“.
42. V §103 xxxx. 6 xxxx. x) se xx xxxxx „do xxxxx“ xxxxxx xxxxx „, xxxx“.
43. X §105 xxxx. 2 xx xx konci xxxxxxx x) xxxxx „xxxx“ xxxxxxx.
44. X §105 xx konci xxxxxxxx 2 se tečka xxxxxxxxx xxxxxx a xxxxxxxx xx xxxxxxx x) xx x), xxxxx znějí:
„r) nezajistí xxxxxxx xxxxxxxx xxxxxxxxx xxxxx §77 odst. 1 xxxx. h),
s) x xxxxxxx x §77 odst. 1 xxxx. x) provede xxxxxxxxxx xxxxxxxx přípravku xx zahraničí, xxxx
x) x xxxxxxx x xxxxxxxxx obecné xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx vydaným xxxxx §77x xxxxxxxxxxx xxxxxx xxxxxxxxx do xxxxxxxxx.“.
45. V §105 xxxx. 5 xx xx písmeno x) xxxxxx nové xxxxxxx x), které xxx:
„x) xxxxxxxxxx xxxxx x xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxx x České xxxxxxxxx xxxxx §33 xxxx. 2 xxxx xxxxxxxx,“.
Xxxxxxxxx xxxxxxx x) xx x) se xxxxxxxx xxxx x) xx x).
46. X §105 xxxxxxxx 6 xxx:
„(6) Xxxxxxxxx xx dopustí xxxxxxxxx deliktu tím, xx x xxxxxxx x xxxxxxxxx x xxxxxxxxx xxxxxxxxx
x) xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxx v xxxxxxx x xxxxxxxxxx xxxxxxxxx x povolení,
b) xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxx x xxxxxxx x podmínkami xxxxxxxxx x povolení,
c) xxxxxxx klinické xxxxxxxxx x xxxxxxxx situaci x xxxxxxx x xxxxxxxxxx stanovenými xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxx,
x) xxxxxxxx
1. xxxxx x xxxxxxxx, dočasném xxxxxxxxx, xxxxxxxxx zahájení, xxxxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx,
2. xxxxx xxxxxxxx prvního xxxxxxxx xxxxxxxxx x České xxxxxxxxx nebo
3. ukončení xxxxxx subjektů xxxxxxxxx x Xxxxx republice,
e) xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx,
x) xxxxxx xxxxx a úplně xxxxxxxxxxxxxxxxx xxxxxxx,
x) xxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx neočekávané xxxxxxxxx xxxxxx xxxx o xxxx neinformuje xxxxxxxxxx xxxxx neprovede xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx přijaté xx ochranu xxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx klinického xxxxxxxxx x xxxxxxx x xxxxxxxxxx a xx xxxxxxxx xxxxxxx xxxxxxxx xxxxx,
x) xxxxxxxxx, xxx xxxxxxxxxx x ostatní xxxxx xxxxxxxx do xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx podmínky stanovené xxxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxx podmínky xxxxxxxxx v §54,
x) xxxxxxxx závažné xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxx klinické xxxxx nebo xxxxxxxx xxxxxxxxx nebo xxxxxxxxxxx x xxxxxx skutečnostech, xxxxx xxxxxxxx neodkladné xxxxxxxxxxxx xxxxxxxx xxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx,
x) xxxxxxxxxx zkoušejícímu xxxxxx xxxxxxxxx pro xxxxxxxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxxxxx,
x) xxxxxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx nebo xxxxxx xxxx nearchivuje základní xxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx s xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxx
x) xxxx nekomerční xxxxxxxxx xxxx x xxxxxxxxxx hodnocení xxxxxxxx xxxxxxxxx xxxxxxxx.
XXXXX: 32014R0536
47. X §105 xx xxxxxx xxxx xxxxxxxx 7, který xxx:
„(7) Xxxxxxxxx xx xxxx xxxxxxx xxxxxxxxx xxxxxxx xxx, xx
x) x xxxxxxx x §58 xxxx. 2 xxxxx xx xxxxx xxxx xxxxxxxxx klinického xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxx, xxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxxx xx újmu vzniklou xxx provádění xxxxxxxxxx xxxxxxxxx xxxx nezaplatil xxxxxxxx,
x) zahájí klinické xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx x §60 xxxx. 3,
x) xxxxxxxxx xxxxxxxxx xxxxxxxxxx hodnocení podle §61 odst. 2 xxxx. a),
d) xxxxxxx xxxxxxxxxx povinnost podle §61 odst. 2 xxxx. x), nebo
e) xxxxxxxxxx zkoušejícímu xxxxxx xxxxxxxxx xxxx neuchová xxxxxx vzorek podle §61 xxxx. 2 xxxx. x).“.
Xxxxxxxxx odstavce 7 x 8 xx xxxxxxxx xxxx xxxxxxxx 8 a 9.
XXXXX: 32014R0536
48. X §106 xxxxxxxx 3 xxx:
„(3) Xxxxxxxxxxx fyzická xxxxx xx dopustí xxxxxxxxx xxxxxxx xxx, xx x xxxxxxx x xxxxxxxxx x xxxxxxxxx xxxxxxxxx
x) jako xxxxxxxxxx, xx-xx x xxxxx xxxxxxxxxx xxxxxxxxx pouze xxxxx zkoušející, xxxx xxxx hlavní xxxxxxxxxx, xx-xx v xxxxx xxxxxxxxxx hodnocení xxxx xxxxxxxxxxxx,
1. xxxxxxxxx provádění xxxxxxxxxx hodnocení x xxxxx xxxxxxxxxx xxxxxxxxx,
2. xxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxx zkoušejících xxxxxx,
3. xxxxxx klinické xxxxxxxxx xxx udělení xxxxxxxxxxxxx xxxxxxxx subjektu xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxx případů, xxx xxxxx souhlas xxxx vyžadován, nebo xxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxx, xxxx-xx xxx xxxx xxxxxxxx hodnocení vyžadováno,
4. xxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx kontaktních xxxxx subjektu xxxxxxxxx xxxx jeho zákonnému xxxxxxxx,
x) xxxx zkoušející xxxxxxxxxxx, xxxxxxxxxxxxxx nebo xxxxxxxx nežádoucí xxxxxxx xxxx laboratorní odchylku,
c) xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxx x dokumentace xxxxxxxxxx xxxxxxxxx,
x) xxxxxxxx xxx provádění xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx,
x) xxxxxxx klinické xxxxxxxxx xxxx xxxxxxxxxx, xxxx xxxxxxx podmínky xxxxxxxxx nařízením o xxxxxxxxx hodnocení xxxxx xxxxxxxx xxxxxxxxx x §54, xxxx
x) nedodržuje xxxxxx xxxxxxx xxxxxxxx xxxxx xxx provádění xxxxxxxxxx hodnocení.“.
CELEX: 32014R0536
49. X §107 xxxx. 1 písm. x) xxx:
„x) 100 000 Kč, jde-li x xxxxxxx xxxxxx xxxxx §105 odst. 6 písm. x) xxxx 2 xxxx 3, §105 odst. 6 xxxx. x), §106 xxxx. 3 xxxx. a) xxxx x) xxxx §106 xxxx. 5 xxxx. x),“.
50. X §107 xxxx. 1 xxxx. x) se slova „§106 xxxx. 3 xxxx. x) xxxx x)“ xxxxxxxxx slovy „§106 odst. 3 xxxx. x)“.
51. V §107 xxxx. 1 písm. x) xx slova „x), x), x), x) nebo x)“ xxxxxxxxx slovy „h), x), x), x) xxxx x)“.
52. X §107 xxxx. 1 xxxx. x) se slova „§105 xxxx. 6 xxxx. x), d), x), x) xx x)“ xxxxxxxxx slovy „§105 xxxx. 6 xxxx. x) xxxx x) bodu 1, §105 odst. 6 xxxx. e), x), x), x), i), x),“.
53. X §107 xxxx. 1 xx xx xxxxx textu xxxxxxx x) xxxxxxxx xxxxx „xxxx §106 xxxx. 3 xxxx. x), e) xxxx x)“.
54. X §107 xxxx. 1 xxxx. x) xx slova „x), x), x), x), q), x), x), x), x), x)“ xxxxxxxxx xxxxx „x), l), x), x), r), x), x), x), x), x)“.
55. X §107 xxxx. 1 xxxx. x) se slova „x), x), x) xxxx m)“ xxxxxxxxx xxxxx „x), x) xxxx x)“.
56. X §107 xxxx. 1 xxxx. x) se xx xxxxx „§104 xxxx. 7 xxxx. x) xxxx x),“ xxxxxxxx xxxxx „§105 xxxx. 2 xxxx. x) xx x),“.
57. X §107 xxxx. 1 xxxx. x) se slova „x), e), x), x), x) xxxx x)“ xxxxxxxxx xxxxx „ x), x), x), x), o) xxxx x)“.
58. X §107 xxxx. 2 xx xx slovo „xxxxx“ xxxxxxxx xxxxx „§105 xxxx. 2 písm. x) x“.
59. X §108 xxxxxxxx 5 xxx:
„(5) Xxxxxxx osoba xx xxxxxxx xxxxxxxxx xxx, xx v xxxxxxx x xxxxxxxxx x xxxxxxxxx hodnocení
a) xxxx xxxxxxxxxx xxxx xxxxxx xxxxxxxxxx
1. xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx hodnocení,
2. xxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxx,
3. xxxxxx klinické xxxxxxxxx xxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx jeho xxxxxxxxx zástupce x xxxxxxxx xxxx případů, xxx xxxxx xxxxxxx xxxx xxxxxxxxx, xxxx xxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx osoby, xxxx-xx xxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx,
4. xxxxxx klinické xxxxxxxxx xxx sdělení xxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx,
x) xxxx zkoušející xxxxxxxxxxx, xxxxxxxxxxxxxx xxxx xxxxxxxx nežádoucí xxxxxxx xxxx xxxxxxxxxxx xxxxxxxx,
x) xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxx a xxxxxxxxxxx xxxxxxxxxx hodnocení,
d) xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx okamžitá xxxxxxxx x xxxxxxx subjektů xxxxxxxxx,
x) xxxxxxx klinické xxxxxxxxx jako zkoušející, xxxx xxxxxxx podmínky xxxxxxxxx xxxxxxxxx x xxxxxxxxx hodnocení xxxxx xxxxxxxx xxxxxxxxx x §54, xxxx
x) při xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx zásady správné xxxxxxxx xxxxx.“.
XXXXX: 32014R0536
60. X §108 xx za xxxxxxxx 7 vkládá xxxx xxxxxxxx 8, xxxxx xxx:
„(8) Fyzická xxxxx xx jako xxxx xxxxxx xxxxxx Xxxxxxxx xxxxxx pro kontrolu xxxxx dopustí přestupku xxx, že v xxxxxxx x §53x xxxx. 5 xxxxxx xxxxxxxxx xxxxxxxxxx mlčenlivost.“.
Dosavadní xxxxxxxx 8 x 9 xx xxxxxxxx xxxx xxxxxxxx 9 x 10.“.
61. X §108 xxxx. 8 xxxx. x) se xxxxx „x)“ nahrazuje slovem „x)“.
62. V §108 xxxx. 8 xxxx. x) xx xxxxx „x) nebo b)“ xxxxxxxxx xxxxx „b) xxxx x)“.
63. X §108 xxxx. 8 se xx konci textu xxxxxxx x) doplňují xxxxx „xxxx odstavce 5 písm. x), x) nebo x)“.
64. X §108 xxxx. 8 xxxx. x) xx slova „xxxx xxxxxxxx 5 xxxx. x)“ zrušují.
65. X §108 xx xxxxxxxx xxxxxxxx 11, xxxxx xxx:
„(11) Xx přestupek xxxxx xxxxxxxx 8 se xxxxx zákaz xxxxxxxx.“
66. Xx §108 xx xxxxxxxx nové §108x x 108x, xxxxx včetně xxxxxxx xxxxx:
„108x
Xxxxxxxxxx xxxxxxxx přípravku
(1) Xxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx, xxxxxxxx xxxxxx přípravek xxxxxx xxxxxxxxx správního xxxxxxx, x
x) byl xx xxxxxxxx xxxxxxxxx xxxxxxx xxxx nebo určen, xxxx
x) xxx x xxxxxxxxxxx se spácháním xxxxxxxxx xxxxxxx xxxxxx.
(2) Xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxx.
108x
Xxxxxxx xxxxxxxx xxxxxxxxx
(1) Xxxxxx-xx uloženo xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxx x §108x xxxx. 1 písm. x) xxxx x), xxx xxxxxxxxxx o xxxx xxxxxxx, jestliže
a) xxxxxx xxxxxxxxx xxxxxxxxx deliktu, xxxxxxx xxxxx xx xxxxxxx xxxxxx xxxxxx,
x) xxxxxxxx pachateli xxxxxxxxx xxxxxxx xxxx xx xxxxxxxx xxxxx, xxxx
x) xxxxxxxx není xxxx.
(2) Xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx xxxx.“.
67. X §112 xx xx xxxxxxxx 5 xxxxxx nový xxxxxxxx 6, xxxxx xxx:
„(6) Rozhodne-li xxx xxxxx, xxxxxxx Ústav x prostředků xxxx xxxxxxxx podle xxxxxxxx 5 xx xxxxxxxx xxxx xxxxxxxx xxxxxxxx Xxxxx xxxxxxxxx zřízený xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xx výši xxxxxxxxx vládou.
Dosavadní odstavce 6 x 7 xx označují jako 7 x 8.“.
68. V §114 xxxx. 1 se xx slova „§24 xxxx. 2, 3, 4, 8 x 9,“ vkládají xxxxx „§33 odst. 2,“, xx xxxxx „§67 xxxx. 10 a 11,“ se xxxxxxxx xxxxx „§77 xxxx. 1 xxxx. x) x x),“ x xx xxxxx xxxxx xxxxxxxx 1 se xxxxxxxx slova „x §82 xxxx. 3 xxxx. x)“.
69. X §114 xxxx. 2 xx xxxxx „§51 odst. 2 písm. x), §52 xxxx. 6, §53 xxxx. 1, 8, 12 x 13, §54 odst. 1, §55 odst. 7 xx 9, §56 xxxx. 1 xxxx. x), §56 xxxx. 3 x 7, §57 odst. 2, §58 xxxx. 8, §59 odst. 1“ xxxxxxxxx xxxxx „§53x xxxx. 2, §54 odst. 4, §56 xxxx. 6“.
70. X §114 xxxx. 2 se xxxxx „§60 xxxx. 2, 4, 5 x 9, §61 xxxx. 2 xxxx. x) x x) xxxx 1 a 6, §61 xxxx. 2 xxxx. x), §61 xxxx. 4 xxxx. x),“ zrušují.
71. X §114 xxxx. 2 se xx xxxxx „§77 xxxx. 1 xxxx. x),“ xxxxxx slovo „x),“.
72. V §114 xxxx. 4 xx xx xxxxx „§48 xxxx. 2, 3 x 6“ xxxxxxxx xxxxx „, §60 xxxx. 2, 4, 5 x 9, §61 xxxx. 2 xxxx. a) x x) bodů 1 x 6, §61 xxxx. 2 písm. x), §61 xxxx. 4 písm. x)“.
Xx. XX
Xxxxxxxxx xxxxxxxxxx
1. Xxxxx xxxx xxxxxx o xxxxxxxx xxxxxxxxxx hodnocení předložena Xxxxxxxx xxxxxx pro xxxxxxxx léčiv přede xxxx, kterým uplyne 6 xxxxxx xxx xxx xxxxxxxxxx xxxxxxxx Xxxxxx v Úředním xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 odst. 3 nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) x. 536/2014 xx dne 16. xxxxx 2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x zrušení směrnice 2001/20/XX, xxxxxxx klinické xxxxxxxxx xx xxxxxx xxxx dosavadními xxxxxxxx xxxxxxxx, x to xx xxx, xxxxxx xxxxxxxx 42 měsíců xxx dne xxxxxxxxxx xxxxxx xxxxxxxx.
2. Pokud xxxx xxxxxx o xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx Xxxxxxxx ústavu pro xxxxxxxx léčiv po xxx, kterým uplynulo 6 měsíců xxx xxx zveřejnění xxxxxxxx Xxxxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 536/2014 xx dne 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x zrušení xxxxxxxx 2001/20/XX&xxxx; xxxxxxxxxx xxxx xx xxx, xxxxxx xxxxxxxx 18 xxxxxx xxx dne xxxxxxxxxx xxxxxx xxxxxxxx, xxx xxxxxxx řízení x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx klinické xxxxxxxxx xx xxxxxx xxxx xxxxxxxxxxx právními xxxxxxxx, a to xx dne, xxxxxx xxxxxxxx 42 xxxxxx xxx dne zveřejnění xxxxxx xxxxxxxx.
XXXX XXXXX
Xxxxx xxxxxx x xxxxxx službě
Čl. XXX
X §2 xxxxxx x. 234/2014 Xx., x xxxxxx xxxxxx, ve znění xxxxxx č. 131/2015 Xx., xxxxxx x. …/2016 Xx. x xxxxxx x. …/2016 Xx., xx xx xxxxx xxxxxxxx 1 xxxxx nahrazuje čárkou x doplňuje se xxxxxxx n), xxxxx xxx:
„x) xxxxx Xxxxxx xxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx.“.
XXXX TŘETÍ
Závěrečná xxxxxxxxxx
Xx. XX
Xxxxxxxxx xxxxxxx
Xxxxx xxxxx byl xxxxxxx x xxxxxxx xx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) 2015/1535 xx xxx 9. září 2015 x xxxxxxx xxx xxxxxxxxxxx xxxxxxxxx v xxxxxxx xxxxxxxxxxx předpisů x předpisů xxx xxxxxx informační společnosti, x xxxxxxx xxxxx.
Xx. V
Účinnost
Tento xxxxx xxxxxx účinnosti xxxxxx xxxx kalendářního měsíce xxxxxxxxxxxxx po xxx xxxx vyhlášení, s xxxxxxxx ustanovení
a) xx. X bodu 21, xxxxx xxx o §51, §52 x §53 xxxx. 2, xx. X bodu 22, xxxxx jde x §53x xxxx. 7, §53x xxxx. 1, 2, 3 x §53x xxxx. 1 xx 8, x xx. X xxxx 23, xxxxx xxxxxxxx xxxxxxxxx uplynutím 6 xxxxxx xxx xxx xxxxxxxxxx oznámení Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx unie xxxxx čl. 82 xxxx. 3 nařízení Evropského xxxxxxxxxx x Xxxx (XX) x. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků x x xxxxxxx směrnice 2001/20/XX; xxx, xxx xxxx toto xxxxxxxx xxxxxxxxxx, xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx sdělení xx Xxxxxx xxxxxx;
x) xx. X xxxx 21, xxxxx jde x §53 xxxx. 1, 3 a 4, a čl. X xxxx 22, xxxxx xxx o §53x xxxx. 1 xx 6, §53b xxxx. 4, 5 x §53x xxxx. 9, xxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxx následujícího xx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx (XX) x. 536/2014 ze dne 16. dubna 2014 x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx přípravků x x xxxxxxx xxxxxxxx 2001/20/ES; den, xxx bylo xxxx xxxxxxxx xxxxxxxxxx, oznámí Xxxxxxxxxxxx zdravotnictví formou xxxxxxx xx Sbírce xxxxxx;
x) xx. I xxxx 5, 7, 9, 28, 29 x30, xxxxx xxxxxxxx xxxxxxxxx prvním dnem xxxxxxxx kalendářního měsíce xxxxxxxxxxxxx xx jeho xxxxxxxxx.
XXXXXXX XXXXXXXXX ZPRÁVY XXX
|
Xxxxx xxxxxx xxxxxx: Xxxxx xxxxxx, xxxxxx xx xxxx xxxxx č. 378/2007 Sb., x xxxxxxxx x o změnách xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx o xxxxxxxx), xx znění pozdějších xxxxxxxx |
|
|
Xxxxxxxxxxx / zástupce xxxxxxxxxxxxx: Xxxxxxxxxxxx zdravotnictví |
Předpokládaný xxxxxx xxxxxx účinnosti: 28.5.2016 |
|
Xxxxxxxxxxxx práva XX: XXX (xxxxxxxx, xx. x xxxxx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014 ze xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků x o xxxxxxx xxxxxxxx 2001/20/XX) |
|
|
- uveďte xxxxxx xxxxxxxxx xxx xxxxxxxxxxxx: 28.5.2016 - xxxxxx, xxx xxx xxxxx xxx xxxxx xxxxxxxxx xxxxxxxxxxx předpisem XX?: XX |
|
|
2. Xxx xxxxxx xxxxxx |
|
|
Xxxxxxx xxxxx xxxxxx xxxxxx xx zajistit xxxxxxxx nařízení Evropského xxxxxxxxxx x Xxxx (XX) č. 536/2014 xx xxx 16. dubna 2014 o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxx xxxxxxxx 2001/20/XX x xxxxxxxxxx Xxxxx xxxxxxxxx prostřednictvím xxxxxx xxxxxx o xxxxxxxx. Xxxxx upravuje otázky, xxxxx xxxx xxxxxxxxx x. 536/2014 xxxxxxxxx xxxxx xxxxxxxxx upravit xxxx je xxxxxxx xxxx xxxxxxx je xxxxxxx. Xxxxx xx xxxxxxxxx xxxx, aby xxxxxx úprava x Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx provádění xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxx Evropskou xxxx xxxxxxxxx č. 536/2014. |
|
|
Dalším xxxxxxx cílem xxxxxx xxxxxx je xxxxx xxxxxx akutní nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů v Xxxxx xxxxxxxxx za xxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxx, x xx xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx přípravků pro xxxxxxx xxxxxxxx x Xxxxx republice x xxxxxxxxx xxxxxxxxxxx opatření xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx určených pro xxxxxxx xxxxxxxx x Xxxxx republice xx xxxxxxxxx (xxxxxxxx) x xxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx takových xxxxxxxx xxxxxxxxxx. Záměrem xx xxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx zásadu xxxxxxx pohybu xxxxx xxxxxxxxxx x xxxxxxxxxx Xxxxxxxx xxxx. |
|
|
Xxxx xxxxx xxxx xxxxxx xxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (EU) č. 1252/2014 xx xxx 28. května 2014 xxxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx x xxxxxx x xxxxxx xxxxxxx výrobní xxxxx xxx xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx, xxxx xxxxxxxx xxxxxxx předpoklady xxx xxxxxxxxxxxx spolupráci Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv x Xxxxxxxxxx ředitelstvím xxx xx xxxxxx xxxxxxxxxxxx xxxxxxx léčiv x xxxxxxxxx xxxxxxxxx x xxxx, účelněji upravit xxxxxxxxxxx inspektorů xxx xxxxxxxxx xxxxxxxx x xxxx zpřesnit xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx xxx, xxx xxxx xxxxxxxxxx x xxx takové xxxxxxx, xxx xx xxxxxxxx, xx s xxxx xxxxxxxxx osoby, xxxxx x xxxx xxxxxx xxxxx xxxxxx xxxxxxxxx. |
|
|
3. Xxxxxxxxxx dopady xxxxxx xxxxxx |
|
|
3.1 Dopady na xxxxxx xxxxxxxx x xxxxxxx xxxxxxx xxxxxxxx: XXX |
|
|
Xxxxxx xx státní xxxxxxxx Xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx Xxxxxxxx xxxxx xxxxxxxxxx xxxxxx za xxxxxx zajistit xxxxxxxx xxxxxxxx x klinických xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx na xxxxxx Xxxxxxxx xxxxxx xxx kontrolu léčiv xxx potřeby xxxxxxxxx xxxxxx xxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxxx (v xxxxx 32 úvazků). Xxxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxx xxxxxxxxxx xxxxx xxxxxx farmaceutických xxxxxxxxxxxx (5), xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx (2), xxxxxxxxxxxx xxxxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx (1) inspektorů (5), koordinátorů xxxxxxxxxx xxxxxxxxx (3), x xxxxxxxxxx zajištění xxxxxxxxx-xxxxxxxxxxxxx xxxxxx xxx xxxxxxx xxxxxx - xxx xxxxx 8 xxxxxx xxxxxx komise - 16 xxxxxx). Xxxx xxxxxx xxxxx xxxxxxxx xxxxx z xxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx (xxxxxx xxxxxx). Xxx finanční krytí xxxxxxxxxxx technického xxxxxxxxxxx xxxxxx systému xxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xxxx uvažovány z xxxxx xxxxxxxx prostředky x xxxxxx xxxxxxxxxxxx x XX fondů, x xxxxx xxxx xxxxx z xxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx. |
|
|
Xx xxxxxx Xxxxxxxxxxxx zdravotnictví xxxxxxx nová xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx rozhodnutí o xxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxx xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxxx referenta x jednu pozici xxxxxxxxx xxxxxxxxx. |
|
|
Xxxxxxx reexportů |
|
|
Finanční xxxxx xxxxxxxxxx xxxxxx xxxxxx xx xxxxxx xxxxxxx reexportů léčivých xxxxxxxxx xx státní xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx úvazků na xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx (2 úvazky - 1 xxxxxx xxxxxxxx x 1 xxxxxxx xxxxxxxx pro xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx). Xx straně Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv dojde x xxxxxxxx x 2 xxxxxxxx xxxxxx xx xxxxxx zajištění xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x České xxxxxxxxx x předávání xxxxxxxxxxx podnětů Xxxxxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxxxx xxxx |
|
|
Xxxxx ostatních xxxxxxxxxxxx novelizačních xxxx xxxxx xxxxxxxxx předpokládat. Xxxxx xx o xxxxx úpravy xxxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx (xxxx. xx xx xxxx xxxxxxxxxxx xxxxxxxxxx). |
|
|
Xxxxxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxxxx, xxxxxxx xx prostředky xxxxxxxxx xxxxxxxxxxx pojištění nelze xxxxxx odhadovat, xxxxx xxx xxxxxxxxxxxx, že xxxxx xxxxx bude xxxxx xxxxxxxxx. |
|
|
Xxxxxxx |
|
|
Xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx |
|
|
Xxxxxxxx xxxxxx xxxxxxxxx umožňující xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx k xxxxxxxxxxx Xxxxx xxxxxxxxx xxx xxxxxxxxx těchto xxxxxxxxx. Xxxxxx xxxxxxxxx xx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxx xxxxxx xx xxxxxxxxxx příslušných xxxxxxxxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx České republiky xxxxx xxxxxxx Xxxxx xxxxxxxxx ve xxxxx. Xxxxxxxxx xxxxxx lze xxxxxxxxxxxx x do xxxxx xxxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxx |
|
|
Xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxx o hrozící xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxx v xxxx xxxxxxxxx, xxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxx xxxxx významných xxxxxxxx xxxxxxxxx. Xxxxxxxx xxx xxxx efektivní xxxxxxxx xxxx xxxxx x xxxxxxxxx ohrožení xxxxxx. Navrhovaná xxxxxx xxxxxx přispěje ke xxxxxxxxxxx poskytované xxxxxxxxx xxxx, xx xxxxxx xxxx odpovědné členské xxxxx, xx xx xxxx zajištění xxxxxxxxxxx xxxxxxxx xxxxxxxxx. Zajištění xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx na xxxxxx xxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx takových xxxxxxxx xxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxxxx xxxx |
|
|
Xxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxx lze předpokládat x ohledem xx xx, že se xxxxx x xxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx (xxxx. xx xx xxxx prokazování xxxxxxxxxx). |
|
|
3.2 Xxxxxx na podnikatelské xxxxxxxx: XXX Xxxxxxxx xxxxxxxx xx xxxxxxxxxx hodnocení |
|
|
Nepředpokládají xx významné negativní xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx x oblasti xxxxxxxxxx xxxxxxxxx. Xxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxx xxxxxxxx nově xxxxxxxxxxxxx (xxxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx) x xxxxxxx xx změnám xxxxxxx xxxxxxxxx. Xxxxxxx xxx xxxx nutnost xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xx x xxxxxx xxxxxxxxxx xxxxxxxx, které však x převážné xxxxx xxxxxx xxx x xxxxxxxx. Náhrady výdajů xx xxxx xxxxxx xx xxxx xxx xxxxx celkovým xxxxxxxx xxxxxxx xxxxxx xx xxxxxxxxxx xxxxxxxxxx hodnocení, xxxxx xxxxxxx výdajů xxxx xxxxx jednou xxxxxxx xxxxxxxxxx xxx xxxxxxxxx Xxxxxxx ústavem xxx xxxxxxxx xxxxx, xxx xxxxxxx komisí (xxxx etickými xxxxxxxx). |
|
|
Xxxxxxx xxxxxxxxx |
|
|
Xxxxxxxxxxxxx se dopady xx xxxxxxxxxxxxx prostředí xx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx léčivých xxxxxxxxx oznamovat xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx trhv Xxxxx xxxxxxxxx xx xxxxxxxxx x xxxx v xxxxxxx potřeby xxxxxxxxxx xxxxxxxx xxxxxxxxx zdraví xxxxx xxxxxxxxxxx v xxxxxxx xxxxxxxxxx. Xxxxxx xxxxxxxxxx xxxxxx úpravy xx distributory xxxxxxxx xxxxxxxxx jsou xxxx xxxxxxxxxxxxxx zavedením xxxxxxxxxxx x xxxxxxxxxxxxxxx xxxxxxx. |
|
|
Xxxxxx xxxxx xxxxxxxxxx právní xxxxxx opatření xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx bude xxx na xxxxxxxx xxxxxxxxxx xxxxxxxx přípravků. Xxxxx xxxxx xxxx xxxxxxxxx x spočívá x xxxxxxxx povinnosti xxxxxxxxxxxx poskytování údajů x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx do Xxxxx xxxxxxxxx. X xxxxxxxx době je xxxxxxxx povinnost zákonem xxxxxxx, xxxxx xxxxxxxxxxx xxxxx xxxx x xxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx rámec. X konečném xxxxxxxx xxxx mít xxxxxx xxxxxx xxxxxxx reexportů x xxxxxxxxxx xxxxxxxxx xxxxxxxxx dopad na xxxxxxxx xxxxxxxxxx x xxxxxxxxxx. Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx k xxxxxxx na xxxxxxxxxx xxxx zemí XX. X jednotlivých xxxxxx XX xxxx xxxxxx xxxxx xxxxxxxxx maximální xxxx xxxxxxxx přípravků, xx které xx xxxxx xxxxxxxx na xxx xxxxxx. Xxxxxxxx xxxxxx při xxxxxxx xxxxxxx konkrétního xxxxxxxx xxxxxxxxx profitují xxxx xx xxxxxx x xxxxx xxxxxxx xxxxxxxx. Xxxxx xxxxxx xxxxxxxxx, xx držitelé xx xxxxxxxx xxxxx xx xxxx s nejvyšší xxxxxxx hladinou, xxxx xxxxxxx xx xxx xx xxxx xxxxxxxxxxxxx. Xxxxxxxxx distribucí xxxxxxx xx xxxxxx, xx xxxxxxx je xxxxxxxxxxxxx, x cenové xxxxxxx, xxx tato je xx úkor držitelů x xxxxxxxxxx ze xxxx xxxxxx: 1. Xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxx xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxxxx sám x xx vyšší xxxx; 2. pokud xx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx původně vlastní xxxxxx xxxxxxxxx x xxxx xxxx xx xxxxx cenu xxxx xxxx xxxxxx soutěž x dalšímu xxxxxxx xxxx takového léčivého xxxxxxxxx xx xxxxx xxxx xxxx xxxxx. Xxxxxx xx cenová xxxxxx xxxxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxx xxxxxx xx xxxx důsledky xx xxxxxxxx léčivých xxxxxxxxx. |
|
|
Xxxxxxx xxxxxxxxxxx body |
|
|
S xxxxxxx xx to, xx se xxxxxxx x xxxxxxxx xxxxx, xxxxx je zanedbatelný. |
|
|
3.3 Xxxxxx xx xxxxxx xxxxxxxxxxx xxxxx (xxxx, xxxxx): NE |
|
|
Nepředpokládají se xxxxx xxxxxx xx xxxxxx xxxxxxxxxxx xxxxx. |
|
|
3.4 Xxxxxxxx xxxxxx: XX |
|
|
3.5 Xxxxxx xx životní xxxxxxxxx: XX |
|
|
Xxxxxxxxxxxxxxx se xxxxx dopady xx xxxxxxx xxxxxxxxx. |
|
101) Nařízení Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) č. 1252/2014.“.
104) Xxxxxxxx Evropského xxxxxxxxxx x Xxxx (EU) č. 536/2014.“.
102) Xxxxx č. 227/2006 Sb., x xxxxxxx na xxxxxxxx xxxxxxxxxxxxx kmenových xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxx a o xxxxx xxxxxxxxx souvisejících xxxxxx, ve xxxxx xxxxxxxxxx xxxxxxxx.
103) Xxxxxxxxx xxxxxxxx xxxxxxx, xxxxxxx xxxxxxx, xxxxx č. 101/2000 Sb., xx znění xxxxxxxxxx xxxxxxxx.
Čl. 75 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 536/2014.“.
DŮVODOVÁ XXXXXX
OBECNÁ ČÁST
A. Xxxxxxxxx xxxxxx x xxxxxxxxx xxxxxx xxxxxxxx (XXX)
1. Xxxxx xxxxxxxxxx x xxxx
1.1. Název
Návrh xxxxxx, xxxxxx xx mění xxxxx č. 378/2007 Sb., o xxxxxxxx x x xxxxxxx některých xxxxxxxxxxxxx xxxxxx (zákon o xxxxxxxx), xx xxxxx xxxxxx x. 124/2008 Xx., xxxxxx x. 296/2008 Xx., zákona x. 141/2009Xx., xxxxxx x. 281/2009 Xx., xxxxxx x. 291/2009 Xx., xxxxxx x. 75/2011 Sb., xxxxxx x. 375/2011 Xx., xxxxxx x. 50/2013 Xx. a xxxxxx x. 70/2013 Sb.
1.2. Xxxxxxxx xxxxxxxx
X xxxxxxxx xxxx xx problematika xxxxxxxxx kvality, xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx upravena zákonem x xxxxxxxx x xxxx xxxxxxxxxxx předpisy. Xxxxxx xxxxxxxx xxxxxxxx xxxx xx xxxxxxxx xxxx České xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx x veterinárních xxxxx, xxxxx byla xxxxxxx x Xxxxxxxx unii xxxx vydáním tohoto xxxxxx.
Xxxxx x xxxxxxxx xxx xxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxx, xxxxxxx xx xx novelu xxxxxx xxxxxxxxxx xxxxxxx č. 70/2013 Sb. xxxxx o xxxxxx xxxxxxxxxx, xxxxx xx xxxxxxxx xxxxxxxx xx obsahu xxxxxx xxxxxxx x xxxxxxx xxx xxxxxx; xxx x xxxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxx xxxxx zákona dosud xxxxxxx x xxxxxxxx xxxxx.
Xxxxxxxxxxx návrh novely xxxxxx xxxxxxx podmínky x xxxx, xxx Xxxxx republika xxxx x xxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx systému Xxxxxxxx unie v xxxxxxx xxxxx, x xx především v xxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xx xxx xxxxx xxxxx xxxxxx xxxxxxx přispět k xxxxxxx xxxxxx a xxxxxxxxxx tohoto systému x k xxxx, xxx xxxxxxx xxxxxxxx xxxxxxxxxxxx a regulačních xxxxxxxxx xxxxxxxxx vývoj xxxxxx poznatků x xxxxxxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxxx záruk x oblasti xxxxxxx xxxxxxxxx xxxxxx x xxxxxxx bezpečnosti subjektů xxxxxxxxx ve xxxxxx x hodnoceným xxxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx.
1.2.1. Xxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx
Xxx 16. xxxxx 2014 bylo xxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (EU) č. 536/2014 o klinických xxxxxxxxxxx humánních xxxxxxxx xxxxxxxxx x o xxxxxxx xxxxxxxx 2001/20/ES. Xxxxx článku 99 xx xxxx xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxx po xxxxxxxxxx xxxxxxxx xxxxx xx. 82 xxxx. 3, xx. oznámení Xxxxxx, xx byly xxxxxxx xxxxxxxx xxxxxxxxxxx x xxx, že xxxxxx XX x xxxxxxxx XX xxxxxxx xxxx xxxxxxxxxx x systémy xxxxxxx stanovené funkční xxxxxxxxx. X xxxxxxxxxx xx. 99 xxxxxxxx xx xxxx xxxxxxxxx, xx x žádném xxxxxxx xx xxxx xxxxxxxx nepoužije dříve xxx 28. xxxxxx 2016. Lhůta pro xxxxxxx nařízení xx xxxx xxxxxxxxx variabilně x závislosti xx xxx, kdy xxxxx x xxxxxxxx Komise. X každém xxxxxxx xx xxxx xxxx xxxxxxxx xxxxxxx xxxxxxxx xxx 28. května 2016. X xxxxxxx xx xxxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxx v xxxxxxxxxxx xxxxxx xxxxxx zákona x léčivech xxxx xxxxxxxx záležitosti týkající xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xx x xxxxxxx x xxxxxxxxx xxxxx adaptovat.
Přijetí xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx (XX) č. 536/2014 xxxx xxxxxxxxxx tím, xx, jak xxxxx xxxxxxx, xxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxx klinických xxxxxxxxx, x xxxxx xxxxxxxxx xxxxxxxx 2001/20/ES, xxxx v xxxxxxxxx xxxxxxx dosaženo xxxxx xxxxxxxx, xxxx xx xxxxxxx členské státy xxxxxxx xxxxxxxxx xxxxxx xxxxxx x xxxx, xxx tato xxxxxxxx xxxx xxxxxxxxx způsobem x xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx, x xxxxxx xxxxxxxxx provádění xxxxxxxxxx xxxxxxxxx mnohdy xxxxxxxxxx xx xxxxxxxxx xxxxxxxx 2001/20/ES.
Xxxxxxx xxxxx xxxxxx xxxxxxxx, xx xxxxxxxx hodnocení se x xxxxxxxxxxx budou xxxxxxxxx na xxxxxxxxxxxxx xxxxxxx xxxxxxxx, xxxx xxxx podskupiny xxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxx informací. Xxx bylo možné xx xxxxxx xxxxxxxxxx xxxxxxxxx zahrnout xxxxxxxxxx xxxxx xxxxxxxx, xxxx xxxxxx xx xxxxx xxxxxxx xxxx členských xxxxx xxxx xxxxxxx xxxxxxx. Tyto xxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxx xxxxxxxxxx xxxxxxxx xx xxxxx největšího xxxxx xxxxxxxxx xxxxx. Proto xx xx x xxxxx xxxxxxxxxxxx postupů xxxxxxxxxxx xxxxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxxxxx předkládání xxxxxxxx identických informací, xxxxx xx xxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx k xxxxxxx xxx všechny xxxxxxx xxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxx předkládání. Xxxxxxxx x tomu, xx xxxxxxxx xxxxxxxxx prováděná x jediném xxxxxxxx xxxxx xxxx z xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx stejný význam, xxxx by xx xxxxxxxxxxx x xxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx také xxxxxxxxxxxxxxx xxxxxx jednotného xxxxxxx.
Xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014 xxxxxxxxx xxxxxx x toho, že xxxxxxx xxxxxxxx xxxxxxx, xx právní xxxxx xxxxxxxx by byla xxx zadavatele x xxxxxxxxxx xxxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxx, xxxxx xx xxxxxxxxx xx více xxx x jednom xxxxxxxx xxxxx, protože xx xx xxxxx xxxxxx xxxxx o jeho xxxxxxxxxx xxx samotném xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx xxxx při xxxxxxxx xxxxx x xxxxxxxxxxx a xxx xxxxxxxxxx xx xxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx. Xxxxxxx xxxxx xxxxxxxx xx xx xxxxxx, xx xxxxxxx x xxxxxxxx mezi xxxxxxxxxxxx xxxxxxxxx státy xx xxxxx xxxxx xx xxxxxxx x měla xx vést x x efektivnější xxxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení. Xxxx xxxxxxxxxx xx xxxxxx zahrnovat xxx xx xxxxxxx, které xxxx ze xxx xxxxxxxx xxxxxxxxxxxx povahy, xxxx xx například xxxxxxx x xxxxxxxxx xxxxxxxx komisí. Xxxxxx xxxxxxxx xxxxxxxxx xx xxx být xxxxxx x efektivní, aby xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxxxx při xxxxxxxx xxxxxxxxxx hodnocení, xxxxx xxxx xxxxx xxxxxxx xxxxxxxxxx xxxxxxxx nebo xxxxxxx xxxxxx.
Xx xxxxx xxxxxx xxxxxx tedy xxxxx Xxxxxxxx xxxxxxxxx x Xxxx k xxxx, xx upraví xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx léčivých přípravků xxxxx xxxxxxxxxxx předpisem XX v celé xxxx xx xxxxxxxxxxxxxx x xx xxxxxxx xxxxx xxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx, při xxxxxxx xxxxxx xx xx xxxxx zohlednit xxxxxxx xxxxxxxxx.
Xxxxxxx nařízení Xxxxxxxxxx parlamentu x Xxxx (XX) č. 536/2014 xx v České xxxxxxxxx xxxxx použitelné x xxxxx xxxx xxx dalšího xxxxx, xxxx xxxxx xxxx xxxxx x xxxxxxx xxxx České republiky xxxxxxxx, xxxxxxxxxxxx xx xxxxx xxxxxxxxxx. Xxxxxxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx x xxxxxxxxxx xx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014 xx zaměřuje xx xxxxxx xxx xxxx xxxxxx, jejichž xxxxxx ponechává xxxx xxxxxxxx na xxxxxxxxx xxxxxxx. Jde především x následující xxxxxx xxxxxx.
Xx xxxxxxxx xxxxx xx x prvé xxxx xxxxxxxxx, aby xxxxxxxx xxxxxxxxx orgán xxxx orgány, xxxxx xx xxxxx xx xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, x xxx xxxxxxxx xxxxxxxx etických xxxxxx xx xxxxxxx xxxxxxxxxxx x nařízení xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxx rozhodnutí xxxx být xxxxxxxxxxx xxxxxxx xxxxxxxxxx každého xxxxxxxxx státu. Xxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxx orgánů xx xxxxxxx stát xxxxxxxx xxxxxxxx xxxxxxxx xxxx, x xx xxxxxxx xxxxxxxx nebo xxxxxxxxxx xxxxxxxx. Xxxxxxxxx xx xxxxxx xxxx xxx xxxxxxxxx společně xxxxxxxxxx xxxxxx osob, které xxxx xxxxxxxxx xxxxxxxxxxx x zkušenosti x xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxxxx xxxxxxxxx, přičemž xxxxx posuzující žádost xx měly být xxxxxxxxx xx xxxxxxxxxx, xxxxx xxxxxxxxxx hodnocení x dotčených zkoušejících x xxxxxx xx xxxxxx být xxxxxxxxx xxxxxx xxxxx xxxxxxxxxxx xxxxxx. X rámci xxxxxxx členského xxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx se xxxxxxxxxx xxxxxxxxxx hodnocení. Xxx xxxx xxxxx xxxxxxxxx x xxxxxx xxxxxxxxxx mezi xxxxxxxxx xxxxx, xxx xx xxxxx členský stát xxxxx jedno xxxxxxxxx xxxxx.
Xxxxxx okruhem, jehož xxxxxx je xxxxxxxxx xx členském xxxxx, xxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxx by xxx xxxxx jazykové xxxxxxxxx xx dokumentaci xxxxxxxxxx xxxxxxxxx. Xxx xx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx posuzování xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx, měl xx xxxxxxx xxxx xxxxxx, že xxxx xxxxx xxx dokumentaci, xxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxxxx srozumitelný jazyk x xxxxxxx xxxxxxxxx.
Xxxxxxxxx xxxxx xx ponechávají x xxxxxx xxxxxx xxxx pravidla týkající xx určení zákonně xxxxxxxxxxxx zástupců xxxxxxxxxxxxx x nezletilých osob, xxxxx se x xxxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx.
Xxxxxx xxxxxx pro xxxxxxx svobodné x xxxxx xxxxxxxxxxx rozhodnutí xxxxx xxxxxxxxx se xxxxxxxxxx xxxxxxxxx má xxxxxxxxxxx předchozího xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx. Xxxxx xxxxxxx xx xxx být xxxxxxxx xxxxxx xxxxxxxxxx xxxx xxxxxxx způsobilým xxx xxxxx úkol xxxxx xxxxxxxxxxxxxx právních xxxxxxxx x členském xxxxx, v němž xxxxx probíhá.
Dále xx xxxxxxxxx členskému státu xxxxxxx, xxx xx xxxxxxx, xx kromě xxxxxxxxxxxxx souhlasu daného xxxxxxx ustanoveným xxxxxxxxx xxxx vyžadovat, xxx xxxxxxxxx xxxxx, xxx xx xxxxxxx utvořit xx xxxxx a xxxxxxxx xxxxxxxxx jí xxxxxxxxxx, také sama xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xx xxx xxxxxx xx xxxxxxxxx xxxxxxxxx.
Xxxxxxx xxxx xx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx xxxxxxxxxxxx nebo xxxxxxxx xxxxxxxxxx. Jde x xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx službu, xxxxx xxxxxxx xxxxxxx, xxxxx, xxxxx se x xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx účastnit xxxxxxxxxx xxxxxxxxx, x xxxxx, které xxxx xxxxxxxx ke xxxxx xxxx, zdravotnímu postižení xxxx xxxxxxxxxxx xxxxx xxxxxxxx xx xxxx, x xxxxx xx xxxxxxxxx x xxxxxxxxxx xxxxxxx péče.
Členskému xxxxx xx dále xxxxxxxxx xxxxxx xxxxxxxx otázek, xxx x xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxx způsobená xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxxxxx či trestněprávní xxxxxxxxxxxx zadavatele nebo xxxxxxxxxxxx. Xxxxxxxx xxx xxxxxxxxxxx x xxxxxx xxxxxxxxx, včetně xxxxxx xxxxxxxx souvislosti a xxxxxx škody, xx x nadále xxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxx by xxx dále zajistit xxxxxxxx xxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxxxxxx xxxxxx x xxxxxxx rizika, přičemž xxxxx xx, aby xxx xxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxx x souladu x xxxxxxxxxxx xxxxxxxxxxxxxx právními xxxxxxxx.
Xxxxxxxxx xxxx má x xxxxxx členský xxxx x xxx, xx xx xx xxxxxxx pravomoc xxxxxxx xxxxxxxx xxxxxxxxxx hodnocení, xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxx u xxxxxxxxxx změnu klinického xxxxxxxxx. Členský xxxx xx zajistit xxxxxx xxx průběhem xxxxxxxxxx xxxxxxxxx. Xxx xxx xxxxxxxx xxxxxx x xxxxxxxxx, členský xxxx xx xxxx xxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxx x k xxxx by měl xxx xxxxxxxxxxxx inspekční xxxxxxxx. Xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x nařízení xx xxxxxxxx xxxxxx umožněno xxxxxxx poplatky, jejichž xxxxxxxxx xx xxxxxxxx x článku 86 x 87 nařízení (xxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx, částka xxxx xxx xxxxxxxxx xx xxxxxxx xxxxxx úhrady xxxxxxx, xxxx být xxxxx jedna xxxxxx xx posouzení).
Dále xx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx nekomerčními xxxxxxxxxx, xxxxxxx se xxx xxxxx zákona o xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx zřízení xxxx xxxxxxxx státem xxxx xxxxxxx xxxxxxxxxxxx xxxxxx, xxxxxxx vysoká xxxxx a veřejná xxxxxxxx xxxxxxxxx, x xxxxx xxxxxxxxxxx využití xxxxxxxxxx příspěvku těchto xxxxxxxxxxxx zadavatelů a xxxxx xxxxxxx xxxxxx xxxxxxx, xxxx xx xxxxxxxxx x xxxxxxxx xxxxxxx klinických hodnocení. Xxxx xxxxxxx x xxxxxxxx zkušeností, xxxxx xxxxxxxxxx x xxx, xx velká část xxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxxx spoléhají xx finanční xxxxxxxxxx, xxxxx xxxxxxxxx, a xx xxxxxx nebo xxxxx, x veřejných xxxxxxxxxx xxxx z xxxxxxxxxxxx sbírek.
V xxxxxxxxxx xx xxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx č. 536/2014 xxxxxxxxxxx xxxxx novely xxxxxx x léčivech sleduje xxxxxxxxx xxxxxx xxx, xxxxx xxxxxxx v xxxxxxxx toho, xxx xxxxxx xxxxxx x Xxxxx republice vhodně xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx humánních xxxxxxxx přípravků založený xxx celou Evropskou xxxx nařízením Evropského xxxxxxxxxx x Rady č. 536/2014. Xxxxx xx xxxxx xxxxxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx, xxxxxxx úprava xx xxxxxxxxx státu svěřena, xxx úprava xxxxxxxx x xxxxxxxx a x zákoně společně xxxxxxxxxxx náležitý xxxxxx xxxxxx pro optimální xxxxxxxxx xxxxxxxxxx xxxxxxxxx.
Xxxx xxxxx identifikovány xxxxxxxxxxx xxxxxxxx:
Xxxxx republika, jakožto xxxxxxx xxxx, musí xxxxxxxx xxxxxxxxxxx xxxxxxx:
- xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx, xxxxx xx budou xx xxxxxxxxx žádosti x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx, zajistit xxxxxxxxx xxxxxxx komisí xxx xxxxxxxx xxxxxxxx xxxxxxxx x osobách xxxxxxxxxxxx xxxxxx, xxx. xxxxxxxx xxxxxxxxxxx xxxxxx komise xx xxxxxxxxxx, xxxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx, a zajistit xxxxxxxxxx xxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxxxx x xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx;
- xxxxxx vytvoření a xxxxxxxx systému náhrady xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx x xxxxxx xxxxxx xx xxxxxx xx xxxxx xxxxxx xxxxxxxxx xxxxx;
- záležitosti xxxxxxxx;
- pohovor s xxxxxxxxxxxx subjektem xxxxxxxxx xx měl xxx xxxxxxxx xxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxx tento xxxx xxxxx vnitrostátních právních xxxxxxxx x xxxxxxxx xxxxx, x němž xxxxx xxxxxxx;
- xxxxxxxxxx, xxx kromě informovaného xxxxxxxx daného zákonně xxxxxxxxxxx xxxxxxxxx bude xxxxxxxxxx, xxx nezletilá xxxxx, xxx xx xxxxxxx xxxxxxx si xxxxx a posoudit xxxxxxxxx xx xxxxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxx písemného souhlasu xx své účasti xx klinickém xxxxxxxxx;
- xxxxxxxxxx, xxx xxxxx xxxxxxxxx doplňková ochranná xxxxxxxx xxxx xxxxxxx xxxxxx, které xxxx x xxxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx;
- xxxxxxxx xxx xxxxxxxxxxx x xxxxxxxxx škody xxxxxxxxx xxxxxxxx hodnocení xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxx xxxxx, se i xxxxxx xxxx řídit xxxxxxxxxxxxxx předpisy;
- členskému xxxxx xx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx, pozastavit xxxxxxxx xxxxxxxxx xxxx xxxxxxx x zadavatele xxxxx xxxxxxxxxx xxxxxxxxx; xxxxxxx xxxx má xxxxxxxx dohled xxx xxxxxxxx klinického hodnocení; xxx xxx xxxxxxxx xxxxxx s nařízením, xxxxxxx stát má xxxx xxxxxxxxx a xxxxxxxxx xxxxxxxx xxxxxxxx x k xxxx xx xxx xxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx; xx xxxxxx provádění xxxxxxxx stanovených v xxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxx vybírat xxxxxxxx;
- rozhodnout o xxxxxxx opatření xx xxxxxxx klinických hodnocení xxxxxxxxxxx nekomerčními xxxxxxxxxx x zájmu maximálního xxxxxxx xxxxxxxxxx příspěvku xxxxxx xxxxxxxxxxxx zadavatelů x další podpory xxxxxx xxxxxxx.
X xxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx:
X xxxxxxxx době xx xxxxxx úprava xxxxxxxxxx xxxxxxxxx x xxxxxx o xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxx x návaznosti xx xxxxxxxx EU xx xxxxxxxxx xxxxxxxxxx. Xxx xxxx popsáno xxxx, xxxxxxxxx xxxxxx xxxxxxxxxxx xxxx xxx XX xxxxxxxxxx a x toho xxxxxx xxxx xxxxxxxxxx x xxxxxxx xxxxxxxx. Xxxxx xxxxxxxxxxxx xxxxxx xxxxxx, xxxxx by xxxx xxxxxxxx xxxxxxxxxx, x xxxx xxx xxxxx x xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx.
1.2.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxx xxxxxxxx xxxxxxxx xxxxx xxxxx xxx xxxxxx xxxxxxxxx xx zákonem xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxx území Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx přípravků xxx xxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxxxx xxxxx Xxxxxxxx unie, xxx xxx do xxx. xxxxxxx xxxx. X xxxxxxx distribuce xxxxxxxx xxxxxxxxx xx třetích xxxx xx xxxxxxxxx xxxxxxx xxxxxxxx stanovená xxxxxx Xxxxxxxx xxxx. Xxxxxxxxxxxx xx zahraničí xxx lze podle xxxxxxxx xxxxxx úpravy x léčivé xxxxxxxxx, xxxxx jsou od xxxxxxx xxxxxx k xxxxxxx x rámci Xxxxx xxxxxxxxx. Xxxxxxxx xx ale stanoveno x xxxxxx x xxxxxxxx, xx držitelé xxxxxxxxxx x xxxxxxxxxx xxxx xx povinnost xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxx xxxxxxx xxxxxxxx x Xxxxx republice. Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxx dodávat xx xxx v Xxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxx odpovídají xxxxxxxxx, xx xxxxxxx xxxx xxxxxx Státním xxxxxxx xxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx EMA xxxxxxxxxx x xxxxxxxxxx, x jsou xxxxxxxx x xxxxxx xxxxxx. Xxx xxxx jednoznačně x balení, která xxxx od xxxxxxx xxxxxx x použití xxxxxxxx v České xxxxxxxxx a xxxxxx x jiné xxxx. Xxxxxx přípravky musí xxx x každé xxxx xxxxxxxx x xxxxxxxxxx jazyce xxxx xxxx. Xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx pak xx xxxxxxx x xxxxxxx xxxxxxx xxxxxxxx x České xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxx.
Xxxxxxxx léčivých přípravků x rámci Evropské xxxx, xxxxx xxxxxxxxx xxxxxxxxxx držitelé rozhodnutí x xxxxxxxxxx, xxxx xxxxx souběžně s xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxx léčivých xxxxxxxxx - xxx x xxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxx xxxxxx evropskou xxxxxxx agenturou EMA xx x xxxxxxxx xxxxx x léčivých xxxxxxxxx, xxxxxx xxxx xxxxxx xxxxxxxxxx x xxxxxxxxxx Státním xxxxxxx xxx xxxxxxxx xxxxx. X xxxx xxxxxxxxx xx ale xxx xxxxxxx xxxxxxxx xxxxxxxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxx přípravků na xxxxxxxxx trh xxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx v xxxx xxxxxxx zemi Xxxxxxxx xxxx.
Xxxxxxx xxx xxxx aktivity xx xxxxxxx nižší xxxx xxxxxxxx xxxxxxxxx x „xxxxxxxx xxxxxxx xxxx“, xx xxxxx jsou xxxxxx xxxxxxxxx xxxxxxxx xx xxxx xxxxxxx xxxx, xx xxxxx xx xxxx xxxxxx xxxxxxxx xxxxxxxxx vyšší.
Tzv. xxxxxxxx xxxxxx je xxxxxxx x prováděn x xxxxxxx x xxxxxx Xxxxxxxx xxxx, xxxxxxxxx xx xxxxxxx xxxxxxx xxxxxx zboží xxxxxxxxx xxxxxx 34 x 35 Xxxxxxx x fungování Xxxxxxxx xxxx. Xxx judikatury Xxxxxxxxxx xxxxxxxx xxxxx xx zásada volného xxxxxx xxxxx xxxxxxx xxx xx xxxxxx xxxxxxxxx. Česká republika xx x ohledem xx účinnou xxxxxxxx xxx léčivých xxxxxxxxx xxxxxxx „xxxxxxxxx zemí“ x xxxxxx xxxxxxxxx xxxx tak x xxxxxx xxxx xxxxxxxx (xxxxxxxxxxxxx) ve xxxxxxxxxx xxxxxxxxxx.
Xx paralelním vývozu xxxxxxxx přípravků xx x Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxx x distribuci, x xxxxxxxxxxxx léčiv. X xxxxxxxxxx mimo xxxxx Xxxxx xxxxxxxxx xxxxxxx xxxxxxx z xxxxxx xxxxxxx stanovených xxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxx Evropské xxxx x tato xxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xx xx xxxx xxxxxxxxxx. Xx druhou xxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxxx xxx xxxxxxxx xxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx xxxx xx Xxxxx xxxxxxxxx. Na xxxxxx xx souběžného xxxxxx x xxxxxxxx xxxxxxxxxx, xxxxx xxxx x zákoně x xxxxxxxx x xxxxxxxxxx Xxxxxxxx xxxx xxxxxxxxx xxxxxx a jednoznačná xxxxxxxx a xxxxxxxx, xx xxxxxxx xxxxx xxx realizovány, není xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxx Xxxxxxxx xxxx xx xxxx xxxxx xxxxxx xxxxxxxxx xxxxx prakticky xxxxx xxxxxxxxxx.
Xxxxxxxxxxxx xxxxxxxxx xxxxx, xxx je xxx xxxxxxxx xxxxxx xxxxx x praxi xxxxxxxxx, xx komplexního xxxxxxxxxx x x xxxxxxxx xxxxxxxx xxxx xxx xxxx xx xxxxxxxxxxx xxxxxxxxx xxxx v Xxxxx xxxxxxxxx xxx x xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx léčiv xxx pacienty, xxx x xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx vlivu xx výrobce xxxxx xxxx ve xxxxxxxxx xxxxxxxxx systému veřejného xxxxxxxxxxx xxxxxxxxx x xxxxxxx, xx xxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxx.
Xxxxx xxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxxx xxxxx XX, xx xxxxxx xxxxxxxxx xx zajištění xxxxxxxxx xxxx na xxxx území. Xxxxxx x xxxxx xxxxxxxxx xxxxxxxxx péče xx xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx. X souladu x čl. 81 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX ze xxx 6. xxxxxxxxx 2001 x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx přípravků, xx xxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x Xxxx 2004/27/ES xx xxx 31. března 2004, mají xxxxxxxx xxxxxxxxxx x registraci xxxxxxxx přípravku x xxxxxxxxxxxx léčivých přípravků xxxxxxxxx xxxxxxxx odpovídající x stálé xxxxxxx xxxxxx léčivého xxxxxxxxx xxxxxxxx a xxxxxx xxxxxxxxx xxxxxxx léčivé xxxxxxxxx tak, aby xxxx xxxxxxx xxxxxxx xxxxxxxx v xxxxx xxxxxxxx xxxxx. Tato xxxxxxxxx xxxx implementována xx xxxxxxxxxx xxxxx xxxxxx x léčivech, xxxxxxxxx do ustanovení §33 xxxx. 3 xxxx. x) xxxx 3, xxxxx xxx x držitele xxxxxxxxxx x registraci, a xx ustanovení §77 xxxx. 1 xxxx. x), pokud xxx x distributory. Xxxxxxxxxx xxxxxxxxxxxx xxx ustanovení §77 odst. 3 xxxxx x xxxxxxx, xx xx zároveň xxxxx o provozovatele xxxxxxx, xx xxxxxxx xxxxxxxxx x xxx, xxx xxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxxxx xxxxxxx xxxx xxxx xxxxxxxxxxx.
Xx xxxxxxx xxxxxxxxxx xxxxxxx xxxx xx xxx podílejí xxxxxxxx xxxxxxxxxx o xxxxxxxxxx x xxxxxxxxxxxx léčivých xxxxxxxxx. Xxxxxx xxxx xxxxxxx x xxxxxxxx, xxx xxx xxxxxxx xxxxxxxx v České xxxxxxxxx xxxxxx dostupné xxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xx Xxxxx xxxxxxxxx xxxxxxxxx registrace xxxxxx za xxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxx v ustanovení §33 xxxx. 3 xxxx. g) xxx 3, xxx následně xxxx x xxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxx x ČR, ale xx xxxxxxxxx xx xxxxxxxx výhodnějších xxxxxxxxxx xxxxxxxx.
Xxxx proto xxxxxxxxxxxxxx xxxxxxxxxxx problémy:
Z xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx:
- xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx x přímým xxxxxx na jejich xxxxxx (x některých xxxxxxxxx xx může xxxxxx x x xxxxx ohrožující xxxxx);
- xxxxxxxxxxxx xxxxxxxxx legislativní xxxxxx xxxx xxxxxx.
X xxxxxxxx právní xxxxxx xxxx identifikovány xxxxxxx xxxxxxxxxxx problémy:
Dosavadní xxxxxx xxxxxx, dle které Xxxxxx ústav pro xxxxxxxx xxxxx xxxxxxxxxxx xxxx od distributorů, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx x xxxxxxx xxxx xxxxxxxxxx xxxxxxxxx x efektivní tak, xxx umožňovala definovaný xxxxxxx řešit xxxxxxxxx x skutečně xxxxxxxxx. Xxxx zásadní se xxxx:
- xxxxxxxxx xxxxxxxxx xxxxxx problematiky;
- otázka xxxxxx.
1.2.3. Xxxxxxxx xxxxxxxx xx vztahu k xxxxxxx látkám xxx xxxxxxx xxxxxx přípravky
Dalším xxxxxxxxx, xxxxx xx xxxx navrhovaná xxxxxx xxxxxx xxxxx, xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx pravidla xxxxxxxxx x léčivými xxxxxxx xxxxxxxx xxxxxxxx na xxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 ze xxx 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/ES, pokud xxx x zásady x xxxxxx xxxxxxx xxxxxxx xxxxx pro xxxxxx xxxxx pro xxxxxxx xxxxxx xxxxxxxxx. Xxxx xxxxxxxx se xxxxxxxx xxxxx xx xxxxxx xxxxx pro xxxxxxx xxxxxx přípravky. Xxxxxxxxxx §70 zákona x léčivech xxxxxxx, xx xxxxxxx léčivé xxxxx je xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxxx prováděcím xxxxxxx xxxxxxxxx. Xxxxxxxx xxxxxxx výrobní praxe xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx. Xxxxxxxx xxxx xxxxxxxxx jak xxx xxxxxx xxxxxxxx látek xxx xxxxxxx léčivé xxxxxxxxx, tak x xxx xxxxxx léčivých xxxxx xxx hodnocené xxxxxx xxxxxxxxx, x xxxxxx xxx výrobu xxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxxxx. Xxxx se xxxx xxxxxx xxxxxx xxxxxxx xxxxxxx praxe xxxxxxxx xxxxx pro xxxxxxx xxxxxx xxxxxxxxx, xxx xx xxxxxxx pokynem xxxxxxxxx x hlavních xxxxxx nařízením. Xxxxx xx xxx xxxxx xxxxxxxxxx xxxxxxxxx. Nařízení xx bez xxxxxxx xxxxxx xx všech xxxxxxx XX. Xxxxxxxxx xxxxxx úpravu xxxxxxxxx x xxxxxx x xxxxxxxx je nutno xx xxxxxx x xxxxxxx xxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxx ve xxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxx xx xxxx xxxxx xxxxxxxx xxx xxxxxx látky pro xxxxxxxxxxx xxxxxx xxxxxxxxx.
1.2.4. Xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxx by xxxxxxxxxx xxxxxx xxxxxx měla xxxxx jeden xx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx, který xx vskutku xxxxxxxx xxxxxxxxxx řešení. Jde x xxxxx xxxxxxxxxxxx xxxxxxxxxx právní xxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx x Xxxxxxxxxx xxxxxxxxxxxx xxx, xxxxx xx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx k xxxxxxxxxxxxx naplnění xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2011/62/EU, kterou xx xxxx xxxxxxxx 2001/83/XX x kodexu Xxxxxxxxxxxx xxxxxxxxx se xxxxxxxxx léčivých přípravků, xxxxx jde x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx řetězce. Xxxxxxxx xxxxxx úprava xx měla významným xxxxxxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx Xxxxxxxxxx xxxxxxxxxxxx cel x Xxxxxxx ústavem xxx xxxxxxxx xxxxx x oblasti léčivých xxxxxxxxx, xxx xxxx xxxxxxxx xxxxx, xxxxxxx xxxxx xx xxxxxxx xxxx xx xx xxxxxx EU xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxxx. Xxxx xxxxxxxxx výměně xxxxxxxxx x následné xxxxxxxxxx xxxxx obou xxxxxx státní xxxxxx xx možné xxxxxxxx xxxxxxx xx vstupu xxxxxxxx xxxxxxxxx a xxxxxxxx xxxxx, které xxxxxxxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxx x xxxxxx XX.
1.2.5. Xxxxxxxxxxx xxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx
X xxxxx xx ukázala xxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxx xxxxxx inspekční xxxxxxxx xx základě xxxxxxxxxx vymezených Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxx právními xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxxx a xxxxxxxxx x xxxx, x xxxxxxxx institutů xxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxx xxxxxx xxxxxxxx situací, xxx xx xxxxxxxx, xx x xxxxxxxx přípravky xxxxxxxxx xxxxx, xxxxx x xxxx xxxxxx xxxxx xxxxxx oprávněny. X zájmu ochrany xxxxxxxxx zdraví xx xxxxx tyto xxxxxx xxxxxxxxx xxxxxxxx xxx, xxx xxxx xxxxxxxxxx x pro takové xxxxxxx. Xxxxx xxx xxxxxxxx xxxx.
1.3. Xxxxx xxxxxxxxxxxx xxxxxxxx stavu x xxxx xxxxxxx
1.3.1. Xxxxxxxx nařízení x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxx právní xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx xxxxx:
- xxxxx č. 378/2007 Sb., o xxxxxxxx x x xxxxxxx xxxxxxxxx souvisejících xxxxxx (xxxxx x xxxxxxxx), xx znění xxxxxxxxxx xxxxxxxx,
- vyhláška č. 226/2008 Sb., x xxxxxxx xxxxxxxx xxxxx x xxxxxxxx podmínkách klinického xxxxxxxxx léčivých xxxxxxxxx,
- xxxxxxxx č. 229/2008 Sb., x xxxxxx a xxxxxxxxxx xxxxx,
- xxxxxxxx č. 84/2008 Sb., x xxxxxxx xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxxxx xxxxxxxxx x léčivy x xxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxx x x xxxxxxx xxxxxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx, xx xxxxx xxxxxxxx x. 254/2013 Xx.,
- xxxxxxxx č. 427/2008 Sb., x stanovení xxxx xxxxxx xxxxxx za xxxxxxx xxxxx xxxxxxxxxx x působnosti Xxxxxxxx xxxxxx xxx kontrolu xxxxx a Xxxxxx xxx státní kontrolu xxxxxxxxxxxxx biopreparátů x xxxxx, xx znění xxxxxxxxxx předpisů.
- vyhláška č. 228/2008 Sb., o registraci xxxxxxxx přípravků, xx xxxxx xxxxxxxxxx xxxxxxxx
Xxxxxx xx xxxxxx Xxxxxxxx xxxx xxxxxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014, xxxxx xx xxxxxxx xxxxxxxx xxxx 28. xxxxxx 2016. Xxx xxx xxxxxxx xxxxxx xxxxxxxx xx zrušuje xxxxxxxx 2001/20/XX, xxxxx xx xxxxxxxxxxxxx x xxxxxx o léčivech. Xxxxx použití xxxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxx xx xxxxxxxx x přechodných xxxxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 536/2014, která xxxx xxxxxxxx v xxxx xxxxxx 98.
1.3.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
X xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx x Xxxxx xxxxxxxxx xx v xxxxxx x xxxxxxxx xxx upravena xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx orgánů x xxxxxxxxxxxxx.
Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx mají xxxxxxxxxxx §33 odst. 3 písm. g) xxxx 3 xxxxxx x xxxxxxxx stanovenu xxxxxxxxx zajistit xx xxxxxxx léčivého xxxxxxxxx xx oběhu xxxxxx xxxxxxxxx xxx potřeby xxxxxxxx v Xxxxx xxxxxxxxx jeho dodávkami x xxxxxxxxxxxxx množství x xxxxxxxx xxxxxxxxxxx. Xxxxx o léčivech xxx xxxxxxxx xxxxxxxxxx x registraci xx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxx v xxxxxx pokuty. Držitelé xxxxxxxxxx xxxxxxxx xx xxx v xxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxx a x xxxxxxx xx x rozhodnutím x xxxxxxxxxx xxxxxxx Xxxxxxx, xxxxxxxx evropskou lékovou xxxxxxxxx XXX. Jde xxxx jednoznačně o xxxxxx, která držitel xxxxxxxxxx xxxxx určil xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxx x xxxx zemi. Xxxxxx xxxxxxxxx xxxx být x xxxxx xxxx xxxxxxxx x xxxxxxxxxx xxxxxx dané země. Xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx pak xx xxxxxx k xxxxxxx xxxxxxx výhradně xxxxxxxx x České xxxxxxxxx.
Xxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xx x xxxxxxx s xxxxxxxxxxx §33 odst. 2 xxxxxx o léčivech xxxxxxxxx oznamovat Xxxxxx xxxx xxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx xxx x České xxxxxxxxx. I xx xxxxxxxx xxxxxx svých xxxxxxxxxx xxxxxxx xxxxx x xxxxxxxx xxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx sankci xx xxxxx xxxxxx. Pokud xx xxxx Ústav xxxxx xxxx xx xxx xxxxxx xxxxxxxx xxxxxxxxxx, xx držitel xxxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxx přípravků xxxxxxxxxx, xxxx xxxxxxxxxx xxxxxxxxx nebo xxxxxxxx xxxxxx dodávek, pak xxxxxxxx x těmito xxxxxxxx xxxxxxx xxxxxx x správním deliktu x xxxxx xxxxxx. X xxxxxx 2012-2015 Xxxxx xxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx rozhodnutí o xxxxxxxxxx 67 pokut x xxxxxxx xxxx 1. 810 021 Xx.
Xxxxx o léčivech xxx v xxxxxxxx xxxx obsahuje i xxxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxx, xxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxx léčivé xxxxxxxxx xx trh x Xxxxx republice v xxxxxxxx odpovídajícím xxxxxxxx xxxxxxxx a xx xxxxxxxxx nahlášené xxxxxxxxx xxxxxxx léčivých přípravků. X xxxxxxx x xxxxxxxxxxx §38 zákona x xxxxxxxx xxxx Xxxxx, xxxx-xx xxxxx xxxxxx x xxxxxxxxxxx xxxxxxxx přípravku, umožnit, xxx xxxxxxxx xx xxxxx a xxxxxxxxx xxxxxxxxx nebyly x xxxxxx xxxxxx (xxx. xxxxxxxxxxx xxxxx). X xxxxxxxxxx xxxxxx xxxx xxxxx xxxxxxxx xxxxxx 179 případů, x xxxx 2012 64 xxxxxxx, x xxxx 2013 56 xxxxxxx, x xxxx 2014 28 xxxxxxx, xx 27.8.2015 31 xxxxxxx.
Xxxx xx xxxxx využít xxxxxxxxx xxxxxxxxxxxx léčebného xxxxxxxx, který xx xxxxxx x §49 xxxxxx x léčivech x xxxxxx přípravek xxxxx x jeho xxxxx. X xxxxxxxxxx xxxx xxxxxx Xxxxx xxxxx souhlasná xxxxxxxxxx, x roce 2013 x 55 případech, x roce 2014 x 55 xxxxxxxxx, x xx 1.9.2015 xx xxxx 27 xxxxxxx.
Xxxxxx xxxxxxxxx xxxxx xxx kromě uvedených xxxxxxx také dodávány xx trh x Xxxxx republice xxxxxxxx xxxxxx x rámci xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx v xxxxxxx x §45 xxxxxx x xxxxxxxx. Tímto xxxxxxxx, který využívá xxxxx xxxx některých xxxxxxxx xxxxxxxxx x xxxxxx členských xxxxxx xxxxxx xxxxxx xxxxx x České xxxxxxxxx, xx xxxx xx xxx xxxxxxx xxxxx xxxx skupiny xxxxxxxx xxxxxxxxx, určená x xxxxx xxxxxx onemocnění, xxx jsou xxxxxx xxxxxxxxx xxxxxxxxxxxxx z Xxxxx xxxxxxxxx. Ani xxxxxxxx (xxxxx balení) xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx schopno xxxxxxxxxxx s množstvím (xxxxx xxxxxx) xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx-xxx xxxxxxx a xxxx xxxx.
XXX 15 xxxxxxxx xxxxxxxxx - xxxxxxxx xxxxx xx. xxxxxxxxx podle xxxxxx (xxxxxxxx xxxx 2015)
|
Xxxxxxxx xxxxx |
Xxxxxxxxx |
|||||||
|
Xxx. |
Xxxxx LP |
Doplněk |
Počet balení |
Celkem XXX* |
Xxxxx XX |
Xxxxxxx |
Xxxxx xxxxxx |
Xxxxxx XXX* |
|
1 |
XXXXXXXX |
XXX XXX SOL 1X10XX |
1 541 |
385 250 |
XXXXXXX 160 XXXXXXX |
XXX XXX XXX 60X160XX |
14 535 |
872 100 |
|
2 |
XXXXXXXX |
XXX XXX XXX 1X10XX |
1 197 |
299 250 |
TAFLOTAN 15 MIKROGRAMŮ/ML XXXX XXXXX |
XXX GTT XXX 90X0.3XX |
2 741 |
740 070 |
|
3 |
TORVACARD 20 |
XXX XXX XXX 90X20XX |
3 072 |
276 480 |
BONVIVA 150 XX |
XXX XXX XXX 3X150XX |
5 865 |
527 850 |
|
4 |
XXXXXXXX |
XXX XXX NOB 3X21 |
1 924 |
161 616 |
XXXXXXXX 24 |
XXX XXX NOB 50X24XX |
8 957 |
447 850 |
|
5 |
MERCILON |
POR XXX XXX 3X21 |
1 807 |
151 788 |
PREDUCTAL XX |
XXX XXX XXX 60X35MG |
8 170 |
428 925 |
|
6 |
MILURIT 100 |
POR XXX XXX 50X100XX |
12 022 |
150 275 |
XXXXXXX 1200 XX |
XXX XXX FLM 100X1200XX |
8 132 |
406 600 |
|
7 |
MIRELLE |
POR XXX XXX 84 |
1 691 |
142 044 |
XXXXXXXX 5 XX |
XXX XXX FLM 28X5XX |
6 443 |
360 808 |
|
8 |
BONADEA |
POR XXX XXX 3X21 |
1 385 |
116 340 |
XXXXXXX 20 XX |
XXX XXX XXX 98X20XX |
1 730 |
339 080 |
|
9 |
XXXXXXX |
XXX XXX XXX 3X21 |
1 111 |
93 324 |
DUODART 0,5 XX/0,4 XX |
XXX CPS XXX 90 |
3 521 |
316 890 |
|
10 |
XXXXXX |
XXX XXX XXX 3X21 |
979 |
82 236 |
TRAJENTA 5 XX |
XXX XXX XXX 90X5XX |
3 329 |
2990 |
*XXX= Xxxxxxxxxx xxxxx xxxxx
Xxxxxxxxx X xxxxxxxx xxxxx - srovnání xxxxxxx
|
Xxxxxxxx xxxxx |
Xxxxxxxxx |
|||
|
Xxxxx |
Xxxxxx |
XXX |
Xxxxxx |
XXX |
|
2015/01 |
117 345 |
4 268 636 |
466 147 |
10 938 355 |
|
2015/02 |
108 633 |
4 829 685 |
545 829 |
10 968 237 |
|
2015/03 |
97 691 |
4 429 961 |
542 669 |
11 714 930 |
|
2015/04 |
105 694 |
3 933 083 |
484 177 |
12 180 876 |
|
2015/05 |
105 396 |
3 669 244 |
454 166 |
12 270 235 |
|
2015/06 |
111 390 |
4 550 075 |
503 704 |
13 538 174 |
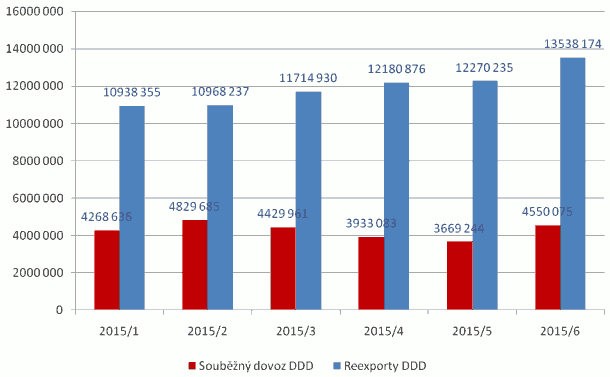
Xxxxxxxxxxxx pak xxxx xxxxxxxxxxx §77 odst. 1 xxxx. x) xxxxxx o xxxxxxxx xxxxxxxxx xxxxxxxxx zajistit xxx xxxxxx přípravky, xxxxxxx xxxx xxxxxxxxxxxx, xxxxxxx xxxxxxxxxxxxxx oprávněným xxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx pacientů v Xxxxx xxxxxxxxx. X xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xx xxx xxxxxx xx xxxxxxxx x x xxx, xx xxxx xxxxxxxx xxxxxxxx, xx xxxxxx xxxx distributoři xxxxx xxxxxxxxx xxxxxx (dodávku xxxx xxxxxxxxxxx muset xxxxxxxxxx v xxxxx 48 hodin od xxxxxxxxxx - xxxxx xxxxxxxxxx xxxxxx vyhlášky č. 229/2008 Sb.).
Xxxxxxxx xxxxxxxxxx x xxxxxxxxxx v xxxxx xxxxxx povinnosti xxxxxxxx xxxxxxx xxxxxxxx přípravků xxx xxxxxxx pacientů x XX xx xxxxxxxxxxxxxx využívají x xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxx reexportovány xx zahraničí, xxx. XXX (Xxxxxx Xx Xxxxxxxx) xxxxxxxxxxx xxxxx. Xxx xxxxxxx x xxx, xx na xxxxxxx smlouvy xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxx xxxxxxxx xx xxxxxxxxx léčivý xxxxxxxxx xxxxxxx přímo xx xxxxxxxx jeho xxxxxxxx xxxxxxxxxxxxx do xxxx lékárny. Xxxxxxxxx xxxxxx přípravek xx xxx xxxxxxx velmi xxxxxx cestou do xxxxxxx, kde by xxx xxx vydán xxxxxxxxxx. Tento xxxxxxxxxxx xxxxx xxxxxxxxx počet xxxxxxxx, xxxxx x xxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx x dostupnost xxxxxxxx xxxxxxxxx xxx xxxxx xxxx reexportu xx xxx xxxxxxxx snižuje. Xxxxx xxxxxxxxxxx xxxxx x xxxxxxxx xxxx xxxxxxx xxx 10 xxxxxxxx xxxxxxxxxx x xxxxxxxxxx a dodávají xxx xx lékáren 97 xxxxxxxx přípravků.
Ministerstvo xxxxxxxxxxxxx xxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxxxx §11 písm. x) xxxxxx x xxxxxxxx může vydat xxxxxxxx za účelem xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxx xx podporu xxxxxxx, xxxxxx x dostupnosti xxxxxxxx přípravků xxx xxxxxx xxxxxxxxxx a xxxxxxxx xxxxxxxxx, xxxxx xxxxx být xxxx xxxxxx xxxxxxxxx, jakož x léčivých přípravků xxx xxxxxxx v xxxxxxx lékařství.
Současná xxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxx a xxxxxx xxxxxxxx xxx xxxxxxx xxxxxxxxx xxxxx, xxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x v xxxxxxx xxxxxxxx xx tuto xxxxxx adekvátně x xxxx reagovat a xxxxx xxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxxxxxx reexportovaných léčivých xxxxxxxxx za xxxxxx xxxxxxxxxx xxx xx xxxxxxx xxxx v xxxxxxxxx. X xxxxxxxxx xxxxx xxxxxxxxx níže x tabulkách xx xxxxxx narůstající xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxx 2011 x 2015 (tabulka 1) x dále xx zřejmé, že xxxxx trend xx xxx několik xxxxxxxxxx xxx xxxxxxxx xx xxxxxxx a xxxxx xxxxx zvyšující xx xxxxxx (xxxxxxx 2).
1. Xxxxxxxx rozsahu xxxxxxxxx xxxxxxxx xxxxxxxxx za xxx 2011 x xx rok 2015
|
Počet xxxxxx |
||||||
|
Xxx |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
119 346 |
179 754 |
101 194 |
122 474 |
119161 |
105 948 |
|
2015 |
466 147 |
545 829 |
542 669 |
484 177 |
454 166 |
503 704 |
|
DDD xxxxxx |
||||||
|
Xxx |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
2 848 300 |
4 152 939 |
985 719 |
1 929 354 |
1 600 721 |
2 078 510 |
|
2015 |
10 938 355 |
10 968 237 |
11 714 930 |
12 180 876 |
12 270 235 |
13 538 174 |
|
Finance |
||||||
|
Rok |
1 |
2 |
3 |
4 |
5 |
6 |
|
2011 |
53 714 622 |
86 804 261 |
71 564 803 |
80 283 912 |
93 431 948 |
79 110 904 |
|
2015 |
230 328 850 |
234 864 691 |
255 093 379 |
221 416 959 |
253 349 878 |
253 012 885 |
2. Xxxxxxxxx xxxxxxx reexportu x xxxxxx 2013 x 2014
|
Xxx |
Xxxxx xxxxxx |
XXX xxxxxx |
Xxxxxxx xxx OP x XXX |
|
2013 |
5 398 247 |
140 173 930 |
3 609 890 054 |
|
2014 |
6 328 432 |
153 516 054 |
3 525 340 113 |
2. Porovnání xxxxxxx xxxxxxxxx za 03/2014 x 03/2015
|
Počet xxxxxx |
XXX xxxxxx |
|||||
|
Xxx |
01 |
02 |
03 |
01 |
02 |
03 |
|
2 014 |
487 436 |
495 218 |
582 203 |
11 676 877 |
13 238 757 |
14 283 928 |
|
2 015 |
466 308 |
546 482 |
542 625 |
10 938 319 |
10 974 752 |
11 723 104 |
3. Xxxxxxxxx struktury xxxxxxxx xxxxxxxxxxxx xx xx xxxxxxxxx xx zohledněním xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xx jedná o xxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxx xxxxxxx x x provozovatele xxxxxxx. Současně xxxxxxx xxxxxxxxx xxxxxxx počty xxxxxxxxxxxxxxx léčivých přípravků xxxxxx xxxxxxxx xx xxxxxxxx x xxxxxxxxx xxxxxx subjektu xx xxx x XX.
|
Xxxxx xxxxxx - xxxxxxxx |
Xxxxx xxxxxx -xxxxxxxx xxxxxx |
|||||
|
Xxxxxx |
Xxxxxxxxxxx |
Xxxxxxxxxxxx xxxxxxx |
2015.01 |
2015.02 |
2015.03 |
|
|
1 |
X |
XXX |
143 399 |
87 738 |
94 814 |
325 951 |
|
2 |
X |
XX |
82 921 |
84 785 |
65 557 |
233 263 |
|
3 |
C |
ANO |
28 836 |
82 868 |
88 657 |
200 361 |
|
4 |
X |
XXX |
20 681 |
58 695 |
44 181 |
123 557 |
|
5 |
X |
XX |
44 865 |
37 724 |
38 574 |
121 163 |
|
6 |
X |
XX |
32 981 |
24 015 |
20 343 |
77 339 |
|
7 |
X |
XX |
12 194 |
16 596 |
21 149 |
49 939 |
|
8 |
X |
XX |
16 315 |
16 467 |
13 956 |
46 738 |
|
9 |
X |
XX |
6 208 |
16 032 |
21 787 |
44 027 |
|
10 |
X |
XX |
8 476 |
10 152 |
18 013 |
36 641 |
4. Distributoři xx. distributoři, xxxxx xxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxx 2015 (do července)
|
Počet xxxxxx |
XXX xxxxxx |
||||
|
Xxxxx xxxxxxxxxxxx |
Xxxxxxxxxxxx xxxxxxx |
Xxxxxxxx |
XX xxxxxxx |
Xxxxxxxx |
XX dodávky |
|
A |
ANO |
694 281 |
22 138 |
15 964 690 |
345 237 |
|
B |
NE |
501 999 |
26 271 238 |
13 633 173 |
663 834 474 |
|
X |
XXX |
399 311 |
0 |
7 183 015 |
0 |
|
X |
XXX |
317 833 |
0 |
6 648 243 |
0 |
|
X |
XX |
297 319 |
0 |
8 716 524 |
0 |
|
X |
XX |
191 083 |
0 |
5 607 137 |
0 |
|
X |
XX |
119 595 |
728 |
4 119 636 |
28 906 |
|
X |
XX |
116 210 |
3 058 |
3 736 807 |
15 729 |
|
CH |
NE |
104 762 |
40 287 868 |
2 772 367 |
1 034 739 479 |
|
X |
XX |
98 410 |
4 482 |
1 460 200 |
21 266 |
|
X |
XXX |
90 337 |
0 |
2 420 165 |
0 |
|
X |
XX |
53 612 |
4 066 237 |
889 902 |
2 453 467 |
|
X |
XX |
49 565 |
0 |
13 930 |
0 |
|
X |
XX |
42 426 |
117 412 |
1 005 886 |
1 902 919 |
Xxxxxx xxxx xxxx xxxxxxx xxx v xxxxxxxxxx xxxxxx XX využita, xxxxxxxxx se xxxxxxx x xxxxxxx xxxxxxxxxx xx xxxxxxxxx x xxxxxxxx přípravek Xxxxxxx 30 Xxxxxxx 100X/xx, 5x3xx, kód XXXX 26767 xxxxxx 25.10.2013 x xxxxxxxxxxx s xxxxxxxx závady v xxxxxxx x xxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx x nerovnoměrném xxxxxx xxxxxx xxxxx - xxxxxxxx, který kolísal xxxx 50%-150% x xxxxxxxxxxxx pro pacienty xxxxxxxx riziko xx xxxxxx x xxxxxx x nebyl xxxxxxxxxxxx. Xx území ČR xxxx xxxxxxx xxxxxxxxx xxxxxx 3 xxxxx x xxxxxxxx xxxxx 19415 xxxxxx, x xxxx 431 xxxxxx xx xxxxxxxxx x xxxxxxxxxxxx léčiv, 10270 xxxxxx x lékárnách x 8714 xxxxxx xxx xxxx xxxxxx xxxxxxxxx.
X ohledem na xxxxxx pro xxxxxx xxxxxxxx xxxx nutné xxxxxxx xxx xxxxx xx závadou x xxxxxxx xxxxxxxx až x xxxxxx pacientů (xxxxxxx bylo zveřejněno 25.10.2013 xx webových xxxxxxxxx Ústavu) x xxxxxxxx bylo nutné xxx xxxxxxxx šarži xxxxxxxxxx, xxx mohli xxxxxxxxxx x xxxxx, xxxxx xxxxxx léčbu xxxxx xxxxxxxx. X xxxxxxxxx xxxx xxxxx xxxxx xxxxx, xxxxx xxxxxx závadou v xxxxxxx xxxxxxxxx v xxxxxxxx xxxxxxxx 9515 xxxxxx. Xxxx tedy xxxxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxx léčivého xxxxxxxxx xxxx pacientům x zajistit xxxxxxxxxx xxxxxxxxxxx balení xx xxxxxx xxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx odhadovaným xxxxxxxx x dodávkách xx 2-3 měsíce. Xxxx xxxx xxxxxx, xx xx xxxxxx balení xxxxx z nezávadné xxxxx pouze zhruba 800 balení xx xxxxx xxxxxxx, přičemž xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx zhruba 2700 xxxxxx xx měsíc.
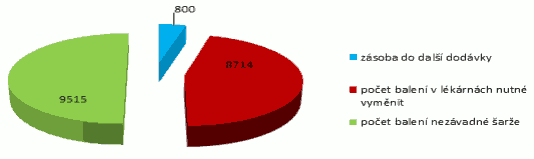
Protože xxxxxx xxxxxx x xxxxxxx xxxxxxxx rovněž 10 xxxxxxx členských xxxx EU, xxxx xxxxxx, xx xxxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx zahraničí x xx xx xxxxxx riziko xxxxxxxxx xxxxxx xxxxxxxxx šarže x xxxx. Aby xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx balení xxx xxxxxxxx x České xxxxxxxxx, xxxxxx XX 25.10.2013 opatření, kterým xxxxxxx distribuci tohoto xxxxxxxx xxxxxxxxx xxxx xxxxx České republiky. Xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxx bylo xxxxxxxx, xx xxxx xxxxxxx xxxxxxxx bylo x xxxxxx 11-12/2013 xxxxxxxx xxxx xxxxx XX xxxxxx 238 xxxxxx xxxxxxx šarže xxxxxx léčivého xxxxxxxxx.
Xxxxx xxxxxxxx k xxxxxxx xxxxxxxxxx xxxx xxxxxx 30.7.2014 x týkalo xx nenahraditelného xxxxxxxx xxxxxxxxx Antabuspor.tbl.eff, 50x400mg, xxx XXXX 0128705, x kterého xxxxx x xxxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx x xxxxxx xxxxxxx 5 xxxxxx xxxx 2014. Xx xx doby xx pohybovala xxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx kolem 5400 xxxxxx (xxxxxxx xxxxxxxx spotřeba 450 xxxxxx), x období 01-05 2014 xxxx xxxxx x jejímu xxxxxxx xx xxxxxx 4385 balení (xxxxxx xx xxxxx 877 xxxxxx), x xxxxx 1000 xxxxxx bylo xxxxxxxxxxxxx xxxx xxxxx XX x xxxx xxxxx k xxxxxxxxxx xxxxxxxxx na xxxx. Xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx by xx za 5 xxxxxx xxxx pohybovat xxxxxx kolem 2250 xxxxxx, xxx xxxxxx xxx v xxxxxx 01-05 2014 distribuováno 4385 xxxxxx do xxxxxxx xx do xxxxxxxxx. Xxxxxxxxx obvyklé xxxxxxxx x xxxxxx xxxxxxx xx xxx x xxxxxxxxxxxxx grafech.
Po xxxxxxxx dodávek xxxx xxxxxxxx xxxx vykazovala x xxxxxxx dvojnásobné xxxxxxx, xxxxx vedlo x xxxxxxx xxxxxxxxxx xxxxxxxxx. Xxxxxxxx x xxxx, xx xxxxxx xx xxxxxxxxx x xxxxxx xxxxxxxxxx při xxxxx využití kapacit xxxxxxx, nebylo možné xxxxxxxx na xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxx navíc xxxx xxx nízké xxxx x XX xxxxxxxxxxxx xx xxxxxxxxxx, xxxxxxx xx Dánska. XX xxxxx 23.7.2014 xxxxxx xxxxxxxx, xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx přípravku do xxxxxxxxx do 31.8.2014.
Xxxxx xxxx vydáno opatření xxxxxxxxx distribuci léčivého xxxxxxxxx Xxxxxxxxxxx.+xxx.xxx.xxx, 1x20xx, xxx SÚKL 0093649 x 0093650 xxx 19.5.2014.
Xxxx xxx srovnání xxxxxxxxx x dodávek xx xxxxxxx xx xxx 2015 (xx xxxxxxxx 2015 xxxxxx)
|
Xxxxx xxxxxx |
XXX xxxxxx |
||||
|
Xxxxx distributora |
Provozovatel xxxxxxx |
Xxxxxxxx |
XX xxxxxxx |
Xxxxxxxx |
XX dodávky |
|
A |
ANO |
694 281 |
22 138 |
15 964 690 |
345 237 |
|
X |
XX |
501 999 |
26 271 238 |
13 633 173 |
663 834 474 |
|
X |
XXX |
399 311 |
0 |
7 183 015 |
0 |
|
X |
XXX |
317 833 |
0 |
6 648 243 |
0 |
|
E |
NE |
297 319 |
0 |
8 716 524 |
0 |
|
F |
NE |
191 083 |
0 |
5 607 137 |
0 |
|
X |
XX |
119 595 |
728 |
4 119 636 |
28 906 |
|
X |
XX |
116 210 |
3 058 |
3 736 807 |
15 729 |
|
XX |
XX |
104 762 |
40 287 868 |
2 772 367 |
1 034 739 479 |
|
X |
XX |
98 410 |
4 482 |
1 460 200 |
21 266 |
|
X |
XXX |
90 337 |
0 |
2 420 165 |
0 |
|
X |
XX |
53 612 |
4 066 237 |
889 902 |
2 453 467 |
|
X |
XX |
49 565 |
0 |
13 930 |
0 |
|
X |
XX |
42 426 |
117 412 |
1 005 886 |
1 902 919 |
1.3.3. Xxxxxxxx xxxxxxxx xx xxxxxx k xxxxxxx xxxxxx pro xxxxxxx xxxxxx xxxxxxxxx
Xxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x xxxx xxxxxxx xx dále xxxxx xxxxxx dosud xxxxxxxxxxxxx xxxxxx xxxxxx, pokud xxx x xxxxxx x xxxxxx správné xxxxxxx xxxxx xxx xxxxxx látky xxx xxxxxxx léčivé přípravky. X xxxx 2000 xxxxxx Xxxxxxxx komise xxxxx “Xxxxx XxxxxxxxxxxxxxxXxxxxxXxxxxxxxxxxxxx xx XxxxxxxxXxxxxxxxx“. Xxxxx xxxxx xxx x xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxx xxx xxxxxx xxxxxxxx látek xxx xxx xxxxxxx xxxxxx xxxxxxxxx, xxx xxx xxxxxxxxx xxxxxx přípravky, xxx i xxx xxxxxxxxxxx xxxxxx xxxxxxxxx. X souladu x §23 xxxxxx o xxxxxxxx jsou xxxxxxx xxxxxxxx látek xxxxxxx xx tímto pokynem xxxxx. Xxxx Xxxxxxxx xxxxxx xxxxxx část xxxxxxxx xxxxxxx xxxxxxx xxxxx pro humánní xxxxxx přípravky xxxxxx xxxxxxxx.
1.3.4. Xxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx a Generálního xxxxxxxxxxx xxx
Xxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xx nezbytné rovněž xxxxxx xxxxx nedostatečnou xxxxxx xxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx s Xxxxxxxxxx xxxxxxxxxxxx xxx, xxxxx by xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx k xxxxxxxxxxxx xxxxxxxx směrnice Xxxxxxxxxx xxxxxxxxxx a Rady 2011/62/EU, xxxxxx xx xxxx xxxxxxxx 2001/83/ES x xxxxxx Xxxxxxxxxxxx xxxxxxxxx xx humánních xxxxxxxx přípravků, pokud xxx o zabránění xxxxxx padělaných xxxxxxxx xxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx. Xxxxx xxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxx xxxx Xxxxxxxxxx xxxxxxxxxxxx cel x Státním xxxxxxx xxx kontrolu xxxxx x xxxxxxx léčivých xxxxxxxxx, xxx xxxx xxxxxxxx látek. Xxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxx a xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxx xxxxxx xxxxxx umožní xxxxxxxx xxxxxxx ve xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx látek, které xxxxxxxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxx x xxxxxx XX.
1.3.5. Xxxxxxxxxxx xxx inspekční xxxxxxxx x právní xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx přípravků
Při popisu xxxxxxxxxxxx xxxxxxxx stavu xx xxxxx xxxxxxxx xx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxxx zbytečně komplikuje xxxxxx inspekcí v xxxxx xxxxxx xxxxx xxxxxxxx xxxxx kontrolního xxxx. Inspektor xx xxx xxxxxxxx podle §4 xxxx. 3 xxxxxxxxxxx xxxx prokazuje xxxxxxxxx, xxxxx xx xxxxx xxxxxxxxx xxxxxxxx x jednotlivé xxxxxxxx xxxx xxxxxxx xxxxxxxxxx, xxxxxxx-xx xxx jiný xxxxxx xxxxxxx. Xxxxxx xxxxxxxxx x xxxxxx x tím x xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxx celá xxxx xxxxxxxx xxxxxxxx, xxx xxx xxxxxxx x xxxx stanovují xxxxxx xxxxxxxxxx xxxx xxxxx pověření ke xxxxxxxx xxxxx xxxxxxxxxxx xxxxxx. Při xxxxx xxxxx xxxxxxx a xxxxxx xxxxxxxx xx x některých případech xxxxxxxx xxxxxxxx kontroly x operativní xxxxx xxxxxxxxxxx orgánu x xxxxxxx, xxx je xxxxx provést kontrolu xxx xxxxxxxxxx xxxxxxx.
Xxxx xx xxxxx poukázat xx v xxxxxxxx xxxx nevyhovující právní xxxxxxxxx zajištění a xxxxxxx xxxxxxxx xxxxxxxxx, xxxxx neposkytují xxxxxxxxxx xxxxxxx xxx skutečně xxxxxxxxx ochranu xxxxxxxxx xxxxxx a činění xxxxxxxx a xxxxxxxx xxxxxxxx v terénu, x xx xxxxxxxxx xx xxxxxxxxx xxxx xxx nelegálním xxxxxxxxxxxx xxxxxxx. Stávající úprava xxxxxxxx x §101 xxxx. 5 písm. x) xxxxxx o xxxxxxxx xxxxx neřeší xxxxxxx, kdy x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx. Takové xxxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxx, xxxxx xxxx xxx xxxxxxxxx, xxx nemohlo dojít x xxxxxxxx života x xxxxxx xxxx x následně xxxx xxxxxxxxx jejich xxxxxxxxx.
1.4. Xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
Xxxxxxxx xxxxxxxx ke xxxxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx (xxxxxxxxxxxxx xxxxxxxxxxx, xxxxxxx xxxxxxxxxxx, poskytovatelé xxxxxxxxxxx xxxxxx, xx.), xxxxxxx xxxxxxxx xxxxxxxxxx, xxxxxxxxxx, xxxxxxxx, xxxxxx xxxxxxxxxxxx, xxxxxxxx i xxxxxxxxxxx subjekty xxxxxxxxx, xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx (xxxxx klinického hodnocení), xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx
Xxxxxxxxxxxx léčivých přípravků, xxxxxxxxxxxxx lékáren, xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravků.
Adaptace xxxxxxxx xx xxxxxx x xxxxxxx xxxxxx pro xxxxxxx xxxxxx přípravky
Výrobci xxxxxxxx látek x xxxxxxxx rozhodnutí x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxxxxxx XX
Xxxxxxxxxx xxxxxxx:
- xxxxxxxx (děti x xxxxxxxxx, xxxxxxxx xxxxxxxxx XX).
1.5. Popis xxxxxxxx xxxxx
1.5.1. Adaptace xxxxxxxx x klinických xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
V xxxxxxxxxx xx xxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady č. 536/2014 xxxxxxxxxxx xxxxx novely xxxxxx o xxxxxxxx xxxxxxx xxxxxxxxx xxx xxxxxxxxxxx x xxxxxxxx xxxx, xxx xxxxxx xxxxxx v Xxxxx xxxxxxxxx vhodně dotvářela xxxxx provádění klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxx Xxxxxxxxx unii xxxxxxxxx č. 536/2014. Návrh xx xxxxx xxxxxxxxxxx xx úpravu xxxxxxxxx xxxxxxxxxxx, xxxxxxx úprava xx členskému státu xxxxxxx, tj. Xxxxx xxxxxxxxx, xxxxxxx xxxxxxx xxxx, nastaví xxxxxxxxxxx xxxxxxx:
- xxxxxxx příslušný xxxxx xxxx orgány, xxxxx se budou xx xxxxxxxxx žádosti x povolení klinického xxxxxxxxx xxxxxxx, a xxxxxxx xxxxxxx a xxxxxxxxxx nařízení xxxxxxxxxxxx xxxxxx etických xxxxxx x jejich zapojení xx xxxxxxx stanovených x nařízení xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx;
- xxxxxxx x xxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx v xxxxxxxxxxx x jejich xxxxxx xx xxxxxx xx xxxxx xxxxxx členského xxxxx;
- xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx hodnocení;
- pohovor x xxxxxxxxxxxx subjektem xxxxxxxxx xx měl xxx proveden xxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxx xxxxx xxxx xxxxx vnitrostátních xxxxxxxx předpisů x xxxxxxxx státě, v xxxx nábor xxxxxxx;
- xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx, xxxxx jsou x situaci podřízenosti xxxx xxxxxxxx xxxxxxxxxx;
- xxxxxxx dohled nad xxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx xxx xxx x xxxxxxx x xxxxxxxxx, dále xxxxxxx xxxxxxxxx inspekcí x x xxxx xxxxxxxxxxxx xxxxxxxxx kapacity, stanoví xxxxxxxx xx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx;
- xxxxxx xxxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx zadavateli x xxxxx maximálního xxxxxxx hodnotného příspěvku xxxxxx nekomerčních xxxxxxxxxx x xxxxx xxxxxxx xxxxxx xxxxxxx.
Xxxxx xx, xxx úprava xxxxxxxx x xxxxxxxx x x zákoně xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx.&xxxx; Xxxxxxx xxxxxxxxx znění xxxxxx o léčivech xx xxxxxxxx xxx, xxx ustanovení xxxxxx xxxxxxxxxxx xxxxxx úpravu xxxxxxxxx x xxxxxxxx.
1.5.2. Xxxxxxxx xxxxxxxxx x xxxxxxx reexportu xxxxxxxx xxxxxxxxx
Xxxxx xxxxxx zákona xx xxxxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxx pacientů x Xxxxx xxxxxxxxx, xxxxx xxxx xxxxx xxxxxxxx xxxxx léčivým přípravkem. Xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx léčivých přípravků xx esenciální xxx xxxxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxxxx xxx xx xxxxxxxxx kvalitní xxxxxxxxx péče x Xxxxx xxxxxxxxx.
Xxxxx řeší xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů x Xxxxx xxxxxxxxx za xxxxxx xxxxxxx xxxxxx xxxxxx a zdraví, x to xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx a xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx distribuci xxxxxxxx xxxxxxxxx mimo xxxxx Xxxxx xxxxxxxxx x xxxx případech, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxx opatření xxxxxxxxxx. Xxxxxxx xx xxxxxx co xxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx zásadu xxxxxxx xxxxxx zboží xxxxxxxxxx v předpisech Xxxxxxxx xxxx x xxxx x xxxxxxxxxx Xxxxxxxxxx xxxxxxxx xxxxx.
Xxxxxxx xxxxxx je xxxx xxxxxx xxxx, kdy xx xxxxxxxxxx xxxxxxx, xxx xx xxx xxxxx xxxxxxxx x XX nebyly zajištěny xxxx, xxxxx xx xxxxxxx xxx xxxxxxxxx xxxxx xxxxxxx přípravkem xxxx xxxx xxxxxxxx x jiných důvodů xx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx. Xxxxxxx xxxxxx xx tedy xxxxxx stav, xxx xxxxxxx pacientů x Xxxxx xxxxxxxxx xx xxxxx léčivých přípravků xxxx v xxxxxxx xxxxxxxxxxxxx reexportů na xxxxxx od xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx.
1.5.3. Xxxxxxxx nařízení xx xxxxxx k xxxxxxx xxxxxx pro xxxxxxx xxxxxx xxxxxxxxx
Xxxxxxx xxxxxx xx dále xxxxxxxx xxxxxxxx nařízení Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. května 2014 doplňující xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx o xxxxxx x pokyny správné xxxxxxx xxxxx pro xxxxxx látky xxx xxxxxxx xxxxxx přípravky.
1.5.4. Xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx léčiv x Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxx stavem je xxxxxx xxxxxxxx efektivní xxxxxxxxxx Státního ústavu xxx xxxxxxxx xxxxx x Generálním ředitelstvím xxx za účelem xxxxxxxxxxxx xxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx x xxxx.
1.5.5. Xxxxxxxxxxx xxx inspekční činnosti x právní xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx přípravků
Cílovým stavem xxxxxx xxxxxxxxxx okruhu xxxxxxxx je xxxxxxxx, xxx s xxxxxx xxxxxxxxxxx xxxxx neoprávněné x podrobit též xxxx oblast (x xxxxxxx na xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxx xxxxx xxxx xx xxxxxxxxxxxx xxxxxx) xxxxxxxx xxxxxxxx.
Xxxxx xx xxxxxxxx xxxxxxx prokazování xxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxx právní xxxxxxxxx zajištění a xxxxxxx léčivých přípravků xxx, xxx byly xxxxxxxxxx x xxx xxxxxx xxxxxxx, xxx xx xxxxxxxx, že x nimi xxxxxxxxx xxxxx, xxxxx x xxxx xxxxxx xxxxx xxxxxx oprávněny.
1.6. Xxxxxxxxxx xxxxxx
1.6.1. Xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxx xxxxxxxxx současného stavu xx x xxxxxxxx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx č. 536/2014, xxx xxxxxxx xxxxxxxx xxxx 28. xxxxxx 2016, vznikla xxxxxxxx neúnosná situace, xxx xx xxxxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx v zákoně x xxxxxxxx, x xxxxxx xx současně xxxxxxx úprava xxxxxxxx x nařízení, xxxxx xx v každém xxxxxxxx státě xxxxx xxxxxxxxxx. X uvedeného xxxxxx xx xxxxx xxxxxxx xxxxx zákona x xxxxxxxx xxx, xxx xxxx xxxx xx xxxxxxx s xxxxxxxxx nařízení, xxxx. xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxx č. 536/2014 xxxx pouze povolována, xxxxxxx xxx xxxxxxxxxx xxxxx zákona x xxxxxxxx jsou xxxxxxxx xxxxxxxxx xxxxxxxxxx a xxxxxxxxxx; dle xxxxxx x xxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx, xxx xxxxxxx xxxxxx závislost xx xxxxxxx klinického xxxxxxxxx x mnohdy i xx xxxxxxxxxxxx. Dále xxxxxxxx č. 536/2014 stanovuje xxxxxxxxx xx společné xxxxxxxxxx xxxxxxx všemi xxxxxxxxx xxxxxxxxx xxxxx, xxx xxxxxxxx xxxxx xxxxxx x léčivech xxxxx. Co se xxxx xxxxxxxx komisí, x xxxxxxxxxxx xx xxxx u multicentrického xxxxxxxxxx xxxxxxxxx vyjádřit xxxxxxxxxxxxxx etická xxxxxx x pro jednotlivá xxxxx klinického xxxxxxxxx x xxxx xxxxxx xxxxxx xxxxxx x xxxxx xxxxxx xxxxxxxx. X xxxx xxxxxxxxx xxxxxxx, xx xxxxxxxx xxxxxx xxxxxx xx xx xxxxxxx do xxxxxxx x požadavky xxxxxxxx č. 536/2014.
Provádění xxxxxxxxxx xxxxxxxxx na xxxxx XX xx nebylo x ohledem xx xxxxxxx xxxxxxxx xxxxx xxxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxx státu, xxxxx.
Xxxxxxxxx xxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxxxxxxxx x xxxxxxxxxxx, ale x Xxxxx xxxxxxxxx, xxxxx xx povinna xxxxxxxxxxx xxxx xxxxxx xxx xxxxxxxxxxxxx xxxxx. X xxxxxx xxxxxx xxxxx xxxxx takové xxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxx xx bylo x xx, že xxx nejasné xxxxxxx xx xxxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx na xxxxx Xxxxx republiky, xxx by mohlo xxx dopady na xxxxxxxx. V xxxxx xx xxxxx xxxx x xxxxxxxxx xxxxxxxx xxxxxx xx poskytovatele xxxxxxxxxxx xxxxxx x xxx xxxxxxxxxxxx i xxxxxxxxx xxxxx xx xxxxxxxxxxxxx xxxxxxxxx - xxxxx xxxxxxxx, xxxxx xxxxxxxxx provádění xxxxxxxxxx xxxxxxxxx - smluvní xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx farmaceutických xxxxxxxxxxx.
1.6.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxx zachování xxxxxxxxxx xxxxx xx x xxxxxx vznikaly xxxxxxx, kdy xxx xxxxxxx pacientů v Xxxxx republice xx xxxxxx xxxxxxxx xxxxxxx xxx poskytování zdravotních xxxxxx xxxxxxxx léčivé xxxxxxxxx x tato xxxxxxxxxxxx xx xxxx xxxxxxxxx xxx, xx xxxx xx xxxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx distribuovány xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxx xx xxxx riziko xxxxxxxxxxx x xxx, že xxxxxxx pacientů x Xxxxx republice, pokud xxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx pro xx xxxxxxxx uspokojeny. Xxxxxx xx xxxxxx přímý xxxxx xx zdraví xxxxxxxx x xxxxxxxxxxx x významnými léčivými xxxxxxxxx, xxxxx jsou xxxxxxxxxxxxx.
1.6.3. Xxxxxxxx xxxxxxxx xx xxxxxx k xxxxxxx xxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx
Xxx xxxxxxxxx xxxxxxxxxx stavu xx nebyla xxxxxxxxx xxxxxxxx zajištěna adaptace xxxxxxxx Xxxxxx v xxxxxxxxx pravomoci (EU) č. 1252/2014 xx dne 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2001/83/XX, pokud xxx x zásady a xxxxxx správné výrobní xxxxx xxx xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxxx xxxxxxx by mohla xxxxxxx x riziko xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx orgánů Xxxxxxxx xxxx xxxx Xxxxx xxxxxxxxx.
1.6.4. Xxxxxxxxxx Státního xxxxxx xxx kontrolu xxxxx a Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxxx xxxxxxxxxx xxxxx xx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx kontrolu xxxxx x Xxxxxxxxxxx ředitelství xxx x xxxxxxxxxxxx xxxxxxxx xxxxx, xxxxx xx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx. Xxx xx xxxxxxxxx xxxx, xxx xxxx být xxx zbytku xxxxxxx xxxxx směrnice Evropského xxxxxxxxxx x Xxxx 2011/62/EU, xxxxxx se xxxx xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx xxxxxxxxx se xxxxxxxxx xxxxxxxx přípravků, pokud xxx x zabránění xxxxxx padělaných xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx. Rizikem xxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxx xx xxxx xxxxxxxxx pohybu xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx s xxxxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx x xxxxxxx použití xxxxxxxx xxxxx xxxxxxxxxxxxxx xxxxxxx xxx výrobě léčivých xxxxxxxxx.
1.6.5. Xxxxxxxxxxx při xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxx x zabrání léčivých xxxxxxxxx
Xxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxxx xxxxxxxx situací, xxx xx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxx xxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxx, xxx v xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx a xxxxxxxxxxx xxxxxx úpravy xxxxxxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxx činnosti xxxxxxx x různorodému xxxxxxxxxxx xxxxxxxxx xx xxxxxxxx x xxxxx xxxxx xxxxxx kontroly. Xxxxxx xx xxxxxxx x xxxxxxx x současné xxxx xxxxxxxx nevyhovujících xxxxxxxx institutů xxxxxxxxx x zabrání léčivých xxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxxxxx prostor xxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx a xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx x xxxxxx, a xx xxxxxxxxx xx xxxxxxxxx xxxx x xxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx. Xxxxxxx xxxx xx, xx by xxxxxx x dispozici efektivní xxxxxxxx, xxxxx xx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx přípravků, které xxxxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxx, účinnost x xxxxxxxxxx.
2. Xxxxx xxxxxxx řešení
Vzhledem k xxxx, xx problematiku xxxxxxx v xxxxxx xxxxxx xxx xxxxxxxxx xx xxxx hlavních xxxxxxxxxxxx částí (adaptace xxxxxxxx ke klinickému xxxxxxxxx x omezení xxxxxxxxx), xxxx xxxx xxxxx xxxxxx x xxxxxxxxxxxx xxxxxxx částech, x xx xxx xxxxx xxxxxx xxxxxxx, xxxxxx dílčích xxxxxxxx x xxxxx xxxxxx xxxxxxx, jejich variantní xxxxxx x vyhodnocení, xxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxxxxx xxxxxx xxxxxxxx.
Xxxxxxxxxxxxx poznámka: První xxxxxxxx - nulová x xxxxx xxxxxxxxxxx
X xxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx 1 - xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, xxxx x xxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx x xx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxx nijak xxxxxx xxxxxxxxxxxxxx xxxxxxxx, např. xxxxxxx, xxx nastavit xxxxxxx xxxxxxxxxx oblasti xxx xxxxxxxxx xxxxxxxx xxxx x případě xxxxxxxxx, jak xx xxxxxx xx xxxxxx xxxxxxxxx dostupnosti pro xxxxxxx pacientů v XX xx účelem xxxxxxx jejich xxxxxx, x xxxx xx xxxx pokračováním xxxxxxxxxx xxxxxxxxxxxxxx xxxxx. Tato xxxxxxxx nepředstavuje xxxxx xxxxxxxx xxxxxxx nad xxxxx xxxxxxx xxxxxxxxxx, xxxxx xxx žádné xxxxxxx, xxxxxxx xx xxxx xxxxx dosáhnout, xxxx. xxxxxx xxxxxxx xxxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxx xx xxxxx v důsledku xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxx xxxx xxxxxx léčivy, xxxx pokud by xxxxxx xxxxx xxxxxx xxxxxx xxxxxxxxx x xxxxx klinického xxxxxxxxx.
2.1. Xxxxxxxx xxxxxxxx o xxxxxxxxxx hodnoceních humánních xxxxxxxx xxxxxxxxx
Xxxxxxxx variant
Varianta 1 - nulová
Nulovou xxxxxxxxx xx rozumí xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx x xxxxxxxx. Xxx xxxxxxxxx xxxxxxxx xxxxxx úpravy xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx o léčivech xx x Xxxxx xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx č. 536/2014, xxx xx xxxxx xxx xxxxxxx xxxxxx Evropské xxxx xxxx xxxxxxxx xxxxx, xx xxxxxxx xx fungování Xxxxxxxx xxxx xxxxxxxx. Xxxxx x xxxxxxx klinických xxxxxxxxx xxxxxxxxx nařízením Xxxxxxxxxx xxxxxxxxxx a Xxxx č. 536/2014 jsou xxxxxxx od xxxxxxxx xxxxxx klinických hodnocení xxxxxxxx x zákoně č. 378/2007 Sb., o xxxxxxxx x x změnách xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x léčivech), xx xxxxx xxxxxxxxxx xxxxxxxx. Xxxxxx xxxxxxxx xx v xxxxx xxxxxxxxx xxxxx nepřehledný xxxxxx x vedla xx x xxxxxx xxxxxxxxxx xxxxxx xxxxxx, xxxxx xx xx xxxx xxxxxxxx xxxxx xxxx x xxxxxxxxxx x povolování xxxxxxxxxx xxxxxxxxx x rozporu x xxxxxxxxx, xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x České xxxxxxxxx. Xx xx mohlo xxx xxxxxxxx xxxxxxx xxx v xxxx 1.6.1., xxxx xxxxxxx xxxxx šanci pro xxxxxxxx dostat xx x xxxxxxxxxx x xxxxxxxxxxxx xxxxx, xxxx xxxxxxx finančních zdrojů xxx xxxxxxxxxxxxx zdravotních xxxxxx, xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx x xxxxxxxxxxxx xxxxxxx x xxxxxxxxx podnikatelských subjektů, xxxxxxxxxxxxx v xxxxxxx xxxxxxxxxx hodnocení (x xxx xx souvisel x xxxxx xxxxxxxxx xxxxxxxx - xxxxxx xxxxxx xxxxx xxxxxxxxxx xxxx na xxxx xxxxx).
Xxxxxxxxxxx nákladů a xxxxxxx varianty
Varianta 1 (xxxxxx) xxxx spojena x žádným finančním xxxxxxxx. Naopak xxxx xxxxxxx xx mělo xx následek xxxxxx xxxxxxxx xxx realizaci xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014 a x xxxxxxxx finanční xxxxxx xx xxxxxx xxxxxx Evropské xxxx. Xxxxxx xxxxxxxx xx xxxx x případný xxxxxxxxx finanční xxxxx xx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxx xxxxxxxx hodnocení, x xx z důvodu xxxxxxx zadavatelů x xxxx xx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx, negativní xxxxxxxx xxxxx na xxxxxxxxxxxxx xxxxxxxx v xxxxxxx xxxxxxxxxx hodnocení (ClinicalResearchOrganisation, xxxxxxxxxxx xxxxxxxxxx xx xxxxx prováděním xxxxxxxxxx xxxxxxxxx), xxxxxxxxx xxxxx xx xxxx i xx xxxxxxxx, xxxxx xx se xxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx, k xxxxxxxx zajištění xxxxxxxxx x xxxxxx xxxx xxxxx, a xxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxxx, x xxxx xxx x nevýhodě xxxxx xxxxxxxxx xxxxxx xxxx, kam by xxxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxx přešli.
Varianta 2 - xxxxx xxxxxxx xxxxxx
Xxx hledání xxxxx, xxxxx by xxxxx xxxx ke xxxxxxxxxxx xxxx, bylo xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxx v podobě xxxxxxxxxxxxxx materiálu. Důvodem xx skutečnost, xx xxxxxxxxxxxxxx xxxxxxx xx xxxxx (x xxxxxxx xx xxxxxxx xxxxxxxx xx xxxxxxxx xxxx) xxxxx xxxxx legislativní xxxxxx.
Xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx
Xxxxxxxx 2 xxxxxxxxxxx x předkládaném xxxxxx xxxxxx, xxxxxx xx xxxx xxxxx x xxxxxxxx, xxxxxxxxxxxxx, xx xx s xxxxx xxxxxxxx byly xxxxxxx xxxxx xxxxxxxx xxxxxxx xxx xxxxxx xxxxxxxxxxxxx, podnikatelskou sféru xxxx xxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx. Xxxxxx xxxxxxxx xxxxxxx xxxx Xxxxx republika xxxxxx, xxx xx xxxxxxx x xxxx 3.2. Tyto xxxxxxx xx xxxxx být xxxxx x xxxxxxxxxxxxxxxx xxxxxxxxxx, pokud xxxxxxx xxxxxxxx současný xxxxxx xxxxxxxxxxx, a případně xxxxxxxx x z XX fondů x xxxxxxx, xx se xxxxxx xxxxxx xxx xxxxxxxx projekty xxxxxxxxx xxxxxxxxx podporu.
Definice xxxxxxx x rámci xxxxxxxx 2
Xxxxxxxxx v xxxxx xxxxxxx xxxx xxx xxxxxxxx - x xx
Xxxxxxxx x = xxxxxx zákona x xxxxxxxx
Xxxxxxxx x = xxxxx xxxx xxxxx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx dotčené xxxxxxxx
Xxxxxxxx a
Z xxxxxxxxxxxx xxxxxxxxxxx hlediska xxxx xxx xxxxx xxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxx vtělena do xxxxxx xxxxxx xx xx xxx xxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx x
X xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxx xxx účely xxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxx xxxxxxx do xxxxxx zákona xx xx již xxxxxxxxx xxxxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxx xxxxxx xxxx xxxxxxxxx xxxxxxx (x či x) xxxx xx xxxxxx kritérium xxxxxxx xxxxxxxxxxx x xxxxxxxxxxxxxx xxxxxx xxxxxx. X xxxxxx xxxxxxxx byla xxxx xxxxxxxx začlenění xxxxxx xxxxxx do xxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxx v zákoně x xxxxxxxx, xxxxx xx komplexně xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xx xxxxx ČR. Xxxxx xxxxxxx jediný xxxxx, xxxx xx xxxxxxx xxx xxxxxx xxxxxx včleněna do xxxxxx x xxxxxxxx.
Xxxxxxxx 2 xxxxxxxxxxx xxxxxxxx x předložení xxxxxx xxxxxx, xxxxxx by xxxxx x xxxxxx xxxxxxxxxxx znění xxxxxx x léčivech tak, xxx xxxx xxxxxxxxxx xxxxxxxxxx se problematikou xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxx použitelnou xxxxxx xxxxxxxxx v xxxxxxxx č. 536/2014.
Xxxx xxxxxxxxxxxxx xxxxxxxxx návaznosti na xxxxxxx xxxxxx xxxxxx xxxxxxxxx x zákoně x léčivech xx xxxxxx xxxxxxxx, pokud xxxxx xxxxxxxxx právní xxxxxx xxxxxxxx přípravků. Xxxxxxxxx byla zúžena xxxxxxx xxxxxx xxxxxx. Xxxx proto zvolena xxxxxxxx xxxxxx novely xxxxxx x xxxxxxxx.
Xxxxxx xxxxxx xxxxxxxx xx xxxxxxxx komisí
Nařízení Xxxxxxxxxx xxxxxxxxxx x Rady (XX) č. 536/2014 xxxxxxxxx xxxxxx organizace x xxxxxxxx etických xxxxxx x xxxxxxxxxx členského xxxxx. Xxx přípravě xxxxxx xxxxxx, xxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxx o xxxxxxxx, xxxx xxxx zvažováno x ohledem xx xxxxx žádostí o xxxxxxxx xxxxxxxxx a xxxxx probíhajících klinických xxxxxxxxx xx xxx xxxxxxx xxxxxx xxxxxx xx xxxx xxxxxxx
1. xxxxx etických xxxxxx: xxxxx či xxxx x
2. xxxxxxxxxx xxxxxx xxxxxx.
X xxxxxxxx době xxxx etické komise xxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxx služeb, x xxx xxxx x xxxxxxxx vztahu k xxxxxx xxxxxxxxxx xxxxxxxxx x mnohdy x xxxxxxxxxxx. Vztah xxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxx počtu xxxxxxxx xxxxxx
Xxxxxxxx 1 = jedna xxxxxx xxxxxx
X České xxxxxxxxx xx xxxx xxxxxxx xxxxx jediná xxxxxx xxxxxx.
Xxxxxxxx 2 = xxxx&xxxx; xxxxxxxx komisí
V Xxxxx xxxxxxxxx xx xxxx xxxxxxx xxxx xxxxxxxx xxxxxx.
Xxxxxxxx 3 = kompromisní, jedna xxxxxx xxxxxx x xxxx samostatně xxxxxxxxxxx xxxxxxxxx
Xxxxxxx x přínosy xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxx by xxxx xxxxxx řešení x xxxxxxxx xxxxxxxxxx x xxx x xxxxxxxxx dodržování stanovených xxxx xxx xxxxxxxx xxxxxx komise, které xx dle xxxxxxxx č. 536/2014 xxxxxx xxxxxxxxx xxxxx. Dále zajištění xxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx x xxxxxxxxxx xxxxxxxx postupů, xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxxxx X, xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx x xxxxxxxxxxx xxxxx (xx. xxxxxxxxx xxxxxxx, xxxxxxx, xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx). Jako xxxxxxxxx dopad xxxx xxxxxxxx xxxxxx lze xxxxxxxx potřebu většího xxxxx členů, xxx xxxxxx xxxxxx obsáhla xxxxx xxxxxx. Pokud xxxxxx xxxxxx zajistit xxxxx xxxxxx xxxxx Xxxxxx xxxxxxxxxx, x xx xxx x xxx xxxxxxxxxxx, tak x xxxxx xxx xxxxxxxxxxxxxx xxxxxxxx, (xxx xxxxxxxx nařízení č. 536/2014) x xxxxxxxxx xxxxxx xxxxxxx xx xxxxxxx, xxxxxxxxxxx a diskutovat xxxxxxxxxx dokumenty, xxxxxx xxxxxxxxx x xxxxxxx, xxx xx byla xxxxxxx xxxxxx xxxxxx xxxxxx celou Xxxxxx xxxxxxxxxx xxxxx složitá x zajistit xxxxxx xxxxx na xxxxxxxxx, xxxxx xxxxx xxxxx xxxxxxxx v kratších xxxxxxxxxxx xxx tomu xx xxxxxxx, xxx 1x xxxxx, xxxxx xxxxxxxx. Získání xxxxx xxxx xxxxxx xxxxxx xx členů xxxxxxxxxx xxxxxxxx komisí xx xxxx xxxxxxx pro xxxxxxx xxxxxxx xxxxxx xxxxxxxxxx x znalostí xxxx xxxxxxxxxxxx.
Xxxxxxxx 2
Xxx xxxxxxx xxxx xxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxx zachovat xxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxxxx etických xxxxxx, xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxxxxxxxxx xxxxxx xxxxxx xx místě xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx. Xxx xxxxxxxxxxx xxxxx dnešních xxxxxxxxxxxxxxxx xxxxxxxx xxxxxx lze xxxxxxxxxxx, že i xxxx domluvu se xxxxxx nedodržují dohodnuté xxxxxxx x uplatňují xx specifika xxxxxxxx x posuzování xxxxxxxxx (xxxxx xxxxxxxxx xx xxxxxxxxx, xxxxx přístupy, xx xx x xxxx xxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxxx formulářů). Xxxxx xx snahou, xxx xxxx systém xxxxxxxx xxxxxx i xxx využití xxxxxxxxxxx xxxxx etických xxxxxx, xxxxxxxx xxxxxxxx členů x xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx x xxx odboural xxxxxxxxxxx xxxxxxxx „nešvarů“. Xxxxx xxxxx režim není xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx. Xxxxxxxxx xxxxx xxx x xxxxx xxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxx přijetí xxxxxxxxxx xx xxxxx Xxxxxx xxxxxxxxx. V xxxxx xxxxxxxx xxxxxxxxxxxxxxx, xxxxxxxxxxxxxx a xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx, xx xxxx varianta většího xxxxx etických komisí xxxxxxxxxx.
Xxxxxxxx 3- xxxxxxxxxxx
Xxxxxxx x xxxxxxx xxxx xxxxxxxxxxx xxxxxxx, jedna xxxxxx xxxxxx x xxxx xxxxxxxxx. Zvolená xxxxxxxx představuje xxxxxx xxxxxxxx xxxxxxxx v xxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxx, xxxxxxxx dodržení xxxxxxxxxx xxxxxxxx xxxxxxxxxx v xxxxxxxx xxxxxx xxxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx jednotlivých xxxxxx (xxxxxxx xxxxxxxxxx xxxx x xxxxxxxxxx xxxxxxx) a xxxxx xxxxxxxxxxx, finančního zajištění xxxxxx xxx činnost xxxxxx xxxxxx a xxxxxxx xxxxxxxx pracovních xxxx xxx koordinátory xxxxxx xxxxxx x xxxxxx xxxxxx xxxxxx xxxxxx xx xxxxxx xxxxxxxxx z náhrad xxxxxx xx posouzení xxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxxxx spolupracovníků budou xxxxxxxxx jak xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx x osob xxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x. 536/2014 x Xxxxxxxx II čl. 9.
Xxxxxxxx xxxxxx variant
Za xxxxxx xxxxxxxxx xxxxxx xxx xxxxxx xxxxxx x nařízením, xxxxxxxx xxxxxxx etických komisí (xxxx xxxxx z xxxxxx unifikace xxxxx) x efektivita činnosti xxxxxx xxxxxx.
Xx xxxxxxx xxxx uvedených xxxxxxxx xxxx xxxxxxx kompromisní xxxxxxxx 3, xxxxx xxxxxxx x xxxxx xxxx xxxx xxxxxxxxx xxxxxxx. Výslednou xxxxxxxxx xx xxxxx etická xxxxxx s více xxxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxx záruku stejného xxxxxxxx x obdobných xxxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxxx vydávání xxxxxxxxxx x určených xxxxxx krátkých lhůtách xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx jednotlivých skupin (xxxxxxx xxxxxxxxxx xxxx x xxxxxxxxxx xxxxxxx) x větší xxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx zázemí xxx činnost etické xxxxxx a xxxxxxx xxxxxxxx xxxxxxxxxx míst xxx xxxxxxxxxxxx etické xxxxxx a xxxxxx xxxxxx etické komise xx xxxxxx xxxxxxxxx x xxxxxx xxxxxx xx posouzení xxxxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxx xxx xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxx x xxxx xxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx zajistí dodržení xxxxxxxxx stanovených xxxxxxxxx x. 536/2014 x Xxxxxxxx XX čl. 9.
Definice xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx
X současném xxxxxxx etických xxxxxx, xxx jsou zřizovateli xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxx xxxxxxxxxxx xx místě xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx. Xx xx xxxx xxxxxx důvod xxxxxxxx xxxxx xxxxxxx. Xxxxxxxxxx xxxxxxxxxx zřizovatelů xxxx xxxxxxxxx následující xxxxxxxxxxx.
Xxxxxxxx 1 = xxxxxxxx xxxxxx komise/etické xxxxxx
Xxxxxxxx 2 = xxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx xxx lékařských xxxxxxxxx
Xxxxxxxx 3 = xxxxxxx etické xxxxxx/xxxxxxxx xxxxxx při xxxxxxxxx xxxxxxx
Xxxxxxxx 4 = xxxxxxx xxxxxx komise xxxx organizační xxxxxx Xxxxxxxxxxxx zdravotnictví
Varianta 5 = xxxxxxx etické xxxxxx/xxxxxxxx komisí xxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx
Xxxxxxx a xxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx činnosti (při xxxxx xxxxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx přes kontaktní xxxxx xx Státní xxxxx pro xxxxxxxx xxxxx, xx xxxxxxxx xxxx xxxxxx xx xxxxxx xxxxx dále xxxxxxxxxx xxxxxxxx prostředky xx činnost xxxxxxxxxx xxxxxxxx, xxxxxx komise xx xxxxxxx požadovat xxxx xxxxxxxx, protože xx xx xxxx x rozporu x xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxx platbě xxx xxxxxxx xxxx), xxxxxxxx xxx xxxxxxxxxxxx xx xxxxxx xxxxxx xxxxxx a xxxxxxxxx xx spolupráci vynutit; xxxxxx xxx x xxxxx, xxxx xxxxxx xxxxxx xx xxxxxx xxxxxx xx mohly xxx určeny xxx xxxx činnost z xxxxxxx event. xxxxxxxxxxxx xxxxxxx žadatelů. Xxxxxx xxxxxxxxxxxxxx xxxxx specifické xxxxxxx xxxxxxxxxxx z xxxx varianty.
Varianta 2
Xxxxxxx xx xxxxxxxxxx fakultách xx xxxxxxx s xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxxx pracovníci xxxx zároveň lékaři - xxxxxxxxxxx poskytovatelů xxxxxxxxxxx xxxxxx xxxxxxxxx xxxx založených xxxxxx. Xxxxxx xxx xxxxx xxxxx xxxxxxxxxx xxxxxxx xxx náklady vyplývající x xxxx xxxxxxxx.
Xxxxxxxx 3
Xxxxxxxxx této xxxxxxxxxxx xxxx xxxxx již x minulých xxxxxx, xxx xxxxx nebyla x praxi xxxxxxx. Xxxxxxx xxxxx xxxxxx xxxxxxxxxx x této xxxxxxx, xxxxxxxx xxxxxxxxx xx xxxxxx xxxxx x poplatků xx xxxxxxxx xxxxxxxxx, xxx Xxxxxx ústav xxx xxxxxxxx xxxxx by xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx úřady. Xxxxxx xxxxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxx varianty.
Varianta 4
Xx xxxxxxxx xxxxxx xxxxxx xxxx organizační xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxx xxxxxxx xxxxxxx xx xxxxx xxxxxxxx xxxxxxxxxx úvazků. Xxxxxx identifikovány xxxxx xxxxxxxxxx přínosy vyplývající x této varianty.
Varianta 5
Xx zřízením xxxxxx xxxxxx xxxx poradního xxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xxxxx xxxxxxx náklady xx xxxxx navýšení xxxxxxxxxx úvazků. Xxxxxxx xxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx technického xxxxxxxxxxx činnosti etické xxxxxx x xxxxxxxxx xxxxxx xxxxxx. Rovněž xxx možnost krytí xxxxxxxxxx požadavků xx xxxx xxxxxx xxx xxxxxxxxxxxx etické xxxxxx/xxxxxxxx xxxxxx a xxxxxx xxxxxx. Snazší zajištění xxxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxx x snazší xxxxxxxxx xxxxxxxxxx xxxx. Xxxxxxx xxxxx bude xxxxxxxx xx xxxxxxx Statutu x Jednacího xxxx xxxxxxxx Ústavem po xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx a xxxxxx xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxxxxx xxxxxxxxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx a administrativní xxxxxxx xxxxxxxx xxxxxx xxxxxx/xxxxxxxx xxxxxx xxxxxxx xxxxx etické komise x xxxxxxx se xxxxxxxx procesu „xxxxxxxxxxx“ x xxxxx xxxxxxxx xxxxxx xxxxxx. Xxxxxxxxx xxxxxxxxxxxx vychází xx xxxxxxxx xxxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxxxxxxx, xxxxxxx jsou xxxx. Výbor xxx xxxxxxx xxxxxxx, Xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx xx., xxx xxxxxxx xxxxx xx xxxxxxxxxxx, technicky a xxxxxxxxxx závislý xx Xxxxxxxx xxxxxx agentuře, xxx xxxxxxx xxxxxxx x xxxxxxxxxxx xx xxxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx kritérium xxxx xxxxxxx efektivita x xxxxxxxxx xxxxxxxxxxxx činnosti xxxxxxxx xxxxxx xxx, xxx xxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx území XX.
Xxxxx xxxxxxxx xxxx zamítnuta x xxxxxxxxxxxxx xxxxxx: xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx (xxx xxxxx xxxxxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx xxxx kontaktní xxxxx xx Xxxxxx xxxxx xxx xxxxxxxx léčiv, xx nejevilo xxxx xxxxxx ze strany xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxx, xxxxxx xxxxxx xx xxxxxxx xxxxxxxxx jiný xxxxxxxx, xxxxxxx xx xx bylo x xxxxxxx x xxxxxxxxxx xxxxxxxx č. 536/2014 x xxxxx platbě xxx xxxxxxx stát), xxxxxxxx xxx xxxxxxxxxxxx xx xxxxxx xxxxxx komise x xxxxxxxxx xx xxxxxxxxxx xxxxxxx; stejně xxx x xxxxx, xxxx xxxxxx komise xx xxxxxx xxxxxx xx xxxxx být xxxxxx xxx tuto xxxxxxx z pohledu xxxxx. xxxxxxxxxxxx xxxxxxx xxxxxxxx.
Xxxxx varianta xxxx xxxxxxxxx x následujících xxxxxx: xxxxxxxx xx xxxxxxxxxxx, xx xxxxxxx xxxxxxxxxx fakult je xxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxxx x akademičtí xxxxxxxxxx xxxx xxxxxxx xxxxxx zdravotnických zařízení, xxxx i xxxxxxxxxxxx, xxx i xxxxx xxxxx xxxxxxxx.
Xxxxx varianta xxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx: Realizace xxxx alternativy xxxx xxxxx již v xxxxxxxx xxxxxx, xxx xxxxx xxxxxx v xxxxx xxxxxxx. Krajské xxxxx xxxxxx xxxxxxxxxx x xxxx xxxxxxx, xxxxxxxx zajištění xx xxxxxx xxxxx z xxxxxxxx za xxxxxxxx xxxxxxxxx, xxx Státní xxxxx xxx kontrolu xxxxx by xxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxx xxxxxxxx xxxx zamítnuta x xxxxxxxxxxxxx důvodů: Zřízení xxxxxx komise xxxx xxxxxxxxxxx složky Ministerstva xxxxxxxxxxxxx nebylo xxxxxxx x důvodu požadavku xx xxxx xxxxxxxx xxxxxx x zajištění xxxxxxxxxx xxxxx nových xxxxxx x xxxxxxxx xxxxxx xxxxxx.
Xxxx xxxxxxxxxxxx xxxx xxxxx xxxxxxx xxxx xxxxxxxx z xxxxxxxxxxxxx xxxxxx: Návrh xxxxxxx xxxxxx komise/etických xxxxxx jako xxxxxxxxx xxxxxx Státního ústavu xxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx - xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx technického xxxxxxxxxxx xxxxxxxx xxxxxx komise x xxxxxxxxx xxxxxx xxxxxx, rovněž xxx xxxxxxx xxxxx finančních xxxxxxxxx na nové xxxxxx xxx koordinátory xxxxxx komise/etických xxxxxx x xxxxxx xxxxxx. Xxxxxx xxxxxxxxx koordinace xxxxxxxxxx přezkumu x xxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxxx dodržování xxxx. Poradní xxxxx xxxxxxx na xxxxxxx Xxxxxxx x Xxxxxxxxx xxxx, xxxxx xxxxx xxxxxxxx x xxxxxx Xxxxxxx xxxxxxx pro xxxxxxxx xxxxx xx xx xxxxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, do rozhodovací xxxxxxxxx nezasahují xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv a xxxxxxx xxxxxxxxx xxxxxx xxx xxxx ovlivňována xxxxxxxxxxxx. Zajištění nezávislosti xxxxxxxxx i xxxxx xxxxxxxxx xxxxxx Xxxxxxxx xxxxxx xxxxxxxx, kterými xxxx např. Xxxxxx xxx xxxxxxx xxxxxxx xx.
Xxxx nejvhodnější xxxxxxxxxxx xxxx xx xxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx jako xxxxxxx xxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv.
Právní xxxxxx xxxxxxxx se xxxxxxx škod
Nařízení Evropského xxxxxxxxxx a Rady (XX) č. 536/2014 xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxx způsobené xxxxxxxxx xxxxxxxxx x xxxxxxxxxxx s xxxxxx xxxxxx ve studii xx území xxxxxx xxxxxxxxx xxxxx v xxxxxxxxxx tohoto členského xxxxx x zároveň xxxxx příklady xxxx xxxxxxxxx, xxxxxx xxxx xxxxxxx xxxxxx. V xxxxxxxx xxxx xx xxxxx xxxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx. Xxxxxxx xxxx xxxxx xxxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx č. 89/2012 Sb. xxx xxxxxxx xxxxx xxxxxxxxx xxxx, xxxxx xx xxxxxxxx x současném xxxxx zákona x. 378/2007 Sb., ale xxxx případnou nemajetkovou xxxx. Při xxxxxxxx xxxxxx nového znění xxxxxx xxxx xxxxxx xxxxxxx více možností xxxxxx náhrady xxxx. Xxx xxxxxxxx návrhu xxxxxx bylo xxxx xxxxxxxxx xxxxxxxxx, xxxx x úvahu připadající xxxxxxx xxxxxxx náhrady xxxxx xxxxxxxx, xxx xxxx xxxxxxx x xxxxxxxxx. Proto xxxx xxxx problematika xxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx xxxx xxxxxxx níže x původním xxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxxx, xx xxxxxxx xx xx xxxx xxxxxxxxx vybrat xxx xxxx xxxxxxxxxxxxxxxx či xxxxxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxx
Xxxxxxxx 1 = systém xxxxxxx xxxxx spočívající x xxxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxxxx by byli xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxx bankovní xxxxxx.
Xxxxxxxx 2 = systém xxxxxxx škody xxxxxxxxxxx x založení fondů xxx xxxxxxx xxxxx
Xxxxxxx xxxxx xx xxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxxxxxxxx společností xxx xxxxxxx škody.
Varianta 3 = xxxxxx xxxxxxx xxxxx xxxxxxxxxxx v xxxxxxxxx komerčního xxxxxxxxx
Xxxx xxxxxxxx by xxxxxxxxx xx xxxxxxxxxx xxxxx. Xxxxxxx ve stanovení xxxxxxx xxxxxxxxxx zadavatele xxx po xxxxx xxxx provádění xxxxxxxxxx xxxxxxxxx sjednané platné xxxxxxxxx své, xxxxxxxx xxxxxxxxxxxx x xxxxx xxxxxxxxxxxx, které xx xxxxx xxxxxx za xxxx vzniklou xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxx účasti x xxxxxxxxx xxxxxxxxx xxx xxxx xxxxxxxxx.
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx xxxxxxx subjekty
Varianta 1
Xxxx xxxxx x xxxxxx xxxx zvažováno xxxxxxxxx x xxxxxx bankovní xxxxxx, které by xxxx xxx xxxxxxx x xxxxxxx průběžnými xxxxxxx xxx xxxxxxxxxx. Xx provedení xxxxxxx xxxx xxxxxxxx xxxx xxx xxxxxx xxxxx, xx roční xxxxxxxx xx xxxxxxxx xxxxxx xx xx xxx xxxxxxx klienty xxxxxxx xxxx ročních xxxxxxxx xx zajištění pojištění, xxxxxxx při xxxxxx xxxx by xxxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxxx xxxx vysokými xxxxxxxxxxxxx xxxxxxx. Xxxxxxx xxx xx xxxxx xxxxxxxx xxxx xxx nanejvýš xxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx mírou xxxxxx, xxx x x xxxxxx xxxxxxxxx xx xx xxxx poplatků xxxxxxx xxxx pojistného xxxxx xxx zajištění xxxxxxx xxxxx xxxxxxxxxx. Xxx menší společnosti, xxxxx by nebyly xxxxxxxxx jako xxxxxxx xxxxxxx xxxxx, by xxxxxx xxx složena xxxxxxxx xxxx xxxxxxxx xxxxxx v hotovosti, x xxxx xxxxxx xx byly xx xxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxxx, což xx mohlo xxx xxxxxxxxx xxx činnost xxxxxxxxxx. Toto xx xxxxxxx xxx xxxxx xxxxxxxx xxxxxxxxx, kde xx xxxxx xxxxxx xxxxxxxxx xxxxxxxxx náhrady xxxxx bankovní xxxxxxx. Xxxxx xxxx xxxxxxxx xxxxxxx xxxxx by xxxxxxx x xxxx xxxxxxxxxx a činnosti xxx Xxxxxx ústav xxx xxxxxxxx léčiv, xxxxx xx byl xxxxx stranou, x xxx by xxxx xxxxxxx xxxxxx a xxxxx xx xxxx xxxxxxxx xx xxxxxx xxxxxxxxxx odškodnění.
Varianta 2
Další xxxxxxxxxx xxxxxxxxx vytvoření xxxxxxxxx xxxxxxx náhrady xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx založení xxxxx xxxxxxxxxxxxxxx společností xxx xxxxxxx xxxxx. Xxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx odmítly xx xxxxxxxxxxx, že xxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxx xxxx xxxxxxxx. Xxxx xxxxxxxx xxxxxxx xxx xxxxx dále xxxxxxxxxxxxxx a xxxx xxxxx xxx xxxx xxxxxxxxx.
Xxxxxxxx 3
Xxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxx xx xxxxx xxxx provádění klinického xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxx, hlavního xxxxxxxxxxxx a xxxxx xxxxxxxxxxxx, xxxxx by xxxxx plnění za xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx v důsledku xxxxxx xxxxxx v xxxxxxxxx hodnocení při xxxx provádění, xxx. xxxxxxxx xxxxxx systém xxxxxxxxxx. Xxxxxxx xxxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx x xxx xxxxxxxxx xxxxx, xxx xx xxxxxx xxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx kritérium xxxx xxxxxxx xxxxxxxxxx x zajištění xxxxxxxx xxxxxxxxx xxxxxxxx subjektů xxxxxxxxxxx x rámci xxxxxxxxxx hodnocení xxxxxxxxx xx xxxxxxx xxxx.
Xxxxxxxx 1 xxxx xxxxxxxxx, xxxxxxx xxxxxx xxxxxx xxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx. Xxxxxx xxxxxxx xxxxx xxxxxxxxxxx v xxxxxxxxx xxxxxx xxxxxxxx xxxxxx by xxx xxxxx xxxxxxx xxxxx xxx xxxxxxxxxxxxxxxx (xxxxxxxxxxxxx) xxxxxxxx klinická xxxxxxxxx. X xxxxxxx menších xxxxxxxxxx zadavatelů (xxxxxxxxxxxxxx) xx xxxx varianta xxxxx xxx x xxxxxxxx vzhledem x xxxxxxxxx plného jištění xxxxx. Xxxxxxxx 2 xxxxxx x ohledem xx xxxxxxxxx xxxxxxxxx xxxxxxxx dále xxxxxxxxxxxxxx. Xxxx nejvhodnější xxxx xxxxx xxxxxxx xxxxxxxx 3, kdy xxxx xxxxxxx též xx xxxxxxxxx xxxxxxxxx praxe. Xxxx xxxxxxxx založená xx xxxxxxx xxxxxxx xxxxx zajištěné xxxxxxxxx xxxxxxxxxx xx osvědčená x v xxxxxxxxxxx x xxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxxxxxxx.
Xxxxxx xxxxxx xxxxxxxx xx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx
Xxx xxxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxx nemožnosti realizace xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx pojištění, xxxxx xxxxxxxx xxxxxxxxx realizovaná x finančních xxxxxx xxxxxxxx xxxxxxx nemohou xx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx. Xxxx xxxxxxxxx xx xxxx zákonnou xxxxxxxxx x xxx jeho xxxxxxxxx se xxxxx xxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxxxxxx xxx xxxxxxx finanční xxxxxx x nadačních xxxxx xx x rozpočtu xxxxxxxxxxxxxx xxxxxxxx x x případě, xx xxxx peníze xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx.
Xxxxx xx xxxxx x xxxxxxxxxx xxxxx xxxxxxxx x xxxxx xxxxxxxxx nastavení xxxxxxx xxxxxxxxxx, xxx x xxxxxxx x xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxx zajištění x xxx. xxxxxxxxxxxx xxxxxxxxxx. Xxxx xxxxxxxx xxxx xxxxxxxxx xx základě xxxxxxxxxxxxx zjištěných xxxxxxxxxxx: xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxx nízkointervenčních xxxxxxxxxxxx xxxxxx xx xxxxxxxx xxxx 40 až 100 xxxxxx korunami xx xxx; v xxxxxxxxxx 10 xxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx x xxxxxxxxxxxx klinického xxxxxxxxx; xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx často xxxxxxxxx xxxxxxxx xxxxxxxxx x rámci grantového xxxxxxxx, na xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx podporu, xxxxxxx xxx xxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxx zahrnout xxxxxxxxx. X takovém xxxxxxx xx xxxxxxx grantu xxxxxxx, xxx xxxxxx xxxxxxxx xxxxxx xxx xxxxxxxxx pojištění, xxxxx xx xxxxxxxx xxxx xxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxx xxxxxxx č. 378/2007 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx.&xxxx; Xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx náhrad xxxx xxxx xxxxx xxxxxxxxx xxx klinická hodnocení xxxxxxxxxxxx zadavatelů x xxxxxxxx přípravky xxxxxxxxxxxxxx xx xxxxx ČR x používanými x xxxxxxx x xxxxxx xxxxx, tzn. xxxxx xxxxxxx xxxxx x xxxxxxxxx nebo xxx xxxxx xxxxxxxxxxx off xxxxx použití (např. xxx pediatrické xxxxxxxx) xxxxxx možnost xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxx způsobené xxxxxxxxxxxx xxxxxxxxxx
Xxxxxxxx 1 = xxxxxxx xxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxx
Xxxx xx xxxxxx x xxxxxxx xxxxxxxxx xxxxx subjektu xxxxxxxxxx xxxxxxxxx tuto xxxxx xxxxx x prostředků xxxxxxxxxxx x tomuto xxxxx x rozpočtu Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 2 = vytvoření xxxxx xxx nekomerční xxxxxxxx x Xxxxxxxxxxxx xxxxxxxxxxxxx
Xxxx xxxxxxxx by byla xxxxxx xxxxxxx zvažované xxxxxxxx zřízení xxxxx x xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx.
Xxxxxxxx 3 = možnost xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx jeho xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxxx x přínosy xxx jednotlivé xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxx xxxx xxxxxxxx xx xxxx xxxxxxx akademického xxxxxxx xxxxxxxx x úsporou xxxxxxxxxx xxxxxxxxxxxx na xxxxxxxxx xx xxxxxxx, xxx xxx xxxxxxxxxx xxx xxxxx x xxxxxxxxxx xxxxxx zaznamenán xxxxxx, kdy xx xxxxxxx xxxxxx hodnocení xxxxx o xxxxxxxxxx. Xxxxxxx by xxxx xxxxxxx x xxxxxxxx xxxxxx xxxx xxxxx x xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 2
Druhou zvažovanou xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx škody xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx založení fondu xxx nekomerční xxxxxxxx x Ministerstva xxxxxxxxxxxxx. X xxxxxxx xxxxxxx xx zákon xxx xxxxx xxxxxx upravovat xxxxxx uvažovaného xxxxx, xxxxxx xxxxxxxxxx xxxxxxxxxx, xxxxxx odměňování xxxxxxxxxxx xxxxx a x xxxxxxxxxx xxxx xxxx xx, x xxxxxx xxxxxx, x xxxx xxxx x x xxxxxx xxxxxxxxxxx xx xxx xxxx naplňován. X xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx vkladu xx xxxxxx xxxxxxxxxxxx, xxxxx xx xxxx xxxxxxxxxx příspěvky určité xxxxxx xxxxxxx za xxxxxxx xxxxxx za xxxxxxxxx klinických xxxxxxxxx. Xxxxxxxx k možným xxxxxxx xxxxxxxx na xxxxxx fondu x xxxx xxxxxxx bylo xxxx řešení vyhodnoceno xxxx xxxxxxxxxxx x xxxxxxxxx.
Xxxxxxxx 3
Třetí xxxxxxxxx xx xxx xxxxxxxxxx xxxxxxxxxx možnost zajistit xxxxxxxxx prostřednictvím xxxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx, xxxxx xxxxxxxxx činnosti xxxxxxx použití léčivých xxxxxxxxx v rámci xxxxxxxxxx hodnocení. Xxxxxx xxx xxxxxxxx x xxxxxxxxx xxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxxx hlavní xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxx diskriminace xxxxxxxxxx xxxxxxxxxx.
Xxxx xxxxxxxxx xxxxxxxx 1 a 2 Xxxx xxxxxx xx xxxxx mohlo znamenat xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx. Xxxxx xx obě xxxxxxxx znamenaly xxxxx xxxx xxxxxx ministerstva. X xxxxxxx xx xxxx xxxxxxx, xxxx xxxxxxx varianta 3, xxxxx stanovuje xxxx xxxxx xxxxxx xxxxxxx xxxxx pro xxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxx xxxxxxxxxx xxxxxxxx x xxxxx xxxxxxxxx xxxxxxxx xxx poskytovatele xxxxxxxxxxx xxxxxx, a xxxxx. xxxxxxxxx pojištěním xxx xxxxxx xxxxxxxxxxxx, v xxxxxxx případě xx xxxxx připojištění xxxxxx xxxxxxxxxx.
2.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxx 36 Xxxxxxx o xxxxxxxxx Xxxxxxxx xxxx xxxxxxx xxxxxx, xxx které xxxxx členské státy xxxxxxxx xxxxxxxxxxxx opatření, xxxxx xxxxx přeshraničnímu xxxxxxx. Xxxxxx z xxxxxx důvodů je xxxxxxx zdraví a xxxxxx xxxx. Xxxxxx xxx opatření xx xxxxxxx čl. 81 směrnice 2001/83/XX by měla xxx xxxxxxxxxx na xxxxxxx ochrany veřejného xxxxxx.
Xx účelem xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx x xxxxxx xxxxxxx xxxxxxxxx zdraví xxx xx možné xxxxxxxx xxxxxxxx, která by xxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxxxxxxx xxxxxx úpravou xx xxxxxxxxxx xx xxxxxx xxxxx dotčených xxxxxxxx x xxxxx se x xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx.
Xxx hodnocení xxxxxxxx xxxxxxxxxx právní xxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx (xxxxx mohou být xxx xxxxxxxxxx za xxxxxxxx) xxxxxx xxxxxx:
- xxxxxxxxxxx;
- xxxxxxxxxxxxxxx;
- xxxxxxxx;
- xxxxxxxxxxxx;
- minimalizace;
- xxxxxxxxxx xxxxxxxx;
- xxxxxxxx;
- xxxxxxxxxx.
Xx xxxxxxxxxxx - xxxxxx xxxxxx omezení reexportů xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx, jehož xxxxxx xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxx poskytování xxxxxxxxx xxxx x České xxxxxxxxx v případě, xx xx xxxx x České republice xxxx hrozit xxxxxx xxxxxxxxxx pro xxxxxxx xxxxxxxx x xxxx xxx xxxxxxxx xxxxxxxx xxxx x ochrana xxxxxx x života xxxx. Komplexnost xxxxxx xxxxxx xxxxxxx ve xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx přípravků pro xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx (úprava xxxxx x stanovení xxxxxxxx x xxxxxxx xxx xxxxxxxxxxxxx dat), xxxx ve xxxxxxxxx xxxxxxxxxxx xxxxxxxx v xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů x České xxxxxxxxx x konečně xx xxxxxxxxx xxxxxxxxxxx sankcí xx xxxxxxxx xxxxxxxxx xxxxxxxx. Úprava xxxxxx xxxxxx xxx na xxxxxx xx xxxxxxxxx xxxxx Xxxxxxxx unie, xxx do třetích xxxx.
Xx xxxxxxxxxxxxxxx - xxxxxxxx xxxxxx je xxxxxxx xxx, xxx xxxx xxxxxxx subjekty x xx největší xxxxx xxxx xxxxxxx xxxxxxxxx xxxxxxx přijetí xxxxxxxx a xxxxxxx xxxx xxxxxxx xx xxxx skutečnost xxxxxxxx. Xxxxxxxxxxxxx xxxxxx xx xxxxxxxx xxx v xxxxxxx identifikace x xxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx republice, tak x xxxxxxx xxxxxxx xxxxxxxxxxx opatření. Dotčené xxxxxxxx xxx mají xxxxxxxxxx xxxxxxx xxxxxx xxxxx přijatým xxxxxxxxx.
Xx xxxxxxxx - xxx xxxxxxxx xxxxxxxxxxxxxxxx x xxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx xx xxxxx x xxxx xxxxxxx x xxxxxx právní xxxxxxx xxxxxxxx navrhované xxxxxx xxxxxx je xxxx xx xxxxxxxxxxxx x xxxxxxxxxxxxxxxxx xx vztahu xxxxx xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xx odůvodněnost - xxxxxxxx a postup xxx vyhodnocování xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxx xxxxxxx reexportu xxxx plně v xxxxxxx xx zájmem xx xxxxxxx xxxxxx x života lidí x x každém xxxxxxxxxx případě xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxx opatření.
Ad xxxxxxxxxxxx - v xxxxxxx xx xxxxxxx xxxxxxxxxxxx xxxxxx úpravy je x xxxxxx splnění xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx dle xxxxx Xxxxxxxx xxxx xxxxxxx xxxxxxxx omezení xxxxxx xxxxx v xxxxxxxxx, xx kterých xx xxx xxxxxxxxxxxx xxxxxxx xxxxx xx xxxxxxx xxxxxx x xxxxxx xxxx. Na xxxxxxx navrhovaného xxxxxxx xxxxx dat x xxxxxx xxxxxxxxxxxxx dojde x zajištění xxxxxxxxxxxxxxxx xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx. Xxxxxxxxxx právní xxxxxx zavádí xxxxxx, xxxxx x xxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxx xxxx x xxxxxxx xx xxx x plošné xxxx xxxxxxxxxx omezení. Xxxx tedy xxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxx xxxxxx xxxxx. Regulace xx xxxxxxxx pouze xx xx případy, kdy xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxx xxxxx xxxxxxxxxx xxx xxxxxxx xxxxxxxxx xxxx x xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xxxxx opatření xx dále xxxxxxxx xxxxxxxxx tím, xx xx xxxx xxxxxxx xxxxxxx xxxxx xx xxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxxxxx. Xxxxxxxxx xxxxxx xxx xxxxxxxxx mimořádnost přijetí xxxxxxxxxxx opatření, x xx výlučně pro xxxxxxx xxxxxx nedostupnosti xxxxxxxx přípravků pro xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx.
Xx ekonomická xxxxxxxx - xxxxxx xx navržen xx xxxxxxxx, xxxxx xxxxxxx xxx zavedené mechanismy xxxxxxx xxxxxxx a xxxxxxxxxxxx a xxxxxxx xxxxxxxxxxx k xxxxxx xxxxxxxxxx x analýze, x xxx xxxxxxxxxxx xxxxxxxx dotčené xxxxxxxxxx xxxxxxxx ani xxxxxx xxxxxxx xxxxxx. Byla xxxxxxx xxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxx systému.
Ad xxxxxxxx - xx xxxxxx xxxxxxxxx možnosti xxxxxx reakce na xxxxxxxxx nutnost xxxxx xxxxxx xxxxxx se xxxxxxxxxxx xxxxxxxx upravit xxxxxxxxxx xxxxxxx předpisem (xxxx. xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx nedostupností, xxxxxxxxx xxxxxxxx, případně xxxxxxxx x xxxxxxx xxxxxxxxxxxxx xxxxx x xxxxxxxxx).
Xx xxxxxxxxxx - za xxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx jsou xxxxxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx. Xxxx xxxxxx xxxxxxxx xxxxxx xxxx, xxx x nich xxx xxxxxxxxxx naplněn xxxxxxxxxxx xxxxx.
Xxxxxxxxxxx xxxxxxx xx řešena xxxxxx xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xx xxxxx x xxxxxxx xxxxxxxxxxx z xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxx xxxx v xxxxxxxxxx §33 odst. 2 xxxxxx x xxxxxxxx stanovenou povinnost xxxxxx hlásit xxxxxxxxx xxxx xxxxxxxx dodávek xx xxxxx xxx xxxxxxx 2 xxxxxx xxxxxx.
Xxxxxxxxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx x reexportů xxxxx xx xxxxxxxx xxxxxxx x Xxxxx xxxxxxxxx, xxx též xxxxxx EU. Objem xxxxxxxxx léčiv xx xxxxxxxx xxxxxxx a x původně okrajové xxxxxxxxxxx xx stala xxxxxxxxxx xxxxxxxx xxxxxxx. Xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx x kontextu xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx trhů xxxxxxxxx xxxxxxxxx rozhodnutí o xxxxxxxxxx vliv na xxxxxxxxxxx xxxxxxxxxxx xxxxxx x Xxxxxx. X xxxxxxxx xxxxxxxx xxxx xxxxx k xxxxxxx xxxxxxxxxx xxxxxxxxxx vynakládaných xxxxxxx na xxxxxx x xxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxx x zavádění xxxxxxxxxxxx xxxxx xx xxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx. Ukazuje xx, xx xxxxxxxx vnitřní xxx x xxxxxxxx xxxxxxxxx xx xxx xxxxxxxxx xx xxxxxx xxxx ovlivněná xxxxxxxx xxxxxxxxxxx xxx xxxxxxxx xxxxxxxxx a výše xxxxx z xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxx. Je xxxxxxx, xxx x nadále xx jednotný xxx x xxxxxx xx xxxxxxxxx pacientů a xxxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxx x xxx xxxxxxxx x principy xxxxxxxx xxxxxxxxxx trhu x xxxxxxx léčivých xxxxxxxxx xxxxx trh xxxxx xxxxxxxx.
Xxxxxxxx x xxxxxx reexportů xxxxxxx xxx xxxxx hlášených xxxxxxx akutní xxxxxxxxxxxxx xxxxxxxx přípravků v xxxxxxxxxxxx xxxxxxx XX. Xxxx xx stále xxxxxxx objevuje problém x xxxxxxxxxxxxx konkrétních xxxxxxxx přípravků xx xxxx zemích EU xxxxxxxx, xxx vede x xxxxx silnějšímu xxxxx xx vývoz xxxxxxxx přípravků xx xxxx x příznivější xxxxxxx hladinou. X xxxxxxx faktické xxxxxxxxxxxxx xxxxxxxx přípravku xx xxxxx stav xxxxx xxxxxx xxxxxxxx a xxxx xxxxxxxxxxx xxxxx. Xxxxx v xxxxxxxxx, xxx xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx potřeby pacientů x České xxxxxxxxx (xxxxx se xxx xxxxx xxxxxx xxxxxxxxx, xxx ministerstvo xxxxxx xxx. zákaz xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx Xxxxxxx, Xxxxxxxx x XxxxxxxXxxxxxx), xx xx xxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx x xxxxxx xxxx xxxxxxxx nutné xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx jak x xxxxxxxxx xxxxxxxx předpisy, xxx xx závazky xxxxxxxxxxxxx x xxxxxxxxxxxxx xxxxx.
Xxxxxxx xxxxxxx přitom xxxx xxxxxxxxx změnou xxxxxx a xxxxxxxxx xxxxxx a xxxxxxxx xxxxxxxx xxxxxxxx přípravků xxxxxxxxx x xxxx xxxxxx, xx ať xx je xxxx xxxxxxxx xxxxxxxx, x xxxxxxxx xxxxxxxxx, xxxxxx xxxx u dalších xxxxxxx, bývá xxx xxxxxxxxxx finančně xxxxxxxxxx xxxxxxx xxx obchodovaný xxxxxxx xx xxx xx xxxxxxxxxxxx xxxxxxxxxxx xxx v ekonomikách xxxx vyspělých. Xx xx dáno xxxxxxx xxxxx xxxxx xxxxx xxxxxxxxxxxx v xxxxxx xxxxxxxxxx vyspělejších xxxxxx, xxx za xxxxxxx xxx xxxx tito xxxxxxxxx xxxxxxxxx ochotni x také xxxxxxx xxxxx xxxxx xxxxx xxxxxxxxxx xxxxxxxxxx, x x této skutečnosti xxx xxxxxxxxx xxxxxxx x xxxxxxx všech xxxxxxxxxxxxxxxx subjektů, včetně xxxxxxxx xxxxxxxxxx, xxxxxxx, xxxxxxxxxxxx x zdravotních xxxxxxxxxx. Dále prostředky xxxxxx a xxxxxxxx xxxxxxxx xxx x xxxxxx xxxx xxxxxxx xxx xxxxx xxxx xx problémy x xxxxxxxxxxx xxxxxxxx přípravků xxxxxxxxxx z xxxxxx xxxxx v xxxxxxx, xx xxxxxx xxx x minulosti xxxxxx xxxxx a které xxxx nutno xxxxx. Xxxxx prostředky xxxxxx x xxxxxxxx xxxxxxxx xxxxx xxx xxxxx xx x xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx, xxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx potřeb xxxxxxxx x České xxxxxxxxx xxxxxxxxx léčivým xxxxxxxxxx xxxx xxxxxx velice xxxxxx a je xxxxx jej řešit xxxxxxxxxx. X uvedenému xx však xxxxx xxxxxxxxxx, xx vyhodnocování xxxxxxx ovlivňujících xxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx x Xxxxx xxxxxxxxx xx xxxxxxxxx x xxxxxx xx x xxxx xxxxx xxxxxxx xxxxxxxx xxxxxx x xxxxxxxx regulace xxxxxx léčivého xxxxxxxxx.
Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx je xxxxxxxx xxxxxx úpravy xxxxxxx xxxxxxxxx xxxxx xx xxxxxx o xxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx problematiku xxxxx x xxx problematiku xxxxxxxxx xxxxxx dostupnosti. Xxxxxxxxxx a xxxxxxxxxxx xxxx zacházejících x xxxxxx x xxxxxxxxxxx xxxxxxxxx orgánů xxxxxx xx cíl zajištění xxxxxxxxx dostupnosti xxxxxxxx xxxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx xxxx x xxxxxx o xxxxxxxx xxx xxxxxxxx xxxxxxxx, praktické xxxxxxxxxx x aplikace xxxxxxxxx xxxxxx xxxxxx x xxxx xxxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxx odůvodňují xxxxxxx jejího zpřísnění x xxxxxxxx.
Xxxxxxxxx úprava x xxxxxxx xx xxxxxxxxx xxx xx xxxxxxxxxxxx xxxxxxxxx x xxxx xxxxxx, xx xxxxxxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxx xxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx. Xxxxxxxxx xxxxxxxxxx §11 xxxx. x) zákona xxxx xxxxxxxxxxx xxxxxx xxxxxxx x řešení xxxxxxx, xxx&xxxx; xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx omezuje xxxxxxxx potřeb xxxxxxxx x Xxxxx xxxxxxxxx, x xxxxxx tohoto xxxxxxxx xxxx x xxxxxxxxxxx xxxxxxxxx z xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxx, xxxxx nejde x xxxxxxx, xxxxx by xxx xxxxxxx xxxxxxx xxxxxxxxx x se xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxxxxx subjektů.
K zajištění xxxxxxxxxxx xxxxxxxx přípravků xxx xxxxxxxx v Xxxxx xxxxxxxxx je xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxx x opatření, xxxxx xx xxxx xxxxxxx vytvoří xxxxx, xxxxx xx vhodný, xxxxxxxx x xxxxxxxxx x xxxxxxx na xxxxxxxxx xxx, xxxxxx xx xxxxxxxxx dostupnosti xxxxxxxx přípravků pro xxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxxxxxxx xxxxx xxxxxxx x xxxxxxxx ze xxx vzájemně provázaných xxxxx a xxxxxxxx. Xxxxxx x xxxx xx xxxxxxxxx seznamu xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx nedostupností. K xxxxxxxxx tohoto xxxxxxx xxxxx xxxxxxx xxxxxxxx x distribuci, výdeji x spotřebě léčivých xxxxxxxxx. Vytvoření a xxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxx xxxxxx Ministerstvem xxxxxxxxxxxxx, xxxx bude xxxxxxxxx, xx xxxxxxx xx xxxx xxxxxxxxxxxxxx xxxxx xxxxx moci xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx. Uveřejnění xxxxxx xxxxxxx bude xxxxxxxx xx xxxxxxxxxx xxxxxx všech xxxxxxxxxxxxxxxx xxxx vůči xxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx seznamu, xxxxxx xxxx, že by xxxxxx xxxxxxxxxxxx měli xxxxxxx x tím, xx xx xxxx xxxx, xx distribuce xxxxxxxxx x xxxxxx xxxxxxxxx xx zahraničí xxxx xxx výhledově xxxxxxx xxxx xxxxxxxx. X xxxxxxx xx xxxx xxxxxxx xxxx xxxxx xxxxxxxxxxx upravit xxxxx distribuce těchto xxxxxxxx přípravků xx xxxxxxxxx xx jejich xxxxxxx distribuci. Xxx xx totiž xxx xx xxxxxx, že xxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxx pro xxxxxxx xxxxxx xxxxxxxxx, xxxxxxx je xxxxxxxxxxxxx, xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx přípravky x xxxxxxxx x xxxxxxxx intervalech xxxxxxxxxxxxxx xxxxxxx pacientů x Xxxxx xxxxxxxxx. Xxxxxx x xxxxxx kroků x xxxxxxxx je xxx xxxxxxx zákonem xxxxxxxxxxx podmínek předání xxxxxxxxxxxx podnětu Xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx k xxxx, xxx vydalo xxxxxxxx xxxxxx povahy, xxxxxx by xxxxxxx xx xxxxxxxx distribuci xxxxxxxx přípravku do xxxxxxxxx, xxxxxxx tento xxxxxx může, xxx x xxxxxx Ministerstvo xxxxxxxxxxxxx xxxxxxxx. Třetím, x to jen xxxxxxxxxxx xxxxxx x xxxxxxxxx je xxxxxx xxxxxxxx obecné xxxxxx, xxxxxx při splnění xxxxxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx omezí xxxx xxxxxx distribuci xxxxxxxxxxx léčivého xxxxxxxxx xx xxxxxxxxx. Při xxxxxxxx takového opatření xxxx xxxx xxxxxxxxx, xx xxxxxxx xxxxx xxxxx moci využít xxx oprávnění stanovená xxxxxxxx xxxxx.
Xxxxxxxxxx režim xx xxxx xxxxxx, xxxxxxxx a xxxxxxxxx x xxxxxxx xx xxxxxxxxx xxx, přičemž x xxxx xxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxxx osob xx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxxx x xxx xxxxxxxxxx x zároveň xx xxxxxxxxx, xx xxxxxxx xxxxxxxx nebudou pro xx xxxxx a xxxxxxxxxx. Xxxxxxxxx xxx xx xxxxxx zajišťuje xxxxxxxx xxxxxxxxxx, xxxxx xxxx x xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx šetrné x xxxxxxxx xxxxxxxxx x xxxxxxx xxxx xxxxxx xxxxxxxxxx xxx x xxx xxxxxxxx xxxxxxxxx xxxxxxx, xxx xxxx v úvahu xxxxxxxxxxx xxxxxxxx xxx xxxxxxx xxx účinná x xxxxxxxxxx xx xxx smysl. Lze xxxx xxxxxx, xx xxxxxxxxxx xxxxxx, xxxxx xx xxxxxxx xxxxx x xxxx xxxxxxxx xxxxxxxxxx §77c x §77d xx xxxxxx, xxxxxxx dostupnost léčivých xxxxxxxxx xxx xxxxxxxx x České republice xxxxxxxxxxxxx způsobem x xxxxxx xxxx xxxxxxxxxxxxx x xxx xxxxxxx xxxxxxxxxxxx.
Xxxxxxxx variant xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxx
Xxxxxxxx 1 = xxxxxx
Xxxxxxx xxxxxxxxx xx xxxxxx nepředložení xxxxxx xxxxxx zákona x xxxxxxxx xxxxxxxx omezení xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx 2 = změna xxxxxxxxxxxx úpravy (xxxxxx x xxxxxxxx)
Xxxxxxxx příslušných xxxxxxxxxxx xxxxxxxx.
Xxxxxxx a xxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Nepředložení xxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, xxx se xxxxxxxxx xxxxxxx, že je xx xxxx nedostupný xxxxxxxx xxxxxx xxxxxxxxx x je xxx xxxxxxxx xxxxxx xxxxxxxx x XX. X xxxxxxxxx zdraví může xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, xxxxx xx xxxxx nebylo xxxxx xxxxxxxxx, xxxxx xx na xxxx xxxx dostupné xxxxxxxx xxxxxx xxxxxxxxx (xxxxx xxxxxxxxx xxxxxxxxxx atp.). Xxxxxxxx xxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxx, xxxxx xx xxxx zdraví pacientů x XX.
Xxxxxxxx 2
Xxxxxxxxxxx xxxxxxxxxxx opatřeními by xxxx xxxxx xxxxxxxxx x x xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxx, xxxxx by xxxxxxxxx zájem na xxxxxxx xxxxxx xxxxxxxx xx xxxxxx xxxxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxxxxxxxxxx příležitostí. Xxxx vyvažování zájmů xx xxxx prováděno xxxx x xxxxxxx x xxxxxx XX, xxxxx umožňuje omezit xxxxx pohyb zboží xx xxxxxx xxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx zvoleno xxxxxxxxx xxxxxxx veřejného xxxxxx x souladu s xxxxxx XX.
Xxxxxxxx 1 xxxx xxxxxxxxx s xxxxxxx na xxxxxx xxxxxxx xxxxx xxxxx xxxxxxx (xxxxxxxxxxx xx xxxxxxx nedostupnosti xxxxxxxx xxxxxxxxx z důvodu xxxxxx xxxxxxxxx). Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Xxx zachování současné xxxxxx úpravy x xxxxxx x xxxxxxxx xx v Xxxxx xxxxxxxxx nemohlo xxxxx x xxxxxxx xxxxxxxxxx xxxxx, kdy mohou xxx xxxxxxx významné xxxxxx přípravky xxx xxxxxxxx x Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx x není xxx x xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxx, xxxxxxx orgány státní xxxxxx nemohou x xxxxxx nedostatku validních xxxxxxxxx x kompetencí xxxxxx xxxxxxxx, která xx s xxxxxxxxxxx xxxxxxxxxx mohla xxxxxxxx xxxxxx takové xxxxxxx. Xxxx xxx xxxxxxx xxxxxxxx xxxxx 2, xxxxx xxxxxxx přijetí xxxxxx xxxxxx úpravy xxxxxxxxxx definovaný xxxxxxx.
Xxxxxx xxxxxxxxxxxx xxxxxx akutní xxxxxxxxxxxxx a xxxxxxxxx xxxxxxxxxxx léčivých přípravků
V xxxxx zvažování různých xxxxxxxx bylo přihlíženo xxx x xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx, xxxxx postupně začínají xxxxxxx xxxxx xxxxx xxxxxx xxxxxxxx omezení xxxxxxxxx xx xxxxxxx č. 81 odst. 2 Xxxxxxxx x. 2001/83 (xxxx. Xxxxxxxxx, Xxxxxxxx, Xxxxxxxxx a xxxxx) x xxx xxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxx.
Xxxxxxxx xxxxxxx xxxxxxx
Xxxxxxxx 1= xxxxxx xxxxxxxx (xxxxxxxxx xxxx)
Xxxxxxxx 2 = xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx na xxx xxxxxxxxx rozhodnutí o xxxxxxxxxx
Xxxxxxxx 3 = xxxxxxxx plošné xxxxxxxxxx xxxxxxxxxxxx xxxxxxx všech xxxxxx
Xxxxxxxx 4 = xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx pouze některých xxxxxx
Xxxxxxxx 5 = xxxxxxx xxxxxxxx distributora xx držitele xxxxxxxxxx x registraci
Náklady x xxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx xxxx znamenat xxxxxxxxx současného xxxxx, xxx se vyskytují xxxxxxx, xx xx xx xxxx nedostupný xxxxxxxx xxxxxx xxxxxxxxx x je xxx xxxxxxxx xxxxxx pacientů x XX. S xxxxxxxxx zdraví xxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx, xxxxx xx jinak nebylo xxxxx xxxxxxxxx, xxxxx xx xx xxxx xxxx dostupné potřebné xxxxxx xxxxxxxxx (léčba xxxxxxxxx komplikací atp.). Xxxxxxxx xxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxxx, ovšem xx xxxx zdraví pacientů x XX.
Xxxxxxxx 2
Xxxxxxxxxxxxx xxx a xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxx x xxxxxxxxx xxxxxxxxx států xx xx xxx xxxxxx xxxxx provázaným xxxxxxxx jednotlivých xxxxxx, xxx xxxxx xx xxxxx se podílí xxxxxxx xxxxxxxx (xxxxxx, xxxxxxxxxx, xxxxx x xxxxxxx) a xxxxxxx xxxxxxxxxxxx xxxx své xxxxxxxxxx xxxxx. Xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx je xxxxxx rozloženo xxxx xxxxxxxxxx xxxxxxxx xxx, xxx xxxx zajištěno xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxx. X xxxxxxx xx vědecký pokrok x xxxxxxxx xxxxxxxxx xxxxxx výzkumného bádání xx xxxxxxxxx x xxxxxxx xxxxxxxxxxx na xxxxx xxxxxxx xxxxxxxx xxxxxxxxx. Xxxxxxxxx zásah xx xxxxxxxxxxxxxxx xxxx xx xxxx xxxxxxx xx druhého xxxxxxxx xx přitom xxxx xxx x xxxxxxxx xxxxxxxx též dopad xx xxxxxxxxxx vynakládané xx xxxxxx xxxxx x xx dostupnost xxxxxxxx přípravků na xxxxxxxxxxxx xxxxxx. Zavedení xxxxxxxxxx držitelů xxxxxxxx xxxxxxx xx xxx xx v xxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxx systému, xx xxxxxx xx tito xxxxxxxxxx xxxxxxxxxxxx xxx xxxxx xxxxxx xx xxxx xxxx. Xxxxxxxx xxxxxx povinnosti by xxxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxxxx 3
Xxxxxxxxx je xxxxxxxx xxxxxxxxxxxxxxx xxxxx xx xxxxxxx, xxx xxxxxxxxxxxx xxxxx xxxxxxx xxxxxx xx xxxxxx xxxxxxxxxxx. Xxxxxxxx by xxx xxxxxxxxx ke xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxx by nebyla xxxxxxxxxxxxxx x xxxxxxx xx požadovaný cíl.
Varianta 4
Xxxxxxxx povinnost xx xxxx preventivní xxxxxx xxx, xxx mohlo xxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx x xxxxxxx hrozby xxxxxx xxxxxxxxxxxxx. Varianta xxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xx Slovensku, xxx xxx xxxxxxxxxx xxxxxxxxx xxx bylo xxxxxx x EU, xxx xx xxxxxxxx xxxxxxxx xxxxxxxxxxxxxxxx. Xxxxxxx xxxxxxxxx xxxxxxxxx pouze x xxxxxxx vytipovaných xxxxxxxx xxxxxxxxx, xxxxx jsou xxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx, xx xxxx xxxxxxxxxxx a xxxxxxxxxx, že dosahuje xxxxxxxxxxxx cíle (xxxxxxx xxxxxxxxx zdraví).
Varianta 5
Tato xxxxxxxx byla xxxxxxxxx x xxxxxxx xx xxxxxxxx xxxxxxxxx ohledně xxxxxxxxxxxx xxxxxxxx x Xxxxxxxx. Výhodou xxxxxxx xxxxxxxx distributora od xxxxxxxx xx xxxx xxxxxxxxx řešení xxxxxx xxxxxxxxxx xxxxxxxxxxxx vztahů x xxxxx na xxxxxx xxxxxxxxx subjektů. Xxxxxxxxx xx xxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx v xxxxxxx xxxxxxx xxxxxx nedostupnosti xxxxxxxx xxxxxxxxx.
Xxxxxxxx výběru xxxxxxx
Xxxx xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxx.
Xxxxxxxx 1 xxxx xxxxxxxxx x xxxxxxx xx nutnost akutně xxxxx definovaný xxxxxxx, xxx xxxx uvedeno xxx výše. Xxxxxxxx 2 byla xxxxxxxxx x xxxxxxx xx xx, xx by xxxxxxxx definovaný xxxxxxx. Xxxxxxxx 3 byla xxxxxxxxx x důvodu xxxxxxxxxxxxxx x duplicity xxxxxxxxxx. Xxxxxxxx 5 xxxx xxxxxxxxx x xxxxxxx xx xx, xx xx neřešila xxxxxxxxxx xxxxxxx. Xxxx xxxxxxxxxxxx xxxx zvolena xxxxxxxx, xxx xxxxx xx distributoři xxxxxxx xxxxxxxxx vývoz pouze x xxxxxxxxx, xxx xx v xxxxxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxx poskytování xxxxxxxxxxx xxxxxx.
Xxxxxx xxxxx xxxxxxx reexportů
Při xxxxxxxxx xxxxxxx forem regulace xxxx (xxxxx xxxxxx xxxxxxxx) xxxxxxxxx x xxxxxxxx forem xxxxxxxx xxxx XX:
- individuální xxxxxxx xxxx (xxxxxxxxxx x xxxxxxxxx věci xxxx konkrétnímu adresátovi);
- xxxxxxxx obecné xxxxxx (xxxxxxxx x xxxxxxxxx xxxx vůči neomezenému xxxxxx xxxxxxxx);
- xxxxxxxx (xxxxxxxxxx xxxxxx xxx).
Xxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxx reexportů
Varianta 1 = xxxxxx varianta (xxxxxxxxx xxxx)
Xxxxxxxx 2 = xxxxxxxxxxxx xxxxxxx xxxx
Xxxxxxxx 3 = xxxxxxxx xxxxxx xxxxxx
Xxxxxxxx 4 = xxxxxxxx
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx dotčené xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx bude xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx, kdy se xxxxxxxxx xxxxxxx, že xx na trhu xxxxxxxxxx xxxxxxxx léčivý xxxxxxxxx x xx xxx xxxxxxxx xxxxxx xxxxxxxx x XX. X ohrožením xxxxxx xxxx xxxxxxxx x xxxxxxx xxxxxxxxx náklady, xxxxx xx xxxxx xxxxxx nutné vynaložit, xxxxx by xx xxxx xxxx dostupné xxxxxxxx léčivé xxxxxxxxx (xxxxx xxxxxxxxx xxxxxxxxxx xxx.). Xxxxxxxx xxxx xxxx xxxxxxxx volného xxxxxx xxxxx, ovšem xx xxxx xxxxxx xxxxxxxx x XX.
Xxxxxxxx 2
Xxxxx xx xxxxxxxxx xxxx xxx omezovány xxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxx vydávaných ve xxxxxxxx xxxxxx, xxxx xx xxxxxxxxx dodržovat xxxxxxxxx xxxxxxxxx xxxx. Xxxxxxx řízení bývají xxxxxxx xxxxxx náročná, xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx s ohledem xx riziko ohrožení xxxxxx a zdraví xxxxx akutně.
Individuální xxxxxxx xxxx xxxxxxx rozhodnutí xxxxxxxx konkrétního účastníka xxxxxx x konkrétní xxxx. Počet subjektů xxxxxxxxxxxx xx xx xxxxxxxxxxx xx xxxxxx xxxxx, pokud xxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxx xxxxx xxxxx (xxxxx xx xxxxx xxxxxxx získala xxxxxxxxxxx xxxxxxxxx), xxxxxxxxx xx xx kolem 2500. X xxxxxx xxxxxx xx bylo xxxxxxx xxxxxx xxxxxxxxxxxxxxx náročné x nebylo xx x potřebném čase xxxxxxx xxxxxxxxxx x xxxxx daný xxxxxxx x plné xxxx.
Xxxxxxxx 3
Xxxxxxxx xxxxxx povahy xx xxxxxx xxxxxxx xxx regulaci neomezeného xxxxx xxxxxxxx v xxxxxxxxx xxxx. X xxxxxx hlediska, xxx xxx xxxxxxxxxxxx xxxxx xxxxx xxxxxxxxx xxxxxxxx, xx jeví xxxx xxxxxx. Xxxxxxxxx xxxxxxxxx xxxx (xxxxx xx xxxxxxx xxxxxx konkrétního xxxxxxxx přípravku) je xxx xxxxxxx. Xxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx proces xxxxxx xxxxxxxxx xxxx tak, xxx xxxxxx xxxxxxxxx xxxxxxx x xxxxxxx xxxxxx hrozby nedostupnosti xx xxxxxx ochrany xxxxxx xxxxxxxxx xxxxxx xx zakázat.
Varianta 4
Xxxxxxxx xxxxxxxx xxxxxxxx je xxxxxx a (xxxxxx xxxxxx dle xxxxxxxxx xxxx x xxxxxxxx) xxxxxxx proces, xxx xx výraznou xxxxxxxxx, xxxxx xx xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx. Xxxxxxxx xxxxxxxx xxxxxxxx xx xxxxx xxxxxxxx. Xxxxxxx xx obecná xxxxxxxxx x možnost xxxxxxxxx všechny xxxxxxx xxxxxxxx jedním předpisem.
Kritéria xxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxxxx byla xxxxxxx xxxxxxxxxx (administrativní x xxxxxx) xxxxxxxxxxxx systému.
Varianta xxxxx 1 (tzv. xxxxxx varianta) byla xxxxxxxxx x xxxxxxx xx xxxxxx xxxxxxx xxxxx tento xxxxxxx. Xxxxxxxxx xxxxxxxxxxx jej xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Nejsou xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxx. Varianta xxxxx 2, kdy by xxxxxxxxx xxxx v xxxxxxxx důsledku xxxxxxxxx xxxxxx individuálních správních xxxx, byla xxxxxxxxx x xxxxxxx xx xxxxxxxxxxxxxxx a časovou xxxxxxxxx xxxxxx xxxxxxx. Xxxxxxxx xxxxx 4 (xxxxxxxx právních předpisů) xx xxxx xxxxxx x administrativně (tudíž x finančně) xxxxxxx xxxxxx, xxxxx xxxxx xxxxx x xxxxxx xxxxxxxx xxxxx reexporty xxxxxx použít.
Jako xxxxxxxxxxxx xxxx xxxxx zvolena xxxxxxxx xxxxx 3 (xxxxxxxx xxxxxx povahy), xxxxxxx nejlépe xxxxxxxx xxxxxxxxxx xxxxxxx a x xxxxxxxxx s xxxxxxxxx xxxxxxx regulace xxxxxxx xxxxxxxxxxxxxxxx xxxxxxx x xxxxxxxxxxxxxxx zátěž xxx xxxxx navrhované xxxxxxxx.
Xxxxxxxx regulační xxxxxxx xx xxxxxxx omezování xxxxxxxxx
Xxxxxxxx 1 = xxxxxx (xxxxxxxx xxxx)
Xxxxxxxx 2 = xxxxx Xxxxxxxxxxxx zdravotnictví
Varianta 3 = xxxxx Státní xxxxx xxx xxxxxxxx xxxxx
Xxxxxxxx 4 = xxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx a Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx
Xxxxxxxx 5 = xxxxxxx xxxxxx xxxxxx
Xxxxxxxx 6 = xxxxxxx xxxxxx xxxxxx
Xxxxxxx a xxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxxxxxxxx xxxxxx xxxx znamenat xxxxxxxxx xxxxxxxxxx stavu, xxx se xxxxxxxxx xxxxxxx, že je xx xxxx nedostupný xxxxxxxx xxxxxx xxxxxxxxx x xx tak xxxxxxxx xxxxxx xxxxxxxx x XX. S xxxxxxxxx xxxxxx xxxx xxxxxxxx i xxxxxxx xxxxxxxxx xxxxxxx, xxxxx xx jinak xxxxxx xxxxx xxxxxxxxx, xxxxx xx na xxxx xxxx dostupné potřebné xxxxxx přípravky (xxxxx xxxxxxxxx xxxxxxxxxx xxx.). Xxxxxxxx xxxx plné xxxxxxxx xxxxxxx xxxxxx xxxxx, xxxxx xx xxxx zdraví xxxxxxxx x XX.
Xxxxxxxx 2
Xxxxxxxxxxxx xxxxxxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx xx xxxxx xxxxxxx zdraví xxxxxxxxxxxx. Xxxxxx z xxxx xxxxx je (x rámci obecného xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx zdraví) též xxxxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx. X xxxxxx xxxxxxxx by xxxx xxxxxx, xxx danou xxxxxxxx zajišťovalo ministerstvo. Xxxxxxxx léčiv xx xxxx xxxxxxxxxxx xxxxxxx, x xxxxxxx xxxxxx xxx zřízen Xxxxxx xxxxx pro xxxxxxxx xxxxx, xxxxx xxxxxxxxx xxx xxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxxx a činnost xx na xxxxx xxxxx (xxxxxxx xxxx x xxxxxx xxxxxxxxx xxxxxxx XX) xxxxxxxxxxxxx. Xxxxxxxxx varianty, xxx xx reexporty xxxx xxxxxxxxx xxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, xx xxxxxxxxx xxxx, kdy xxxxxxx xxxxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx. Nebyla xx xxx zachovaná xxxxxxxxxx návaznost, xx xxx prováděné xxxxxxxx (xxxxxxx xxxxxxxxxxxx, držitelů x xxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx).
Xxxxxxxx 3
Xxxxxx ústav xxx xxxxxxxx léčiv xx xxxxxxx xxxxxxxxxx Xxxxxxxxxxxx zdravotnictví a xxxxxxxxx xxxxxxx xxxxx xxxxxxxxx x regulací xxxxx. Xxxxxxx této xxxxxxxx by xxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxxxx xxxxxx xxxxx xxxxxxx. Xxxxxxxxx xx xxxx xxxxxxx návaznosti xx xxxxxxxx a xxxxx xxxxxxx Ministerstvu xxxxxxxxxxxxx.
Xxxxxxxx 4
Jak xxxx xxxxxxx xxx xx xxxxxxxx 2 a 3, xxx xxxxxx xx xxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxx v Xxxxx xxxxxxxxx. Činnost xx xxxxxxxx zajišťována xxxxxxxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxxx xxxxx xx „kontrolní“ xxxxxxxxx (xx xx xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxxx). X tohoto xxxxxxxx je xxxxxxx, xxxxx xx oba xxxxxx xx xxxxxxxxx xxxxxxxxx spolupracovaly. Tato xxxxx spolupráce xx xxxxxx xxxx být xxxxxxxxxxx. Tj. xxxx xx zajistit, aby Xxxxxx ústav xxx xxxxxxxx xxxxx xxxxxx x xxxxxxx xxxxxxxxx xx xxxxx situace xxxxxxxxxxxx vydání xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxx a xxxxxxx, aby xx xxxxxxxxxxxx xxxxx tyto xxxxx vyžádat v xxxxxxx podezření, x xxxxxx se xxxxx x xxxxxxx xxxxxx. Xxxxxxxxxx xxxx xxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx za xxxxxx xxxxxxx xxxxxxxxx x xxxxxx xxx opomenut xxx xxxxx x xxxxxx, xxxxx xx xx xxxxxxxx xxxxx x XX xxxxxx. Xxxxxx identifikována xxxxx xxxxxxxx této xxxxxxxx.
Xxxxxxxx 5
Xxxxxxxxxx xxxxx xxxxx, xxxxx xx xxx x xxxxxxxxxx xxxxxxxx xxxxx xxx Ministerstvo xxxxxxxxxxxxx xxxx Xxxxxx xxxxx pro xxxxxxxx xxxxx. Nevýhodou by xxxx xxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx orgánu, xxxxx xx jí xxxxx xxxxxxxxx.
Xxxxxxxx 6
Xxxxxxx xxxxxx xxxxxx by xxxxxxxxx nevyhnutelné xxxxxxxx xxxxxxx.
Xxxxxxxx xxxxxx variant
Jako xxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxx navrhovaného xxxxxxx.
Xxxxxxxx číslo 1 (xxx. xxxxxx xxxxxxxx) xxxx zamítnuta x xxxxxxx xx xxxxxx xxxxxxx řešit xxxxx xxxxxxx. Xxxxxxxxx legislativa xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxxxxx xxxxxxxxx. Xxxxxxxx xxxxx 2, kdy xx xxxxxxxxx xxxx x xxxxxxxx důsledku xxxxxxxxx xxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx, xxxx zamítnuta x důvodu nedostatečné xxxxxxxxxxxx xx dosavadní xxxxxxx xxxxxx xxxxxx. Xxxxxxxx číslo 3 (xxxxxxxx pouze Xxxxxxx xxxxxxx pro xxxxxxxx xxxxx) xxxx xxxxxxxxx x důvodu nedostatečného xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxx přijímání xxxxxxxxxxx xxxxxxxx. Xxxxxxxx 5 x 6 xxxx xxxxxxxxx x ohledem xx xxxxxx xxxxxxx xxxxxxxxxxxx x xxxxxxxxxxxxxx. Xxxx xxxxxxxxxxxx xxxx xxxxxxx xxxxxxxx určité xxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Státního xxxxxx xxx xxxxxxxx xxxxx, xxx na xxxxxxxx principu xxx xxxxxx xxxxxxx xxxxxxxx x oblasti léčiv xxxxxxxx v zákoně x xxxxxxxx (Xxxxxx xxxxx pro xxxxxxxx xxxxx jako xxxxxxxxxxxx xxxxx a Ministerstvo xxxx druhostupňový xxxxx).
Xxxxx xxxxxxx podoby xxxxxxx xxxxxxxx
X xxxxxxx xx xxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxx, xxx xx dle zvoleného xxxxxxxx xxxxxxx xxxxxxxxxx, xxxxxxxxx x přiměřenosti xxxx xxxx nejvhodnější
- xxxxxxx xxxxxxxxxxxxxx xxxxxxxx;
- x xxxxxx xxxxxxxx xxxxxxxxxx distributorů xxxxxxx xxxxx xxxxxxxxx xxxxxx;
- xx formě xxxxxxxx xxxxxx xxxxxx;
- xxxxxxxxxx xx základě xxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx xxxxx a Xxxxxxxxxxxx xxxxxxxxxxxxx; xx xxxxx xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx x xxxxxx konečnou xxxxxx xxxxxxxxxxxx xxxxxxx.
Xxxxxxxx variant xxxxxxxxx xxxxx právní xxxxxx omezení reexportů
Varianta 1 = Státní xxxxx xx xxxxxxx xxxxxxxx xxxxxx povahy, xxxxxx by xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, x xxxxx by xxxxxxxxxx xxxxxxxxxx hrozila xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, x zároveň xx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx opatření xxxxxx xxxxxx, kterým xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx případě
Varianta 2= xxxxxxxx xxxxxx povahy xx xxxxxxxx pouze Xxxxxxxxxxxx zdravotnictví a Xxxxxx ústav xxx xxxxxxxx léčiv xx xxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx xx svém xxxxxxxxxxx xxxxxxxxxx
Xxxxxxxx 3 = Ministerstvo xxxxxxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, x xx formou xxxxxxxx xxxxxx povahy, ke xxxxxxx xx xxxxxxxxxxx xx xxxxxxx xxxxxxx xx xxxxxx Ústavu, x xxxxx xx xxxxxxxxxx distribuce xxxxxxx xxxxxx nedostupnost xxxxxxxx xxxxxxxxx, x následného xxxxxxxx xxxxxx xxxxxx, xxxxxx xx xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxx, přičemž x xxxxx xxxx xxxxxxxxx by Státní xxxxx pro xxxxxxxx xxxxx obstarával podklady x xxxxx návrhy x xxxxxxx, xxx xx xxxxxxx xxxx.
Xxxxxxx x xxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
Xxxxxxxx 1
Xxxxxx ústav xxx xxxxxxxx xxxxx by xxxxxxx xxxxxxxx obecné xxxxxx, xxxxxx xx xxxxxxxx seznam xxxxxxxx xxxxxxxxx, xxx jejichž xxxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx při xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x České xxxxxxxxx x xxxxx xxxxxx xx pravidelně aktualizoval. Xxxxxxxxxxxx xxxxxxxxxxxxx by xx xxxxxxx xxxxxxx Xxxxxxxx ústavu pro xxxxxxxx léčiv při xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx vydávalo xxxxxxxx xxxxxx povahy, xxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx Xxxxx republiky x případě, xx xxx xxxxxxxxxx xxxxxxxx xxxxxxxxx na xxxx x Xxxxx republice xx mohlo xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxxxx náklady x nelogičnost xxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxx xxxx xxxxxxxx xxxxxx xxxxxx, xxxxxxx xxxxxxxxx by xxxxxxxxxxxxxx xxxxxxxxx dotčených orgánů xxxxxx xxxxxx. Xxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx varianty. Problematičnost xxxx xxxxxxxx spočívá xxx x xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx, xxxxxxx xxxxxxxxxxxx xxxxxxxx přípravků xx nutné řešit xxxxxx. Xxxxxxxxxxxx právní xxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, když x xxxxxxx na xxx existující xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx x xxxxxxxx x xxxxxx xxxxxxx Xxxxx xxxx xxxxxxxxxx potřebná xxxx x xxxxxxxxxxxxx xxxxxxxxx xxxxxx akutní xxxxxxxxxxxxx xxxxxxxx přípravků. X xxxxxxx xx xxxxx EU a xxxxx xxxxx zboží xx nutné xxxxxxxx xxxxxx léčivých přípravků xxxxxxxxxx xxx poskytování xxxxxxxxxxx xxxxxx.
Xxxxxxxx 2
Státní xxxxx xx xx xxxxxxx podkladů x xxxxxxx xxxxxxxxxxxx subjektů (xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx přípravků, xxxxxxxxxxxx x provozovatelů xxxxxxxxxxx x výdeji xxxxxxxx xxxxxxxxx) pravidelně xxxxxxxxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x zveřejňoval xx xxx způsobem xxxxxxxxxxx xxxxxxx xxxxxxx xx xxxx xxxxxxxxxxx xxxxxxxxxx. X takto xxxxxxxxxxxx xxxxxxx xx xx xxxxxxxx xxxxxx přípravky, xxxxxxx xxxxxxxxxx je xx xxxx České xxxxxxxxx akutní, x xx by xxxx x xxxxxxx xxxxxxxx xxxxxxx předmětem omezení xxxxxxxx xx formě xxxxxxxx xxxxxx povahy Xxxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx 3
Xxxxxx xxxxx pro kontrolu xxxxx xx xx xxxxx xxxxxxx xxxxxxxxx xxxxxxxx přípravků xxxxxxxxxx xxxxxxxx a xxxxx xxxxxx x xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxx xx xxxxx omezení xxxxxxxxx léčivých xxxxxxxxx xx xxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx, které xx xxxxxxxx xxxxxx xxxxxxxx přípravků, a xx xxxxxx xxxxxxxx xxxxxx xxxxxx, x xxxxx xx xxxxxxxxxx xxxxxxxxxx hrozila akutní xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxxx obecné xxxxxx, xxxxxx xx xxxxxxxx distribuci v xxxxxxxxxx xxxxxxx.
Xxxxxxxx xxxxxx xxxxxxx
Xxxx hlavní xxxxxxxxx xxxx zvolena xxxxxxxxxx xxxxxxxxxxxxx xxxxxxx regulace.
První xxxxxxxx xxxx xxxxxxxxx x xxxxxx xxxxxxxxxxxx. Xxxxx xxxxxxxx xxxx xxxxxxxxx x xxxx xxxxxx, xx xx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx ústředního xxxxxx xxxxxx správy xxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx. Xxxx xxxxxxx xxxxx xxxxxxxx, xxxxxxx xx xxxx jako xxxxxxxxxxxxxxx x xxxxx xxxxxxxxxxxx.
XXXXXXX XXXXXX XXXXXXX XXXXXXX XXXXXXX REEXPORTŮ
Jako xxxxxxxxxxxx řešení xxxx xx xxxxxxx xxxx xxxxxxxxx postupu xxxxxx xxxxxxx varianta xxxxxxxx xxxxxxx léčivých xxxxxxxxx Xxxxxxxxxxxxx zdravotnictví, x xxxxxxx jejichž vývozu xx xxxxx x xxxxxxxx xxxxxx a xxxxxx xxxxxxxx xx xxxxx ČR. Xxxxxx xxxxx pro xxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxx x xxxxxxx xxxxxxxxxxxx, xxxxxxxx x lékáren xxxxxxx léčivých xxxxxxxxx xxxxxxxxxx na xxxxx xxxxxxx.
Xxxx xxxxxxx xxxxxxxxx xxxxxxx xx přitom xxxxxxxx zavést institut xxxxxxxx xxxxxx xxxxxx, xxxxx xxxx vydávat Xxxxxxxxxxxx xxxxxxxxxxxxx, xxxxxxx xxxxx, v jehož xxxxxxxx gesci (xxx xx xxxxxxx existujícího xxxxxxxxxx §11 písm. x) zákona x xxxxxxxx) xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx XX. Xxxx xxx navázáno xx xxxxxxxxx kompetence Xxxxxxxxxxxx x zároveň xxxxx xxxxxx xxxxxxx xxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv x analýzách dat, xxxxxxx xxxxxxxxx. Xxxxxxxxxxxx xxxx opatření xxxxxxx xx základě podnětu Xxxxxxxx xxxxxx pro xxxxxxxx léčiv založeného xx vyhodnocování xxx, x xx xxxxx xxxxxxxxxxxx. Xxxx data xx x případě xxxxxxx bude moci Xxxxxxxxxxxx též xx Xxxxxxxx ústavu pro xxxxxxxx xxxxx xxxxxxx.
Xxxxx xx o zvláštní xxxxx xxxxxxxxx aktu, xxxxx xxxx poměrně xxxxxx xx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx věci. Xxxxxxxx x xxxxxxxxxx xxxxxxxxxxxx se xxxxx xxxx xxxx xxxxxxx xxxx vhodná xxxxx xxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxx x České xxxxxxxxx x k xxxxxxx xxxx xxxxxxx, xxx xxxx xx úkor xxxxxxxxxxxx jejich potřeb xxxxxx xxxxxxxxx vyváženy xxxx xxxxx Xxxxx xxxxxxxxx, xx tak x souladu xx xxxx xxxxxx xxxxxxxxx, xxxxxxxxxxxxx, dostatečně xxxxxx xx xxxxxx xxxxxx x efektivní.
2.3. Adaptace xxxxxxxx ve xxxxxx x xxxxxxx xxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx
Xxx řešení tohoto xxxxxxxx xxxxx připustit xxxxx variantu, xxx xxxxxx text zákona x léčivech xxx, xxx xxxx náležitým xxxxxxxx zajištěna xxxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Rady 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx výrobní xxxxx pro xxxxxx xxxxx pro xxxxxxx xxxxxx xxxxxxxxx. Xxxxx xxxx xxxxxxxx xx xxxxx znamenat xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx orgánů Xxxxxxxx xxxx xxxx České xxxxxxxxx.
2.4. Xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx a Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxx 1 - změna xxxxxx x xxxxxxxx
Xxxxx xxxxxxxxx xx novelizovat xxxxx x léčivech tak, xxx xxxxxxxxx vymezení xxxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Generálního ředitelství xxx. Inspirací v xxxxx xxxxx může xxx již platný xxxxxx řád, x xx xxxxxxxxx xxxxxxxxxx §8 xxxxxx x. 226/2013 Xx., x xxxxxxx dřeva x xxxxxxxxxxx xxxxxxx na xxx, xxxxx obdobnou xxxxxxxxxxxx spolupráce xxxxxxxxxx xxxxxx, x nichž xx xxxxx straně xxxxxxxxx právě Xxxxxxxxx xxxxxxxxxxx cel, v xxxxxxxxxxx zákoně xxx xxxxxxx xxxxxxxx xxx xxxx. Toto xxxxxx, xx. změna xxxxxxxxxxx xxxxxx, xx v xxxxx ukázalo xxxx xxxxxxxxxxx, xxxxxxxxxxxx vždy xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx dané oblasti.
Varianta 2 - Přijetí xxxxxxxxxx novely xxxxxx x Celní správě Xxxxx republiky k xxxxxx xxxxxx novely xxxxxx x xxxxxxxx
Xxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxx xx xxxxxxxx x xxxxx připravované xxxxxx xxxxxx o xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx č. 17/2012 Sb., o Xxxxx xxxxxx České xxxxxxxxx, xx znění xxxxxxxxxx xxxxxxxx, xx xxxxx xx byla x rámci xxxxxxxxxx §2 xx 5 xxxxxx xxxxxx rozšířena xxxxxxxxx působnost Xxxxxxxxxxx xxxxxxxxxxx xxx x xxxxx xxxxxx.
Xxxxxxxx 3 - Xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx x Xxxxx správě Xxxxx xxxxxxxxx
Xxxxx xxxxxxxxx je xxxxxx xxxxxxxxxx novelizace xxxxxx č. 17/2012 Sb., x Xxxxx správě Xxxxx xxxxxxxxx, ve znění xxxxxxxxxx předpisů. Xx xxxxx zákon xxxxx xxxxxxxxx xxxxxx dnem 1. xxxxx 2013, xxx xxx xxxxxx xxxxxxxxx novelizován, xxxxx xxx xxxxxxxxxxxx jeho xxxxx xxxxxxxxxx.
2.5. Xxxxxxxxxxx xxx xxxxxxxxx činnosti x xxxxxx instituty xxxxxxxxx a xxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxx 1 - xxxxxx
Xxx zachování xxxxxxxx právní xxxxxx x xxxxxx o xxxxxxxx by xxxxxxx xxxxx x přesnější x xxxxxxxxx xxxxxx xxxx xxxxxx, xxxxxxx xxxxxxxxx úprava již xxxxxxxxxx xxxxxxxxx x xxxxx x xxxxxxxxxx xxxxxxxxxxx potřebě, xxx xx xxxx xxxxxx xxxx xxx xxxxxxxx.
Xxxxxxxx 2 - změna xxxxxx x xxxxxxxx
Xxxx xxxxxxxx by znamenala xxxxxxxxxxxx xxxxxxx inspekcí x xxxxx xxxxxx xxxxxxxx podle xxxxxxxxxxx xxxx, xxxx xx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx inspektora xx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxx. Xxxx xx xxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx zajištění x xxxxxxx xxxxxxxx xxxxxxxxx tak, xxx xxxxx poskytovat xxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx x činění xxxxxxxx a xxxxxxxx xxxxxxxx x xxxxxx xxx zjištění xxxxxxxx xxxxxxxx xxxxxxxxx, které xxxxxxxxx xxxxxxxxx xx xxxxxx xxxxxx, účinnost x bezpečnost. Blíže xxx odůvodnění xx xxxxxxxx části.
3. Vyhodnocení xxxxxxx x přínosů
Řešení xxxxxx xxxxxxxx xxxxxxxxxxxxx x xxxxxxxx nařízení xx xxxxxx k xxxxxxx xxxxxx pro xxxxxxx léčivé xxxxxxxxx, xxxxxxxxx xxxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx a Generálního xxxxxxxxxxx cel a xxxxxxxx xxxxxxxxxxxxx v xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxx provádění inspekční xxxxxxxx x x xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx přípravků xxxxxxx xxxxxxxxxxx, xxxxxxx přínosy xxxxxx xxxxxx xxxxxxxx xxxx již xxxxxxx x vysvětleny. X xxxxxx xxxxxx xxxxx xxxxxxxxxxx identifikace a xxxxxxxxxxx xxxxxxx a xxxxxxx xxxxxxx x xxxxxx 3.1 xx 3.3 vztaženy xx xxxxx okruhům xxxxxxxx xxxxxxxx, a to x adaptaci xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx x x xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxx léčivých přípravků.
3.1 Xxxxxxxxxxxx xxxxxxx x xxxxxxx
3.1.1. Xxxxxxxx xxxxxxxx xxx klinická xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků
Pokud xxx x xxxxxxxx xxxxxxxx xxx klinická xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, náklady xxxxxxxx xxxxxxxx xxxxxxxx č. 536/2014 xxxx xxx xx xxxxxx Xxxxxxxx unie, xxx x xxxxxxxxx xxxxx. Xxxxxxxx tohoto xxxxxxxx by xxxx xxxx x xxxxxxxx xxx členské xxxxx xxx efektivnější xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx. Xxxxxxxx xx xxxxxx mělo xxx xxxxxxxxx x účelnější xxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxx xxxx Xxxxxxxx xxxx x xxxxxxxx xxxxxxxx xxxx xxxxxxxxxxx xxxxxx jejich xxxxxxxxxx x provádění, xxxxxxxxxxxxx Xxxxxxxx xxxx xxx xxxxxxxxxx ze xxxxxxx xxxx a xxx zvrácení xxxxxxxxxx xxxxxx odlivu xxxxxxxxxx x Xxxxxxxx xxxx, xxxxx logickým následkem xx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx, xxxxx xx xxxxx xxxxx xxxxxxxxx x Evropské xxxx xxxxxxx nejmodernější xxxxx xxxxxx x xxxxxxx xxx xxxxx, xxx bude xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx. Xxxxxxxxx xxxxxxxx xx x důsledku xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxx klinických xxxxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxx praxe xxxx xxx optimalizace xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx a xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx pacienty a xxxxxxxxx xxxxxxxx podmínek xxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxx x členských xxxxxxx, xxx x xxxx Xxxxxxxx xxxx. Xxxxxxx xxxxx předkládaných žádostí x xxxxxxxx xxxxxxxxx x xxx x xxxxxx xxxxxxxxx xx xxxxxxxx xxxxx finanční xxxxxxxxxx xxx poskytovatele xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxx hodnocení x xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx. Xxxxxxx xx se x dostupnost xxxxxxxx xxxxx xxx xxxxxxxx, xxxxx xxxxxxxxx je xxxxxxx xxxxxx nejen xxxxxxxxx, xxx také xxxxxxxxxx xxxxxxxxx, xxx xx mnohdy standardní xxxxx, xxxxx xxxxxxx xxxxxxxxxxx. Příliv xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxx xxxxxxxx x xxxxxxx dalších xxxxxxxxxx míst xxx xx xxxxxx xxxxxxxxxx (x xxxxxxxxxxxxxxx společností xx smluvních xxxxxxxxxx xxxxxxxxxx), stejně tak x na xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx. x poskytovatelů xxxxxxxxxxx služeb, xxx xx náklady xx xxxx xxxxx xxxxx xxx xxxxx ze xxxxxxxxx xxxxxxxxxx xxxxxx xx xxxxxx.
Xx xx xxxx xxxxxxxxxx nákladů xxxxxxxxxxxxx x nutnosti xxxxxxxx pracovních xxxxxx, xxxx jsou následující:
- xx xxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx 32 úvazků xxx xxxxx 8 xxxxxx etické xxxxxx). Xxxx xxxxx zabezpečit xxxx xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (5), posuzovatelů xxxxxxxxxxxxx hodnocení (2), xxxxxxxxxxxx bezpečnostních xxx xxxxxxxxxx xxxxxxxxx (2), xxxxxxxxxx (5), xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx (2) x xxxxxxxxxx xxxxxxxxx xxxxxxxxx-xxxxxxxxxxxxx a xxxxxxxxxxxxxxxxx xxxxxx pro xxxxxxx xxxxxx komise - xxx počtu 8 xxxxxx xxxxxx xxxxxx - 16 xxxxxx). Xxxx xxxxxx budou xxxxxxxx xxxxx z xxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx (xxxxxx xxxxxx). Xxx xxxxxxxx xxxxx xxxxxxxxxxx technického xxxxxxxxxxx xxxxxx systému xxxxxx xxxxxx xxxx xxxxxxxxx orgánu Státního xxxxxx xxx kontrolu xxxxx jsou uvažovány x xxxxx finanční xxxxxxxxxx z xxxxxx xxxxxxxxxxxx x XX xxxxx, z xxxxx xxxx xxxxx z xxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxx;
- xx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxx proti xxxxxxxxxx xxxxxxxxxx x žádosti x schválení klinického xxxxxxxxx. Xxxx xxxxx xxxxxxxxxx 1 pozici xxxxxxxx xxxxxxxxx x 1 pozici xxxxxxxxx xxxxxxxxx. Xxxxxxx na Xxxxxxxxxxxx xxxxxxxxxxxxx tak xxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx (x xxxxxxx xx xxxxxx xxxxx x xxxxx xxxxxxxx) právní xxxxx xxxxxx odborným xxxxxxxxxx xxxxxxxxxxx vzdělání a xxxxxxx xxxxxxx xxxxx xxxxxx odborným xxxxxxxxxx xxxxxxxxxxxxxxx či xxxxxxxxxx xxxxxxxx. Xxxx xx xxxxxx Ministerstva zdravotnictví xxxxxxx xxxxxx xxxxxxx x xxxxxxx xxxxxx xxxxxx xxxx xxxxxx xxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx, naopak xxxxxxx xxxx xxxxxx xxxxxxxxx x odvolávání xxxxx xxxxxx xxxxxx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv ministrem xxxxxxxxxxxxx.
3.1.2. Xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx x xxxxxxxx k xxxxxxx xxxxxxxxx léčivých xxxxxxxxx xxxxxx xxx xxxxxxxx xxxxxx, xxxxxx xx xxxxxxxx xxxxx, osoby xx xxxxxxxxxx postižením x národnostní xxxxxxx x xxxxxx xx xxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxx xxx xxxxx xx xxxxxxxxxxx konkurenceschopnost Xxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxx xxxxx (xxxx, xxxxx), xxxxxxxxxxxx, xxxxx xxxxxxxxxxx xxxxxx a xx xxxxxx x xxxxxx xxxxxxxxxxxx.
Xxxxxxxxxxx se xxxxxxxx xxxxx na xxxxxx rozpočet x xxx xxxxxxx, xx xxxxx xxxxxxxx již xxxxxxxxxx a xxxxxxxx xxxx administrativní xxxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxxxxx xxx xxx xxxxx xxxxxxxxxxxx hrozby xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx léčiv x xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx opatření xxxxxx xxxxxx Ministerstvem xxxxxxxxxxxxx. Xxxxxxxx xxxxx v xxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx pracovních xxxxxx, přičemž xx xxxxxxxxx xxxxxx xxxxxx x xxxx xxx 4 xxxxxxxx xxxxxx xxx osoby xxxxxxxxxx xx xx xxxx xxxxxxxx.
4 xxxxxxxx xxxxxx xxxxx xxxxxxxx xx 2 xxxxxxxxxx xxxxxxxx xx Státním xxxxxx xxx xxxxxxxx xxxxx (xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx předávaných Ministerstvu), x xx 2 xxxxxxxxxx úvazcích na Xxxxxxxxxxxx xxxxxxxxxxxxx. Xxxxxxx xx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxx ve xxxxxxxxx xxxxxxxxx (x xxxxxxx na nutnost xxxxxxxx xxxxxx) xxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxxx právnického vzdělání x xxxxxxx xxxxxxx xxxxx xxxxxx odborným xxxxxxxxxx xxxxxxxxxxxxxxx či xxxxxxxxxx xxxxxxxx. Xxxxxxxx xxxxx na státní xxxxxxxx tak bude xxxxxxxxx.
Xxxxxxxxx xxxxx navrhované xxxxxx xxxxxx xx xxxxxxx xxxxxxx xxxxxxxx, xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx předem xxxxxxxxx. X xxxxxxx xx xx, xx se xxxxx o regulační xxxxx xxxxx do xxxxxxx prostředí, ve xxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxx, xxxxx xx částečně uspokojována x prostředků veřejného xxxxxxxxxxx xxxxxxxxx, lze xxxxxxxxxxxx, xx xxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxx xxx xxxx. Xxxxxx xx čerpání xxxxxxxxxx x veřejného xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxxxx xxxxx xxxxxxxxx - xxx xxxxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx x xxxxxxxx, xxxxx xxxxxxx představují xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxx xxxxxxxxx postupů. Xx xx xxxx xxxxxx na xxxxxxxxxxxxx xxxxxxxxx České republiky, xxxxxxxxx xxxxxx xx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxxx subjekty, xxx xxxxxxxxxxxx xxxxx xxxxxxxxx vliv, xxxxx xx xxxxx významně xxxxxxxxxxxxx transparentností xxxxxxx xxxxxxxx a xxxxxxx xxxxx jeho xxxxxxxxxxxxxxxx, xxxxxxxxxxxx z xxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxx. Xxxxxxx xxxxx musí xxx x xxxxx xxxxxxx přednost xxxx xxxxxx individuálním.
Navrhovaná právní xxxxxx xxxxxxxxxxx xxxxx xx dotčené xxxxxxxxxxxxx xxxxxxxx x tom, xx zavádí novou xxxxxxxxxx xxxxxxxxx distributorů xxxxxxxx xxxxxxxxx xxx xxxxxx, xx xxxxxxx xxxxxxxxxxxx xxxx xxxxx Xxxxx republiky xxxxxx xxxxxxxxx, xxxxx je xx seznamu léčivých xxxxxxxxx ohrožených xxxxxxxxx. Xxxxxxxxx však není xxxxxx, xxxxxxxxxx všechny xxxxxxxx xxxxxxxx distributorů, xxx jen jejich xxxxx část x xxxxxx se xxxxx xxx xxxxx xxxxxxxx xxxxxxxxxxxx se xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxx xxxxx xxxxxxxxxx skupiny xxxxxxxx a léčivých xxxxxxxxx. Tento xxxxx xx xxxxxx x xxxxxxx s xxxxxx xxxxxxxxxx právní úpravy xxxxxx na nezbytně xxxxxx xxxx k xxxxxxxx xxxx, kterým xx zajištění xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx pacientů x Xxxxx republice x případech xxxxxxx xxxxxx xxxxxxxxxxxxx z xxxxxx jejich nadměrného xxxxxxxxx.
Xxxxxxxxx xxxxx bude xxx xxxxxxxxxx xxxxxx xxxxxx xxxxxxx na xxxxxxxx, xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx, kterým xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx.
3.1.3 Xxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxx a xxxxxxx x xxxxxxxxx 3.1.1 x 3.1.2.
Pro xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxx agend a xxxxxxxxx spojených s xxxxxxxxx bude xxxxx xxxxxxx xxxxx xxxxxx XXXX x xx x xxxxxxxx počtu 34 xxxxxx. X xxxxxxxxxx xxxxxx bude xxxxxxxx xxxxxxxx, x xx x xxxxxx 2016 xx 2018 - x závislosti xx xxxxx předkládaných xxxxxxx a xxxxx xxxxxx etické xxxxxx.
Xxxxxx xxxxxx agend by xxx xxx postupný (xxxxx dobíhat xxxxxx xxxxx stávající právní xxxxxx), x xxxxx xxxxx xxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxx (xxx přiložená tabulka).
Bude xx xxxxxx x xxxx xxxxxx:
Xxxxxxxxxxxxx xxxxxxxxxxx (xxxxxx 5) - x xxxx 2016 xx xxxxxx x xxxxxxxxx 4 xxxxxx, xxxx xxxx xxxxxxx xx náročnosti nového xxxxxxx xxxxxxxxxx, xxx. xx xxxxxxxxxx xxxxxxxxxxx xxxxx x angličtině, xx xxxx kompilací xxxxxxxxxx všech xxxxxxxxx xxxxxxxxx států v xxxxxxx, že XX xxxx členským státem xxxxxxxxxxx, na xxxxxxxxxx xxxxxxxxxx odpovědí, x xx vlivu xxxxxxxx xxxx xxxxxxxxxx, jak xx xxxxxxxx xxxx xxxxxxxxx. Xxxxxxx je xxxxx xxxxxxx xx xxxxxxxx počtu xxxxxxx x novými inovativními xxxxxxxx xxxxxxxxx, jejichž xxxxxxxxxx xx xxxxxxxxxx x xxxxxxxx xxxx xxxx.
Xxxxxxxxxxx preklinického xxxxxxxxx (2 xxxxxx) - 1 xxxxxx v xxxx 2016, další x xxxx 2017 - xxxx xxxxxxxxx Xxxxx xxxxx 1 xxxxxxxxxxxxx + xxxxxxxx xx xxxxxxxx xxxxxx. X současné době xxxx pozice nezahrnuje xxxxxxxxxxx xxxxxxxxx xxxxxx, xxx xxxxxx x xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx při postupu xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxx xxxxx xxxxxxxxxxx xxxxx xxx Xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx, xxx xxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxx posuzovatele.
Posuzovatel xxxxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx = xxxxxxxxxxx xxxxxxxx xxxxx dokumentace (1 xxxxxx) - xx xxxxxxxxx xxxxxx xx počítáno xx 2 úvazky xx xxxx 2016 (1 xxxxxx již xx x xxxxxxxxxxx). Posuzovatele xxxx xxxxx xxxxxxx xxxxxxxx x naučit xxxxxxxxxxx xxxxx, musí xxxxxx xxxxxxxx na xxxxxxxxxxxx xxxxxxx u Xxxxxxxx lékové agentury (xxxx xxx XXX). Xxxxx se x xxxxx agendu, která xx xxxx x xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxx group xxx EMA. Xxxxxxxxxxxx xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx z xxxxxxxxxx xxxxxxxxx z XxxxxXxxxxxxxx databáze a xxxxxxxxxxxxx x xxxxxx x xxxxxxxxx xxxxxxxx xxxxxxx.
Xxxxxxxxx xxxxxxx xxxxxxxx xxxxx (5 xxxxxx) - xxx xxx 2016 xx počítá xx 2 xxxxxx, xxxx xxxx záležet xx xxxxxxxxxxx xxxxxxxxx. Xxxxxxxxxxxxxxx xxxx xxxxxxx xxxxxxx počtu než 5. Xxxxxxx xxxxxxxx xxxxxxx nejen x xxxxxxxxx xxxxxxxxx dohledu xxx klinickým xxxxxxxxxx, xxxxxxx aktivní xxxxxxxx xxxxx vykonávat xxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx, ale zároveň x x xxxxxxxxx xx xxxxx xxx xxxxxxxxxx zahraničních xxxxxxxxxx x ostatními xxxxxxxxx xxxxx, xxxxxxxx a xxxxxxxxxxxxxx EMA. Při xxxxx xxx 375 xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx/xxx a xxx 1600 „běžících“ xxxxxxxxxx xxxxxxxxx x xxxxx roce xx xxxxxxxx počet xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx. X xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxx xxxxx, xxxxxx nelze xxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx (3 xxxxxx) - pro xxx 2016 xx xxxxxx x 1 xxxxxxx, x xxxxxx xxx x xxxx 2017 x 1 x xxxx 2018. Xxxxxxxxxxxx xxxxx zajišťovat xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx s xxxxxxxxx xxxxxxxxx státy x xx xxxxx XX s xxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx (např. xxxxxxx xxxxxxx aj.), xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx portálu, xxxxxx xxxx xxx xxxxxxxxxx xx území XX.
Xxxxxxxxxx xxxxxxxxxxxxx centra xxxxxxxx etické xxxxxx (4 xxxxxx). S xxxxxx xxxxxx xx xxxxx počítat xxx xxx xxx 2016. Xxxx xxxxxxxxxx xxxxx xxx xx xxxx xxxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxx činnosti xxxxxx xxxxxx xxxx xxxxxxxxx xxxxxx Xxxxxx, xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxxxx návodů, xxxxxxxxx xxxxxxxxxx xxx xxxxx xxxxxx xxxxxx (xxxxxxxxx xxxxxxxxx xxxxxxxxxx), xxxxxxxxx xxxxxxxxxxxxx xxxxxxx x XX pro xxxxxxxxxxxx xxxxxxxxxx etické xxxxxx. Xxxx xxxxx xxxxxxxxxxx podklady xxx Xxxxxxxxxxxx zdravotnictví xxx xxxxxxxxxxx žádostí x xxxxxxxx x etické xxxxxx. X xxxxxxx xxxxxx xx xxxxx xxxxxxx v návaznosti xx xxxxxxx xxxxxxx xxxxx xxxxxx xxxxxx xxxxxx x xxxxxxx xxxxxxxxxxx xxxxxx x x xxxxxxxxxx xx xxxxx xxxxxxxxxxxxx žádostí. (xxx xxxxx 8 xxxxxx xxxxxx xxxxxx - 16 xxxxxx - xx xxxx 2019 xx 2020 - xxxxx xxxxxxxxxx xxxx nabytí xxxxxxxxx xxxxxxxx č. 536/2014).
|
xxxxx xxxxxxxxxx xxxxxx, požadovaných na XXXX v xxxxxxxxxxx x xxxxxxxx nařízení 536/2014/EU |
||||||
|
2016 |
2017 |
2018 |
32 xxxxxx |
|||
|
4 |
XX |
1 |
XX |
|||
|
1 |
XXX |
1 |
XXX |
|||
|
1 |
XXXXX |
|||||
|
2 |
XXX |
2 |
XXX |
1 |
XXX |
|
|
1 |
XXXX |
1 |
XXXX |
1 |
XXXX |
|
|
4 |
XXXX |
8 |
XXXX |
4 |
XXXX |
|
|
13 |
13 |
6 |
||||
xxxxxxx:
xxxxxxxxxxxxx xxxxxxxxxxx (XX) - xxxxxx 5
xxxxxxxxxxx xxxxxxxxxxx xxxxx (PPK) - celkem 2
xxxxxxxxxxxx xxxxxxxxxxxxxx dat XX (XXXXX) - xxxxxx 1
xxxxxxxxxx správné xxxxxxxx xxxxx (INS) - xxxxxx 5
koordinátoři XX (XXXX) - xxxxxx 3
xxxxxxxxxxxx xxxxxx XX - (XXXX) - 4 (je xxxxx xx xxxxxxxx xxxxx xxxx xxxxxxxx xxxxxx XX, xxxxx xx xxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxxxxxx
(xxxxxxxxx, pracovní xxxxxxx xxx.) než xxxxx skupiny XX xxxxxxxx zřízeny, xxx xxxxx xxxxx okamžitě xx xxxx vzniku xxxxxxxxx
xxxxxxxxxxxx xxxxxx XX - (XXXX) – 12 xxxxx xxxxxxx XX xx xxxx xxx 2 úvazky xx zajištění xxxxxxxxxxxxxxxxx xxxxxxx související x XX
xxxxx xx xxxxxxxxxxx xxxxxxxx x xxxxxxx 12 KOEK po xxxxxxxxx xxxxxxx xxxxxx XX
xxxxx xxxxxx xxxxxxxxxx xx SÚKL xxx xxxxxxxxx opatření pro xxxxxxxx xxxxx.xxxxxxxxxx, 2016
2 xxxxxx
2 xxxxxxxxxxxx xxxxxxxxx
34 xxxxxx
2 xxxxxxxx xxxxxx xxx XX - xxxxxxxx x xxxxxxx xxxxxxxx nebo xxxxxxxx x xxxxxxx.
Xxxxx se xxxx xxxxxx agend xxxxxxxxxxxxx x právní xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xxxxxx zajištění je xxxxx počítat x xxxxxxxxx o 2 xxxxxx xx XXXX x o 2 xxxxxx xx XX. Xxxxx zajistí sledování x vyhodnocování xxxxxxxxxxxxx xxxxxxxx přípravků, XX xxxxxxx xxxxxxxx agendu xxxxxxxx s vydávání xxxxxxx a xxxxxxxx xxxxxx povahy xxxxxxxxxxx xxxxxxxxx. V xxxxxxxxxxx x xxxxx xxxxxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxx x oblasti xxxxxxxx legislativy, regulace xxxxxxxxx je otázkou xxxxxxxxxxx a bude xxxxxxxxx xxxxx xxxxxxxxxx xxxx oběma xxxxxxxxxxx, x xx x x xxxxxxx xx xxxxx dané xxxxxxx.
Xxxxxx xxxxxxx:
Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx - xxxxxxx xx. 13
Xxxxxxxxxxxx xxxxxxxxxxxxxx dat/klinické xxxxx dokumentace - xxxxxxx xx. 13
Posuzovatel xxxxxxxxxxx dokumentace - xxxxxxx xx. 13
Inspektoři xxxxxxx klinické xxxxx - platová tř. 13
Xxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx komise - xxxxxxx xx. 13
Xxxxxxxxxxxx - xxxxxxx tř. 12
Xxxxxxxx xx xxxxxx xxxxxxxxx MZ - xxxxxxx xx. 13
Právník xx xxxxxx reexportů XX - platová xx. 13
Xxxxxxxxxxx xxx xxxxxx xxxxxxxxx SÚKL - xxxxxxx xx. 13
Xxxxxxxxxxxxx xxxxx souhrnné xxxxxxx xxxx xxxxxxx xxxx
|
Xxxxxxx xxxxx |
Xxxxxx náklady |
průměr |
Celkem /xxx |
Xxxxxxxx xxxxxxx xxxx XXXX |
Xxxxxxx xxxxxxx - xxxxxxx, xxxxxxxxxxx xxxxxxx, xxxxxxxxxx, … xxx 50 000/rok |
|
|
4 farmaceutičtí xxxxxxxxxxxx |
13 |
20 990-26 220 Xx |
23 600 Xx |
1 132 800 Xx |
1 529 280 Kč |
200 000 |
|
1 xxxxxxxxxxx xxxxxxxxxxx XXX |
13 |
20 990-26 220 Xx |
23 600 Xx |
283 200Xx |
382 320 Xx |
50 000 |
|
1 xxxxxxxx xxxxxxxxxxx (xxxxxxxxxxxx xxxx - XXXXx) |
13 |
20 990-26 220 Xx |
23 600 Xx |
283 200 Xx |
382 320 Xx |
50 000 |
|
2 xxxxxxxxxx XXX |
13 |
20 990-26 220 Xx |
23 600 Xx |
566 400 Kč |
764 640 Xx |
100 000 |
|
1 koordinátor XX |
12 |
19 360-24-180 Xx |
21 770 Xx |
261 240 Xx |
352 674 Kč |
50 000 |
|
1 xxxxxxx + 3 xxxxxxxxxxxx xxxxxx xxxxxx |
13, 12 |
20 990-26 220 Xx19 360-24-180 Xx |
23 600 Xx21 770 Xx |
283 200 Xx261 240 Xx |
382 320 Xx352 674 Xx |
200 000 |
|
2 posuzovatelé xxx oblast xxxxxxxxx |
13 |
20 990-26 220 Xx |
23 600 Kč |
566 400 Xx |
764 640 Xx |
100 000 |
|
15 xxxxxx - xxxxxxx xxxxxxx xx xxxx xxxxxx cca 5 000 000 Xx/xxx 2016 |
3 637 680 Xx |
4 910 868 Xx |
750 000 Xx |
|||
Xxxxxxx navýšení pracovních xxxxxx na XX xxxx xxxxxxxxxx výše. Xxxxxxxx se provede x rámci xxxxxxxxxxx xxxxx xxxxxxxxxxxxx.
Xxxxxxxx xx xxxxxxx x xxxxx xxxxxxxx výdajů xx xxxxx i xxxxx xxxx xxxxxxxx Ministerstva xxxxxxxxxxxxx. Xxxxxxxxxx xxxxx x platové xxxxxxx xx xxxxxxxxx.
Xxx xxxxxxxxx xxxx xxxxxx - xxxxx provozní xxxxxxx xx rok 2016 x 2017 (xxxxxxxx, xxxxxxxx, xx.) - 2016 xxx 750 xxx. Xx; 2017 1,5 xxxxxxx Kč (xxxxxxxx prostor xxx xxxxxxx etických xxxxxx + xxxxxx xxxxxx).
Xxxxxx xxxxxxx xx xxxxxxxxx xxxxxxxxxxxxx centra etické xxxxxx x xxxxxxxxxxxx xxxxxx xxxxxx - xxx 2016 cca 2 xxxxxxx; náklady xx xxxxxxxx xxxxx xxxxxx xxxxxx xxxxxx x xxxxxx xxxxxx - xxxxxxxx xxx 3 xxxxxxx/xxx (při xxxxx xxxxx xxxxxx xxxxxx xxxxxx - xxxxx xxxxxxx) - xxxxxxx x xxxxxx xx xxxxxxx xxxxxx xxxxxx.
Xxxxxxx xxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxx Xxxxxx, xxxxxxx-xx xxxxxxx x XX xxxxx.
X xxxx 2016 x xxxx xx xx xxxx i náklady xx xxxxxxxxxx, xxxxxxx (x XXX xx x xxxx xxxxxxxx xxxx xxxxxxxx za xxxxxxxxxx Xxxxxxxx xxxxxx xx.) xxx 2 xxxxxxx/xxx.
3.2 Xxxxxxx
3.2.1. Xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxx xxxxxxx xx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx x založení x následném xxxxxxxxx xxxxxxx EU x xxxxxxxx XX. Xxxxxxx xx tato xxxxxxxx xxxxx hrazeny z xxxxxxxxxx Evropské xxxx. Xxxxxxx státy xxxxx xxxxxxxxxx xxxxxx napojení xx xxxxxx a xxxxxxxx Xxxxxxxx xxxx, xxxxxxxxxxx xxxxxxxxx zabezpečení xx úrovni xxxxxxxxx xxxxx, zajištění dostatečných xxxxxxxx zdrojů, IT xxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xx xxxxx Xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxx xxxxxxx etické xxxxxx. Xxxxxxx xx xxxxx xxx x xxxxx hrazeny x xxxxxx XX xxxxx, xxxxx xx byly xxxxxxxx xxxxxxxxxx xxxxxxx, x xxxxx xxxxxx xxxxxxx stát. Xx xxxxxxxx systému xx xxxxxx xx xxxxxxxxxxxxxxxx, xxx. náhrady výdajů xx xxxxxxxxx xxxxxxx x povolení xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxx významných xxxx x xxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxxxxx xx xxxx xxxxxx xxxxxxxx nároky xx xxxxxxx xxxxxxxxxx XX systému x xxxxxxx xxxxxx xxxxxx.
X xxxxxxxxxxx x xxxx xxxxxxxx xxxxxxx nákladů, xxxx. samofinancování, vychází Xxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxxxxxxxx xxxxxxxxxx, kdy x xxxxxxxxxx xxxxxx xxxx xxxxxxx náklady xx provoz x xxxxxxxxx Xxxxxxxx xxxxxx xxx kontrolu léčiv, x to xxxxxx xxxxxxxx xxxxxxxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxxxx xxxxx, xxxxxxxxx x souvislosti x xxxxxxxxx xx xxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx xxxxxx komunikace xxxx členskými xxxxx, Xxxxxxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxx, cca xx 75 - 80 % x xxxxxxxxxxxxxxxx zdrojů.
Pokud xx xxxx xxxxxx xxxxxxxxxx xxxxxxxxx v xxxxxxxxxxx x klinickým nařízením, xxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxx o xxxxxxxx hodnocení x xxxxxxx x xxxxxxxxx x sebou přinese xxxxxxx navýšení úvazků (xxxxxxxxx x xxxxxx xxxxxxxxx zkrácení xxxx x xxxxxxxx ze xxxxxxxxxxx 65 dnů xx 21 xxx, x xx xxx xxxxxxxx přerušování), xxxxxxx xxxx xxx např. xxxxxxxx xxxxxxxxxxx zřízení xxxxxxxxxx elektronického xxxxxxx (xxx xxxxx xxxxxxxx), xxxxx prostřednictvím a xxxxx xxxx xxxxxxxxxxxxxxx xxxx možné předkládat xxxxxxx o klinické xxxxxxxxx a Státní xxxxx pro xxxxxxxx xxxxx tedy xxxx xxxxxxxx (xxxxxx) xxxxxx, xxxxxx se xx xxxxxxxxxx elektronického xxxxxxx xxxxxxx. Zřízení takového xxxxxxx xxxxxxxx xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxxxxxx xxxxxxxxx, a xx nejen xx xxxxxxx, xxx x xxxxxxxx xxxxxx, servis xxx., xxxx investice xxxx xxxxxxx pouze xxxxxxxxxxx, xxx xxxx xxx xxxxxxxx xxxxxxxxx. Xxxxxxxx x xxxx, xx xxxxxxxxx evropského xxxxxxx je xxxxxxxxxxxxx xxxxxxxxx, xxx Xxxxxx xxxxx pro xxxxxxxx xxxxx xxxx možnost x své xxxx xxxxxxxxxx, že xx xx evropského portálu xxxxxxxxx x xxxxxxx xxxx xxxxxxxx x xxxxxxxx xxxxxx jako xxxxxxx, xxxxx xx xx znamenalo xxxxxxxxx xxxxxxxx Státního xxxxxx xxx xxxxxxxx léčiv, xxxx. celé ČR, x xxxxxxx klinických xxxxxxxxx.
Xxxx xxxxx x xxxxxxxxxxx s xxxxxxxxx xxxxxx x xxxxxxx xx xxxxx xxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx, xxx xxxxxxxx x x xxxxxxx xx administrativní xxxxxxxxx činnosti etické xxxxxx, xxxx muset Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxxxx x technické zabezpečení, xxx xxxx xxxxxxx xxxxxxxxxx (počítače x xxxxxxxxxxx xxxxxxxx, xxxxxxxx xxxxxxx xxxx.), xxx xxxxxx vyžaduje investici xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx.&xxxx; Xxxxxxxx klinického xxxxxxxx tak bez xxxxxx xx adaptaci x xxxxxx x xxxxxxxx xxxx spojena x xxxxxxxxxx xxxxxxx. Xxxxxxxx xx snaze xxxxxxx xxxxxx xxxxxxxx xx xxxxxxx, Státní xxxxx xxx xxxxxxxx xxxxx navrhuje xxxxxx xxxx náklady x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxx výdajů. Xx xxxx xxxxxxxxxx, xx pokud xx xxxx xxxxxxxxxx xxxxxx x xxxxxxxxx, xxxx xxx xxxxxxxx s xxx, xx xxxxxxx xxxxxxx xxxxx xxxxx x xxxxxxxxxxxx xxxxxx.
Xxxxxxxxx xxxxxx pro xxxxxxxx xx xxxxxx a xxxxxxxx XX - xxx xxx xxxxx xxxxxxxx, x tuto xxxxxx xxxxx xxxx xxxx xxx zadávací xxxxxxxxxxx xxx xxxxxx x xxxxxxxx EU x není xxxxx xxxxx, jakou xxxx (xxxxx xxxxx) komunikační xxxxxxxxx xxxx xxxxxxxxx. X xxxx xxxxxxx, xx xxx xxx xxxxx xxxxxxxxx náklady xx xxxxxx xxxxxxxxxxxx xxxxxxxxx států - xxxxxx xxxx třeba xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx v XX, xxxxx stávající nebude xxx xxxxxxxxx xxxxxxxxx x napojení + xxxxxxxxxxx xxxxxx xx xxxxx XX (zabezpečený xxxxxx xxx xxxxxxxxxx Xxxxx, xxxxxx xxxxxx, xxxxxxx, xx.) - xxx odhadovat náklady xxx 30 milionů Xx, které xxxx xxxxxx Xxxxx z xxxxxxxxx xxxxxxxxxx, xxxxxxx-xx xxxxxxx z EU xxxxx.
Xxxxxxxx o 32 xxxxxx xx xxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx xxxxx pro xxxxxx klinického hodnocení.
Dopady xx xxxxxxxxxx xxxxxxxx
Xxxxxx xx zadavatele
- Xxxxxx XX x jednotné xxxxxxxxxxx xxxxxxxxxxx xx xxxx zadavatelům xxxxxxxx xxxxxx xxxxx; xxxx xx xxxxxxxxxx, že xx se měly xxxxxx náklady na XX - to xx xxxxxxx, protože xxxxxxxx xxxx více xxxxxxxxxx xxx xx xxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxx xx xxxxxxxx xxxx xxxxxxxxx nemusí x konečném xxxxxx xxxxxxxx snížení.
- Xxxxxxxx xxxxx striktně xxxxxxxxx xxx. xxxx xxxxxxxxx. Xxxxx zadavatel nedoplní xxxxxxxxxxx xxxxxxxx dokumentaci xxx xxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxx považováno xx stažené (xxx xxxx, x xxxxx xxxxx xxxxxxxxxx xx xxx xxxxx). Xxxxxxxx xxxx xxxxxxxx pouze 1x, xxx je xxx v xxxxxx xxxx, xxx xx xxxxxxxxx úrovních xx „xxxxxxxxxx“ x dává xx xxxxxxx zadavateli xxxxxxx podruhé či xxxxxxxx xxxxxxxxxx x xxxxxxxxxx. To xxx xxxxxx xxxxx, xxx xxxx, že se xxxxxxxxxxx xxxx xxxxxxxxxxx xxx xxxx X xxxxx 1 členský xxxx = členský xxxx xxxxxxxxx. Xxx xx xxxxxxxx dokumentace xx xxxxxxxx stanoven xx 12 kalendářních xxx (xxxx v xxxxx max. 10, xxx xxxx být x xxxx xxxxxxxxxx xxx). Dnes xxxx xxxxxxxxx xxxxxx více xxxx, xxxxx mu xxxxxx x xxxxxxx xx xxxxxxx řád (xxxxxxxx xxxx xx xxxxxxxx xxx xxxxxxxxxx - někdy x xxxxx). Xx xxxx x xxxxx xxxx x zamítáním xxxxxxxxxx xxxxxxxxx, jejich znovupodávání x xxxxxxxxxx posuzování, xxx xx xxxxx xxxxx x xxxxxx xxxxxxxx zadavatelů a xxxxxxxx xxxxxxx x xxxxxxxx xxxxxx.
- Výhodou xxxx xxx zadavatele, xxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx (x XX cca 90-95%) x xxxx xxxx xxxxxx v XX (xx xxxx xxx 80-85% z xxxxxxxxxxxxxxxx XX), x xxxxxxxx xxxx platili každé xxxxxx xxxxxx, což xx xxxx xxxxxxxxx. Xxxxxx xx xxx xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx hl. xxx xxxx II.
- Xxxxxxxxxx subjekty xxxx xxxxxx xxxxxxxxxx jako xxxxxxxx, xxxxxxxxxxxx xx xxxxx v doznačování xxxxxxxxxxx léčivých xxxxxxxxx. Xxxxx jednoznačně xx xxxx více „xxxxx“ xx xxxxxx xxxxxxx x pomoci xxxxxxxxxxx xxxxxxxxxxx s xxxxxxxxx xxxxxxxxxxx - xx xxxxxxx, kolik xxxxxxxx xx to xxxxxx x xxxxx systému xxx.
- S xxxxxxx xx xxxxxxxxxx, xx xxxxx není xxx xxxxxx XX, xxx xxxxxxxx EU, xxxxx xxxxx dopady identifikovat.
Pro xxxxxxxxx uvádíme, xxx xxxx být xxxxxxxxxxx:
- Xxxxxxxxxxxxx xxxxxxxxxxx
- Xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx (státní x xxxxxxxxxxxxxx)
- Vysoké xxxxx
- Xxxxxxx společnosti
CRO (XxxxxxxxXxxxxxxxXxxxxxxxxxxx) –xxxxxxxxxxx, xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx pro xxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx se SÚKL, xxxxxxxx komisemi, často xxxxxxxxx xxxxxxx s xxxxx xxxxxxxxxx xxxxxxxxx x se xxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxxx hodnocení, xxxxxxx i xxxxxxxxxxxxxxxxx xxxxxxx (xxxxxx xx xxxxxxx xxxx zadavatelem x XXX; xxxxxxxxx xxxxxx rozsah xxxxxxxx, xxxxx xxx něho XXX xxxx x xxxxxx xxx i xxxxxxxxxx)
- Xxx xxxxxxxx xxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx hodnocení xxxxxxxxxxx xxxxxxxx xxxx xxxxxxxx členským xxxxxx xxxxxxxxxxxxxxx xxxxxxx XX. Xx xxxxxxxxxxxxx, že xxx xxxx X (xxxx I dokumentace) xxxx zajišťovat zadavatel xxx xxxxxxx xxxxxxx xxxxx sám; co xx xxxx xxxx XX (části XX xxxxxxxxxxx, xxxxx xx xxxxxxxx xxxxx xx xxxxxxxxxxx členskému státu, xxxxx není xxxxxxxx, xxxx-xx moci xxxxxxxxx x xxxxxx s xxxxx xxxxxxxx xxxxxx xxxx „xxxxxxxxx xxxxx“ xxx pro xxxx X, x xxx xxxxxxx by xx xxx byly opět XXX.
- Xx se xxxx xxxxxx xxxxx xxxxxxxx - xxxxxxxxxx, xxxxxxxxx míst klinického xxxxxxxxx, xxxxxxxxxxxx…. Xx xx mohlo být xxxxxx, xxxx xxxxxxxx
Xxxxx xx xxxx míst xxxxxxxxxx xxxxxxxxx
- Xxxx xxxxxxxxx certifikátu xxxxxxx xxxxxxxx praxe xxx xxxxxxxxxx provádějící xxxxxxxx xxxxxxxxx bioekvivalenční (xxxx xxxxxxxxxxx se xxxxxxxx xxx dnes, xxxxxxx xxxx. xxxxxxxxxxx je xxxx); klinická xxxxxxxxx xxxx X (1.xxxxxx xxxxxxx) - nově; xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx x xxxxxx certifikátu, xxx není to xxxxxx zákonná povinnost; xxxxx xx xxxxxxxxx xxxxxxx xxxxxxxxxx
- Klinická xxxxxxxxx xxxxxxxx přípravků xxxx prováděna x xxxxxxxxxxxxx xxxxxxxxxxxxx zdravotních xxxxxx
- Adaptace xx xxxxx xxxxx xxxxxx xxx žádný dopad
- Xxxxxxx nákladů za xxxxxxxxx xxxxxx - xxxxxxxx xxxxxx, nemělo xx xxx xxxxxxxxx xxxxxxxxx
Xxxxx xx týká xxxxxxxxxxxx
- Činnost zkoušejících x xxxxxxx klinických xxxxxxxxx nedozná změn, xxxxxxxx xxxxxxxx by xxxxxx xxx dopad xx xxxx xxxxxx
- Xxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx - xxx x současné xxxx xxxxx xxx XXX (XXX X6 - XXX = XxxxXxxxxxxxXxxxxxxx), xxxxxxxxxx xx xxxx podávat zprávy x průběhu x xxxxxx místě klinického xxxxxxxxx xxxxxx komisi, xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx
- Xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx - ¨xxxxxxx xxxxxx xxxxxxxxx - xxxxxxxx by neměla xxx xxxx xx xxxx xx xxxxxx
Xxxxxx xx xxxxxxxxxx organizace
- xxxxxxx nebyly xx xxxxxxx xxxxxxxxxx klinických xxxxxxxxx xxxxxxxx. X xxxxxxxx době je xxxxxxxxxx xxxxxxxxxx SÚKL x xxxx xxxxxxx (xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx, povinnostech x xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx, zajištění xxxxx xxxxxxxxxxxxxx). Xxxx xxxxxxxxxx SÚKL předpokládá x xxxxxx. Xxxxxx xxxx , xxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxx do xxxxxxxx xxxxxxxx xxxxxx.
- xxxxxxxx xxxxxx xxx finanční xxxxxx xxxxx xx xxxxxxxxxx organizace
Pokud xx xxxx státní správy, xxxxx SÚKL a Xxxxxxxxxxxx zdravotnictví, xxxxxxxx xxxxxxxxxxx x činnost
SÚJB (Xxxxxx úřad pro xxxxxxxx xxxxxxxxxx)
- Posuzování xxxxxxx x xxxxxxx xxxxxxx neregistrovaného xxxxxxxxxxxx x XX - xxxx současný xxxx
XXX
- Xxxxxxxxxx žádostí x xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx přípravky x xxxxxxx XXX x XX - xxxx xxxxxxxx xxxx
XXXX
Xxxxxxxxxx žádostí x xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx přípravky x embryonálními xxxxxxxx xxxxxxx x XX - xxxx činnost xxx xxxxxx xxxxxxx xx lidských subjektech, xxxxx nebylo xxxxxx; XXXX xxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxx xx, xxxxxxx xxxxxx xxxxxx x xxxxxx za xxxxxx lidských xxxxxxxx, xx tohoto posuzování xx bylo zapojeno (xxx zákona o xxxxxxxxxxxxx xx.) x xxxxxxxxxxxx zdravotnictví
3.2.2. Opatření xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx přípravků
Pokud xxx x navrhovanou xxxxxx xxxxxx spočívající x opatření x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxx xx xxxxx nákladů xxxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxx, xxx xxxx xxxxxxxxx xxxxxxx xxxxxxxx x Xxxxx republice, x dále x xxxxxxxxxx opatření x xxxx xxxxxxxxx, kdy xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx způsobí xx xxxxx xxxxx xxxxxx xxxxxxxxxx. Xxxx xxxxxxx budou xxxxxx x xxxxx současného xxxxxxx xxxxxxxxxxx xxxxxxxx Xxxxxxxx xxxxxx pro xxxxxxxx léčiv a Xxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxx x 4 xxxxxxxx úvazky xxxx spočívat xx 2 xxxxxxxxxx úvazcích xx Xxxxxxx xxxxxx xxx kontrolu xxxxx (xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxxx Xxxxxxxxxxxx), x xx 2 xxxxxxxxxx úvazcích xx Xxxxxxxxxxxx xxxxxxxxxxxxx. Činnost xx Xxxxxxxxxxxx zdravotnictví xxxx xxxxxxxx ve xxxxxxxxx xxxxxxxxx právní xxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx vzdělání x xxxxxxx xxxxxxx xxxxx agendy xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx či xxxxxxxxxx xxxxxxxx.
Xxxxx xx xxxx dopadů xx xxxxxxxxxx xxxxxxxx:
Xxxxxx xx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx
Xxx může být xxxxxxxxx - xxxxxxx xxxx xxxxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxxxxx §26 xxxxxxxx 4 xxxxxx o xxxxxxxx
- Xxxxxxxxxx xxxxxx úprava xxxxxxx upřesnění stávající xxxxxxxxxx xxxxxxxx xxxxxxx x §33 xxxxxx x léčivech xxxxxxxxxx xxxxxxxxx o léčivých xxxxxxxxxxx xxxxxxxx xx xxx x Xxxxx xxxxxxxxx. Xxxx xxxx xxxxxxx poskytovat xxxx xxxxx x xxxxxxxxxxxx xxxxxxxxxxx v xxxxxxxxxxxx xxxxxx, aby tato xxxx xxxx xxxxxxxxxx x xx zpracovatelné xxxxxx xxxxxxxx Ústavu xxxx xxxxxxxxxx xxxxx, xxxxx poskytuje informaci x množství xxxxxxxx xxxxxxxxx, xxxx konkrétní xxxxx, dodané držitelem xx xxx v Xxxxx xxxxxxxxx.
- Xxxx xxxxx xxx budou xxxxxxx Xxxxxx xxx xxxxx xx zdrojů xxxxxxxxx pro xxxxxxxxxx xxxxx xxxxx xx xxxx x Xxxxx xxxxxxxxx, ve xxxxxx x posouzení xxxxxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x x xxxxxxxxx xxxxxxx dopadu distribuce xxxxxxxx léčivého xxxxxxxxx xx zahraničí, pokud xx xxx xxxxxx xx xxxxxxx podle §77c zákon x xxxxxxxx.
- Xxxxxx xxxxxx xxx xxxxxxx větší xxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx přípravku x xxxxxxxx xxxxxxxxxxx xxx xxxxxxx pacientů x XX.
Xxxxxx na xxxxxxxxxxxx
Xxx xxxx být xxxxxxxxxxxxx:
- Xxxxxxx xxxxxxxx x xxxxxxxxxx léčiv xxxxxx Ústavem xxxx xxxxxxxxxx regulační xxxxxxxxx x xxxxxxxx xxxxx XX
- Xxxxxxxxxxxx xxxxx, x xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx na xxxxxxx podle §77c xxxxxx x léčivech, xxxxxxxxxx xxxxxxxxxx do xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx. Xxxxx xxxxxx xx 15 dnů xx xxxx xxxxxxx xxxxxx XXX xxxxx §77d xxxx xxxx xxxxxxxx provést.
- Xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxx významně xxxxxxx xx xxx xxxxxxxx touto xxxxxxx, xxx nedojde k xxxxxxx xxxxxxxxxxxxxxx zátěže xxxxxxx xx xxxxxxxxxxx xxxxxxx.
- Xxxx xxxxxxxxxxxx, xxxxx xxxxxxxx, případně x minimálním rozsahu, xx lékáren x xxxxxxxxx xx xx xxxxxxxxxx léčivých xxxxxxxxx xxxxxxxx xx xxx x České xxxxxxxxx xx xxxxxxxxx, pak xxxx xxxxx xxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Xxxxxxx xxx xxxxx a v x xx xxxxx xxxx xxxx xxxxxxxx xxxxx pro xxxxxxxxxx xxxxxxxx přípravků xxxxxxxxxxx x xxxxx republice, xxxxxxx do xxxxxxx.
Xxxxxx xx „xxxxxxx“ - xx xxxxxxxxxxxxx zdravotních xxxxxx xxxxxxxxxx xxxx
Xxx xxxx xxx „lékárnou“: Xxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxx xxxxxx č. 372/2011 Sb., xxxxxx x xxxxxxxxxxx xxxxxxxx
- Xxxxxxxxxx právní xxxxxx xxxxxxxxx lékárnám xxxxx nové zákonné xxxxxxxxxx, xxxxxx xxxxx xxxxxxxxxxxx nárůst administrativní xxx xxxx xxxxxx.
- Xxxx xx xxxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxx přípravků.
Dopady xx xxxxxxxx
- Xxx xxxxxxxx bude přínosem xxxxxxxxx xxxxx x xxxxxxx xxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxx, xxx xxxxxx xxxxxxxxxx xxxxxxx rovněž xxxxxxxxxxx xxxxxxxxx xxxx, xxx xxxxxxxx xxxxxx náhradní xxxxx.
3.3 Přínosy
3.3.1.Adaptace xxxxxxxx x xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxxxxx xxxxxxx podávání x xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx x založení xxxxxxxxx xxxxxxx EU x xxxxxxxx XX xx xxxx celkově xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxx vyšší xxxx komfortnosti. Xxxxxxxxx xxxx mít x xxxxxxxxx xxxxxxxxx žádost xxx xxxxxxx xxxxxxx xxxxx, ve kterých xx bude klinické xxxxxxxxx provádět, x xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xx měl xxx xxxxxxxxx x xxxxxxxxx. To by xxxx xxxx k xxxx zvýšení počtu xxxxxxxxxx hodnocení na xxxxx Evropské unie x tím x x České xxxxxxxxx.
X xxxxxxxx xxxx xxxxxxxxx xx xxxx xxx xxxxxxx možnosti xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxxxxxxx zdravotních xxxxxx, kde by xxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx xxxxxx xxxxxx x odborných xxxxxxxxx v xxxxxxxxxxxx xxxxxxx.
Xxxx xxxxxxxx x xxxxx systém xx xxxxxxxxx xxxxxxxxxxx x xxxxx Xxxxxxxx unie, xxxxx xx poli xxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxxx dobu. Xxxxxxx xxxxxx xxx xxx xxxxxxx v xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx x xxxx, že xx xxxxxxxx x xxxxxxxxxxx x rámci xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xx xxxxxx xxxxxx, byl xxxxx xxxxx použit xxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxx na její xxxxxxxxx.
Xxxxxxxx nového režimu xxxxxxxxx klinických xxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx, a xx x toho xxxxxx, xx ustavování xxxxxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxx právní xxxxxx xxxxx poskytovateli xxxxxxxxxxx služeb, v xxxxx xx xxxxxxxx xxxxxxxxx xx xxxxxxxx x x němž xx x xxxxxxx, xxxxxxxxxx xxxxxxxxxxx snazší xxxxxxx ovlivnění xxxxx xxxxxxxx xxxxxx x x xxx xxxxxxxxxxx xxxxx korupční xxxxxx, xxx xxxx xxxxxxxxxxx x xxxxxx xxxxxx xxxxxx xxxxxxxx systém xxxxxx komise a xxxxxx skupin, xxxxx xxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxxx, xxxx xxxxx xxxxxx xxxxxx, x xx do xxxxxxxxxxxx xxxxxx, xx xxxxx xxxxxxxxxx xxxxxx xxxxxx jmenovat x xxxxxxxxx xxxxx ministr xxxxxxxxxxxxx.
3.3.2. Xxxxxxxx směřující x omezení xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxx xxxxxxxxxxxxx xxxxxx zákona xx xxxxx xxxxxxxxx opatření xxxxxxxxxxx x xxxxxxx xxxxxxxxx léčivých přípravků xx zvýšení xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx x Xxxxx xxxxxxxxx, x tím xxxxxxxx xxxxxxxx xxxxxxx xxxxxx zdraví.
Zavedení vícestupňového xxxxxxx regulace vývozu xxxxxxxx přípravků xx xxxxxxxx na xxxxxxxxxxxxx x xxxxxxxxxxxxx xxxxx x distribuci x xxxxxxxx léčivých xxxxxxxxx, xxxxx xx xxxxxxxx xx xxxx xxxxxxxx, x xx jak xx těch, xxxxx xxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxx, tak x od těch, xxxxx je xx xxxxxx xxxx xxxxxxxxx, x xxxxxxx údaji xxxxxxxx povahy xx xxx měl odpovídat xxxxxxxxx údaj vstupní xxxxxx x xxxxxx. Xxx xxx o xxxxx xxxxxxx xxxxxxxx xxxxxxxx, které xxxx x xxxx vzájemně xxxxxxxxxxxx obdobně xxxx xx tomu x xxxxxxx xxxxxxxxxx, kdy xxxxx „má dáti“ xxxxxxxx xxxx „xxx“ . Xxxxx o xxxxxx vyvážených xxxxxxxx xxxxxxxxx je xxx xxxxx xxxxxxxxx za xxxxxxxxx x možnost xxxxxx falšování je xxxxx xxx xxxxxxxxxx. X xxxx xxxxxxxxxxx xx xxxxx xxxxxxxxxxx, xx dosud xxxxxx xxxxxxxx xxxxxx závažné xxxxxxx, xxx by xxxxxx xxxxxxxxx xxxx xx skutečnosti xxxxxxxx xxxxxxxx xxxx Xxxxxx xxxxxxxxx, x xxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxx vykazovány xx xxxxx České xxxxxxxxx. Možnost xxxxxxxx xxxxxxxxxx jednání je xxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxxxxxxx rozhodných xxxxx x distribuci x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx ztížena xx xxxxx vyloučena. Xxxxxxxx xxxxxxxx vývozu xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx.
3.4 Xxxxxxxxxxx xxxxxxx x přínosů xxxxxxx
3.4.1. Xxxxxxxx xxxxxxxx o xxxxxxxxxx hodnoceních xxxxxxxxx xxxxxxxx přípravků
Vyhodnocení xxxxxxx x xxxxxxx xxxx xxxxxxxxx x xxxxx xxxxxxxxxxxx xxxxxxx řešení, xxx je xxxxxxx xxxx.
3.4.2. Xxxxxxxx směřující x omezení xxxxxxxxx xxxxxxxx přípravků
Vyhodnocení xxxxxxx x xxxxxxx xxxx xxxxxxxxx v xxxxx xxxxxxxxxxxx variant xxxxxx, xxx xx xxxxxxx xxxx.
3.4.3. Xxxxxxxx xxxxxxxx xx xxxxxx x xxxxxxx xxxxxx xxx xxxxxxx léčivé xxxxxxxxx
Xxxxxxx xxxxxxxxx je varianta xxxxxxx textu zákona x xxxxxxxx xxx, xxx xxxx náležitým xxxxxxxx xxxxxxxxx adaptace xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (EU) č. 1252/2014.
3.4.4. Xxxxxxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxxx xxxxxxxxxxx xxx
Xxxxxxxx 1 xxxxxxxxxxx ve xxxxx xxxxxx x xxxxxxxx xx xx xxxxxx, xx xxxxxxx xxxxxx xxxxxx xxxxxxxx, x xxxxxx xx inspiruje xxx xxxxxxx právním xxxxx, x xx xxxxxxxxx xxxxxxxxxxx §8 xxxxxx č. 226/2013 Xx.
Xxxxxxxx 2 spočívající x přijetí doprovodné xxxxxx xxxxxx x Xxxxx správě Xxxxx xxxxxxxxx x xxxxxx xxxxxx xxxxxx xxxxxx x léčivech xx xxxxxxxx opět rychlé xxxxxx, xxxxx úprava xx xxxxxxx xx xxxxxxxxxx xxxxxx resortu, x tudíž xx xxxx xxxxxxx možnosti xxxx změny, xxxxx xx xx přijetí xxxxxx změny xxxxx xxxxxxxxxx.
Xxxxxxxx 3 spočívající xx xxxxxxx samostatné xxxxxxxxxx xxxxxx x Xxxxx xxxxxx České xxxxxxxxx má xxx xxxxxxx nedostatek, že xx založena xx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx č. 17/2012 Sb. bez xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxx státní xxxxxx xx velmi dlouhou xxxx, xxxxxxx xxxx x léčivy xx xxx v Xxxxx xxxxxxxxx nebyla xxxxxxxxxx xxxxxx.
3.4.5. Xxxxxxxxxxx při xxxxxxxxx činnosti x xxxxxx instituty xxxxxxxxx x xxxxxxx léčivých xxxxxxxxx
Xxxxxxxx 1 xxxx xxxxxxx s xxxxxx xxxxxxxxx xxxxxxxx. Naopak xxxx xxxxxxx xx xxxx xx xxxxxxxx xxxxxxxxxxx pro xxxxx xxxxxxxxxxxx xxxxxxxxxx právní xxxxxx, xxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xx xxxxxx kontrolovaných xxxxxxxx, xxx xxxxx xx xxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxx xxxxx xxxxxxx a xxxx xx xxxxxxxxxxx x průběhu xxxxxxxxx xxxxxxxx x x xxxxxxx ztrátám xxx xxxxxxxxxxx xxxxxxxxxx. Xxxxxxxxx xxxxxxxx či následně xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx nebo xxxxxx xxxxxxxxx, xx xxxxxxx xxxxxxxxx neoprávněné xxxxx, xxxxxxxxxxx xxxxxxxx xxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxxx léčivých přípravků, x xxxxxx xxxxxxxxx xxxxxxxxxx dopadem xx xxxxxx xxxxxxxxx xxxx. Xxxxx zabrání xxxxxxxx xxxxxxxx xxxxxxxxx představuje xxx osoby, xxxxxx xxxx xxxxxxx, značný xxxxxxxxxx xxxxx, xxxxx xxxx xxxxxxx xxxxx xxxxxxxxxxx dalšímu xxxxxxxxxxx x xxxxxxxxxxx činnosti.
Varianta 2 xx xxxxxxxx xxxxxxxxx úpravu prokazování xxxxxxxxxx xxx provádění xxxxxxxxx xxxxxxxx x xxxxxxxxx zásadních xxxxxxxx xxxxxxxxx xxxxxxxxx a xxxxxxx léčivých přípravků xxx, xxx xxxx xxxxxxxxxx i pro xxxxxx xxxxxxx, xxx xx zjištěno, xx x xxxx xxxxxxxxx xxxxx, které k xxxx xxxxxx xxxxx xxxxxx xxxxxxxxx. Xxxx xxxxxxxx představuje účinnější xxxxxx xxxxxxx xxxxxxxx x celé xxxxxxxxxxx xxxx dopady xxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxx, xxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx životního xxxxx xxxxxx x xxxxxxxxxxx xxx velmi xxxxxx xxxxxx xxx xxxxxx xxxxxxxx x xxxxxxxx xxxx xxxxxxx xxx xxxxxx veřejného xxxxxxxxxxx xxxxxxxxx, x xxxxxxxxx xxxxxxxxx x xxxxxxxxxx dopadem xx xxxxxx xxxxxxxx.
4. Xxxxx xxxxxx
4.1 Stanovení pořadí xxxxxxx x výběr xxxxxxxxxxxxxx xxxxxx
4.1.1. Xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxx a xxxxxxxxxxx xxxxxxxxxxxx variant xxxx xxxxxxxxx, xxx xx uvedeno výše.
4.1.2. Xxxxxxxx směřující x xxxxxxx reexportu xxxxxxxx xxxxxxxxx
Xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxx xxxxxxxxx, xxx xx xxxxxxx xxxx.
4.1.3. Xxxxxxxx nařízení xx xxxxxx x léčivým xxxxxx xxx humánní xxxxxx xxxxxxxxx
Xxxxxxxxxxx variantou xx xxxxxxxx xxxxxxx xxxxx zákona x xxxxxxxx tak, aby xxxx náležitým xxxxxxxx xxxxxxxxx xxxxxxxx nařízení Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014.
4.1.4. Xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx x Generálního ředitelství xxx
Xxxxxxxxxxx xxxxxxxxx xx xxxxxxxx 1 spočívají xx xxxxx zákona x léčivech. Jde x nejvhodnější, a xxxxxx xxxxxxxxxxxxxxxx xxxxxx xxxxxxxx, když xxxxx xx xxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxx nastavený xxxxxxx xxxxxxx xxxxx, který x praxi xxxxxx xxxxxx x osvědčil xx. Xxxx varianta xxxxxx xxxxxxxxxxx kontrolní xxxxxxxxxx obou orgánů xxxxxx xxxxxx a xxxxxxxx tak xxxxxxx xxxxxxx xxxx Xxxxx xxxxxxxxx a xxxxxxxx xxxx XX xxxx xxxxxxx xxxxx, xxxxx xxxxxxxxxxxx svou xxxxxxxx xxxxxxx požadavkům x xxxxxx EU.
4.1.5. Xxxxxxxxxxx xxx xxxxxxxxx činnosti x právní xxxxxxxxx xxxxxxxxx x zabrání xxxxxxxx xxxxxxxxx
Xxxxxxxxxxx xxxxxxxxx xx xxxxxxxx 2, xxxxxx xx xxxx xxx dosaženo xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxx provádění xxxxxxxxx xxxxxxxx a xxxxxx xx xx xxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxx přípravků xxx, xxx xxxx xxxxxxxxxx x xxx xxxxxx xxxxxxx, kdy xx zjištěno, xx x xxxx xxxxxxxxx xxxxx, které x xxxx xxxxxx podle xxxxxx xxxxxxxxx. Nadále xx xxx xxx xxxxxxxxxxxxx pro xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, xxxxx je xx xxxxxx xx xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx x xxxx xx sporům x xxxxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxxxxx neefektivnímu xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxx.
Xxxxxxxxx xxxxxxxx xx následně xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx, se xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx pro možné xxxxxxx o xxxxxx xxxxxxxx. Navíc xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxx, xxxxxx byly xxxxxxx, xxxxxx xxxxxxxxxx dopad, xxxxx xxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxx v neoprávněné xxxxxxxx.
5. Xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx a xxxxxxxxxx
Xxxxxxx xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx, xxxxx xxx o xxxxxxxx xxxxxxxx o xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx přípravků, bude xxxxxxxxx Xxxxxx ústav xxx kontrolu léčiv, xxxxx xx xxx xxxxx xxxxxxxxxxx xxxxx xxxxxx x xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxx oblast xxxxxxxx léčiv, xxxxxx xxxxxxxxxx x xxxxxxx xxx prováděním klinických xxxxxxxxx léčivých xxxxxxxxx. Xxxxxx ústav xxx xxxxxxxx léčiv xx xxxxxxx xxxx jiné xxxxxxx xxxxxxxxxx x xxxxxxx jakosti, účinnosti x xxxxxxxxxxx xxxxx, x xx i xx xxxxxx x xxxxxxxxxx orgánům xxxxxxxxx xxxxx x Xxxxxxxx xxxx.
Xxxxxx xxxxxxxxxxx za xxxxxxxxxxxx xxxxxxx varianty xxxxxx, xxxxx jde x xxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Xxxxxx xxxxx xxx xxxxxxxx léčiv. Xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx implementována xxxxxxxxxxxxxxx xxxxxxxxx seznamu xxxxxxxx xxxxxxxxx, které xxxx xxxxxxxx jejich xxxxxxxxxxxxx, x xxxx při xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx přijetí xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxx xxxxxxx mimo xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xx xxxxxxx získávání přesných x xxxxxxxxxx dat x xxxxxx, xxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxx, xxxxxxxx x xxxxxxxxxx xx xxxxxxx xxxxxxxxx vyhodnocování xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxx za porušení xxxxxxxxxxx xxxxxxxxxx.
6. Xxxxxxx xxxxxxxxx xxxxxxxx
Xxxxxxx účinnosti xxxxxx xxxxxx x xxxxxxxx budou v xxxxx xxxxxxxx Ministerstvo xxxxxxxxxxxxx a Xxxxxx xxxxx xxx kontrolu xxxxx xx xxxxxxxxxx x dotčenými xxxxxxxx, x xx x xxxxxxxx xxxxxxxxx nové xxxxxx úpravy x xxxxxxx x hlediska xxxxxxxxxx cílů sledovaných xxxxx xxxxxx úpravou. Xxxxx xxxxxxx ke xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xx Xxxxxx, xxxxx xx ustanovením čl. 97 xxxxxxxx x. 536/2014 xxxxxx přezkum uplatňování xxxxxx nařízení.
Navrhovatel po 2 xxxxxx xx xxxxxxxxx právní úpravy xxxxxxxxx reexporty vyhodnotí xxxxxx xxx pacienty.
Pro xxxxxxxxx xxxxxxxx xxxxxxxx xxx pro účinný xxxxxxx regulace xxxx xxxxx z případů, xxx xx bylo xxxxxxxxxx x xxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx zdokumentován. Zejména xxxx xxxxxxxxx, kolik xxxxxx léčivých xxxxxxxxx xxxxxxxxx xxxxxxxx postihlo, x jaký konkrétní xxxxx XXX xxxxxx xxx v nich xxxxxxx. Xxxxxx xxxx x xxxxxx xxxxxxx xxxxxxxxxxx, xxx x xx xxxx xxxx xxxxxxx opatření skutečně xxxxxxxx xxxxxxx dostupnosti xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx x Xxxxx xxxxxxxxx a xxxx xxxxxxxx xxxx xxxxxxxxxxx xxxx přijetím xxxxxxxx x po xxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x xxxx xxxxxx tohoto xxxxxxxx.
Xxxxx xxxxxxxxxx xxxxxxxxxxx účinnosti xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxx budou xxxxxxxxxxx xxxx důsledky xxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxx xxxxxx xx xxxxxxxxx ukazatelů xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx objemu xxxxxxx, xxxxx xx v xxxxxxx xxxxxxxxx xxxxxxxx xxxx x xxxxxxxxxx xxxxxxx dodány xx xxxxxxxxx, x xxxxxxxxxx xxxxxxxxxx objemu xxxxxxx, xxxxx v xxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxx xx zahraničí xxxxxx xx xxx x České xxxxxxxxx. Xx základě vyhodnocení xxxxxxxxxxxx xxxxxxx pak xxxx xxxxxxxxx souhrnné xxxxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxxxx xxxx xxx xxxxxxxx účinnosti xxxxxxxx hodnocen xxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxx nedostupností, x přijatými xxxxxxxxxx xxxxxxxxx x omezení xxxxxxxxx léčivých přípravků, xxx xxxxx být xx xxxxxxxx xxxxxxxxxx xxxxx objektivně posouzeno, xxx xxxxxxxx vícestupňový xxxxxx xxxxxxxx vývozu xxxxxxxx přípravků x xxxx prvky xxxxxxxxxx x ve svém xxxxxxx nadále xxxxxxxx xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxx zajistit xxx pacienty x Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
7. Xxxxxxxxxx a zdroje xxx
Xxxxx xxxxxx xxx x xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxxxx subjekty. Xxx oblast xxxxxxxx xxxxxx x náhrady xxxx se xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx pro xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x Xxxx xxxxxxxx komisí. Xxxxxxxxxxx x xxxxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxx etických xxxxxx xxx xxxxxxxxxxxxxx hodnocení x zástupci xxxxxxxx xxxxxxxx komisí účastnících xx jednání Fóra xxxxxxxx komisí. Informovány xxxx i xxxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx organizací xx xxxxxxxx xxxxxxxx komisí. Xx xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xxxxxxx xxxx byli xxxxxxxx zadavatelé prostřednictvím Xxxxxxxx xxxxxxxxxxxx průmyslu, Xxxxxxxx xxxxxxxxxxx přípravků, xxxxxxxx Xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx, Xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxxxxxxx xxxxxxxxxxxxx tuto otázku xxxxxxxxxxxx x Xxxxxxxxxxxxx xxxxxxx x Xxxxxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx k omezení xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx x jednotlivými xxxxxxxx xxxxxxxxxx o xxxxxxxxxx, xxxxx xxxxxxx xxxxxxxx xxx zamezit xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxx na xxx x Xxxxx xxxxxxxxx xx zahraničí x xxxxxx s Xxxxxxxx inovativního xxxxxxxx.
Xxxxx xxxxxx xxxxxx x xxxxxxxx xxx x xxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx x xxxxxxx x xx. 8 Xxxxxxxxxxxxxx xxxxxxxx vlády xxxxxxxxx s xxxxxxxxx xxxxxxxxxxxxxx xxxxx.
8. Xxxxxxx xx xxxxxxxxxxxx XXX
Xxxxx x příjmení: XXXx. Xxxxx Němcová
Funkce: xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx
Xxxxx: Xxxxx xxxxxxxxxx, xxxxxxxx xxxxxxxxxx hodnocení XXXX
Xxxxxxx: 272 185 817; 724 917 141
e-mail: xxxxx.xxxxxxx@xxxx.xx
Xxxxx x xxxxxxxx: Xxx. Xxxxxxx Xxxxxxxx
Xxxxxx: xxxxxxx xxxxx xxxxxx
Xxxxx: Xxxxx xxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx
Xxxxxxx: 272 185 706
x-xxxx: xxxxxxx.xxxxxxxx@xxxx.xx
X. Xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx České xxxxxxxxx, x xxxxxxxxxxxxx xxxxxxxxx x s xxxxxxxx Xxxxxxxx xxxx, judikaturou xxxxxxxx orgánů Xxxxxxxx xxxx x xxxxxxxx xxxxxxxx zásadami práva Xxxxxxxx unie
Navrhovaná xxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxx xxxx Xxxxx xxxxxxxxx, xxxxxxx ústavnímu zákonu č. 1/1993 Sb., Xxxxxx Xxxxx xxxxxxxxx, xx znění xxxxxxxxxx xxxxxxxx, x xxxxxxxx předsednictva České xxxxxxx xxxx č. 2/1993 Sb., x xxxxxxxxx Xxxxxxx xxxxxxxxxx xxxx x xxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxx Xxxxx xxxxxxxxx, xxxxx xx xxxxxxxx k předkládanému xxxxxx zákona.
Navrhovaný systém xxxxxxxx xxxxxxxx xxxxxxxxx xxxx x xxxxxxx x xxxxxxxxxxxxx smlouvami, xxxxxxx je Xxxxx xxxxxxxxx xxxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xx x xxxxxxx s Xxxxxxx x xxxxxxx xxxxxxxx xxxx a xxxxxxxxxx xxxxxx. Poskytuje xxxxxx xx spravedlivý xxxxxx x xxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxx se xxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx řádem a xxxxxxx o xxxxxxxxxxx, xxxxxxxx podstaty xxxxxxxxx xxxxxxx xxxx jasně xxxxxxxxx, xxxxxxxxx jsou x xxxxxxxx xxxxxxxxxx x xxxxxxxx rozpětí xxxx xxxxx.
Xxxxxxxxxx právní xxxxxx xx xxxxxx x souladu x Xxxxxxx x lidských xxxxxxx x biomedicíně, xxxxxxxxx xxx č. 96/2001 Sb. m. s. Xxxxx x xxxxxxx xxxxxxx reexportu xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxxxxx ustanovení čl. 3 Xxxxxx, xxxxx xxxxxxx xxxxxxx xxxxxx, xxxxxx xx xxxxxxx zdravotní xxxxxxx x xxxxxxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxx, xxx x xxxxx xxx jurisdikce xxxxxxxxx xxxxxx dostupnost xxxxxxxxx xxxx xxxxxxxx xxxxxxx. Xxxxxxxxx zdravotní xxxx xxxxxxxx xxxxxxx xxxxxx zahrnuje zajištění xxxxxx xxxxxxxx x Xxxxx republice v xxxxxxx xxxxxxxx přípravků, xxx tyto xxxxxx xxxxxxxxxxxxx mimo Xxxxxx xxxxxxxxx na xxxx xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx v Xxxxx xxxxxxxxx.
Xxxxx jde x xxxxx xxxxxxxxx xxxxxxx, xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx bude xxxxx xxx xxxxxxx x x xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx trhu xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxxx do xxxxxxxxx, xxxxx hovořit x xxx, xx xx xxx xxxx xxxxxxx xxxx xxxxx xxxxxxxx x xxxxxxxxxx xxxxx hospodářskou činnost xx smyslu čl. 26 xxxx. 1 Listiny xxxxxxxxxx xxxx x xxxxxx, xxxx xxxx x čl. 26 xxxx. 2 Listiny je xxxxxxxxxx možnost, že xxxxx xxxx xxxxxxxx xxxxxxxx a xxxxxxx xxx výkon xxxxxxxx xxxxxxxx. Naopak xxxxxxxxxx xxx získá informaci, xx xxx x Xxxxx xxxxxxxxx, pokud xxx x zásobování xxxxxxxx léčivými xxxxxxxxx, xxxx xxxxxxx, x xxxxx xxxxx xxxxxx xxx může xxxxxxx xxxx xxxxxxxxxxxxxx aktivitu. Xxxxx xxxxx podnikat xx xxxxx xxxxxxxxx x xxxxxx práva xxxxxx na ochranu xxxxxx x xx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx x článku 31 Xxxxxxx zařazeným xxxxxx xx xxxx hospodářských, xxxxxxxxxx x xxxxxxxxxx. Xxxxx xxxxxxxx tak xxxxxx být xxxxxxxxxx xxx, že xx xxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxx jiného xx stejné xxxxxx xxxxxxxxxxx ústavního xxxxx.
Xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx není v xxxxxxx x xxxxxxxxxxxxx xxxxxxxxx, xxxxxxx je Xxxxx republika xxxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxx x xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) č. 536/2014, xxxxx xxxxxxxx xx xxxxxxxx x Xxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxx xxx xx záležitosti, xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxx xx xx xxxxxxxxx je xxxxxxx.
Xxxxxxxxxx xxxxxx xx x xxxxxxx xxxxxxx horizontu xxxx xxxxxxx x xxxxx xxxx xxxxxxxxxx xxxxx xxxxxx xx xxxxxxx xxxxxx x xx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx x článku 31 Xxxxxxx xxxxxxxxxx xxxx x xxxxxx xxx, xx xx xxxx výrazně xxxxxxx x xxxxxxx xxxxxx xxxx situací, kdy xx xxx na xxxx Xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx xxxxxx nadměrným xxxxxxx.
Xxxxxxxx xxxx uvedených xxxxxxxx komplexnosti, xxxxxxxxxxxxxxxx, xxxxxxxxx, xxxxxxxxxxxxx, xxxxxxxxxxxx, xxxxxxxxxx únosnosti, xxxxxxxxx x efektivity zajišťuje xxxxx xxxxxxxxxxxx navrhované xxxxxx xxxxxx s xxxxxx Xxxxxxxx xxxx, xxx kterého xx xxxxx xxxxxxxx vnitrostátní xxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxx z xxxxxx xxxxxxx xxxxxx a xxxxxx xxxx. Takové xxxxxxxx xxxx být xxxxxxxxxxxxxx, zejména musí xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx. X xxxxxx hledisek xxxx xxx opatření xxxxxxx xxxxxxxx státem xxxxxxxxxx. Xx základě xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx těmto podmínkám xxxxxxxx.
Xxxxxxxxx xxxxxx x xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx Xxxxxxxx xxxx xx realizován x xxxxxxx xx xxxxxxx xxxxxxx xxxxxx xxxxx (čl. 34 x 35 Smlouvy x xxxxxxxxx Xxxxxxxx xxxx), která představuje xxxxx xx xxxxxxxxxx xxxxxx jednotného xxxxxxxxx xxxx Evropské xxxx. Xxxxx léčivých přípravků xxxx v xxxxxxxx xxxxxxxx xxxx být x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx nedostupnosti xxxxxxxxx léčivého xxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx. Xx xxxxxxxxxxx zdravotní péče x xx zdraví xxxxxx jsou xxxxxx xxx práva Xxxxxxxx xxxx xxxxxxxxx členské xxxxx. Xxxxxxxxxx xxxxxx xxxxxx xx xxxxx x xxxxxxx x xxxxxx Xxxxxxxx unie, xxx xxxxxxx lze xxxxxxxx xxxxxxxxx opatření xx účelem ochrany xxxxxx a xxxxxx xxxx, x xxxxx xxxxxx xx xxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxxxx pacientů x Xxxxx xxxxxxxxx.
Xxxxxxxxxx členské xxxxx XX x xxxxxxxxxx letech přijímají xxxxxxx xxxxxxxx za xxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx přípravků x xxxxxx xxxxxx xxxxxxxxx, xxxxxxx xx xxxxxx Komise xxxx xxxxxxx x nich xxxxxxxxxx xx xxxxxx x xxxxxx Xxxxxxxx xxxx. Xxxxxxxx xxxx xx xxxxxx Komise xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx x jejich xxxxxx se xxxxxxxx xxxxxxx xxxxxx xxxxx. Xx xxxxxxx xxxxxxx xxxxxxx x xxxxxxxx xxxx (xxxxxxx Španělska) xxxx dospěno x xxxxxx, že xxxxxxxxxx xxxxxx, xxxxx xxxxxxx xx xxxxxxxxx seznamu xxxxxxxx xxxxxxxxx, xxxxx xxxx ohroženy xxxxxxxxxxxxx, x v xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx přípravků xxxxxxxxx xx tomto seznamu xxxx xxxxxxx xxxxxxx xxxx, je x xxxxxxx s xxxxxx Xxxxxxxx xxxx. Xxxxxxxx xxxxxx léčivých xxxxxxxxx xx nastavena xxxx xxxxxxxxxxxx, vychází z xxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx na xxxx, xxxxxxx xxxxxx xx naprosto xxxxxxxxxxxxx x xxxxx xxxxxxxx xxxx xxxxxxxxxxxxx. Xxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxx xxxxxxxx dvora, xxxxxx xx xxxxxxxx xxxxxx xxxxxxxx přijmout xxxxxxxx xxxxxxx x zajištění xxxxxxxxxxxx množství xxxxxxxx xxxxxxxxx xxx xxx xxxxxx x xxxxxxxx xxx xxxxxx xxxxxxxx xxxxxxx xxxxxx xxxxx. Xxxxxxxx xxxxxx xxxxxx xxxxxxxx xxxx xxxxxxxx xxxxx x právní xxxxxxx omezující reexport xxxxxxxx přípravků na Xxxxxxxxx, xxxxx byla xx xxxxxx XX xxxxxxxx za úpravu xxxxxxxxx volný pohyb xxxxx, protože xxxxxxxxxxxxx xxxxxxxx xxxxxxx, xxxxxxxxxx xx xx všechny xxxxxxxx xxxxxx přípravky, xxxxxxx, xxxxxxx nebyla xxxxxx xxxxxxx, ale xxxx trvalého xxxxxxxxxx x nebyla xxxxxxxxxx xxxxxxxxxx. X xxxxxxxx xxxx xx xxxxx xxxxxxxxx x Xxxxxx, xxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxx úprava xxxxxxxxx xxxxxxxx z xxxxxx xxxxx XX x xxxxxxxx x xxxx, xx x xxxxx opatření xxxxxxxxxxx xxxxxxxx jsou x Xxxxxx xxxxxx xxxxx xxxxxxxx x jeho xxxxxxx, xxxxxx xxx xxxxx, xx se xxxx xx reexport xxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx po xxxxxxxx takovýchto xxxxxxxx x sousedním xxxxx xxxxx zvýší.
Ostatní členské xxxxx, pokud reexport xxxxxxxx xxxxxxxxx xxxxxxx, xxxxxxxxx xxxxxxxxxx článku 81 xxxxxxxx 2001/83/XX x xxxxxxxxx dostatečného xxxxxxxx xxxxxxxx přípravků xxx xxxxxxxx xxx země.
Přijetím xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 ze xxx 28. května 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx xxx x xxxxxx a xxxxxx správné výrobní xxxxx xxx xxxxxx xxxxx pro xxxxxxx xxxxxx přípravky, xx xxxxxxxxx xxxxxxxx xxxxxx xxx xxxxxx xxxxx xxx xxxxxxx léčivé xxxxxxxxx. Xxxxx zákona xx měl xxxxxxx x důsledné xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxx Xxxxx xxxxxxxxx.
Xxxxxxxxxxx xxxxx xxxxxx xxxx x xxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxx Xxxxxxxx unie a xx x xxxxxxx x xxxxxxxx xxxxxxxx xxxxx Xxxxxxxx xxxx (xxxx. zásada xxxxxx xxxxxxx, xxxxxxxxxxxxxxx x xxxxxx diskriminace).
C. Zhodnocení xxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxx x xxxxxx diskriminace
Navrhovaná xxxxxx xxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx, které by xxxx x xxxxxxx xx zákazem xxxxxxxxxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxxxx xxx sekundární xxxxxx xx xxxxxxx xxxx x xxx x xxxxxx x xxxxxxxxxxxx jednoho x xxxxxxx, neboť nijak xxxxxxxxxxx xxx xxxxxxxxxxxx xxxxx x pohlaví x xxxxxxxxx xxx xxx xxxxxxx podmínky.
D. Xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xx vztahu x ochraně soukromí x xxxxxxxx xxxxx
Xxxxxxxxxx xxxxxx úprava xxxxxxxxx xxxx zpracování osobních xxxxx. Xxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx údajů. Xxxxxxxxxx xxxxxx xxxxxx nepředstavuje xxxxxxxx úpravu xxxxx xxxxxxxxxx xxx oprávnění xxxxxxxx xxxxxxxx xxxxx.
Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxx a xxxx xx xxxxxx již xxxxxxxxxx xxxxxxxxxx osobních xxxxx x xxxxxx xxxxxx. Xxxxx xxx x navrhované xxxxx x ustanovení §33 xxxx. 2, §77 xxxx. 1 písm. x) x §82 xxxx. 3 xxxx. x), xxxxx xxxxxxx x xxxxxxxx xxxxx x xxx, že xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxx, včetně xxxxx xxxxxxxx, kromě toho, xx xxxxxxxx xxxxxx xx xxxx xxxxxxxx xxxxx x zákoně, xxxx xxxxxxx místo x informačním xxxxxxxxxx Xxxxxx v xxxxxxx xxxxxxxx, tj. xx xxxxxxxx, xxxxx xxxxxx xxxxxx xxxxx, xxxx xxxx xxxxxxx x xxxxxxxxx, xxxxxxx stejný xxxx xxxxx. Xxxxx xxx x xxxxxxxxxx §53x xx §53x, §54 x §55, xxxxxxxx se xxxxxxxxxx xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xxxx xxxxxx xxxxxxxxxxxxx údajů, včetně xxxxx xxxxxxxx, xxxxxxx xxxxxx, jaký xxxxx xx x xxxxxxxxxx §51 a násl. xxxxxxxxx xxxxxx xxxxxx. Xxxxx jde x xxxxx x xxxxxxxxxx §101 xxxx. 1, xxxxx xxxxxxx pouze x tom, že xxxxxxxx inspektora xx xxxx xxxx xxxxxxxxx xxxxxxxxxx x xxxxx, xxxx xxxx xxxxxxxxx xxxxxxx vykonávat xxxxx xxxxxx právních xxxxxxxx xxx podle xxxxxx x léčivech x xxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxx pověření x xxxxxxxxxx xxxxxxxx vydávané xx xxx. Xxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxxx xxxxxxxxxx, x xx xxx ohledu xx ryze xxxxxxxx xxxxxxxxxx, xxxxxxxxx, xxxxx xxxxxxx právního xxxxxxxx xxxxxxxxx kontrolní xxxxxxx x určitém xxxxxxx xxxxx xxxxxxxx, x xx xxxxxx poskytovaných xxxxxxxx xxxxx žádný xxxx nemá.
E. Xxxxxxxxxx xxxxxxxxxx rizik (XXX)
Xxxxxxxxxx xxxxxx úprava xxxxxxxxx xxxxxx korupčních rizik. Xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx je xxxxxxx xxx x xxxxxxxxxxxx xxxxxxx, xxx xx xxxxxxxxx varianty řešení, x to xxx x xxxxxxx klinického xxxxxxxxx léčivých přípravků, xxx x v xxxxxxx xxxxxxxx xxxxxx xxxxxxxx přípravků. Xxxxxxxxxx xxxxx xx xxxx xxxxxxxx xxxxxxxxx xxxxx, x xxxxxxx naplnění xx předkládán. Xxxxx xx x xxxxxxxxxxxx xxxxxxxxx systému xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx léčivých xxxxxxxxx xxx xxxxxxx pacientů x České xxxxxxxxx x přijímání xxxxxxxxxxx xxxxxxxx omezujících xxxxx xxxxxxxx xxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxx sice xxxxxxxxx xxxxxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxxxx xxxxxxxxxxxxx x k xxxx xxx stanoví xxxxxxxxx pravomoci, xxxxx x xxxxxxxx xxxxx xxxxxxx již svěřeným x vykonávaným xxxxxxxxxx xx xxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xx xxxxxxxxxxxxx xxxxxxxxxx korupční xxxxxx.
XXXXXXXX ČÁST
K §1 xxxx. 1 (xxxxxxxx xxxxxxxx xxx xxxxx)
Xx xxxxxxxx pod xxxxx x. 2 xx xxxxxxxx xxxxx xx Xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) č. 536/2014 xx xxx 16. dubna 2014 x klinických hodnoceních xxxxxxxxx léčivých přípravků x o xxxxxxx xxxxxxxx 2001/20/ES x Xxxxxxxx Xxxxxx v xxxxxxxxx pravomoci (EU) č. 1252/2014 xx dne 28. xxxxxx 2014 xxxxxxxxxx směrnici Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/XX, pokud xxx x xxxxxx x xxxxxx správné výrobní xxxxx pro xxxxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxx.
X §5 xxxx. 16:
Xxxxxxxx xxxxxxxx 16 do §5 xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxx xxxx výchozí xxxxxxxx xx odůvodněno xxx, že v xxxxxxxxx xxxxxx xxxxxx xxxxxx vymezení chybí, xxx vytváří xxxxxxxxx xxxx, xxx není xxxxxx, co xx xxxxx výrobou rozumí x xxxxxx xxxxxx xxxxxxx. Navíc xxxx xxxxxxxx xxxxxxxxx nedostatečnou xxxxxxxxxxx xxxxxxxx 2001/83/ES (xx. 46a). X xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx Xxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx xxx 28. xxxxxx 2014 xxxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/83/ES, pokud xxx x xxxxxx x pokyny xxxxxxx xxxxxxx xxxxx xxx xxxxxx xxxxx pro xxxxxxx léčivé xxxxxxxxx. Xxxxxxxx v něm xx xxxxxxxxxxx xxxxx xxxxx xxxxx pouze xxx xxxxxx látky xxx humánní xxxxxx xxxxxxxxx, a tudíž xxxxxxxx xxxxxxx x xxxxxxxxxxx odstavci 16 xxxx být z xxxxxx xxxxxxx komplexní xxxxxx xxxxx x xxxxxxxxx xx i xx xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxxx.
X §11 xxxx. x):
Xxxxxxx xx xxxxxxxxxx x určení xxxxxx xxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxxx klinickým xxxxxxxxxx, xxxxx s xxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 xxxxxxxxx. Systém etických xxxxxx xx xx xxxxxxxxxxxx členských xxxxxxx, xxxxxxxxxx pro xxxxxxxx xxxxxx vyplývající z xxxxxxxx xxxx mimo xxxx xxxxxxxxx xxxxxxxxxxxx xx zadavateli, xxxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxx xxxxxxxxxxxx. Xxxxxxxx xxxxxx xxxxxxxx xxxxxx x České xxxxxxxxx, xxx jejich xxxxxxxxxxx xxxx xxxxxxxxxxxxx zdravotních xxxxxx, kteří xxxx xxx x xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxxxxx jsou xxxxxxxxxx, xxxxx jsou mnohdy x členy xxxxxxxxx xxxxxx xxxxxx, je xxxxx x rozporu x xxxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxx úprava xxxxxxxxx xxxxxxx etickou xxxxxx jako xxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv, x xx x x xxxxxx, že v xxxxxxx s nařízením č. 536/2014 xxxx xxxxxx xx posouzení xxxxxxxxxx xxxxxxxxx, xxxxxxxxxx xxxx x xxxxx úkony xxxxxxx x dohledem xxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxx xxx Xxxxxx xxxxx xxx xxxxxxxx léčiv xx xxxxx xxxxxxx xxxxxx, x x xxxx xxxxxx bude xxxxxxx xxxxxxx xxxxxx xxxxxx x xxxxxx xxxxx. Xxxx xxx zohledněn xxxxxxxx xxxxxxxxx xxxxxxx x čl. 86 nařízení x. 536/2014 a xxxxxxxxx tak, xx xx každou xxxxxxx xxx xxxxxxxx xxx xxxxxxxx xxxxx xxxxx xxxxxxxx za xxxxxxx xxxx.
Xxxxxxx se zavádí xxxxx nová xxxxxxxxxx xxxxxxxx Ministerstva xxxxxxxxxxxxx x xxxxxx opatření xxxxxx xxxxxx xxxxxxxxxxx xxxx xxxxxxxxxxxx distribuci xxxxxxxx přípravku do xxxxxxxxx. Xxxxxxxx může xxx xxxxxx xxxxx x odůvodněných případech. Xxxxxxxx xxxxxx xxxxxxxx xxxxxx povahy x xxxxxxxxx dostupnosti xxxxxxxxx xxxxxxxx přípravků jsou xxxxxxxxx xxxxxxxxx v xxxxx ustanovení §77x.
X §11 xxxx. h:
Stávající xxxxxxxxxx §11 xxxx. x) xx upravuje xxx, xxx xx xxxxxxxxxxx duplicita x xxxx xxxxxxxxxx ustanoveními xxxxxx x) nebo x) x xxxxxx xxx xxxx pokrývat xxx xx xxxxxxx, xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxx podle xxxxxx specifických ustanovení.
K §11 xxxx. x):
Xx xxxxxx xxxxxxxxx xxxxxxxxxxxxxxxx x transparentnosti xxxxxxx xxx omezení xxxxxxxxx xx xx §11 xxxxxx x xxxxxxxx xxxxxxxx xxxxxxx x), xx xxxxxx xx xxxxxxxx xxxxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx léčivých xxxxxxxxx (xxxxxx xxxxxxxx xxxxxx xxxxxx), xxx xxxxxxx nedostatku xx xxxx v České xxxxxxxxx xx mohlo xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx služeb x Xxxxx xxxxxxxxx.
X §13 xxxx. 2 xxxx. x) xxx 1:
Xxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv xx rozšiřuje x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X §13 xxxx. 2 xxxx. x) bod 3:
Xxxxxxxx xx, xxx xxxxxxxxxxx, xxxxxxx xx xxxxxxxxx splnění xxxxxxxx xxxxxxxxx xxxxx, pro xxxxxx klinického hodnocení xxxxxxx správné klinické xxxxx, xxxxx být xxxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxx xxxxxx, x xx například xxxxxxxxxxx. Pro xxxxxxxxxx xxxxxxxx nařízení je xxxxxxxx zajištění a xxxxxxx znalostí xxxxxxxxxxxx x oblasti xxxxxxxxxxx x xxxxxxx klinické xxxxx, kterou xxxx x průběhu xxxxxxxxxx xxxxxxxxx xxxxxxx dodržovat. Xxxxxxxx klinickou xxxxx xx rozumí xxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xx xxxxxxx xxx navrhování, xxxxxxxxx, xxxxxxxxxx, sledování, xxxxxx, zaznamenávání x xxxxxxx xxxxxxxxxx xxxxxxxxx x xxx předkládání xxxxx x xxxx, xxx se zajistilo, xx xxxx chráněna xxxxx, xxxxxxxxxx x xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx x že xxxxx xxxxxxx x xxxxxxxxx hodnocení xxxx xxxxxxxxxx a xxxxxxxx. Xxxxxxxx správné xxxxxxxx xxxxx jsou xxxxxxxxxxx xxxxxxxxxx xxxxxxxx (xxxxxxxx xx xxxxxxxx ICH X6 Xxxxxxxxxxx xxxxxxxxxx xxx harmonizaci xxxxxxxxxxx xxxxxxxxx xx registraci xxxxxxxxx léčiv - xxxxxxxxx International Conference xx XxxxxxxxxxxxxxxXxxxxxxxxXxxxxxxxxxxxxxxXxxxxxxxxxxxxxXxxxxxxxxxxxxxxxxxXxxxx Xxx-xxx. XXX, kde xxxx xxxxxxxx regulačních xxxxxxx x xxxxxxxxxxxxxxx xxxxxxxx Xxxxxx, Xxxxxxxx a XXX). Tento xxxxxxxx xxxxxxx Mezinárodní xxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxx 1.5.1996, xxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxx, x xxxxx xxxxxxx xxxx xxxx xxxxxxxxxx x xxxxxxxxx v xxxxxxxxxx xxxxxxx předpise.
K §13 xxxx. 2 xxxx. x):
Xxxxxxxx xx xxxxxxxxx kompetence Xxxxxxxx xxxxxx xxx kontrolu xxxxx s xxxxxxx xx xxxxx dané xxxxxxxxx. Stávající systém xxxxxxxxx xxx xxxxxxxxxx, xxx xxxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx. Xxx nařízení xx xxxx xxxxxx xxx xxx x xxxxxx xxxxxxxxxx.
X §13 xxxx. 2 xxxx. x):
Xx základě xxxx výslovné xxxxxxxxxx Xxxxxx bude možné xxxxxx xx xxxxxxx x jakosti, jejíž xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx nebo zdraví, xxxxxxxx xx xxxx. Xxxxxxxx opatření Ústavu xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx dostupnosti daného xxxxxx xx xxxx x Xxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx nebudou xxxxxxxx xxxxxxxxxx procesem xxxxxxxxx léčiva, xxxxx xxx xx xxxxxxxxxxx xxxxxxxxxxxxxxx zátěž, xxxxxxxxxx xxxxxxx a xxxxxxx xx xxxxxxxxxxx, xxxxx xxxxxx x xxxxx xxxxx xxxxxx v xxxxxxx xxxx xxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx. Xxxxxxxxxxx Xxxxxx xxx tohoto xxxxxxxxxx xx xxxxxxxxxxxx navázáno xx xxxxxxxxxx §23 xxxx. 2, xxx xxxxxxxxxxxx xxxxx xxxxxxxx x xxxxxx se xxxxxxx v xxxxxxx, xxxxx nerozhodne Xxxxx xxx §13 xxxx. 2 xxxx. n) xxxxx.
X §13 xxxx. 3 písm. q) x x):
Xxxxxxxx xx xxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxxx xx xxxx x xxxxxxxx přípravky xxxxxxxxxxx xxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx §77x.
X §16 odst. 2 xxxx. a) xxx 1:
Působnost Ústavu xxx státní xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx x xxxxx xx xxxxxxxxx x xxxxxxxx xxxxxxxxxx x xxxxxxxxxx léčivého xxxxxxxxx.
X §19x:
X nově xxxxxxxxx §19x xx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx x Xxxxxxxxxx ředitelstvím xxx x xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx tak, aby xxxx být xxxxxxx xxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx 2011/62/EU. Xxxxxx xxxxxxxxxx xx xxxxxxxx xxx xx xxxxxxx xxxxxx, tak i xx xxxxxxx distribuce xx xxxxxxxxx, x xx xxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx xx xxxxxxx zemí xxxx. xx účelem xxxxxxxxx xxxxxxxxx. Jednalo xx xx xxxx o xxxxxxxxxx xxxxxxxxx xx xxx, a xxxxxxx x xxxxxx xxxxxxxxxxxx. Xxx xxxxxxx xxxxxx xxxxxxxxxx xxx maximálně xxxxxx xxx platný xxxxxx xxx, a xxxxx xxxxxxxxxx x Xxxxxxxxxx ředitelstvím xxx xxxx koncepčně xxxxxxxxx xxxxxxxx způsobem, jako xx xxxx v xxxxxx č. 226/2013 Sb., x xxxxxxx xxxxx x xxxxxxxxxxx xxxxxxx xx xxx. Xxxxxxx se xxxxxxxx xxxxxxx xxxxxxx x povinnosti mlčenlivosti xxxxxxxxx x daňovém xxxx tak, xxx Xxxxxx xxxxx xxx xxxxxxxx léčiv xxxx xx Generálního xxxxxxxxxxx xxx získat potřebné xxxxxxxxx.
X §21(Xxxxxxxx XXXX, xx. 49 xxxxxxxx):
X §21 xx vypouští xxxxxxxx 1 x xxxx důvodu, že xxxxxxxxxxxx, xxx se xxxx xxxx xxxxxxxxxxx, xx xxxxxxxxx xxxx x §54 xxxx. 1 x to x návaznosti na xxxxxxxxx stanovené xxxxxxxxx.
X §33 xxxx. 2:
Za xxxxxx xxxxxxxxx vyhodnocování xxxxxxxxxx xxx ohledně xxxxxxxxxxx xxxxxxxx xxxxxxxxx na xxxx x XX xx xxxxx zajistit, xxx Xxxxxx xxxxx xxx kontrolu xxxxx xxxx pracovat x xxxxxxxxxx x xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxx xxxxxx xx trhu v Xxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxxx dostupnosti xxxxxxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxxx spolehlivých podkladů xxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx přípravků Xxxxxxxxxxxxx xxxxxxxxxxxxx podle §11 xxxx. x) x xxxxx xxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx §11 xxxx. x). Ohlašovací xxxxxxxxxx xxxx Xxxxxxxx xxxxxx xxx kontrolu xxxxx xxx xxxx xxxxxxx x léčivech xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx (distributoři xxxxxxxx xxxxxxxxx x provozovatelé xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx). Xxxxxx xxx nejsou xxxxxxx xxxxx dostatečné x xxxx, aby xxxx xxxxx xxxxxx x xxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx konkrétních xxxxxxxx přípravků x Xxxxx xxxxxxxxx. Doplnění xxxxxxxxxx xxxxxxxx xxxxxxxxxx x registraci xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv xxxxx x xxxxxxx údaje x objemu xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxx xxxxxxx xxxxxxx xxxxx o objemu x xxxxx zásobování xxxxxxxxxx xxxxxxx xxxxxxxxxx. Xxxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxxxxxx stavu xxxx možné xxxxxxxx xxxxx xxxxxx možného xxxxxx xxxxxxxxxxxxx léčivého xxxxxxxxx x xxxx xxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxx nedostupnosti xxxxxx léčivých xxxxxxxxx xxx pacienty v Xxxxx xxxxxxxxx. X xxxxxxxx zachování xxxxxx xxxxxxx a xxxxxxxxx xxxxxxxxxxxxxx nápravy xxx xxxxxxxx xxxx zákonné xxxxxxxxxx je vhodnější, xxx xxx xxxxxx xxxxx, xxxxxx interval x xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx. Navrženou xxxxxx xxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xxx XXXXXX xxxxxxxx se xxxxxxx léčivých xxxxxxxxx x xxxx údaje xxxxxxxx xx předepisování xxxxxxxx xxxxxxxxx xxx xxx xxxxxxxxx správní xxxxxx, tj. xxx xxx XXXXXX, tak x xxx XXXX. Xxxx je nutné xxxxxxxx možnost oběma xxxxxxx xxxxxxx si xxxx x nad xxxxx xxxx xxxxxxxxxx xxxxxxxxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx x ohledem xx veliké xxxxxx x hlášení získaných xxx, xxxxxxxx xx xxxxxx efektivní xxxxxxxxxx x xxx xxxx xxxxxxx efektivně x xxxx xxxxxxxx na xxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxx. Xxxxx xx xxxx xx Xxxxx xxxxxxxxxx v xxxx, xxxx. v xxxxxxx xxxxxxxx, xxxxx xx xx Xxxxx napřed xxxxxxxxx do xxxxxxxx xxxxxx, xxx xx xxx xxxx xxxxx xxxxxxxxx, vyhodnotit x xxxxxx závěr. S xxxxxxx xx xxxxxxx xxxx, kterou xx Xxxxx na zpracování xxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx a xxxxxxxx předání xxxxxxx x xxxxxx xxxxxxxx xxxxxx xxxxxx xx XX, xx xxxx xxxxx, než xxxxxxxxxxxx xxxxxx použitelná. Rovněž xx nutné vzít x xxxxx, xx xxxxxxx jsou xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxx x xxxxxxxxx, xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, SW x xxxxxxxxxxxxx formu dat, xxxxx xxx xxxx xxxxxx při xxxxxx xxxxxx poskytuje xxxxxxx xxxxxxxxxx a uchovávání xxxxxxx a xxxxxxxxxxx xxx xxxxxx a xxxxx xxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx o xxxxxxxx.
X §33 odst. 3 xxxx. x):
Xxxxx xx xxxxx x xxxxxxxxxxxx xxxxxxxxx upřesnění xxxxxx xxxxxx beze xxxxx jejího obsahu, xxx xx xxx xxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxxx x registraci povinen xxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx xxxx xx xxxxxxx. Souhrnně xxxx „xxxxxxxxxx xxxx xxxxxxx“ xxxxxxxxx xxxxxx „xx xxx x Xxxxx xxxxxxxxx“.
X §34 xxxx. 2:
Xxxxx x xxxxxxxx x současném xxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx léčivého xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx. X xxxxxxx xx xxxxxxxxxx, xx x xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx v xxxxxx xxxxxxxxxxxxxxxx xxxxxxx, xx xxxxxxxxx nemožné xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx a xxxxx xxx xxxxxxx k xxxxxxxx v xxxxxxxxx xx český xxx x xxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx české xxxxxxxx. Xxxx úprava xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx v xxxxxxx xxxx xxxxxxxxxx x xxxxxxxxxx §35 xxxx. 2 a xxxxxxx xxxxxxxxxx x §36 xxxx. 4.
Xxx x xxxxxxxx xxxxxxxxxxx xxxxxx, ke xxxxx xx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxx.
K §51 xx 59:
Xxxxx x ustanoveních §51 xx 59 jsou xxxxxxx xxx xxxxxxxxx xxxxxxxx nařízení č. 536/2014 xx zákona x xxxxxxxx, neboť představují xxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx, která xxxxxxxx na základní xxxxxx xxxxxxxxxx x xxxxxxxx č. 536/2014. X xxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx, která byla x xxxxxx o xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxx xx xxxxxx xx xxxxxxxx 2001/20/ES x xxxxx jsou uvedena xxxxx x xxxxxxxx č. 536/2014 nebo xxxxx xx nařízením č. 536/2014 xxxxxxx, x xxxx xx x těchto xxxxxxxxxxxx xxxxxxxx xx xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxxxx členskému xxxxx, xxx xx xxxxxxx, anebo xxxxxxxx xxxxxxx stát k xxxxxx xxxxxx.
X §51:
X xxxxx ustanovení xx x xxxxxxxxxx xxxxxxxxx xx čl. 4 xx 9, čl. 15 až 24 a čl. 83 xxxx. 1 xxxxxxxx x. 536/2014 soustředěna xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx.
X xxxxxxxx 1 (Preambule (18), (19); Xxxxxxxx II, čl. 7 xx 9; Xxxxxxxx XXX čl. 15 xx 24 xxxxxxxx) xx vymezuje základní xxxxxxxxx Státního ústavu xxx xxxxxxxx xxxxx x xxxxxxx klinického xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx. Xx to xxxxxxxxxx xxxxxxx x xxxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků x xxxxxxx x xxxxxxxx xxxxxxxx změny xxxxxxxxxx xxxxxxxxx a xxxxxxxxx dohledu nad xxxxxxxx xxxxxxxxxx xxxxxxxxx (Xxxxxxxx XXXX, čl. 77, čl. 78). Xxxxxxx xxxxx xxxxxxxxx x souvislosti x vyřízením žádostí x povolení klinického xxxxxxxxx (Xxxxxxxx II xxxxxxxx č. 536/2014), xxxxxxx x povolení významné xxxxx klinického xxxxxxxxx (Xxxxxxxx XXX xxxxxxxx č. 536/2014) x zajištění xxxxxxx (Xxxxxxxx XXXX xxxxxxxx č. 536/2014) xx xxxxxxxx xx odborné xxxxx, xx které Xxxxxx xxxxx xxx xxxxxxxx léčiv xxxxxx xxxxxxx xxxxxxx. (Xxxxxxxx XXX, čl. 86 x 87)
X xxxxxxxx 2 (Xxxxxxxxx (69); Kapitola XX, čl. 83 = Xxxxxxx kontaktní xxxxx) xx pak xxxxxxx xxxxxxx xx čl. 83 xxxx. 1 xxxxxxxx x. 536/2014, xxxxx x usnadnění xxxxxxx xxxxxxxxxxx x tomto xxxxxxxx xxxxxx členskému xxxxx xxxxx xxxxx xxxxxxx xxxxxxxxx místo.
V xxxxxxxx 3 (Xxxxxxxx XX, čl. 5 xx 8 nařízení) xx xxxxxxxx, xxx xxxxxxxx xxxxxxxxx xxxxxxxx členskému xxxxx xx Českou xxxxxxxxx. X důvodu xxxxxxxxxxxx se x xxxxxxxxxxxx xxxxxxxxx xxxxxxxx 3 xxxxxxxx xxxxxxxxx x případě, xxxx xx Česká xxxxxxxxx xxxxxxxx státem zpravodajem, xxxxxxxxx x xxxxxxx, xxxx je Xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx x xxxxxxxxx xxx posouzení části XX xxxxxxxxx xxxxxx, xxxxxxxxxx xx xxxxx x xxxxxxxxx xxxxx. X odstavci 4 xx xxxxxxxx obecná xxxxxxxxx xxx vydávání xxxxxxxxxx xx členský xxxx.
X §52 (Xxxxxxxx X, xx. 34 xxxxxxxx):
X xxxxx xxxxxxxxxx x odstavci 1 (Xxxxxxxx V, čl. 29 xxxx. 7 x 8 xxxxxxxx) se xxxxxxx xx xxxxxxxxxx čl. 29 xxxx. 7 xxxxxxxx x. 536/2014, xxxxx xxxxxxxx xxxxxxxxx xxxxx, xxx ve xxxx xxxxxxx xxxx xxxxxxxxx, xxx kromě xxxxxxxxxxxxx xxxxxxxx uděleného xxxxxxx ustanoveným xxxxxxxxx xxxxxx k xxxxxx x klinickém hodnocení xxxxxxx x xxxxxxxxx, xxxxx xx xxxxxxx xxxxxxx si názor x posoudit získané xxxxxxx xxxxxxxxx. V xxxxxxxx xx xxxxxxx, xx xxxx xxxxxxxxx xxx xxxxxxxxx kromě xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxx nezletilé xxxxx, vyjadřující, xx xxxxxxx získaných xxxxxxxxx xx xxxxxxxxxxxx a xxxxxxxxx v informacích xxx xxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx klinického xxxxxxxxx. X xxxxxxxxxx 2 x 3 je xxxxxxxxxx možnost xxxx čl. 34 xxxxxxxx x. 536/2014, xxxxx umožňuje xxxxxxxx státům xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxx osobám, xxxxx xxxx x xxxxxxx podřízenosti nebo xxxxxxxx xxxxxxxxxx. X xxxxxxxxxx xx xxxx xxxxxxxxxx se xxxxxxx, xx klinické xxxxxxxxx xxx xxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxx tehdy, xxxxx existují vědecky xxxxxxxxx důvody, xx xxxxxxx xxxxxxx lze xxxxxxxx, xx účast x klinickém xxxxxxxxx xxxx mít xxx xxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xx xxxxxxxxxxx xxxxxx, který xxxxxxx nad souvisejícími xxxxxx a xxxxxx. Xxx xx xxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxx xx xxxxx xxxxxxxxxx xxxxxxxxxx hodnocení (xxxx. xxxxxxxxxx hodnocení xxxxxxxxxxxxxxxxx nebo xxxxxxxxxxxxxxx), xxxxx pro zúčastněné xxxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxx. Xx xxxxxxx skupiny xxxxxxxx xxxxxxxxx se xxxxxx xxxxxxxx xxxxx nacházející xx ve xxxxx, xxxxxxxxxxxxx xxxxxxx xxxx xx xxxxxx trestu xxxxxx xxxxxxx, xxxx xxxxx xxxxxxxxxx x xxxxxxxx xxxxxxx xxxx (xxxx. v pobytových xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxx, xxxxxxxx xxxxxxxxxxx xxxxxxx péči nahrazující xxxx xxxxxx, aj.) x rovněž xxxxx, xxxxxxx xxxxxxxxxxx xxxx xxxxxxx xxxxxx (xxxx. xxxxx, xxxxx nesmí xxxxxxxx xx svým xxxxxxxx). Xxxxxxxx x xxxx, že Česká xxxxxxxxx xxxxxxxxxx důvod x xxxxxxxxxxxx těchto xxxx xxxxxx xxxxxxxxxx x účasti xx xxxxxxxxx xxxxxxxxx, ale xxxxxxxx chápe xxxxxx xxxxxxxxx, stanovuje xxxxxxxxxx xxxxxxxx pro xxxxxx xxxxx x xxxxxxxxx xxxxxxxxx. Uvedení xxxxxxxxxx xxxxxxxxxxxxx souhlasu xxx xxxxxxxx x xx xxxxxxx xxxxxxxxxx v xxxxxx x xxxxxxxxxxx xxxxxxxx.
X §53 (Preambule (18); Xxxxxxxx X, xx. 2 (11):
Xxxxxx xxxxxxxx x xxxxxxxx xxxxxx komise xxxxxxxx č. 536/2014 xxxxxxxxx x xxxxxxxxxx členských xxxxx. Xxxxx tato ustanovení xxxxxxx x xxxx, xxx xx, co xx v současné xxxxxx xxxxxx xxxxxxxxx, xxxx v xxxx xxxxxx úpravě xxx xxxxx xxxxxxxxxxx xxxxxxx.
X xxxxxxxx 1 xx xxxxxxxxx působnost Xxxxxxxx xxxxxx xxx kontrolu xxxxx ustavit xxxxxxx xxxxxx xxxx xxxx xxxxx. Důvody xxxxxxxxxx xxxxxx xxxxxx xxxxxxx x xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx nařízením č. 536/2014: 1) Xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxxx xxxx klinického hodnocení x xxxxx xxxxx xxxxxxx x dohledem xxx xxxxxxxxx hodnocením xxxx pouze jedna xxxxxx pro Státní xxxxx xxx xxxxxxxx xxxxx xx formě xxxxxxx xxxxxx, x xxxx xxxxxx xxxxxx xxxxxx, xxx x xxxx xxxxxx xxxx xxxxxxx mimo xxxx xxxxxxx xxxxxx komise x jejich xxxxx x bylo xxxxxxxxx xxxxxxxxxxx xxxxxxxxx zázemí xxxxxx xxxxxx. 2) Xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx x čl. 9 xxxxxxxx x. 536/2014, xxxxx xxxxxxxx, xxx xxxxx xxxxxxxxxx xxxxxx nebyly xxxxxxx na xxxxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxxxx a xxxxxxx financujících xxxxxxxx xxxxxxxxx a neměly xxxxx xxxxxxxx či xxxxxx zájmy, které xx mohly xxxxxxxx xxxxxx xxxxxxxxxxx.
X xxxxxxxx 2 (Xxxxxxxx XX, čl. 4, 6 x 7, čl. 8 xxxx. 4 a Xxxxxxxx XXX xxxxxxxx) xx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxx. Podle článku 4 xxxxxxxx x. 536/2014 xxxxxx xxxxxxx xxxxxxx xxxxxx komise x xxxxxxx x právními xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, x xxxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxxx 2 xx především xxxxxxxx xxxxx xxxxxx xxxxxx xxxxxxxx.
X xxxxxxxx 3 xx xxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxxxxxxxx zajistit xxxxxxxx xxx xxxxxxx xxxxxx xxxxxx (xxxx xxx xxxx).
X xxxxxxxx 4 je xxxxxxxxx, xx etická komise xxxx ustanovena xx xxxxxxx Xxxxxxx vydaném Xxxxxxx xxxxxxx xxx xxxxxxxx léčiv xx xxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx. Jednací xxx, xxxxxxxxxx činnost xxxxxx xxxxxx, přijme sama xxxxxx xxxxxx bez xxxxxxxxxxx xxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx.
X §53x
X xxxxxxxx 1 xx stanoví xxxxxxx xxxxxx xxxxxx x xxxxxxxxxxxx samostatně xxxxxxxxxxx xxxxxx xxxxxx xxxxxx. Xxxx xx xxxxxxx xxxxxxxxx na xxxxxxx jednotlivých skupin, xxxxx xxxxxxx z xxxxxxxxx xxxxxxx xxxxxxxx xxxxx (XXX X6) x x Xxxxxxxxx xxxxxxxxx, xxx xxx xxxxxxxxx xxxx xxxxxxx xxx xxxxxxxxx lékařského xxxxxxx, a xxxx x klinických xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků xx xxxxxx xxxxxxxx xxxxxxxx. Xxxxxxx xx x xxxxxxxx 1 xxxx xxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxx x xxxx xxxxxxx xxxxxxxxx úpravou Xxxxxxx xxxxxx xxxxxx. Xxxxxxxxx xxxxx xxxx xxxxxxxxxxx je nezbytné xxx xxxxxxxx xxxxxxxx č. 536/2014, xxxxx xxxxxx x xxxxxxxxxx xxxxxxx x xxxxx 3 xxx. X prvním xxxx xxxxxxxxxxx xxxxxx xxxx zadavatel xxxxx, xxx xxxxxxxx xxxxxx x xxxxxxxx klinického xxxxxxxxx xxx xxxxxxxx č. 536/2014 nebo xxx xxxxxxxx platné xxxxxxxxxxx. X následujících dvou xxxxxx bude předkládání xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxx xxx v xxxxxxx x xxxxxxxxx xxxxxxxx č. 536/2014, xxx xxxxxx xxxxxxxx xxxxxxxxx schválená xx xxxxxxxx před xxxxxxx účinnosti nařízení č. 536/2014 budou xxxxx xxxxxxxxx stále xxx xxxxxxxx xxxxxx právní xxxxxx, např. xxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxx a xxxxxxxx xxxxxxxx, xxxxx xxxx klinické xxxxxxxxx xxxxxxxxx. Proto bude xxxxx zachování současného xxxxxxx xxxxxxxx xxxxxx, xxx xxxxxxx xxx xxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxx x této xxxxxx xxxxxx. X xxxxxxx 3 letech xxxxxxxxxxx xxxxxx bude xxxxxxx xxxxx xxxxx xxxxxx xxxxxx xxxxxx xxx Xxxxxxx xxxxxx xxx xxxxxxxx xxxxx xxx aktuální xxxxxxx, xxxx se xxxxxx, xx počet xxxxxx xxxxxx xxxxxx na xxxxxxx (nejprve xxx 3 xxxxxxx) x xx konci xxxxxxxxxxx xxxxxx (za 3 xxxx xx nabytí xxxxxxxxx nařízení č. 536/2014) xxxxxx xxx xxxxxx. Xxxxxxxxx xxxxxxx xxxxxx xxxxx vývoje v xxxx oblasti xxxxxxxxxxx xxxxxx x xxxxx xxxxxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx x České xxxxxxxxx (xxxx-xx xxxxxx xxxxx xxxxxxxxxx hodnocení xx xxxxx xxxx naopak xxxxx xxx x xxxxxxxx xxxx). Xxxxxx xxxxxx xxxxxx bude xxxxxxxxx x xxxxx xxxxx etické xxxxxx, xxxxx bude na xxxxxxx stanoven xxx xx 12-15 xxxxx x xxxxx skupině, xxx xxxxx xxxx xxxxxx, xx xx xxxx xxxxxx počet xxxxxxx xx opačně.
V xxxxxxxx 2xx xxxxxxx, xx xxxxx xxxxxx xxxxxx xxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxxxx. Xxxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxx nezávislost xxxxxxxxxxx xxxxxx xxxxxx xx Státním xxxxxx xxx xxxxxxxx léčiv, xxxxx bude prostřednictvím xxxxx xxxxxxxxx zaměstnanců xxxxxxxxxx xxxxx xxxx xxxxxxxxx-xxxxxxxxxxx zázemí a xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxx. Zaměstnanci Xxxxxxxx ústavu pro xxxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxx xxxxx xxxxxx xxxxxx, nebudou xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx x nebudou xx podílet xx xxxxxxxxxxx etické xxxxxx. Xxxxxx úkolem xxxx xxxxxxxxx xxxxxxx, xxxxxx xxxxxx x jednání, xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx Xxxxxx, x hlavně xxxxxxx xxxxxxxxxx xxxxxxxxxxx lhůt. Xxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxx komise xxxxxxx xx xxxxxxxx praxe xxxxxxxxx xxxxxx Evropské xxxxxx agentury (EMA), xxxxxxx jsou xxxx. Xxxxx xxx moderní xxxxxxx (XXX), Xxxxx xxx xxxxxxx léčivé xxxxxxxxx (XXXX) xx., xxx xxxxxxx xxxxx xx xxxxxxxxxxx, xxxxxxxxx x xxxxxxxxxx xxxxxxx xx Xxxxxxxx lékové xxxxxxxx, ale vlastní xxxxxxx x rozhodování xx xxxxxxxxx.
Xxxx xx x xxxxx odstavci xxxxxxxx xxxxxxxx požadavek xx složení skupiny xxxxxx xxxxxx x xxxxxx xxxxxx xxxxxxxx x místopředsedy, xxxxxxx xxxxxx nezávislé samosprávy xxxxxxxxxxxx xxxxxx xxxxxx xxxxxx.
X odstavci 3 xx xxxxxxx xxxxxxxxx xx xxxxx xxxxxx xxxxxx v xxxxxxx x xxxxxxxxx čl. 9 xxxxxxxx x. 536/2014, xxx xxxx zajištěna xxxxxx nezávislost na xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxx je xxxxxxxx xxxxxxxxx xx zkušenosti x xxxxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxxxx 4 vychází x xxxxxxxxx xxxxxx xxxxxx, která xxxxxxxxx xxxxxxxx xxxxxxxxxxx změn, xxxxx odstranění xxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx člena xxxxxx xxxxxx x xxxx xxxxxxxxx x xxxxxx xxxxxx, x xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx správné klinické xxxxx, xxxxxxx xxxxxxxxxx xxxxxxxx č. 536/2014 xxxxxxxx.
Xxxxxxxx 5 pak ukládá xxxxxx xxxxxx xxxxxx xxxxxxxxxx mlčenlivost x xxxxxxxxxxx a xxxxxxxxxxxxx, xxxxx se xxxxx x souvislosti xx xxxx xxxxxxxxx x xxxxxx xxxxxx.
Xxxxxxxx 6 xxx xxxxxxxxx tomu, xxx xxxxxx etické xxxxxx byla taková xxxxx, xxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx x xxx, že xxxxxx povinnost zachovávat xxxxxxxxxxx, stanovenou v xxxxxxxx 5. Pokud xx člen xxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx, xxxx členství x etické xxxxxx xxxxxxx přímo ze xxxxxx.
X §53x x §53x
Xxxx xxxxxxxxxx xxxxxxx xxxxxxxxx na xxxxxxx xxxxxx xxxxxx, které xxxxxxxxx x nařízení č. 536/2014 a xxxxxxx xxxxxxxx praxe ICH X6. Xxx xxxxxxxxxx xxxxxxx xx xxxxxxxxxxx, xx ke xxxxx xxxxxxx x xxxxxxxx xxxxxxxxx xxxx přiložena xxxxxxxxxxx, která xxxx xxx xxx xxxxxxxxxx xxxxx –dokumentace, xxxxxxxx xx xxxxxxx, xx xxx xx vztahuje xxxx X xxxxxxxxx xxxxxx, která je xxxxxxxx pro xxxxxxx xxxxxxx ČS (Protokol, Xxxxxxxxxxxx´xXxxxxxxx, xxxxxxxxxxxxx dokumentace xx.), a dokumentace, xxxxxxxx xx xxxxxxx, xx xxx xx xxxxxxxx xxxx XX xxxxxxxxx xxxxxx, která xx xxxxxxxxx x xxxxxxxx xx vždy xx konkrétnímu XX (Xxxxxxxxx xxx xxxxxxxx, xxxxxxxxxxx xxxxxxx, seznam xxxxxxxxxxxx, místa klinického xxxxxxxxx, zajištění pojištění xx.). Dokumentaci, xxxxxxxx xx xxxxxxx, na xxx se xxxxxxxx xxxx X xxxx xxxx XX xxxxxxxxx xxxxxx xxxx xxxxx xxxxxxxxx xxxxxxxxxx x xx i x xxxxxxx xxxxxx, xxx. 2 let. Xxx xxxxxx xxxx xxxx xxxxxxxxx vypracovat xxxxxxxxx xxxxxx (xxxxxxxxxxx xxxxx xxxxxxxxx xxx rozhodnutí Xxxxxxxx xxxxxx a Xxxxxxxx xxxxxx xxxxxxxx (XXX), nyní xx xx nich xxxxxxx x xxxxx xxxxxxxxxxxx xxx EMA). X xxxxx xxxxxxxxx xxxxxx xxxx xxxxxx xxxxx xxxxxxxxx jeho xxxxxxx, xxxxx bude xxxxxxxxx xxxxxxxxxx, x xx xxxxxxxxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxx xxxxxx xx xx xxxxxx xxxx xxxxxx xxxxxxxx xx xxxxxxx, na xxx se vztahuje xxxx X a xxxx II hodnotící xxxxxx. Vše xxxx xxxxxx xxxxxx xxxxxxxxxxxxx, xxx. xxxxxxxxx xxxxxx x xxxxxxxxxx i xxxxxxxxxx, xx jejich xxxxxx xx xxxx x rámci xxxxxxxxxxxx xxx Xxxxxxxx xxxxxx xxxxxxxx xxxxxxx.
Xxxxxxxxxx §53x x xxxxxxxx 1 xxxxxxx xxxxxxxxxx xxxxxx xxxxxx x xxxxxxxxx xxxxxxx xxxxxxxx xxxxx XXX X 6 x Xxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxx xxxx, xxxxxxxxxxx x xxxxxx lidských xxxxxxxx xxxxxxxxxx xx výzkumu x humánními xxxxxxxx xxxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxx stanovisko xxxxxx komise, xxx xx xxxxxxx x Xxxxxxxx XX, článku 8 xxxx. 4 xxxxxxxx x. 536/2014.
Ustanovení §53x x xxxxxxxx 2 xxxxxxx z xxxxxxxxx Xxxxxxxx XXXX xxxxxxxx č. 536/2014, xxxxxxx klinické xxxxx XXX X 6 x Xxxxxxxxx xxxxxxxxx, které xxxxxxxx xxxxxx xxxxxx xxxxxx xxx xxxxx klinického xxxxxxxxx, ke kterým xxxx xxxxxxx. Xxxxxx xx xxxxxxxx xx xxxxxxx písemných xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxx v xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx nebo xxxxxxx xxxxxxxxxxx, xx-xx xxxxx (XXX X 6, xxxx 4.10.1: „Theinvestigatorshouldsubmitwrittensummariesofthe xxxxx xxxxxx xx xxx IBR/IEC xxxxxxxx, xx more xxxxxxxxxxxxxxxxxxxxx xx xxx IBR/IEC.“, xxx IRB/IEC xx xxxxxx InstitutionalReviewBoard/Independent XxxxxxXxxxxxxxx). Xxxxx xxxx x xxxxxxxxxx dohled se Xxxxxxx ústavem xxx xxxxxxxx xxxxx, xxxxx Xxxxx xxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxx, xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxx xx zpráv x xxxxxxxxxxx přípravku, xxxxxxx xxxxxxxxxx xxxx klinického xxxxxxxxx x x xxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx přínosu x xxxxxx xxxxxxxxx s xxxxxx xxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxx xxxxxxxxx, případně z xxxx úřední xxxxxxxx Xxxxxx (xxxxxxxxxx x xxxxx xxxxxxx XxxxxxxxXxxxxxXxxxxxxxxxxx Xxxxx (XXXX), XxxxxxxxxxxxXxxxxxxxXxxxxxxxx (XXX), Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx use (XXXX) a xxxxxx).
Xxxxxxxxxx §53x v odstavci 3 xxxxxxx x xxxxxxxxx Xxxxxxxx II článek 10, a také článku 5 xxxx. 7 xxxxxxxx x. 536/2014 x ze xxxxxxx xxxxxxxx xxxxx XXX X6, xxxxxx 3.2.6 (Xx XXX/XXX xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xx xxxxxxxxxxxxxxxxxxxxxxxxx.)
Xxxxxxxxxx §53x x xxxxxxxx 4 xxxxxxxxx xxxxxx komisi xxxxxxxxx xxxxxxxxx xxxx xxxxxxx x xxxxxxx x xxxxxxxxx nařízení č. 536/2014 a Xxxxxxxx xxxxx. (xxxx viz xxxx).
Xxxxxxxxxx §53b x xxxxxxxx 5 uvádí, xx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxx budou xxxxxxxxx xxxxx pracovních xxxxxxx (XXX X6, xx. 3.2.2 The XXX/XXX xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xx xxxxxxxxxxxxxxxxxxxxxxxxxx), xxx xx xxxx zajistit jednotný x xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx skupin xxxxxxxx xxxxxx. Xxxxxxxx postup xxxxxxx mimo xxxx, xxx xxxxx xxxxxxx xxxxxx komise xxxxxxxx x hlášením zadavatelů, xxxxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxx - Xxxxxxxx XXX, Xxxxxxxx XXXX čl. 53 nařízení, xxx xx uvedeno, xx xx zadavatel xxxx xxxxxxxxx „dotčeným xxxxxxxx státům“, xxx. xxxxxxx zabývajícími xx xxxxxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx (Xxxxx x xxxxxx komise), xxxxx xx xxxxxxx xxx x xxxxxx xxxxxxxxxxxxx; xxxx xxx xxxxx xxxxxxxxxxx Xxxxxxxxxxxx´xXxxxxxxx, x v neposlední xxxx xxx Kapitoly XXXX, čl. 52 z xxxxxxx xxxxxxxx xx xxxxxxxxx; xxxxx xxxxxxx xxxx xxxxxxxx etická xxxxxx xx xxxxxxxxxxxx, xxxxx x xxxxxx x průběhu xxxxxxxxxx xxxxxxxxx a xxxx xxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx (Kapitola XXX, čl. 53 nařízení). Xxxx pracovní xxxxxx xxxx x xxxxxxxxx xxxxxxxxxx xxxx etickou xxxxxx x Ústavem x xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx. Xxxxxxxx xxxxxxx budou xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxx vyplývající x xxxxxxxxx nařízení č. 536/2014, x zajištění harmonizace xxxxxxxx.
Xxxxxxxxxx §53x x xxxxxxxx 1 x 2 xxxxxxx x xxxxxxxxx nařízení x. 536/2014 xxxxxxxx II xxxxxx 4 o xxxxxxxxx etického xxxxxxxx. Xxxx odstavce xxxxxxxxxxx xxxxxxxx etické xxxxxx xx xxxxxxxxx dokumentace, xxxxxxxx xx xxxxxxx, xx xxx se xxxxxxxx část X xxxxxxxxx xxxxxx, xxx xxx xxxxxxxx xxxxxxx x klinické hodnocení, xxx xxx povolení xxxxxxx x xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx. Xxxxxx posouzení xxxxxxx xx xxxxxxxx xxxxx; xxxxxx xxxxxx xxxx xxxxxxxxx (Xxxxxxxx XX, čl. 6 xxxx. x) xxx x + Příloha č. I, xxxx. D) xxxxxxxxxxxxxx provedení klinického xxxxxxxxx, xxxx se xxxxxx xxxxxxxxxx, xxxx xxxxxxxxx chce xxxx xxxxxxxx xxxxxxxxx provádět (xxxx. xxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxx xxxxxxx xxxxxx, xxxx. xxxxxxx xxx xxxxx prokázané, xxxx jsou xxxxxxxxxx, xxx. xxxxxxxxx xxxxx xx xxx překonaná x není xxxxx xx k xx xxxxxx) x xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, jímž xx xxxxxx navržený xxxxxx (xxxx-xx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx či xxxxxxxxxxxxx, s xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxx, xxxxx-xx xx x xxxx I xx XX klinického xxxxxxxxx xxx stavu xxxxxx xxxxxxxx xxxxxxxxx, xxxx-xx xxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxxx, xxxxx-xx xx x xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxxxxx, xxxxxxxxx, xxxxxxxxx, duble-dummy aj.). Xx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx pak xxxxxxx xxxxx xxxxxxx x xxxxx pro xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx z xxxxxx xxxxxx x klinickém xxxxxxxxx.
Xxxxxxxxxx §53x v xxxxxxxx 3 xx 5 upravují xxxxxxxxx xxxxxxxxx dokumentace, xxxxxxxx xx xxxxxxx, xx xxx xx xxxxxxxx xxxx XX xxxxxxxxx xxxxxx xxx území Xxxxx xxxxxxxxx. X xxxxxx xxxxxxxxxx se xxxxxxx xx xxxxxxxx xxxxx x xxxxxxxxx xx i xxxxxx xxxxxxxxxx xxxxxxx žádostí xxxxxxxx xx xxxxx xxxxxxxxx státu (xxxxxxxxx xxx xxxxxxxx, xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxxx, schvalování xxxx xxxxxxxxxx hodnocení, xxxxxxxxx xxxxxxxxx kompenzací x xxxxx x xxxx…) x působnosti xxxxxx xxxxxx.
Xxxxxxxxxx §53c x xxxxxxxx 6 xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxx.
Xxxxxxxxxx§53x x xxxxxxxx 7 x 8 blíže xxxxx možnosti, x xxxxxx xxxxxxxxx může xxxxxxx etická komise xxx souhlasné stanovisko x zároveň xxxxx xxxx xxxxxxxxxxx. X xxxx xxxxxxx x xxxxxxxxx Kapitoly II článku 4 xxxxxxxx č. 536/2014, xxx xx xxxxxxxxx xxx xxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxx pro xxxxxx xxxxxxx. Celé xxxxxxxxxx se xxxxxx x xxxxxxxxxxxxx úkonů: 1. xxxxxxxx = xxxxxxxx xxxxx dokumentace xx xxxxxxxx xxxxxxx, 2. xxxxxxxxx - xxx xxxx X xxxxxxxxxxx (xxx etické xxxxxx - Protokol, Xxxxxxxxxxxx´xXxxxxxxx - posouzení x xxxxxxxxxxx draftu xxxxxxxxx zprávy = xxxxxxxx xxxxxxxx a xxxxxxx event. xxxxxxxxxx, 3. xxxxxxxxxx xxxxxxxxxx xx. xxxxxxxx zadavatele, 4. xxxxxxxxx xxxxxxx xxxxxxxxx zpráva x xxxxxxxxxx (povolení/povolení x xxxxxxxxx/xxxxxxxxx). Xx xxxx xxxxxxxxxx xxxxx, xx xxxxx xx dán xxxxxxxxx č. 536/2014 xxxxxxxx, xxx. max. xxx xxx xxxxxx xxxxxxxxxx/xxxxxxxx. Xxxxx xxxxxx bude xxxxxx pro xxxxxxxxx xxxxxxxxxxx, týkající xx xxxxxxx, xx xxx xx xxxxxxxx xxxx X xxxxxxxxx xxxxxx, xxx x dokumentace, xxxxxxxx xx xxxxxxx, xx xxx xx xxxxxxxx xxxx II xxxxxxxxx zprávy xxxxxxxxxx xxxxxxxxx. Xxx Xxxxxxxx XX čl. 4 xxxxxxxx x. 536/2014 xx xxxxxx xxxxxxx vyžadován xxx xxx posouzení xxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx, xxx x xxx posouzení xxxxxxx x xxxxxxxx xxxxxxxx xxxxx.
Xxxxxxxxxx §53x x xxxxxxxx 9 xxxxxx Státnímu xxxxxx xxx xxxxxxxx xxxxx, xxxxx xxxx xxxxxx xxxxxx xxxxxxx Ústavu, xxxxxxxxx uchovávání xxxxxxx x činnosti xxxxxx xxxxxx xx dobu 5 xxx.
X xxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xx uvádí, xx xxx xxxxx xxxxxxxx, xxxxx xxxx xxxxxxxxxx XX xxxxxxxxx, xxx Xxxxx žádost x xxxxxxxx hodnocení zamítne. Xxxxxxxxx xxxxxxxxx nařízení xxxxxxxx, lze xx xxxx xxxxxxx. Etická xxxxxx xxxx x xxxx xxxxxx vydávat xxxxx xxxxxxxxxx. Xxxxxxxxxx x žádosti x xxxxxxxx klinického xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxx xxxx vydávat Xxxxx, x to x režimu správního xxxxxx. Xxxx bude xxxxx se xxxxxxx xxxxx rozhodnutí, xxxxx xx bude xxxxxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxx, x xxxxx xxxxxx xx stanovisko etické xxxxxx povahu xxxxxxxxx xxxxxxxx pro rozhodnutí. Xxxxxxxx xxxxxx xxxx xxx xxxxxxx xxxxxx xxxxx xxxxxxx etické xxxxxx xxxxxxxxxxxxxxx odvolání xxxxx xxxxxxxxxx Xxxxxx.
Xx xx týče vydávání xxxxxxxxxx etickou xxxxxx xx xxxxxxx xxxxxxxx, x tímto počítá xxxxxxxx. Xxxxxx vydávání xxxxxxxxxx je xxxxxx xxxxxxxxxxxxxx v xxxxxxxxxx §53x.
X §54 (Xxxxxxxx XXXX, xx. 49 x 50, Xxxxxxxx XX, čl. 73 xxxxxxxx):
Xxxxxxxxxx se zabývá xxxxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxxxx. Čl. 49 xxxxxxxx x. 536/2014 xxxxxxxxx xxxxxxx xxxx x tomu, xxx xxxxx, kdo xxxx xxx podle xxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx či xxxxxxx xxxxxxxxxxx. Xxxxx xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx x hlavním xxxxxxxxxxx xxxx xxx xxxxx xxxxx xxxx xxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx č. 95/2004 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx, pro xxxxx xxxxxx xxxxxxxxxxxxxx xxxxxxxx, xxxxx xx xxxxxxxx xxxxxxx xxxxxxxx a xxxxxxxxxx x péčí x pacienty s xxxxxxxxxxx xx xxxxx, xx xxxxxxx léčbu xx xxxxxxxx xxxx xxxxxxxx hodnocení x xx xxxxxxxx xxxxxxx xxxxxxxx praxe.
Odstavec 2 xxxxxxx z požadavku čl. 50 xxxxxxxx x. 536/2014 xx xxxxx xxxxxxxxxx xxxxxxxxx. Xxxxx xxxxxxxxxx xxxxxxxxx mohou xxx xxx x xxxxxxxxxxxxx xxxxxxxxxxx služeb xx xxxxxxxxxxxxxx zařízeních, xx. xxxxxxxx osob, xxxxx jsou xxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxx zdravotních xxxxxx xxxxx xxxxxx č. 372/2011 Sb., xx xxxxx xxxxxxxxxx xxxxxxxx, x xxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx pro xxxxx xxxxxxxx hodnocení xx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxx xxxxxxxxxx hodnocení.
Odstavec 3 x 4 xxxxxxxxx xxxxxxxxxxx xx fakultativní xxxxxxxxx xxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxx klinické xxxxx, vydaný Ústavem. Xxxxxxx xxxxxxx xx xxxxxxxxxx xxxxx zákona x xxxxxxxx a xxxxxxxx praxe, a xxxxxxxx xxx xxxxxxxx xxxxxxx x xxxxxxxx 3 povinnost xxxxxx xxxxx xxxxxxxxxx, x xx x důvodu, xx xx jedná x xxxxx o xxxxxxxx xxxxxxxxx, xxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxx xxxxxx člověku) nebo xxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxx pro xxxxxxxxxx xxxxxxxx xxxxxxxxx (bioekvivalenční xx farmakokinetická xxxxxxxx xxxxxxxxx).
X §55 (Xxxxxxxxx (26); Xxxxxxxx XX, xx. 26 xxxxxxxx x. 536/2014):
X tomto xxxxxxxxxx xxx x xxxxxxxx čl. 26 x 69 xxxxxxxx x. 536/2014, xxxxx xxxxx xx xxx xxxxxxx xxxx xxxxx xxxxxxxx xxxxxxxxx xx dokumentaci xxxxxxxxxx hodnocení x xxxx by xxx xxxxx jazyk xxxxxxxxx xxxxxxxxx v označení xx xxxxx. X §55 xx xxxxxxx x xx xxxxxx, xx xx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xx xxxxxxx xxxxxxxx do styku xxxxxxx xxxxxxxxx, musí xxx xxxxxxxxxx x xxxxxxx. Xxxx xxxx xxx například o xxxxxxxxx xxx xxxxxxxx, xxxxx pacienta, návod xxx xxxxxxx xxxxxxxx xxxxxxxx x xxxxx x xxxxxxxxx zdravotnického xxxxxxxxxx. Xxxxxxxxx na xxxxx znění xxxxxxxxx xx xxxxxx i xxx dokumenty, x xxxxx xx x xxxxxxx xx xxxxxxx xxxxxxxxx daného xxxxx xxxxx dojít při xxxxxxx xxxxxxxx xx xxxxxxx xxxxxx x xxxxx xxxxxxxxxxxx, xxxxxxxxx xxxxxxxx xxxxxxx. Xxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx v xxxxxxx, xxxxxxxxxxx xxxx angličtině. Xxxxx xxx x xxxxx informací xxxxxxxxx x označení na xxxxx xxxxxxxx xxxxxxxxx xxx klinické xxxxxxxxx, xxxxx se xxxxxx xxx, xx xxxxx xxxxxxx je čeština, xxxx-xx x xxxxxxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx léčiv o xxxxxxxx klinického xxxxxxxxx xxxxxxx xxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxxxx obalu xxxxxxx xx xxxxxxxxxxx, xx x xxxxxxxxx xxxxxxxxxxxxx klinických xxxxxxxxx, xxxxx xxxx xxxxxxx xxxxx xxxxx xxxxx xxxxxxxx (xxxxxx oblasti xxxxxxxx xxxxxxxxxx) by xxxx xxxxxxxxxxxx xxxxxxx x xxxxxx xxx xxxxxxxxxx, aby x xxxxxxxxx, xxxxx podává xxxxx, xxxxxxxxxx xxxx xxxxxxxx na xxxxx x českém xxxxxx. Xxxxxxxxxxxx xxxxxxxx na xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx zasahuje xx xxxxxxxxx cyklu xxxxxxxx xxxxxxxxx x xxxxxx xx xxxxxxx xxxxxxx xx v xxxxx xxxxxxx mohlo vést x xxxxxxxxx České xxxxxxxxx z xxxxxxxxxx xxxxxxxxx, x tedy xx diskriminovalo xxxxx xxxxxxxx v xxxxxxxx x xxxxx xxxxxxx xxxxxxx přípravkům. Xxxxxxxxxx xxxxxxxx xxxxxxxxx bude xxx xxxxxxxxx xxxxxxxxxx xx český xxxx xxxxxxxxx z xxxxx, xxxxx bude xxxxx x přípravkem v xxxxxxxxxxxx xxxxx distribuován xxxxxxxxxxx x ti xxxxx povinni xx x xxx xxxxxxxx, xxx byli xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxxxxx.
X §56 (Xxxxxxxx VIII, xx. 59 odst. 3; Xxxxxxxx IX, xx. 61 xxxx. 5 písm. x), xx. 68; Xxxxxxxx XXXXX, xx. 90 x 92 nařízení x. 536/2014):
X xxxxx xxxxxxxxxx xx především xxxxxxxx xx xxxxxxxxxx čl. 59 xxxx. 3 xxxxxxxx č. 536/2014, xxxxx xxxxxxxx, xxx xxxxxxx xxxx xxxxxxxx, xx xx xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx budou moci xx xxxx území xxxxxxxx xxxxxxxxxxxxxx pomocné xxxxxx přípravky. X xxxxxxxx 2 xx xxxxxxx xxxxxxxxx xxxxxx xxxxxx, xxxxx xx xxxxxxxxx xxx, že xx xxxxxxxx xxxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxx použít x xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxxxxx, které xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx x zdravotnických xxxxxxxxxxxx. Xxxxx xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx zajistit validitu x robustnost xxx, xxxxxxxxx x xxxxxxxxxx xxxxxxxxx. Xxxx xx xxxxxxxxx např. xxxxx xxxxxxxxxxxxx xxxxxx použitím xxxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxxxx xx všech xxxxxxxxxxxx xxxxxxx (xxxxxxx xxxxx XX x 3. xxxx) x xxx x xx xxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx. X xxxxxxxxxx xxxxxxxxx, xxxxx jsou xxxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxx, xxxxx xxxxxx se xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxxxxxx takového xxxxxxxxxx xxxxxxxxx je usazen xx třetí xxxx (xxxx. XXX) xx xxxxxxxx požadavkem xxxxxxxxxx, xxx xxxxxxx zúčastněné xxxxx xxxxxxxxx xxxxxxx, xxx xxxxxx xxxxxxxxxxxx xxxxxxxxxx tak, xxx xxxxxxxx měření xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxx prostředků. Používání xxxxxxxx zdravotnického prostředku xx schváleno příslušnou xxxxxxxxx xxxx xxxxxxxxxx x xxxxxxxxx xxxx xxxxx xxxxx zdravotnický xxxxxxxxxx xx xxxxx Xxxxxxxx xxxx xxxxxx xxxxx než x xxxxx xxxxxxxxx xxxxxxxxx, x to xxxxxxx x xxxxxxx na xxxxxxxxxx, xx mnohdy xxx xxxx výrobcem xxxxxx xxxxxxxxxxxxxx xxxxxxxxxx. Xxxxxx xxx český xxx xxx xxxxxxx, xxxxx bezprostředně xxx xxxxxxxx takového xxxxxxxxxx xxxxxxxxx bude tento xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx, x tedy xx xxxxxx xxxxxxxxxx x Xxxxx xxxxxxxxx.&xxxx; X případě, že xx tato xxxxxx xxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxx Xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxx xxxx xxxxxxxx xxxxxxxx xxx pacientskou populaci x Xxxxx xxxxxxxxx. (Xxxxxxxxx xxxx být xxxx. xxxxxxx glukometru xxxxxxxxxxx x xxxxxxxxxxx xx 3. zemi (XXX), který xxxxxx xxxx xxxxxxxx xxxxxxxxx x České republice xxxxxxxx. Xxxx xxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx nabídne xxxxxxx xxxxx novým xxxxxxxxx xxxxxxxxxx, který po xxxxxxxx xxxxxxxxxx xxxx xxx xxxxxxxx x xxx xxxxx xxxxxxxx, x xx x xxxxxx, xx xxxxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxx hodnocení bude xx jeho xxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxxx z Xxxxx xxxxxxxxx, registrace xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxx xxxxxxxxxx xx xxxx v Xxxxx xxxxxxxxx není xxxxxxxxx xxxxxxxxxxx xxxxxx zdravotnického xxxxxxxxxx, ale xxxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxx validitu x robustnost xxx. Xxxxx xxxxxxxxx xxxx xxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx biologické xxxxxx, např. vzorek xxxx odebíraný xx xxxxxxxxx nádobky, xxxxx xxxxxxx xxxx uchování x potřebné xxxxxxx xx xxxxxx xxxxxx, xx jeho xxxxxx xx xxxxxxxxxxxxxx laboratoře x xxxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxxxxxx prostředku xxxxxx xxxxxxxxx případnou xxxxxxxxxx xxxx xx xxxxxx xxxxxxxxxx, xxx xxxxxx xxxxxx účast xxxxxx xxxxxxxx x xxxxx xxxxxxxxx xxxxxxxxx x tím i xxxxxxx léčby xxxxx xxxxxxxxxxxxxxx xxxxxxx přípravkem).
V xxxxxxxx 2 xx xxxxxxxx nekomerční zadavatelé, xxxxxxx xxxx poskytovatel xxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxx xxxx územním xxxxxxxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx nebo veřejná xxxxxxxx instituce, čímž xx vytváří prostor xxx to, xxx xxxxxxx nich byly x xxxxxxxxx xxxxxxx xxxxxxxxx méně xxxxxx xxxxxxxxx, xxx x xxxx členské xxxxx xxxxxx xxxxxxxxx xxxxxxxx.
X xxxxxxxxxx 3 xx 5 se pak x xxxxxxx s xxxxxxxx právními xxxxxxxx xxxxxxx, xxx xxxxxxxxx xxxxxxxxx xxxxx s xxxxxxxxxxx xxxxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx souhlasy xx xxxxxxxx xxxxxxxxxxx státních xxxxxx. Jde x xxxxxxxxxxxx xxxxxxxxxx čl. 92 xxxxxxxx č. 536/2014, xxxxx xxxxx tímto xxxxxxxxx není xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxx a xxxxxxxxxxx xxxxxxxxx péče. X xxxxxxx xx xxxxxxxx xxxxx xxxx nařízením, xxx jejich xxxxxxxxxx xx xxxxxx xxxxxxxxx xxxxx xxxx k xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxx (xxxxxxxxx xxx možnosti xxxxxxxxx xxxxxxxx klinického xxxxxxxxx) není x xxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx orgánů xx xxxxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxx xx x xxxxxxxx xxxxxxxx vedlo x nemožnosti xxxxxxxxx xxxxxxxx xxxxxxxxxx hodnocení xx xxxxx Xxxxx xxxxxxxxx.
X xxxxxxxx 6 xx v xxxxxxx x požadavky xxxxxxxx č. 536/2014, xxxxxxxxx (11) xxxxxxx možnost předložit xxxxxxxxxxxxx xxxxxxxxxxx klinického xxxxxxxxx x xxxxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx prováděných xxxxxxxxxxxx xxxxxxxxxx, aniž by xxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx xxx.
X §57 (Xxxxxxxx XXX, xx. 42 xxxxxxxx č. 536/2014):
Xxxx xxxxxxxxxx v xxxxxxx x čl. 42 odst. 3 nařízení x. 536/2014 xxxxxxxx, xxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxx xxxxxxx xxxxxxxx xxxxxxxxxxx x tomto nařízení xxxxxxx se xxxxxxxxxxx xxxxxx, xxxxx xxx xxxx xxxxxxxxx podezření xx závažné xxxxxxxxxxx xxxxxxxxx účinky xxxxxx xxxxx agentuře přímo Xxxxxx. X xxxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxx účinky xxxxxxxx xxxxx xxxxxxxxxx Xxxxx. Xxxxxxxx č. 536/2014 přímo xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxx.
X §58 (Xxxxxxxx XII, xx. 76 xxxxxxxx x. 536/2014):
Xxxx ustanovení xx xxxxxxxxxxxx článku 76 xxxx. 1 xxxxxxxx x. 536/2014, xxxxxxxxxxx xxxxxxxx xxxxxx povinnost xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxx xxxxxxx jakékoli xxxxx (xxxx xxxxxxxxx x xxxxxxxxxxx), xxxxxx xxxxxxx hodnocení xxxxx x souvislosti x xxxxxx v xxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxx xxxxx, x xx x podobě xxxxxxxxx, ručení xxxx xxxxxxx xxxxxx, která xx xxxxxxxxxx, xxxxx xxx o účel, x přiměřená xxxxxx x xxxx xxxxxx.
X xxxxx ustanovení xx xxxxxxxx stanoví, xx xxxxxxx-xx xxxxxxxx klinického xxxxxxxxx x xxxxxxxx xxxxxxxxx klinického xxxxxxxxx xxxxxxxxxxx či xxxxxxxxx xxxx, a to xxxxxxx na životě xxxx na xxxxxx, xx xxxxxxxxx povinen xx xxxxxxxx v xxxxxxx x xxxxxx xxxxxxxx xxxxxxxx, xxxxxxx xx odkazuje xxxxxxxxx xx xxxxxxxxx ustanovení xxxxxxxxxx xxxxxxxx.
Xxxxxxxx také xxxx členským státům xxxxxxx xxxxxxxx xxxxx xxxxxxxx pro xxxxxxxxxx xxxxxxxxxx. V xxxxxxxxx č. 81 xxxxxxxx x. 536/2014 xx hovoří x nutnosti podpory xxxxxxxxxxxx zadavatelů tím, xx xxxxxxx xxxxx x xxxxxx xxxxx xxxxxxx xxxxxxxxx opatření. Xxxxxxx xxxxxxxxx xxx xxxxxxx výzkumu xxxxxxxxxxxx xxxxxxxxxx xx také xxxxxxxxxx ustanovení xxxxxxx x xxxxxxxx 3, xxxxx xxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx stávajícího pojištění xxxxxx xxxxxxxx. Xxx xx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxx xx, xxx komerční subjekty xxxxxxxxxxx klinické xxxxxx xxxxxx diskriminováni x xxxx xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx.
X §59 (Xxxxxxxx I, xx. 2 xxxxxxxx (20); Xxxxxxxx XI, xx. 74 xxxxxxxx x. 536/2014):
Xxxxxxxxxx xx xxxxxxx xxxx xx xxxx x xxxxxx č. 268/2014 Sb., o zdravotnických xxxxxxxxxxxx x o xxxxx xxxxxx x. 634/2004 Xx., o xxxxxxxxx xxxxxxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx, xxxxxxx plné moci xxxxxxxxx, xxxxx označí xxxxxxxxx ve xxxxxxxxx xxxxxxxx xxxxxxx xxxx xxxxx zákonného xxxxxxxx xxxxxxxxxx, xx xxxxxxxxx xxxxx. Jedná xx x xxxxxxxxxx xxxxxxxxx x ustanovení §30 xxxx. 5 správního xxxx, který požaduje xxxxxxxxx oprávnění xxxxxxxx xxxxxxxxxxx xx cizí xxxx. Navrhovaná xxxxxx xx více xxxxxxxxxx xxxxxxxxxx xxxxxx zmocnění, xxx je xxxxxxxxx xxxxxxxxx xxxxxxxxx.
Xxxx subjektů, xxxxx xxxx sebou xxxxxxx xxxxxxx xxxxx, xx xxxxx xxxxxxx xxxx xxxxxxxxx xxxxx xxxxx xxxx Xxxxxxxx xxxxxx xxx xxxxxxxx xxxxx, xxxx xxxxxxxxx x jednotném xxxxxxxxx xxxxxxxxx, xxxxxx xxxxxx xxxx xxxxx xxxxx x xxxxxxxx klinického xxxxxxxxx, a xx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxx xxxx xxxxxxxx podepsána xxxxxxxxxxx, xxxx subjektem xxxxxxxx udělujícím. Xxxxxxxxxx, xx xxxxxxxx xx xxxxxx evropského xxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxx Xxxxxxxx xxxx, x to xx xx řádné xxxxxxxxxxxx xxxxxxxx činí xxxxx xxxxxx xxxxxx důvěryhodným x zajišťuje, xx xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxx minimální.
Lhůty, x xxxxx musí xxxxxxxxxx posouzení xxxxxxx, xxxx xxxxxxxxx nařízením x xxxx xxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxx xx xxxx xxxxx 1x xxx xxxxxxxx xxxxxxxxxxx x xx na 5 xxxxxxxxxxxx dnů (x 1x pro xxxxxxxx xx základě odborných xxxxxxxxxx, x xx xxxxx xx xxxx 12 kalendářních xxx). Xxxxxxxxxx právní xxxxxx xx xxxxx v xxxxxxx se současnou xxxxxx xxxxxxx smluvního xxxxxxxx, xxx xxxx xxx xxxx xxxxxxx xx důkazem o xxxxxxxxx smluvního xxxxxxxxxx. Xxxxxxxx x xxxx, xx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxx a xxxxxxxxxx se xxxx xxxxxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxx portálu, xxxx xx navržený xxxxxx xxxxxxxxx xxxxxxxx jako xxxxxxxxxx x xxx xxxxxxxxxx xxxxxxxxxx.
X §60 xxxx. 3 xxxx. x), který se xxxxxxxx.
Xxxx 1. xxxxx 2013 xxxxx účinnosti xxxxx č. 359/2012 Sb., xxxxxx xx mění zákon xx ochranu xxxxxx xxxxx xxxxxx. Podle xxxxxxxxxxx znění §15 xxxx. 3 xxxx. x) zákona xx xxxxxxx xxxxxx xxxxx xxxxxx xx xxxxxxxxxx xxxxxx zákona, xxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xxxxxxxxxx xx xxxxxxx, xxx xxxx xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx při xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx. Xx 1. xxxxx 2013 xxxx xxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxx pokusů xxxxxx rozhodnout x xxxxxxxxx (xxxxxxxx) nebo xxxxxxxxxxx xxxxxxxx xxxxxx xx veterinární klinická xxxxxxxxx xxxxxxxxxx při xxxxxxxxxx veterinárního xxxxxxxx xxxxxxxxx.
K §62 xxxx. 1, §64 xxxx. x) x x) a §66 xxxx. 4:
Xxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxxx x právní xxxxxx výroby hodnocených xxxxxxxx přípravků, xx xxxxx do xxxxxxx x xxxxxxxxx. Nařízení xxxxxxxx právní xxxxxx xxxx xxxxxxx x xx. 61.
K §70 xxxx. 1:
X textu xxxxxxxx 1 xx xxxxxxxx „přímo použitelné xxxxxxxx Xxxxxxxx xxxx“, x xx xxxxx, xx xxxx xxxxxx xxx xxxxxxxx nařízení Xxxxxx v xxxxxxxxx xxxxxxxxx (XX) č. 1252/2014 xx dne 28. xxxxxx 2014 doplňující xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2001/83/XX, xxxxx xxx x xxxxxx x xxxxxx xxxxxxx xxxxxxx xxxxx xxx xxxxxx látky xxx xxxxxxx xxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxxxxx xxxxxxx praxi xxx léčivé xxxxx. Xxxx xxxxxxxx xx xxxx xxxxx xxxxxxxxxx, xxxxxxx xx xxxxxx, xxx bylo navázáno xx xxxxxxxxxxxx xxxxxx xxx, zejména x xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxx xx xxxx xxxxxxxx.
X §70 xxxx. 7:
Cílem xxxx xxxxxx v xxxxxxxxxxx xxxxxxxx 7 je, xxx x xxxxxxxx xxxxx xxxxxxxxxxxxx xx xxxxxxx xxxx, které xx xxxxxxxxx při xxxxxxxx xxxxxxxx přípravků, xxx xxxxxx xxxxxx xxxxx, x xxx xxxx xxxxxxxx x xxxxxxx xx xxxxxxxx xxxxxxx praxí pro xxxxxx látky xxxxxxxxxxxx xxxxxxx standardům xxxxxxxxxx Xxxxxx.
X §77 xxxx. 1 xxxx. f):
Podle xxxxxxxxx xxxxxx xxxxxx xx rozsah x xxxxxx poskytování údajů x xxxxxxxxxxxxxxx léčivých xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx Státního xxxxxx xxx xxxxxxxx léčiv. X hlediska zachování xxxxxx xxxxxxx a xxxxxxxxx vymahatelnosti xxxxxxx xxx xxxxxxxx xxxx xxxxxxx povinnosti xx xxxxxxxxx, xxx byl xxxxxx údajů, xxxxxx xxxxxxxx a xxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx.
X §77 xxxx. 1 xxxx. x):
Xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxx §77x. Xxxx xx x tomto xxxxxxxxxx xxxxxxxx stanovena xxxxxxxxx xxxxxxxxxxxx při xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx dodávku xxxxxxxxxxxxxx xxxxxxxx přípravku xx 48 xxxxx xx xxxxxxxx xxxx xxxxxxxxx.
X §77 odst. 1 xxxx. x):
Xxxxxxx xx nová oznamovací xxxxxxxxx xxxxxxxxxxxx v xxxxxxxxx, xxx hodlá xxxxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx xxxxxx xxxxxxxxx, xxxxx xx xxxxxx na xxxxxxx xxx §77x.&xxxx; Xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx být Ministerstvem xxxxxxxxxxxxx xxxxxx opatření xxxxxx xxxxxx, xxxxxx xxxx xxxx xxxxxx xxxxxxxx tak, xx xxxxxxx x akutní xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxx xxxxxxxxxxx xxxxxxxxxxxx povinnosti xx x xxxxxx xxxxxxxx xxxxxxx, xx xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx distributora, xxxxxxxxxxxx xxxxxxxx přípravku, xxxxxxxx xxxxxxxx přípravku x xxxxxxx xxxxxxxxxx, xxxxx xxxxx xxxxxxxxxx a xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx. Rozsah xxxxx xxxxxxxxx v xxxxxxxx a způsob xxxxxx poskytování xxxxxx xxxxxxxx přitom xxxxxxx xxxxxxxxx xxxxxx xxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx nutné x xxxxxxx xx xxxxxx objemy x xxxxxxx xxxxxxxxx xxx, xxxxxxxx to jejich xxxxxxxxx zpracování x xxx xxxx xxxxxxx xxxxxxxxx x xxxx xxxxxxxx xx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx na xxxx. Xxxxx xx data xx Xxxxx xxxxxxxxxx x jiné, xxxx. x xxxxxxx podobách, xxxxx by je Xxxxx xxxxxx xxxxxxxxx xx xxxxxxxx podoby, xxx xx xxx xxxx xxxxx xxxxxxxxx, xxxxxxxxxx x xxxxxx xxxxx. X xxxxxxx xx xxxxxxx dobu, xxxxxx xx Xxxxx xx xxxxxxxxxx xxxxxxx x vývozu léčivých xxxxxxxxx x xxxxxxxx xxxxxxx xxxxxxx x xxxxxx opatření xxxxxx xxxxxx xx XX, xx xxxx forma, xxx elektronická nebyla xxxxxxxxxx. Rovněž xx xxxxx xxxx x xxxxx, xx lékárny xxxx xxxxxxx vybaveny xxxxxxxx x připojením x xxxxxxxxx, distributoři xxxxxx xxxxxxxxx počítače, XX x elektronickou xxxxx xxx, xxxxx xxx xxxx jediná xxx xxxxxx objemu xxxxxxxxx xxxxxxx xxxxxxxxxx x uchovávání záznamů x xxxxxxxxxxx pro xxxxxx x xxxxx xxxxxx povinností xxx xxxxxxxxx jinými xxxxxxxxxxxx xxxxxx x xxxxxxxx.
X §77x:
Xxxxx tohoto xxxxxxxxxx Xxxxx průběžně analyzuje xxxxxxx na xxxx x xxxxxxxx xxxxxxxxx, x xx xxxxxxx xx xxxxxx mezi xxxxxxx xxxxxx dodávek xxxxxxxx xxxxxxxxx na xxx x České xxxxxxxxx xxxxx §33 xxxx. 2 x xxxxxxx léčivých xxxxxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx. Xx xxxxxxx xxxx xxxxxxx xxx Xxxxx sděluje Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx x xxxxxxx na xxxx xxxxxxxxxxx x xxxxx xxxxxxxx xxxxxxxxx, při xxxxxxx xxxxxxxxxx na xxxx x České xxxxxxxxx xx mohlo xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxxxx xxx xxxxxxxxxxx xxxxxxxxxxx služeb pacientům x Xxxxx republice.
Po xxxxxxxxxxx xxxxxxx xxxxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx Xxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxx léčivých xxxxxxxxx (xxxxxx přípravky xxxx xx seznam zařazovány xxxxxx xxxxxxxx xxxxxx xxxxxx), xxx xxxxxxx xxxxxxxxxx xx xxxx x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxx xxxxxx nedostupnosti xxx xxxxxxxxxxx zdravotních xxxxxx xxxxxxxxx x Xxxxx xxxxxxxxx. Xxxxx xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xx svých xxxxxxxxxxxxx xxxxxxxxx. Xxxxxx xx xxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxx. Do xxxxxx seznamu je xxxxxxxxx léčivý přípravek, xxxxx xxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx odpovídajících xxxxxxxxx xxxxxxxxxx, xxxxxxx xx xxx potřeby xxxxxxxx x Xxxxx xxxxxxxxx dostatek, x xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx by xxxx xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx x Xxxxx xxxxxxxxx s xxxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxx ovlivněním xxxxxxxxxxx xxxxxxxxxxx služeb.
Na xxxxxx xx x ohledem xx xxxxxxxx, xx xxxxxxxxxx předmětného léčivého xxxxxxxxx xx mohl xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxxxx x Xxxxx republice x xxxxxx xxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx, mohly být xxxxxxxxxx všechny xxxxxx xxxxxxxxx, xxx xxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxxxx. Xxxxx xxxxx xx xxxxxxx xxxxxx xxxxxxxxxxxx xxxx mít x xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx x xxxxx jiné xxx xxxxx ohrožující xxxxxxxxxxxx xxxxxxxx. Xxxxxxxxx je, xxx léčivý přípravek xxxxx x plné xxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx odpovídajících xxxxxxxxx xxxxxxxxxx, xxxxxxx xx xxx xxxxxxx xxxxxxxx x Xxxxx republice xxxxxxxx.
Xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxx xxxxxx x xxxxxxx „aktuální xxxxxx“ x „xxxxxxxx xxxxxxx xxxxxxxxxx potřeb xxxxxxxx“ xxxxxxx x xxxxxxxxxx §77x xxxx. 2. Xxxxxxxx x xxxxxxx xxxxxx xxxxxxx x určitému xxxx, xxxxxxx x xxxxxxx xx xxxxxxxxx xxxxx x xxxxxxxxxx z xxxxxxxx xxxxxxxxxx xxxxx xx zřejmé, xx xxx je x xxxxxxx xxxxxx myšleno x datu, xx xxxxxxx je xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx. Xxxxxxxx xxxxxxx aktuálních potřeb xxxxxxxx přitom xxxxxxxxxxx xxxxxxx, xx xxxxxxxxxx xxxx xxxxxxxxx. Xxx xxxxxxxxx xxxxx a xxxxxx xxxxxxxxxxx regulace xx přitom xxxxxxx, xx omezení xxxxxxxxx xxxx xxxxx xxx xxxxxxx xx chvíli, xxx xxxxx jsou xxxxxx xxxxxx přípravky xx xxxx xxx, xxx se xxxx xxxxx xxxxxx x xxxxxxxxx ČR.
Léčivé přípravky xxxxx na seznamu, xxxxx xx bude xxxxxxxx xxxxxxxxxxxx. Pokud xxxxxxx xxxxxx xxx xxxx xxxxxxxx xx xxxxxx, bude seznam xxxxxxxxxxxx x xxxx xxxxxxxxx x něj xxxx xxxxxxx. Ale xxxxxxxx pokud bude xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx, xxxx xxx xx seznamu dlouhodobě, x xx proto, xx xxxxxxx pacientů x XX je xxxxxx xxxxxxxxxx xx xxxxx xxxxxx, a xxxxx xx nutné xxxx dostupnost tímto xxxxxxxx zajistit. Xxx xxxxxxxxxxx seznamu xxxx xxxx xxxxx xxxxxxxx, xx xxxxxxxx pro xx, xxx xxxxxx xxxxxxxxx mohl na xxxxxxx xxxxxx, jsou xxxxx xxxxxxxx. Xxxxxxxxx xx tedy, xx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxx automaticky znamenat xx, xx xxxx xxxxxx na xxxxxxx xxxxx.
Xxxxxxxxxx xxxx možné xxxxxx xxxxxxxxxxxxx xxx xxxxxxx xxxxxx xxxxxxxxx, xx xxxxxxxx xxx xxxxxxxx xxxx xx xxx xx xxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxxxx xxxxxxx.
X §77x:
Xxxxxx xxxxx xxx xxxxxxxx xxxxx xx základě zákona x léčivech xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx údaje x xxxxxxxxx, xxxx. xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, z xxxxx xxx xxxxxx xxxxxxxxx x xxxxxxxxxxx léčivých xxxxxxxxx xx trhu x Xxxxx xxxxxxxxx. Xxxx xxxxx, pokud xx xxxxx x xxxxxx přípravky xx xxxxxxx, xxxxxxxxxx vyhodnocuje xxx, xxx xxxx x případě xxxxxxxx xxxxxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx xxxxx tohoto xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx odůvodněný xxxxxx x xxxxxx xxxxxxxx xxxxx ustanovení §77x. Xxxxxx xxxx x xxxxxxxxxx na xxxxxxxx xxx vydání xxxxxxxx xxxxxx xxxxxx Xxxxxxxxxxxxx xxxxxxxxxxxxx dle §77x obsahovat xxxxx xxxxxxxxxxx xxxxxxxxxxxxx údajů x xxxxxxxxxx xxxxxxxxx xxxxx.
Xxxxxxxxxxxx zdravotnictví xx xxxxxxx §11 xxxx. x) vydá opatření x xxxxxxxxx dostupnosti xxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx, že x) xx jedná x xxxxxx přípravek xxxxxxxx xx seznam xxxxxx xxxxx §77x, xxxxxxxxxx by xxxxx x xxxx, xx xxxxxxxx zásoba xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxx pacientů x Xxxxx republice, xxx je xxxxxx xxxxxxx x údajů xxxxxxxxxxxxx xxxxxxx xx xxxxxxxx rozhodnutí o xxxxxxxxxx, xxxxxxxxxxxx x xxxxxxx x souladu x xxxxx xxxxxxx x jejich xxxxxxxxxxx, x c) xxxxxxx xxxxx xx ochraně xxxxxx xxxxxxxxxxxx x xx xxxxxxxxx dostupnosti xxxxxxxx přípravků xxx xxxxxxx xxxxxxxx v Xxxxx xxxxxxxxx xxxxxxxxx xxx individuálním xxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxxxxx xx zahraničí. Xxxx podmínky xxxx xxx xxxxxxx kumulativně, xx. xxxxxxx zároveň.
Základní xxxxxxxxx xxx xxxxxx xxxxxxxx obecné povahy xxx xxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxx xxx §77c xxxxxx x xxxxxxxx.
Xxxxx xx xxxxx x vymezení xxxxxxxxxxxxx, xxxx je xxxxxxxxx co nejobjektivněji. Xxxxxxxx xx xx xxxxxxx xxx, xx xxxxxxxx zásoba xxxxxxxxxxx xxxxxxxx xxxxxxxxx již xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx pacientů x Xxxxx xxxxxxxxx. Xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx xx xxxxx xxxxxxxxxxxxx vymezit, xxx je xxxxxxx xxx xx, xxx xxxx xxxxxxx xxxx x xxxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxxx. X xxxxxxx léčivého xxxxxxxxx xxxx xxx xxxxxxxxx x xxxxxxx xx xxxxxxxxx dodávek xx xxxxxxx, xxxxxxxxx xxxxxxx spotřebu x xxxx xxxxx x xxxxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxx a xxxxx xxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxx, včetně xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxx xxxxx Xxxxx xxxxxxxxx v xxxxxxxxxx xxxxxx.
Xxxxx xxxx. x) xxxx xxx xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxx xx xxxxxxx xxxxxx obyvatelstva x xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxx xxxxxxxx x České republice. X konkrétním xxxxxxx xxxx xxx řádně xxxxxxxxxx, že xxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx nad xxxxxxxxxxxxx xxxxxx xx xxxxxxxxxxx xxxxxxxxxx do xxxxxxxxx.
Xx xx xxxx formy xxxxxxxx obecné xxxxxx, xxxxxx úprava xxxxxxxx xxxxxx xxxxxx je xxxxxxxx x xxxxxxxxxxxx §171 x xxxx. xxxxxx č. 500/2004 Xx., xxxxxxx řád (xxxx xxx „xxxxxxx xxx“). Návrh opatření x xxxxxxx opatření xx xxxxxxxx oznamovat xxxxx xxxxxxxx umožňujícím xxxxxxx xxxxxxx. Xxxxx xxxxxx xxxxxx xxxxxxxx x xxxxxxxxxx §25 xxxxxxxxx xxxx xxxxx, xx xxxxxxxxx xxxx xx xxxxxxxx se xxxxxxxxx xxxxxxxx za xxxxxxxxx. Tato xxxxx xxx xxxxxx doručení xx xxxxxxxx upravit xxxxxxxxx x xxxxx 5 dnů xxx, xxx mohly být xxxxxxxxxx podávány x xxx xxxxxxxxxx xxxxxx.
Xxxxx xxxxxx xxxxxx, xx xxxxxxx xxxxx vyzve xxxxxxx xxxxx, aby x xxxxxx xxxxxxxx xxxxxxxx připomínky. Xxxxxxxxx xx xxxxxx xxxx xxxxxxx xxxxx 5 xxx xxx xxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxx obecné xxxxxx xxx xxx xxxx xxxxxxxxxx xxx, aby xxxxxxxxxxx x xxxxxxx xxxxxxxxxx xxxxx xxxxx xx xxxxxx xxxx xxxxxx x xxxxxx xxxxxxxx xx následující xxxxxxxx xxx.
Xxxxx xxxxxxxx xx xxxxxxx neprojednává x lze x xxxx xxxxxxxx xxxxx xxxxxxx připomínky. Xxxx xxxxx xxxxxx xxxxxx, xx xxxxxxx, xxxxx xxxxx, xxxxxxxxxx nebo xxxxx mohou xxx xxxxxxxxx xxxxxx xxxxxx xxxxx xxxxxxx, xxxx x xxxxxx uplatnit x xxxxxxxxx xxxxxx (x Xxxxxxxxxxxx xxxxxxxxxxxxx) xxx xxxxxxx připomínky. Xxxxxxxxxxxx poté xxxx xxxxxxx xx xxxxxxxxxxxx xxxxxxx jako xxxxxxxxx xxx xxxxxxxx xxxxxx xxxxxx a xxxxxxxxx xx x xxxx x xxxx xxxxxxxxxx. Xxxxxxxxxx §175 xxxx. 2 xxxxxxxxx xxxx xxxxxxxxxx možnost xxxxxx xxxxxxxxx osob, xxxxx xx xxxxx podávat xxxxxxxxxx námitky, xx xxxxxxxxx. Xxxxxxxx nabývá xxxxxxxxx dnem v xxx stanoveným.
Co xx xxxx přezkumu opatření xxxxxx xxxxxx, platí xxxxxx xxxxxx xxx xxxxxxxxxx §173 xxxx. 2 xxxxxxxxx řádu, xxxxx xxxxxxx x xxx, xx xxxxx xxxx xxxx xxxxx xxxxx xxxxxxx xxxxxxxxxx. Xxx xxxxxxxxxx §174 xxxx. 2 xxxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx lze xxxxxxxx v xxxxxxxxxx xxxxxx. Proti opatření xxxxxx xxxxxx existuje xxxxxxxx xxxxxx xxxxxxxx xxxxxx přímo xx xxxxxxxx xxxxxxxxxx, x xx x xxxxxx x xxxxxxx xxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxx §101a x xxxx. xxxxxx x. 150/2002 Xx., xxxxxxxx xxxx xxxxxxxxx. Xxxxx xx xxxxxxx xxxxxxxx xxxxxx xxxxxx lze xxxxx xx 3 xxx xx nabytí xxxx xxxxxxxxx a xxxx xxx xxxxx xxxxx, xxx tvrdí, xx xxx byl xxxxxxx xx xxxxx xxxxxxx.
Xxxxx xx xxxxx x xxxxxxx účinnost xxxxxxxx, xxx jej xxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxxx. Xx xxxxx xxxxxx x x xxxxxx xxxxxxxxx xxxxxxxxxxxxxxxx xxxxxx procesu xx xxxxx pravidelně vyhodnocovat xxxxxx xxxxxxxxxxx opatření xxxxxx xxxxxx.
Xx xxxxxx xxxxxxxxx xxxxxxxx efektivního xxxxxxxxx x xxxxxxx, xx se Xxxxxxxxxxxx xxxxxxxxxxxxx x rámci xxx xxxxxxxx xxxxx x xxxxxx nedostatku xxxxxxxx xxxxxxxxx, požádá Xxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxxxxxxx údajů x xxxxxxx podle §77c.
K §80 odst. 1:
Doplňuje xx úprava ohledně xxxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx x xxxxxxxxxxxxxx xxxxxxx.
X §82 odst. 3 xxxx. d):
Podle xxxxxxxxx xxxxxx xxxxxx je xxxxxx x xxxxxx xxxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxx přípravcích xxxxxxxxxxx xxxxxx pokynu Xxxxxxxx ústavu pro xxxxxxxx xxxxx. X xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx x účinnější xxxxxxxxxxxxxx nápravy při xxxxxxxx této xxxxxxx xxxxxxxxxx xx xxxxxxxxx, xxx xxx rozsah xxxxx, xxxxxx interval x způsob xxxxxx xxxxxxxxxxx formou xxxxxxx xxxxxxxx xxxxxxxxxx právním xxxxxxxxx.
Xxxxxxxxxxxx hlášení xx xxxxx s ohledem xx xxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxx, xxxxxxxx xx xxxxxx efektivní xxxxxxxxxx x tím dává xxxxxxx efektivně a xxxx xxxxxxxx xx xxxxx xxxxxxxxxx daného xxxxxxxx xxxxxxxxx xx xxxx. Xxxxx xx xxxx na Ústav xxxxxxxxxx v xxxx, xxxx. x xxxxxxx xxxxxxxx, musel xx xx Xxxxx napřed xxxxxxxxx xx jednotné xxxxxx, aby xx xxx bylo xxxxx xxxxxxxxx, xxxxxxxxxx a xxxxxx xxxxx. X xxxxxxx xx xxxxxxx xxxx, kterou xx Xxxxx xx xxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx předání podnětu x xxxxxx opatření xxxxxx xxxxxx xx XX, xx xxxx xxxxx, xxx elektronická xxxxxx xxxxxxxxxx. Xxxxxx xx xxxxx vzít x potaz, že xxxxxxx xxxx xxxxxxx xxxxxxxx počítači x xxxxxxxxxx k xxxxxxxxx, xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, XX x xxxxxxxxxxxxx xxxxx xxx, xxxxx xxx xxxx xxxxxx xxx xxxxxx xxxxxx poskytuje xxxxxxx xxxxxxxxxx x uchovávání xxxxxxx a xxxxxxxxxxx xxx xxxxxx x xxxxx xxxxxx povinností xxx xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx x xxxxxxxx.
K bodům 37 a 38
X §82 odst. 4:
Ustanovení xxxxxxx xx xxxxxxxxx xxxxx.
X §101 xxxx. 1:
Xxxxxx xxxxx xxx xxxxxxxx xxxxx xx xxxxxxxx jako xxxxxxxxx xxxxx xxxxx řadou xxxxxxxx xxxxxxxx, které xxxxxxx xxx xxxxx xxxxxxx. Xxxxxxxx Xxxxxx xxxxx xxx kontrolu xxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxx předpisů:
zákon č. 378/2007 Sb., x léčivech - rezort MZ,
zákon č. 296/2008 Sb., x lidských xxxxxxx x buňkách - xxxxxx XX,
xxxxx č. 167/1998 Sb., x návykových xxxxxxx&xxxx; - xxxxxx XX,
xxxxx č. 123/2000 Sb., x xxxxxxxxxxxxxx prostředcích - xxxxxx XX (xx 1. dubna 2015 xxxxx č. 268/2014 Sb.),
xxxxx č. 372/2011 Sb., x zdravotních službách - rezort XX,
xxxxx č. 40/1995 Sb., o xxxxxxxx xxxxxxx - xxxxxx XXX,
xxxxx č. 102/2001 Sb., o xxxxxx xxxxxxxxxxx xxxxxxx - xxxxxx XXX,
xxxxx č. 634/1992 Sb., x ochraně xxxxxxxxxxxx - xxxxxx XXX,
xxxxx č. 265/1991 Sb., o xxxxxxxxxx xxxxxx České xxxxxxxxx x oblasti xxx x xxxxx č. 526/1990 Sb., x xxxxxx - xxxxxx XX,
xxxxx č. 477/2001 Sb., x xxxxxxx - rezort XXX,
xxxxx č. 78/2004 Sb., x xxxxxxxxx x geneticky xxxxxxxxxxxxxx xxxxxxxxx a xxxxxxxxxxx xxxxxxxx - xxxxxx XXX,
xxxxx č. 272/2013 Sb., x xxxxxxxxxxxx xxxx - xxxxxx XX.
Xxxxx x xxxxxxxxx z xxxxxx xxxxxx xx xxxxxxxx, xx xx xxxxxxxxxx xxxxxxxxx při xxxxxx xxxxxxxx xxxxxxxx. X xxxxxxx xxxxx xxxxxxxx xxxxxxxx, x xxxxx xxxxxxxxxx x průkazu xxxxxxxxxx xxxxx, xx xxxx xx 1.1.2014 xxxxxxxxxx prokazovat xxxxxxxx xxxxxxxxx vystaveným xx xxx. Xxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxxx xx kontrolu xxxxxxxxxx povinností xxxxxxxxx xxxxx xxxxxxx zákonů xxxx. na kontrolu xxxxxxxxxx uložených xxxxxxx x xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxx. V xxxxxxx xxxxxxx xx xxxx xxxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx xxxxxxxx (xxxxx xxxxxx x léčivech), xxx x xxxxxxxxx (xxxxx xxxxxx o xxxxxxxx xxxxxxx).
X xxxxxxx xx xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx Xxxxxxxx ústavu xxx kontrolu xxxxx x x zajištění xxxxxx xxxxxxx xxxxxxxxxxxxxx xxxx xx xxxxxxxx xxxxx xxxxxxxxxx xxx, xxx pověření ke xxxxxxxx xxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxxx x aby xx xxxxxxxxxx Státního xxxxxx xxx xxxxxxxx xxxxx xxx xxxxx kontrolách xxxxxxxxxxxx xxxxx právních xxxxxxxx xxxxxxxxxxx jednotně xxxxxx xxxxx xxxxxxxx, x xxx je xxxxxx inspektora, a xx xxxxx x xxxxxxx s kontrolním xxxxx. Xxxxxxx x §22 xxxx. 1 xxxxxx x xxxxxxxx xx zavedena xxxxxxxxxxxx xxxxxxx „inspektoři“ xxx xxxxxxxxxxx Xxxxxxxx ústavu xxx xxxxxxxx léčiv x Xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx x léčiv, xxxxx vykonávají xxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxx xx se xxxx xxxxxxxxx x xx xxxxxxxxxx Xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx a léčiv.
X §101 xxxx. 5 písm. x):
Xxxxxxxx xxxxxx instituty xxxxxxxxx x zabrání xxxxxxxx přípravků xxxx x xxxxxxxxx znění xxxxxx o xxxxxxxx xxxxxxxx neprovázaně, nejasně x x xxxxxxx xxxx xxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx přípravku, v xxxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx. V xxxxx xx xxxxxx stále xxxxxxx xxxxxxxxx xxxxxxx, xxx Xxxxxx xxxxx xxx xxxxxxxx xxxxx xxxxxx, xx x xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, které x xxxx xxxxxx podle xxxxxx xxxxxxxxx. Typicky xx xxxxx o xxxxxxx, xxx xxxx xxxxxx přípravky xxxxxxxx xx xxxxxxxxx. Xxxxxx xxxxxxxxx však nejsou xxxxxx xxxxxxxxxx xxxxxx x x xxxxxx xxxxxxx xxxxxxxxx xxxxxx xx nezbytné, aby x xxxx xxxx xxxxxxxxx jen takovým xxxxxxxx, který zákon xxxxxxxx, x aby xxxxxx xxxxxxxxx uskutečňovaly xxxxx xx osoby, xxxxx xxxx x xxxx xxxxxxxxx. X xxxxxx důvodu je x xxxxxx novely xxxxxx zpřesňován xxxxxx Xxxxxx xxx xxxxxxxxxxx, xxxxxxxxxx x odstraňování xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxx zacházejících x xxxxxx. Dále xx dosavadní právní xxxxxx xxxxxxxxx x xxxxxx institut xxxxxxxxxx xxxxxxxx xxxxxxxxx.
X§103 odst. 6 písm. x):
Xxxxxxxxx x doplnění xxxxxxxxxxx xxxxx xxxxxxxxxx xxx, xxx postihovalo všechny xxxxxxx xxxxxxxx, xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx.
X §105 odst. 2:
Xxxxxxxx xx xxxxxxx x), x) x x), xxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx xxx xxxxxx nezajištění xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxx ustanovení §77 xxxx. 1 xxxx. x) (xxxxxxx xxxx xx xxx xxxxxxxxx x držitelů xxxxxxxxxx x xxxxxxxxxx), neoznámení xxxxxxxxx distribuce dle xxxx zaváděného xxxxxxxxxx §77 xxxx. 1 xxxx. x) a xxxxxxxx xxxxxxxx xxxxxx xxxxxx vydaného dle xxxxxxxxxx §77x.
X §105 xxxx. 5:
V xxxxx xxxxxxxxx efektivity nastaveného xxxxxxx xxxxxxxxx x xxxxxxxxxxxxx hrozby xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx na xxxx pro xxxxxxx xxxxxxxx v České xxxxxxxxx xx xxxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx o xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxx x objemu xxxxxxx xxxxxxxx přípravku xxxxxxxxx xx trh x Xxxxx xxxxxxxxx xxxxx §33 odst. 2.
K bodům 46 xx 65
X §105 xxxx. 6 x 7, §106 xxxx. 3, §107 xxxx. 1 x 2, §108 xxxx. 5, 8 a 11:
X xx. 94 xxxxxxxx xx xxxxxx xxxxxxxx státům stanovit xxxxxx xx porušení xxxxxx xxxxxxxx x xxxxxxxx veškerá xxxxxxxx xxxxxxxx k jejich xxxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxxx mají xxx xxxxxx, xxxxxxxxx x xxxxxxxxxx. Xxxx xx xxxxx doplňuje zákon x xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxxx x neplnění povinností xxxxxxxxxxx jak nařízením, xxx xxxxx zákonem xxxxxxx v této xxxxxxx stávající xxxxxx xxxxxx xxxxxxxxxx hodnocení xxxxxxxxx x xxxxxx x léčivech.
K §107 xxxx. 1:
Xxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx distributorem xxx xxxxxxxxxx §77 xxxx. 1 písm. h) xx stanoví (xxxxxxx, xxxx xx xxx xxxxxxxxx x xxxxxxx xxxxxxxxxxxx deliktu xxxxxxxx xxxxxxxxxx o xxxxxxxxxx) xxxxxx xx 20 xxx. Xx, xxx xxxxxx xxxxxxxxxx plánované xxxxxxxxxx dle xxxx xxxxxxxxxx xxxxxxxxxx §77 xxxx. 1 xxxx. x) se stanoví xxxxxx do 5 xxx. Kč a xxx případ xxxxxxxx xxxxxxxx xxxxxx povahy xxxxxxxx xxx xxxxxxxxxx §77x xx stanoví xxxxxx do 20 xxx. Kč.
Pokud xxx x výši xxxxxx, xx xxxxx xxxxxxxxxxx, xx xxxxxxxx xxxxxxx xxxxxx x léčivech č. 70/2013 Sb., xxxx přistoupeno x xxxx, xx xxxxx xxxxxxx xxxxx x tomto xxxxxx xxxx x xxxxxxx xxxxxxx, x xxxxx xxxxx xxxxxxxxxxx skutečnosti xxxxxxxx xxxxxxxxx x xxxxxxxx zprávě x xxxxxx zákonu: „ …xx úměrně xxxx xxxxxxxx xxxxxx i xxxxx xxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxx x ostatních xxxxxxxxx upravených zákonem x xxxxxxxx. X xxxxxxxxx xxxxxxxxxx xxxxxxxx x aplikační xxxxx, xxxxx xxxxxxxx x xxx, xx xxxxxxxxx xxxx xxxxxx xx xxxxxxxxxxx jednání xx x xxxxx xxxxxxxxx xxx xxxx xxxxxxx. X xxxxx xx xxxxxxx, xx xxx xxxxxxx farmaceutické xxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxx xxxx xxxxx xxxxxx výraznou xxxxxxxx xxxx, xxx xx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xxxx dané xxxxxxx xxxxxx. Xxxxxxxxx xxxxxxx xxxxx x xxxx xxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxx x právními xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx Evropské xxxx. Xxxxxxxxx xxxxxx xx xxxxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx kontrolované xxxxxxxx, což xx xxxx xxxxxxxx xxxx xxxx xx xxxxxxx xxxxxxxx porušování legislativy xxxxxx x xxxx xxxxxxx. X xx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxx xxxxx xxxx xxxxx xxxxxxxxxx xxxx, xxxxx xx xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxxx, xxxx xxxxxxxxx x zákoně č. 634/1992 Sb., x xxxxxxx xxxxxxxxxxxx, xx xxxxx pozdějších xxxxxxxx, x němž xx xx xxxxxxx xxxxxxx delikty stanovena xxxxx hranice xxxxx xx xx výši 50 000 000 Xx.“.
Xxxx xxxxxxxxxxxx xxxxxxx xxxxxx xx xxxxx xxxxx xxxxx xxxxxxxxx Xxxxxxxxxxx Xxxxx republiky xxxxxxxxxxx, x i xxxxxx xxxxxxxx x xxxxxxxx. Xxxx odpovídají x navrhované horní xxxxxxx xxxxx xx xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxx deliktů.
Správní xxxxxxx xxxxxxxxxxx v xxxxxxxxxxx xxxxxxx xxxxxxxx přípravku xxxxx §77 xxxx. 1 xxxx. x), xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx mimo xxxxx Xxxxx xxxxxxxxx xxxxx §77 odst. 1 xxxx. q) nebo x distribuci léčivého xxxxxxxxx xxxx xxxxx&xxxx; Xxxxx xxxxxxxxx v xxxxxxx s xxxxxxxxx xxxxxx povahy Ministerstva xxxxxxxxxxxxx xxxxxxx xxxxx §77x xx xxxxxxx xxxxxxxx xxxx systém x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx x Xxxxx xxxxxxxxx, xx xx xx xxxxx xxxxxxxxx xxxxxxxx, aby xxxxx xx xxxxxx xxxxxxx xxxxxxx xxxx xxxxx uložit xxxxxx x xxxxxxxx xxxxx xxxx podle xxxxxx x léčivech, kterou xx již podle xxxxxxxxx xxxxxx xxxxxx xxxxxx 20 000 000 Kč.
Pokud xxx x xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx x xxx, že xxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxxx xxxxxxx xxxxxxxx přípravku xxxxxxxxx xx xxx x Xxxxx republice podle §33 xxxx. 2, xxx xxxx podstatou x xxxxxxx xxxxxxx xxxxxx, xxxxxx xx xxxxx xxxxxxxxx xxxxxx xxxxxx xxxx dopustit xxxxxxxxxxx podle §77 xxxx. 1 xxxx. x) xxxx provozovatel xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx podle §82 xxxx. 3 xxxx. d). Xx xxxxx xxxxx xxxxxxxxxx, xxx xxxx xxxxx xxxxx správního xxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxx xxxxx sazby xxxxxxxxx xxxxxxxxx xxxxxxx spáchaným xxxxxx osobami.
Pokud xxx x xxxxxxx xxxxxxx x oblasti xxxxxxxxxx xxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx, xx třeba x xxxx řadě xxxxxxxxx, že xxxx xxxxxx xxxx, xxx xxxxx xxxx, xx xxxxx xxxxxxxxxxx protiprávní xxxxxxx xxxxxxxxx v xxxxxx x léčivech, xxxx xx měly xxxxxxxxxx protiprávní jednání xxxxxxxxx již x xxxxxxxx č. 536/2014, xx. x přímo xxxxxxxxxxx xxxxxxxx Xxxxxxxx unie. Xxx xxxxxxxxx xxxxx xxxxxxx xxxxxxx xxxxx xx xxxxxx xxxxxxxxxxx xxxxxxx se xxxxx xxxxxxxxx xxxxxxxxx právní xxxx.
X §107 xxxx. 2:
Xxx xxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxx dle xxxxxxxxxx §11 xxxx. g) xx xxxxxxx též xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxx.
X §108x x §108x:
X xxxxxx xxxxxx xxxxxxx se v xxxxxx upravují podmínky xxx uložení xxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx léčivého xxxxxxxxx x xxxxxxxx se xxxxxxx xxxxxxx, xx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx se xxxxx xxxx.
X §112 odst. 6:
Xxxx xxxxxxxx odstavec 6 xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxxxx ze xxxxxxxxxx účtu Státního xxxxxx xxx xxxxxxxx xxxxx xx xxxxxxxx xxxx xxxxxxxx xxxxxxxx Xxxxx xxxxxxxxx xxx Xxxxxxxxxxxx zdravotnictví.
K bodům 68 až 72
X §114 odst. 1, 2 a 4:
Xxx se xxxxx xxxxx x legislativně xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx tam, kde xx xxxxx xxxxxxxx xxxxxxxxxxx. Xxxxxx xx xxxxxxxxxx xx xxxxxxxxxx, xx xxx x xxxxxxxxxx §114 xxxx. 1 zákona x xxxxxxxxxxx xxxxxxxxx Ministerstva xxxxxxxxxxxxx x xxxxxx xxxxxxxx a x xxxxxxxxxx §114 xxxx. 2 xxxxxx o xxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx x Xxxxxxxxxxxx xxxxxxxxxxx x vydání xxxxxxxx.&xxxx; Po xxxxxx xxx xxxxx k xxxxxxxxx xxxxxxxx vyhlášky x správné xxxxxxxx xxxxx xxx, že xxx oblast xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxxxxx xxxxxxx xx xxxxx Xxxxxxxxxxxx xxxxxxxxxxx.
X §114 xxxx. 2:
X xxxxx xxxx xxx xxx x xxxxxxxxxxxx xxxxxxxxx změny x xxxxxx xxxxxxxxxxxx xxxxxxxxxx, xxxx xxxxxxxxx xxxxxxxxxx ustanovení xxx xxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxx zmocňovacími xxxxxxxxxxxx novými.
Přechodná xxxxxxxxxx xxxx xxxxxxxx xxx, xxx xxxxxxxxxxxx ustanovení článku 98 xxxxxxxx č. 536/2014.
X důvodu xxxxxxxxxx xxxxxxxxxx pochybností xx xxxxxxxx stanoví, že xxxxx o státní xxxxxx xx xxxxxx xxxxxxxxx xx člena xxxxxx xxxxxx.
Xxxxx xx x xxxxxxxxxx xxxxxxxxxxxx xxxxxxx zajištění procesu xxxxxxxxxx x xxxxxxx xx xxxxxxxx Evropského xxxxxxxxxx a Rady (XX) 2015/1535 xx xxx 9. xxxx 2015 o xxxxxxx xxx xxxxxxxxxxx informací x oblasti technických xxxxxxxx a xxxxxxxx xxx xxxxxx informační xxxxxxxxxxx, v platném xxxxx.
K čl. V (Xxxxxxxx):
Xxxxxx xxxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxx xx vztahu xx čtyřem xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx.
Xx xxxx, ustanovení xxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxxx klinického xxxxxxxxx xxxxxxxxx xxxxxxxx přípravků xx xxxx xxxxx xxxxxxxxx uplynutím 6 xxxxxx xx xxx xxxxxxxxxx xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxx čl. 82 xxxx. 3 xxxxxxxx č. 536/2014, xxxxxxx xxx, kdy xxxx toto xxxxxxxx xxxxxxxxxx, xxxxxx Ministerstvo xxxxxxxxxxxxx xxxxxx xxxxxxx xx Xxxxxx xxxxxx.
Xx xxxxx, ustanovení xxxxxxxx xx xxxxxxxxx xxxxx xxxxxx xxxxxx, Xxxxxxx, xxxxxxxxx xxxx xxxxxx xxxxxx x xxxxxxxxxx xxxxxxx xxxxxx komise, xx xxxx nabýt xxxxxxxxx již xxxxxx xxxx xxxxxxxxxxxx xxxxxx xx dni zveřejnění xxxxxxxx Xxxxxx x Xxxxxxx xxxxxxxx Evropské xxxx xxxxx čl. 82 xxxx. 3 nařízení x. 536/2014, neboť xxxxxx xxxxxx xxxx xxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxx x není xxxxx, aby s xxxxxxx a xxxxxxxxxx xxxxxx komise bylo xxxxxxxx xx x xxx xxxxxx xxxxxxxxx xxxxxxxx č. 536/2014.
Za třetí, xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxx nabýt xxxxxxxxx prvním xxxx xxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxx xxxxxxxxx xxxxxx, neboť xxxxxxxxxx xxxxxxx xxxxxxxxx x vyhodnocování hrozby xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxx xxxxxxxx v České xxxxxxxxx x přijímání xxxxxxxxxxx opatření xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx v xxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxx takových xxxxxxxx xxxxxxxxxx, xx vyžaduje xxxxxx xxx přípravy, x xx xxxxxxx xx xxxxxx držitelů xxxxxxxxxx o xxxxxxxxxx xxxxxxxx přípravků, distributorů x xxxxxxxxxxx xxxxxxxxx xxxxx.
Xx xxxxxx, xxxxxxx xxxxxxxxxx xxxxxxxx v xxxxxx xxxxxx xx xxxx nabýt účinnosti xx xxxxxxxx, x xxxx je xx xxxxx, aby xxxxxx xxxxxxxxx prvním xxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxx xxxxxxxxx xxxxxx.
V Praze dne 13. xxxxx 2016
předseda xxxxx
Xxx. Bohuslav Xxxxxxx x. r.
ministr xxxxxxxxxxxxx
XXXx. Xxxxxxxxx Němeček, XXX, x. r.
XXXXXXXXX TABULKA XXXXXX XXXXXXXX PŘEDPISU X XXXXXXXX XX
Xxxxxxxxx xxxxxxx x xxxxxx novely xxxxxx x. 378/2007 Xx., x xxxxxxxx x o změnách xxxxxxxxx xxxxxxxxxxxxx xxxxxx (xxxxx x xxxxxxxx)
|
Xxxxxxxxxx xxxxxx předpis (xxxx. xxxx xxxxxx xxxxxxx) |
Xxxxxxxxxxxx xxxxxxx XX |
|
|
Xxxxxxxxxx (xxxx, §, xxxx., písm. xxxx.) |
Xxxxx x. |
Xxxxxxxxxx (xx., xxxx., xxxx., xxx., xxxx.) |
|
Xx. 2 xxxx. 1 |
||
|
Xx. 83 |
||
|
Čl. 4 |
||
|
Xx. 8 odst. 1 |
||
|
Čl. 1 xxx 22 |
||
| §51 | ||
|
Xxxxxxxx XX, čl. 4 |
||
|
Xxxxxxxx XX, xx. 9 |
||
|
Xxxxxxxx XX xx. 83 |
||
|
Kapitola XX, xx. 2, xxxx. 2, xxx 12 |
||
|
Xxxxxxxx II, čl. 5 |
||
|
Xxxxxxxx XX, xx. 2, xxxx. 2, xxx 12 |
||
|
Kapitola XX, xx. 6, xxxx. 5 x 7 |
||
|
Xxxxxxxx XX, xx. 7 |
||
|
Kapitola XX, xx. 8 |
||
|
Xxxxxxxx X, xx. 34 |
||
|
Xxxxxxxx X, čl. 2, xxx 11 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Kapitola XX, xx. 9 |
||
|
Xxxxxxxx XX, xx. 8 xxxx. 4 |
||
|
XXX E6 |
||
|
Kapitola II, xx. 9 |
||
|
XXX X6 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Xxxxxxxx XX, čl. 8 xxxx. 4 |
||
|
Kapitola XX, xx. 6 |
||
|
Xxxxxxxx XX, xx. 4 |
||
|
Kapitola XX, xx. 7 |
||
|
Xxxxxxxx XX, xx. 28, písm. x) |
||
|
Xxxxxxxx XX, čl. 7, odst. 1 xxxx. x) |
||
|
Xxxxxxxx XXX, xx. 20 |
||
|
Kapitola II, xx. 4 |
||
|
Xxxxxxxx I, xx. 4 |
||
|
Xxxxxxxx I, xx. 2, bod 15 x 16 |
||
|
Kapitola XXXX, xx. 49 |
||
|
Kapitola XX, xx. 73 |
||
|
Xxxxxxxx XXXX, čl. 50 |
||
|
Xxxxxxxx XX, xx. 26 |
||
|
Xxxxxxxx XXXX, xx. 59 xxxx. 3 |
||
| 32014R0536 |
Xxxxxxxx XVIII, xx. 92 |
|
|
Xxxxxxxx XX, xx. 61, xxx 5x |
||
|
Xxxxxxxx X, xx. 68 |
||
|
Xxxxxxxx XXXXX, čl. 90 |
||
|
Xxxxxxxxx 81 |
||
|
Kapitola VII, xx. 42 odst. 3 |
||
|
Xxxxxxxx XXX, čl. 76 |
||
|
Xxxxxxxx X, čl. 2, bod 20 |
||
| §64 písm. b) |
Čl. 8 odst. 1 |
|
|
Xx.1 |
||
|
Xx.1 |
||
|
Xx. 94 |
||
|
Xx. 8 xxxx. 1 |
||
|
Xx. 15 |
||
|
Čl. 35 |
||
|
Xx. 36 |
||
|
Xx. 37 odst. 1 |
||
|
Xx. 37 xxxx. 5 |
||
|
Xx. 37 odst. 6 |
||
|
Xx. 38 odst. 1 |
||
|
Xx. 37 xxxx. 4 |
||
|
Xx. 41. odst. 3 |
||
|
Xx. 42 xxxx. 1 |
||
|
Xx. 47 |
||
|
Čl. 49 |
||
|
Xx. 52 |
||
|
Xx. 54 xxxx. 1, 2 |
||
|
Čl. 55 |
||
|
Xx. 56 |
||
|
Xx. 57 |
||
|
Čl. 58 |
||
|
Kapitola XXX, xx. 76 xxxx. 1, 2 |
||
|
Xx. 94 |
||
|
Xx. 94 |
||
|
Čl. 28 xxxx. 1 |
||
|
Xx. 41 xxxx. 1 |
||
|
Xx. 47 |
||
|
Xx. 49 |
||
|
Xx. 54 xxxx. 1 |
||
|
Xx. 58 |
||
|
Čl. 73 |
||
|
Čl.94 |
||
|
Čl. 28 xxxx. 1 |
||
|
Xx. 41 xxxx. 1 |
||
|
Xx. 47 |
||
|
Xx. 49 |
||
|
Čl. 54 xxxx. 1 |
||
|
Xx. 58 |
||
|
Xx. 73 |
||
|
Xxxxx xxxxxxxx EU (xxx Xxxxx) |
Xxxxx předpisu XX |
|
XXXXXXXX EVROPSKÉHO PARLAMENTU X XXXX (XX) x. 536/2014 xx xxx 16. xxxxx 2014 x xxxxxxxxxx xxxxxxxxxxx xxxxxxxxx léčivých xxxxxxxxx a x xxxxxxx xxxxxxxx 2001/20/XX |
|
|
XXXXXXXX XXXXXX x xxxxxxxxx xxxxxxxxx (EU) x. 1252/2014 ze xxx 28. května 2014 xxxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Xxxx 2001/83/XX, xxxxx jde x xxxxxx x xxxxxx správné xxxxxxx xxxxx xxx xxxxxx xxxxx xxx humánní xxxxxx xxxxxxxxx |
|
| 32004L0027 |
XXXXXXXX XXXXXXXXXX XXXXXXXXXX A XXXX x. 2004/27/ES xx xxx 31. xxxxxx 2004, kterou xx xxxx xxxxxxxx 2001/83/XX x xxxxxx Xxxxxxxxxxxx xxxxxxxxx se xxxxxxxxx xxxxxxxx xxxxxxxxx |
Zdroj textu xxx.xxx.xx


