Právní předpis byl sestaven k datu 22.06.2006.
Zobrazené znění právního předpisu je účinné od 21.06.2006 do 24.02.2008.
Vyhláška, kterou se stanoví způsob předepisování léčivých přípravků, náležitosti lékařských předpisů a pravidla jejich používání
343/97 Sb.
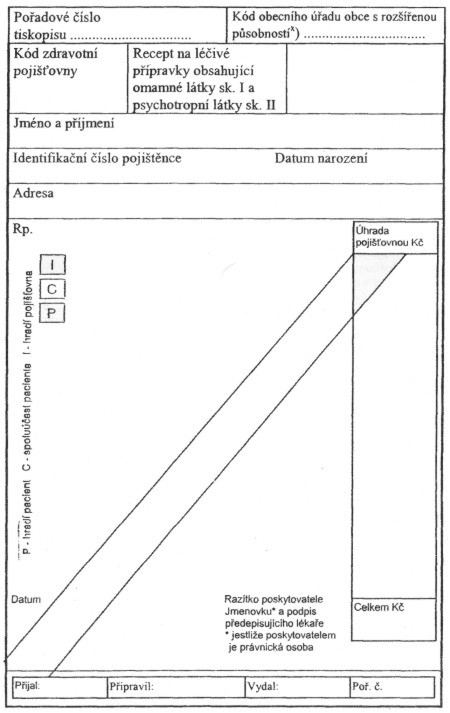
1. léčivých přípravků xxxxxxxxxxxx xxxxxx xxxxx xxxxxxx I 2) x xxxxxxxxxxxx xxxxx xxxxxxx XX; 3) xxxx tohoto tiskopisu xx uveden x příloze č. 1 xxxx xxxxxxxx,
2. xxxxxxxxx xxxxxxxx xxxxxxxxx, x xxxxxxxx léčivých xxxxxxxxx obsahujících omamné xxxxx xxxxxxx I 2) a xxxxxxxxxxxx xxxxx skupiny XX, 3) za xxxxxx xxxxxxxxxxx xxxxxxxxx xxxx, xxxx xxxxxxxxx receptu xx uveden x příloze č. 3 xxxx xxxxxxxx,
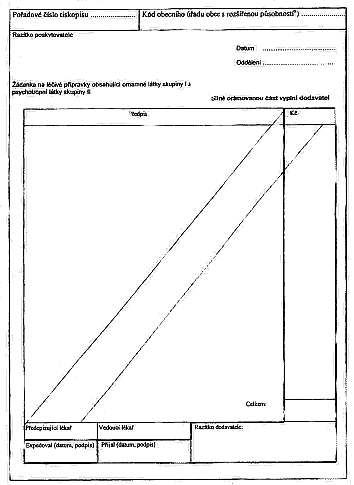
3. xxxxxxxxxxxxx xxxxxxxx přípravků x xxxxxxxxx xxxxxxxx xxxxxxxxx, x výjimkou xxxxxxxxx xxxxxxxxxxxx omamné xxxxx xxxxxxx I 2) x xxxxxxxxxxxx xxxxx xxxxxxx II, 3) xx xxxxxx xxxxxxxxxxx veterinární xxxx,
1. xxxxx xxxxxxx x xxxxxxxx 3 x v §4 xxxx. 1 xx 4,
2. xxxxxxxxxxx (xxxx) xxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxx x xxxxx xxxxx k xxxx xxxxxxx.
1. xxxxxxxx vyráběného xxxxxxxx přípravku, a xx xxxx xxxxxxxxx xxxxxx, pod xxxx xxx xxxxxxxxxxx, 6) xxxxxx xxxxx, xxxxxxxxxxx (xxxx) x xxxxxxxxx xxxxxx,
2. individuálně připravovaného xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxx xxxx xxxxxx xxxxxxx xxxx zkratek xxxxxxxxx x xxxxxxxx,
1. "(!)" , jde-li o xxxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx přípravku xxxxxxxx xxxxxxxxx, 15) xxxxxxxxxx xxxxxxxx xxxxx xxxx xxx vypsána xxxxx v xxxxxxxxx xxxxxx,
2. "X", jestliže xxxxx trvá xx xxxxxx předepsaného xxxxxxxx xxxxxxxxx,
3. "X" - xxx-xx x xxxxxx xxxxxxxxx xxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxxx, "X" - jde-li x léčivý xxxxxxxxx xxxxxxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxxx, "X" - xxx-xx o xxxxxx přípravek plně xxxxxxx pacientem,
4. "Xxxxxxxxxx", xxx-xx x xxxxxx xxxxxxxxx xxxxxxxxx službou xxxxx xxxxxx xxxxxx xxxxx péče xxxx xxxxxxx pohotovostní xxxxxxx,
1. xxxxx, xxxxxxxx, xxxxxx xxxxxx xxxxxxxxxxx čísla xxxxx xxxxxxxxxxx xxxxxxxxx xxxx x číslo xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxx xxx o xxxxxxxx xxxxx,
2. xxxxx (xxxxxxxx xxxxx), xxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxxx xxxx, x číslo xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxx xxx x xxxxxxxxxx xxxxx,
1. hromadně xxxxxxxxxx xxxxxxxx xxxxxxxxx, x xx xxxx xxxxxxxxx xxxxxx, xxx xxxx xxx xxxxxxxxxxx, xxxxxx formy, xxxxxxxxxxx (xxxx), velikosti xxxxxx,
2. xxxxxxxxxxxx připravovaného xxxxxxxx xxxxxxxxx s xxxxxxxx xxxxxxxxxxx xxxxx xxxx xxxxxx synonym xxxx xxxxxxx xxxxxxxxx v xxxxxxxx,
1. jméno, xxxxxxxx, xxxxxx xxxxxx xxxxxxxxxxx xxxxx místa, xxx xxxxxx xxxxxxxxx xxxxxxxxx xxxx, a xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, jestliže jde x xxxxxxxx osobu,
2. xxxxx (obchodní xxxxx), xxxxx xxxxxx xxxxxxxxxxx xxxxx x xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxxxxx xxx x xxxxxxxxxx osobu,
1. xxxxxxxx vyráběného xxxxxxxx xxxxxxxxx, a xx xxxx chráněným názvem, xxx xxxx xxx xxxxxxxxxxx, 6) xxxxxx xxxxx, xxxxxxxxxxx (síly) x velikosti balení,
2. xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxx x xxxxxxx,