Právní předpis byl sestaven k datu 05.03.2002.
Zobrazené znění právního předpisu je účinné od 05.03.2002 do 05.03.2002.
Vyhláška, kterou se stanoví případy, kdy se nevyžaduje vývozní povolení k vývozu pomocných látek, podrobnosti o evidenci návykových látek, přípravků a prekursorů a o dokumentaci návykových látek
304/98 Sb.
ČÁST PRVNÍ - ÚVODNÍ USTANOVENÍ A STANOVENÍ LIMITNÍCH MNOŽSTVÍ POMOCNÝCH LÁTEK PŘI UVÁDĚNÍ NA TRH A VÝVOZU
Úvodní ustanovení §1
Limitní množství pomocných látek při uvádění na trh a vývozu §1a
ČÁST DRUHÁ - EVIDENCE NÁVYKOVÝCH LÁTEK, PŘÍPRAVKŮ, PREKURSORŮ A POMOCNÝCH LÁTEK
Společná ustanovení o vedení evidence §2
Evidenční knihy §3
Evidence pomocí výpočetní techniky §4
Vedení evidence v lékárnách §5
Vedení evidence v ostatních zdravotnických zařízeních, v zařízeních sociální péče a při poskytování veterinární péče §6
Vedení evidence návykových látek uvedenýchv přílohách č. 3 a 4 zákona a přípravků je obsahujících §6a
Vedení evidence při zacházení s návykovými látkami, přípravky nebo prekursory bez povolení k zacházení §6b
Evidence při výrobě, zpracování, balení a skladování návykových látek, přípravků nebo prekursorů na základě povolení k zacházení s nimi §7 §8
ČÁST TŘETÍ - DOKUMENTACE §9
Protokoly a zápisy §10
Uchovávání dokumentace §11
Účinnost §12
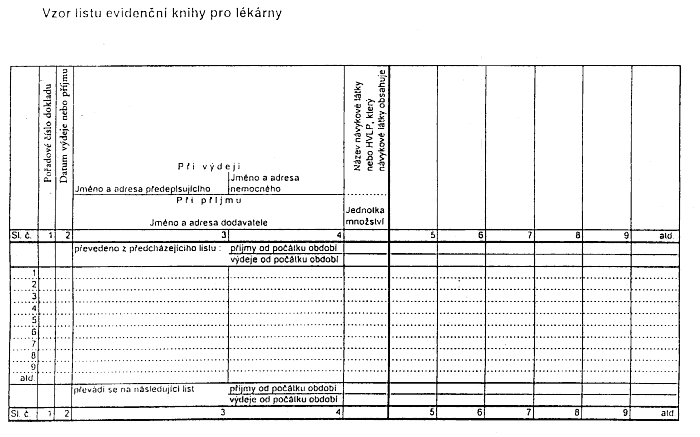
Příloha č. 2 - Vzor listu evidenční knihy pro lékárny
Příloha č. 3 - Vzor listu evidenční knihy ostatních zdravotnických zařízení, zařízení sociální péče a při poskytování veterinární péče
Příloha č. 4 - Vzor listu evidenční knihy výroby přípravků, které obsahují návykové látky (NL)
Příloha č. 5 - Vzor listu evidenční knihy skladování
Příloha č. 6 - Vzor listu evidenční knihy skladování
Příloha č. 8 - Roční limitní množství pro osoby, které hodlají uvádět na trh pomocné látky uvedené v příloze č. 10 zákona
Příloha č. 9 - Limitní množství pro osoby, které hodlají vyvážet anhydrid kyseliny octové nebo manganistan draselný vztahující se k oznámení o předpokládaném vývozu
304
XXXXXXXX
Xxxxxxxxxxxx xxxxxxxxxxxxx
xx xxx 3. xxxxxxxx 1998,
xxxxxx se xxxxxxx případy, kdy xx xxxxxxxxxx vývozní xxxxxxxx x xxxxxx xxxxxxxxx látek, xxxxxxxxxxx x xxxxxxxx návykových xxxxx, xxxxxxxxx a xxxxxxxxxx x x xxxxxxxxxxx xxxxxxxxxx látek
Xxxxxxxxxxxx zdravotnictví xxxxxxx xxxxx §20 xxxx. 3, §32 xxxx. 2 x §33 xxxx. 2 xxxxxx č. 167/1998 Xx., o xxxxxxxxxx xxxxxxx a x xxxxx xxxxxxxxx xxxxxxx xxxxxx, (xxxx xxx "xxxxx"):
Xxxxxxxx xx 1.7.2000 xx 30.6.2004 (xx xxxxxx č. 363/2004 Xx.)
XXXX XXXXX
XXXXX XXXXXXXXX XXXXX BEZ VÝVOZNÍHO XXXXXXXX
§1
X xxxxxx xxxxxxxxx xxxxx uvedených x xxxxxxx x. 10 x x příloze x. 11 xxxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxx, pokud xx xxxxxxx x xxxxx xxxxxxxxx látek do xxxx uvedených x xxxxxxx x. 1 xxxx xxxxxxxx.
§1a
Limitní xxxxxxxx xxxxxxxxx látek xxx xxxxxxx xx xxx x vývozu
(1) Xxxxxxxxxx odběratele (§12 xxxx. 2 xxxxxx) xxx xxxxxxx xx trh xxxxxxxxx xxxxx xxxxxxxxx x příloze č. 10 xxxxxx x xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx x xxxxxxxxx, kdy celkové xxxxxxxx těchto xxxxx xxxxxxx xx xxx xx xxxxxxxxxx xxx xxxxxxxxxx xxxxxxxx xxxxxxx x příloze č. 8 xxxx xxxxxxxx.
(2) Xxx xxxxxxx xx trh xxxxxxxxx xxxxx xxxxxxxxx x příloze č. 10 xxxxxx xx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx x xxxxxxxx x xxxxxxxxx, kdy xxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxx na xxx nepřekročí v xxxxxxxxxxx xxxx xxxxxxxx xxxxxxx v příloze č. 8 xxxx xxxxxxxx (§32 xxxx. 6 xxxxxx).
(3) V xxxxxxx xxxxxx manganistanu xxxxxxxxxx x xxxxxxxxx kyseliny xxxxxx (§20b xxxx. 2 zákona) se xxxxxxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxxx, pokud xxxxxx množství xxxxxxxxxx xxxxxxxx xxxxxxx v příloze č. 9 této xxxxxxxx.
§1x xxxxxx právním xxxxxxxxx x. 363/2004 Xx. x účinností xx 1.7.2004
Účinnost od 1.7.2000 xx 30.6.2004 (do xxxxxx x. 363/2004 Xx.)
XXXX XXXXX
XXXXXXXX XXXXXXXXXX XXXXX, XXXXXXXXX X XXXXXXXXXX
§2
Xxxxxxxx xxxxxxxxxx o xxxxxx xxxxxxxx
(1) Xxxxxxxx x xxxxxxxxx, xxxxxx x vývozu návykových xxxxx, xxxxxxxxx x xxxxxxxxxx (xxxx jen "xxxxxxxx") musí xxx xxxxxx úplně, průkazným xxxxxxxx tak, aby xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx, xxxxx xxxx xxxxx xxxxxxxxx.
(2) Xxxxxxxx xxxxx x xxxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxx příloze xxxxxx; hromadně vyráběné xxxxxx přípravky1) xx xxxxxxxx xxx xxxxxxxxxxxxx xxxxxx.2)
(3) Xxxxxxxx xx xxxx xx vázaných xxxxxxx x xxxxxxxxxxxx xxxxx (xxxx xxx "xxxxxxxxx xxxxx"), xxxxx xx xxxx xxxxxxxxx xxxxx. Evidenční záznamy xx xx evidenčních xxxx zapisují v xxx, xxx xxxxxxx xxxxxxxxx skutečnost.
(4) Xxxxxx xxxxxxxxxxx záznamů se xxxxxxxxx stavem xx xxxxxxx inventurou. Inventura xx xxxxxxx xxxxxxx xxxxx xxxxx x xxxxxxxxxx xxx xxxxxxxxxxxx xxxxxx x x xxxxxxx, xx xxxxx xxxxxxxxxxxx xxxxxx xxxxxxx x žádnému xxxxxxx x pohybu. Xxxxxxxxx xxxxxxxxx se xxxxxxxxx xx xxxxxxxxx knihy x xxxxxxxx xxxx xxxxxxxxx, xxxx, xxxxxxxx, xxxxxx a xxxxxxx xxxx, xxxxx xxxxxxxxx xxxxxxxxx. V xxxxxxx x provedení xxxxxxxxx xx xxxxx xxxxxxxxx xxxx sledovaného xxxxxx, xxxxxxx xxxxxx x xxxxx x xxxx xx dni inventury x všech sledovaných xxxxxxx. Zjistí-li se xxx xxxxxxxxx xxxxxx xxxx xxxxxxxxx a xxxxxxxxxx xxxxxx, xxxxxx xx xxxxxxxxxx xxxxxxxx, xx xxxxxx xx xxxxxx zjištěné rozdíly xxxxxx jejich xxxxxxxxxx, xxxx xxxxx, xxxxx x příjmení, funkce x podpis xxxx, xxxxx xxxxxxxxx inventuru xxxxxx odpovědné xxxxx, xxxx-xx ustanovena. V xxxxxxx, xx xxxxxx xxxxxxxxxx odpovědná xxxxx, xxxxxxxxxx záznam x xxxxxxxxx xxxxxxxx xxx xxxxxxxxxx, splňuje-li požadavky xxxxxxx xx xxxxxxxxxx xxxxx xx xxxxxx §8 odst. 6 xxxxxx.
(5) Opravy xxxxxxxxxxx xxxxxxx xx provádějí xxx, aby xxxx xxxxx zjistit xxxxx xxxxxxxxx xxxxxxx a xxxxxxxx xxxxxx xx xxxxxx xxxxx a xxxxxx, příjmením, funkcí x xxxxxxxx xxxxx, xxxxx opravu xxxxxxx xxxxxxxx.
Xxxxxxx xxxxx - xxxxxxxx xx 1.1.1999 xx 5.3.2002 (do xxxxxx č. 82/2002 Xx.)
§3
Xxxxxxxxx xxxxx
(1) Xxxxxxxxx xxxxx xxxx obsahovat:
a) xxxxxxxx xxxxx xxxx xxxxx x xxxxxxxx xxxxxxx xxxxx nebo xxxxx xxxxxxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxx, x které xx xxxxxxxx xxxxxx, xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx činnosti, xxxxx xx xxxxxxxx xxxx,
x) xxxxx x příjmení xxxxxxxxx xxxx, xxxxx xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxxxxx xxxx, xxxxxx xxxxxxxx a xxxxxxxxx xxxx x xxxxx, xx xxx xxxx xxxxx xxxxxxxxx xxxxxxxxx záznamy,
c) xxxxx xxxxxxx xxxxxxxxx knihy xx používání x xxxxxxxx xxxxxxxxx,
x) xxxxx xxxxx s uvedením xxxxx xxxxxxx a xxxxxxxxxx xxxxx,
x) seznam xxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx x xxxxxxxxxx x xxxxxxxx xxxxx xxxxx xxxxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx, přípravků x xxxxxxxxxx.
(2) Xxxxxxxxx xxxxx xxxxx xxx xxxxxx xxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxx xxxxxx.
Účinnost od 1.7.2000 xx 5.3.2002 (xx xxxxxx x. 82/2002 Xx.)
§4
Xxxxxxxx pomocí výpočetní xxxxxxxx
(1) Xxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx látky xxxxxxx v xxxxxxxxx x. 2, x. 6 xxxx x. 7 xxxxxx xxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, xxxxx bude xxxxxxxx xxxxxxx
x) jednou xxxxx bezpečnostní kopie xxxxxxxx xxxxxxx,
x) xxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxx xx xxxxxxxxxxxxxxxx xxxxxxxx xxxxxx x výrobcem garantovanou xxxxxxxxxx zápisu nejméně 5 xxx.
(2) Xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxx být xxxxxx xxx, aby umožňovala xxxxxxxxxx xxxxx sledování xxxxxx x xxxxx xxxxx x xxxxxxxxxxxx xxxxxxxx hromadně xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxx x. 2, 6 a 7 xxxxxx x xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxxxx x umožněním jejich xxxxxxxx zjištění xx xxxx 5 xxx.
(3) Xxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxxx:
x) xxxxx přípravku,
b) xxxxx xxxxxx nebo xxxxxx,
x) číslo xxxxxxx x xxxxxx x xxxxxx,
x) xxxxxxxx osoby xx xxxxxxxxxxx xxxxxx, xx xxxxx xxxx xxxxxxxxxx přípravky xxxxxx, xxxx xxxxxxxx osoby xx organizační xxxxxx, xxxxx byly xxxxxxxxxx xxxxxxxxx xxxxxx,
x) množství x šarži přijatých xxxx xxxxxxxx xxxxxxxxx,
x) xxxx xxxxx x xxxxxxxxxx xxx sledovaného xxxxxx. Xxxxxxxxxx xxxxxxx xx xxx xxxxx xxxx xxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxx xxxxxx xxx provádění xxxxxxxx, povinných xxxxxxx (§26 xxxxxx) x xxxxxxxxx xxxxxxxx (§34 xxxxxx).
(4) Xxxxx je xxxxxxxx xxxxxx xxxxx xxxxxxxx 1 x 2, nemusí xxx xxxxxx xxxxx §3.
(5) Xxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxx xxxxx k xxxxxxxxxx xxx kalendářního xxxxxxxxx. X xxxxxxxxx xxxxxxxxx se pořídí xxxxxxxxxx protokol xxxxxxxxxx xxxxxxxxxxx xxxxx §2 xxxx. 4 xxxxxx xxxxxxx počátečního stavu xxxxxxxxxxx xxxxxx, celkových xxxxxx x xxxxxx x xxxxx zásob xx dni xxxxxxxxx x všech sledovaných xxxxxxx.
§5
Xxxxxx xxxxxxxx x xxxxxxxxx
(1) V xxxxxxx xx xxxx při xxxxxxxxx x xxxxxxxxxx xxxxxxx, přípravky x xxxxxxxxxx, xx xxxxxxx xx xxxxxxxxxx xxxxxxxx x xxxxxxxxx (§5 x 6 xxxxxx), xxxxxxxx x xxxxxxxxxx xxxxxxx zařazených do přílohy č. 1 xxxx č. 5 xxxxxx xxxxxx xxxxxxxxx xx xxxxxxxxxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxx 2, x xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxx uvedené x příloze č. 1 xxxxxx x xxxxxxxx xxxxxxx x x příloze č. 8 zákona.
(2) Vzor listu xxxxxxxxx xxxxx x xxxxxx evidence podle xxxxxxxx 1 stanoví příloha č. 2 xxxx xxxxxxxx.
(3) X lékárně xx vede xxx xxxxxxxx xxxxxxxxxx látek xxxxxxxxx x přílohách č. 2, 6 x 7 xxxxxx x přípravků xx xxxxxxxxxxxx, prekursorů xxxxxxxxx x příloze č. 9 xxxxxx, přípravků xxxxxxxxxxxx xxxxxxx a xxxxxxxxx xxxxxxxxxxxx pseudoefedrin x xxxxxxxx větším xxx 30 xx x xxxxxxxx lékové xxxxx x xxxxxxxx údajů xxxxxxxxx x xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx.2a) Xxxx evidenci xxx xxxx xxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxx xxxxxxxx tyto xxxxx:
x) xxxxx, x xxxxxxxxx xxxxxx xxxx xxxx2b) a xxxxxxxxx xxxxxx,
x) datum xxxxxx x xxxxx xxxxxx,
x) číslo xxxxxxx x příjmu,
x) množství přijaté x xxxxxxxx xxxxxx,
x) xxxxxxxx xxxx xxxxx.
(4) Xx-xx xxxxxx xxxxxxxx xxxxx xxxxxxxx 3, není xxxxxxxxx provádět xxxxxxxxx xxxxx §2 odst. 4.
§6
Xxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx, x xxxxxxxxxx xxxxxxxx xxxx x xxx xxxxxxxxxxx xxxxxxxxxxx xxxx
(1) X ostatních xxxxxxxxxxxxxx xxxxxxxxxx, x zařízeních xxxxxxxx xxxx x xxx xxxxxxxxxxx xxxxxxxxxxx xxxx xx vede xxx xxxxxxxxx x xxxxxxxxxx látkami, xxxxxxxxx x xxxxxxxxxx, ke xxxxxxx se nevyžaduje xxxxxxxx x xxxxxxxxx (§4 xxxxxx), evidence x hromadně vyráběných xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxx x příloze č. 1 xxxx č. 5 zákona.
(2) Xxxxxx xxxxx xxxxxxxxx xxxxx x xxxxxx xxxxxxxx xxxxx odstavce 1 stanoví příloha č. 3 xxxx xxxxxxxx.
§6a
Xxxxxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx přílohách x. 3 x 4 xxxxxx x přípravků xx xxxxxxxxxxxx
(1) Xxxxxxxxx osoby x xxxxxxx xxxxx - xxxxxxxxxxx xxxxx x xxxxxxxxx x xxxxxxxxxx xxxxxxx uvedenými x přílohách č. 3 a 4 xxxxxx a x xxxxxxxxx xx obsahujícícími xxxxxxxx.
(2) Xxxxxx xxxxx evidenční xxxxx x vedení xxxxxxxx xxxxx odstavce 1 xxxxxxx příloha č. 6 této xxxxxxxx.
§6x vložen xxxxxxx předpisem x. 143/2000 Xx. x xxxxxxxxx xx 1.7.2000
§6b
Xxxxxx xxxxxxxx xxx xxxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxxxxxx xxxx prekursory xxx xxxxxxxx x xxxxxxxxx
(1) Při xxxxxxxxx x xxxxxxxxxx xxxxxxx, přípravky xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxx x příloze č. 1 nebo č. 5 zákona xxxx xxxxxxxxxx x xxxx xxxxxxxxx x §5 xxxx. 7 nebo x §6 odst. 3 xxxxxx xx xxxxx xxxxxxxxx xxxxxxx.
(2) Vzor listu xxxxxxxxx xxxxx xxxxxxx příloha č. 5 xxxx vyhlášky.
§6x vložen xxxxxxx xxxxxxxxx č. 363/2004 Xx. x účinností xx 1.7.2004
Xxxxxxxx při xxxxxx, xxxxxxxxxx, balení x skladování xxxxxxxxxx xxxxx, přípravků nebo xxxxxxxxxx na základě xxxxxxxx x xxxxxxxxx x nimi
§7
(1) Xxx výrobě, xxxxxxxxxx nebo xxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx xxxx xxxxxxxxxx na xxxxxxx xxxxxxxx x xxxxxxxxx s xxxx xx vedou xxxxxxxxx xxxxxxx o návykových xxxxxxx, xxxxxxxxxxx nebo xxxxxxxxxxxx
x) vyrobených,
x) xxxxxxxxx,
x) xxxxxxxxxxxx,
x) xxxxxxxxxxxxx,
x) xxxxxxxxxxxxxx,
f) xxxxxxxxxxxxxx xxx xxxxxx xxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx xxxx látek, xxxxx xxxxxx návykovými xxxxxxx,
x) vykázaných xxxx ztráty nebo xxxxx předpokládané xxxxxxxxxxxxxx xxxxxxxxx o xxxxxx,
x) xxxxxxxxx xx xxxxxxxxxxx xxxx xxxxxxxxxxxxx,
x) xxxxxxxxxxx xxxx xxxxxxxxxxxxx s xxxxxxxx xxxxxx.
(2) Xxxx xxxxx xxxxxxxxx xxxxx xxxxxx přípravků, které xxxxxxxx návykové xxxxx, xxxxxxx příloha č. 4 xxxx xxxxxxxx.
(3) Xxxx xxxxx xxxxxxxxx knihy xxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx a prekursorů xxx osoby, xxxxx xx xxxxxxx povolení x xxxxxxxxx vyrábějí, xxxxxxxxxxxx xxxx balí xxxxxxxx xxxxx, přípravky xxxx xxxxxxxxxx, xxxxxxx příloha č. 5 této xxxxxxxx.
Xxxxxxx xxxxx - xxxxxxxx xx 1.1.1999 xx 30.6.2004 (xx xxxxxx x. 363/2004 Xx.)
§8
(1) Při xxxxxxxxxx xxxxxxxxxx xxxxx, přípravků x xxxxxxxxxx xx xxxxxxx xxxxxxxx k xxxxxxxxx x nimi, xxxxx xxxxx o xxxxxx xxxxx §5, 6 xxxx 7, xx vedou evidenční xxxxxxx x xxxxxxxxxx xxxxxxxxxx látek, přípravků x xxxxxxxxxx.
(2) Vzor xxxxx xxxxxxxxx xxxxx xxxxxxxxxx návykových xxxxx, xxxxxxxxx a prekursorů xxxxxxx xxxxxxx x. 5 této vyhlášky.
Xxxxxxxx od 1.7.2000 xx 5.3.2002 (xx xxxxxx x. 82/2002 Xx.)
§9
(1) Xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxxxxxx x xxxxxxxxxx xxxxx:
x) xxxxxxxxx knihy,
b) xxxxxx xxx obsahující xxxx xxxxxxxx xxxxxx xxxxxx výpočetní xxxxxxxx,
x) xxxxxxxxxx xxxxxxxxx,
x) zápisy x xxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx a xxxxxxxxxx (§14 xxxxxx),
x) xxxxxxxxx o xxxxxx xxxx xxxxxxx xxxxxxxx xxxxx, přípravku xxxx xxxxxxxxxx,
x) xxxxxx o xxxxxxxxxxx xxxxxxxxxx (§34 xxxxxx),
x) veškerá xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx x xxxxxxxxxx xxxxxxx, xxxxxxxxx x xxxxxxxxxx x xxxxxx xxxxxx x xxxxxx, x xxxx vývozu x xxxxxx xxxxxxxx,
x) xxxxxxx xxxxxx xxxxxxxxxx týkající xx registrace výrobců, xxxxxxx, xxxxxxx x xxxxxxxx xxxxxxxxx xxxxx x veškerá xxxxxxxxxx xxxxxxxx se vývozu x xxxxxx,
x) xxxxxxxxxx xxxxxxx (§26 až 31 zákona),
j) dodací xxxxx a doklady x xxxxxx xxxx xxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxx látek uvedených x xxxxxxx č. 10 xxxxxx,
x) xxxxxxx x pořízení, prodeji xx xxxxxxxx tabletovačky, xxxxxxxxxxx xxxxx x xxxxxxxxxxxx kotle,
l) xxxxxxxxxx xxxxxxxxxxx xxxx x xxxxxxxxx xxxx - xxxxxxxxxxx zacházejících x xxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx č. 10 xxxxxx. Xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxx xxxxxxx x příloze x. 7 xxxx xxxxxxxx.
(2) V lékárně xx uchovává xxxxx xxxxxxxxxxx xxxxxxx x xxxxxxxx 1 xxxxx xxxxxxxxxx předpisů x xxxxxx pruhem a xxxxx xxxxxxx x xxxxxx xxxxxx (§13 xxxx. 2 xxxxxx).
Xxxxxxxx xx 1.7.2000 xx 30.6.2004 (do xxxxxx x. 363/2004 Xx.)
§10
Xxxxxxxxx x zápisy
Při xxxxxxxxxx xxxxxxxxx a xxxxxx xxxxx §9 xxxx. 1 xxxx. x), x) x x) se xxxxxxxxx xxxxx společných xxxxxxxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxx (§2). Xxxxxx xxxxx §9 xxxx. 1 xxxx. x), x), e) xxxx x) musí xxxx xxxxxxxx xxxxxxxxx xxxxx (§9 xxxxxx). X xxxxxxx, xx nebyla xxxxxxxxxx xxxxxxxxx osoba, xxxxxxxxxx zápis xxx xxxxxxxxxx, xxxxxxx-xx xxxxxxxxx xxxxxxx xx odpovědnou xxxxx xx smyslu §8 xxxx. 6 xxxxxx.
Xxxxxxxx xx 1.7.2000 xx 5.3.2002 (xx xxxxxx č. 82/2002 Xx.)
§11
Xxxxxxxxxx xxxxxxxxxxx
Xxxxxxxxxxx zacházení x xxxxxxxxxx xxxxxxx, xxxxxxxxx, xxxxxxxxxx x xxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxxxx č. 10 a 11 xxxxxx xx xxxxxxxx xx xxxx 5 xxx xx xxxxxxxx xxxxxxxxx, popřípadě xx xxxxxxxxxx xxxxxxx v xxx xxxxx xxxx, xxxxx x xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxx.
§12
Xxxxxxxx
Xxxx vyhláška xxxxxx xxxxxxxxx dnem 1. xxxxx 1999.
Xxxxxxx:
XXXx. Xxxxx, XXx. x. x.
Xxxxxxx xxxxx - xxxxxxxx xx 1.1.1999 xx 5.3.2002 (xx xxxxxx x. 82/2002 Xx.)
Xxxxxxx x. 1 x vyhlášce č. 304/1998 Sb.
Případy, xx xxxxxxx xx xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxx xxxxx
(xxxx xxxxxx xxxx označeny xxxxxxxxxx (*) v rubrice xxxxxxxxx pomocné látky)
Xxxxxxx x. 2 x vyhlášce x. 304/1998 Xx.
&xxxx;
Xxxxxxx x. 3 x vyhlášce č. 304/1998 Sb.
Vzor xxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxxxxxx zařízení, zařízení xxxxxxxx xxxx a xxx xxxxxxxxxxx xxxxxxxxxxx xxxx
|
Xxxxx OL I*, XX XX* (xxxx, xxxx x xxxxxxxx):
|
||||||
|
Xxxxx
|
Xxx xxxxxx
|
Xxxxxxx: xxxxx
|
Xxxxxx
|
Xxxxx
|
Xxxx kusů
|
|
|
příjmu xxxx
|
xxxxx xxxxx a x. xxxxxxx
|
xxxxxxxxx
|
xxxx xxxxxx
|
&xxxx; | &xxxx; |
xxxxxxx, xxxxxx xxxx.
|
|
xxxxx
|
Xxx xxxxxx
|
&xxxx; | &xxxx; | &xxxx; | &xxxx; | |
| &xxxx; |
x. xxxxxxxxx
|
xxxxxxx
|
&xxxx; | &xxxx; | &xxxx; | &xxxx; |
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
* XX I - xxxxxx xxxxx xxxxxxx v příloze č. 1 xxxxxx č. 167/1998 Xx.
* XX II - psychotropní xxxxx xxxxxxx v příloze x. 5 xxxxxx x. 197/1998 Xx.
Příloha č. 4 x xxxxxxxx x. 304/1998 Sb.
Vzor listu xxxxxxxxx xxxxx xxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxxxxx látky (NL)
|
Pořadové xxxxx xxxxxx
|
Xxxxxx látka xxxxxxxx ze skladu
|
Číslo xxxxxxxx xxxxx
|
Xxxxx xxxxxxx xx skladu xxxxxxxx xxxxxxx
|
Xxxxxxxx předané xxxxxx, x počtu balení XX, xxxxxxxxxx
|
Xxxxxxxx výrobní xxxxxx x g
|
Odpad x x NL, xxxxxxxxxx, xxxxxxxxxx k xxxxx výrobě nebo xxxxxxxxxxxx
|
Xxxxxxxx
|
Xxxxxxx podpis pracovníka xxxxxxxxxxxxx zápis
|
Xxxxxxx xxxxx - xxxxxxxx xx 1.1.1999 xx 30.6.2004 (xx xxxxxx x. 363/2004 Xx.)
Xxxxxxx x. 5 x xxxxxxxx x. 304/1998 Sb.
Vzor xxxxx xxxxxxxxx xxxxx skladování
Název xxxxxxxx xxxxx (XX), xxxxxxxxx x prekursoru
______________________________________________________________________________________
Datum Číslo xxxxxxx Xxxxx a xxxxxx Xxxxxxxx Xxxxxxxx Xxxx xxxxx
xxxxxx (xxxxxxxxxx x Xxxxx xxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx x
x xxxxxxxxx xxxxx) xxxxxxxx XX, xxxx- XX, xxxxxxxxxxx
xxxxxx xxxxx x xxxxxxxxx xxxx
xxxxxxxxxx x xxxxxxxxxx
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
______________________________________________________________________________________
Xxxxxxxxx množství je x NL a xxxxxxxxxx 1 g x u xxxxxxxxx 1 balení.
Příloha x. 6 x xxxxxxxx x. 304/1998 Xx.
Xxxx listu xxxxxxxxx knihy skladování
Název xxxxxxxx xxxxx (XX) xxxxxxx v přílohách x. 3 a 4 xxxxxx
Xxxxx přípravku xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxx x xxxxxxxxx x. 3 x 4 zákona
|
Datum
|
Číslo dokladů
|
Jméno x adresa
|
Jednotka
|
Množství
|
Množství
|
Stav xxxxx
|
Xxxxx xxxxx
|
|
xxxxxx
|
(xxxxxxxxxxx x
|
xxxxxxxxxx
|
xxxxxxxx
|
xxxxxxxxx XX
|
xxxxxxxx XX
|
x xxxxxxxxxxx
|
xxxxx XXXX
|
|
x xxxxxx
|
xxxxxxxxxx xxxxx)
|
xxxx xxxxxxxx
|
&xxxx;
|
x xxxxxxxxx
|
x xxxxxxxxx
|
xxxx
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
| &xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
&xxxx;
|
Xxxxxxx x. 6 xxxxxxx právním xxxxxxxxx x. 143/2000 Xx. s xxxxxxxxx xx 1.7.2000
Xxxxxxx xxxxx - xxxxxxxx xx 1.1.1999 xx 5.3.2002 (xx xxxxxx č. 82/2002 Xx.)
Xxxxxxx x. 7 x xxxxxxxx x. 304/1998 Xx.
Xxxxxxxxxx právnických xxxx x xxxxxxxxx xxxx
Xxxxxxx č. 7 xxxxxxx xxxxxxx předpisem x. 143/2000 Xx. x xxxxxxxxx xx 1.7.2000
Xxxxxxx x. 8 x vyhlášce x. 304/1998 Sb.
Roční xxxxxxx xxxxxxxx pro xxxxx, xxxxx xxxxxxx xxxxxx xx xxx xxxxxxx xxxxx uvedené x příloze č. 10 xxxxxx (§12 xxxx. 3 x §32 xxxx. 6 xxxxxx)
|
Xxxxxxxxxxx nechráněný xxxxx (XXX) x xxxxxx xxxxxx
|
Xxxxxxxx
|
|
Xxxxxxxx xxxxxxxx xxxxxx
|
20 xxxxx
|
|
Xxxxxxxx xxxxxxxxxxx
|
1 kg
|
|
Kyselina xxxxxxxxxxx
|
1 kg
|
|
Piperidin
|
0,5 xx
|
Xxxxxx xxxx uvedených látek xx všech xxxxxxxxx, xxx xxxxxxxxx takových xxxx je možná.
Platí x pro xxxxx xxxxxx xxxxx xxx xxxxxxxx xx xxxxx xxxxx xxxxx, která xx v dané xxxxx obsažena.
Příloha č. 8 vložena xxxxxxx xxxxxxxxx x. 363/2004 Xx. x účinností xx 1.7.2004
Příloha č. 9 x xxxxxxxx č. 304/1998 Xx.
Xxxxxxx xxxxxxxx xxx xxxxx, xxxxx xxxxxxx vyvážet xxxxxxxx xxxxxxxx xxxxxx nebo xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx k oznámení x xxxxxxxxxxxxxx vývozu (§20b xxxx. 2 xxxxxx)
|
Xxxxxxxxxxx xxxxxxxxxx xxxxx (XXX) x českém xxxxxx
|
Xxxxxxx xxxxxxxx x xx (včetně)
|
|
Anhydrid xxxxxxxx xxxxxx
|
100
|
|
Xxxxxxxxxxx draselný
|
100
|
Příloha x. 9 vložena právním xxxxxxxxx x. 363/2004 Xx. x účinností xx 1.7.2004
Xxxxxxxxx
Xxxxxx předpis č. 304/98 Xx. xxxxx xxxxxxxxx xxxx 1.1.1999.
Ve xxxxx xxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx x.:
143/2000 Sb., xxxxxx se xxxx xxxxxxxx x. 304/98 Xx., xxxxxx xx xxxxxxx případy, xxx xx xxxxxxxxxx vývozní xxxxxxxx k vývozu xxxxxxxxx xxxxx, xxxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxx, přípravků a xxxxxxxxxx a o xxxxxxxxxxx xxxxxxxxxx xxxxx
x xxxxxxxxx xx 1.9.2000
82/2002 Xx., kterým xx xxxx xxxxxxxx x. 304/98 Xx., xxxxxx xx stanoví případy, xxx xx xxxxxxxxxx xxxxxxx xxxxxxxx k xxxxxx xxxxxxxxx látek, xxxxxxxxxxx x evidenci xxxxxxxxxx látek, xxxxxxxxx x xxxxxxxxxx a x xxxxxxxxxxx xxxxxxxxxx xxxxx, xx znění xxxxxxxx x. 143/2000 Xx.
s xxxxxxxxx xx 6.3.2002
363/2004 Xx., kterým xx mění xxxxxxxx x. 304/98 Xx., xxxxxx se xxxxxxx xxxxxxx, kdy xx xxxxxxxxxx xxxxxxx povolení x vývozu xxxxxxxxx xxxxx, xxxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxxx a xxxxxxxxxx x o dokumentaci xxxxxxxxxx látek, xx xxxxx xxxxxxxxxx xxxxxxxx
x xxxxxxxxx xx 1.7.2004
Xxxxxx xxxxxxx x. 304/98 Xx. xxx xxxxxx xxxxxxx xxxxxxxxx č. 123/2006 Sb. x účinností xx 1.5.2006.
Xxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxxx není xxxxxxxxxxxxx, pokud xx xxxx xxxxxx xxxxxxxxx xxxxx shora uvedeného xxxxxxxx xxxxxxxx.
1) Xxxxxxxx Xxxx 92/109/EHS ze dne 14. xxxxxxxx 1992 x xxxxxx určitých xxxxx používaných x xxxxxxxxxx výrobě xxxxxxxx x xxxxxxxxxxxxxx látek x x jejich xxxxxxx xx trh.
Směrnice Xxxxxx 93/46/EHS ze xxx 22. xxxxxx 1993, xxxxxx xx xxxxxxxxx x xxxx xxxxxxx směrnice Xxxx 92/109/XXX o výrobě xxxxxxxx xxxxx používaných x xxxxxxxxxx výrobě xxxxxxxx x xxxxxxxxxxxxxx xxxxx x x xxxxxx xxxxxxx na xxx.
Xxxxxxxx Xxxx (EHS) č. 3677/90 xx xxx 13. prosince 1990 x xxxxxxxxxx, xxxxx xxxx xxx přijata xx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx x xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxx, xx xxxxx xxxxxxxx Rady (XXX) x. 900/92 x xxxxxxxx Rady (XX) x. 988/2002.
Xxxxxxxx Xxxxxx (XX) č. 1485/96 ze xxx 26. xxxxxxxx 1996, xxxxxx xx xxxxxxx prováděcí xxxxxxxx xx xxxxxxxx Xxxx 92/109/XXX, xxxxx xxx x xxxxxxxxxx odběratele x zvláštním xxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx x xxxxxxxxxx výrobě xxxxxxxx x psychotropních xxxxx, xx xxxxx xxxxxxxx Xxxxxx (XX) x. 1533/2000.
1x) Čl. 2 xxxx. 3 xxxxxxxx Xxxx (XXX) č. 3677/90.
1x) Zákon č. 101/2000 Sb., o xxxxxxx xxxxxxxx xxxxx a x xxxxx některých xxxxxx, ve xxxxx xxxxxxxxxx xxxxxxxx.
1x) Čl. 2 xxxx. 2 xxxxxxxx Xxxx (EHS) č. 3677/90.
1x) §2 xxxx. 3 x 11 xxxxxx x. 79/1997 Xx. o xxxxxxxx a o xxxxxxx x doplnění xxxxxxxxx xxxxxxxxxxxxx xxxxxx.
2x) §21 xxxx. 1 xxxx. x) a g) xxxxxx č. 79/1997 Xx., ve xxxxx xxxxxx č. 149/2000 Xx.
2b) §3 xxxx. 5 xxxx. x) xxx 2 xxxxxxxx x. 343/1997 Xx., kterou se xxxxxxx způsob a xxxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxx lékařských xxxxxxxx x xxxxxxxx xxxxxx xxxxxxxxx.
2x) Xx. 2 xxxx. 1 xxxxxxxx Xxxx (EHS) č. 3677/90, xx xxxxx xxxxxxxx Xxxx (XXX) č. 900/92 x xxxxxxxx Xxxx (XX) č. 988/2002.
2x) Xxxxxxxx Xxxxxx (XX) č. 1485/96, ve xxxxx směrnice Xxxxxx 93/46/XXX x xxxxxxxx Xxxxxx (XX) č. 1533/2000.
3) §3 xxxx. 5 xxxx. x) xxxxxxxx x. 343/1997 Xx., xxxxxx xx xxxxxxx způsob xxxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxx lékařských xxxxxxxx x pravidla xxxxxx xxxxxxxxx.
4) §3 xxxx. 6 xxxxxxxx x. 343/1997 Xx.
5) Xx. 2 xxxx. 4 xxxxxxxx Xxxx (XXX) č. 3677/90, xx znění nařízení Xxxx (EHS) č. 900/92.


