Věstník MŽP ČR, částka 4/2019
METODICKY POKYN
Ministerstva životního prostředí
k postupu podle zákona č. 93/2018 Sb., o podmínkách využívání genetických zdrojů podle Nagojského protokolu
ČÁST PRVNÍ
Kapitola I Důležité dokumenty
Kapitola II Hlavní pojmy
Kapitola III Příslušné orgány v České republice
ČÁST DRUHÁ Hlavní povinnosti uživatelů
Kapitola IV Postup s náležitou péčí
Kapitola V Prohlášení o náležité péči
Kapitola VI Sbírky genetických zdrojů
Kapitola VII Kontroly
ČÁST TŘETÍ Příručka pro uživatele / otázky a odpovědi - informační systém DECLARE pro Nagojský protokol
Úvod
Ministerstvo životního prostředí vydává tento metodický pokyn s cílem usnadnit uživatelům genetických zdrojů v České republice praktické naplňování požadavků právních předpisů souvisejících s Nagojským protokolem o přístupu ke genetickým zdrojům a spravedlivém a rovnocenném sdílení přínosů plynoucích z jejich využívání (dále jen „Nagojský protokol“). Na přípravě pokynu se podílela pracovní skupina složená ze zástupců dotčených resortů, vědeckých institucí a dalších sektorů. Objasňuje hlavní povinnosti, které se získáváním a využíváním genetických zdrojů souvisejí. Je určen především uživatelům genetických zdrojů, nicméně obsahuje důležité informace i pro držitele sbírek genetických zdrojů. Týká se také využívání tradičních znalostí souvisejících s genetickými zdroji, ačkoliv se z důvodu zestručnění dokumentu obvykle pojednává pouze o genetických zdrojích. Povinnosti vztahující se na využívání genetických zdrojů se na tradiční znalosti související s genetickými zdroji použijí obdobně.
Přístup ke genetickým zdrojům a sdílení přínosů plynoucích z jejich využívání jsou jedním ze tří hlavních cílů Úmluvy o biologické rozmanitosti. Konkrétně tento cíl rozvádí článek 15, který mimo jiné uznává suverénní právo států na jejich přírodní zdroje a jejich pravomoc stanovit podmínky přístupu ke genetickým zdrojům. Za účelem naplnění tohoto cíle byl v roce 2010 sjednán Nagojský protokol, který vstoupil v platnost 12. října 2014. Protokol má zajistit transparentní pravidla pro přístup ke genetickým zdrojům a spravedlivé sdílení přínosů mezi jejich poskytovateli a uživateli. Úlohou smluvních stran protokolu je také zajistit, aby uživatelé na jejich území výše uvedená pravidla dodržovali.
EU jako smluvní strana Nagojského protokolu přijala v souvislosti s otázkou dodržování pravidel uživateli na území EU nařízení Evropského parlamentu a Rady (EU) č. 511/2014 ze dne 16. dubna 2014 o opatřeních pro dodržování pravidel, která vyplývají z Nagojského protokolu o přístupu ke genetickým zdrojům a spravedlivém a rovnocenném sdílení přínosů plynoucích z jejich využívání, ze strany uživatelů v Unii (dále jen „nařízení EU“), a prováděcí nařízení Komise (EU) 2015/1866 ze dne 13. října 2015, kterým se stanoví prováděcí pravidla, pokud jde o registr sbírek, monitorování dodržování pravidel ze strany uživatelů a osvědčené postupy (dále jen „prováděcí nařízení Komise“). V návaznosti na tyto předpisy přijala Česká republika zákon č. 93/2018 Sb., o podmínkách využívání genetických zdrojů podle Nagojského protokolu, účinný od 20. června 2018 (dále jen „zákon“), který zajišťuje aplikaci implementovaných nařízení EU z hlediska institucionálního, procedurálního a sankčního.
Evropská komise (dále jen „Komise“) dále vydala Metodický pokyn k oblasti působnosti nařízení a hlavním povinnostem uživatelů v Unii a připravuje metodické pokyny pro uživatele z jednotlivých dotčených sektorů. Tento metodický pokyn pak doplňuje a upřesňuje výše uvedené dokumenty v kontextu českého prostředí.
ČÁST PRVNÍ
Kapitola I
Důležité dokumenty
Závazné právní předpisy
- nařízení Evropského parlamentu a Rady (EU) č. 511/2014 ze dne 16. dubna 2014 o opatřeních pro dodržování pravidel, která vyplývají z Nagojského protokolu o přístupu ke genetickým zdrojům a spravedlivém a rovnocenném sdílení přínosů plynoucích z jejich využívání, ze strany uživatelů v Unii
- prováděcí nařízení Komise (EU) 2015/1866 ze dne 13. října 2015, kterým se stanoví prováděcí pravidla, pokud jde o registr sbírek, monitorování dodržování pravidel ze strany uživatelů a osvědčené postupy
- zákon č. 93/2018 Sb., o podmínkách využívání genetických zdrojů podle Nagojského protokolu
Metodické pokyny
Metodický pokyn k oblasti působnosti nařízení a hlavním povinnostem uživatelů v Unii (dále jen „metodický pokyn Komise“) vydala Evropská komise v roce 2016. Dokument je dostupný na webových stránkách: https://eur-lex.europa.eu/legal-content/CS/TXT/PDF/?uri=CELEX:52016XC0827(01)&from=EN.
S ohledem na průběžné získávání praktických zkušeností s prováděním výše uvedených právních předpisů se očekává, že Komise vydá upravenou a aktualizovanou verzi metodického pokynu a také nové pokyny pro konkrétní skupiny uživatelů.
Tyto metodické pokyny nejsou právně závazné, nicméně slouží uživatelům, ale i příslušným orgánům ve všech členských státech EU jako výkladové pomůcky k objasnění některých aspektů nařízení EU a zejména tzv. postupu s náležitou péčí. Jejich cílem je zajistit jednotnou aplikaci právní úpravy v celé EU. Metodický pokyn Ministerstva životního prostředí pouze doplňuje metodické pokyny Komise a od výkladu zastávaného Evropskou komisí se nemůže odchýlit. Stejně tak tento metodický pokyn nijak nenahrazuje, nedoplňuje ani nemění výše uvedené závazné právní předpisy.
Kapitola II
Hlavní pojmy
Definice klíčových termínů vymezuje Úmluva o biologické rozmanitosti, Nagojský protokol a nařízení EU. Podrobněji jsou rozvedeny také v metodickém pokynu Komise. Tento slovníček představuje syntézu a vysvětlení uvedených definic.
Informační systém ABS (Access and Benefit-Sharing Clearing-House): Informační systém pro přístup a sdílení přínosů neboli IS ABS, dostupný na adrese https://absch.cbd.int, je mezinárodní informační platforma pro výměnu všech důležitých informací o přístupu a sdílení přínosů mezi aktéry v různých zemích, které jsou smluvními stranami Nagojského protokolu. To, aby se významné množství informací sdílelo prostřednictvím IS ABS, je právním požadavkem vyplývajícím ze samotného protokolu. Protokol například vyžaduje, aby smluvní strany poskytly IS ABS informace o právních předpisech či regulačních požadavcích týkajících se přístupu (pokud nějaké přijaly).
Na stránkách informačního systému ABS lze zobrazit profily jednotlivých zemí obsahující mimo jiné informace o tom, zda daná země je či není smluvní stranou Nagojského protokolu, kontaktní údaje národních kontaktních míst i příslušných orgánů zodpovědných za vydávání povolení k přístupu či obdobných dokumentů, odkazy na národní informační portály, informace o legislativě související s Nagojským protokolem či národní zprávy o provádění Nagojského protokolu.
Dále jsou zde (pod záložkou Virtual Library Resource) k dispozici také články a publikace související s problematikou Nagojského protokolu, vzorová smluvní ustanovení, příklady smluvní praxe aj.
Mezinárodně uznávaný certifikát o shodě (Internationally Recognised Certificate of Compliance / IRCC): povolení k přístupu (nebo obdobný dokument) dokládající rozhodnutí o udělení předchozího informovaného souhlasu (PIC) a sjednání vzájemně dohodnutých podmínek (MAT), které vydal příslušný orgán poskytující země a zveřejnil jej v informačním systému ABS.
Národní kontaktní místo (National Focal Point / NFP): kontaktní osoba/instituce, jejíž povinností je podle čl. 13 Nagojského protokolu poskytnout zájemcům o genetické zdroje informace o postupech pro získání předchozího informovaného souhlasu (PIC) a sjednání vzájemně dohodnutých podmínek (MAT), případně o příslušných orgánech v dané zemi.
Oblast působnosti (scope of application): není-li uvedeno jinak, rozumí se jí v tomto dokumentu oblast působnosti nařízení EU, tak jak ji vymezuje v čl. 2. Vztahuje se na genetické zdroje, které kumulativně splňují tyto podmínky: jsou předmětem využívání v EU, byly získány po 12. říjnu 2014 ze země, jež je v době získání těchto zdrojů smluvní stranou Nagojského protokolu, a zároveň se na tyto genetické zdroje vztahují právní předpisy nebo regulační požadavky týkající se přístupu a sdílení přínosů. Mimo oblast působnosti jsou lidské genetické zdroje a zdroje, na něž se vztahuje speciální mezinárodní nástroj pro přístup a sdílení přínosů. Podrobněji viz také metodický pokyn Komise, kap. 2, str. 3-10 a příloha I.
Právní předpisy a regulační požadavky zemí poskytujících genetické zdroje mohou mít širší oblast působnosti než nařízení EU. Očekává se, že uživatel bude tyto předpisy plně respektovat, nicméně jejich dodržování nebude předmětem kontroly ze strany příslušných orgánů v EU, budou-li dané genetické zdroje mimo oblast působnosti nařízení EU.
Postup s náležitou péčí (Due Diligence): v obecném smyslu se jedná o takový postup, kdy uživatel plní své povinnosti svědomitě a s vynaložením úsilí přiměřeného okolnostem, aby předešel rizikům a odpovědnosti za zanedbání. Povinnost postupovat s náležitou péčí podle nařízení EU znamená, že se uživatelé mají ujistit, že mají dostatek informací dokládajících, že získání a využívání genetických zdrojů probíhá v souladu s právními předpisy či regulačními požadavky poskytující země. Postup s náležitou péčí se netýká jen jednotlivých případů, kdy uživatel získává a využívá genetické zdroje, ale v obecném smyslu také procesů a pravidel v rámci organizace, které by měly být nastaveny tak, aby postupu s náležitou péčí napomáhaly a předcházely případům, kdy by mohlo k porušení náležité péče dojít. Podrobněji viz také metodický pokyn Komise, kap. 3.1, str. 10 a 11.
Předchozí informovaný souhlas (Prior Informed Consent / PIC): doklad, který pro genetický zdroj, o jehož získání uživatel usiluje, vydá v souladu s příslušnou národní legislativou a na základě žádosti ze strany uživatele příslušný orgán poskytující země. Jedná se tedy o potvrzení na formuláři dané instituce.
Příslušný orgán (Competent National Authority / CNA): instituce ustanovená platným vnitrostátním právem a správními a politickými opatřeními, která v dané zemi zastupuje poskytovatele na národní, regionální nebo místní úrovni. Příslušný orgán odpovídá za umožňování přístupu nebo vydávání písemných dokladů osvědčujících splnění požadavků pro přístup, poskytuje poradenství v oblasti postupů a požadavků pro získání předchozího informovaného souhlasu a sjednání vzájemně dohodnutých podmínek.
Ve smyslu nařízení EU se příslušným orgánem rozumí instituce, která je v daném státě odpovědná za uplatňování tohoto nařízení, tedy obvykle státní orgán, jehož povinností je monitorovat, zda uživatelé na území daného státu dodržují svoje povinnosti podle nařízení EU.
Sbírka (collection): za sbírku se považuje soubor získaných vzorků genetických zdrojů a souvisejících informací, který je shromážděn a uchováván. Může být v držení veřejných nebo soukromých subjektů.
Specializovaný mezinárodní nástroj (specialised International access and benefit-sharing instrument): podle čl. 4 odst. 4 Nagojského protokolu se jedná o takový nástroj, který se vztahuje na přístup a sdílení přínosů, je v souladu s protokolem a neměl by být dotčen prováděcími předpisy, které jsou k protokolu přijímány. Za takový nástroj se podle nařízení EU považuje Mezinárodní smlouva o rostlinných genetických zdrojích pro výživu a zemědělství (ITPGRFA), sjednaná v roce 2001 v rámci Organizace spojených národů pro výživu a zemědělství (FAO), a Rámec pro připravenost na pandemii chřipky, přijatý v roce 2011 v rámci Světové zdravotnické organizace (WHO). Je možné, že v budoucnu se seznam těchto specializovaných mezinárodních nástrojů rozšíří. Podrobněji viz také metodický pokyn Komise, kap. 2.3.1., str. 6 a kap. 5.2., str. 16-18.
Tradiční znalosti (Traditional Knowledge): tradiční znalosti, které vlastní domorodé nebo místní společenství a které mají význam pro využívání genetických zdrojů a jako takové jsou popsány ve vzájemně dohodnutých podmínkách (MAT) vztahujících se na využívání daných genetických zdrojů. Podrobněji viz také metodický pokyn Komise, str. 3 a kap. 2.3.2., str. 7.
Za účelem zestručnění tohoto metodického pokynu se obvykle zmiňují pouze genetické zdroje. Pokyny pro jejich využívání se ovšem použijí obdobně i pro tradiční znalosti s nimi související.
Uživatel (User): fyzická nebo právnická osoba, která využívá genetické zdroje, tedy provádí výzkum a vývoj v oblasti genetického nebo biochemického složení (a to i prostřednictvím biotechnologií) jakéhokoliv materiálu rostlinného, živočišného, mikrobiálního nebo jiného původu obsahujícího funkční jednotky dědičnosti.
V případě organizací, kde probíhá využívání genetických zdrojů, se doporučuje vymezit odpovědnost za postup s náležitou péčí vnitřními předpisy. Výzkumné aktivity provádějí jednotliví pracovníci, nicméně obvykle se tak děje v rámci projektů, do nichž je zapojena organizace jako celek, a odpovědnost tak nese její statutární zástupce. Je proto vhodné, aby povolení k přístupu bylo sjednáváno jménem organizace, na kterou se pak bude pohlížet jako na uživatele. Záleží také na vnitřní struktuře dané organizace a na rozhodnutí, zda bude jako uživatel vystupovat organizace jako celek nebo její jednotlivá pracoviště (ústav, katedra atp.). Obdobné rozhodnutí ohledně odpovědnosti by každá organizace měla provést i před registrací do systému DECLARE.
Podrobněji viz také metodický pokyn Komise, kap. 2.4., str. 10 a návod pro používání systému DECLARE v části druhé tohoto pokynu (2. Jak „organizace“ fungují v systému DECLARE?).
Využívání (Utilisation): výzkum a vývoj v oblasti genetického nebo biochemického složení genetických zdrojů (a to i prostřednictvím biotechnologií). Z hlediska Nagojského protokolu se nerozlišuje, zda se jedná o výzkum základní, komerční atd. S ohledem na širokou definici a obtížné určení, zda lze danou aktivitu definovat jako výzkumnou z pohledu Nagojského protokolu a souvisejících předpisů EU, se metodické pokyny Komise (vydané i v přípravě) pokoušejí předložit jasnější vymezení. Metodický pokyn např. při definici výzkumu odkazuje na Frascatiho manuál (vydaný OECD v roce 2002) a uvádí příklady konkrétních situací a jejich interpretaci z hlediska nařízení EU. Viz metodický pokyn Komise, kap. 2.3.3., str. 7¬10.
Nejistota ohledně přesného vymezení některých aktivit ovšem přetrvává a je předmětem diskusí v rámci Komise i členských států EU s cílem nalézt jednotný výklad. Výsledná interpretace těchto otázek bude zveřejněna v rámci aktualizovaných či nových metodických pokynů Komise.
Ukázkou projednávaných otázek mohou být taxonomické aktivity za účelem identifikace genetického materiálu, u nichž se má za to (ačkoliv tento výklad nebyl dosud zveřejněn ve schválených metodických pokynech), že stojí mimo oblast působnosti nařízení EU i v případě použití molekulárních metod.
Bez ohledu na vymezování působnosti nařízení EU je třeba mít na zřeteli, že země poskytující genetické zdroje mohou využívání ve smyslu Nagojského protokolu definovat odlišným způsobem. Postup v souladu s legislativou těchto zemí tedy předpokládá také respektování těchto případných odlišných definic. V konkrétním případě taxonomie to může znamenat, že pokud země poskytující genetický zdroj tuto aktivitu za využívání považuje, je třeba požádat o povolení k přístupu ke genetickému zdroji podle právních předpisů této země. Postup s náležitou péčí ovšem v případech mimo oblast působnosti nařízení EU není třeba dokládat.
Vzájemně dohodnuté podmínky (Mutually Agreed Terms / MAT): smlouva nebo obdobný typ dokumentu uzavřená mezi poskytovatelem genetických zdrojů a jejich uživatelem. Dokument by měl vymezovat přesné podmínky pro sdílení přínosů z využívání genetického zdroje. Dále může obsahovat podmínky a pravidla pro přístup či využívání i pro nakládání s výsledky využívání.
Kapitola III
Příslušné orgány v České republice
Úlohu příslušných orgánů ve smyslu čl. 6 nařízení EU vymezují §6 a 7 zákona. Gestorem Nagojského protokolu v ČR a příslušným orgánem, který je odpovědný za uplatňování nařízení EU v České republice, je Ministerstvo životního prostředí. Ministerstvo také poskytuje uživatelům genetických zdrojů podporu a konzultace v případě dotazů, nejasností či problémů při komunikaci s příslušnými orgány zemí poskytujících genetické zdroje.
Národní kontaktní osoba: Eliška Rolfová, Odbor druhové ochrany a implementace mezinárodních závazků, oddělení mezinárodních úmluv (eliska.rolfova@mzp.cz nebo abs@mzp.cz, tel.: 267 122 030; platnost údajů doporučujeme ověřit na webu).
Web: https://www.mzp.cz/cz/nagojsky_protokol
Působnost příslušného orgánu, pokud jde o kontroly, dále vykonává Česká inspekce životního prostředí, Odbor ochrany přírody, lesa a CITES, oddělení ochrany přírody.
Web: http://www.cizp.cz/
ČÁST DRUHÁ
Hlavní povinnosti uživatelů
Nařízení EU ukládá uživatelům genetických zdrojů v Unii dvě hlavní povinnosti: postupovat při využívání genetických zdrojů s náležitou péčí (čl. 4) a podávat o tomto postupu prohlášení (čl. 7).
Podrobný návod, jak tyto povinnosti plnit, představuje metodický pokyn Komise, zejména v kap. 3, str. 10-13 (dostupný na webu: https://eur-lex.europa.eu/legal-content/CS/TXT/PDF/?uri=CELEX:52016XC0827(01)&from=EN). Níže uvedené informace tento návod stručně shrnují a upřesňují pro potřeby uživatelů v ČR.
Kapitola IV
Postup s náležitou péčí
Požadavek postupovat s náležitou péčí znamená pro uživatele zejména administrativní povinnost získávat a uchovávat, případně předávat dalším uživatelům informace dokládající:
- že byl k využívaným genetickým zdrojům uplatněn přístup v souladu s platnými právními předpisy poskytující země (tedy legální původ genetického materiálu),
- že jsou genetické zdroje využívány v souladu s případnými podmínkami dohodnutými s poskytovatelem materiálu (tj. vzájemně dohodnutými podmínkami, MAT),
- že jsou na základě vzájemně dohodnutých podmínek spravedlivě a rovnocenně sdíleny přínosy plynoucí z využívání.
Zároveň se doporučuje vždy dodržovat i případné další právní předpisy země poskytující genetické zdroje, ačkoliv mohou povinnosti z nich vyplývající přesahovat rámec nařízení EU.
Níže uvedený postup představuje soubor konkrétních kroků pro uživatele, kteří uplatňují přístup ke genetickým zdrojům. Doporučuje se ovšem, aby se uživatelé v rámci svých organizací zaměřili v první řadě na obecná opatření, která mohou přijmout s cílem postupovat s náležitou péčí. Tato opatření mohou zahrnovat například školení výzkumných i administrativních pracovníků o problematice Nagojského protokolu, souvisejících právních předpisech a o povinnostech z nich vyplývajících. Dále se může jednat o přezkoumání stávajících a přijetí nových interních pokynů, postupů, zásad atp., určení odpovědných osob, nastavení vnitřních mechanismů pro kontrolu nebo sledování získávaného a poskytovaného genetického materiálu, systémů prevence a zmírňování rizik aj. Volba nejvhodnějších opatření by měla vycházet z vyhodnocení stávajících procesů v rámci organizace a měla by být přiměřená objemu genetického materiálu v oblasti působnosti nařízení EU, s nímž daná organizace nakládá.
Je-li uživatel členem sdružení uživatelů, které vytvořilo kombinaci postupů, nástrojů nebo mechanismů, na niž dohlíží a která byla Evropskou komisí uznána jako osvědčený
postup (podrobněji viz níže, Osvědčené postupy), je vhodné tento osvědčený postup uplatňovat.
Požadovaná dokumentace
Při zavádění obecných opatření, pravidel či vymezování odpovědnosti by se organizace měly zaměřit také na způsoby evidence dokumentů souvisejících s genetickými zdroji a jejich archivace. U genetického materiálu je třeba evidovat následující informace:
- Genetické zdroje mimo oblast působnosti nařízení EU: základní evidence, tzn. popis materiálu, místo a datum přístupu.
- Genetické zdroje v oblasti působnosti: informace a dokumenty uvedené v čl. 4 odst. 3 nařízení EU (viz také kap. 3.3, str. 12 a 13 metodického pokynu Komise), tedy mezinárodně uznávaný certifikát o shodě, nebo, není-li k dispozici, informace a příslušné dokumenty ohledně:
- data a místa přístupu ke genetickým zdrojům nebo tradičním znalostem souvisejícím s genetickými zdroji,
- popisu genetických zdrojů nebo tradičních znalostí souvisejících s využitými genetickými zdroji,
- zdrojů, ze kterých byly genetické zdroje nebo tradiční znalosti související s genetickými zdroji přímo získány, jakož i ohledně následných uživatelů genetických zdrojů nebo tradičních znalostí souvisejících s genetickými zdroji,
- existence nebo neexistence práv a povinností týkajících se přístupu a sdílení přínosů, včetně práv a povinností týkajících se následných aplikací a uvedení na trh,
- povolení k přístupu v příslušných případech,
- vzájemně dohodnutých podmínek, včetně ujednání o sdílení přínosů v příslušných případech.
Za určitých okolností mohou genetické zdroje spadat do oblasti působnosti nařízení EU, ale příslušné právní předpisy poskytující země nevyžadují pro tento konkrétní materiál nebo způsob využití, aby uživatel získal předchozí informovaný souhlas (PIC) a sjednal vzájemně dohodnuté podmínky (MAT). Příkladem může být Švýcarsko, které v případě nekomerčního využití genetických zdrojů švýcarského původu pouze požaduje, aby uživatelé přístup náležitě dokumentovali a v případě uvedení výstupu využívání na trh tuto skutečnost oznámili příslušným orgánům Švýcarska. I v takovém případě je třeba evidovat výše uvedené informace (s výjimkou povolení k přístupu a vzájemně dohodnutých podmínek).
Podle čl. 4 odst. 6 nařízení EU mají uživatelé povinnost uchovávat tyto informace po dobu 20 let po skončení období využívání daných genetických zdrojů.
1. Příprava výzkumu: zjišťování informací
Při plánování výzkumu v oblasti genetických zdrojů je třeba vzít v potaz případné požadavky vyplývající z Nagojského protokolu s dostatečným předstihem. V první řadě je třeba zjistit, zda se na daný genetický zdroj mohou vztahovat regulační požadavky ze strany poskytující země. Pokud ano, je vhodné zajistit dostatečnou časovou i finanční rezervu pro získávání potřebných povolení a zohlednit případné sdílení přínosů. Podrobnější informace viz také metodický pokyn Komise, kap. 3.2. Zjištění použitelnosti nařízení (str. 12).
Klíčovým informačním zdrojem je informační systém ABS (https://absch.cbd.int/), kde lze nalézt informace o tom, zda je daná země smluvní stranou Nagojského protokolu a zda má platné právní předpisy týkající se přístupu. Tyto informace by měly být uvedeny přímo v profilu zemí (právní, správní a politická opatření, případně postupy v oblasti ABS) nebo by měl být uveden odkaz na webové stránky dané země s podrobnějšími informacemi. Zdrojem přehledných informací o požadavcích dané země a o postupu pro uživatele mohou být i národní zprávy. Ministerstvo životního prostředí, které je národním kontaktním místem pro Nagojský protokol v ČR (eliska.rolfova@mzp.cz nebo abs@mzp.cz, tel. 267 122 030 - platnost údajů doporučujeme ověřit na webu https://www.mzp.cz/cz/nagojsky_protokol), nabízí asistenci uživatelům v případech, kdy se v informačním systému ABS obtížně orientují.
Užitečnou pomůckou jsou také publikace shrnující právní předpisy vybraných zemí poskytovatelů: Advancing implementation of the Nagoya Protocol, Komise, 2018 (http://ec.europa.eu/environment/nature/biodiversity/international/abs/pdf/ABS%20workshop%20report.pdf) a Vilm ABS Dialogue - Informing about Domestic Measures for Access to Genetic Resources, Bundesamt fur Naturschutz (BfN), 2017 a 2018 (https://www.bfn.de/fileadmin/BfN/service/Dokumente/skripten/Skript485.pdf, https://www.bfn.de/fileadmin/BfN/service/Dokumente/skripten/Skript524.pdf).
Nejsou-li uvedené informace postačující, doporučuje se oslovit národní kontaktní místo, jehož úkolem je informace o postupech poskytovat žadatelům. Uživatel by měl co nejkonkrétněji popsat výzkumný záměr, tedy o jaké genetické zdroje má zájem, jaké aktivity v oblasti výzkumu a vývoje plánuje provádět, případně jak bude naloženo s výsledky výzkumu. Na základě těchto informací bude moci kontaktní místo navrhnout další postup.
Dále se doporučuje komunikovat s partnerskými organizacemi v dané zemi, které se na výzkumu budou podílet a s příslušnými pravidly by měly být obeznámeny. V některých zemích je spolupráce s místním partnerem nezbytnou podmínkou pro udělení povolení k přístupu ke genetickým zdrojům.
Veškerou písemnou i elektronickou komunikaci s příslušnými orgány poskytující země či místními partnery je vhodné uchovávat jako doklad o postupu s náležitou péčí.
2. Získání nového materiálu
a) Od poskytující země
Získává-li uživatel nový genetický materiál (bez ohledu na to, zda spadá do oblasti působnosti příslušného nařízení EU či nikoliv), je vždy třeba evidovat informace dokládající jeho původ. Mezi základní informace patří: datum, kdy byl materiál získán, a místo, odkud byl získán, popis genetického zdroje (o jaký genetický materiál se jedná či z jakého materiálu byl vzorek získán) a zda se na něj vztahují právní předpisy poskytující země, které mají souvislost s Nagojským protokolem.
Nařízení EU se týká primárně využívání genetických zdrojů, nikoliv jejich získávání jako takového. Doporučuje se ovšem, aby získávání jakéhokoliv materiálu proběhlo vždy v souladu s aktuální legislativou poskytující země ohledně přístupu, pokud taková legislativa existuje. Tento postup je zásadní nejen proto, že získané genetické zdroje mohou být v budoucnu využívány a uživatelé v takovém případě budou s ohledem na náležitou péči potřebovat informaci o tom, že byl konkrétní materiál získán v souladu s předpisy poskytovatele. Neméně důležitým ohledem je také to, že nelegálně získaný materiál se může stát předmětem komplikací již v poskytující zemi, např. při kontrolách na hranicích/letištích apod.
Jestliže v době získání materiálu poskytující země příslušnou legislativu nemá či je materiál získán v souladu se stávající legislativou, která se v budoucnu může změnit, má se podle nařízení EU za to, že přístup k takovému genetickému zdroji proběhl legálně, i kdyby poskytující země v budoucnu příslušnou legislativu přijala či změnila.
Pokud se jedná o materiál, na nějž se vztahují regulační předpisy/požadavky poskytující země, je třeba postupovat v souladu s nimi, což zpravidla znamená, že je třeba podle pokynů příslušných orgánů poskytující země získat povolení k přístupu nebo obdobný doklad prokazující, že byl udělen předchozí informovaný souhlas (PIC) a sjednány vzájemně dohodnuté podmínky (MAT). Vzhledem k tomu, že se u vzájemně dohodnutých podmínek jedná o soukromoprávní smlouvu uzavřenou mezi poskytovatelem a příjemcem materiálu (uživatelem), je jejich obsah výsledkem dohody mezi oběma stranami. Poskytující země obvykle mají k dispozici vzorová smluvní ujednání v souladu s národní legislativou, ovšem konečná podoba dokumentu závisí na dohodě obou smluvních stran. Doporučuje se, aby si poskytovatel a uživatel ujednali co nejpřesněji podmínky a pravidla pro využívání genetického zdroje a pro sdílení přínosů, a to včetně ustanovení upravujících např. použití výsledků výzkumu, předání materiálu dalším uživatelům nebo řešení sporů. Užitečnou pomůckou pro sjednávání vzájemně dohodnutých podmínek mohou být také související články a publikace zveřejněné v informačním systému ABS (dostupné na: https://absch.cbd.int/search/referenceRecords?schema=modelContractualClause) nebo související studie, kterou zadal sekretariát Úmluvy o biologické rozmanitosti (dostupná z: https://www.cbd.int/doc/meetings/abs/icnp-03/information/icnp-03-inf-02-en.pdf).
Specifickým případem jsou rostlinné genetické zdroje pro výživu a zemědělství v návaznosti na Mezinárodní smlouvu o rostlinných genetických zdrojích pro výživu a zemědělství: možné scénáře viz str. 15 a 16 metodického pokynu Komise.
b) Od jiného uživatele nebo ze sbírky mimo zemi poskytovatele
Pokud uživatel získává genetický zdroj ze sbírky nebo od jiného uživatele, je třeba si vyžádat také potřebnou dokumentaci. Z ní lze získat informace o tom, zda se na genetický zdroj vztahují podmínky související s Nagojským protokolem, a pokud ano, zda byl získán v souladu s legislativou poskytující země a zda případné vzájemně dohodnuté podmínky (MAT) umožňují materiál využívat způsobem, který odpovídá záměru uživatele. Není-li dokumentace kompletní nebo se nevztahuje na zamýšlené využívání, je třeba se obrátit na zemi původu genetického zdroje a získat nové nebo aktualizovat stávající povolení. Pokud nelze určit zemi původu genetického zdroje, nařízení se nepoužije, i kdyby materiál splňoval ostatní kritéria pro působnost nařízení. V rámci náležité péče ovšem uživatel musí být schopen zdůvodnit, proč není možné zemi původu zjistit.
c) Genetické zdroje jako obchodovatelné komodity
Má-li uživatel zájem o provádění aktivit výzkumu a vývoje na takovém materiálu, který je volně dostupný jako komodita (tedy nebyl získán v zemi původu za účelem využívání spolu s příslušným povolením) a zároveň splňuje všechny podmínky pro použitelnost nařízení, je rovněž třeba obrátit se na zemi původu a povolení vyjednat. Viz také metodický pokyn Komise str. 7. Obdobně jako u písm. b) výše se nařízení nepoužije, nelze-li určit zemi původu materiálu.
3. Využívání materiálu
Využíváním se rozumí provádění výzkumu a vývoje v oblasti genetického nebo biochemického složení genetického zdroje. Materiál, který je předmětem regulace ze strany jeho poskytovatele, je třeba využívat pouze v souladu s povolením k přístupu či obdobným dokumentem. Stejně tak je třeba plnit případné smluvní povinnosti vyplývající ze vzájemně dohodnutých podmínek neboli MAT (dohodnutý způsob využití, sdílení přínosů, předávání informací apod.).
Změní-li se okolnosti, způsob nebo účel využívání materiálu (např. při přechodu z nekomerčního využívání daného materiálu na komerční), je třeba obrátit se znovu na poskytující zemi. Za těchto nových okolností může být nutné znovu získat předchozí informovaný souhlas (PIC) a sjednat nové vzájemně dohodnuté podmínky (MAT).
4. Poskytování materiálu dalšímu uživateli
Poskytuje-li uživatel genetický materiál jinému uživateli, je třeba jej předat spolu s veškerou výše uvedenou dokumentací tak, aby i následný uživatel předmětného genetického zdroje měl k dispozici potřebné informace a mohl postupovat s náležitou péčí. Jsou-li sjednány vzájemně dohodnuté podmínky (MAT), které upravují poskytování daného materiálu dalším uživatelům, je třeba postupovat v souladu s nimi (někdy může být předání materiálu třetí straně zcela zakázáno).
Jak řešit problematické situace
Jestliže se komplikuje komunikace s poskytovatelem genetického zdroje nebo je postup získávání příslušných povolení nejasný či příliš složitý, doporučuje se zvážit, zda má význam o daný genetický zdroj v daném místě dále usilovat. V takovém případě je vhodné posoudit finanční a časovou náročnost získávání povolení, ale i možné komplikace, pokud by genetický zdroj nebyl získán v souladu s legislativou poskytující země.
Z hlediska postupu s náležitou péčí, tedy splnění povinnosti, které uživatelům ukládá nařízení EU, se očekává, že uživatel vyvine přiměřené úsilí - podrobněji viz metodický pokyn Komise, kap. 3.2., str. 12. Předpokládá se proto, že při zjišťování podmínek přístupu ke genetickým zdrojům uživatel konzultuje přiměřené množství informačních zdrojů (viz výše, Příprava výzkumu). Nereaguje-li národní kontaktní místo v přiměřené časové lhůtě (např. do dvou týdnů) na žádost o informace, doporučuje se kontaktovat jej znovu a zároveň do kopie e-mailu přidat kontaktní osobu na Ministerstvu životního prostředí (jako doložení náležité péče).
Zároveň je třeba vzít v potaz, že využívání genetického zdroje v případě, že se uživateli ani po vynaloženém úsilí nepodařilo zjistit informace o podmínkách pro získání povolení k přístupu, může sice být v souladu s požadavky na postup s náležitou péčí podle legislativy EU, ale v rozporu s právními předpisy a regulačními požadavky poskytující země. Tyto situace mohou přinést komplikace v budoucnu (například při publikaci výsledků nebo při předávání materiálu dalším uživatelům) a poskytující země může později požadovat, aby uživatel získal povolení k přístupu zpětně.
V komplikovaných případech nabízí Ministerstvo životního prostředí asistenci například při komunikaci se zahraničními kontaktními místy (kontakt: eliska.rolfova@mzp.cz nebo abs@mzp.cz, tel. 267 122 030 - platnost údajů doporučujeme ověřit na webu https://www.mzp.cz/cz/nagojsky_protokol).
Osvědčené postupy
Podle čl. 8 odst. 1 nařízení EU mohou sdružení uživatelů nebo jiné zúčastněné strany požádat o to, aby kombinace postupů, nástrojů nebo mechanismů, kterou vytvořily a na niž dohlížejí, byla uznána za osvědčený postup v souladu s požadavky nařízení. Sdružením uživatelů se rozumí například konsorcia výzkumných organizací nebo asociace společností v rámci jednotlivých sektorů. Členové těchto sdružení pak mohou tyto osvědčené postupy uplatnit v rámci své činnosti.
Náležitosti žádosti o uznání osvědčeného postupu vymezuje čl. 8 a příloha IV prováděcího nařízení Komise. Konkrétní postup, forma žádosti i další podmínky jsou upřesněny v čl. 8 nařízení a dále v čl. 8-11 prováděcího nařízení Komise. Žádost je třeba zaslat Komisi elektronicky, na adresu ENV-F3-NAGOYA-ABS@ec.europa.eu.
Dne 10.5.2019 schválila Komise první osvědčený postup: sdružení CETAF (Consortium of European Taxonomie Facilities).
Internetový registr osvědčených postupů spravuje Komise. Dostupný je na: http://ec.europa.eu/environment/nature/biodiversity/international/abs/pdf/Register%20of%20Best%20Practices.pdf.
Dodržování osvědčených postupů usnadňuje uživatelům plnění jejich povinností. Podle čl. 9 odst. 1 nařízení EU vezmou příslušné orgány v potaz, že uplatňuje-li uživatel uznaný osvědčený postup, může se tak snížit riziko, že nedodrží příslušná pravidla. Vzhledem k tomu, že kontroly se podle čl. 9 odst. 3 písm. a) nařízení EU provádějí v souladu s pravidelně aktualizovaným plánem vypracovaným za použití postupu založeného na hodnocení rizik, jsou uživatelé postupující v souladu s osvědčenými postupy zohledněni právě v rámci plánu kontrol.
Sdílení přínosů
Cílem Nagojského protokolu je spravedlivé a rovnocenné sdílení přínosů plynoucích z využívání genetických zdrojů, které by zároveň mělo přispívat k ochraně biologické rozmanitosti a trvale udržitelnému způsobu využívání jejích složek, a naplňovat tak hlavní cíle Úmluvy o biologické rozmanitosti. Uživatelé genetických zdrojů by proto měli uvážit, jakým způsobem mohou přínosy, které jim z využívání daných zdrojů plynou, směřovat na ochranu biologické rozmanitosti.
Příloha Nagojského protokolu nabízí příklady peněžních i nepeněžních přínosů. Mezi nepeněžní přínosy lze zařadit např. spolupráci a účast ve vědeckém výzkumu a rozvojových programech či sdílení jejich výsledků, převod znalostí a technologií či přístup k vědeckým informacím souvisejícím s ochranou a trvale udržitelným využíváním biologické rozmanitosti, včetně biologických inventarizací a taxonomických studií.
Genetický materiál českého původu
Česká republika je smluvní stranou Nagojského protokolu, ale nezavedla v této souvislosti žádná opatření, která by upravovala přístup ke genetickým zdrojům českého původu a sdílení přínosů z jejich využívání nad rámec stávající legislativy.
V souvislosti s Nagojským protokolem tedy genetické zdroje českého původu regulaci nepodléhají, a na jejich získávání a využívání se proto výše uvedené povinnosti nevztahují. Projeví-li o genetické zdroje českého původu zájem uživatelé ze zahraničí, je vhodné je o této skutečnosti informovat a ujistit je, že nemusejí získávat předchozí informovaný souhlas (PIC) ani sjednávat vzájemně dohodnuté podmínky (MAT).
Zároveň je třeba podotknout, že v některých případech je přístup ke genetickým zdrojům omezen v rámci jiných platných předpisů a postupů. Jedná se například o získávání genetických zdrojů v chráněných územích a genetických zdrojů, které jsou chráněnými druhy rostlin nebo živočichů (regulováno zákonem č. 114/1992 Sb., o ochraně přírody a krajiny, a souvisejícími prováděcími předpisy). Genetické zdroje rostlin významné pro výživu a zemědělství se dalším uživatelům poskytují z genových bank v souladu s pravidly používání Standardní smlouvy o transferu materiálu (SMTA).
Kapitola V
Prohlášení o náležité péči
Uživatelé genetických zdrojů mají povinnost předložit prohlášení o tom, že postupují s náležitou péčí. Tuto povinnost stanovuje čl. 7 odst. 1 a 2 nařízení EU a dále ji upřesňuje čl. 5 a 6 prováděcího nařízení Komise.
Jedná-li se o využívání genetických zdrojů mimo oblast působnosti nařízení, prohlášení se nepodává.
Prohlášení předkládají uživatelé ve fázi financování výzkumu a ve fázi konečného vývoje produktu. Podrobněji také viz metodický pokyn Komise, kap. 4, str. 14-15. Prohlášení se podává příslušnému orgánu, kterým je v ČR Ministerstvo životního prostředí.
1. Prohlášení o náležité péči ve fázi výzkumu
Ministerstvo životního prostředí vyzývá všechny příjemce finančních prostředků na výzkum spojený s využíváním genetických zdrojů, aby podali prohlášení o postupu s náležitou péčí. Toto prohlášení je třeba podat poté, co uživatel obdržel první grantovou platbu a zároveň již získal všechny genetické zdroje (a příslušná povolení k nim), jež jsou ve financovaném projektu využívány, avšak nejpozději před ukončením projektu (v době podání závěrečné zprávy). Financováním výzkumu se rozumí jakékoliv finanční příspěvky na výzkum poskytnuté prostřednictvím grantu. Nezahrnují vnitřní rozpočtové zdroje uživatelských subjektů.
Požadavek, aby příjemci finančních prostředků na výzkum spojený s využíváním genetických zdrojů prohlásili, že postupují s náležitou péčí, je již součástí evropských programů zaměřených na výzkum, např. programu Horizont 2020. Praktické pokyny pro příjemce finančních prostředků EU jsou k dispozici na Portálu pro účastníky programu v rámci oddílu k etice (http://ec.europa.eu/research/participants/docs/h2020-funding-guide/cross-cutting-issues/ethics_en.htm). Mají výzkumným pracovníkům pomoci zjistit, zda z jejich projektů vyplývají povinnosti podle nařízení EU a jak je případně dodržovat.
2. Prohlášení o náležité péči ve fázi konečného vývoje produktu
Prohlášení o náležité péči je dále třeba podat, dojde-li k některé z událostí uvedené v čl. 6 prováděcího nařízení Komise:
a) je žádáno o povolení nebo schválení uvedení produktu vyvinutého využíváním genetických zdrojů na trh;
b) je učiněno oznámení požadované před prvním uvedením výrobku vyvinutého využíváním genetických zdrojů na trh Unie;
c) první uvedení produktu vyvinutého využíváním genetických zdrojů, pro které se nepožaduje povolení, schválení ani oznámení, na trh Unie;
d) výsledek využívání je prodán nebo jakýmkoli jiným způsobem předán fyzické nebo právnické osobě v Unii, aby tato osoba mohla provádět některou z činností uvedených v písmenech a), b) a c);
e) využívání v Unii skončilo a jeho výstup je prodán nebo jakýmkoli jiným způsobem předán fyzické nebo právnické osobě mimo Unii.
Je možné, třebaže poměrně neobvyklé, že jeden uživatel bude muset předložit dvě prohlášení o náležité péči týkající se stejného genetického zdroje, tj. jedno ve fázi financování výzkumu a jedno ve fázi konečného vývoje produktu. Bude to nezbytné, pokud uživatel provádí činnosti, na které se vztahují oba požadavky (provádí výzkum zahrnující využívání genetických zdrojů a uvádí na trh produkt vyvinutý využíváním genetických zdrojů).
Nástroj DECLARE
Prohlášení se podávají výhradně elektronicky prostřednictvím systému DECLARE. DECLARE je celounijní webový nástroj, který spravuje Evropská komise. Je přístupný na webových stránkách: https://webgate.ec.europa.eu/declare. Manuál pro používání systému DECLARE (odpovědi na nejčastěji kladené dotazy) je součástí tohoto metodického pokynu v části třetí.
V systému DECLARE se zpracovávají osobní údaje a další data. Podrobnější informace k tomu, jak se s těmito osobními údaji zachází a jakým způsobem jsou chráněny, jsou k dispozici na webových stránkách Komise: http://ec.europa.eu/environment/nature/biodiversity/international/abs/pdf/DECLARE-NAGOYA_privacy_statement.pdf.
K přístupu do systému DECLARE je třeba registrace, která se provádí přímo v systému a kterou schvaluje Ministerstvo životního prostředí. Příslušný uživatel, ať už se jedná o fyzickou či právnickou osobu, se registruje jako „organizace“ (viz manuál v části třetí).
Vzhledem k tomu, že systém DECLARE neumožňuje při registraci elektronické ověření identity, předloží uživatel Ministerstvu životního prostředí také žádost o schválení registrace, která bude obsahovat údaje uvedené při registraci, kontaktní údaje a v případě právnické osoby také potvrzení, že je osoba, která danou organizaci v systému DECLARE zaregistrovala, oprávněna jménem této právnické osoby podávat prohlášení o náležité péči. Žádost musí obsahovat podpis a případně razítko dané fyzické osoby či statutárního zástupce právnické osoby. Formuláře žádosti jsou součástí tohoto metodického pokynu jako příloha I a II.
Žádost se podává v listinné podobě na adresu: Ministerstvo životního prostředí, Odbor druhové ochrany a implementace mezinárodních závazků, Vršovická 1442/65, Praha 10, 100 10, prostřednictvím datové schránky (9gsaax4) nebo v elektronické podobě podepsané uznávaným elektronickým podpisem na adresu: abs@mzp.cz.
Kontrolní zpráva
Prohlášení o náležité péči (vyjma informací označených jako důvěrné) předává Ministerstvo životního prostředí do informačního systému ABS v podobě tzv. kontrolní zprávy. Tímto způsobem získá příslušný orgán poskytující země informace o tom, že je genetický zdroj využíván v souladu s povolením k přístupu, které pro daný zdroj vydal.
Kapitola VI
Sbírky genetických zdrojů
Pokud jde o sbírky genetických zdrojů, z předpisů EU či ČR pro jejich držitele nevyplývají žádné přímé povinnosti, nejsou-li sbírky nebo jejich části zařazeny do evropského registru. Uživatelé, kteří mají zájem využívat vzorky genetických zdrojů ze sbírek, budou ovšem potřebovat informace o původu vzorků, bez nichž nemohou prokázat postup s náležitou péčí. Dále může nastat situace, kdy využívání genetických zdrojů probíhá v rámci samotné sbírky. Držitel sbírky se tak stává uživatelem, a za těchto okolností pro něj taktéž platí povinnost postupovat s náležitou péčí.
Z těchto důvodů se i sbírkám doporučuje postupovat s náležitou péčí, tedy nové vzorky genetických zdrojů získávat, uchovávat a předávat pouze spolu s příslušnými informacemi o jejich původu a případně s dokumentací k předchozímu informovanému souhlasu (PIC) a vzájemně dohodnutým podmínkám (MAT). Dále je vhodné upozornit uživatele, že pokud jeho plánované aktivity nejsou pokryty povolením uděleným pro daný genetický materiál (např. proto, že povolení bylo uděleno pro nekomerční využití a uživatel plánuje komerčně zaměřený výzkum), musí se obrátit na poskytující zemi a povolení znovu získat.
U vzorků, které nespadají do oblasti působnosti evropského nařízení (např. proto, že byly získány před 12. říjnem 2014 nebo pocházejí ze země, která není smluvní stranou Nagojského protokolu), je vhodné evidovat alespoň základní informace (popis vzorku, místo původu, datum získání - viz výše, Požadovaná dokumentace) a uživatelům je předávat s upřesněním, že se na tyto vzorky povinnost náležité péče nevztahuje. Totéž se týká vzorků genetických zdrojů českého původu, zejména při jejich poskytování do zahraničí: je vhodné přiložit informaci o tom, že Česká republika přístup ke svým genetickým zdrojům nereguluje, a není tedy třeba získávat specifická povolení související s Nagojským protokolem a postupovat s náležitou péčí (v případě uživatelů z EU).
Nelze-li k novému vzorku požadovanou dokumentaci získat a zároveň je pravděpodobné, že podléhá Nagojskému protokolu, doporučuje se takový vzorek nepřijímat, případně jej neposkytovat uživatelům za účelem výzkumu.
Zařazení sbírky nebo její části do registru
Nařízení EU zavádí možnost registrace pro sbírky genetických zdrojů, které splňují určitá kritéria (stanovená v nařízení a dále upřesněná v prováděcím nařízení Komise). Podle nařízení EU se má za to, že uživatel, který získá genetický zdroj z registrované sbírky, postupoval s náležitou péčí, pokud jde o získání informací o legálním původu genetického zdroje. Ostatní povinnosti, včetně povinnosti předložit prohlášení o náležité péči, uživateli zůstávají.
Registrace sbírky nebo její části je dobrovolná a může mít přidanou hodnotu pro jejího držitele. Ta může mimo jiné spočívat v tom, že z hlediska postupu s náležitou péčí je pro uživatele snazší získávat materiál z registrované sbírky (uživatel má jistotu, že spolu s genetickým zdrojem získá také potřebné informace). Zároveň je registrace podmíněna splněním a dodržováním níže uvedených kritérií. Za registraci podle nařízení EU nelze považovat registraci sbírky podle jiných právních předpisů a zároveň registrace podle nařízení EU nezakládá držiteli sbírky práva či povinnosti související s registrací podle jiných právních předpisů. Pojem sbírka či registrovaná sbírka se používá pouze ve smyslu, v jakém jej vymezuje nařízení EU.
Má-li držitel sbírky zájem o registraci sbírky nebo její části ve smyslu nařízení EU, je třeba, aby splnil a dále dodržoval podmínky, které upravuje čl. 5 odst. 3 nařízení. Sbírka nebo její část musí být prokazatelně schopna:
a) používat standardní postupy při výměně vzorků genetických zdrojů a souvisejících informací s jinými sbírkami a při poskytování vzorků genetických zdrojů a souvisejících informací třetím osobám za účelem jejich využívání v souladu s úmluvou a Nagojským protokolem;
b) poskytovat genetické zdroje a související informace třetím osobám za účelem jejich využívání pouze s dokumentací prokazující, že přístup ke genetickým zdrojům a souvisejícím informacím byl uplatněn v souladu s platnými právními předpisy nebo s regulačními požadavky týkajícími se přístupu a sdílení přínosů a případně se vzájemně dohodnutými podmínkami (MAT);
c) vést záznamy o všech vzorcích genetických zdrojů a souvisejících informacích poskytnutých třetím osobám za účelem jejich využívání;
d) podle možnosti zavést nebo využívat jedinečné identifikátory u vzorků genetických zdrojů poskytnutých třetím osobám; a
e) používat vhodné nástroje ke sledování a monitorování výměn vzorků genetických zdrojů a souvisejících informací s jinými sbírkami.
Žádost o zařazení do registru a její náležitosti pak upravuje čl. 3 a příloha I prováděcího nařízení Komise. Žádost se podle §2 zákona podává Ministerstvu životního prostředí.
Registr sbírek v Unii spravuje Komise a je k dispozici na webových stránkách: http://ec.europa.eu/environment/nature/biodiversitv/international/abs/pdf/Register%20of%20Collections.pdf.
Kapitola VII
Kontroly
Uživatelé genetických zdrojů a držitelé registrovaných sbírek mohou být předmětem kontroly ze strany České inspekce životního prostředí. Jako příslušný orgán ve smyslu čl. 6 nařízení EU má povinnost ověřovat, zda uživatelé plní své povinnosti podle čl. 4 a 7 (viz čl. 9 nařízení) a zda sbírky nebo její části zařazené do registru splňují kritéria stanovená v čl. 5 odst. 3 nařízení (viz čl. 5 odst. 4).
Obecným právním předpisem v oblasti kontroly, který upravuje procesní postup kontrolních orgánů, je zákon č. 255/2012 Sb., kontrolní řád, ve znění pozdějších předpisů.
Kontroly se provádějí v souladu s každoročně aktualizovaným plánem, který za použití přístupu založeného na hodnocení rizik připravuje Ministerstvo životního prostředí ve spolupráci s Českou inspekcí životního prostředí, případně na základě opodstatněných obav, že daný uživatel neplní své povinnosti stanovené nařízením EU nebo že sbírka či její část zařazená do registru nesplňuje kritéria stanovená v čl. 5 odst. 3 nařízení EU.
Podle čl. 9 odst. 4 nařízení EU mohou kontroly uživatelů zahrnovat prověrku:
a) opatření, která uživatel přijal s cílem postupovat s náležitou péčí v souladu s článkem 4 nařízení EU;
b) dokumentace a záznamů, které prokazují v souvislosti s konkrétním využitím, že bylo postupováno s náležitou péčí v souladu s článkem 4 nařízení EU;
c) případů, kdy byl uživatel povinen učinit prohlášení podle článku 7 nařízení EU.
Podle potřeby mohou být provedeny rovněž kontroly na místě.
Zjistí-li Česká inspekce životního prostředí v průběhu kontroly nedostatky, lze uživateli genetických zdrojů či držiteli registrované sbírky uložit opatření k nápravě podle §8 zákona, v případě přestupků pak pokutu podle §9.
Časové hledisko
Nařízení EU je použitelné od 12. října 2014, tedy ode dne, kdy vstoupil v platnost Nagojský protokol. Vztahuje se proto na všechny genetické zdroje, k nimž byl uplatněn přístup po tomto datu (při splnění ostatních podmínek, viz pojem Oblast působnosti a také metodický pokyn Komise, kap. 2.2, str. 5).
Články 4, 7 a 9 nařízení EU vstoupily v platnost jeden rok poté, tedy v říjnu 2015. Vzhledem k tomu, že nařízení EU je přímo použitelné pro všechny členské státy EU, mají i uživatelé v ČR povinnost postupovat s náležitou péčí již od října 2015. Za případné porušení této povinnosti ovšem nemohli být uživatelé postihováni, pokud k němu došlo před nabytím účinnosti zákona, tj. před 20. červnem 2018.
Kontroly toho, zda uživatelé plní své povinnosti, se tedy budou vztahovat na využití, která se uskutečňují po 20. červnu 2018 na genetických zdrojích získaných po 12. říjnu 2014.
ČÁST TŘETÍ
Příručka pro uživatele / otázky a odpovědi - informační systém DECLARE pro Nagojský protokol
Původní dokument v angličtině připravila Evropská komise, která systém DECLARE spravuje. Kompletní a průběžně aktualizovaná verze příručky je k dispozici na webových stránkách Komise:
http://ec.europa.eu/environment/nature/biodiversity/international/abs/material en.htm
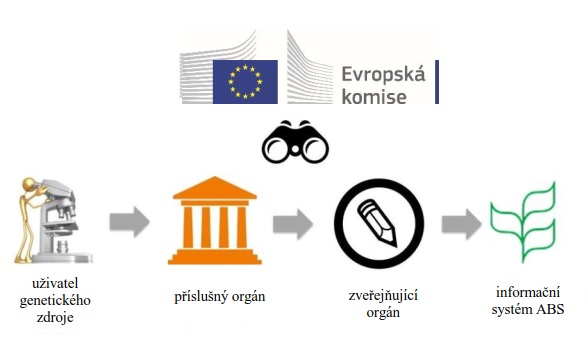
1. Jak mohu začít používat systém DECLARE?
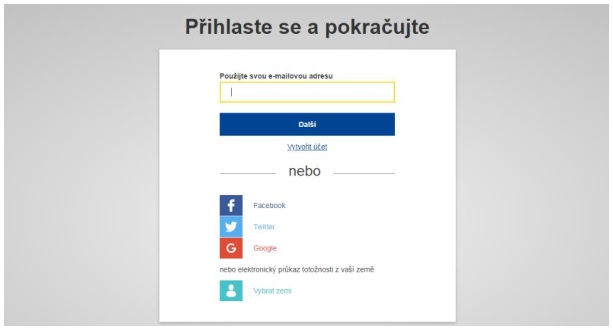
Abyste mohli předkládat prohlášení o náležité péči v systému DECLARE, musíte se nejdříve registrovat do systému EU Login (dříve Ověřovací služba Evropské komise - ECAS). Na stránkách systému DECLARE (https://webgate.ec.europa.eu/declare) budete automaticky přesměrováni do systému EU Login. Pokud již máte účet v systému EU Login, lze jej využít pro účely předkládání prohlášení o náležité péči prostřednictvím systému DECLARE. V opačném případě je třeba účet (v systému EU Login) vytvořit.
Registrace do systému DECLARE
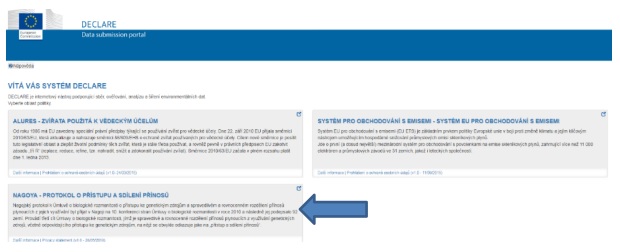
Jakmile jste přihlášeni do systému EU Login, můžete vstoupit do systému DECLARE (kde se také budete muset registrovat). Nejprve je třeba zvolit oblast politiky Nagojský protokol.
I. Zvolte oblast politiky NAGOJSKÝ PROTOKOL
II. Zaregistrujte se v systému DECLARE

Informace uvedené v systému EU Login se automaticky použijí pro účely registrace v systému DECLARE.
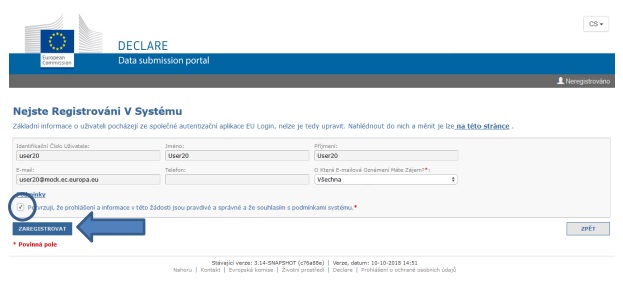
III. Zaregistrujte svou organizaci
Systém DECLARE nahlíží na každého uživatele jako na „organizaci“ a je třeba se v systému registrovat jako organizace.
V dalším kroku proto poskytujete informace o uživateli genetických zdrojů - tedy o subjektu, jenž bude předkládat prohlášení o náležité péči (viz níže, otázka č. 2).

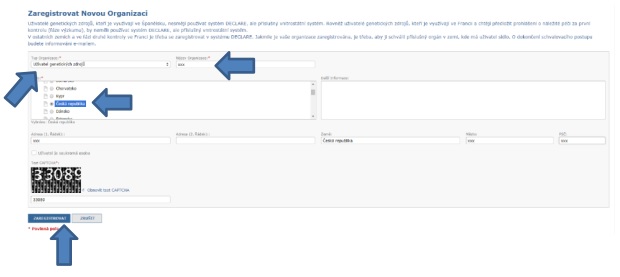
Registrace uživatelů genetických zdrojů (organizací) vyžadují potvrzení ze strany příslušného orgánu (orgán určený pro tento účel vládou členského státu - viz také výše, pojem Příslušný orgán v kap. II, Hlavní pojmy).

Po schválení registrace obdrží osoba, jež organizaci v systému DECLARE zaregistrovala, e-mail s potvrzením, že má přístupová práva potřebná k používání systému DECLARE a k předkládání prohlášení o náležité péči.
Jakmile uživatel obdrží e-mail, který mu dává přístupová práva k používání systému DECLARE, může se přihlásit a předkládat prohlášení o náležité péči.
2. Jak v systému DECLARE fungují „organizace“?
Prohlášení předkládají v souladu s nařízením EU a prováděcím nařízením Komise uživatelé genetických zdrojů. Uživatelem genetických zdrojů může být jednotlivec nebo subjekt (laboratoř, univerzita, společnost atd.). Je-li uživatelem jednotlivec, měl by se zaregistrovat jako soukromá osoba.

Uživatelé však obvykle pracují v organizacích/subjektech, např. ve výzkumných laboratořích, průmyslových závodech atd. Pokud uživatel pracuje pro takovou organizaci/subjekt a využívání provádí jejich jménem, měl by být jako uživatel genetických zdrojů uveden název této organizace / tohoto subjektu.
Je na uživatelích a jejich organizacích/subjektech, aby se rozhodli, na jaké úrovni své organizace chtějí zajišťovat předkládání prohlášení o náležité péči. Univerzita se například může rozhodnout, že se pro účely systému DECLARE zaregistruje jako organizace, nebo se může rozhodnout, že jako organizace bude zaregistrována katedra této univerzity. Podobně se pak může rozhodnout společnost, že se zaregistruje do systému jako organizace nebo že jako organizaci(-e) zaregistruje pouze jeden útvar nebo několik samostatných útvarů. Toto rozhodnutí bude znamenat, že uživatelé v rámci jedné organizace budou moci nahlížet do prohlášení učiněných jinými uživateli v rámci stejné organizace.
Každá organizace může mít v systému DECLARE libovolný počet aktivních členů.
Zaregistruje-li se více členů, alespoň jedna osoba musí být registrována jako správce, aby mohla „spravovat“ (přidávat nebo upravovat) přístup ostatních členů. První osoba, která zaregistruje danou organizaci, automaticky obdrží status správce. Existují tedy dva typy členů v organizaci: „správce“ a „řádný člen“. Oba dva mohou prohlížet, vytvářet a předkládat prohlášení o náležité péči. Správce pak může přidávat další členy do této organizace.
Mějte na paměti, že důvěrné informace, které systému DECLARE poskytnou členové jedné organizace, budou viditelné ostatním členům ze stejné organizace. Chce-li se dotyčná organizace takové situaci vyhnout, pak by se různá oddělení měla zaregistrovat jako samostatné organizace se svými vlastními členy.
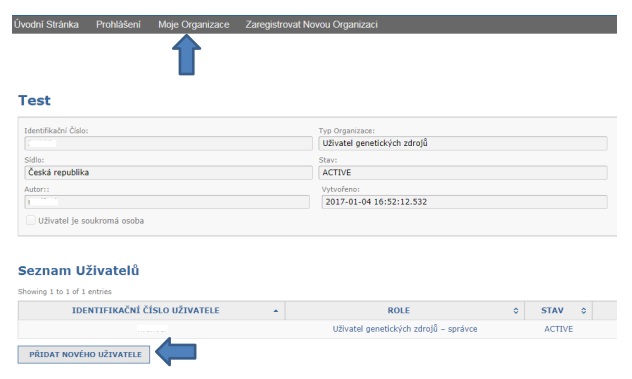
Dále upozorňujeme, že výměna poznámek mezi členy jedné organizace pomocí možnosti Přidat novou poznámku může být viditelná pro příslušné orgány, které mají přístup k dotyčnému prohlášení, a to podle toho, jak je nastaveno zobrazování poznámek.
Zobrazování poznámek v systému DECLARE si můžete nastavit. Jestliže chcete prostřednictvím možnosti Přidat novou poznámku komunikovat mezi členy jedné organizace (a nechcete, aby komunikace byla viditelná pro příslušné orgány), vyberte možnost „zobrazuje se pouze členům naší organizace“.

3. Co musím udělat, pokud chci předložit prohlášení o náležité péči prostřednictvím systému DECLARE?
Jakmile jste přihlášeni do systému, musíte si zvolit, který typ prohlášení o náležité péči si přejete předložit, tj. ve fázi financování výzkumu („fáze výzkumu“) nebo ve fázi konečného vývoje produktu („fáze konečného vývoje“). Nyní můžete rovněž nahlížet do přehledu prohlášení, která jste v minulosti předložili vy nebo vaše organizace („Přehled prohlášení“).
I. Zvolte typ prohlášení o náležité péči, které chcete podat

II. Vyplňte formulář prohlášení a uložte ho
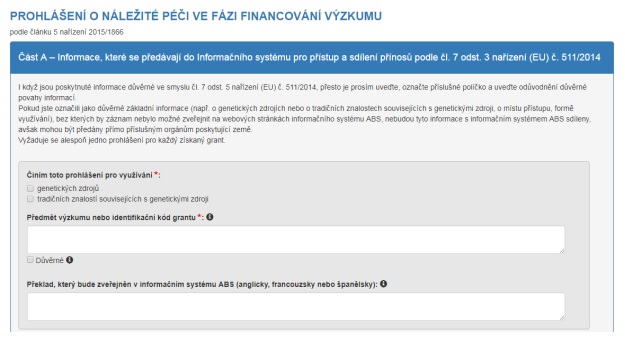

Prohlášení lze uložit jako koncept a následně jej znovu procházet a upravovat až do chvíle, než jej odešlete.

III. Zkontrolujte prohlášení o náležité péči a odešlete jej příslušnému orgánu
Jakmile jste spokojeni s informacemi vloženými do prohlášení, můžete ho odeslat příslušnému orgánu v daném členském státě.
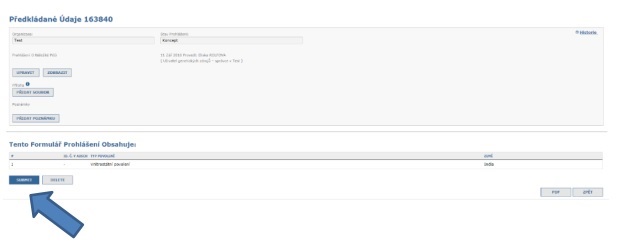
4. Co když jsem ve svém výzkumném projektu využil více než jeden genetický zdroj?
Pro každý výzkumný projekt se vyžaduje pouze jedno prohlášení o náležité péči, a to i pokud je v projektu využito více genetických zdrojů.
Nastat mohou různé situace:
- na více genetických zdrojů využitých v jednom projektu se vztahuje stejné povolení;
- na více genetických zdrojů využitých v jednom projektu se vztahují různá povolení ze stejné poskytující země;
- na více genetických zdrojů využitých v jednom projektu se vztahují různá povolení z různých poskytujících zemí.
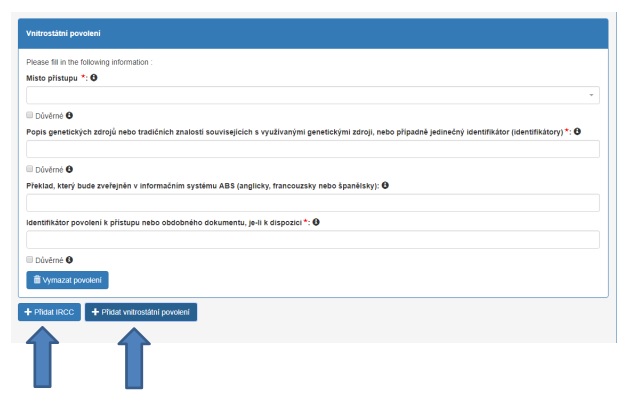
Jestliže se na více genetických zdrojů vztahuje jedno povolení (první scénář uvedený výše), informace o genetických zdrojích je třeba uvést v kolonce „Popis genetických zdrojů nebo tradičních znalostí souvisejících s genetickým zdrojem“ (viz také níže, otázka č. 10).
V dalších dvou scénářích (na genetické zdroje se vztahují různá povolení, ať již ze stejné poskytující země nebo z různých poskytujících zemí) je třeba doplnit informace o těchto zdrojích. V takovém případě použijte tlačítko(-a) „Přidat IRCC“ nebo „Přidat vnitrostátní povolení“ a systém vygeneruje všechny další kolonky, které je třeba vyplnit.
5. Co když jsem ve svém produktu využil více než jeden genetický zdroj?
Vyžaduje se pouze jedno prohlášení o náležité péči na produkt, a to i když je v daném produktu využito více genetických zdrojů. Totéž platí pro výsledek využívání a výstup využívání.
Podobně jako v případě výzkumného projektu i zde může nastat několik různých situací:
- na více genetických zdrojů využívaných v jednom produktu1) se vztahuje stejné povolení;
- na více genetických zdrojů využívaných v jednom produktu2) se vztahují různá povolení ze stejné poskytující země;
- na více genetických zdrojů využívaných v jednom produktu3) se vztahují různá povolení z různých poskytujících zemí;
1) Nebo na výsledek využívání nebo výstup využívání
2) Nebo na výsledek využívání nebo výstup využívání
3) Nebo na výsledek využívání nebo výstup využívání
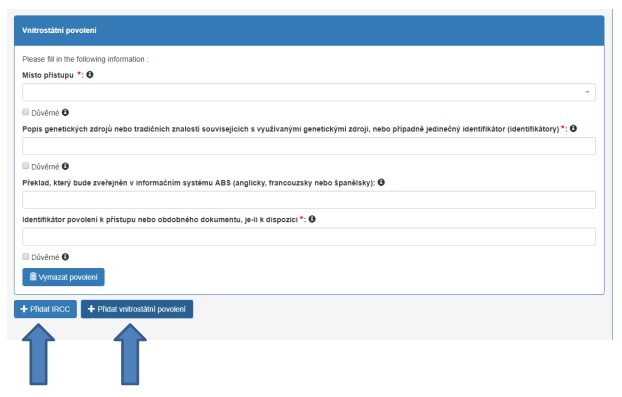
Pokud se na více genetických zdrojů vztahuje jedno povolení (první scénář uvedený výše), uveďte informace o genetických zdrojích v kolonce „Popis genetických zdrojů nebo tradičních znalostí souvisejících s genetickým zdrojem“ (viz také níže, otázka č. 10).
V dalších dvou scénářích (na genetické zdroje se vztahují různá povolení, ať již ze stejné poskytující země nebo z různých poskytujících zemí) je třeba doplnit informace o těchto zdrojích. Pokud použijete tlačítko „Přidat IRCC“ nebo „Přidat vnitrostátní povolení“, systém automaticky vygeneruje všechny další kolonky, které je třeba vyplnit.
6. Kdy přesně musím předložit prohlášení o náležité péči ve druhém kontrolním bodě (ve fázi konečného vývoje produktu)?
Podle prováděcího nařízení Komise je nutno předložit prohlášení o náležité péči ve fázi konečného vývoje produktu před tím, než nastane první z následujících událostí:
- je žádáno o povolení nebo schválení uvedení produktu (vyvinutého využíváním genetických zdrojů a tradičních znalostí souvisejících s genetickými zdroji) na trh;
- je učiněno oznámení požadované před prvním uvedením produktu (vyvinutého využíváním genetických zdrojů a tradičních znalostí souvisejících s genetickými zdroji) na trh Unie;
- první uvedení produktu (vyvinutého využíváním genetických zdrojů a tradičních znalostí souvisejících s genetickými zdroji), pro který se nepožaduje povolení, schválení ani oznámení, na trh Unie;
- výsledek využívání je prodán nebo jakýmkoli jiným způsobem předán fyzické nebo právnické osobě v Unii, aby tato osoba mohla provádět některou z činností uvedených výše (povolení, oznámení, uvedení na trh…);
- využívání v Unii skončilo a jeho výstup je prodán nebo jakýmkoli jiným způsobem předán fyzické nebo právnické osobě mimo Unii.
Uživatelé genetických zdrojů proto musí určit, která z výše uvedených událostí se vztahuje na jejich situaci. První tři události jsou spojeny s uvedením produktu na trh. Některé produkty vyžadují povolení k uvedení na trh (například farmaceutické produkty); u některých produktů je nutné učinit oznámení (například u kosmetických produktů); jiné produkty lze uvést na trh bez povolení/schválení nebo oznámení (například nová odrůda okrasné rostliny). Prohlášení musí být předloženo před tím, než je produkt uveden na trh, učiněno oznámení nebo se žádá o povolení/schválení.
Čtvrtá a pátá událost nejsou přímo spojeny s uvedením produktu na trh (nebo s úmyslem tak učinit). Ve čtvrtém případě je výsledek využívání prodán nebo předán jiné osobě v EU a tato osoba má v úmyslu uvést produkt na trh, neprovádí však již využívání (a tudíž nespadá do oblasti působnosti nařízení EU). V pátém případě výstup využívání opouští EU; produkt lze vyrábět bez dalšího využívání, nebo může být výstup předmětem dalšího výzkumu a vývoje, který se však uskutečňuje mimo EU. Ve čtvrtém a pátém případě musí prohlášení podat poslední účastník hodnotového řetězce, který prováděl využívání v EU a před tím, než je výsledek nebo výstup využívání předán.
Podrobnější vysvětlení těchto dvou událostí naleznete v dokumentu Pokyny koblasti působnosti v oddílu 4.2. (dostupný na webových stránkách: https://eur-lex.europa.eu/legal-content/CS/TXT/PDF/?uri=CELEX:52016XC0827(01)&from=EN).
7. Jaké informace je třeba uvést v kolonce „Předmět výzkumu nebo identifikační kód grantu“?
Zde uveďte informace o předmětu výzkumu; postačí název projektu a jeho stručný popis. Případně uveďte identifikační kód grantu, který projektu přidělila organizace poskytující financování, lze podle něj grantový projekt jednoznačně určit a nalézt informace o předmětu výzkumu.
Tyto informace - předávané prostřednictvím informačního systému ABS nebo přímo orgánům poskytující země, pokud jsou základní informace důvěrné - umožní poskytující zemi ověřit, zda je genetický zdroj využíván v souladu s předchozím informovaným souhlasem a vzájemně dohodnutými podmínkami a zda jsou podle vzájemně dohodnutých podmínek sdíleny přínosy.
8. Jaké informace by měly být uvedeny v kolonce „Název produktu“?
Zde uveďte název, podle něhož lze určit typ daného produktu (například pleťový krém, odrůda rostliny atd.) i konkrétní produkt podle značky nebo jiného názvu, který umožní jednoznačnou identifikaci (např. v případě odrůdy rostliny její název nebo obchodní název).
Stejně jako v případě grantů na výzkum (otázka č. 7 výše) umožní poskytnuté informace poskytovateli genetického zdroje ověřit, zda je genetický zdroj využíván v souladu s předchozím informovaným souhlasem a vzájemně dohodnutými podmínkami a zda jsou podle vzájemně dohodnutých podmínek sdíleny přínosy.
9. Co je to „Místo přístupu“?
Místem přístupu se rozumí poskytující země. Za poskytující zemi se považuje země původu genetických zdrojů nebo jakákoli (jiná) smluvní strana protokolu, která tyto genetické zdroje získala v souladu s úmluvou. Jestliže byl ke genetickému zdroji uplatněn přístup přímo v poskytující zemi, pak je místem přístupu tato země.
Pokud byl ke genetickému zdroji uplatněn přístup nepřímo přes zprostředkovatele, například prostřednictvím sbírky ex-situ (která se nenachází v poskytující zemi), pak je místem přístupu i nadále poskytující země, a nikoli země, v níž se nachází zprostředkovatel. Stručně řečeno, místem přístupu se vždy rozumí poskytující země.
10. Jaké informace musí být uvedeny v kolonce „Popis genetických zdrojů nebo tradičních znalostí souvisejících s genetickým zdrojem“?
Tyto informace umožní poskytující zemi identifikovat genetický zdroj nebo tradiční znalosti související s genetickými zdroji; jedinečné identifikátory by se měly používat vždy, když jsou k dispozici.
Doporučuje se používat termíny z původních povolení. Například v případě povolení týkajícího se 10 000 neroztříděných členovců bude vhodné v informacích v prohlášení o náležité péči rovněž uvést 10 000 neroztříděných členovců, a to i kdyby byl využíván pouze jeden z nich; uživatel pak v prohlášení o náležité péči může uvést konkrétní využitý genetický zdroj, tj. „Curculio oblongus, jeden z 10 000 neroztříděných členovců”. Příslušným orgánům poskytujících zemí tento postup usnadní práci. Uvedení pouze jednoho konkrétního genetického zdroje (v tomto případě „Curculio oblongus“) by pravděpodobně vedlo k tomu, že by poskytující země požádala o vyjasnění.
Informace uvedené v kolonce „Popis genetického zdroje“ se mohou vztahovat k biotě v jakékoli taxonomické kategorii (druh, rod, čeleď atd.), která nese taxonomické označení. Mohou také obsahovat odkaz na místo, kde byl materiál sebrán. Stejně tak lze genetický zdroj identifikovat prostřednictvím odkazu na dokladový exemplář nebo terénní poznámky v identifikovaném archivu nebo sbírce.
11. Co je to „Identifikátor povolení k přístupu“?
Číslo nebo jiné kódové označení, které vydávající orgán přidělil danému povolení, aby jej bylo možné identifikovat.
12. Co je to „Dokument obdobný povolení k přístupu“?
Smluvní strany protokolu mohou uplatňovat zvláštní pravidla pro různé typy přístupu ke genetickým zdrojům. Například mohou vyžadovat povolení k přístupu pro využití ve fázi uvedení na trh, zatímco v případě nekomerčního využívání mohou požadovat jen oznámení nebo záznam. Takové oznámení nebo záznam se rovněž považují za dokument obdobný povolení k přístupu, jelikož se jedná o požadavek týkající se přístupu. Tuto skutečnost je pak třeba také uvést v prohlášení o náležité péči.
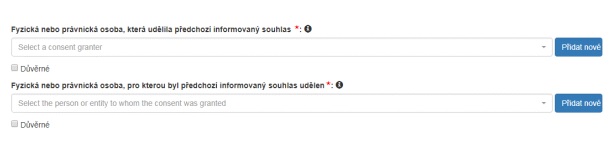
13. Kdo je to „Subjekt, který udělil předchozí informovaný souhlas“?
V závislosti na vnitrostátních právních předpisech země poskytovatele může být předchozí informovaný souhlas (PIC) udělen formou rozhodnutí vydaného na státní nebo regionální úrovni. Stejně tak mohou pravomoc vydat předchozí informovaný souhlas země delegovat na místní komunity. Kdo nese za vydání předchozího informovaného souhlasu odpovědnost, je stanoveno v právních předpisech země poskytovatele.
Informaci o subjektech, které v určitém okamžiku udělily předchozí informovaný souhlas, získá systém DECLARE z informačního systému ABS a lze ji zobrazit v rozbalovací nabídce. Pokud subjekt, který udělil předchozí informovaný souhlas pro genetický zdroj, jehož se dané prohlášení o náležité péči týká, nemá odpovídající záznam v informačním systému ABS, je třeba příslušný záznam vytvořit.
14. Kdo je to „Subjekt, jemuž byl udělen předchozí informovaný souhlas“?
Jedná se o subjekt, který obdržel povolení (předchozí informovaný souhlas).
Stejně jako u subjektu, který udělil předchozí informovaný souhlas (otázka č. 13 výše), získává systém DECLARE seznam těchto subjektů z informačního systému ABS. Pokud subjekt, který v daném případě obdržel předchozí informovaný souhlas, nemá odpovídající záznam v informačním systému ABS, je třeba příslušný záznam vytvořit.
15. Co je to „Přímý zdroj genetického zdroje“?
Jedná se o fyzickou nebo právnickou osobu, od níž uživatel získal genetické zdroje přímo, tj. předcházející účastník v hodnotovém řetězci. Pokud byl genetický zdroj získán přímo z poskytující země, uveďte tuto zemi. Je-li genetický zdroj získán ze sbírky, uveďte údaje o dané sbírce. Jestliže byl genetický zdroj získán od jiného uživatele v hodnotovém řetězci, je třeba uvést kontaktní údaje tohoto uživatele.
16. Jakou odpověď zvolím u otázky týkající se omezení ve vzájemně dohodnutých podmínkách?
Nabízejí se tři možné odpovědi na otázku týkající se možných omezení ve vzájemně dohodnutých podmínkách limitujících možné využívání genetických zdrojů (nebo tradičních znalostí souvisejících s genetickými zdroji): „ano“, „ne“, „nehodí se“.
Jestliže vzájemně dohodnuté podmínky nebyly sjednány, zvolte odpověď „nehodí se“. Existují-li ve vzájemně dohodnutých podmínkách omezení ohledně využívání a povolují-li například pouze využívání pro nekomerční účely, pak zvolte odpověď „ano“. Pokud ve vzájemně dohodnutých podmínkách neexistují žádná omezení, zvolte odpověď „ne“.
17. Co když můj produkt spadá do více než jedné kategorie a systém umožňuje zaškrtnout pouze jednu kategorii?
Zaškrtněte „jiné“ a upřesněte.
18. Co mám zapsat do kolonky „Datum“ a „Místo“ na konci prohlášení?
„Datum“ je datem, kdy prohlášení předkládáte (jako kdybyste prohlášení předkládali v listinné podobě). Datum se v systému doplňuje automaticky.
„Místo“ je místem, kde se při předložení tohoto prohlášení nacházíte (jako kdybyste jej podávali v listinné podobě).
19. Kdo může vidět mé prohlášení?
Informace v prohlášení o náležité péči, které nejsou označeny jako důvěrné, uvidí kdokoli, protože se předají do informačního systému ABS, a tím se zveřejní. Před tím, než příslušný orgán předá informace do informačního systému ABS, může informace, které nejsou důvěrné, vidět daný příslušný orgán (jemuž uživatel předložil prohlášení o náležité péči), Komise (poté, co příslušný orgán prohlášení o náležité péči potvrdí) a jiné příslušné orgány v EU (v případech, kdy je produkt uveden na trh ve více členských státech).
20. Co se stane s důvěrnými informacemi?
K důvěrným informacím uvedeným v prohlášení o náležité péči v systému DECLARE mají přístup ostatní zástupci téže organizace využívající genetické zdroje (viz otázka č. 2) a příslušné orgány, kterým se prohlášení o náležité péči předkládá. Důvěrné informace mohou vidět pouze tyto subjekty. Jiné příslušné orgány (například z jiných zemí EU, v nichž je produkt uváděn na trh) ani Evropská komise k těmto důvěrným informacím přístup nemá. Důvěrné informace se nepředávají do informačního systému ABS.
Za určitých okolností lze v prohlášení o náležité péči označit za důvěrné informace, bez nichž nelze vytvořit tzv. kontrolní zprávu (viz výše, Kontrolní zpráva), například místo přístupu. Taková prohlášení o náležité péči nebudou v informačním systému ABS zveřejněna, protože poskytující země podle nich nemůže identifikovat své genetické zdroje. V takovém případě příslušný orgán členského státu EU, v němž se prohlášení o náležité péči předkládá, kontaktuje přímo poskytující zemi a informace o jejích genetických zdrojích jí poskytne (viz čl. 7 odst. 2 prováděcího nařízení Komise). Tyto informace umožní poskytující zemi ověřit, zda je genetický zdroj využíván v souladu s předchozím informovaným souhlasem a vzájemně dohodnutými podmínkami a zda jsou podle vzájemně dohodnutých podmínek sdíleny přínosy.
21. Na základě čeho se určuje důvěrnost informací?
Pokud jsou informace označeny jako důvěrné, je podle prováděcího nařízení Komise třeba uvést důvody, proč byly takto označeny.
V článku 7 odst. 5 nařízení EU se uvádí, že příslušné orgány věnují náležitou pozornost zachování důvěrnosti obchodních a průmyslových informací, pokud je tato důvěrnost stanovena unijními nebo vnitrostátními právními předpisy za účelem ochrany oprávněných hospodářských zájmů. Tyto zájmy mohou souviset zejména s informacemi o genetických zdrojích nebo jejich využívání.
Uživatelům se doporučuje, aby se otázkám důvěrnosti příslušných ustanovení smluv věnovali při sjednávání vzájemně dohodnutých podmínek s poskytující zemí.
22. Proč je v prohlášení o náležité péči uvedena kolonka pro překlady?
Do informačního systému ABS je třeba odeslat údaje v jednom ze šesti jazyků OSN, z nichž tři jsou zároveň úředními jazyky EU (angličtina, francouzština a španělština). Předkládají-li uživatelé prohlášení o náležité péči v jiném jazyce, doporučuje se připojit překlad do jednoho z těchto tří jazyků. Prohlášení lze předložit i bez překladu (ten případně doplní příslušný orgán, kterému se prohlášení předkládá).
Informace označené jako důvěrné není nutné překládat, protože nebudou předány informačnímu systému ABS.
23. Vyžaduje se prohlášení i v případě, že poskytující země nepožadovala sjednání vzájemně dohodnutých podmínek?
Ano. Jsou-li splněny ostatní podmínky použitelnosti nařízení EU, prohlášení je třeba předložit, i když nebyly sjednány vzájemně dohodnuté podmínky. Některé poskytující země nepožadují sjednání vzájemně dohodnutých podmínek, přestože povinnost získat předchozí informovaný souhlas platí.
Dále je také možné, že země požaduje sjednání vzájemně dohodnutých podmínek, ale nepožaduje získání povolení k přístupu. I v tomto případě se prohlášení o náležité péči vyžaduje.
Prohlášení o náležité péči je třeba podat také v případě, že země požaduje pouze oznámení nebo záznam o přístupu, protože i toto se považuje za dokument obdobný povolení k přístupu.
Stručně řečeno, prohlášení o náležité péči se vyžaduje, pokud poskytující země stanovila jakékoliv právní předpisy nebo regulační požadavky týkající se přístupu.
24. Proč se část B nepředává do Informačního systému pro přístup a sdílení přínosů?
Prováděcí nařízení Komise vyžaduje, aby se do informačního systému ABS předávaly informace z části A, nikoli však z části B přílohy II a III. Informace shromážděné v části B jsou relevantní spíše pro provádění nařízení v EU a poslouží příslušným orgánům při provádění případných kontrol uživatelů.
Příloha I
Žádost Ministerstvu životního prostředí o schválení registrace uživatele genetických zdrojů v systému DECLARE
(fyzická osoba)
Jméno a příjmení:
Číslo občanského průkazu, cestovního pasu nebo jiného osobního dokladu:
Adresa:
E-mail:
Telefon:
Datová schránka:
Tímto žádám o schválení registrace v systému DECLARE a prohlašuji, že se údaje uvedené v této žádosti shodují s údaji uvedenými při registraci.
……………………………
Datum a podpis
Příloha II
Žádost Ministerstvu životního prostředí o schválení registrace uživatele genetických zdrojů v systému DECLARE
(právnická osoba)
Název právnické osoby:
IČ:
Sídlo (adresa):
Datová schránka:
Kontaktní osoba pověřená k podávání prohlášení o náležité péči
Jméno a příjmení:
E-mail:
Telefon:
Statutární zástupce - jméno, příjmení, funkce:
Tímto žádám o schválení registrace v systému DECLARE, prohlašuji, že se údaje uvedené v této žádosti shodují s údaji uvedenými při registraci, a zároveň potvrzuji, že je výše uvedená kontaktní osoba oprávněna podávat jménem mé organizace prohlášení o náležité péči ve smyslu nařízení (EU) č. 511/2014.
……………………………………………………………………………
Datum, podpis statutárního zástupce právnické osoby a razítko


