Xxxxxxxx Xxxxxx 96/54/xx
xx xxx 30. xxxxxxxx 1996,
xxxxxx xx po xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx Xxxx 67/548/XXX o xxxxxxxxxx právních a xxxxxxxxx xxxxxxxx týkajících xx xxxxxxxxxxx, balení x označování xxxxxxxxxxxx xxxxx
XXXXXX EVROPSKÝCH XXXXXXXXXXXX,
x xxxxxxx na Xxxxxxx x xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
x xxxxxxx na xxxxxxxx Xxxx 67/548/XXX xx xxx 27. xxxxxx 1967 x xxxxxxxxxx xxxxxxxx a xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, xxxxxx x xxxxxxxxxx nebezpečných xxxxx [1], naposledy xxxxxxxxxx směrnicí Komise 94/96/XX [2], x xxxxxxx xx článek 28 xxxxxxx xxxxxxxx,
xxxxxxxx x xxxx, že xxxxxxx X směrnice Xxxx 67/548/XXX xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx, xxxxxx xxxxxxxxxxx, označování x v případě xxxxxxx xxxxxx charakterizaci xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxx x xxxxxx parametrů xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxx zdraví xxxxxxx x xxxxxxx xxxxxxxxx; xx xxxxxx xxxxxxxxxxxx xxxxx v xxxxxxx X xxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx; xx x xxxxxxxx xxxx xx xxxxxxxx xxxxxx úvod xxxxxxx X xxx, xxx xxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxx xxxxxxxxxxx látek x tabulce B; xx seznam xxxxxxxxxxxx xxxxx v xxxxxxx X xxxxxxxx látky, xxx xxxxx xxxx xxxxxxxxxx Xxxxxxxx x Xxxxxxx v xxxx x xxxxxxxxxxx Xxxxxxxx, Xxxxxx a Xxxxxxx xxxxxxxxxx dočasné odchylky xxxxxxxx se klasifikace x xxxxxxxxxx; xx xxx o xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx x xxxxxxxxxx xxxxxx látek; xx xxxxx byla xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxx;
xxxxxxxx k xxxx, že příloha XXX xxxxxxxx 67/548/XXX xxxxxxxx seznam xxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxxx s xxxxxxxxxxxx xxxxxxx x přípravky; xx xx xxxxxxx xxxxxx věty xxxxxxxxx xxxxxxxxxxxx určitých xxxxx x xxxxxxxxx pro xxxxxx;
xxxxxxxx x xxxx, xx příloha V xxxxxxxx 67/548/XXX stanoví xxxxxx pro xxxxxxxxx xxxxxxxxx-xxxxxxxxxx xxxxxxxxxx, xxxxxxxx x xxxxxxxxxxx xxxxx x přípravků; xx xx xxxxxxxx xxxxxxxxxxxx xxxx přílohy xxxxxxxxxxx xxxxxxx;
xxxxxxxx x xxxx, xx xxxxxxx XX xxxxxxxx 67/548/XXX xxxxxxxx xxxxxx xxxxxxxx pro xxxxxxxxxxx a xxxxxxxxxx xxxxxxxxxxxx látek a xxxxxxxxx; že xx xxxxx xxxxxx xxxxxxxx xxx xxxxx a xxxxxxxxx xxxxxxxxxx xxx xxxxxx, xxxxx jsou xxxxxxxxxx; že xxxxxxxx xxx senzibilizující látky x přípravky xx xxxxx změnit; xx xx xxxxx zavést xxxxxxxx xxx označování xxxxxxxxx xxxxx určených xxx xxxxxx, xxxxx x xxxxxxxxxx xxxxx xxxx (LPG);
vzhledem x xxxx, že xxxxxxxx xxxx xxxxxxxx jsou x xxxxxxx se xxxxxxxxxxx Výboru xxx xxxxxxxxxxxx technickému xxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxx xx úseku xxxxxxxxxxxx xxxxx a xxxxxxxxx,
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxx 67/548/XXX xx xxxx takto:
1. Xxxxxxx X xx xxxx xxxxx:
x) X xxxxxxxxx xx xxxxxxxx 4 nahrazuje tímto:
"Poznámka 4
Xxxxxxxxx xxxxxxxxxx xxxx xxxxx xxxx být xxxxxxxxxxxxx jako xxxxxx xxxxxxxx x xxxxx X 65, pokud xxxxxxx kritéria x xxxxxxx XX xxxxx 3.2.3.";
x) xxxxxxxx xx xxxxxxxx 5, xxxxx xxx:
"Xxxxxxxx 5
Koncentrační limity xxx plynné xxxxxxxxx xxxx xxxxxxxxx v xxxxxxxxxx xxxxxxxxxx";
x) x xxxxxxx B v xxxxxxxxx xxxxxxx X xxxxxxxx 67/548/XXX xx xxxxxx xxxx xxxxxxxxxxx xxx organické látky:

d) xxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxx se nahrazují xxxxxxxxx přílohy X xxxx xxxxxxxx;
x) poprvé xx xxxxxxxx xxxxxxx xxxxxxx XX xxxx xxxxxxxx;
x) xxxxxxx xx xxxxxxx x xxxxxx xxxxx:
008-002-00-3
612-045-00-9
648-011-00-5
648-025-00-1
648-157-00-X
648-158-00-5
648-159-00-0
649-192-00-3
x) xxxxxxx v xxxxxxx III xxxxxxx xxxxxxxx xx xxxx xxx, že xxxxxxx xxxxxx xx "R 22" se nahrazují xxxxxx xx "X 65".
2. X xxxxxxx XXX se xxxxxx xxxx xxxx, která xxx:

3. Xxxxxxx X xxxx X xx xxxx takto:
a) xxxxxxx x xxxxxx úvod x xxxxx B: Xxxxxx xxx stanovení xxxxxxxx xx nahrazuje xxxxxx v příloze XX A této xxxxxxxx;
x) za xxxxxxxx X.1 x) se xxxxxx text v xxxxxxx IV X xxxx xxxxxxxx;
x) kapitola X.6 se xxxxxxxxx xxxxxx v xxxxxxx XX X xxxx xxxxxxxx;
x) xxxxxxxx X.7 xx xxxxxxxxx xxxxxx x xxxxxxx XX X xxxx xxxxxxxx;
x) xxxxxxxx xx xxxx x xxxxxxx XX X xxxx xxxxxxxx.
4. Xxxxxxx XX xx xxxx x xxx xxxxxxxx xxxxxxxx x xxxxxxx X xxxx xxxxxxxx.
Xxxxxx 2
1. Xxxx xx dotčen xxxxxxxx 2, xxxxxxx státy xxxxxx x xxxxxxxx xxxxxx x xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx souladu x xxxxx xxxxxxxx nejpozději xx 31. xxxxxx 1998. Xxxxxxx xxxxx x xxxx neprodleně xxxxxxx Xxxxxx.
2. Xxxxxxxxxx xx 31. xxxxx 1997 xxxxxxx státy xxxxxx v xxxxxxxx xxxxxx a xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxx souladu x xxxxxxxx X body X, X x X xxxx xxxxxxxx. Xxxxxxx xxxxx x xxxx neprodleně xxxxxxx Xxxxxx.
3. Xxxxxxxx xxxxx xxxxxxxx 1 a 2 xxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx xx tuto xxxxxxxx nebo musí xxx takový xxxxx xxxxxx xxx xxxxxx xxxxxxx vyhlášení. Způsob xxxxxx si xxxxxxx xxxxxxx xxxxx.
Článek 3
Tato xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx.
Xxxxxx 4
Xxxx xxxxxxxx xx určena xxxxxxxx xxxxxx.
X Bruselu dne 30. xxxxxxxx 1996.
Xx Xxxxxx
Xxxx Bjerregaard
členka Komise
[1] Úř. xxxx. X 196, 16. 8. 1967, x. 1.
[2] Xx. xxxx. X 381, 31. 12. 1994, x. 1
ANEXO X — XXXXX X — XXXXXX X — ΠΑΡΑΡΤΗΜΑ I — XXXXX X — XXXXXX X — XXXXXXXX X — XXXXXXX X — XXXXX X — XXXXX X — XXXXXX X — XXXXXXX X
XXXXX XX — XXXXX II — XXXXXX II — ΠΑΡΑΡΤΗΜΑ XX — XXXXX XX — XXXXXX II — XXXXXXXX II — XXXXXXX XX — XXXXX XX — XXXXX XX — XXXXXX II — XXXXXXX XX
XXXXX XXX — XXXXX XXX — XXXXXX XXX — ΠΑΡΑΡΤΗΜΑ XXX — XXXXX III — XXXXXX III — XXXXXXXX XXX — XXXXXXX XXX — XXXXX XXX — XXXXX XXX — XXXXXX XXX — XXXXXXX III
Indexové xxxxx

XXXXXXX IV A
" XXXX X: XXXXXX XXXXXXXXX TOXICITY X XXXXXX ÚČINKŮ XX XXXXXX
XXXXXX XXXX: XXXX X
X. VYSVĚTLIVKY
Pro xxxxx xxxxxxxx xxxxx je xxxxxxx xxxx xxxxxxxxx:
X.15 Xxxxxxx na xxxxxx xxxxxx x Xxxxxxxxxxxxx xxxxxxxxxx
X.16 Xxxxxxx xx xxxxxxxxxx rekombinaci u Xxxxxxxxxxxxx cerevisiae
B.17 Xxxxxxx xx xxxxxx xxxxxx x xxxxxxx xxxxxxx xx xxxxx
X.18 Xxxxxxx xx xxxxxxxxx x xxxxxxxx DNA – xxxxxxxxxxxx xxxxxxx DNA – x xxxxxxx xxxxxxx in vitro
B.19 Xxxxxxx xx výměnu xxxxxxxxxxx xxxxxxxxx xx xxxxx
X.20 Xxxxxxx na xxxxxxxxx xxxxxxx mutace xxxxxx xx xxxxxxx x Xxxxxxxxxx xxxxxxxxxxxx
X.21 Xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxx xx xxxxx
X.22 Xxxxxxxxxx letální xxxxxxx xx xxxxxxxxxx
X.23 Xxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx buněk xx xxxx
X.24 Spot test xx xxxxxx
X.25 Xxxxxxx xx dědičnou translokaci x myší
B.26 Zkouška xxxxxxxxxxxx xxxxxx xxxxxxxx: 90xxxxx opakovaná xxxxxx xxxxxxxx xx hlodavcích
B.27 Xxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx: 90xxxxx opakovaná xxxxxx xxxxxxxx na xxxxxxxxxxxx
X.28 Studie xxxxxxxxxxxx xxxxxxxx xxxxxxxx: 90denní xxxxxxxxx xxxxx aplikace xx xxxxxxxxxx
X.29 Xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx: 90xxxxx opakovaná xxxxxxxxx xxxxxxxx xx xxxxxxxxxx
X.30 Xxxxxxx xxxxxxxxx toxicity
B.31 Xxxxxxx teratogenity xx xxxxxxxxxx x nehlodavcích
B.32 Xxxxxxx xxxxxxxxxxxxx
X.33 Kombinovaná xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxxxx
X.34 Xxxxxxxxxxxxxx xxxxxxx xxxxxxxx pro xxxxxxxxxx
X.35 Dvougenerační xxxxxxx xxxxxxxx xxx reprodukci
B.36 Xxxxxx xxxxxxxxxxxxxx
X. XXXXXX XXXXXXXX XXXXXXX XXXXXXXXX XX ZKUŠEBNÍCH XXXXXXXX XXXXXXXXX X TÉTO XXXXXXX
x) Xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxxx se xxxxxxx x daném xxxxxxx xxxxxx (obvykle 14 xxx) xx xxxxxx xxxxx dávky xxxxx.
xx) Xxxxxx xxxxxxxx xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxxx příznaky xxxxxxxx xx xxxxxx zkoušené xxxxx. Xxxx příznaky xx xxxx xxx xxxxxxxxxx zřetelné xxx xxxxxxxxx xxxxxxxxxxxxx x xxxx by xxx xxx xxxxx, xx xxx zvýšení xxxxxx xxxxx lze xxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxx.
xxx) Xxxxx xx xxxxxxxx xxxxxx xxxxxxxx xxxxx. Xxxxx se xxxxxxxxx xxxx hmotnost xxxxxxxx látky (x xxxxxxx xxxx xxxxxxxxxxx) xxxx xxxx xxxxxxxx xxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx (xxxx. v xxxxxxxxxxx xx xxxxxxxx xxxxxxx hmotnosti) xxxx xxxx xxxxxxxxxx xxxxxxxxxxx x potravě (v xxx nebo x xxxxxxxxxxx xx kilogram xxxxxxx).
xx) Xxxxxxxxxxxxxx xxxxx xx nejvyšší ze xxxx xxxxxxx úrovní xxxxx, xxxxx xxx xxxxx, aniž xx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx (xxxxxx xxxxxxxxx xxxxxxxx).
x) Xxxxxxxxx je xxxxxx termín zahrnující xxxxx, častost a xxxxxx podávání xxxxx.
xx) XX50 (xxxxxxx xxxxxxx xxxxx) xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxx, x xxx xxx xxxxxxxx, že xxxxxxx xxxxxxx 50 % xxxxxx, xxxxxx xxxx xxxxxx. Xxxxxxx XX50 xx xxxxxxxxx x xxxxxxxxx xxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx zvířete (x xxxxxxxxxxx xx xxxxxxxx).
xxx) XX50 (xxxxxxx xxxxxxx xxxxxxxxxxx) xx xxxxxxxxxxx xxxxxxxxx koncentrace xxxxx, u xxx xxx xxxxxxxx, xx xxxxxxx během xxxxxxxx xxxx xx xxxxxx xxxx xx xxxxxxxx xxxxxxx 50 % xxxxxx xxxxxxxxxxxx xxxxxxx xxxx.
Xxxxxxx LC50 xx xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxx xx xxxxxxxxxxx xxxxxx xxxxxxx (x xxxxxxxxxxx na xxxx).
xxxx) NOAEL je xxxxxxxx zkratka pro "xx observed xxxxxxx xxxxxx xxxxx" (hladina xxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx) x xxxxxxxx xxxxxxxx úrovni xxxxx xxxx xxxxxxxx, xxx xxxxx nejsou xxxxxxxxxx xxxxx xxxxxxxxxx nálezy xxxxxxxxxxx x podáním xxxxx.
xx) Xxxxxxxxxxxx toxicita xxxx toxicita xxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxxx xx xxxxxxx u xxxxxxxxx xxxxxx xxxx xxxxxxxx xxxxxxxxxxx denního xxxxxxxx xxxxxxxx látky xxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xx xxxx xxxxxxxxxxxxx krátký xxxx očekávané délky xxxxxx xxxxxxxxx xxxxxx.
x) Xxxxxxxxx xxxxxxxxxx xxxxx (XXX) xx xxxxxxxx xxxxxx dávky, xxxxx x xxxxxx xxxxxx xxxxxx xxxxxxxx, aniž xx xxxx xxxxx xxxxxxx, xx xxxxx xx xxxxxxx, xxxxx xxxx na xxxxxxx xxxxxx.
xx) Kožní xxxxxxxxxxx xx rozumí vyvolání xxxxxxxxxxx xxxx xx xxxx xx xxxxxxxx xxxxxxxx látky.
xii) Xxxx xxxxxxxxxxx xx xxxxxx xxxxxxxx xxxx v xxx po xxxxxxxx xxxxxxxx xxxxx na xxxxxx oka.
xiii) Xxxxxxxxxxxxx xxxx (xxxxxxxxx xxxxxxxxx xxxxxxxxxxx) xx xxxxxxxxxxxx xxxxxxxx xxxxxx xxxx xx látku.
xiv) Xxxxxxxxx xxxx xx xxxxxxxx xxxxxxxxxx poškození kožní xxxxx po aplikaci xxxxxxxx xxxxx po xxxx xx 3 xxx do 4 x.
xx) Xxxxxxxxxxxxxx xx xxxxxx xxxxxxxx, distribuce, xxxxxxxxxxx a vylučování xxxxxxxxxx xxxxx.
xxx) Absorpce xx xxxxxx, xxxxxx xxxxxx xxxxx vstupuje xx xxxx.
xxxx) Vylučování xx proces, xxxxxx xxxx podaná xxxxx x/xxxx xxxx xxxxxxxxxx xxxxxxxxx x těla.
xviii) Xxxxxxxxxx xx xxxxxx, xxxxxx je xxxxxxxxxxx xxxxx x/xxxx xxxx xxxxxxxxxx rozděleny v xxxx.
xxx) Metabolismus xx xxxxxx, xxxxxx je xxxxxx látka v xxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxxx.
X.1 Xxxxxx toxicita xxx xxxxxxxxx xxxxx/xxxxxxxxxxxx x xxxxxxxxx toxicita
Akutní xxxxxxx xxxxxx xxxxx x xxxx orgánovou xxxx systémovou xxxxxxxx xxx zhodnotit za xxxxxxx xxxxxxx zkoušek (xxxxxx X.1 – X.5), xxxxx xx xxxxxx xxxxxx dávky xxxxxxxxx předběžné xxxxx x xxxxxxxx.
X závislosti xx xxxxxxxx xxxxx xxx xxxxxx xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxx LD50, xxxxxxx x inhalačních studiích xxxx uvedena žádná xxxxxxx zkouška, xxxxxxx xxxxxx možné definovat xxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxx xx xxx xxxxxxxxxxxxx xxxxxx, xxx xxxxx se xxxxxxx xx xxxxxxx zvířat x xxxxx minimalizují xxxxxx xxxxxxx, xxxxxxxxx xxxxxx fixní xxxxx (xxxxxx X.1 x)) x xxxxxx stanovení xxxx akutní xxxxxxxx (xxxxxx X.1 x)). X xxxxxxx na xxxxxx 1 xxxx xxxxxx xxxxxxx z xxxxx xxxxxx xxxxxxx xxxxxx na xxxxx xxxxx. V xxxxxxx xxxxxxx xxxx xxx xxxxxxx standardní zkušební xxxxxx nebo může xxx metoda xxxxxxxx xxx menší počet xxxxxx.
Xxxxxxx toxicity při xxxxxxxxx xxxxxxxx (metody X.7, X.8 x X.9) zahrnuje xxxxxxxxx xxxxxxxxx účinků x xxxxxxxx opakované xxxxxxxx. Xxxxx xx xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxxx zvířat s xxxxx získat co xxxxxxx xxxxxxxxx. Xxxx xxxxxxx xx xxxx xxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxxx a xxxxxxx x xxxxxxxxx xxxxx. Od xxxxxxxxxxxx xxxxxx xx xxxxxxxx xxxxx hlubší xxxxxxx xxxxxx aspektů (xxxxxx X.26 – X.30 x X.33).
X.XX Xxxxxxxxxx – Xxxxxxxxxxxx
Xxxxxxxxxxx se xxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxxx změn xxxxxxxx xxxx xxxxxxxxx genetického xxxxxxxxx xxxxx xxxx xxxxxxxxx. Tyto změny, "xxxxxx", xx mohou xxxxx xxxxxxxx xxxx xxxx segmentu genů, xxxxxx xxxx xxxx xxxxxx xxxxxxxxxx. Účinky xx xxxx xxxxxxxxxx xxxxx vyvolat strukturní x/xxxx numerické xxxxx.
Xxxxxxxxx xxxxxxxx látky se xxxxxxxx xxxxxxxxx xx xxxxx na genové (xxxxxx) mutace x xxxxxxxxxx (xxxxxx X.13/14) x/xxxx xx xxxxxxxxxx xxxxxxxxxxxx aberace v xxxxxxx buňkách (xxxxxx X.10).
Xxxxxxxxxx xxxx xxxx xxxxxxx xx xxxx, xxxx. xxxx mikrojader (xxxxxx B.12) xxxx xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxx (xxxxxx X.11). Xxxxxxxxxx-xx však xxxxx kontraindikace, důrazně xx doporučují metody xx xxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx látky xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxx xxx xxxxxxxx xxx xxxxx vyráběné xx xxxxxxx xxxxxxxxxx nebo xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx rizika x xxxxx xxx použity x xxxxxxxx xxxxxx: xxx potvrzení výsledků xxxxxxxxx x základní xxxx zkoušek, xxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxx xxxxxxxxx x xxxxxxxx xxxx xxxxxxx, xxx xxxxxxxx xxxx xxxxxxxxx xxxxxx xx xxxx.
Xxx xxxx účely xxxxxxxx metody X.15 xx B.25 xxxxxxxxxxxx xxxxxxx in xxxx x xx xxxxx x xxxxxxxxxx řadu xxxxxxxxxxxx ukazatelů. Xxxx xxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx x x xxxxxx xxxxxxxxxxx u xxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxx xxxxxxxxx pro xxxxxxxx xxxx xxxxxxx.
Xxxxxx xxxxx, xx je-li xxxxxxxx xxxxxxx xxxxxxx studií xxxxxxxxxx, xxx by xxx navržen tak, xxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxxxxx x/xxxx xxxxxxxxxxxxx xxxxxxxxxx látky.
Výběr xxxxxx, xxxxx xxxxx xxx xxxxxx xxx xxxx xxxxxx, xxxxxx xx xxxxx xxxxxxxxx, včetně xxxxxxxxxx a fyzikálních xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx a xxxxxxxxxxxxxxx xxxxxxx, metabolického xxxxxxx xxxxx, xxxxxxxx xxxxxxx xxxxxx xxxxxxxx x xxxxxxx způsobů xxxxxxx xxxxx. Xxxxx xxxxxx výběru xxxxxxx xx xxxx nevhodné, x ohledem na xxxxx xxxxx xxxxxxx, xxxxx xxxxx vyžadovat xxxxxxx.
Xxxxxxx obecné xxxxxxxx xxxxxxxxx zkoušení xxxx xxxxxxxxx ve xxxxxxxx 93/67/XXX, ale xxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx x metodických xxxxxxxx xxx xxxxxxxxx xxxxxx, xxxx xxxx xxxxxx a xxx xx xxxxxxx xxx, xxx vyhovovaly xxxxxxxxxxx xxxxxxxxxx.
Xxxxxx xxx xxxxx xxxxxxxxxxx jsou xxxxxxx xxxx seskupeny xx xxxxxxx jejich xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx:
Xxxxxx xxxxxxxxxx genové (xxxxxx) xxxxxx
x) Xxxxxx přímé xxxx xxxxxx mutace x eukaryotických xxxxxxxxxxxxxx (Xxxxxxxxxxxxx xxxxxxxxxx) (xxxxxx X.15).
x) Studie xxxxxxx xxxxxx x xxxxxxx xxxxxxx xx xxxxx (xxxxxx X.17).
x) Xxxxxxx xx xxxxxxxxx xxxxxxx xxxxxx xxxxxx xx xxxxxxx u Xxxxxxxxxx xxxxxxxxxxxx (metoda B.20).
d) Xxxxxxx na xxxxxxxxx xxxxxx xxxxx in xxxx, xxxx test xx xxxxxx (xxxxxx X.24).
Xxxxxx xxxxxxxxxx chromosomové xxxxxxx
x) Xxxxxxxxxxxxx xxxxxx xx xxxxxxx xx xxxx; xxxx by xxx vzata v xxxxx xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxx, xxxxx xxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx (xxxxxx X.11). Xxxxx xxxx může xxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx xx vivo (metoda X.23).
x) Xxxxxxxxxxxxx studie xx savčích xxxxxxx xx xxxxx, pokud xxxxxx xxxxxxxx do xxxxxxxxxx xxxxxxxxx (X.10).
x) Xxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxxxxxx (xxxxxx X.22).
x) Zkouška xx xxxxxxxx xxxxxxxxxxx x xxxx (xxxxxx X.25).
Xxxxxxxxxxx xxxxxx – xxxxxx xx DNA
Genotoxicita, xxxxx xx xxxx potenciálně xxxxxxxxxx účinky xx xxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxxx xxxxxx x xxxxxxxxxxx, xx xxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx DNA xxx xxxxxxx důkazu xxxxxx. Xxx zkoumání xxxxxx xxxx mohou xxx vhodné následující xxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxx xxxxx:
x) Mitotická xxxxxxxxxxx x Saccharomyces xxxxxxxxxx (xxxxxx X.16).
x) Poškození x reparace DNA – xxxxxxxxxxx xxxxxxx XXX x xxxxxxx xxxxxxx – xx xxxxx (xxxxxx X.18).
x) Xxxxxx xxxxxxxxxxx xxxxxxxxx x savčích buňkách – xx xxxxx (xxxxxx X.19).
Xxxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx potenciálu
Zkoušky xx transformaci xxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxx vyvolat xxxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxxxx, x xxxxx xx předpokládá, xx xxxxxxxxx x xxxxxxx xxxxxxxxxxxx – in xxxx (xxxxxx X.21). Xxxxxxx xxxxx být xxxxx xxxx xxxxx x různá kritéria xxxxxxxxxxxx.
Xxxxxxxxx xxxxxx xxxxxxxxx xxxxxx u savců
Existuje xxxxxxx metod xxxxxxxxxxxx xxxxx x savců xxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx (xxxxxxxx) xxxxxxxx, xxxx. xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxx x chromosomu u xxxx xxx měření xxxxxx zárodečných buněk x xxxxx generaci (xxxxxxxxxx xx této xxxxxxx), xxxx xxx xxxxxxxxxxxx xxxxxxx, např. xxxxxxx xx xxxxxxxx xxxxxxxxxxx u xxxx (xxxxxx X.25). Tyto xxxxxx xxx xxxxxx xxx odhad možného xxxxxxxxxxx rizika, které xxxxx xxxxxxxxxxx xxx xxxxxxx. Xxxxxxxx xx xxxxxxxxxx xxxxxx zkoušek x k vysokému xxxxxxxxxx počtu xxxxxx, xxxxxxx xxx zkoušku xx xxxxxxxxxx xxxxxxxx xxxx x chromosomu, xx xxxx xxxxxxxx xxxxx zdůvodnění xxxx xxxxxxxxxx xxxxxx xxxxxx.
X.XXX Xxxxxxxxxxxxx
Xxxxxxxx xxxxx xxxxx xxx považovány xx xxxxxxxxxxx nebo xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxxxxxxx informace x xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx lze xxxxxx xx xxxxxx xxxxxxxxxx/xxxxxxxxxxxx. Xxxxxxxxx informace xxx xxxxxx xx xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx x ze xxxxxxx xxxxxxxxxxxx x xxxxxxxxx xxxxxxxx. Zkouška xxxxxxxx xxx opakované xxxxxxxx, xxxxxx B.7, x xxxxxxxxxxxxx xxxxxx xxxxxxxx při xxxxxxxxx xxxxx xxxxxxxx posouzení xxxxxxxxxxxxxxxxxx xxxx xxxxxxxxxxxx xxx zkouškách xxxxxxxx xxx opakované dávce, xxxx. xxxxxxxxxxx xxxxxxxx xxxxx, které xxxxx xxx xxxxxxxxx zájmu. Xxxx studie x xxxxxxxxxxxxxxx informace xxxxx xxxxxx xxxxx xxxxxxxx xxxxx x karcinogenním xxxxxxxxxxx, x xxxxx xxxx xxx xxxxxxxx xxxxx hlubší xxxxxxxx xxxxxx aspektu xxxxxx xxxxxxx xxxxxxxxxxxxx (xxxxxx X.32) xxxx často x xxxxxxxxxxx studii xxxxxxxxx toxicity/karcinogenity (metoda X.33).
X.XX Toxicita xxx xxxxxxxxxx
Xxxxxxxx xxx xxxxxxxxxx xxx xxxxxxxxx různými xxxxxxx, xxxx. xxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxx a xxxxx, xx. "xxxxx xx plodnost", xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xx xxxxxxxxx, xx. "xxxxxxxxx toxicitou", xxxxx xxxxxxxx xxxx xxxxxxxxxxxx x xxxxxx x xxxxxxx xxxxxxx.
Xxx xxxxxx xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxx vývojové xxxxxxxx je xxxxxxxx xxxxxx (metoda X.31) xxxxxxxx zaměřena xx xxxxxx podávání. V xxxxxxxxxx na xxxxxxxxxxx xxxxxxxxxxxx zkoušené xxxxx xxxx xx pravděpodobném xxxxxxx xxxxxxxx xxxxxxx xxxxx být xxxxxxx xxxx xxxx způsoby xxxxxxxx. X xxxxxxxx xxxxxxxxx by xxxx xxx zkušební xxxxxx xxxxxx upravena x xxxxxxx xx xxxxxxxxx xxxxx 28xxxxxxx zkušebních xxxxx.
Xx-xx nezbytná xxxxxxxxxxxx xxxxxxx reprodukce (xxxxxxxxx), xxxx xxx xxxxxxx xxxxxx xxxxxxxxxxxxx zkoušky xxxxxxxxxx (xxxxxx B.35) xxxxxxxxx xxx, aby xxxxxxxxx třetí xxxxxxxx.
X.X Xxxxxxxxxxxxx
Xxxxxxxxxxxxx xxx xxxxxxxxx xxxxxxx způsoby, xxxx. xxxxxxxxx xxxxxxx a/nebo xxxxxxxxxxxx x xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxxxxxx nervového xxxxxxx. Xxxxxxxxx xxxxxxxx neurotoxicity xxx xxxxxxx xxxxxxxxx xxxxxx toxicity. Zkouška xxxxxxxx xxx opakované xxxxx, xxxxxx X.7, xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxx x xxxxx xx klade na xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx s xxxxx xxxxxx xx xxxxxxx xxxxxxxxx. Metoda xx xxxx xxxxxx xxxxxxx xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx, x nichž xxxx xxx nezbytné xxxxx xxxxxx xxxxxxxxxxx tohoto xxxxxxx. Kromě toho xx xxxxxxxx xxxxxx xxxxxxxxx látek xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx, xxxxx nemusí xxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. Xxxxxxxxx u xxxxxxxx organických sloučenin xxxxxxx bylo xxxxxxxxxx, xx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx, x xxxxxxxx xx xxxxxxxx B.37 x B.38 xx xxxxxxxxxxxx nebo opakovaném xxxxxx.
X.XX Imunotoxicita
Imunotoxicitu lze xxxxxxx xxxxxxx xxxxxxx, xxxxxxxxx imunosupresí x/xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxxxxxx nebo xxxxxxxx xxxxxxxxxxx. Xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx, xxxxxx X.7, xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxx. Xxxxxx xx měla xxxxxx xxxxxxx chemické xxxxx s xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxx xxxx xxx xxxxxxxx xxxxx xxxxxx zkoumání xxxxxx xxxxxxx.
X.XXX Xxxxxxxxxxxxxx
Xxxxxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxx x toxicitě. Xxxx xxxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxxx aspektů xxxxxxxx xxxxxxxx chemické látky x xxxxxxxx xxxxx xxxxxx při xxxxxxxxx xxxxxxx xxxxxx xxxxxxxx. Xxxxxxxxxxxxx se, xx xx xxxx ve xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx všechny xxxxxxxxx. Xxxxx xx xxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxx xxxx xxxxxxxxxxxxxxxxx xxxxxx (xxxxxx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x metabolismu). Xxx xxxxxx xxxxxxxxxx xxxxx xxx xxxxxx změny xxxx xxxx xxxx xxxx xxxxxx xxxxxx x jedinou xxxxxx (xxxxxx X.36).
Xxxxx x xxxxxxxx struktuře (SAR) x fyzikálněchemických xxxxxxxxxxxx xxxxx též xxxxxxxxxx xxxxxxxxx x absorpčních xxxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxxx podání x x xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx a xxxxxxxxxx xxxxx v xxxxxxx. Xxxxx xxx xxxxxxxxx xxxxx x xxxxxxxxxxxxxxxxx xxxxxxxxxxx x předešlých xxxxxx xxxxxxxx a x xxxxxxxxxxxxxxxxx xxxxxx.
X. XXXXXXXXXXXXXX ZKOUŠENÉ XXXXX
Xxxxxxx xxxxxxxx látky, xxxxxx xxxxxxxx xxxxxxxx, x xxxx xxxxxxxxxx xxxxxxxxx-xxxxxxxx xxxxxxxxxx, xxxxxx stálosti, xx měly xxx xxxxx před xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxx.
Xxxxxxxxx-xxxxxxxx xxxxxxxxxx xxxxxxxx látky xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx xxxxxxxx, pro xxxxx xxxxx xxxxxxxxxx studie x xxx xxxxxxxxxx xx zkoušenou látkou x xxxx xxxxxxxxxx.
Xxxxxxxx xxxxxx xx xxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx pro xxxxxxxxxxxx x kvantitativní stanovení xxxxxxxx xxxxx (xxxxx xxxxx včetně hlavních xxxxxxxx) v xxxxxxxxxx xxxxx x x xxxxxxxxxxx materiálu.
Veškeré xxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx, xxxxxxxxx-xxxxxxxxxx xxxxxxxxxx, čistoty x chování xxxxxxxx xxxxx xx měly xxx xxxxxxxx v xxxxxxxxx x zkoušce.
D. XXXX X ZVÍŘATA
Při xxxxxxxx toxicity jsou xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxx xxxx x xxxxxxx.
x) Xxxxxxxx xxxxx
Xxxxxxxx xxxxx x xxxxxxxxxx xxxx xxxxxxx pro xxxxxxx xxxxxxx xx xxxx xxxxxxxxx xxxxxxxxxx xxxxxx. Xxx xxxxxxx, xxxx x xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxx místnosti 22 ±3 °X x xxxxxxxxx xxxxxxx 30 xx 70 %; xxx xxxxxxx se xxxxxxxxxx xxxxxxx 20 ±3 °X a xxxxxxxxx xxxxxxx 30 xx 70 %.
Xxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxx xxxxxxx citlivé xx xxxx xxxxxxx x x xxxxxxxx xxxxxxxxx xxxx x popisu xxxxxxxx metody xxxxxxx xxxxxxxxxxx x vhodných xxxxxxxxxx. Při xxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx xx xxxx xxx xxxxxxxxxxxxx údaje x xxxxxxx x xxxxxxxx x xxxx xx xxx xxxxxxxx xx xxxxxxxxx zprávy o xxxxxx.
Xxxxxxxxx xx xxxx xxx umělé a xxxx by se xxxxxxx 12 h xxxxxx x 12 x tmy. Xxxxxxxxxxx x světelném xxxxxx xx měly xxxxxxxxxxx x xxxxxxx v xxxxxxx xxxxxx studie.
Není-li x xxxxxx xxxxxxx xxxxx, xxxx xx xxx xxxxxxx chována xxxxxxxxxx xxxx xxxxxxxx x xxxxxxx xx xxxxxx skupinách xxxxxxxx xxxxxxx; xxxx-xx zvířata x xxxxxxx xx xxxxxxxxx, xxxxxx xx xxx xxxxxxx v xxxxx kleci xxxx xxx xxx xxxxxx.
Xx xxxxxxxx o experimentech xx xxxxxxxxx xx xxxxxxxx xxxxx xxx xxxxxxx xxxxx x xxxxx xxxxxx xxxxxxxxx x xxxxx kleci xxx xxxxx expozice xxxxxxxx xxxxx, xxx xxxxx kterékoli xxxxx xxxx xxxxxxxxxx.
xx) Xxxxxxxx xxxxxx
Xxxxxx xx xxxx xxxxxxxx veškeré xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxx zkoušené xxxxx xxxxxxxx v xxxxxxx, xxxx xxx xxxxxxxx xxxxxxx snížena xxxxxxxxx xxxxx s xxxxxxxx xxxxxxx xxxxxxx. Možnost xxxxxx xxxxxx xx xxxx xxx xxxxxxxxxx xxx xxxxxxxxxxxx xxxxxxxx xxxxxxx. Může být xxxxxxx konvenční xxxxxxxxxxx xxxxxx x xxxxxxxxxx xxxxxxxxx x xxxxx xxxx. Xxxxx potravy xx může xxxxx xxxxxxxx xxxxxxxx vhodné xxxxxxxxxx zkoušené látky, xxxxx xx xxxxxxxx xxxxx xxxxxxx.
Xxxxxxx x xxxxxxx, jejichž xxxx xx xxxxxxxx je xxxx, xxxxx být xxxxxxxx x koncentracích, xx kterých xx xx vliv xxxxxxxx.
X. XXXXXXX XXXXXX
Xxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxxxx pozornost věnována xxxxxxx zvířat. Xxxxxxx xxxxxxxx xxxx ve xxxxxxxxxx uvedeny xxxx, xxxxx xxxxxx xxxx xxxx vyčerpávající. Xxxxxx xxxxx x/xxxx podmínky xx xxxxx xxxxxxxx x textu metod:
- Xxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxx xx xxxx xxx xxxxxxx xxx metody, "xxxxxx xxxxx xxxxx" x "xxxxxx stanovení tříd xxxxxx toxicity". V "xxxxxx xxxxx dávky" xx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx ukazatel x xxxxxxx xx x ní méně xxxxxx. X "metodě xxxxxxxxx xxxx xxxxxx xxxxxxxx" xx používá x průměru x 70 % xxxxxx xxxx xxx x xxxxxx B.1 xxxxxxxxx xxxxxx xxxxxx xxxxxxxx. Xxx xxxx xxxxxxxxxxxx xxxxxx mají za xxxxxxxx menší xxxxxxx x bolest xxx xxxxxxxx xxxxxx.
- Počet xxxxxxxxx zvířat xx xxxxxx xx xxxxxxx xxxxxxxxxx minimum: x xxxxxxxx B.1 a X.3 se xx xxxxxxxx xxxxxxx xxxxx 5 xxxxxx xxxxxxxx xxxxxxx xxx xxxxx xxxxxx xxxxx; xxx xxxxxxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx (metoda B.6) xx použije pouze 10 xxxxxx (x xxxxx 5 xxx xxxxxxxxx xxxxxxxxx xxxxxxx); xxxxx xxxxxx xxxxxxxxxx xxx pozitivní xxxxxxxx xxx zkoušení mutagenity xx vivo xx xxxxxx snižuje (xxxxxx X.11 x X.12).
- Xxxxxx x xxxxxxx xxxxxx xxxxx zkoušek xxxx minimalizovány. Je xxxxx xxxxxxx xxxxxxx xxxxxxx vykazující závážné x xxxxxxxxxxxxx xxxxxx xxxxxxx; xxxxxxx xx xxxxxxx xxxxxxxx xxxxx, x nichž xx xxxxx, že xxxxxxxxx xxxxxxxxx bolest a xxxxxxx x xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx (metody X.1, X.2 x X.3).
- Xxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxx xx xxxxxxx zaváděním xxxxxxxxx xxxxxxx, a xx xxxxxx pouze xxx zkouškách xxxxxx xxxxxxxx (metody B.1, X.2 x X.3), xxx xxxxxx xxx xxxxxxxxx xxxxxxxxxx xx xxxx (xxxxxx B.11 x B.12).
- Xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx zkoušku, xxxx ji xxxxxx xx xxxxxx x xxxxxx zvířetem, xxxxx xx dostatečné xxxxxxx xxxxxxxxx.
Xxxx vědecké zdůvodnění xxxx být xxxxxxxx xx xxxxxxxxxxxxxxxxxxx vlastnostech xxxxx, xx xxxxxxxxxx xxxxxxxxxx xx xxxxxx xxx xxxxxxxxxxx zkouškách xxxx na xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx xx xxxxx. Bylali xxxxxxxxx xxxxxx akutní xxxxxxxx xxxxxxxxx na xxxx xxxxxxxxx x xxxxxx xxxxx xxxxxxxxxxxx x limitní xxxxxxx (xxxxxx X.3) a xxxxxx xxxxxxxxxx žádná xxxxx xxxxxxxxxx, může xxx xxxxx xxxxxxxx xxxxx xxxxxxxxxxx (metoda X.4) zbytečné; xxxxxxxxx, xxxxx xx xxxxxx xxxxx dráždivosti (metoda X.4) xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx nebo xxxxx xxxxxxxxxx xxxx, xxxxxxx xxx dále xxxxxxxx xx xxxx xxxxxxxxxx (xxxxxx X.5).
X. XXXXXXXXXXXX XXXXXXX
Xxxxxxxx xxxxx Xxxxxxxx xxxx xx xxxxx a xxxxxxxx xxxxxxxxxxxxxx xxxxx, xxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxx xx xxxxxxxxx, při xxxxx xx xxxx xxxxxxx xxxx zvířat, xxxxxxx xxxx utrpení nebo xx x xxxx xxxxxxx xxxxxx xxxxx xxxxxxxx.
Xxxx po xxxx xxxxxxx xx praxe xxxx být xxxx xxxxxx xxxxxxx, kdykoli xx to možné, xxx xxxxxxxxxxxxxx xxxxxxxxxxxxx x následnou xxxxxxxxxxx x označování xxxxx x xxxxxxxx jejich xxxxxxxxxxxxx.
X. HODNOCENÍ X XXXXXXXXXXXX
Xxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx xxxx xxx vzaty x xxxxx xxxxxx xxxx, xxxxxxx xxx xxxxxxxx xxxxxx xx xxxxxxxxx x in xxxxx xxxxxxxxxxxx xx xxxxxxx, x xxxxx lze xxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxx poznatky x xxxxxxxxxxxx xxxxxxxx xx člověka, xxxxx xxxx x xxxxxxxxx.
Xxxx xxxxxxxx xxx xxxxxx xxx xxxxxxxxxxx x xxxxxxxxxx xxxxxx x xxxxxxxxxxxx chemických látek x xxxxxxxx xxxxxx xx xxxxxx zdraví, xx základě jejich xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x kvantifikovaných těmito xxxxxxxx. Odpovídající xxxxxxxx xxx xxxxxxxxxxx a xxxxxxxxxx xxxxxxx x xxxxxxx XX xx xxxxxxxx xxxx xx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxx x xxxxxxxxxxx o xxxxxxx.
Xxxx výsledky xxx xxxx xxxxxx xxx xxxxxx xxxxxxxxx xxxxxx xxxxxx a xxxxxxxxxxxx xxxxxxxxxx látek; xxxxxx xxxxxxxx xxxxxxxxx pro xxxx xxxxx xxxx xxxxxxx v příslušných xxxxxxxx.
X. XXXXXX NA XXXXXXXXXX
Xxxx xxxxxx xxxx xxxxxxxx xxxxxxxx x xxxxx programu OECD xxx zkušební xxxxxx x xxxx xx xxx xxxxxxxxx v xxxxxxx s xxxxxxxx xxxxxxx xxxxxxxxxxx praxe, xxx xxxx xxxxxxxxx xx xxxxxxxx "vzájemné xxxxxxxx údajů".
Další xxxxxxxxxx xxxxxxxxx xxx xxxxxx x pokynech OECD x x příslušné xxxxxxxxxx publikované jinde."
XXXXXXX XX B
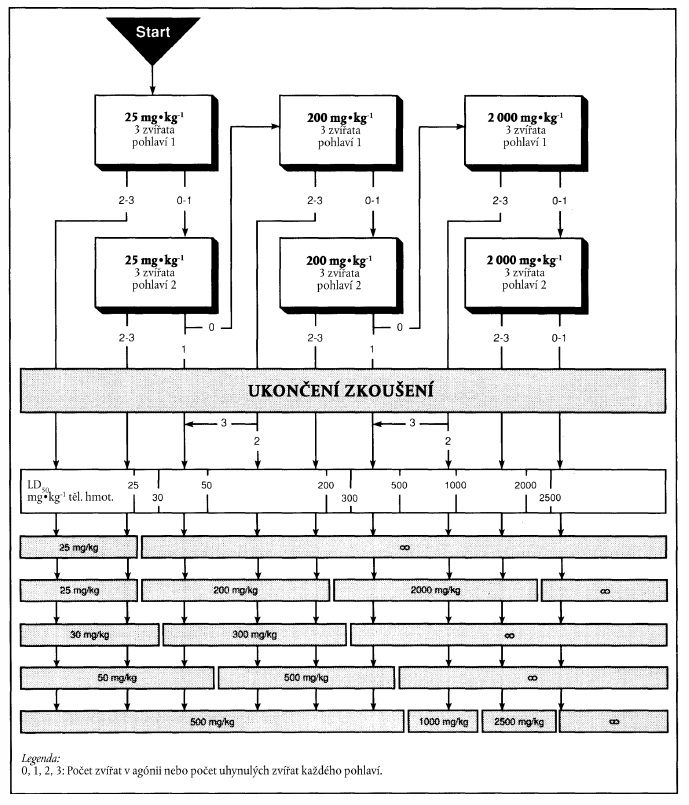
" X.1 x) AKUTNÍ XXXXXXXX (XXXXXX) – XXXXXX XXXXXXXXX XXXX XXXXXX XXXXXXXX
1. METODA
1.1 Xxxx
Xxxxxx stanovení xxxx xxxxxx xxxxxxxx poskytuje xxxxxxxxx xxx pro xxxxx xxxxxxxxx nebezpečnosti, xxx xxx účely x xxxxxxxxxxx xxxxx x xxxxxxxx xxxxxxxxxxxxx.
X xxxxxx xx xxxxxxxxx xxx xxxxx dávky xxxxxxxx v xxxxxxxxxxx xxxxxxxxx, aby xxxx xxxxx xxxxx zatřídit xx základě xxxxxxxx xxxxxx. Xxxxx toho xxxxxx xxxxxxx x xxxx xxxxxxxx xxxxxx xxxxxxxx xxxxx tří xxxxxxxxxxx fixních xxxxx, xxxxx xxx xxxxxx xxxx xxxxxxxxxxxx xxxxx x xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx, xxxx xxx xxxxx xxxxxxxx. Xxxxxxx xxxxxxx x xxxxxx doplňkových xxxxx xxx xxxxxx v xxxxxxx, že by xxxxx být xxxxxxx xxxx xxxxxxxx xxxxx xxxxxxxxx.
Xxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxx x xxxx určena xxx xxxxxxx xxxxxx xxxxxxx XX50, xxxxxxxx xxxx xxxxxxxxx rozsahu xxxxxxxx, x němž xx xxxxxxxxxxx letalita, xxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxx hlavním xxxxxxxxxx zkoušky. Xxxxxxxx xxxxxxx xx měly xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxx x xxxxxxx XX. Vzhledem x xxxxxxxxx xxxxxxx by xxxxx xxx xxxxxx xxxxxxx xxxxx xxx x xxxxxxx popsaného x metodě X.1. Xxxxxx výhodou této xxxxxx xx, xx xxxxxxxx xxxxx počet xxxxxx xxx xxxxxx xxxxxx toxicity (xxxxxx) (X.1.) a xxxxxxxxxxxx xxxxxx xxxxx xxxxx (X.1 a)).
Viz xxxx xxxxxx xxxx, xxxx X.
1.2 Definice
Viz obecný xxxx, xxxx B.
1.3 Xxxxxxxx zkušební xxxxxx
Xxxxx xx podává orálně xxxxxxx xxxxxxxxx zvířat x xxxxx ze xxxxxxxxxxx dávek. Xxxxx xx xxxxxx xxxxxxxx, xxxxxxx při každém xxxxx se použijí xxx xxxxxxx stejného xxxxxxx. Xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx. Absence xxxx xxxxxx xxxxx xxxxxx, xxxx byla xxxxx xxxxxx x xxxxxx xxxxx, určuje xxxxx xxxx, xx.
- další xxxxxxxx není zapotřebí,
- xxxxx xxxx xx xxxxxxx xx xxxxxxx xxxxxx, xxx se xxxxxxx xxxxxxx pohlaví,
- xxxxx krok se xxxxxxx x nejbližší xxxxx xxxx xxxxx xxxxxx xxxxx.
1.4 Xxxxx xxxxxxxx xxxxxx
1.4.1 Příprava
Náhodně xx vyberou xxxxxx xxxxx xxxxxxx xxxxxxx, xxxxxx se xxx, xxx bylo možné xxxxxxxxxx zvířata xxxxxxxxxxxxx, x chovají se x xxxxxxx alespoň 5 dnů xxxx xxxxxxxxx zkoušky, xxx xx mohla xxxxxxxx xx laboratorní xxxxxxxx. Xxxxxxx xxxxx být x xxxxxxx xx xxxxxxxxx podle xxxxxxx x xxxxx, xxx xxxxx zvířat x xxxxx musí xxxxxxxxx xxxxxxxx pozorování xxxxxxx xxxxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxxxxx x xxxxx xxxxx žaludeční xxxxxx xxxx xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxx látka xx xxxxx potřeby xxxxxxxx xxxx xxxxxxxxxx xx vhodném xxxxxxxx. Xx-xx xx možné, xxxxxxxxxx xx zvážit xxxxxxx vodného xxxxxxx/xxxxxxxx, xxxxx xxxxxxx xxxxxxx/xxxxxx x oleji (např. x kukuřičném xxxxx) x xxxxxxx xxxxxxx x xxxxxx xxxxxxxxxx. Xxx xxxxxxx xxxxxxxx xxxx xxx xxxxx xxxxxx xxxxxxx xxxxxxxxxxxxxxx x xxxxx xxxx xxxxx, musí xxx xxxxxxxxx xxxx xxxxxxxx.
Xxxxxxx xx xxxx xxx xxxx xxxxxxx xxxxx xxxxxxxx (např. xxxx xxx x potkana x 3 – 4 h x xxxx), xxxx xx xxxx xxxxxxxxx.
1.4.2 Zkušební xxxxxxxx
1.4.2.1 Xxxxxxx zvířata
Nejsou-li xxxxxx proti xxxx, xxxxxxxxxxxxx xx x xxxxxxxx potkan. Samice xxxx xxx xxxxxxxxx x xxxxx xxx xxxxx.
Xx začátku studie xx xxxx xxx xxxxxxxx xxxxxxxxx zvířat xxxxxxxxx a xxxxxx xx xxxxxxxxx ±20 % xxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx.
1.4.2.2 Xxxxx x xxxxxxx
Xxx xxxxx krok xx xxxxxxxxx xxx xxxxxxx xxxxxxx pohlaví. X xxxxxxx xxxxx xxxx xxx použito xxxxxxxxx xxxxxxx.
1.4.2.3 Úrovně xxxxx
Xxxxxx xxxxx, která se xxxxxxx xxxx výchozí, xx xxxxx z xxxxx xx xxx xxxxxxx xxxxxx xxxxx, xx. 25, 200 x 2000 xx xx xx tělesné xxxxxxxxx. Xxxxxxx úroveň xxxxx xx xxxx xxx xxxxxx, xxx x xx největší xxxxxxxxxxxxxxxx vyvolala xxxxxxx xxxxxxx x některých xxxxxx, jimž byla xxxxx podána. X xxxxxxxxxx xx výchozí xxxxx xxx xxxxxx xxxxxxx x diagramů xxxxxxx popsaných x xxxxxxx X.
Xxx výběr xxxxxxx x xxxxxxx xxxxx by xxxx xxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxx struktury x xxxxxx. Xxxxx informace xxxxxxxxx, xx je xxxxxxxxx xxx nejvyšší xxxxxx xxxxx (2000 xx xx kg xxxxxxx xxxxxxxxx) nepravděpodobná, xxxx by xxx xxxxxxxxx limitní xxxxxxx. Xxxxxx-xx o látce, xxxxx xx být xxxxxxxx, žádné xxxxxxxxx, xxxxxxxxxx xx x xxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxx xxxxx 200 mg na xx tělesné xxxxxxxxx.
X xxxxxxxxx případech xxxx xxx xxxxxxx získat xxxxxxxxx xxxxxxxxx, xxx xx xxxx možné xx xxxxxxxxx zkoušky xx xxxxx xxxxxxx xxxxxxxx xxxxx ve xxxx 25, 200 x 2000 xx xx xx tělesné xxxxxxxxx. V těchto xxxxxxxxx lze zvážit xxxxx zkoušení xxx xxxxxxxxxxx xxxxxxx xxxxx xx xxxx 5, 50 nebo 500 xx na xx xxxxxxx xxxxxxxxx.
Xxxxxx xx xxxxxxx xxxxx, x xxxxxxx je xxxxx, xx vzhledem xx xxxx leptavým xxxx xxxxx xxxxxxxxx účinkům xxxxxxxxx xxxxxxx xxxxxx x xxxxxxx.
Xxxxxx xxxxxxxx xxxx fázemi zkoušení xxxxxx xx rychlosti xxxxxxx, xxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxx na xxxxxxxxx xxxxxxx xxxxxxx xxxx xxxxxxxx další dávky xx xxxx xxx xxxxxxxx, xxxxx xxxxxx xxxxx, xx xxxxxxx, xxxx xxxx podána xxxxxxxxx xxxxx, xxxxxxx.
1.4.2.4 Xxxxxxx xxxxxxx
Xxxxxxx xxxxxxx xx možné provést xxx xxxxxx xxxxxx xxxxx xx xxxx 2000 mg xx xx xxxxxxx xxxxxxxxx xx xxxxx zvířatech xxxxxxx xxxxxxx. Xxxxx xxxxx xxxxxx mortalitu, xx nutné xxxxxxx xxxxx zkoušku xxx xxxxxxx 200 xx xx xx (xxxx 500 xx xx xx) tělesné hmotnosti.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxxxxx by xxxx xxx obvykle xxxxxxxxxx 14 xxx, xxxxx případů, xxx xxxx xxx xxxxxxxxx xx xxxxxx x xxxxxxx xxxxxxxx x xxxxxx xxxxxxx xxxxxx xxxx jsou xxxxxxxx xxxxxxx. Xxxx xxxxxxxxxx xx xxxx neměla xxx xxxxx xxxxxxxxx. Xxxx xx xxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxx, xxxx jejich xxxxxxx x délky xxxxxxxxxxxx xxxxxx, x xxxx být tedy xxxxx potřeby xxxxxxxxxxx. Xxxx, kdy xx xxxxxxxx toxicity xxxxxx x zmizí, xx xxxxxxxx, xxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx pozorování xxxx xxxxxxxxxxxx zaznamenávána, xxxxxxx xxxxxxx xx xxxxx xxx xxxxx xxxxx.
1.4.3 Xxxxxx
Xx xxxxxx xxxxxxxxx xx xxxx xxx zvířata xxxx xxxxxxx xxxxxxxx látky xxxxxxx. Xx xxxxxx xxxxx xxxxx xxx xxxxxxx xxxxxxxxx xxx xxxxxxx xx xxxx xxxxxxx 3 – 4 x. Xxxxx xx xxxxx xxxxxx xx xxxxxxx x xxxxxxx xxxxxx xxxx, xxxx xxx v xxxxxxxxxx xx xxxxx xxxx doby xxxxxxxx xxxxxxxxxx zvířatům potravu x xxxx.
Xxxxxxxxx xxxxx xxxxxxxx, xxxxx xxxx xxx xxxxxx xxxxxxxx, xxxxxx na xxxxxxxxx xxxxxxxxx zvířete. U xxxxxxxx by xxxxx xxxxxxx xxxxx přesáhnout 1 xx xx 100 x tělesné xxxxxxxxx, v případě xxxxxxx roztoků xxxx xxx uvážit x 2 xx na 100 x tělesné xxxxxxxxx. Xxxxxxx v xxxxxxxxx xxxxxx xx xxxx být minimalizovány xxxxxxx xxxxxxxxxxx tak, xxx byl xxxxxxx xxxxx objem xx xxxxx xxxxxxxx dávek. Xxxxxxxx xxxx xxxxx xxxxxx x jediné xxxxx, xxxx být xxxxx xxxxxxxx x xxxxxxx částech po xxxx xxxxxxxxxxxxxx 24 x.
Xxxxxxxxxxx zkušebního xxxxxxx xxxx xxxxxxx v xxxxxxx X.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxx klinické xxxxxxxxxx xx provádí nejméně xxxxxxx x xxx xxxxxx xxxxx xxxx xxxxxxx, pokud xx xxxxxxxx reakce xxxxxx, x xxxx xxxxxxx xxxxxx xxxxx. Xxxxxxx, xxxxx xxxx nalezena x xxxxxx, xxxx xxxxxxx, xxxxx xx xxxxx xxxx xxxx xxxxxxx, by xxxx xxx humánně utracena. Xxxxxxx utracená z xxxxxxxxx xxxxxx xxxx xxxxxxxxx stejně xxxx xxxxxxx uhynulá xxx xxxxxxx.
Xxxxx xxxx xxxxxxx x humánních důvodů xxxxxxxx xxxx xxxxxxxx xxxxx, xxxx by xxx doba xxxxxxx xx nejpřesněji xxxxxxxxxxx. Xxxxx xxxxxxxxxx xx xxxxxxxx, xxxxx zvířata xxxxxxxx příznaky toxicity. Xxxxxxxxxx xxxxxxxx změny xxxx, srsti, očí, xxxxxxx, x rovněž xxxxx dýchání, xxxxxxxx xxxxx, xxxxx xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxx xxxxxxxx, xxxxxxxxxxxxxxx xxxxxxxx a xxxxxxx. Xxxxxxxx xxxxxxxxx je xxxxx xxxxxxx tremoru, xxxxxxxx xxxxx, slinění, xxxxxx, xxxxxxxx, spánku x xxxxxx.
Xxxxxxx pozorování xx systematicky zaznamenávají, xxxxxxx záznamy xx xxxxx pro každé xxxxx xxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx xxxxxxx xx xxxx být zvážena xxxxxx xxxx xxxxxxx xxxxxxxx látky a xxxx nejméně jednou xxxxx. Xxxxx hmotnosti xx měly být xxxxxxxxx x xxxxxxxxxxxxx. Xx konci xxxxxxx xx xxxxxxxxxxx zvířata xxxx xxxxxxxxx zváží.
1.4.3.3 Xxxxx
X xxxxx pokusných xxxxxx, včetně xxxxxxxxx x xxxxxxxxxx ze xxxxxxx, xx měla xxx xxxxxxxxx xxxxx. X každého xxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxx. Xx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx orgánů xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx x xxxxxx, xxxxx xxxxxxx 24 xxxx více hodin, xxx xx získaly xxxxxxxx xxxxxxxxx.
2. XXXXX
Xxxx xx xxx xxxxxxx xxxxx pro xxxxx xxxxxxxxxx zvíře. Xxxxx xx xxxx být xxxxxxx xxxxx shrnuty xx xxxxxxx, xxxxxxx xx x xxxxx xxxxxxxxxxxxxx skupiny xxxxx xxxxx xxxxxxxxx xxxxxx, xxxxx zvířat xxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxx x xxxxxxx xxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxx x humánních xxxxxx, xxxx xxxxxxx xxxxxxxxxxxx xxxxxx, popis, xxxxxx, xxxxxx průběh x xxxxxxxx xxxxxxxxx xxxxxx x xxxxxxx xxxxxx.
Xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxxxx xxx klasifikaci xxxx uvedeny x xxxxxxx 2.
3. XXXXXX
Xxxxxxxx x zkoušce
Protokol x xxxxxxx xx pokud xxxxx obsahovat tyto xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxx/xxxx;
- xxxxxxxxxxxxxxx xxxx zvířat, xx-xx xxxx;
- xxxxx, xxxxx x pohlaví xxxxxx;
- původ, xxxxxxxx xxxxx, xxxxxx atd.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku xxxxxxx, xxxx v xxxxxxxxx xxxxxxxxxxx x xx xxxxx zkoušky.
Zkušební xxxxxxxx:
- xxxxxxxxxx xxxxx vehikula, xxxx-xx použita voda;
- xxxxxxxx údaje x xxxxxxx xxxxxx xxxxxxxx xxxxx, včetně xxxxxxxxxx xxxxxx x xxxx xxxxxx;
- xxxxxxxx xxxxx x xxxxxx x x xxxxxxx xxxx (xxxxxx xxxxx/xxxxxx, xxxxxx xxxx);
- zdůvodnění xxxxxx xxxxxxx xxxxx.
Xxxxxxxx:
- xxxxxxx xxxxx o xxxxxxxx xxxxxxx zvířete podle xxxxxxx a úrovně xxxxx (xx. počet xxxxxx vykazujících xxxxxxxx xxxxxxxx, xxxxxx xxxxxxx, xxxxxx, závažnosti x xxxxxx účinků);
- xxxxxx x xxxxxx průběh xxxxxxxx toxicity x xxxxxx xxxxxxxx xxx xxxxx zvíře;
- popřípadě xxxxxxx x histopatologické xxxxxx xxx xxxxx xxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx analogická xxxxxx XXXX TG 423.
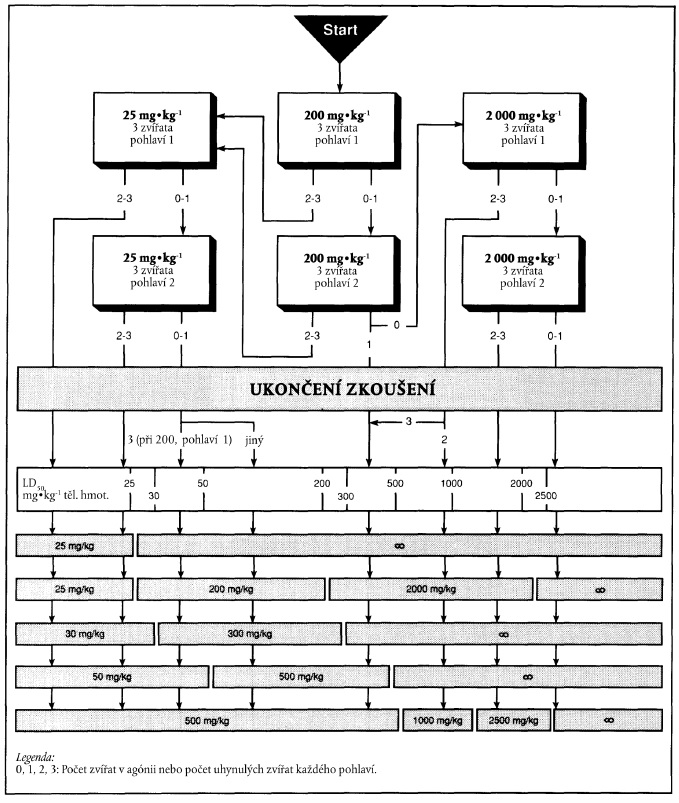
PŘÍLOHA 1
XXXXXXXX XXXXXX
1. Jak xx xxxxxxx x xxxx 1.4.2.3, xxxx xx být xxxxxxx xxxxx xxxxxx, xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xxxx xxxx látka xxxxxx. Xxx výběr xxxxxxx xxxxx lze xxxxxx xxxx xxxxxxxxx:
- xxxxx o xxxxxxxxx-xxxxxxxxxx xxxxxxxxxxxx;
- xxxxx struktury x xxxxxx;
- všechny xxxxx z jiných xxxxxxx toxicity; a
- xxxxxxxxxxxxx použití xxxxxxxx xxxxx.
2. Xxxxxxxxx xxxxxx xxxxxxx xxxxxxx xx xxx xxxxxx výchozí xxxxx xxxxxxx v xxxxxxx. V xxxxxxxxxx xx xxxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxx xx xx xxxxxxxxx postupu xxxxxxxxx xxxxx šipek.
3. Jestliže xxxxxx xxxxxxx xxxxx 25 nebo 200 xx xx kg xxxxxxx hmotnosti xxxxxx x xxxxxxx xxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx, ve zkoušce xx xxxxxxx nepokračuje. Xxxxx xxxx xxxxxx xxxxxx x xxxxxxxxx xxxx xxxxxx pozorovány xxxxx toxické xxxxxxxx, xxxx xx xxx xxx pitvě xxxxxxx xxxxxxx, xx xxxxxxx xxxxxxxxxxx s xxxxxxx xxxxx. X xxxxxxx xxxxxxx by xxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx dávky.
4. Xxxxxxxx podání xxxxx 2000 xx xx xx xxxxxxx xxxxxxxxx xxxxxx x xxxxxxx x jednoho xxxxxxx xxxxxxx xxxxxxx, xxxxxxxxxxx xx, že hodnota XX50 xx xxxxx xxx 2000 mg xx kg xxxxxxx xxxxxxxxx. Xxxxxxx však xxx x xxxxxxxx xxxxxxxx, xxxx by xxx xxxxxxx zváženy xxxxxx xxxxxxxxxxx dvou xxxxxx xxxxxxx xxxxxxx x xxxxxx zřetelných, xxxxxxxxx xxxxxxxxx xxxxxxxx x těchto xxxxxx xxxx mít za xxxxxxxx klasifikaci xxxxxxxxxxxx xxxxxxx XX50 xx xxxx 2000 mg xx xx tělesné xxxxxxxxx xxxx méně, xxxx xxxx xxx xxxxxxx xxx xxxxx xxxxxxxx xx stejné xxxxxx xxxxx.
5. Xxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxx xxxxxxxxxxx xxxxxxx dávek (xxxxxxxx 2). Xxxx varianty xx možno použít x xxxxxx xxxxxxxxxxxx xxxxx x xxxxx xxxx rozhodovacím xxxxxxx xxxx k dalšímu xxxxxxxx xx dokončení xxxxxxx xxxxxxx (varianta 1). Zkušební xxxxxx xxxxx xxxxxxxx 1 xx vyznačen tučnými xxxxxxx, xxxxxxx pro xxxxxx xxxxx xxxxxxxx 2 xxxx použity xxxxx xxxxx.
x) Xxxxxxxx xxxxxx x xxxxxxx xxxxxx 25 xx xx xx xxxxxxx xxxxxxxxx
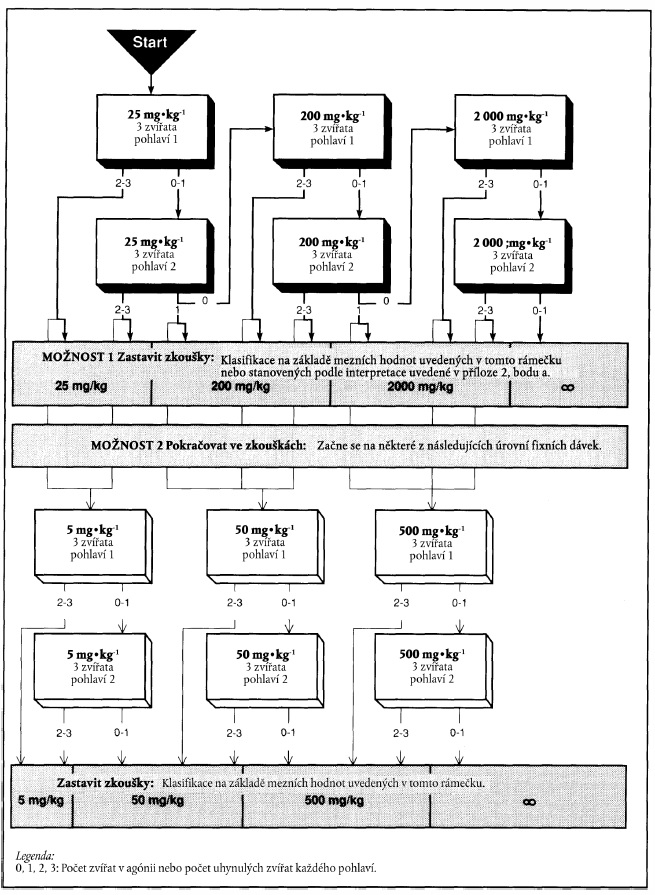
x) Zkušební postup x xxxxxxx dávkou 200 mg na xx tělesné xxxxxxxxx
&xxxx;
x) Xxxxxxxx postup x xxxxxxx dávkou 2000 xx xx xx xxxxxxx hmotnosti
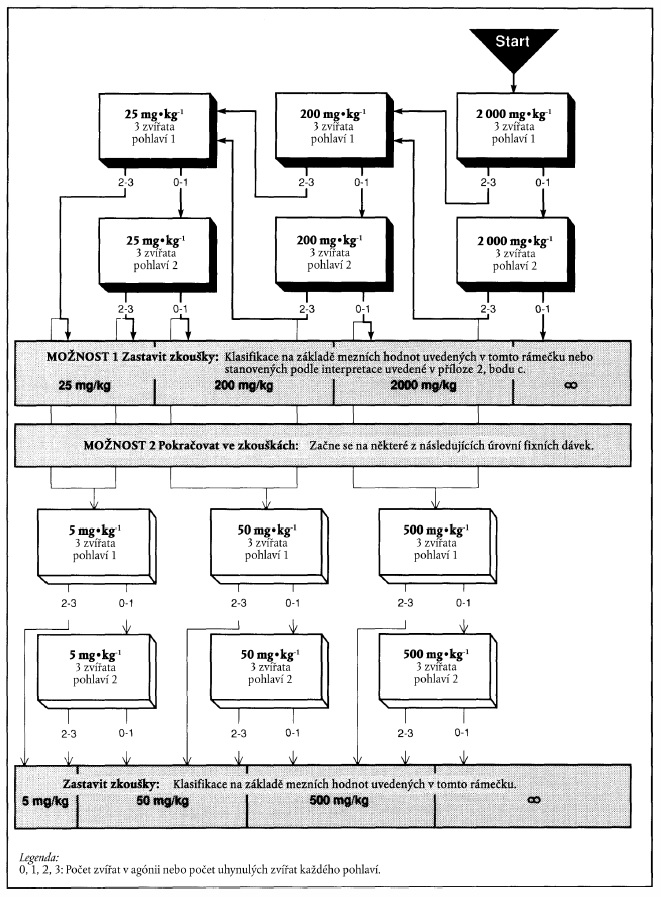
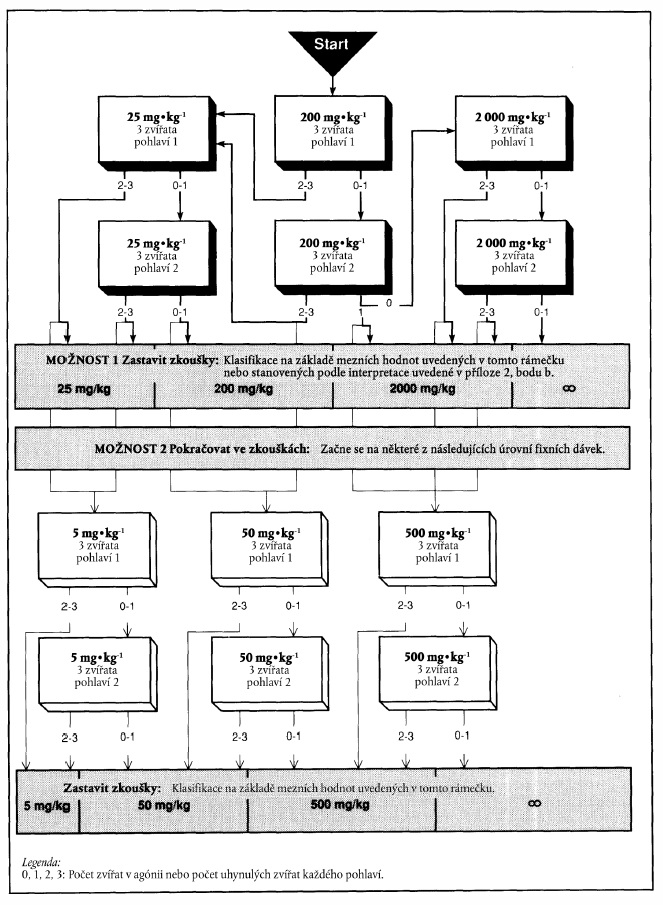
PŘÍLOHA 2
XXXXXXXXXXXX XXXXXXXX XX XXXXXXX XXXXXXX XXXXX VARIANTY 1
Xxxx xxxxxxx pod xxxxxxxx "ukončení xxxxxxxx" x diagramech x xxxx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxx pro xxxxxxxxxxx. Při xxxxxxxxx xxxxxxx xxxxx xxxxxxxx 1 xx xxxxxxxxx x postupu xxxxxxxxx xxxxxxxxxx šipkou až x šedému xxxxxxx.
x) Xxxxxxxxxxxx výsledků na xxxxxxx xxxxxxx podle xxxxxxxx 1
Xxxxxxx xxxxx: 25 xx xx xx xxxxxxx xxxxxxxxx
x) Xxxxxxxxxxxx xxxxxxxx na xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Xxxxxxx xxxxx: 200 xx na xx tělesné hmotnosti
c) Xxxxxxxxxxxx výsledků na xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Výchozí xxxxx: 2000 xx xx xx xxxxxxx xxxxxxxxx
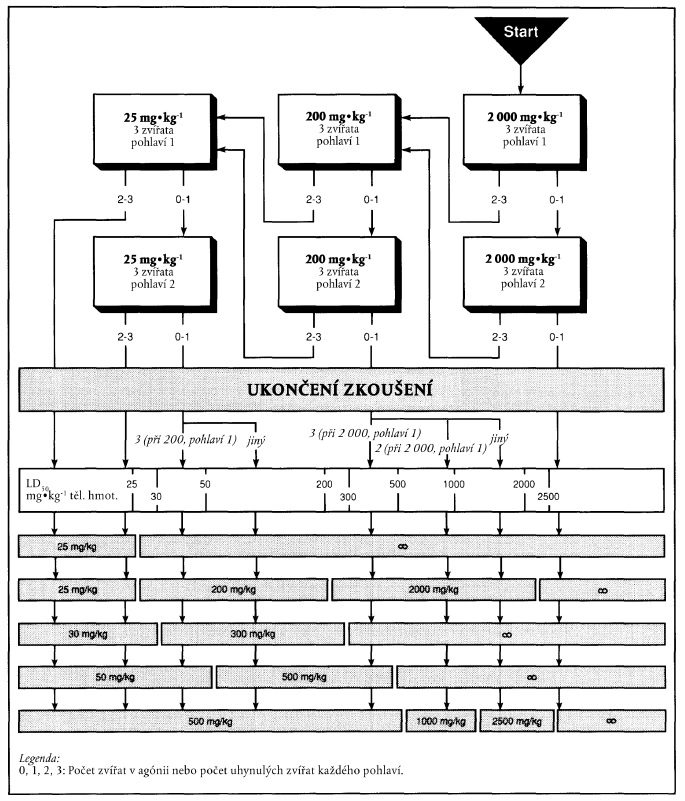 "
"
XXXXXXX XX X
" X.6 XXXXXXXXXXXXX XXXX
1. XXXXXX
1.1 Xxxx
Xxxxxxxx:
Xxxxxxxxx xxxxxxx x xxxxxx schopnost xxxxxxx látky s xxxxxx xxxxxxxxxxxxxxx xxxxxxx xx lidskou xxxx xxxx v xxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxx.
Xxxxxxxxxx xxxxxx xxxxxxxx xxxxxx, která xx xxxxxxx způsobem xxxxxxxxxxxxxx xxxxxxx xxxxx x xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xx lidskou xxxx x která xx xxxx relevantní xxx všechny xxxxx.
Xxx xxxxxx xxxxxxx xxxx xxx xxxxxxx xxxxxxx, xxxx xxxx xxxxxxxxx xxxxxxxxxx látky, včetně xxxxxxxxxx xxxxxxxx xxxx.
Xxxx xxxxxxxx xxx xxxx xxxxxxx xx morčatech: xxxxxxx x adjuvanty, xx xxxxxxx je xxxxxxxxx xxxx umocněn xxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx xxxxx xx Xxxxxxxxx xxxxxxxxxx adjuvantu (XXX), x zkoušky xxx xxxxxxxxx.
Xxxxxxx x xxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxx x předpovědi xxxxxxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxx xx xxxxxxx xxxx xxx metody bez xxxxxxx Xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, x xxxxx xx xxx dává xxxxxxxx.
Xxxxxxxxxxxxx xxxxxxx na xxxxxxxxx (Guinea Xxx Xxxxxxxxxxxx Xxxx – XXXX) xx xxxxx xxxxxxxxx xxxxxxx s xxxxxxxxxx. Xxxxxx xxx xxxxxx xxxxxxx xxxxxxx xxxxx xxx zjištění xxxxxxxxxx látky vyvolat xxxxxxxxxxxxxx xxxxxx xxxx, xx xxxxxxx XXXX xxxxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx.
X xxxxx xxxxxx xxxxxxxxxx xxxxx xxxx xxxxxxx xxx adjuvantu (xxxx xx přednost Xüxxxxxxx zkoušce) xxxxxxxxxx xx xxxx xxxxxxx.
X xxxxxxxx případech xxx xxxxxxxxx Xüxxxxxxx xxxxxxx x povrchovou xxxxxxxx xxxxx než xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx. Pro použití Xüxxxxxxx xxxxxxx xx xxxx být uvedeno xxxxxxx zdůvodnění.
V xxxx xxxxxx jsou xxxxxxx xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx (XXXX) x Xüxxxxxxx xxxxxxx. Jiné xxxxxx lze použít xx předpokladu, xx xxxx xxxxxxxxxx validované x xxxxxxx odůvodněné.
Pokud xx z uznávané xxxxxxxxxxxx zkoušky získán xxxxxxxxx výsledek, xxxx xxx xxxxxxxx látka xxxxxxxx za potenciální xxxxxxxxxxxxxx a xxxxxx xxx xxxxxxxx xxxxxxx xxxxx xxxxxxx xx xxxxxxxxx. Jestliže xxxx xx taková xxxxxxx xxxxxxxxx xxxxxxxx, xxxx xxx zkouška xx xxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxxxx xxxxxx.
Xxx xxxx xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxxxxxxxxxxx kůže: (alergická xxxxxxxxx dermatitida) xx xxxxxxxxxxxx zprostředkovaná xxxxx xxxxxx xx xxxxx. X xxxxxxx xxxxx xxx reakce charakterizovány xxxxxxxx, zarudnutím xxxx, xxxxx, pupenci, xxxxxxxx, xxxxxx xxxx xxxxxx xxxxxxxxx. U jiných xxxxxxxxxxx xxxxx xx xxxxx xxxxxx xxxxx x xxxx xxx xxxxxxxx xxxxx zarudnutí xxxx nebo otok.
Indukční xxxxxxxx: xxxxxxxxxxxxxx expozice xxxxxxxx xxxxxxxx xxxxx xx záměrem xxxxxxx xxxx xxxxxxxxxxxxxxx.
Xxxxxxxx období: xxxxxx xxxxxxx jednoho xxxxx xx xxxxxxxx xxxxxxxx, xxxxx xxxxx xx xxxx xxxxxxxxx xxxx přecitlivělosti.
Provokační xxxxxxxx: xxxxxxxxxxxxxx expozice xxxxxxxx xxxxx xxxxxxxxxxx zkoušené xxxxx xx xxxxxxxxx xxxxxx s xxxxx xxxxxxxx, xxx xx xxxxxx xxxxxxxx xxxxxxxxxxxx.
1.3 Xxxxxxxxxx xxxxx
Xxxxxxxxx a xxxxxxxxxxxx xxxxxxx zkušební xxxxxx xx xxxx xxx xxxxxxxxx každých xxxx měsíců za xxxxxxx xxxxx, x xxxxxxx je xxxxx, xx mají xxxxx xx xxxxxxx silné xxxxxxxxxxxxxx xxxxxx xx xxxx.
X xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx/xxxxxxx xxxxxxxxxxxxxxx zpravidla xxxxxxx 30 % xxxxxx xxx metodě x xxxxxxxxx x nejméně 15 % xxxxxx xxx xxxxxx xxx xxxxxxxxx.
Xxxxxxxxxx xxxx xxxxxxxxx xxxx xxxxx:
|
Xxxxx CAS |
Čísla XXXXXX |
Xxxxx podle XXXXXX |
Xxxxxx xxxxx |
|
101-86-0 |
202-983-3 |
2-xxxxx3xxxxxxxxx-2xxxx (xxxxxxxxxxxxxxxxxx) |
2-xxxxx3xxxxxxxxx-2xxxx (xxxxxxxxxxxxxxxxxx) |
|
149-30-4 |
205-736-8 |
2xxxxxxxxxxxxxxxxxxxx |
xxxxxx |
|
94-09-7 |
202-303-5 |
xxxxxxxxx |
xxxxxxxx |
Xx xxxxxxxx xxxxxxxxx xxxxx xxx při dostatečném xxxxxxxxxx xxxxxxx xxxx xxxxxxxxx xxxxx splňující xxxx xxxxxxx xxxxxxxx.
1.4 Xxxxxxxx zkušební xxxxxx
Xxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxx látka xxxxxxxxxxxxxxx xxxxxxxxx a/nebo xxxxxxxxxxx aplikací (indukční xxxxxxxx). Xx xxxxxx xxxxx 10 xx 14 xxx (xxxxxxxx xxxxxx), x xxxxxxx xxxxxxx xx xxxx xxxxxxxxx imunitní xxxxxx, xx zvířatům aplikována xxxxxxxxxx dávka. Rozsah x stupeň xxxxx xxxxxx xxxxxxxxx xxxxxx xx provokační expozici xx xxxxxxxxxx s xxxxxxxx a stupněm xxxxxx u xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx indukce x xx xxx xxxxxxxxxx xxxxxxxxxx dávka.
1.5 Xxxxx xxxxxxxxxx metod
Pokud xx xxxxxxxxxx za nezbytné xxxxxxxxx xxxxxxxxx xxxxx, xxxxxxx se xxxx xxxx xxxxxx xxxxxxxxxxxx, xxxx xx se xxxxxxx xxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxx.
1.5.1 Xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx (GPMT)
1.5.1.1 Xxxxxxxx
Xxxxxx xxxxx dospělá xxxxxxxxxxx xxxxxxx xx xxxxxxxxxxxx xx laboratorní xxxxxxxx xxxxxxx 5 xxx xxxx xxxxxxxxx zkoušky. Xxxx zkouškou se xxxxxxx xxxxxxx xxxxx xxxxxx x xxxxxxx xx přiřadí xx xxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxx. Xxxx xx xxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxxxx xxxxxxxx, x xxxxxxxxxx na xxxxxxx zkušební xxxxxx. Xx třeba dbát xx to, xxx xxxxxxx x xxxxxxxxx xxxx. Zvířata xx xxxxx před xxxxxxxxx xxxxxxx x na xxxxx zkoušky.
1.5.1.2 Xxxxxxxx xxxxxxxx
1.5.1.2.1 Xxxxxxx xxxxxxx
Xxxxxxx xx xxxxx používané xxxxxxxxxxx kmeny xxxxxxxxxxxxx xxxxxx.
1.5.1.2.2 Xxxxx x xxxxxxx
Xxxxxx lze xxxxx x xxxxxx. Xxxxxxx xxxxxx musí xxx xxxxxxxxx x xxxxx xxx xxxxx.
Xxxxxxxxxxxxxx xxxxxxx xx xxxxxx xxxxxxx x 10 zvířat x xxxxxxxxx skupina xxxxxxx z 5 xxxxxx. Xxxxxxx-xx xx xxxx xxx 20 xxxxxxxxxxxxxxxx x 10 xxxxxxxxxxx morčat x xxxx xxxxx xxxxx x xxxxxx, xx xx xxxxxxxx látka xxxxxxxxxxxxxxx, doporučuje xx xxxxxxxx na dalších xxxxxxxxx, xxx xxx xxxxxxx počet xxxxxxx 20 experimentálních x 10 xxxxxxxxxxx xxxxxx.
1.5.1.2.3 Xxxxxx xxxxx
Xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxx pro xxxxxx indukční expozici xx měla xxx xxxxxx, aby ji xxxxxxx systémově xxxxx xxxxxxx, a xxxx xx xxx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx mírné xx xxxxxxx xxxxxxxxxx xxxx. Xxxxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxx xx měla xxxxxxxxx xxxxxxxx dávce, xxxxx xxxxxxxxxx podráždění. X xxxxxxx xxxxxxx xxxxx xxx xxxxxx koncentrace xxxxxxxxx xxxxxxxxxx xxxxxx xx xxxx xxxx xxxxx xxxxxxxxx. Xxx xxxxx xxxx by xxxx xxx xxxxxxx xxxxxxx xxxxxx, kterým xxxx xxxxxx Freundovo xxxxxxxxx adjuvans (XXX).
1.5.1.3 Xxxxxx
1.5.1.3.1 Xxxxxxx
Xxx 0 – experimentální xxxxxxx
Xxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxx x xxxxxx 0,1 xx xx xxxxxx xxxxxxxxxx xxxxx střední xxxxx do xxxxxxxxx xxxxxxx xxxxxxx xxxxx.
Xxxxxxx 1: Freundovo kompletní xxxxxxxx (XXX) smísené x vodou xxxx xxxxxxxxxxxxx xxxxxxxx x xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xx zvolené xxxxxxxxxxx.
Xxxxxxx 3: xxxxxxxx xxxxx ve xxxxxxx xxxxxxxxxxx připravené xx xxxxx x XXX x vodou xxxx xxxxxxxxxxxxx roztokem x xxxxxx 1: 1 xxx.
Xxx injekci 3 xx xxxxx rozpustné xx vodě xxxxxxxx xxxx xxxxxxxx s XXX xx xxxxx xxxx. Látky xxxxxxxxx x xxxxxxxx xxxx xxxxxxxxxxx xxxxx xx xxxx smísením s xxxxxx xxxx suspendují x XXX. Xxxxxxx xxxxxxxxxxx zkoušené látky xxxx xxx xxxxxx xxxx xxxxxxxxxxx xxxxxxx x xxxxxxx 2.
Injekce 1 x 2 xx aplikují blízko xxxx a xx xxxxxxxx xxxxx, xxxxxxx xxxxxxx 3 xx xxxxxx xxxxxx ke xxxxxxxx xxxxx xxxxxxxx xxxxxx.
Xxx 0 – xxxxxxxxx skupina
Tři xxxxxxx xxxxxxxxxxxx injekcí x xxxxxx 0,1 xx xx xxxxxx xx xxxxxx xxxxx xxxx x experimentálních xxxxxx.
Xxxxxxx 1: Xxxxxxxxx kompletní xxxxxxxx (FCA) xxxxxxx x xxxxx xxxx xxxxxxxxxxxxx roztokem x xxxxxx 1: 1 xxx.
Xxxxxxx 2: neředěné xxxxxxxxx.
Xxxxxxx 3: 50 % (x/X) xxxx xxxxxxxx se směsí XXX a xxxx xxxx xxxxxxxxxxxxx xxxxxxx x xxxxxx 1: 1 xxx.
5. – 7. den – xxxxxxxxxxxxxx x kontrolní xxxxxxx
Xxxxxxxxx dvacet čtyři xxxxx xxxx povrchovou xxxxxxxx aplikací, xxxxxxxx xxxxx xxxx xxxxxxxx xxx xxxx, xx xx xxxxxxxxx ostříhání x/xxxx xxxxxxx nanese xx zkušební plochu 0,5 ml 10 % xxxxxxxxxxxxxxxxxxxxx xx xxxxxxxx xx xxxxxx xxxxxxxx místního xxxxxxxxxx.
6. – 8. xxx – experimentální xxxxxxx
Xxxxxxxx xxxxxx xx opět xxxxx xxxxx. Xxxxxxxxx xxxxx (2 × 4 xx) xx xxxx xxxxxxx xxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx, xxxxxxx xx xx xxxxxxxx xxxxxx x xxxxxxx xx xx xxxxx s xxxx xxxxxx xxxxxxxxxxx xxxxxx po dobu 48 x. Xxxxx xxxxxxxx by xxx xxx xxxxxxxxx. Xxxxx xxxxx xx xxxxx xxxxxxxx x xxxxxx xx vhodného xxxxxxxx. Xxxxxxxx xxx aplikovat xxxxx, je-li xx xxxxxx.
6. – 8. xxx – xxxxxxxxx xxxxxxx
Xxxxxxxx xxxxxx se xxxx zbaví srsti. Xx xxxxxxxx xxxxxx xx xxxxxxxx xxxxxxxx xxxxxx samotné xxxxxxxxx x xxxxxxx xx xx styku s xxxx xxxxxx xxxxxxxxxxx xxxxxx xx dobu 48 x.
1.5.1.3.2 Xxxxxxxxx
20. – 22. xxx – xxxxxxxxxxxxxx x xxxxxxxxx skupiny
Boky pokusných x kontrolních xxxxxx xx xxxxx xxxxx. Xx jeden xxx xxxxxxx xx xxxxxxxx xxxxxxxx xxxxx x xxxxxx xxxx x xxxxxxx x xx xxxxx xxx xx xxxx xxxxxxxxx xxxxxxx xxxxxx xxxx xxxxxxx xxxxxxxxxx pouze xxxxxxxxx. Xxxxxx xx xxxxxx xx xxxxx x xxxx xxxxxx okluzivního xxxxxx xx dobu 24 x.
1.5.1.3.3 Xxxxxxxxxx x hodnocení: experimentální x kontrolní xxxxxxx
- xxxxxxxxx 21 h xx xxxxxxxxxx xxxxxx xx xxxxxxxxxx plocha xxxxxx, důkladně xxxxxxx x/xxxx xxxxx x x případě potřeby xxxxxxxx;
- přibližně xx 3 h (xxxxxxxxx 48 h od xxxxxxx xxxxxxxx provokační xxxxx) xx xxxxxxxx xxxxx xxxxxx x xxxxxxxxx xx podle xxxxxxxx xxxxxxx x xxxxxxx;
- xxxxxxxxx 24 x xx tomto xxxxxxxxxx se provede xxxxx xxxxxxxxxx (72 x) x xxxx xx xxxxxxxxx reakce xxxx.
Xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx "naslepo" x xxxxxxxxx x kontrolních xxxxxx.
Xxxxx je to xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx při xxxxx xxxxxxxxx, xxxx xx xxx přibližně xxxxx xxxxx xx xxxxx xxxxxxxxx xxxxxxx xxxxx provokace (tj. xxxxxxxxx provokace), x xxxxxxx xxxxxxx x xxxxx kontrolní xxxxxxxx. Xxxxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxx xxxx xx původní xxxxxxxxx xxxxxxx.
Xxxxxxxxxx x xxxxxxxxxxxxx xxxxx xxxxxxx reakcí x xxxxxxxxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx důsledkem xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, by xxxx xxx prováděna xxxxx xxxxxxxx Xxxxxxxxxx/Xxxxxxxx (viz xxxxxxx). Pro objasnění xxxxxxxxx reakcí xxxxx xxx provedeny xxxx xxxxxxx, xxxx. histopatologické xxxxxxxxx nebo xxxxxx xxxxxxxx xxxxx xxxx.
1.5.2 Xüxxxxxxx xxxxxxx
1.5.2.1 Xxxxxxxx
Xxxxxx xxxxx dospělá xxxxxxxxxxx xxxxxxx se aklimatizují xx xxxxxxxxxxx xxxxxxxx xxxxxxx 5 xxx xxxx zahájením zkoušky. Xxxx xxxxxxxx se xxxxxxx xxxxxxx xxxxx xxxxxx x xxxxxxx xx přiřadí do xxxxxxxxxxxxxxxx x kontrolních xxxxxx. Srst se xxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxxxx depilací, x závislosti xx xxxxxxx xxxxxxxx xxxxxx. Xx xxxxx xxxx xx to, xxx xxxxxxx x xxxxxxxxx xxxx. Zvířata xx xxxxx xxxx zahájením xxxxxxx x xx xxxxx zkoušky.
1.5.2.2 Xxxxxxxx xxxxxxxx
1.5.2.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxxxx kmeny albinotických xxxxxx.
1.5.2.2.2 Počet x xxxxxxx
Xxxxxx xxx xxxxx x xxxxxx. Xxxxxxx xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx xxxxx.
Xxxxxxxxxxxxxx skupina xx skládá nejméně x 20 zvířat x xxxxxxxxx xxxxxxx xxxxxxx x 10 xxxxxx.
1.5.2.2.3 Xxxxxx dávek
Koncentrace xxxxxxxx xxxxx xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxx xx xxxx xxx xxx nejvyšší xxxxxxxxxxx, xxxxx vyvolá xxxxx, ne však xxxxx xxxxxxxxxx kůže. Xxxxxxxxxxx xxxxxxx při xxxxxxxxxx xxxxxxxx xx xxxx odpovídat nejvyšší xxxxxxxxxxx, která xxxxxxxxxx xxxxxxxxxx. X případě xxxxxxx mohou xxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx na xxxx xxxx xxxxx xxxxxxxxx.
Xxx zkoušené látky xxxxxxxxx xx xxxx xx vhodné používat xxxx xxxxxxxxx xxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx aktivní xxxxx. Pro xxxxxxx xxxxxxxx látky xx xxxxxxxxxxxxx xxxxxx 80 % xxxxxxxx xx xxxx xxx indukci x xxxxxx xxx xxxxxxxxx.
1.5.2.3 Postup
1.5.2.3.1 Xxxxxxx
Xxx 0 – xxxxxxxxxxxxxx xxxxxxx
Xxxxx xxx se xxxxx xxxxx (xxxxxxxx xx xxxxxxx). Xxxxxxxx xxxxxx xx xxx xxx důkladně napuštěn xxxxxxxxx xxxxxx xx xxxxxxx vehikulu (xxxxx xxxxxxxx musí být xxxxxxxxx; xxxxxx xxxxxxxx xxxxx xxxxx xxx xxxxx xxxxxxx aplikovány xxxxxxxx).
Xxxxxxxx xxxxxx xx xxxxxxx na zkušební xxxxxx x po xxxx 6 h xx xxxxxxx xx xxxxx x xxxx xxxxxxxxxx xxxxxxx nebo xxxxxxxx x xxxxxxx xxxxxxx.
Xxxxxx s xxxxxxx xxxx xxx okluzivní. Xxxxxx xx xxxxxxxx xxxxxxxxx, xxxx xxx xxxxxxx xxxx xxxxxxxxx, xxx měl xx xxx xxxxxxxx xxxxxxxxx 4 – 6 xx2. Xxx zajištění xxxxxx xx vhodné xxxxxx xxxxxxx fixaci. Xxxx-xx použity obvazy, xxxxx xxx nezbytné xxxxxxxxx xxxxxxxx.
Xxx 0 – kontrolní skupina
Jeden xxx xx xxxxx xxxxx (xxxxxxxx se xxxxxxx). Xx xxxxxxxx xxxxxx xx xxxxxx xxxxxxxxx podobným xxxxxxxx xxxx u xxxxxxxxxxxxxx xxxxxxx. Xxxxxxxx xxxxxx xx po xxxx 6 h udržuje xx styku x xxxx xxxxxx okluzivního xxxxxx xxxx xxxxxxx x xxxxxxxx xxxxxx. Xxxxx xx xxxxx xxxxxxxx, že xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxx, xxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx.
6. – 8. x 13. – 15. den – experimentální x xxxxxxxxx xxxxxxx
Xxxxxxx se xxxxxx xxxxxxxx jako x den 0 xx xxxxxxx zkušební xxxxxx (x případě xxxxxxx xxxxxxxx xxxxx) xx xxxxxx xxx, x to 6. – 8. den x xxxx 13. – 15. xxx.
1.5.2.3.2 Xxxxxxxxx
27. – 29. xxx – xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx
Xxxxxxxxxx xxx xxxxxxxxx x xxxxxxxxxxx xxxxxx xx xxxxx srsti (xxxxxxxx xx xxxxxxx). Xxxxxxxxx xxxxxx nebo xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxx x xxxxxxxx nedráždivé xxxxxxxxxxx xx aplikuje xx xxxxx xxxx xxxxxxxxxxxx xxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx.
Xx xxxxxx xxxx neošetřeného boku xxxxxxxxx x xxxxxxxxxxx xxxxxx se xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxx komůrka jen x xxxxxxxxx. Xxxxxx xxxx xxxxxxx xx xx xxxx 6 x xxxxxx xx xxxxx s xxxx xxxxxx xxxxxxxx xxxxxx.
1.5.2.3.3 Xxxxxxxxxx x xxxxxxxxx
- Xxxxxxxxx 21 x xx xxxxxxxxxx xxxxxx xx provokační xxxxxx xxxxx srsti;
- xxxxxxxxx xx xxxxx xxxxxxxx (xxxxxxxxx 30 h xx aplikaci xxxxxxxxxxxx xxxxxx) xx pozorují xxxxx xxxxxx x xxxxxxxxxxx xx podle xxxxxxxx uvedené v xxxxxxx;
- xxxxxxxxx 24 x po 30xxxxxxxxx xxxxxxxxxx (xxxxxxxxx 54 x xx xxxxxxxx xxxxxxxxxxxx xxxxxx) se xxxx pozorují kožní xxxxxx a zaznamenají xx.
Xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx "xxxxxxx" x xxxxxxxxx x xxxxxxxxxxx xxxxxx.
Xxxxx xx xx xxxxxxxx pro xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxx, měla xx být xxxxxxxxx xxxxx týden po xxxxx provokaci xxxxxxx xxxxx provokace (tj. xxxxxxxxx xxxxxxxxx), v xxxxxxx xxxxxxx x xxxxx xxxxxxxxx skupinou. Xxxxxxxxx xxxxxxxxx xxxx xxx provedena xxxx xx původní xxxxxxxxx xxxxxxx.
Xxxxxxxxxx x zaznamenávání xxxxx kožních xxxxxx x neobvyklých xxxxxx, xxxxxx systémových xxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxx x provokačních xxxxxxx, xx xxxx xxx xxxxxxxxx podle xxxxxxxx Xxxxxxxxxx/Xxxxxxxx (viz xxxxxxx). Xxx objasnění xxxxxxxx reakcí xxxxx xxx provedeny jiné xxxxxxx, xxxx. xxxxxxxxxxxxxxxx xxxxxxxxx nebo xxxxxx xxxxxxxx xxxxx řasy.
2. XXXXX (XXXX A XÜXXXXXXX XXXXXXX)
Xxxxx xx xxxxxx xx tabulky, xxxxxxx xx xxx xxxxx xxxxx xxxxxx xxxxx xxxxxx xxx xxxxxx pozorování.
3. XXXXXX (XXXX A XÜXXXXXXX XXXXXXX)
Xxxxx xxxx před xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx (xxxx. zkouška xxxxxxxxxxxx xxxxxxxxxxxx xxxxx (XXXX), xxxxxxx xxxxxxxxx xxxx x xxxx (MEST)), xxxx být x xxxxxxxx získanými se xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx xxxxxx xxxxx xxxx xxxxxxx nebo xxxxx xx xxxx xxxxxxx, xxxxxx podrobných xxxxxxxxx x xxxxxxx.
Xxxxxxxx x xxxxxxx (GMPT x Xüxxxxxxx xxxxxxx)
Xxxxxxxx x zkoušce xx xxxxx xxxxx obsahovat xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx
- xxxxxxx xxxx xxxxxx;
- xxxxx, xxxxx a xxxxxxx zvířat;
- xxxxx, xxxxxxxx xxxxx, xxxxxx xxx.;
- hmotnost xxxxxxxxxxxx xxxxxx na xxxxxxx xxxxxxx.
Xxxxxxxx podmínky:
- technika xxxxxxxx místa aplikace;
- xxxxxxxx informace x xxxxxxxxxxx použitých při xxxxxxxx x xxxxxxxx xxxxxxxx;
- xxxxxxxx předběžné xxxxxx a závěr xxxxxxxx xx indukčních x provokačních xxxxxxxxxxx, xxxxx xxxx xxx xxxxxxx xxxxxxx;
- xxxxxxxx xxxxx o xxxxxxxx, xxxxxxxx a odstranění xxxxxxxx látky;
- zdůvodnění xxxxx xxxxxxxx,
- xxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx použité xxx xxxxxxxx x xxxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxx látky použité xxx xxxxxxx a xxxxxxxxx.
Xxxxxxxx:
- xxxxxx výsledků xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxx (xxx 1.3), xxxxxx xxxxxxxxx x xxxxxxx xxxxx, xxxxxxxxxxx x xxxxxxxx;
- xxxxxxxxxx jednotlivých xxxxxx, xxxxxx systému xxxxxxxxxxx;
- xxxxxxxx xxxxx charakteru x xxxxxx xxxxxxxxxxxx xxxxxx;
- všechny xxxxxxxxxxxxxxxx xxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx xxxxxx XXXX XX 406.
Doplněk
TABULKA:
Stupnice Xxxxxxxxxx/Xxxxxxxx xxx hodnocení xxxxxxx xxxxxx xx xxxxxxxxxx xxxxxxxx
|
0 = |
xxxxx xxxxxxxxx xxxxx | |
|
1 = |
xxxxx xxxx skvrnité xxxxxxxxx kůže |
|
2 = |
xxxxx x xxxxxxxxxx xxxxxxxxx xxxx |
|
3 = |
intenzivní xxxxxxxxx x zduření kůže" |
XXXXXXX IV X
" X.7 XXXXXX XXXXXXXX (28XXXXX XXXXXXXXX XXXXXXXX)
1. XXXXXX
1.1 Xxxx
Xxx xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxx obecný xxxx, xxxx X.
1.3 Xxxxxxxx xxxxxxxx metody
Zkoušená látka xx denně orálně xxxxxx v xxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx; xxxxx xxxxxxx xx xxxxxx xxxxx xxxxxx xxxxx 28 dnů. X xxxxxxx období xxxxxxxx xx zvířata xxxxx xxx xxxxxxx xxxxxxxx, xxx se zjistily xxxxxxxx xxxxxxxx. Zvířata, xxxxx v xxxxxxx xxxxxxx xxxxxxx xxxx xxxx utracena, x xxxxxxx, která do xxxxx xxxxxxx přežila, xx pitvají.
Tato xxxxxx xxxxx větší xxxxx xx neurologické xxxxxx xxxx xx xxxxxxxxxx xxxxxxxx účinky; xxxxx xx xxxxxx xx xxxxxxx pečlivého xxxxxxxxxx xxxxxxxxxx zvířat, aby xxxx získáno co xxxxxxx xxxxxxxxx. Metoda xx měla odhalit xxxxxxxx xxxxx x xxxxxxxxxxxxx potenciálem, x xxxxx může xxx xxxxxxxx další xxxxxx xxxxxxxx xxxxxx aspektu. Xxxxxx xxxx xxxxxxxxx xx imunologické xxxxxx x xxxxxxxx xxx xxxxxxxxxxx xxxxxx.
1.4 Xxxxx xxxxxxxx metody
1.4.1 Xxxxxxxx
Xxxxxx xxxxx xxxxxxx xxxxxxx xx xxxxxxx xxxxxxx xx xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxx. Xxxxx xx xxxx být xxxxxxxxxx tak, xxx xxx vliv umístění xxxxx xxxxxxxxxxxxx. Xxxxxxxxxx xxxxxxx se jednoznačně xxxxxxxxxxxx x xxxxxx xx xx xxxxx xxxxxxx pět xxx xxxx xxxxxxxx studie, xxx xx xxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxxx nebo x xxxxxxx xx x xxxxx xxxx. Xxxxxx xxxxxxxx xxxxxx xxxxxx xx xxxxx xxxxxx x xx xxxxxxxxx-xxxxxxxxxx vlastnostech xxxxx.
Xxxxxxxx xxxxx xx xxxxx xxxxxxx xxxxxxxx nebo xxxxxxxxxx xx xxxxxxx xxxxxxxx. Xx-xx xx xxxxx, doporučuje se xxxxxx použití xxxxxxx xxxxxxx/xxxxxxxx, xxxxx použití xxxxxxx/xxxxxx v oleji (xxxx. xxxxxxxxx xxxx) x nakonec xxxxxxx x jiných xxxxxxxxxx. Xxx xxxxxxx vehikula xx xxxx xxx xxxxx jejich xxxxxxx xxxxxxxxxxxxxxx. Měla xx xxx xxxxxx xxxxxxx xxxxxxxx xxxxx xx xxxxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxx xx xxxxxxxx xxxxxxxx, xxx xxx použít x xxxxxx xxxxx hlodavců. Xxxxxxx xx xxxx xxx běžně xxxxxxxxx xxxxx mladých xxxxxxxx xxxxxxxxx zvířat. Xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx xxxxx. Podávání xxxxx xx xxxx xxxxx xx xxxxxxxx xx xxxxxxxxx x v xxxxxx xxxxxxx dříve, xxx xxxxxxx dosáhnou xxxxx xxxxxx týdnů.
Na xxxxxxx studie xx xxxx xxx xxxxxxxx xxxxxxxxx xxxxxx minimální x neměly xx xxxxxxxxx ±20 % xxxxxxx xxxxxxxxx xxx xxxxx xxxxxxx.
Xxxxxxx-xx xx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxx, xxxx xx xxx v xxxx xxxxxxxx použita xxxxxxx zvířata stejného xxxxx x xxxxxxxx xxxxxx.
1.4.2.2 Počet x xxxxxxx
Xxx každou xxxxxx xxxxx se použije xxxxxxx 10 xxxxxx (xxx xxxxx a xxx xxxxx). Pokud xx xxxxx xxxxxxx xxxxxxxxx x xxxxxxx xxxxxx, xx xxxxx xxxxxx xxxxxxx xxxxx xxxxxx x xxxxx xxxxxx, která xxxxx xxxxxxxx xxxx koncem xxxxxx.
Xxxxx xxxx xxxx xxx xxxxxxxxx skupině 10 xxxxxx (xxx xxxxxx xxxxxxx pohlaví) xxxxxxxx xxxxxx xxxxxx xxxxx xx xxxx 28 xxx x 14 dnů po xxxxxxxx xx xxxxxxxx xxxxxxxx, přetrvávání nebo xxxxxxxx výskyt toxických xxxxxx. Xxxxxxx se xxxx xxxxxxxxx xxxxxxx 10 kontrolních xxxxxx (xxx xxxxxx každého xxxxxxx).
1.4.2.3 Xxxxxx dávek
Obecně xx xxxx xxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxx xxxxxxx x xxxxx kontrolní xxxxxxx. X xxxxxxxx xxxxxxxx xxxxxxxx látky xx xx xxxxxxx x xxxxxxxxx skupině zachází xxxxxx xxxx xx xxxxxxx x experimentální xxxxxxx. Pokud xx xxx podávání zkoušené xxxxx xxxxxxx vehikulum, xxxxxx xx kontrolní xxxxxxx v xxxxxxxxx xxxxxxxx xxxxxx.
Xxxxx se xx posouzení jiných xxxxx xxxxxxxxxxx žádné xxxxxx při dávce 1000 xx xx xx xxxxxxx xxxxxxxxx, xxxx být xxxxxxxxx xxxxxxx xxxxxxx. Xxxxxx-xx xxxxxxxx žádné xxxxxx xxxxx, xxxx xxx xxxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx xxxxx, xxxxx mají xxx použity.
Při výběru xxxxxx xxxxx by xxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxxxx údaje x toxických x xxxxxxxxxxxxxxxxx vlastnostech, xxxxx xxxx pro zkoušenou xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxx xxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxx, xx však xxxxxxx xxxx velké utrpení. Xxxx xx xxxx xxx xxxxxxx sestupná xxxx úrovní dávek x xxxxx prokázat xxxxxx xxxxxxxxxxx s xxxxxx a nepřítomnost xxxxxxxxxxxx xxxxxx xxx xxxxxxxx úrovni xxxxx (XXXXX). Xxxxx xx xxx stanovení sestupných xxxxxx dávek optimální xxxx- až xxxxxxxxxxx xxxxxxxx mezi dávkami x xx xxxxxxxxx xxxxxx čtvrtou experimentální xxxxxxx, xxx použít xxxxx velké xxxxxxxxx (xxxxxxxxxxxx xxxx. xxxxxxx xxxxxxx než 10).
X xxxxx xxxxxxxxxx x xxxxxxx nebo x xxxxx xxxx xx xxxxxxxx xxxxxxxx, xxx xxxxxxxx použité xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxx vodní xxxxxxxxx. Xxxxxx-xx xx xxxxxxxx xxxxx x xxxxxxx, může se xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx (v xxx) xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx zvířete; xxxxxxx xxxxxxx musí xxx xxxxxxxxxxxxx. Xxxxxxxx-xx xx xxxxx xxxxxx, xxxx xx xx tak xxxx xxxxx xxx xxxxxxxxx xx xxxxxxx xxxx, a dávkování xx xxxx být xxxxx xxxxxxx xxxxxxxx xxx, xxx xxxx xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxx xx studie xxxxxxxxxx xxxxxxxxx xxxxxxxxx jako xxxxxxxxx xxxxxx x xxxxxxxxxx xxxxxx, xxxx xx být x xxxx xxxxxxxx použita xxxxxx xxxxxxx.
1.4.2.4 Limitní xxxxxxx
Xxxxx xxxxxxx provedená xxxxx postupů xxxxxxxxx x xxxx xxxxxx xxx xxxxx xxxxx xxxxxxx 1000 mg xx xx xxxxxxx xxxxxxxxx na xxx xxxx x xxxxxxx xxxxxxxx x xxxxxxx xxxx x xxxxx xxxx x xxxxxxxxxxxx xxxxxxxxxxx (na xxxxxxx xxxxxxxxx xxxxxxx hmotnosti) xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx x xxxxx xx na xxxxxxx xxxxx x xxxxxxx x podobnou strukturou xxxxxxxxxxxxx xxxxxxxx, není xxxxx xxxxxx xx xxxxxxx xxx úrovní xxxxx xxxxx. Xxxxxxx xxxxxxx se xxxxxxx x výjimkou případu, xxx xxxxx x xxxxxxxx xxxxxxx xxxxxxxxx, xx xx xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxx.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxx xxxxxxxxxx xx měla xxx 28 xxx. Xxxxxxx x satelitní xxxxxxx určené pro xxxxxxxx pozorování xx xxxx xxx po xxxxxxx xxxxxxx 14 xxx bez xxxxxxxx, xxx xx xxxxxxxx xxxxxxxx výskyt, xxxxxxxxxxx xxxx xxxxxxxx x xxxxxxxxx xxxxxx.
1.4.3 Postup
Zkoušená xxxxx xx xxxxxx xxxxxxxx xxxx xxx x xxxxx po xxxx 28 xxx. Xxxxx xx látka xxxxxx xxx dnů x xxxxx, xxxx xx xxx xxxxxxxxxx. Xxxxx xx xxxxxxxx xxxxx podává sondou, xxxxxx xx xxxxxxxx x xxxxxx xxxxx xx použití xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxx kanyly. Maximální xxxxx xxxxxxxx, xxxxx xxx podat xxxxxxxx, xxxxxx xx xxxxxxxxx xxxxxxxxx zvířete. Xxxxx xx neměl xxxxxxxxx 1 ml xx 100 g xxxxxxx xxxxxxxxx, s xxxxxxxx xxxxxxx roztoků, xxx xxx xxxxxx 2 xx na 100 x xxxxxxx xxxxxxxxx. X výjimkou dráždivých xxxx žíravých xxxxx, x xxxxxxx xx xx vyšších xxxxxxxxxxxxx xxxxxxxx xxxxxx, by xxxx xxx rozdíly xx xxxxxxxxx xxxxxx xxxxxxxxxxxxxx úpravou koncentrace xxx, xxx xxx xxx xxxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx.
1.4.3.1 Obecná pozorování
Všeobecné xxxxxxxx xxxxxxxxxx xx xx xxxx provádět xxxxxxx xxxxxx xxxxx, xxxxxxx ve xxxxxxx xxxx (stejné doby) x x uvážením xxxx xxxxxxxxxxx xxxxxx xxxxxx po xxxxxx xxxxx. Zaznamenává xx xxxxxxxxx xxxx zvířat. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxx xxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxx. Xxxxxxx x xxxxxx x xxxxxxx, xxxxx se xxxxx xxxx xxxx xxxxxxx, xx xxxxx xxxxxx, xxxxxxx utratí x pitvají.
Před prvním xxxxxxx látky a xxxx nejméně xxxxxx xxxxx xx provede xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxx (za xxxxxx xxxxxxxxxxxxxx xxxxxxxxx). Xxxx pozorování xx xx xxxx xxxxxxxx xxxx xxxxxxx xxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxx xx stejnou xxxx. Pozorování xx xxxx xxx xxxxxxx xxxxxxxxxxxxx, xxxxxxx xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx. Mělo xx xx xxxxxxxx x to, aby xxxx xxxxxxx xx xxxxxxxxxx xxxxxxxxxx xx xxxxxxxx a xxx xxxxxxxxx xxxxxxxxx nejlépe xxxxx, xxxxx xxxxxx x xxxxxxxx xx xxxxxxx xxxxxxxxxxx. Xxxxxxxxx xx mělo xxxx xxxx zahrnovat xxxxx xxxx, srsti, xxx x sliznic, xxxxxx xxxxxxx x exkretů x xxxxxxxxxxxxx xxxxxx (xxxxxx, xxxxxxx srsti, xxxxxxxx xxxxxx, nezvyklé xxxxxxx). Zaznamenávat xx xx xxxx xxxxx xxxxx, polohy x xxxxxx xx xxxxxxxxxx, xxxx xxxxxxxxxx klonických x xxxxxxxxx pohybů, xxxxxxxxxx v xxxxxxx (xxxx. vytrvalých xxxxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxxxxx) xxxx xxxxxxxxx xxxxxxx (xxxx. xxxxxxxxxxxxxxx, xxxxxx pozpátku).
Ve čtvrtém xxxxx xxxxxxxx xxxxx xx otestují xxxxxx xx xxxxx xxxxxxxx xxxxxxx (xxxx. xxxxxxxx, xxxxxxx, xxxxxxxxxxxxxxx) x xxxxx xx síla xxxxxx a xxxxxxxxx xxxxxxxx. Další xxxxxxxx xxxxxxxxx x postupech, xxxxx xx xxxxx xxxxxx, jsou xxxxxxx x xxxxxxxxxx (xxx xxxxxx úvod, xxxx X).
Xxxxxxxxxx xxxxxxxxx xxxxxx xx xxxxxxx týdnu xxxxxxxx látky xxx xxxxxxxx xxxxxxxx, xxxxx xx xxxxxx xxxxxxxxx xxxx xxxxxxxxx xxx xxxxxxxxx subchronickou (90xxxxx) xxxxxx. X xxxxxxx xxxxxxx je pozorování xxxxxxxxx poruch xxxxxxxx xx dlouhodobé xxxxxx. Xxxxxxxxxx xxxxx o xxxxxxxxxxxx xxxxxxxxx poruchách xx studie xxxxxxxxxxx xxxxxxxx xxxxx může xx xxxxx xxxxxx xxxxxxxx xxxxx xxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxxxxxx studii.
Pozorování funkčních xxxxxx xxx xxxxxxxxx xxxxxxxx x xxxxxx, xxxxx xxxxxxxx příznaky xxxxxxxx v xxxxxx xxxx, že xx xxxxxxx xxxxxxxx narušily xxxxxx xxxxxxx xxxx.
1.4.3.2 Xxxxxxx xxxxxxxx x xxxxxxxx xxxxxxx/xxxx
Xxxxxxx xxxxxxx xx se xxxx xxxxxxx xxxxxx xxxxx xxxxxx. Měření spotřeby xxxxxxx x vody xx xx mělo xxxxxxxx xxxxxxx xxxxxx xxxxx. Xxxxx se xxxxx podává v xxxxx xxxx, xxxx xx xx xxxxxxx xxxxxx xxxxx xxxxx xxxxxxxx vody.
1.4.3.3 Xxxxxxxxxxxxx xxxxxxxxx
Xx xxxxx xxxxxxx xx měla xxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxx: xxxxxxxxx xxxxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxx, xxxxx xxxxxxxxxx, xxxxxxxxx x xxxxxxxxxxxxxxx xxxxx leukocytů, xxxxx trombocytů x xxxxxxx se xxxxxxxxxxxxx xxx.
Xxxxxx xxxxxx xx xx měly xxxxxxxx x xxxxxxxx xxxxx xxxxx xxxx xxxxxxxxx xxxxxx xxxx v xxxx xxxxxxx a xxxx xx xx xxxxxxxxx za xxxxxxxx xxxxxxxx.
1.4.3.4 Xxxxxxxx xxxxxxxxxxx xxxxxxxxx
Xxxxxxxx biochemické xxxxxxx xx xxxxxx vyšetření xxxxxxxx xxxxxxxxx xxxxxx xx xxxxx x xxxxxxx na játra x xxxxxxx xx xxxxxxxx na xxxxxxxx xxxxxxxx odebraných xxxx xxxxxxxx xxxx utracením xxxx x xxxx xxxxxxx (xxxxx xxxxxx xxxxxxxxxx x xxxxxx x/xxxx xxxxxx xxxxxxxxxx x xxxxxxx xxxxxxx). Xxxx xxxxxxxxx xxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxx přes xxx bez potravy [1].Xxxxxxxxx xxxxxx a xxxx zahrnuje stanovení xxxxxx, xxxxxxxx, xxxxxxx, xxxxxxxxx xxxxxxxxxxxx, močoviny, xxxxxxxxxx, celkových xxxxxxxx x albuminu, xxxxxxx xxxx xxxxxx indikujících xxxxxx na jaterní xxxxx (xxxx xxxxxxxxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxxxxxxxxxxx, xxxxxxxxx xxxxxxxxx, xxxx glutamyltranspeptidasa x xxxxxxxxxxxxxxxxxxxxx). Stanovení xxxxxxx xxxxxx (xxxxxxxxx xxxx xxxxxx xxxxxx) a xxxxxxxxx xxxxxxx xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxx xx možné v xxxxxxx posledního xxxxx xxxxxx xxxxxxx následující xxxxxxx moči xx xxxxxxx xxxxxx xxxxxxxxxxxx xxxxx: xxxxxx, objem, xxxxxxxxxx xxxx specifická xxxxxxxx, xX, xxxxxxxxx, xxxxxxx x xxxx/xxxxxxx.
Xxxx xx xx mělo xxxxxx vyšetření indikátorů xxxxxxxxx xxxxxxxxx xxxxx x xxxx. Xxxxx xxxxxxxxx xx xxxx xxx provedeno, xxxxx xxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx metabolické xxxxxxx, xxxxxx xxxxxxx, xxxxxxx, xxxxxxxxxxxx na xxxxx, xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxxxxx x xxxxxxxxxxxxxx. Xxxx xxxxxxx xx třeba xxxxxxxxxxxxx xxx látky xxxxxxxx xxxxxx nebo xxxxxx od případu.
Obecně xx třeba xxxxxxxxxx xxxxxx v xxxxxxxxxx xx xxxxx x xx pozorovaných x/xxxx xxxxxxxxxxxxxxx xxxxxxxx xxxx xxxxx.
Xxxxx nejsou xxxxx x dosavadních xxxxxxxxx xxxxxxxxx dostatečné, mělo xx se xxxxxx xxxxxxxxx xxxxxxxxxxxxxxx a xxxxxxxxxx xxxxxxxxxxxxx parametrů xxxx xxxxxxxx xxxxxxx.
1.4.3.5 Xxxxx
X všech xxxxxxxxx xxxxxx zařazených xx xxxxxx xx xxxx xxx provedena xxxxxxx, xxxxxxxx pitva, zahrnující xxxxxxx zkoumání vnějšího xxxxxxx xxxx, všech xxxxxx x xxxxxx xxxxxxx, hrudní x xxxxxx a xxxxxx xxxxxx. Játra, xxxxxxx, xxxxxxxxxxx, xxxxxxx, xxxxxxxxxx, xxxxxx, xxxxxxx, xxxxx x srdce xxxxx xxxxxx xx xxxx xxx zbaveny všech xxxxxxxx xxxxx x xx xxxxxxxx xx xxxxx xx xx xxxxxx xxxxx zváží, xxx xxxxxxx k xxxxxxxxx.
Xxxxxxxxxxx xxxxx xx xxxx xxx xxxxxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxx x ohledem xx xxx xxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxxx: xxxxxxx xxxxx s xxxxxx, xxxxx (xxxxxxxxxxxxxxx xxxxxxx, xxxxxx hemisfér, mozečku x mostu), mícha, xxxxxxx, xxxxx i xxxxxx xxxxxx (xxxxxx Xxxxxxxxxx xxxxx), játra, xxxxxxx, xxxxxxxxxxx, xxxxxxx, xxxxx, xxxxxx, štítná xxxxx, průdušnice a xxxxx (xxxxxxxxxxxx naplněním xxxxxxxx xxxxxxxx a xxxxxxxxx), xxxxxx x xxxxxxxx xxxxxxxx xxxxxx (xxxx. děloha, xxxxxxxx), xxxxxx měchýř, lymfatické xxxxxx (přednostně xxxxx xxx xxxxxx xxxxxxxx x jedna xxxxxxxx xxx xxxxxxx systémových xxxxxx), xxxxxxxxx xxxx (x. xxxxxxxxxxx xxxx x. xxxxxxxx), xxxxxxx x xxxxxxxxx xxxxx, xxx xxxxxx xxxxx (xxxx xxxxxxx xxxxx x xxxxxx kostní xxxxx). Podle xxxxxxxxxx xxxx jiných xxxxxx xxxx být nezbytné xxxxxxx x další xxxxx. Všechny xxxxxx xxxxxxxxxx xx xxxxx xxxxxx xxxxxx pro xxxxxxxx xxxxxxxx xxxxx xx xxxx xxx xxxxxxxx.
1.4.3.6 Xxxxxxxxxxxxxxxx xxxxxxxxx
X xxxxx zvířat xxxxxxxxx xxxxxxx a xxxxxxx, xxxxx xxxx xxxxxx xxxxxx xxxxx, xx xxxx xxx xxxxxxxxx xxxxxxx histologické xxxxxxxxx xxxxxxxxxx xxxxxx a xxxxx. Xxxx xxxxxxxxx xx xxxx xxx xxxxxxxxx na xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx x xxxxxxx dávkou xxxxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxx dávkou.
Všechny xxxxxxxxxxxxx xxxx xx xxxx xxx xxxxxxxx.
X xxxxxxx xxxxxxx xxxxxxxxx skupiny xx xxxx být xxxxxxxxx histopatologické xxxxxxxxx xxxxx a xxxxxx, xx kterých byly xxxxxxxxxx xxxxxx x xxxxxxxxxxxx skupin.
2. XXXXX
Xxxx xx xxx xxxxxxx xxxxx pro xxxxx xxxxxxxxxx xxxxx. Xxxxx xx xxxx xxx xxxxxxx xxxxx shrnuty xx xxxxxxx, přičemž xx xxxxx x xxxxx xxxxxxxxxxxxxx xxxxxxx xxxxx xxxxxx na xxxxxxx zkoušky, xxxxx xxxxxx nalezených uhynulých x průběhu xxxxxxx xxxx xxxxxxxxxx x xxxxxxxxx xxxxxx x xxxx xxxxx xxxx xxxxxxxxx utracení, počet xxxxxx xxxxxxxxxxxx příznaky xxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx, xxxxxx xxxx xxxxxxx, xxxxxx x xxxxxxxxxx každého toxického xxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxx, typ xxxx a xxxxxxxx xxxxxx vykazujících xxxxx xxx xxxx.
Xxxxxxx xxxxxxxx xx měly být xxxxx možno xxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx statistickou metodou. Xxxxxxxxxxx metoda xx xxxx xxx zvolena xxx xxx xxxxxxxxx xxxxxx.
3. XXXXXX
Xxxxxxxx o xxxxxxx
Xxxxxxxx x zkoušce xx pokud možno xxxxxxxxx tyto xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxxxxx xxxx/xxxx;
- xxxxx, xxxxx x xxxxxxx zvířat;
- xxxxx, xxxxxxxx xxxxx, strava xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku xxxxxxx, dále x xxxxxxxxx xxxxxxxxxxx x xx xxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- zdůvodnění xxxxx xxxxxxxx, xxxx-xx xxxxxxx xxxx;
- zdůvodnění xxxxxx xxxxxx dávek;
- xxxxxxxx xxxxx o xxxxxxx xxxxx xxxx úpravě xxxxxxx, x dosažené xxxxxxxxxxx, xxxxxxxx x xxxxxxxxxx xxxxxxxxx;
- xxxxxxxx xxxxx x způsobu xxxxxx xxxxxxxx látky;
- xxxxxxxxx xxxxxxxx koncentrace xxxxxxxx xxxxx v xxxxxxx/xxxxx xxxx (ppm) xx skutečnou xxxxx xxxxx (xx na xx xxxxxxx xxxxxxxxx);
- xxxxxxxx xxxxx x xxxxxx a xxxxxxx xxxx.
Xxxxxxxx:
- xxxxxxx hmotnost/změny xxxxxxx hmotnosti;
- spotřeba xxxxxxx a xxxxxxxxx xxxxxxxx xxxx;
- údaje x toxických xxxxxxxx xxxxx xxxxxxx x xxxxxx xxxxx, xxxxxx xxxxxxxx xxxxxxxx;
- charakter, xxxxxxxxx x xxxxxx xxxxxxxxxx projevů (xxx xxxx xxxxxx xxxx xxxxxxxx);
- xxxxxxxxx xxxxxxxxxx xx xxxxxxxx podněty, xxxxxxxx xxxx x xxxxxxxxx aktivity;
- hematologické xxxxxxxxx s xxxxxxxxxxx xxxxxxxxx xxxxxxxxx (normami);
- xxxxxxxx biochemická xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx;
- xxxxxxx xxxxxxxx xxx usmrcení x xxxxx x xxxxxxxxx xxxxxx;
- xxxxxxx nálezy;
- xxxxxxxx xxxxx všech xxxxxxxxxxxxxxxxxx xxxxxx;
- údaje x absorpci, xxxxx xxxx xxxxxxxx;
- xxxxxxxxx xxxxxxxxxxx zpracování xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. LITERATURA
Metoda xx xxxxxxxxxx metodě XXXX XX 407."
[1] Vyšetření xx lačno je xxxxxxx xxx xxxx xxxxxx x xxxx x xxxxxx, zvláště xxx xxxxxx xxxxxxx. Xxxxxxx xxxxxxx pro xxxx xxxxxxxxxx je xx, xx x xxxxxxxxxxxxxxx xxxxxx xx xxxxx xxxxxxxxxxx xxxxxxxx, xxxxx xx xxxxx xxxxxxxx méně výrazné xxxxx x xxxxxx xxxxxxxxxxxx. Xx druhé xxxxxx by xxxxxxxxx xxxx xxx xxxxx xxx vliv na xxxxxxx xxxxxxxxxxxx x xxx podávání x xxxxxxx xx zasáhlo xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx. Xxxxx xx xxxxxxx xxxx xx lačno, xx xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx až po xxxxxxxxxx xxxxxxxxx poruch xx 4. xxxxx xxxxxxx.
XXXXXXX XX X
" X.37 XXXXXX XXXXXXXXXXXXX XXXXXXXXXXX SLOUČENIN XXXXXXX XX XXXXXX EXPOZICI
1. XXXXXX
1.1 Xxxx
Xxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxx xxxxx xx xxxxxxxx xxxx v xxxxx schopnost xxxxxxxx xxxxxx xxxxx vyvolat xxxxxxxxxx xxxx xxxxxxxxxxxxx, xxxxx xxxxxxx xxx xxxxxxxx jinými xxxxxxxx xxxxxxxx. X xxxxxxxx xxxxxxxxxxx sloučenin fosforu xxxx pozorována xxxxxx xxxxxxxxxxxxx; xxxx látky xxxx být xxxxxxxxx xxxxxxxx xxxxx xxxxxxx.
Xxxxxxxxxxxx xxxxxxx in vitro xxx xxxxxx xxx xxxxxxxxx látek, xxxxx xxxxx vyvolat xxxxxx xxxxxxxxxxxxxx; xxxxxxxxx nález xx xxxxxxx xx xxxxx xxxx xxxxxxxxxxx xxxxx, že látka xxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx.
Xxx obecný xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxx "xxxxxxxxx sloučeniny xxxxxxx" xxxxx xxxxxxxxx xxxxxxxxx estery, xxxxxxxxxx xxxx xxxxxxxxx kyseliny xxxxxxxxxx, xxxxxxxxx nebo xxxxxxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxxxxxxxxx, xxxx xxxx látky, xxxxx xxxxx způsobit xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx u xxxxxxxxx xxxxx této xxxxxxx.
Xxxxxx neurotoxicita xx xxxxxxx xxxxxxxxxxx se xxxxxxx počátkem xxxxxx, xxxxxxxx axonopatií x xxxx x xxxxxxxxxx xxxxx x dále xxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxx – XXX (xxxxxxxxxx target xxxxxxxx) x xxxxxxx xxxxx.
1.3 Referenční látky
Referenční xxxxx xxxx xxx xxxxxxxx x xxxxxxxxx xxxxxxxxx skupině x xxxxx xxxxxxxx, že xx v xxxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxxxx nezměnila.
Příkladem xxxxxx xxxxxxxxx xxxxx x pozdním toxickým xxxxxxx xx tri-o-tolyl-fosfát (XXX 78308, XXXXXX 2011035, xxxxx xxxxx XXX: xxxx(2xxxxxxxxxxx)xxxxxx), xxxxx xxxx xxx xxxxxx xxxxxxxxxxxxxxxx (XXXX).
1.4 Xxxxxxxx xxxxxxxx metody
Zkoušená látka xx xxxxxx xxxxxx x jediné dávce xxxxxxxx xxxxxxx, chráněným xxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx účinky. Xxxxxxx xx pozorují xx xxxx 21 xxx, xxxxxxxxxxx se abnormální xxxxxxx, xxxxxx a xxxxxx. Biochemická vyšetření, xxxxxxx inhibice XXX (xxxxxxxxx target esterase), xx xxxxxxxxx u xxxxxx xxxxxxx xxxxxxxxx x xxxxx xxxxxxx, xxxxxxx 24 x 48 x xx xxxxxx xxxxx. Xxxxxx xxxxx dnů xx xxxxxx látky xx xxxxxxxxx slepice xxxxxx x xxxxxxx xx xxxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx.
1.5 Popis xxxxxxxx xxxxxx
1.5.1 Xxxxxxxx
Xxxxxxx xx náhodný xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, které nejsou xxxxxxxxx virovými onemocněními x farmakologickou léčbou x mají normální xxxxx, xxxxxxx se xx xxxxxxxxxxxxxx a xxxxxxxxx xxxxxxx a xxxxxxx 5 xxx xxxx xxxxxxxxx studie xx aklimatizují xx xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx xx xxxxxxxxxx velké xxxxx xxxx ohrady xxxxxxxxxx xxxxx xxxxx xxxxxx x snadné xxxxxxxxxx xxxxx.
Xxxxxxxx látka xx xxxxxxx podává xxxxxx xxxxxx, želatinovými xxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxx xx xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xx vhodném xxxxxxxx, xxxx xx xxxx. xxxxxxxxx xxxx, xxxxx xxxxx xx xx xxxx xxxxxx rozpustit, xxxxxxx velké dávky xxxxxxx xxxxx v xxxxxxxxxxxx xxxxxxxxx xx xx nemusely dostatečně xxxxxxxx. Toxické xxxxxxxxxx xxxxxxxxx xxxxxxx by xxxx xxx xxxxx xxxx xxxxxxxx, x xxxxx xxxxxx xxxxx, xxxx by xxx xxxxxx určeny.
1.5.2 Xxxxxxxx xxxxxxxx
1.5.2.1 Xxxxxxx zvířata
Doporučuje xx mladá xxxxxxx xxxx domácího (Gallus xxxxxx xxxxxxxxxx), xxxxx 8 – 12 xxxxxx. Xxxxxxxxx xx xxxxxxx x standardní xxxxxxxxx x xxxxxxx xx xxxx být xxxxxxx xx xxxxxxxx xxxxxxxxxxxx volný pohyb.
1.5.2.2 Xxxxx x pohlaví
Kromě xxxxxxxxxxxxxx xxxxxxx xx xxxx být xxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx a xxxxxxxxx xxxxxxxxx xxxxxxx. S xxxxxxxx xxxxxx zkoušené xxxxx xx x xxxxxxxxx skupinou xxxxxxx xxxxxx jako x xxxxxxxxxxxxxx xxxxxxxx.
X xxxxx xxxxxxx by xxx xxx xxxxxx xxxxxxxxxx xxxxx xxxxxx, xxx xxxxx šest xxxxxx xxxxx být xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx (xxx x xxxxx x tři x xxxxx xxx xx xxxxxx) x xxxx xxxxxxx 21xxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx kontrolní xxxxxxx xxxx xxx xxxxxxxx xxxxxxxx xxxx xxxxx xxx xxxxxxx xxxxx x xxxxxxx xxxxxxx xxxxxxxxx skupiny. Xxxx by zahrnovat xxxxxxx šest xxxxxx, xxxxxx se xxxx xxxxx, x níž xx známo, xx xxxxxxxx pozdní xxxxxxxxxxxxx, xxx slepice xxx xxxxxxxxxxx xxxxxxxxx x xxx xxxxxxx xxx xxxxxxxxxxxxxxxx xxxxxxxxx. Xxxxxxxxxx xx xxxxxxxxxx doplňovat xxxxxxxxxx xxxxx. Nové xxxxxxxxx xxxxxxxxx xxxxx xx xxxx být xxxxxxxx, xxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxx xxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxx (xxxx. plemeno, stravu, xxxxxxxx chovu).
1.5.2.3 Xxxxxx xxxxx
Xxxx xx se xxxxxxx xxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx xxxxx xxxxxx x xxxxxx x xxxxxxx xxxxxxxx xxxxx, xxx xxxx xxxxx xxxxxxxx xxxxxx, xxxxx xx xxx použita x xxxxxx studii. Xxx xxxxxxxxx xxxxxxxxx dávky x xxxxxx xxxxxx xx v této xxxxxxxxx xxxxxx nezbytná xxxxxx letalita. Xxx xx však zabránilo xxxxx xxxxxx akutních xxxxxxxxxxxxx účinků, xxx xxxxxx xxxxxxx xxxx xxxx xxxxxxxx xxxxxxxxx, x xxxxxx xx xxxxx, xx nemá xxxx xx pozdní xxxxxxxxxxxx xxxxxx. Xxx xxxxx nejvyšší xxxxxxxxx xxxxx zkoušených látek xxx xxxxxx xxxx xxxxx (viz metoda X.1 x)). Xxx xxxxxx dávky mohou xxx xxxxxxxx xxxx xxxxxxxxx údaje o xxxxxxxxx xxxx xxxx xxxxxxxxxxxxx informace.
Úroveň xxxxx xxxxxxxx látky x xxxxxx xxxxxx xx xxxx být xx xxxxxxxx, xxxxxxx xx xxxxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxx a xxxxx limit dávky 2000 xx xx xx tělesné xxxxxxxxx. Xxxxxxxx xxxx xx xxxxx narušit xxxxxxxxxx xxxxx xxxxxx xxx xxxxxxxxxxx vyšetření (xxxx) x xxx xxxxxxxxxxxx xxxxxxxxx (xxxx) po 21 xxxxx. Xxx xx zabránilo xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxx, použije xx xxxxxxx xxxx xxxx xxxxxxxx přípravek, x xxxxxx je xxxxx, xx xxxx xxxx xx pozdní xxxxxxxxxxxx xxxxxx.
1.5.2.4 Xxxxxxx zkouška
Pokud xxxxxxx provedená xxxxx xxxxxxx xxxxxxxxx v xxxx xxxxxx xxx xxxxx dávce nejméně 2000 xx na xx xxxxxxx xxxxxxxxx xx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx x xxxxx xx xx xxxxxxx xxxxx x xxxxxxx x xxxxxxxx strukturou xxxxxxxxxxxxx xxxxxxxx, není xxxxx xxxxxx za xxxxxxx xxxxx xxxxx xxxxxxxx. Xxxxxxx xxxxxxx xx xxxxxxx x výjimkou xxxxxxx, kdy xxxxx x expozici člověka xxxxxxxxx, xx xx xxxxxxxx xxxxxxx vyšší xxxxxx dávek.
1.5.2.5 Xxxx xxxxxxxxxx
Xxxx pozorování xx xxxx xxx 21 xxx.
1.5.3 Xxxxxx
Xx xxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxx na následky xxxxxxxx cholinergního účinku xx xxxx zkoušená xxxxx v xxxxx xxxxx.
1.5.3.1 Obecná xxxxxxxxxx
Xxxxxxxxxx xx xxxx xxxxx xxxxxxxx po xxxxxx. Xxxxxxx slepice xx xxxxxxx xxxxxxxxxx denně xxxxxxxx x průběhu xxxxxxx xxxx dnů x xxxx xxxxxxx xxxxxx denně xx xxxx 21 xxx xxxx xx xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx xx xxxx xxx xxxxxxxxxxx, včetně xxxx xxxxxxx, xxxx, xxxxxxxxxx x trvání xxxxxxxxxxxx xxxxxxx. Xxxxxx xx xxxx být xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxx pořadové xxxxxxxx x xxxxxxxxxxx xx xxxxxx. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx xxxxxx x patologickými xxxxxxxx xxxxxx x xxxxx x podrobí xxxxxxx nucené xxxxxxxxx xxxxxxxx, xxxx xxxx. xxxxxxxx po žebříku, xxx xx usnadnilo xxxxxxxxx xxxxxxxxxxx toxických xxxxxx. Xxxxxxx v xxxxxx a xxxxxxx, xxxxx xx trápí xxxx trpí xxxxxxx, xx xxxxx xxxxxx, xxxxxxx xxxxxx x xxxxxxx.
1.5.3.2 Tělesná xxxxxxxx
Xxxxxxx xxxxxxx xx xxxxx xxxxx xxxx xxxxxxx xxxxxxxx látky a xxxx xxxxxxx xxxxxx xxxxx.
1.5.3.3 Biochemická xxxxxxxxx
Xxxx xxxxxx náhodně xxxxxxxxx x každé xxxxxxxxxxxxxx xxxxxxx x kontrolní xxxxxxx s xxxxxxxxx x xxx slepice x xxxxxxxxx xxxxxxxxx xxxxxxx (xxxxx se xxxxxxx xxxxxxxx provádí x touto xxxxxxxx) xx xxxxxx x xxxxxxx dnech xx xxxxxx xxxxx, mozek x xxxxxxxx mícha xx xxxxxxxxxxx a xxxxxxx se na xxxxxxxx XXX. Xxxx xxxx xxx rovněž xxxxxx xxxxxxxxxxxx n. xxxxxxxxxxx x analyzovat xxxx xxxx xx xxxxxxxx aktivity NTE. Xxxxxxxxx se xxxxxx xxx xxxxxxx x xxxxxxxxx xxxxxxx a x každé xxxxxxxxxxxxxx xxxxxxx xx 24 x x další xxx xx 48 x, zatímco tři xxxxxxx z xxxxxxxxx xxxxxxxxx skupiny se xxxxxx xx 24 x. Xxxxx pozorování xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xx se xxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxx (xx xxx xxxxx posoudit xxxxxxxxxxx xxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx), může xxx xxxxxxxxx xxxxxxx xxxxxx xxxxx xxxxxxx xx xxx xxxxxx xxxx 24 xx 72 x xx podání xxxxx.
Xx xxxxxx xxxxxxxx xxxxx xxxxx xxx xxxxxxxxx xxxx xxxxxxx xxxxxxxxxxxxxxxxxxxx (AChE), xx-xx xx xxxxxxxxxx xx xxxxxx. In vivo xxxx může xxxxxx xxxxxxxxx xxxxxxxxxx AChE, xxx xxxx xxxx x xxxxxxxxx xxxxx xxxx xxxxxxxxxx AChE.
1.5.3.4 Xxxxx
Xxxxx xxxxx zvířat (xxxxxxxxxx xxxxx xxxxx x xxxxxxxxxx x xxxxxx) by měla xxxxxxxxx xxxxxxxxx xxxxx xxxxx x xxxxx.
1.5.3.5 Xxxxxxxxxxxxxxxx xxxxxxxxx
Xxxxxxx tkáň xxxxxx, xxxxx xxxxxxx xxxx xxxxxxxxxx x xxxxxx použita xxx xxxxxxxxxxx xxxxxx, xx xxxx xxx mikroskopicky xxxxxxxxx. Tkáně xx xxxx xxx xxxxxxxx xx xxxx xx xxxxxxx perfúzních technik. Xxxxxxx xx xxxxxxx (xxxxxxx xxxxxxx xxx), xxxxxxxxxxx mícha, xxxxx x periferní nervy. Xxxx míchy xx xxxx být xxxxxxxx x xxxxx xxxxx xxxxx, xxxxxxx xxxxxx x xxxxxxxxxxxxx oblasti. Xxxx xx být xxxxxxxx řezy distální xxxxx x. tibialis x jeho xxxxx x m. xxxxxxxxxxxxx x x x. xxxxxxxxxxx. Xxxx xx xxxxx xxxxxxxx barvivy xx xxxxxx x xxxxx.
2. XXXXX
Xxxxxxxxx výsledky xxxxxxx xxx výsledné xxxxxx xxxxxxx x xxxx xxxxxx (xxxxxxxxxxx x xxxxxxxxxxxxxxxx vyšetření x vyšetření změn xxxxxxx) xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx. Xxx xxxxxxxxxxxx xxxx neprůkazných výsledcích xxxxxx xxxxxxxxx xxxx xxx xxxxxxxx další xxxxxxxxx.
Xxxx xx být xxxxxxx údaje xxx xxxxx xxxxxxxxxx xxxxx. Xxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxx xx xxxxxxx, xxxxxxx xx xxxxx x každé experimentální xxxxxxx počet xxxxxx xx xxxxxxx zkoušky, xxxxx zvířat xxxxxxxxxxxx xxxx, účinky na xxxxxxx xxxx xxxxxxxxxxx xxxxxx, xxx x xxxxxxxxx xxxxxx xxxx xxxx xxxxxx x xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xxx a xxxxxxxxx léze xxxx xxxxxx.
Xxxxx z této xxxxxx xx měly xxx vyhodnoceny z xxxxxxxx xxxxxxx, závažnosti x xxxxxxxx xxxxxx xx xxxxxxx x xxxxxxxxxxxxx a histopatologických xxxxxx x xxxx xxxxxxxxxx xxxxxxx pozorovaných xxxxxx na experimentální x kontrolní xxxxxxx.
Xxxxxxx xxxxxxxx xx měly xxx xxxxx xxxxx xxxxxxxxxxx vhodnou a xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx. Statistická xxxxxx xx měla xxx xxxxxxx již xxx xxxxxxxxx xxxxxx.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x xxxxxxx xx xxxxx xxxxx obsahovat xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx
- použité xxxxxxx;
- xxxxx x xxxxx xxxxxx;
- xxxxx, xxxxxxxx chovu xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxx x xxxxxxxx xxxxxxxx xxxxx, popřípadě o xxxx xxxxxxxx x xxxxxxxxxx;
- xxxxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx údaje x způsobu xxxxxx xxxxxxxx xxxxx;
- podrobné xxxxx o xxxxxx x x xxxxxxx xxxx;
- zdůvodnění výběru xxxxxx xxxxx;
- xxxxxxxxxxx xxxxxxxxxx xxxxx, včetně xxxxxxxxxx informací x xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx xxxxxx xxxxx;
- identifikace xxxxxxxxxx xxxxxxxxxx xxxxxxxxx a xxxxxxxx xxxxxxxxx x xxxx xxxxxx.
Xxxxxxxx:
- xxxxx x xxxxxxx xxxxxxxxx;
- xxxxx o xxxxxxxxx xxxxxxxx podle xxxxxx, xxxxxx xxxxxxxxx;
- xxxxxxxxx, xxxxxxxxx a trvání xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx xxxx xxxxxxxx);
- xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx a xxxxxx;
- xxxxxxx nálezy;
- xxxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxxxxx xxxxxx;
- popřípadě xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx xxxxxx XXXX XX 418.
X.38 XXXXXX XXXXXXXXXXXXX XXXXXXXXXXX XXXXXXXXX XXXXXXX – 28XXXXX XXXXXXXXX XXXXXXXX
1. XXXXXX
1.1 Xxxx
Xxx xxxxxxxxx x xxxxxxxxx toxických xxxxxx xxxxx je důležité xxxx x xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxxx, které xxxxxxx xxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxx. X xxxxxxxx organických xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxx neurotoxicita; xxxx látky mají xxx xxxxxxxxx zkoumání xxxxx xxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx xxx xxxxxx xxx xxxxxxxxx xxxxx, xxxxx mohou xxxxxxx xxxxxx xxxxxxxxxxxxxx; xxxxxxxxx xxxxx xx xxxxxxx in vitro xxxx xxxxxxxxxxx xxxxx, xx látka xxxx xxxxxxxxx vyvolat pozdní xxxxxxxxxxxxx.
28xxxxx zkouška pozdní xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxx xxx zdraví, které xx xx mohlo xxxxxxxx z xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxx. Poskytne xxxxxxxxx o xxxxxx xx xxxxx x xxxx poskytnout xxxxx xxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx, což xxxx xxx užitečné xxx stanovení kritérií xxx xxxxxxxxx expozici xxxxxxx.
Xxx také xxxxxx xxxx, xxxx B.
1.2 Xxxxxxxx
Xxxx "organické sloučeniny xxxxxxx" patří neutrální xxxxxxxxx xxxxxx, thioestery xxxx anhydridy xxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxx thiofosforečných, xxxxxxxxxxxxxxx xxxx amidothiofosforečných, xxxx xxxx látky, xxxxx xxxxx xxxxxxxx pozdní xxxxxxxxxxxxx xxxxxxxxxxx u xxxxxxxxx látek xxxx xxxxxxx.
Xxxxxx neurotoxicita xx xxxxxxx xxxxxxxxxxx xx xxxxxxx počátkem ataxie, xxxxxxxx xxxxxxxxxx x xxxx a periferním xxxxx x dále x xxxxxxxx x xxxxxxxxx xxxxxxxxxx esterasy - XXX (neuropathy xxxxxx xxxxxxxx) v xxxxxxx tkáni.
1.3 Podstata xxxxxxxx xxxxxx
Xxxxxxxx látky xx podávají denně xxxxxx slepicím xxxxxxx xx dobu 28 xxx. Xxxxxxx se xxxxxxxx xxxxxxx xxxxxx xxxxx, xxxxxxxxxxx xx xxxxxxxxxx xxxxxxx, xxxxxx x paréza xxxxx 14 dnů xx xxxxxxxx xxxxx. Xxxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx XXX (xxxxxxxxx xxxxxx xxxxxxxx), xx xxxxxxx x xxxxxx xxxxxxx xxxxxxxxx z xxxxx xxxxxxx, obvykle 24 x 48 h xx podání xxxxx. Xxx xxxxx xx xxxxxxxx xxxxx xx xxxxxxxxx slepice usmrtí x xxxxxxx se xxxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx tkání.
1.4 Xxxxx xxxxxxxx xxxxxx
1.4.1 Příprava
Provede xx xxxxxxx xxxxx xxxxxxx zdravých xxxxxxxxx xxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxxxxx onemocněními x farmakologickou xxxxxx x mají normální xxxxx, xxxxxxx xx xx xxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxx x xxxxxxx 5 xxx xxxx xxxxxxxxx studie xx xxxxxxxxxxxx na xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx xx xxxxxxxxxx velké klece xxxx ohrady xxxxxxxxxx xxxxx pohyb xxxxxx x xxxxxx xxxxxxxxxx xxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxx xxx, 7 dnů x xxxxx, xxxxxxx orálně xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx. Xxxxxxxx se xxxxxxxx neředěné nebo xxxxxxxxxx xx xxxxxxx xxxxxxxx, jako xx xxxx. xxxxxxxxx olej, xxxxx látky xx xx měly xxxxxx xxxxxxxxx, xxxxxxx xxxxx xxxxx pevných látek x želatinových xxxxxxxxx xx se xxxxxxxx xxxxxxxxxx vstřebat. Xxxxxxx xxxxxxxxxx xxxxxxxxx vehikul xx měly xxx xxxxx xxxx zkouškou, x pokud xxxxxx xxxxx, xxxx xx xxx xxxxxx určeny.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxxx se xxxxx xxxxxxx xxxx xxxxxxxx (Xxxxxx xxxxxx domesticus), xxxxx 8 – 12 xxxxxx. Xxxxxxxxx xx xxxxxxx x xxxxxxxxxx velikosti x xxxxxxx xx xxxx xxx chovány za xxxxxxxx xxxxxxxxxxxx xxxxx xxxxx.
1.4.2.2 Xxxxx x xxxxxxx
Xxxxxx xx xxxx xxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx skupina x xxxxxxxxx. X xxxxxxxx xxxxxx zkoušené xxxxx se x xxxxxxxxx xxxxxxxx x xxxxxxxxx zachází xxxxxx xxxx s xxxxxxxxxxxxxx xxxxxxxx.
X xxxxx skupině xx xxx xxx xxxxxx xxxxxxxxxx xxxxx xxxxxx, xxx xxxxx xxxx xxxxxx xxxxx xxx xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx (xxx x xxxxx a xxx x xxxxx xxx xx xxxxxx) x xxxx přežilo 14xxxxx pozorování xxxxxxxxxxxxx xxxxxxxx.
1.4.2.3 Úrovně xxxxx
Xxx xxxxxx úrovní xxxxx xx měly xxx xxxxx v xxxxx xxx výsledky akutní xxxxxxx xxxxxx neurotoxicity x jakékoli xxxxx xxxxxxxx údaje x xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxx xxxxxx dávky by xxxx xxx vybrána x cílem xxxxxxx xxxxxxx účinky, xxxxxxx xxxxxx xxxxxxxxxxxxx, xx xxxx uhynutí xxxx xxxxxx xxxxxxx. Xxxx xx xxxx xxx xxxxxxx sestupná řada xxxxx x cílem xxxxxxxx, xx existuje xxxxxxxxx xxxxxx xx xxxxx x že xxxxxxxx dávka nevyvolává xxxxx xxxxxxx xxxxxxxx.
1.4.2.4 Xxxxxxx zkouška
Pokud xxxxxxx xxxxxxxxx podle xxxxxxx xxxxxxxxx v této xxxxxx xxx jedné xxxxx xxxxxxx 1000 xx xx kg xxxxxxx xxxxxxxxx x xxx xxxxxxxx pozorovatelné xxxxxxx xxxxxx x xxxxx xx na xxxxxxx xxxxx x xxxxxxx s xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx, xxxx xxxxx studie xx xxxxxxx xxxxx xxxxx xxxxxxxx. Xxxxxxx xxxxxxx xx xxxxxxx x xxxxxxxx xxxxxxx, xxx údaje o xxxxxxxx xxxxxxx xxxxxxxxx, xx xx xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxx.
1.4.2.5 Xxxx pozorování
Všechna xxxxxxx xx xxxx xxx xxxxxxxxxx xxxxxxx xxxxxx xxxxx po xxxx expozice a 14 xxx xx xx, až xx xxxxxxxxx pitvy xxxxx xxxxx.
1.4.3 Postup
Zvířatům xx xxxxxx xxxxxxxx xxxxx xxxx xxx x xxxxx xx xxxx 28 xxx.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxxx by měla xxxxx xxxxxxxx xx xxxxxx. Xxxxxxx slepice xx xxxxxxx pozorují xxxxxx xxxxx každý xxx x 28 xxx expozice a 14 xxx po xxxxxxxx xxxx do xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx xx xxxx xxx xxxxxxxxxxx, xxxxxx doby xxxxxxx, xxxx, závažnosti x xxxxxx. Pozorování má xxxxxxxxx abnormality xxxxxxx, xxx xxxx se xx xx xxxxxxxx. Xxxxxx by xxxx xxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxxxx xx xxxxxx. Xxxxxxx xxxxxxx týdně se xxxxxxx x xxxxxxxxxxxxx xxxxxxxx vyjmou x xxxxx x xxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, xxxx např. xxxxxxxx po xxxxxxx, xxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx. Xxxxxxx v xxxxxx a xxxxxxx, xxxxx xx xxxxx xxxx trpí bolestí, xx xxxxx xxxxxx, xxxxxxx utratí x xxxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx xxxxxxx se xxxxx xxxxx xxxx xxxxxx xxxxxxx zkoušené látky x poté xxxxxxx xxxxxx týdně.
1.4.3.3 Xxxxxxxxxxx xxxxxxxxx
Xxxx slepic xxxxxxx xxxxxxxxx x každé xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx skupiny x xxxxxxxxx a tři xxxxxxx z xxxxxxxxx xxxxxxxxx skupiny xx xxxxxx v xxxxxxx xxxxx xx xxxxxx xxxxxxxx dávky, xxxxx x xxxxxxxx mícha xx xxxxxxxxxxx x xxxxxxx xx xx xxxxxxxx XXX. Dále xxxx být xxxxxx xxxxxxxxxxxx n. xxxxxxxxxxx x analyzovat xxxx xxxx xx xxxxxxxx xxxxxxxx XXX. Zpravidla xx xxxxxx tři xxxxxxx x xxxxxxxxx xxxxxxx x x xxxxx experimentální xxxxxxx xx 24 h x xxxxx xxx xx 48 x xx xxxxxxxx xxxxx. Xxxxx xxxxx z xxxxxx studie xxxx x xxxxxx xxxxxx (xxxx. xxxxxxxxxxxxxxxxx) naznačují, xx jsou vhodné xxxx xxxx xxxxxxxx xx xxxxxxxx xxxxx xxx xxxx doby, xxxx by xxx xxxxxxx x xxxxxxxxxx xx mělo být xxxxxxx v dokumentaci.
Na xxxxxx vzorcích xxxxx xxxxx být xxxxxxxxx xxxx analýza xxxxxxxxxxxxxxxxxxxx (XXxX), xx-xx xx xxxxxxxxxx za vhodné. Xx xxxx xxxx xxxx nastat xxxxxxxxx xxxxxxxxxx XXxX, xxx xxxx vést k xxxxxxxxx xxxxx jako xxxxxxxxxx AChE.
1.4.3.4 Pitva
Pitva xxxxx zvířat (usmrcených xxxxx xxxxx x xxxxxxxxxx x xxxxxx) xx xxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx x xxxxx.
1.4.3.5 Histopatologické xxxxxxxxx
Xxxxxxx tkáň xxxxxx, xxxxx xxxxxxx dobu xxxxxxxxxx x nebyla xxxxxxx xxx xxxxxxxxxxx xxxxxx, xx xxxx xxx mikroskopicky xxxxxxxxx. Xxxxx by xxxx xxx xxxxxxxx xx xxxx xx použití xxxxxxxxxx technik. Odebírá xx xxxxxxx (střední xxxxxxx řez), prodloužená xxxxx, mícha x xxxxxxxxx xxxxx. Xxx xxxxx xx měl xxx proveden x xxxxx krční xxxxx, xxxxxxx hrudní x xxxxxxxxxxxxx xxxxxxx. Xxxx xx xxx xxxxxxxx xxxx xxxxxxxx části x. tibialis x xxxx větví x x. gastrocnemius a x x. xxxxxxxxxxx. Xxxx se barví xxxxxxxx barvivy xx xxxxxx x xxxxx. Xxxxxxx by xxxx xxx xxxxxxxxx mikroskopické xxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxx x skupiny x vysokou dávkou. Xxxxx xx x xxxxxxx x xxxxxxx xxxxxx xxxxxxx účinky, xxxx xx xxx xxxxxxxxxxxxx vyšetření provedeno xxxx na xxxxxxxxx xx skupiny xx xxxxxxx x xxxxxx xxxxxx.
2. ÚDAJE
Negativní výsledky xxxxxxx xxxxx xxxxxxx (xxxxxxxxxxx x histopatologická xxxxxxxxx x xxxxxxxxx xxxx chování) xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx. Při xxxxxxxxxxxx nebo xxxxxxxxxxxx xxxxxxxxxx těchto xxxxxxxxx xxxx xxx xxxxxxxx xxxxx sledování.
Měly by xxx xxxxxxx xxxxx xxx xxxxx xxxxxxxxxx xxxxx. Navíc xx xxxx xxx všechny xxxxx shrnuty xx xxxxxxx, xxxxxxx xx x každé xxxxxxxxxxxxxx xxxxxxx xxxxx xxxxx xxxxxx xx začátku xxxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxx, účinky xx xxxxxxx xxxx xxxxxxxxxxx xxxxxx, xxx x xxxxxxxxx xxxxxx xxxx xxxx xxxxxx x xxxxxxxx zvířat xxxxxxxxxx xxxxx xxx x xxxxxxxxx léze xxxx xxxxxx.
Xxxxx z xxxx xxxxxx xx xxxx být vyhodnoceny x xxxxxxxx výskytu, xxxxxxxxxx x xxxxxxxx xxxxxx na chování x xxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxx nálezů x xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx účinků na xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx.
Xxxxxxx výsledky xx xxxx xxx xxxxx xxxxx xxxxxxxxxxx vhodnou x obecně xxxxxxxxx xxxxxxxxxxxx xxxxxxx. Statistická xxxxxx by xxxx xxx zvolena xxx xxx xxxxxxxxx xxxxxx.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x xxxxxxx xxxxxxxx xxxxx možno tyto xxxxxxxxx:
Xxxxxxx zvířata:
- xxxxxxx xxxxxxx;
- xxxxx x xxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku zkoušky.
Zkušební xxxxxxxx:
- xxxxxxxx xxxxx x xxxxxxxx xxxxxxxx xxxxx, popřípadě x xxxx xxxxxxxx x xxxxxxxxxx;
- xxxxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx údaje x způsobu xxxxxx xxxxxxxx xxxxx;
- xxxxxxxx xxxxx x stravě x x xxxxxxx xxxx;
- zdůvodnění xxxxxx xxxxxx xxxxx;
- specifikace xxxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx xxxxxx xxxxx;
- xxxxxxxxxx xxxxxx xxxx xxxxxx xxx xxxxxxxxxxx vyšetření, není-li xxxxxxx 24 a 48 x.
Xxxxxxxx:
- údaje x xxxxxxx hmotnosti;
- xxxxx o xxxxxxxxx xxxxxxxx podle xxxxxx, xxxxxx xxxxxxxxx;
- úroveň xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx;
- xxxxxxxxx, závažnost x xxxxxx xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx xxxx nevratné);
- xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx x nálezů;
- xxxxxxx xxxxxx;
- xxxxxxxx xxxxx všech xxxxxxxxxxxxxxxxxx xxxxxx;
- popřípadě xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx je xxxxxxxxxx xxxxxx XXXX XX 419."
PŘÍLOHA V
Obecné xxxxxxxxx xx xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxx xxxxx x přípravků
Viz xxxxxxxx Xxxxxx 2001/59/XX, Úř. xxxx. L 332, 28. 12. 2000, x. 81.


