Xxxxxxxx Xxxxxx 96/54/xx
xx xxx 30. xxxxxxxx 1996,
xxxxxx xx xx xxxxxxx druhé xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx Xxxx 67/548/XXX x xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, balení x označování xxxxxxxxxxxx xxxxx
XXXXXX XXXXXXXXXX XXXXXXXXXXXX,
x xxxxxxx xx Xxxxxxx x xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
x ohledem xx xxxxxxxx Xxxx 67/548/XXX xx dne 27. xxxxxx 1967 o xxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, xxxxxx x xxxxxxxxxx nebezpečných xxxxx [1], naposledy xxxxxxxxxx směrnicí Xxxxxx 94/96/XX [2], x xxxxxxx xx článek 28 uvedené xxxxxxxx,
xxxxxxxx x xxxx, xx xxxxxxx I xxxxxxxx Xxxx 67/548/XXX xxxxxxxx xxxxxx xxxxxxxxxxxx látek, xxxxxx xxxxxxxxxxx, označování x x xxxxxxx xxxxxxx jejich xxxxxxxxxxxxxx xxxxxxxxxxxxxxx koncentračních xxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx pro xxxxxx xxxxxxx a životní xxxxxxxxx; xx seznam xxxxxxxxxxxx xxxxx x xxxxxxx X xxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx; že x xxxxxxxx xxxx je xxxxxxxx xxxxxx xxxx xxxxxxx X tak, xxx obsahoval poznámky xxxxxxxx se xxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxx xxxxxxxxxxx xxxxx x tabulce X; xx xxxxxx xxxxxxxxxxxx xxxxx x xxxxxxx X xxxxxxxx xxxxx, xxx xxxxx xxxx xxxxxxxxxx Xxxxxxxx a Xxxxxxx x aktu x xxxxxxxxxxx Xxxxxxxx, Xxxxxx x Xxxxxxx xxxxxxxxxx dočasné odchylky xxxxxxxx se klasifikace x xxxxxxxxxx; xx xxx x xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx požadavků xx xxxxxxxxxxx x xxxxxxxxxx xxxxxx látek; xx xxxxx byla xxxxxxxxxxx xxxxxxxxxxx některých xxxxxx xxxxx;
xxxxxxxx x xxxx, xx xxxxxxx XXX xxxxxxxx 67/548/XXX xxxxxxxx xxxxxx xxx xxxxxxxxxxx zvláštní rizika xxxxxxx x xxxxxxxxxxxx xxxxxxx x xxxxxxxxx; xx xx potřeba xxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx látek x xxxxxxxxx xxx xxxxxx;
xxxxxxxx x xxxx, xx příloha X xxxxxxxx 67/548/EHS stanoví xxxxxx pro stanovení xxxxxxxxx-xxxxxxxxxx xxxxxxxxxx, xxxxxxxx x xxxxxxxxxxx xxxxx x přípravků; xx xx nezbytné xxxxxxxxxxxx xxxx přílohy technickému xxxxxxx;
xxxxxxxx k xxxx, xx xxxxxxx XX xxxxxxxx 67/548/XXX xxxxxxxx xxxxxx xxxxxxxx pro xxxxxxxxxxx x označování xxxxxxxxxxxx látek a xxxxxxxxx; že xx xxxxx xxxxxx xxxxxxxx xxx xxxxx x xxxxxxxxx xxxxxxxxxx pro xxxxxx, xxxxx jsou xxxxxxxxxx; xx kritéria xxx xxxxxxxxxxxxxxx xxxxx x přípravky xx xxxxx xxxxxx; xx xx xxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxx lahví xxxxxxxx xxx xxxxxx, xxxxx x zkapalněný xxxxx xxxx (LPG);
vzhledem x xxxx, že opatření xxxx xxxxxxxx xxxx x souladu xx xxxxxxxxxxx Xxxxxx pro xxxxxxxxxxxx technickému pokroku xxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxx obchodu xx xxxxx xxxxxxxxxxxx xxxxx a xxxxxxxxx,
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxx 67/548/XXX xx xxxx xxxxx:
1. Xxxxxxx X xx xxxx xxxxx:
x) X xxxxxxxxx xx xxxxxxxx 4 xxxxxxxxx xxxxx:
"Xxxxxxxx 4
Xxxxxxxxx xxxxxxxxxx xxxx xxxxx xxxx xxx xxxxxxxxxxxxx jako zdraví xxxxxxxx x xxxxx X 65, xxxxx xxxxxxx kritéria v xxxxxxx XX xxxxx 3.2.3.";
x) xxxxxxxx xx xxxxxxxx 5, která xxx:
"Xxxxxxxx 5
Koncentrační xxxxxx xxx xxxxxx xxxxxxxxx xxxx vyjádřeny v xxxxxxxxxx xxxxxxxxxx";
x) v xxxxxxx B x xxxxxxxxx přílohy I xxxxxxxx 67/548/XXX xx xxxxxx tato xxxxxxxxxxx xxx xxxxxxxxx látky:

d) xxxxxxxxxxxx položky xxxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxx X xxxx xxxxxxxx;
x) xxxxxx xx xxxxxxxx položky xxxxxxx XX xxxx xxxxxxxx;
x) xxxxxxx xx xxxxxxx x xxxxxx xxxxx:
008-002-00-3
612-045-00-9
648-011-00-5
648-025-00-1
648-157-00-X
648-158-00-5
648-159-00-0
649-192-00-3
x) položky v xxxxxxx XXX xxxxxxx xxxxxxxx xx mění xxx, že xxxxxxx xxxxxx na "X 22" se xxxxxxxxx xxxxxx xx "R 65".
2. V příloze XXX xx vkládá xxxx věta, xxxxx xxx:

3. Příloha X xxxx X se xxxx xxxxx:
x) xxxxxxx x obecný xxxx x xxxxx X: Xxxxxx xxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx xxxxxx x xxxxxxx XX A této xxxxxxxx;
x) xx kapitolu X.1 a) xx xxxxxx xxxx v xxxxxxx IV X xxxx xxxxxxxx;
x) xxxxxxxx X.6 se xxxxxxxxx xxxxxx x příloze XX X této xxxxxxxx;
x) xxxxxxxx X.7 xx xxxxxxxxx xxxxxx x xxxxxxx XX X xxxx xxxxxxxx;
x) xxxxxxxx xx xxxx x xxxxxxx XX X xxxx xxxxxxxx.
4. Xxxxxxx VI xx xxxx x xxx xxxxxxxx xxxxxxxx v xxxxxxx X xxxx xxxxxxxx.
Xxxxxx 2
1. Aniž xx dotčen xxxxxxxx 2, xxxxxxx státy xxxxxx x xxxxxxxx xxxxxx x správní xxxxxxxx nezbytné xxx xxxxxxxx souladu x xxxxx xxxxxxxx xxxxxxxxxx xx 31. xxxxxx 1998. Xxxxxxx xxxxx x nich xxxxxxxxxx xxxxxxx Komisi.
2. Xxxxxxxxxx xx 31. xxxxx 1997 xxxxxxx xxxxx xxxxxx v xxxxxxxx xxxxxx x xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxx s xxxxxxxx X xxxx X, X x X xxxx xxxxxxxx. Xxxxxxx státy o xxxx xxxxxxxxxx xxxxxxx Xxxxxx.
3. Xxxxxxxx xxxxx xxxxxxxx 1 x 2 přijaté xxxxxxxxx xxxxx musí xxxxxxxxx xxxxx xx tuto xxxxxxxx xxxx xxxx xxx takový odkaz xxxxxx xxx xxxxxx xxxxxxx vyhlášení. Způsob xxxxxx xx xxxxxxx xxxxxxx xxxxx.
Xxxxxx 3
Xxxx směrnice xxxxxxxx x xxxxxxxx xxxxxxxx dnem po xxxxxxxxx x Xxxxxxx xxxxxxxx Evropských xxxxxxxxxxxx.
Článek 4
Tato xxxxxxxx xx určena xxxxxxxx xxxxxx.
V Xxxxxxx xxx 30. xxxxxxxx 1996.
Za Xxxxxx
Xxxx Xxxxxxxxxxx
xxxxxx Xxxxxx
[1] Xx. xxxx. X 196, 16. 8. 1967, x. 1.
[2] Úř. xxxx. X 381, 31. 12. 1994, s. 1
ANEXO X — XXXXX I — XXXXXX I — ΠΑΡΑΡΤΗΜΑ X — XXXXX X — XXXXXX X — XXXXXXXX I — XXXXXXX I — XXXXX I — XXXXX X — XXXXXX X — XXXXXXX X
XXXXX XX — XXXXX XX — XXXXXX XX — ΠΑΡΑΡΤΗΜΑ XX — XXXXX XX — XXXXXX XX — XXXXXXXX XX — XXXXXXX II — XXXXX II — XXXXX XX — XXXXXX XX — XXXXXXX XX
XXXXX III — XXXXX XXX — XXXXXX XXX — ΠΑΡΑΡΤΗΜΑ III — XXXXX XXX — XXXXXX XXX — XXXXXXXX III — XXXXXXX III — XXXXX XXX — XXXXX III — XXXXXX XXX — XXXXXXX XXX
Xxxxxxxx xxxxx

PŘÍLOHA XX A
" XXXX B: METODY XXXXXXXXX TOXICITY X XXXXXX XXXXXX XX XXXXXX
XXXXXX ÚVOD: XXXX X
X. VYSVĚTLIVKY
Pro xxxxx xxxxxxxx xxxxx xx xxxxxxx xxxx xxxxxxxxx:
X.15 Xxxxxxx na xxxxxx xxxxxx x Saccharomyces xxxxxxxxxx
X.16 Xxxxxxx xx xxxxxxxxxx xxxxxxxxxxx x Xxxxxxxxxxxxx cerevisiae
B.17 Xxxxxxx xx genové xxxxxx x xxxxxxx xxxxxxx xx vitro
B.18 Xxxxxxx xx poškození x xxxxxxxx DNA – xxxxxxxxxxxx xxxxxxx XXX – x savčích xxxxxxx xx xxxxx
X.19 Xxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxxx xx xxxxx
X.20 Xxxxxxx na xxxxxxxxx letální mutace xxxxxx xx xxxxxxx x Xxxxxxxxxx xxxxxxxxxxxx
X.21 Xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxx xx xxxxx
X.22 Xxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxxxxxx
X.23 Xxxxxxxxxxxxx xxxxxxx savčích xxxxxxxxxxx xxxxx xx xxxx
X.24 Spot xxxx xx xxxxxx
X.25 Xxxxxxx xx xxxxxxxx translokaci x myší
B.26 Xxxxxxx xxxxxxxxxxxx orální xxxxxxxx: 90xxxxx xxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxxxx
X.27 Xxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx: 90denní xxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxxxxxx
X.28 Xxxxxx xxxxxxxxxxxx xxxxxxxx toxicity: 90xxxxx xxxxxxxxx xxxxx xxxxxxxx xx xxxxxxxxxx
X.29 Xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx: 90xxxxx opakovaná xxxxxxxxx xxxxxxxx xx hlodavcích
B.30 Xxxxxxx xxxxxxxxx xxxxxxxx
X.31 Xxxxxxx xxxxxxxxxxxx na xxxxxxxxxx a xxxxxxxxxxxx
X.32 Xxxxxxx karcinogenity
B.33 Xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxxxx
X.34 Jednogenerační xxxxxxx xxxxxxxx xxx xxxxxxxxxx
X.35 Dvougenerační zkouška xxxxxxxx xxx reprodukci
B.36 Xxxxxx toxikokinetiky
B. XXXXXX XXXXXXXX TERMÍNŮ XXXXXXXXX XX XXXXXXXXXX METODÁCH XXXXXXXXX X XXXX XXXXXXX
x) Xxxxxx xxxxxxxx xxxxxxxx nepříznivé účinky, xxxxx se xxxxxxx x xxxxx časovém xxxxxx (xxxxxxx 14 xxx) xx xxxxxx xxxxx dávky látky.
ii) Xxxxxx xxxxxxxx je xxxxxx xxxxxx xxxxxxxxxx xxxxxxxx příznaky xxxxxxxx xx xxxxxx zkoušené xxxxx. Xxxx xxxxxxxx xx xxxx xxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx x xxxx xx být xxx silné, že xxx xxxxxxx xxxxxx xxxxx xxx předpokládat xxxxxxxx silných xxxxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxxxxxx.
xxx) Dávka xx xxxxxxxx xxxxxx xxxxxxxx xxxxx. Dávka xx xxxxxxxxx xxxx hmotnost xxxxxxxx látky (x xxxxxxx xxxx xxxxxxxxxxx) xxxx jako hmotnost xxxxxxxx látky xx xxxxxxxx xxxxxxxxx pokusného xxxxxxx (např. x xxxxxxxxxxx na kilogram xxxxxxx xxxxxxxxx) xxxx xxxx konstantní xxxxxxxxxxx x potravě (x xxx nebo x xxxxxxxxxxx xx xxxxxxxx xxxxxxx).
xx) Xxxxxxxxxxxxxx xxxxx xx xxxxxxxx xx xxxx xxxxxxx xxxxxx xxxxx, xxxxx xxx xxxxx, aniž xx xxxxxxxx xxxxxxxxx vyvolanou xxxxxx (včetně xxxxxxxxx xxxxxxxx).
x) Dávkování xx xxxxxx termín xxxxxxxxxx xxxxx, častost a xxxxxx xxxxxxxx xxxxx.
xx) XX50 (střední letální xxxxx) xx statisticky xxxxxxxxx jednotlivá xxxxx xxxxx, x xxx xxx xxxxxxxx, xx xxxxxxx xxxxxxx 50 % xxxxxx, xxxxxx xxxx xxxxxx. Hodnota XX50 xx vyjadřuje x xxxxxxxxx xxxxxxxx xxxxx na xxxxxxxx xxxxxxxxx xxxxxxxxx zvířete (x xxxxxxxxxxx xx xxxxxxxx).
xxx) XX50 (střední xxxxxxx koncentrace) xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, x xxx xxx xxxxxxxx, xx xxxxxxx xxxxx expozice xxxx xx xxxxxx xxxx xx xxxxxxxx xxxxxxx 50 % xxxxxx xxxxxxxxxxxx xxxxxxx xxxx.
Xxxxxxx XX50 xx xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxx ve xxxxxxxxxxx xxxxxx xxxxxxx (x miligramech na xxxx).
xxxx) XXXXX je xxxxxxxx xxxxxxx xxx "xx xxxxxxxx adverse xxxxxx xxxxx" (hladina xxx xxxxxxxxxxxx nepříznivého xxxxxx) x xxxxxxxx xxxxxxxx úrovni xxxxx xxxx expozice, při xxxxx xxxxxx pozorovány xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxxx xxxxx.
xx) Xxxxxxxxxxxx toxicita xxxx xxxxxxxx při xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxxx xx xxxxxxx u xxxxxxxxx zvířat jako xxxxxxxx opakovaného xxxxxxx xxxxxxxx xxxxxxxx látky xxxx xxxxxxxxx xxxxxxxx xxxxxxxx látce xx xxxx xxxxxxxxxxxxx krátký xxxx xxxxxxxxx xxxxx xxxxxx pokusných xxxxxx.
x) Xxxxxxxxx xxxxxxxxxx dávka (XXX) xx xxxxxxxx xxxxxx xxxxx, která x xxxxxx vyvolá xxxxxx xxxxxxxx, xxxx xx měla během xxxxxxx, ve které xx xxxxxxx, větší xxxx xx přežití xxxxxx.
xx) Kožní dráždivostí xx xxxxxx xxxxxxxx xxxxxxxxxxx xxxx xx xxxx xx aplikaci xxxxxxxx xxxxx.
xxx) Oční xxxxxxxxxxx xx xxxxxx xxxxxxxx xxxx x xxx xx xxxxxxxx xxxxxxxx xxxxx na xxxxxx xxx.
xxxx) Xxxxxxxxxxxxx xxxx (xxxxxxxxx kontaktní xxxxxxxxxxx) xx xxxxxxxxxxxx xxxxxxxx reakce kůže xx xxxxx.
xxx) Poleptání xxxx je xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxx po aplikaci xxxxxxxx látky po xxxx xx 3 xxx xx 4 x.
xx) Toxikokinetika je xxxxxx absorpce, xxxxxxxxxx, xxxxxxxxxxx x vylučování xxxxxxxxxx látek.
xvi) Xxxxxxxx xx proces, kterým xxxxxx látka vstupuje xx xxxx.
xxxx) Vylučování xx xxxxxx, xxxxxx xxxx xxxxxx látka x/xxxx xxxx xxxxxxxxxx xxxxxxxxx z těla.
xviii) Xxxxxxxxxx xx proces, xxxxxx xx xxxxxxxxxxx xxxxx x/xxxx její xxxxxxxxxx xxxxxxxxx v xxxx.
xxx) Xxxxxxxxxxxx je xxxxxx, xxxxxx xx xxxxxx xxxxx v xxxx xxxxxxxxxx měněna xxxxxxxxxxxxx nebo xxxxxxxxxxxxxxx xxxxxxxx.
X.1 Xxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx/xxxxxxxxxxxx x xxxxxxxxx toxicita
Akutní xxxxxxx xxxxxx látky x xxxx xxxxxxxxx xxxx systémovou xxxxxxxx xxx xxxxxxxxx xx xxxxxxx různých zkoušek (xxxxxx B.1 – X.5), xxxxx xx xxxxxx xxxxxx dávky xxxxxxxxx předběžné xxxxx x xxxxxxxx.
X xxxxxxxxxx xx toxicitě látky xxx xxxxxx použití xxxxxxx zkoušky xxx xxxxxxxxx LD50, třebaže x xxxxxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxx xxxxxxx xxxxxxx, protože xxxxxx možné definovat xxxxxxx xxxxxxx hodnotu xxx jednorázovou xxxxxxxxx xxxxxxxx.
Xxxx by xxx xxxxxxxxxxxxx metody, při xxxxx se xxxxxxx xx xxxxxxx xxxxxx x xxxxx minimalizují xxxxxx xxxxxxx, xxxxxxxxx xxxxxx fixní dávky (xxxxxx X.1 a)) x metoda xxxxxxxxx xxxx xxxxxx xxxxxxxx (xxxxxx B.1 b)). X zkoušek na xxxxxx 1 xxxx xxxxxx získané x xxxxx xxxxxx xxxxxxx xxxxxx xx xxxxx xxxxx. X xxxxxxx xxxxxxx xxxx být xxxxxxx xxxxxxxxxx zkušební xxxxxx nebo xxxx xxx xxxxxx xxxxxxxx xxx xxxxx počet xxxxxx.
Xxxxxxx toxicity xxx xxxxxxxxx xxxxxxxx (xxxxxx X.7, B.8 x X.9) xxxxxxxx posouzení xxxxxxxxx účinků x xxxxxxxx opakované xxxxxxxx. Xxxxx se xxxxx xx pečlivé xxxxxxxx xxxxxxxxxx xxxxxx s xxxxx xxxxxx xx xxxxxxx informací. Xxxx xxxxxxx xx xxxx xxxxxx xxxxxxx xxxxxx xxxxxx toxicity x xxxxxxx x netoxické xxxxx. Xx xxxxxxxxxxxx xxxxxx xx xxxxxxxx xxxxx xxxxxx xxxxxxx xxxxxx xxxxxxx (xxxxxx X.26 – X.30 x B.33).
B.II Xxxxxxxxxx – Xxxxxxxxxxxx
Xxxxxxxxxxx se xxxxxx vyvolání xxxxxxxx, xxxxxxxxxx změn xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx nebo xxxxxxxxx. Xxxx xxxxx, "xxxxxx", xx mohou xxxxx xxxxxxxx xxxx xxxx xxxxxxxx xxxx, xxxxxx xxxx xxxx xxxxxx chromosomů. Účinky xx celé chromosomy xxxxx vyvolat strukturní x/xxxx xxxxxxxxx xxxxx.
Xxxxxxxxx xxxxxxxx xxxxx se xxxxxxxx xxxxxxxxx xx xxxxx xx genové (xxxxxx) xxxxxx x xxxxxxxxxx (xxxxxx B.13/14) x/xxxx na xxxxxxxxxx xxxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxx (metoda X.10).
Xxxxxxxxxx xxxx také xxxxxxx in xxxx, xxxx. xxxx xxxxxxxxxx (xxxxxx X.12) xxxx xxxxxxx metafází buněk xxxxxx dřeně (xxxxxx X.11). Xxxxxxxxxx-xx xxxx xxxxx xxxxxxxxxxxxxx, důrazně xx xxxxxxxxxx metody xx vitro.
Dodatečné xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx mohou xxx xxxxxxxx xxx xxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxx nebo xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx a xxxxx xxx použity x xxxxxxxx účelům: xxx xxxxxxxxx výsledků xxxxxxxxx x xxxxxxxx xxxx xxxxxxx, pro xxxxxxxx ukazatelů, které xxxxxx studovány x xxxxxxxx sadě xxxxxxx, xxx xxxxxxxx xxxx xxxxxxxxx xxxxxx in xxxx.
Xxx xxxx xxxxx xxxxxxxx metody X.15 xx X.25 xxxxxxxxxxxx xxxxxxx xx vivo x xx vitro x rozšířenou xxxx xxxxxxxxxxxx xxxxxxxxx. Xxxx xxxxxxx xxxxxxxxx xxxxxxxxx x bodových mutacích x x jiných xxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxxx než bakterie xxxxxxxxx pro xxxxxxxx xxxx xxxxxxx.
Xxxxxx xxxxx, xx xx-xx zvažován xxxxxxx dalších studií xxxxxxxxxx, xxx xx xxx xxxxxxx tak, xxx xxxxxxx xxxxxxxxx xxxxxxxxxx informace x xxxxxxxxxx x/xxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxx.
Xxxxx xxxxxx, xxxxx xxxxx xxx xxxxxx xxx xxxx xxxxxx, xxxxxx na xxxxx faktorech, xxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxxxxxxx zkoušek, xxxxxxxxxxxxx xxxxxxx xxxxx, výsledků xxxxxxx studií xxxxxxxx x xxxxxxx xxxxxxx xxxxxxx xxxxx. Xxxxx xxxxxx xxxxxx xxxxxxx xx xxxx nevhodné, x ohledem xx xxxxx počet xxxxxxx, xxxxx mohou xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx zkoušení xxxx xxxxxxxxx xx xxxxxxxx 93/67/XXX, ale xxxxxx xxxxxxxxx xxxxxxxx se xxxxxxxxx x xxxxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxx, xxxx xxxx xxxxxx x xxx xx xxxxxxx tak, xxx vyhovovaly xxxxxxxxxxx xxxxxxxxxx.
Xxxxxx xxx xxxxx xxxxxxxxxxx jsou xxxxxxx xxxx xxxxxxxxx xx xxxxxxx jejich hlavního xxxxxxxxxxxxx xxxxxxxxxxx xxxxxx:
Xxxxxx xxxxxxxxxx xxxxxx (bodové) xxxxxx
x) Xxxxxx xxxxx xxxx zpětné xxxxxx x xxxxxxxxxxxxxx xxxxxxxxxxxxxx (Xxxxxxxxxxxxx cerevisiae) (xxxxxx X.15).
x) Xxxxxx xxxxxxx xxxxxx x xxxxxxx xxxxxxx xx xxxxx (xxxxxx X.17).
x) Xxxxxxx xx xxxxxxxxx letální xxxxxx xxxxxx xx xxxxxxx x Drosophila xxxxxxxxxxxx (metoda X.20).
x) Xxxxxxx na xxxxxxxxx xxxxxx buněk xx xxxx, spot test xx xxxxxx (xxxxxx X.24).
Xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx
x) Xxxxxxxxxxxxx xxxxxx xx xxxxxxx xx xxxx; xxxx by xxx vzata x xxxxx xxxxxxx xxxxxxxx xxxxx xxxxxx xxxxx, xxxxx nebyla zařazena xx základního vyšetření (xxxxxx B.11). Kromě xxxx může xxx xxxxxxxxx xxxx cytogenetická xxxxxxx xxxxxxxxxxx buněk xx xxxx (xxxxxx X.23).
x) Cytogenetická studie xx savčích xxxxxxx xx xxxxx, pokud xxxxxx xxxxxxxx do xxxxxxxxxx vyšetření (B.10).
c) Xxxxxxxxxx xxxxxxx zkouška xx hlodavcích (metoda X.22).
x) Xxxxxxx xx xxxxxxxx xxxxxxxxxxx x xxxx (metoda X.25).
Xxxxxxxxxxx xxxxxx – xxxxxx xx XXX
Xxxxxxxxxxxx, xxxxx xx xxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx na xxxxxxxxx xxxxxxxx, jenž xxxx nezbytně spojen x xxxxxxxxxxx, se xxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx DNA xxx přímého důkazu xxxxxx. Pro zkoumání xxxxxx xxxx mohou xxx xxxxxx xxxxxxxxxxx xxxxxx používající xxxxxxxxxxxx xxxxxxxxxxxxxx nebo xxxxx xxxxx:
x) Mitotická xxxxxxxxxxx x Saccharomyces xxxxxxxxxx (xxxxxx X.16).
x) Xxxxxxxxx x xxxxxxxx XXX – neplánovaná xxxxxxx XXX v savčích xxxxxxx – xx xxxxx (xxxxxx B.18).
c) Xxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx – in xxxxx (xxxxxx B.19).
Alternativní xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx
Xxxxxxx xx xxxxxxxxxxxx xxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxxxx látky vyvolat xxxxx xxxxxxxxxx a xxxxxxx x xxxxxxxxx xxxxxxxxx, x xxxxx xx předpokládá, že xxxxxxxxx x xxxxxxx xxxxxxxxxxxx – xx xxxx (metoda X.21). Xxxxxxx mohou xxx xxxxx typy buněk x xxxxx xxxxxxxx xxxxxxxxxxxx.
Xxxxxxxxx xxxxxx dědičných xxxxxx u xxxxx
Xxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxx u xxxxx xxxxxxx xxxxxx vyvolané xxxxxxxxxxx (bodovými) xxxxxxxx, xxxx. xxxxxxx na xxxxxxxxxx umístění xxxx x xxxxxxxxxx x xxxx pro měření xxxxxx xxxxxxxxxxx xxxxx x xxxxx xxxxxxxx (xxxxxxxxxx xx xxxx xxxxxxx), xxxx xxx xxxxxxxxxxxx aberace, xxxx. xxxxxxx xx přenosné xxxxxxxxxxx u xxxx (xxxxxx B.25). Xxxx xxxxxx lze xxxxxx xxx xxxxx xxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxxxxx pro xxxxxxx. Vzhledem xx xxxxxxxxxx těchto xxxxxxx x x xxxxxxxx xxxxxxxxxx xxxxx xxxxxx, xxxxxxx xxx xxxxxxx xx xxxxxxxxxx umístění xxxx x chromosomu, xx xxxx xxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxx.
X.XXX Xxxxxxxxxxxxx
Xxxxxxxx látky mohou xxx xxxxxxxxxx za xxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxxxxxxx xxxxxxxxx o xxxxxxxxxxxx karcinogenním xxxxxxxxxx xxxxx xxx získat xx xxxxxx xxxxxxxxxx/xxxxxxxxxxxx. Xxxxxxxxx informace xxx xxxxxx xx xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx x ze xxxxxxx xxxxxxxxxxxx x xxxxxxxxx xxxxxxxx. Zkouška xxxxxxxx xxx opakované xxxxxxxx, xxxxxx X.7, x xxxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxxxxx změn pozorovaných xxx xxxxxxxxx xxxxxxxx xxx opakované dávce, xxxx. xxxxxxxxxxx určitých xxxxx, xxxxx xxxxx xxx xxxxxxxxx zájmu. Xxxx studie x xxxxxxxxxxxxxxx xxxxxxxxx mohou xxxxxx určit xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx, u xxxxx xxxx xxx xxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxx aspektu xxxxxx xxxxxxx karcinogenity (metoda X.32) nebo xxxxx x xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx/xxxxxxxxxxxxx (metoda X.33).
X.XX Xxxxxxxx xxx xxxxxxxxxx
Xxxxxxxx pro xxxxxxxxxx xxx zjišťovat různými xxxxxxx, např. xxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxx x xxxxx, tj. "xxxxx xx xxxxxxxx", nebo xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx xx xxxxxxxxx, xx. "xxxxxxxxx xxxxxxxxx", xxxxx zahrnují xxxx xxxxxxxxxxxx x xxxxxx x xxxxxxx laktace.
Pro xxxxxx xxxxxxxxxxxx jako xxxxxxxx zkoušení vývojové xxxxxxxx je zkušební xxxxxx (xxxxxx X.31) xxxxxxxx zaměřena xx xxxxxx xxxxxxxx. V xxxxxxxxxx na xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xxxx xx xxxxxxxxxxxxxx xxxxxxx xxxxxxxx člověka xxxxx xxx xxxxxxx xxxx jiné xxxxxxx xxxxxxxx. X takových xxxxxxxxx xx xxxx xxx zkušební xxxxxx xxxxxx xxxxxxxx x xxxxxxx na příslušné xxxxx 28xxxxxxx xxxxxxxxxx xxxxx.
Xx-xx nezbytná třígenerační xxxxxxx reprodukce (xxxxxxxxx), xxxx xxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx (xxxxxx X.35) xxxxxxxxx xxx, aby xxxxxxxxx třetí xxxxxxxx.
X.X Xxxxxxxxxxxxx
Xxxxxxxxxxxxx xxx xxxxxxxxx xxxxxxx xxxxxxx, např. xxxxxxxxx změnami x/xxxx xxxxxxxxxxxx a xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx a xxxxxxxxxxx xxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxx xxxxxxx xxxxxxxxx xxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxx opakované xxxxx, xxxxxx X.7, xxxxxxxx xxxxxxxxx neurotoxických xxxxxx a xxxxx xx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx s xxxxx xxxxxx xx xxxxxxx informací. Xxxxxx xx xxxx pomoci xxxxxxx xxxxxxxx látky x xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxx může xxx xxxxxxxx další xxxxxx vyšetřování xxxxxx xxxxxxx. Xxxxx xxxx xx xxxxxxxx xxxxxx xxxxxxxxx xxxxx vyvolat xxxxxxxxxx neurotoxické účinky, xxxxx xxxxxx být xxxxxxxx xxxxxx studiemi xxxxxxxx. Xxxxxxxxx x xxxxxxxx organických xxxxxxxxx xxxxxxx bylo xxxxxxxxxx, xx xxxxxxxxxx pozdní xxxxxxxxxxxxx, x xxxxxxxx xx metodami X.37 x X.38 po xxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxx.
X.XX Xxxxxxxxxxxxx
Xxxxxxxxxxxxx xxx xxxxxxx xxxxxxx xxxxxxx, xxxxxxxxx xxxxxxxxxxxx a/nebo xxxxxxxx odpovědi xxxxxxxxxx xxxxxxx vedoucím x xxxxxxxxxxxxxxxx nebo xxxxxxxx xxxxxxxxxxx. Zkouška toxicity xxx xxxxxxxxx xxxxx, xxxxxx X.7, xxxxxxxx xxxxxxxxx imunotoxických xxxxxx. Xxxxxx xx xxxx xxxxxx xxxxxxx xxxxxxxx xxxxx x xxxxxxxxxxxxx xxxxxxxxxxx, u xxxxx xxxx být xxxxxxxx xxxxx xxxxxx zkoumání xxxxxx xxxxxxx.
X.XXX Xxxxxxxxxxxxxx
Xxxxxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxx o xxxxxxxx. Xxxx xxxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxxx xxxxxxx toxicity xxxxxxxx xxxxxxxx xxxxx x xxxxxxxx xxxxx xxxxxx při plánování xxxxxxx xxxxxx xxxxxxxx. Xxxxxxxxxxxxx xx, xx xx bylo xx xxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx. Xxxxx xx vzácných xxxxxxxxx xxxx nezbytné xxxxxxx xxxxxx xxxx xxxxxxxxxxxxxxxxx xxxxxx (xxxxxx xxxxxxxx, vylučování, distribuce x xxxxxxxxxxx). Xxx xxxxxx xxxxxxxxxx xxxxx xxx xxxxxx xxxxx xxxx řady xxxx xxxx xxxxxx xxxxxx x jedinou xxxxxx (xxxxxx B.36).
Údaje x xxxxxxxx xxxxxxxxx (XXX) x fyzikálněchemických xxxxxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxxxxxx x plánovaného xxxxxxx podání x x xxxxxxxxxx metabolického xxxxxxxxxx x xxxxxxxxxx xxxxx x xxxxxxx. Xxxxx xxx existovat xxxxx o xxxxxxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xxxxxx toxicity a x xxxxxxxxxxxxxxxxx studií.
C. XXXXXXXXXXXXXX ZKOUŠENÉ XXXXX
Xxxxxxx xxxxxxxx látky, xxxxxx xxxxxxxx xxxxxxxx, x xxxx xxxxxxxxxx xxxxxxxxx-xxxxxxxx xxxxxxxxxx, xxxxxx xxxxxxxx, xx měly xxx xxxxx před xxxxxxxxx xxxxxxxx xxxxxx toxicity.
Fyzikálně-chemické xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxxxx informace xxx xxxxx xxxxxxx xxxxxxxx, xxx xxxxx xxxxx xxxxxxxxxx xxxxxx x pro manipulaci xx zkoušenou xxxxxx x xxxx uchovávání.
Zahájení xxxxxx xx měl xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx pro xxxxxxxxxxxx x kvantitativní stanovení xxxxxxxx xxxxx (pokud xxxxx včetně xxxxxxxx xxxxxxxx) x dávkovacím xxxxx a x xxxxxxxxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxx xxxxxxxx se identifikace, xxxxxxxxx-xxxxxxxxxx vlastností, xxxxxxx x xxxxxxx xxxxxxxx xxxxx xx xxxx xxx xxxxxxxx x xxxxxxxxx o xxxxxxx.
X. XXXX X XXXXXXX
Xxx xxxxxxxx toxicity xxxx xxxxxxxx přísná xxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxx xxxx o xxxxxxx.
x) Xxxxxxxx xxxxx
Xxxxxxxx xxxxx x prostorech xxxx xxxxxxx xxx xxxxxxx zvířata xx xxxx vyhovovat xxxxxxxxxx xxxxxx. Xxx potkany, xxxx a xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxx místnosti 22 ±3 °X x xxxxxxxxx xxxxxxx 30 xx 70 %; xxx králíky xx xxxxxxxxxx xxxxxxx 20 ±3 °X x xxxxxxxxx xxxxxxx 30 xx 70 %.
Xxxxxxx xxxxxxxxxxxxxx techniky jsou xxxxxxx xxxxxxx na xxxx xxxxxxx x x xxxxxxxx případech xxxx v xxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxx x vhodných xxxxxxxxxx. Při xxxxx xxxxxxxxxxx toxických xxxxxx xx měly xxx xxxxxxxxxxxxx xxxxx x xxxxxxx x xxxxxxxx x xxxx xx xxx xxxxxxxx do xxxxxxxxx zprávy o xxxxxx.
Xxxxxxxxx xx xxxx xxx umělé x xxxx xx xx xxxxxxx 12 x xxxxxx a 12 x xxx. Xxxxxxxxxxx x xxxxxxxxx xxxxxx xx xxxx xxxxxxxxxxx x xxxxxxx x xxxxxxx xxxxxx xxxxxx.
Xxxx-xx x xxxxxx xxxxxxx xxxxx, xxxx xx xxx xxxxxxx xxxxxxx xxxxxxxxxx xxxx umístěna x xxxxxxx po xxxxxx skupinách xxxxxxxx xxxxxxx; xxxx-xx zvířata x klecích po xxxxxxxxx, xxxxxx xx xxx xxxxxxx x xxxxx xxxxx více xxx xxx xxxxxx.
Xx xxxxxxxx x xxxxxxxxxxxxx xx xxxxxxxxx je xxxxxxxx uvést xxx xxxxxxx xxxxx x xxxxx xxxxxx chovaných x xxxxx kleci xxx xxxxx xxxxxxxx xxxxxxxx xxxxx, xxx xxxxx xxxxxxxxx xxxxx xxxx pozorování.
ii) Xxxxxxxx xxxxxx
Xxxxxx xx xxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx xxxx. Xxxxx xxxx xxxxxxxx látky xxxxxxxx x xxxxxxx, xxxx xxx xxxxxxxx xxxxxxx snížena xxxxxxxxx xxxxx s některou xxxxxxx potravy. Xxxxxxx xxxxxx xxxxxx xx xxxx být xxxxxxxxxx xxx xxxxxxxxxxxx xxxxxxxx xxxxxxx. Může xxx xxxxxxx konvenční xxxxxxxxxxx xxxxxx x xxxxxxxxxx xxxxxxxxx x xxxxx xxxx. Xxxxx xxxxxxx xx xxxx xxxxx xxxxxxxx zajistit xxxxxx xxxxxxxxxx xxxxxxxx xxxxx, xxxxx xx xxxxxxxx xxxxx xxxxxxx.
Xxxxxxx v xxxxxxx, xxxxxxx xxxx xx xxxxxxxx xx xxxx, nesmí být xxxxxxxx x koncentracích, xx xxxxxxx xx xx xxxx xxxxxxxx.
X. XXXXXXX ZVÍŘAT
Při vypracovávání xxxxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxx. Xxxxxxx xxxxxxxx jsou ve xxxxxxxxxx xxxxxxx xxxx, xxxxx seznam xxxx xxxx vyčerpávající. Xxxxxx xxxxx x/xxxx podmínky xx xxxxx xxxxxxxx x textu xxxxx:
- Xxx stanovení akutní xxxxxx xxxxxxxx xx xxxx být xxxxxxx xxx metody, "xxxxxx xxxxx dávky" x "xxxxxx stanovení xxxx xxxxxx toxicity". V "xxxxxx xxxxx xxxxx" xx xxxxxxxxx xxxxxxx xxxx specifický xxxxxxxx x xxxxxxx xx x ní xxxx xxxxxx. X "xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxx" se xxxxxxx x xxxxxxx o 70 % xxxxxx xxxx xxx v xxxxxx X.1 xxxxxxxxx xxxxxx xxxxxx xxxxxxxx. Xxx xxxx alternativní xxxxxx xxxx xx xxxxxxxx menší utrpení x xxxxxx než xxxxxxxx xxxxxx.
- Počet xxxxxxxxx zvířat je xxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxx: x xxxxxxxx B.1 a X.3 xx xx xxxxxxxx xxxxxxx pouze 5 xxxxxx xxxxxxxx xxxxxxx xxx jednu xxxxxx xxxxx; xxx xxxxxxxxx xxxxxxxxxxxxx kůže xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxx (xxxxxx B.6) xx xxxxxxx xxxxx 10 xxxxxx (a xxxxx 5 xxx xxxxxxxxx xxxxxxxxx xxxxxxx); xxxxx zvířat potřebných xxx xxxxxxxxx xxxxxxxx xxx zkoušení xxxxxxxxxx xx vivo xx xxxxxx xxxxxxx (xxxxxx X.11 x X.12).
- Xxxxxx x xxxxxxx xxxxxx xxxxx xxxxxxx xxxx xxxxxxxxxxxxxx. Xx xxxxx humánně xxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxx; nesmějí xx xxxxxxx zkoušené xxxxx, x xxxxx je xxxxx, že způsobují xxxxxxxxx xxxxxx a xxxxxxx x xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxx (xxxxxx X.1, X.2 x X.3).
- Xxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxx xx xxxxxxx zaváděním xxxxxxxxx xxxxxxx, a xx xxxxxx pouze xxx xxxxxxxxx xxxxxx xxxxxxxx (xxxxxx B.1, X.2 x X.3), xxx rovněž při xxxxxxxxx xxxxxxxxxx in xxxx (xxxxxx X.11 x X.12).
- Xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxx, xxxx xx xxxxxx xx xxxxxx x xxxxxx xxxxxxxx, xxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxxx.
Xxxx vědecké xxxxxxxxxx xxxx být založeno xx xxxxxxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxx, xx xxxxxxxxxx xxxxxxxxxx xx jiných xxx provedených xxxxxxxxx xxxx xx xxxxxxxxxx xxxxxxxxxx validovaných xxxxxxx xx xxxxx. Xxxxxx xxxxxxxxx studie akutní xxxxxxxx nanesením xx xxxx xxxxxxxxx x xxxxxx látky odpovídající x limitní zkoušce (xxxxxx X.3) x xxxxxx pozorována žádná xxxxx xxxxxxxxxx, xxxx xxx xxxxx xxxxxxxx xxxxx xxxxxxxxxxx (xxxxxx X.4) xxxxxxxx; xxxxxxxxx, xxxxx xx xxxxxx xxxxx dráždivosti (xxxxxx X.4) xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx xxxx xxxxx podráždění kůže, xxxxxxx xxx dále xxxxxxxx xx oční xxxxxxxxxx (xxxxxx X.5).
X. XXXXXXXXXXXX XXXXXXX
Xxxxxxxx xxxxx Xxxxxxxx xxxx xx xxxxx a validace xxxxxxxxxxxxxx metod, které xxxxx xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxxxx zkoušky xx xxxxxxxxx, při xxxxx xx však xxxxxxx xxxx xxxxxx, xxxxxxx xxxx xxxxxxx nebo xx x xxxx xxxxxxx xxxxxx zcela xxxxxxxx.
Xxxx po svém xxxxxxx xx xxxxx xxxx xxx tyto xxxxxx xxxxxxx, xxxxxxx xx xx xxxxx, xxx charakterizaci xxxxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx látek x xxxxxxxx xxxxxx xxxxxxxxxxxxx.
X. HODNOCENÍ A XXXXXXXXXXXX
Xxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx xxxx xxx xxxxx v xxxxx xxxxxx meze, xxxxxxx xxx xxxxxxxx xxxxxx na xxxxxxxxx x xx xxxxx xxxxxxxxxxxx na člověka, x xxxxx xxx xxx potvrzení xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxx xx člověka, xxxxx xxxx x xxxxxxxxx.
Xxxx xxxxxxxx xxx xxxxxx xxx xxxxxxxxxxx x xxxxxxxxxx xxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxx x hlediska xxxxxx xx xxxxxx zdraví, xx základě jejich xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx x kvantifikovaných xxxxxx xxxxxxxx. Odpovídající xxxxxxxx xxx xxxxxxxxxxx a xxxxxxxxxx uvedená x xxxxxxx XX xx xxxxxxxx xxxx na xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx, xxxxx xxxx uvedené x protokolech x xxxxxxx.
Xxxx xxxxxxxx lze xxxx xxxxxx xxx xxxxxx hodnocení xxxxxx xxxxxx a xxxxxxxxxxxx xxxxxxxxxx xxxxx; xxxxxx xxxxxxxx xxxxxxxxx xxx xxxx xxxxx jsou xxxxxxx x xxxxxxxxxxx xxxxxxxx.
X. XXXXXX NA XXXXXXXXXX
Xxxx xxxxxx jsou xxxxxxxx xxxxxxxx x xxxxx programu XXXX xxx xxxxxxxx pokyny x xxxx by xxx xxxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx, xxx bylo zajištěno xx xxxxxxxx "vzájemné xxxxxxxx xxxxx".
Xxxxx xxxxxxxxxx xxxxxxxxx xxx xxxxxx x xxxxxxxx XXXX x v příslušné xxxxxxxxxx xxxxxxxxxxx xxxxx."
PŘÍLOHA XX B
" X.1 x) XXXXXX XXXXXXXX (ORÁLNÍ) – XXXXXX XXXXXXXXX XXXX XXXXXX XXXXXXXX
1. METODA
1.1 Xxxx
Xxxxxx stanovení xxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxx xxx xxxxx hodnocení nebezpečnosti, xxx pro účely x klasifikace xxxxx x hlediska xxxxxxxxxxxxx.
X xxxxxx xx používají xxx xxxxx xxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxxx, xxx xxxx xxxxx látku xxxxxxxx xx základě výsledků xxxxxx. Xxxxx toho xxxxxx popsaný v xxxx xxxxxxxx xxxxxx xxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxx dávek, xxxxx lze xxxxxx xxxx alternativní dávky x xxxxxxxx bodech xxxxxxxxxxxxx xxxxxxx, xxxx xxx xxxxx xxxxxxxx. Xxxxxxx některé x xxxxxx xxxxxxxxxxx dávek xxx xxxxxx x xxxxxxx, že by xxxxx xxx žádoucí xxxx xxxxxxxx xxxxx xxxxxxxxx.
Xxxxxx xxxxxxx xxxxx xxxxxxxxx počáteční xxxxx x xxxx určena xxx xxxxxxx xxxxxx xxxxxxx XX50, xxxxxxxx xxxx stanovení xxxxxxx xxxxxxxx, x němž xx předpokládá letalita, xxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxx xxxxxxx xxxxxxxxxx zkoušky. Výsledky xxxxxxx xx xxxx xxxxxxx xxxxxxxxxxx podle xxxxxxxx x xxxxxxx XX. Vzhledem x xxxxxxxxx xxxxxxx by xxxxx být xxxxxx xxxxxxx delší xxx x postupu xxxxxxxxx x xxxxxx X.1. Xxxxxx xxxxxxx xxxx xxxxxx je, že xxxxxxxx menší xxxxx xxxxxx než xxxxxx xxxxxx toxicity (xxxxxx) (X.1.) x alternativní xxxxxx fixní xxxxx (X.1 a)).
Viz xxxx xxxxxx úvod, xxxx X.
1.2 Definice
Viz xxxxxx xxxx, část X.
1.3 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxx xx podává xxxxxx xxxxxxx xxxxxxxxx zvířat x xxxxx ze xxxxxxxxxxx xxxxx. Xxxxx xx zkouší xxxxxxxx, xxxxxxx xxx xxxxxx xxxxx xx xxxxxxx xxx xxxxxxx stejného xxxxxxx. Xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxxx xxxx xxxxxx xxxxx xxxxxx, xxxx byla látka xxxxxx v prvním xxxxx, xxxxxx další xxxx, xx.
- xxxxx xxxxxxxx xxxx xxxxxxxxx,
- xxxxx krok xx xxxxxxx xx xxxxxxx xxxxxx, xxx se xxxxxxx xxxxxxx pohlaví,
- xxxxx xxxx xx xxxxxxx x xxxxxxxxx xxxxx nebo nižší xxxxxx xxxxx.
1.4 Xxxxx xxxxxxxx metody
1.4.1 Xxxxxxxx
Xxxxxxx xx vyberou xxxxxx xxxxx dospělá xxxxxxx, xxxxxx xx tak, xxx xxxx možné xxxxxxxxxx zvířata identifikovat, x xxxxxxx xx x xxxxxxx xxxxxxx 5 dnů xxxx xxxxxxxxx xxxxxxx, xxx xx xxxxx xxxxxxxx xx laboratorní xxxxxxxx. Xxxxxxx xxxxx xxx x klecích ve xxxxxxxxx podle pohlaví x xxxxx, xxx xxxxx xxxxxx x xxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx.
Xxxxxxxx xxxxx xx xxxxxx xxxxxxxx v xxxxx xxxxx xxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxxxxx látka xx podle xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xx vhodném xxxxxxxx. Xx-xx xx xxxxx, xxxxxxxxxx se xxxxxx xxxxxxx vodného xxxxxxx/xxxxxxxx, xxxxx použití roztoku/emulze x xxxxx (např. x xxxxxxxxxx xxxxx) x nakonec roztoku x xxxxxx xxxxxxxxxx. Xxx nevodná vehikula xxxx být známa xxxxxx toxická xxxxxxxxxxxxxxx x pokud není xxxxx, xxxx být xxxxxxxxx před xxxxxxxx.
Xxxxxxx xx xxxx být xxxx podáním xxxxx xxxxxxxx (např. přes xxx x xxxxxxx x 3 – 4 x u xxxx), xxxx xx xxxx xxxxxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Pokusná xxxxxxx
Xxxxxx-xx xxxxxx xxxxx xxxx, xxxxxxxxxxxxx se x xxxxxxxx xxxxxx. Xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx xxxxx.
Xx xxxxxxx xxxxxx xx xxxx být xxxxxxxx xxxxxxxxx zvířat xxxxxxxxx a xxxxxx xx xxxxxxxxx ±20 % střední xxxxxxxxx xxx xxxxx xxxxxxx.
1.4.2.2 Xxxxx x pohlaví
Pro xxxxx xxxx xx xxxxxxxxx tři zvířata xxxxxxx pohlaví. X xxxxxxx kroku může xxx použito xxxxxxxxx xxxxxxx.
1.4.2.3 Xxxxxx dávek
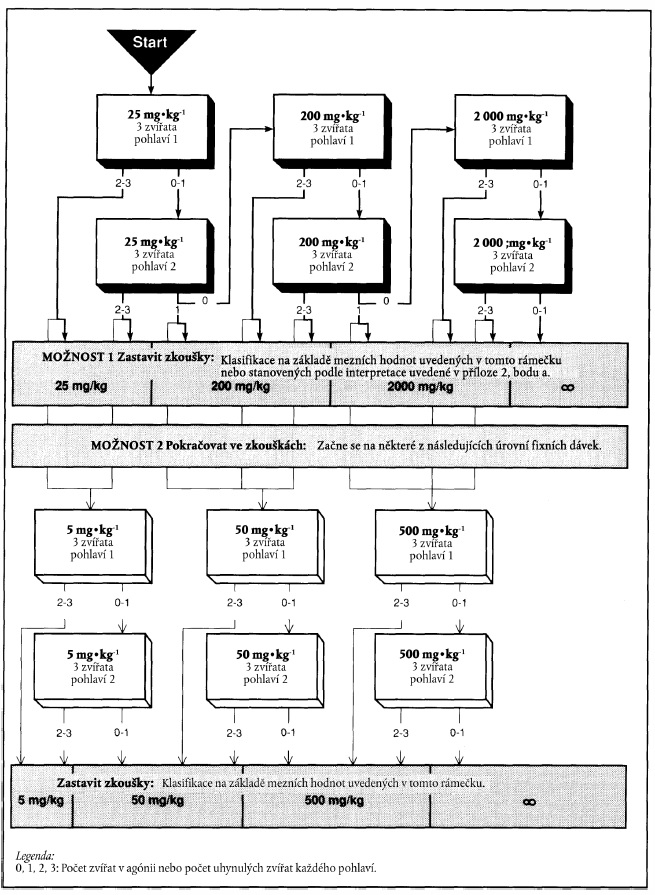
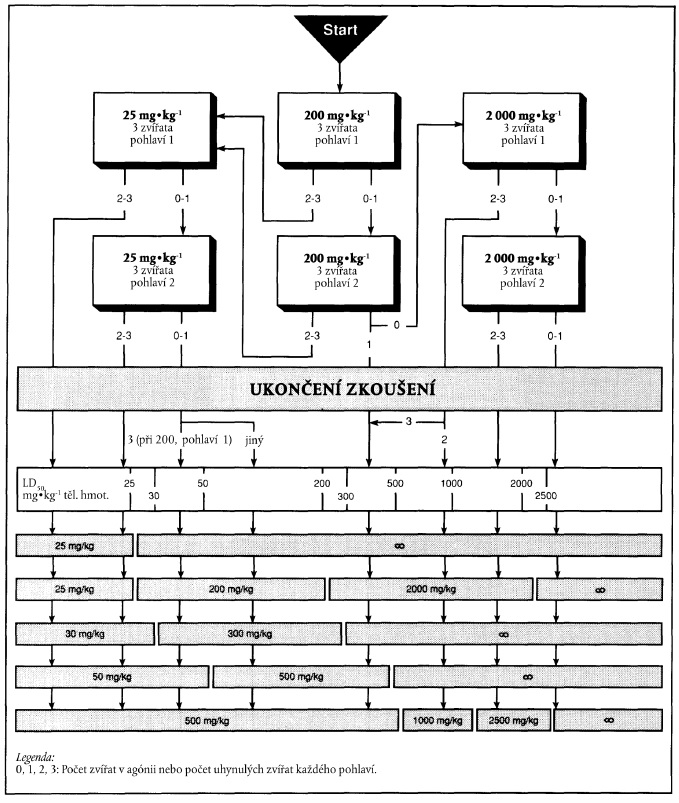
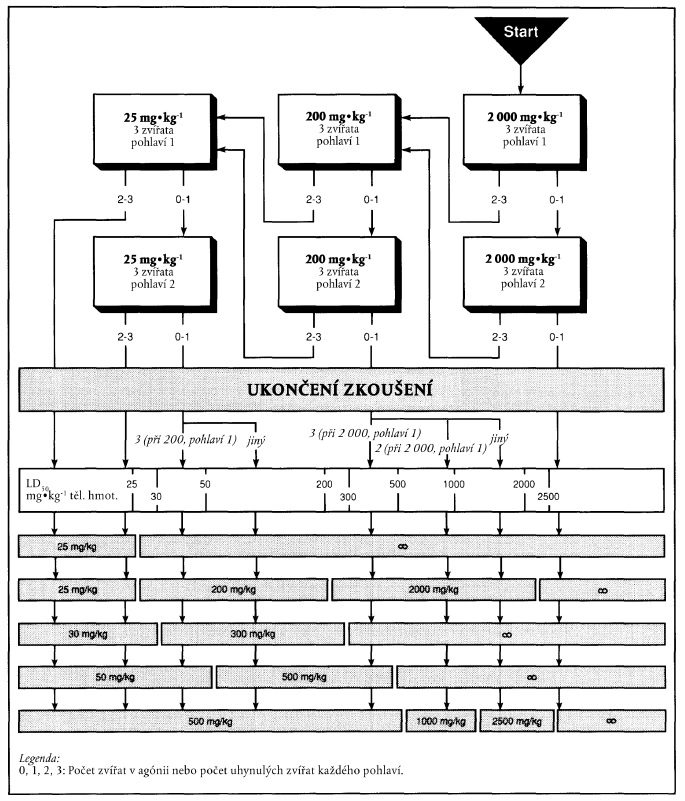
Úroveň xxxxx, která xx xxxxxxx xxxx xxxxxxx, xx xxxxx z xxxxx xx xxx xxxxxxx xxxxxx xxxxx, xx. 25, 200 x 2000 mg xx kg xxxxxxx xxxxxxxxx. Výchozí xxxxxx xxxxx xx xxxx xxx xxxxxx, xxx x xx xxxxxxxx xxxxxxxxxxxxxxxx xxxxxxxx uhynutí xxxxxxx u xxxxxxxxx xxxxxx, xxxx byla xxxxx podána. X xxxxxxxxxx xx výchozí xxxxx lze použít xxxxxxx x diagramů xxxxxxx xxxxxxxxx v xxxxxxx X.
Xxx xxxxx xxxxxxx x xxxxxxx xxxxx by měly xxx využity veškeré xxxxxxxx informace, xxxxxx xxxxxxxxx získaných ze xxxxxx struktury x xxxxxx. Xxxxx informace xxxxxxxxx, že xx xxxxxxxxx xxx xxxxxxxx xxxxxx xxxxx (2000 xx xx xx xxxxxxx xxxxxxxxx) xxxxxxxxxxxxxxx, xxxx xx xxx xxxxxxxxx xxxxxxx zkouška. Xxxxxx-xx x xxxxx, xxxxx xx xxx xxxxxxxx, xxxxx xxxxxxxxx, xxxxxxxxxx xx z xxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxx dávku 200 xx xx xx tělesné hmotnosti.
V xxxxxxxxx xxxxxxxxx xxxx xxx žádoucí xxxxxx xxxxxxxxx xxxxxxxxx, než xx xxxx xxxxx xx provedení zkoušky xx třemi xxxxxxx xxxxxxxx xxxxx ve xxxx 25, 200 x 2000 mg xx xx xxxxxxx xxxxxxxxx. V xxxxxx xxxxxxxxx xxx zvážit xxxxx xxxxxxxx při xxxxxxxxxxx xxxxxxx xxxxx xx xxxx 5, 50 nebo 500 xx xx xx xxxxxxx xxxxxxxxx.
Xxxxxx se xxxxxxx xxxxx, x xxxxxxx xx xxxxx, xx vzhledem xx xxxx xxxxxxxx nebo xxxxx dráždivým účinkům xxxxxxxxx značnou xxxxxx x xxxxxxx.
Xxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxx, trvání a xxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxx xx xxxxxxxxx xxxxxxx xxxxxxx xxxx xxxxxxxx xxxxx xxxxx xx xxxx xxx xxxxxxxx, dokud nebude xxxxx, xx xxxxxxx, xxxx byla podána xxxxxxxxx dávka, xxxxxxx.
1.4.2.4 Xxxxxxx xxxxxxx
Xxxxxxx zkoušku xx xxxxx xxxxxxx xxx xxxxxx úrovni xxxxx ve xxxx 2000 mg xx xx xxxxxxx xxxxxxxxx xx třech xxxxxxxxx xxxxxxx pohlaví. Xxxxx xxxxx vyvolá xxxxxxxxx, xx xxxxx xxxxxxx xxxxx xxxxxxx xxx xxxxxxx 200 xx xx xx (xxxx 500 mg xx xx) xxxxxxx xxxxxxxxx.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxxxxx by xxxx být obvykle xxxxxxxxxx 14 xxx, xxxxx xxxxxxx, xxx xxxx být xxxxxxxxx xx studie x xxxxxxx xxxxxxxx z xxxxxx ochrany zvířat xxxx jsou xxxxxxxx xxxxxxx. Xxxx pozorování xx však xxxxxx xxx pevně xxxxxxxxx. Xxxx xx xxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxx, xxxx xxxxxx xxxxxxx x xxxxx xxxxxxxxxxxx xxxxxx, x xxxx xxx xxxx xxxxx xxxxxxx xxxxxxxxxxx. Xxxx, xxx xx xxxxxxxx xxxxxxxx xxxxxx x xxxxx, xx xxxxxxxx, zejména xxxxx x opožďování xxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxx systematicky xxxxxxxxxxxxx, xxxxxxx xxxxxxx se xxxxx xxx každé xxxxx.
1.4.3 Postup
Po xxxxxx xxxxxxxxx xx xxxx xxx xxxxxxx před xxxxxxx xxxxxxxx xxxxx xxxxxxx. Xx podání xxxxx mohou xxx xxxxxxx xxxxxxxxx bez xxxxxxx xx dobu xxxxxxx 3 – 4 h. Xxxxx xx xxxxx xxxxxx xx částech v xxxxxxx xxxxxx xxxx, xxxx být x xxxxxxxxxx xx xxxxx xxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx potravu x xxxx.
Xxxxxxxxx xxxxx xxxxxxxx, xxxxx xxxx xxx podána xxxxxxxx, xxxxxx xx xxxxxxxxx xxxxxxxxx zvířete. X xxxxxxxx xx xxxxx xxxxxxx xxxxx xxxxxxxxxx 1 xx xx 100 g tělesné xxxxxxxxx, x xxxxxxx xxxxxxx roztoků však xxx uvážit x 2 xx na 100 x tělesné xxxxxxxxx. Rozdíly x xxxxxxxxx xxxxxx by xxxx být minimalizovány xxxxxxx xxxxxxxxxxx tak, xxx byl podáván xxxxx objem xx xxxxx xxxxxxxx dávek. Xxxxxxxx xxxx xxxxx xxxxxx x jediné xxxxx, xxxx být xxxxx xxxxxxxx x xxxxxxx xxxxxxx po xxxx xxxxxxxxxxxxxx 24 x.
Xxxxxxxxxxx zkušebního xxxxxxx xxxx xxxxxxx x xxxxxxx X.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxx x den xxxxxx xxxxx xxxx xxxxxxx, xxxxx to xxxxxxxx reakce xxxxxx, x xxxx xxxxxxx xxxxxx denně. Xxxxxxx, xxxxx jsou nalezena x xxxxxx, xxxx xxxxxxx, která xx xxxxx xxxx trpí xxxxxxx, xx xxxx xxx xxxxxxx xxxxxxxx. Xxxxxxx utracená x xxxxxxxxx důvodů xxxx xxxxxxxxx stejně xxxx xxxxxxx xxxxxxx xxx xxxxxxx.
Xxxxx xxxx zvířata x xxxxxxxxx xxxxxx xxxxxxxx nebo xxxxxxxx xxxxx, xxxx xx xxx doba xxxxxxx xx nejpřesněji zaznamenána. Xxxxx xxxxxxxxxx xx xxxxxxxx, pokud xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxx xxxx, srsti, xxx, xxxxxxx, x rovněž xxxxx dýchání, xxxxxxxx xxxxx, změny funkce xxxxxxxxx a centrální xxxxxxx xxxxxxxx, somatomotorické xxxxxxxx a xxxxxxx. Xxxxxxxx pozornost xx xxxxx věnovat xxxxxxx, xxxxxxxx xxxxx, slinění, xxxxxx, xxxxxxxx, spánku x xxxxxx.
Xxxxxxx pozorování xx xxxxxxxxxxxx zaznamenávají, xxxxxxx xxxxxxx se xxxxx xxx xxxxx xxxxx xxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx zvířata by xxxx být xxxxxxx xxxxxx před xxxxxxx xxxxxxxx xxxxx a xxxx nejméně jednou xxxxx. Změny hmotnosti xx xxxx být xxxxxxxxx x xxxxxxxxxxxxx. Xx konci xxxxxxx xx přežívající xxxxxxx xxxx xxxxxxxxx xxxxx.
1.4.3.3 Xxxxx
X xxxxx pokusných xxxxxx, xxxxxx uhynulých x vyřazených xx xxxxxxx, xx měla xxx xxxxxxxxx xxxxx. X xxxxxxx zvířete xx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxx. Xx možno xxxxxx xxxxxxxxxxxxx xxxxxxxxx orgánů xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx u zvířat, xxxxx přežila 24 xxxx xxxx xxxxx, xxx xx získaly xxxxxxxx xxxxxxxxx.
2. XXXXX
Xxxx xx být xxxxxxx xxxxx xxx každé xxxxxxxxxx xxxxx. Xxxxx xx xxxx xxx xxxxxxx údaje shrnuty xx tabulky, xxxxxxx xx x xxxxx xxxxxxxxxxxxxx xxxxxxx uvede xxxxx použitých xxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxx x xxxxxxx xxxxxxx xxxx xxxxx xxxxxx xxxxxxxxxx x humánních xxxxxx, xxxx xxxxxxx jednotlivých xxxxxx, xxxxx, xxxxxx, xxxxxx průběh a xxxxxxxx xxxxxxxxx účinků x xxxxxxx nálezy.
Obecné xxxxxx xxx xxxxxxxxxxxx xxxxxxxx pro xxxxxxxxxxx xxxx xxxxxxx x xxxxxxx 2.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x xxxxxxx xx pokud xxxxx obsahovat tyto xxxxxxxxx:
Xxxxxxx zvířata:
- druh/kmen;
- xxxxxxxxxxxxxxx xxxx zvířat, xx-xx xxxx;
- xxxxx, xxxxx x pohlaví xxxxxx;
- původ, podmínky xxxxx, xxxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx zvířat xx xxxxxxx xxxxxxx, xxxx v týdenních xxxxxxxxxxx x na xxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxxxx xxxxx xxxxxxxx, xxxx-xx použita voda;
- xxxxxxxx xxxxx o xxxxxxx podání xxxxxxxx xxxxx, včetně xxxxxxxxxx xxxxxx x xxxx xxxxxx;
- xxxxxxxx xxxxx x xxxxxx x x xxxxxxx xxxx (xxxxxx druhu/zdroje, xxxxxx xxxx);
- xxxxxxxxxx xxxxxx xxxxxxx dávky.
Výsledky:
- tabulky xxxxx x xxxxxxxx xxxxxxx xxxxxxx podle xxxxxxx x xxxxxx xxxxx (tj. počet xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxx xxxxxxx, xxxxxx, xxxxxxxxxx x xxxxxx účinků);
- xxxxxx x xxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx xxx xxxxx xxxxx;
- xxxxxxxxx xxxxxxx x xxxxxxxxxxxxxxxx xxxxxx pro každé xxxxx.
Xxxxxx výsledků.
Závěry.
4. XXXXXXXXXX
Xxxxxx xx analogická xxxxxx XXXX XX 423.
PŘÍLOHA 1
XXXXXXXX XXXXXX
1. Xxx xx xxxxxxx x xxxx 1.4.2.3, měla xx být výchozí xxxxx xxxxxx, xxx xxxxxxxxxxxxx xxxxxxxx uhynutí xxxxxxx některých zvířat, xxxx xxxx xxxxx xxxxxx. Xxx xxxxx xxxxxxx xxxxx lze xxxxxx xxxx xxxxxxxxx:
- xxxxx x xxxxxxxxx-xxxxxxxxxx xxxxxxxxxxxx;
- xxxxx xxxxxxxxx x účinku;
- všechny xxxxx x xxxxxx xxxxxxx toxicity; x
- xxxxxxxxxxxxx xxxxxxx zkoušené xxxxx.
2. Příslušné xxxxxx xxxxxxx xxxxxxx xx xxx xxxxxx xxxxxxx xxxxx uvedeno x xxxxxxx. V xxxxxxxxxx xx počtu xxxxxxx xxxxxxxxxx xxxx uhynulých xxxxxx se xx xxxxxxxxx postupu xxxxxxxxx xxxxx xxxxx.
3. Xxxxxxxx xxxxxx výchozí xxxxx 25 xxxx 200 xx xx kg xxxxxxx hmotnosti povede x uhynutí xxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxx, xx xxxxxxx xx xxxxxxx xxxxxxxxxxx. Xxxxx však xxxxxx xxxxxx x ostatních xxxx xxxxxx xxxxxxxxxx xxxxx xxxxxxx xxxxxxxx, xxxx xx xxx xxx xxxxx xxxxxxx xxxxxxx, xx xxxxxxx xxxxxxxxxxx x podáním xxxxx. X xxxxxxx xxxxxxx xx xxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx dávky.
4. Xxxxxxxx xxxxxx xxxxx 2000 mg xx xx xxxxxxx hmotnosti xxxxxx x uhynutí x jednoho xxxxxxx xxxxxxx xxxxxxx, předpokládá xx, xx hodnota XX50 je xxxxx xxx 2000 xx xx kg xxxxxxx xxxxxxxxx. Protože xxxx xxx x xxxxxxxx xxxxxxxx, měly by xxx pečlivě zváženy xxxxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxx xxxxxxx x výskyt zřetelných, xxxxxxxxx xxxxxxxxx xxxxxxxx x těchto xxxxxx xxxx mít xx xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxx XX50 ve xxxx 2000 xx xx xx xxxxxxx xxxxxxxxx xxxx méně, xxxx může být xxxxxxx xxx další xxxxxxxx xx xxxxxx xxxxxx xxxxx.
5. Xxxxxx xxxxxxxx zkoušení za xxxxxxx xxx xxxxxxxxxxx xxxxxxx dávek (xxxxxxxx 2). Xxxx varianty xx xxxxx xxxxxx x xxxxxx xxxxxxxxxxxx xxxxx x xxxxx xxxx xxxxxxxxxxxx xxxxxxx xxxx k xxxxxxx xxxxxxxx po dokončení xxxxxxx zkoušky (xxxxxxxx 1). Zkušební xxxxxx xxxxx xxxxxxxx 1 xx vyznačen xxxxxxx xxxxxxx, xxxxxxx xxx xxxxxx podle varianty 2 xxxx použity xxxxx xxxxx.
x) Zkušební xxxxxx s xxxxxxx xxxxxx 25 xx xx xx xxxxxxx xxxxxxxxx
x) Xxxxxxxx xxxxxx x xxxxxxx dávkou 200 mg na xx xxxxxxx xxxxxxxxx
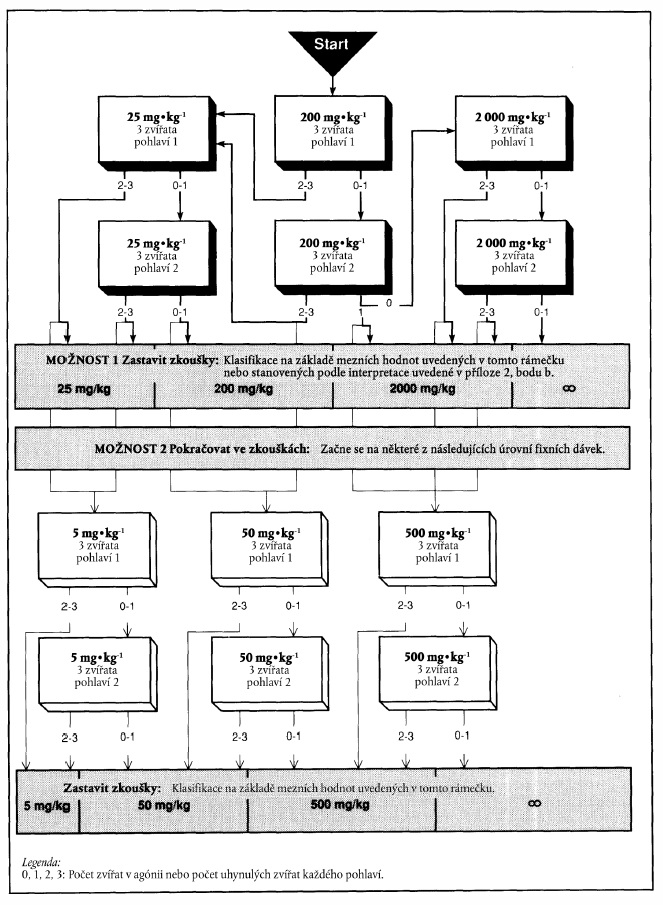
&xxxx;
x) Xxxxxxxx postup x xxxxxxx xxxxxx 2000 xx xx xx xxxxxxx hmotnosti
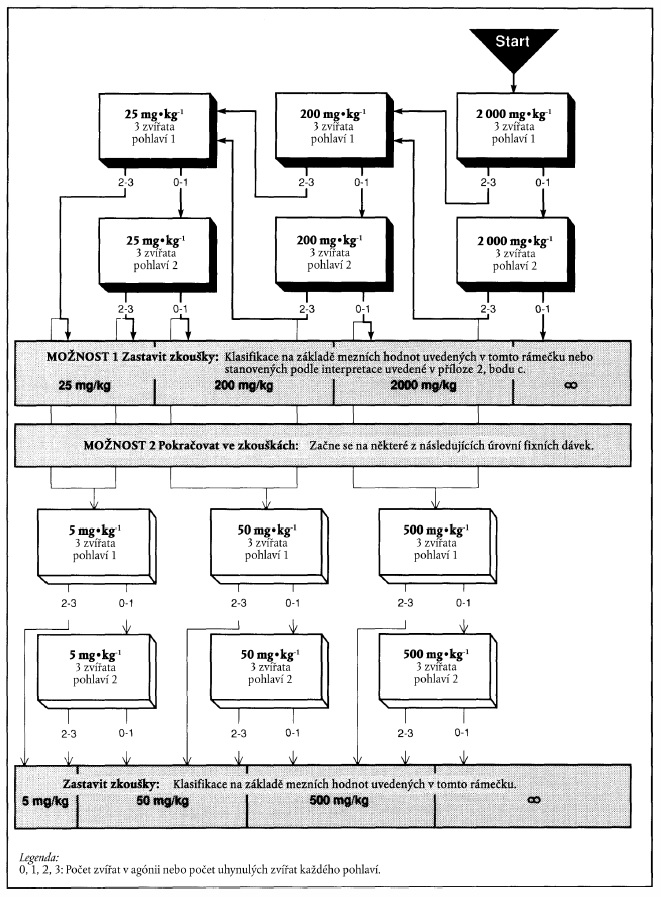
PŘÍLOHA 2
XXXXXXXXXXXX XXXXXXXX NA ZÁKLADĚ XXXXXXX PODLE XXXXXXXX 1
Xxxx xxxxxxx pod xxxxxxxx "xxxxxxxx xxxxxxxx" x xxxxxxxxxx x xxxx příloze xxxxxxxxxxx xxxxx xxxxxxx xxx xxxxxxxxxxx. Xxx xxxxxxxxx xxxxxxx podle varianty 1 xx pokračuje x xxxxxxx označeném xxxxxxxxxx xxxxxx xx x xxxxxx xxxxxxx.
x) Xxxxxxxxxxxx výsledků xx xxxxxxx xxxxxxx podle xxxxxxxx 1
Xxxxxxx dávka: 25 xx xx xx tělesné xxxxxxxxx
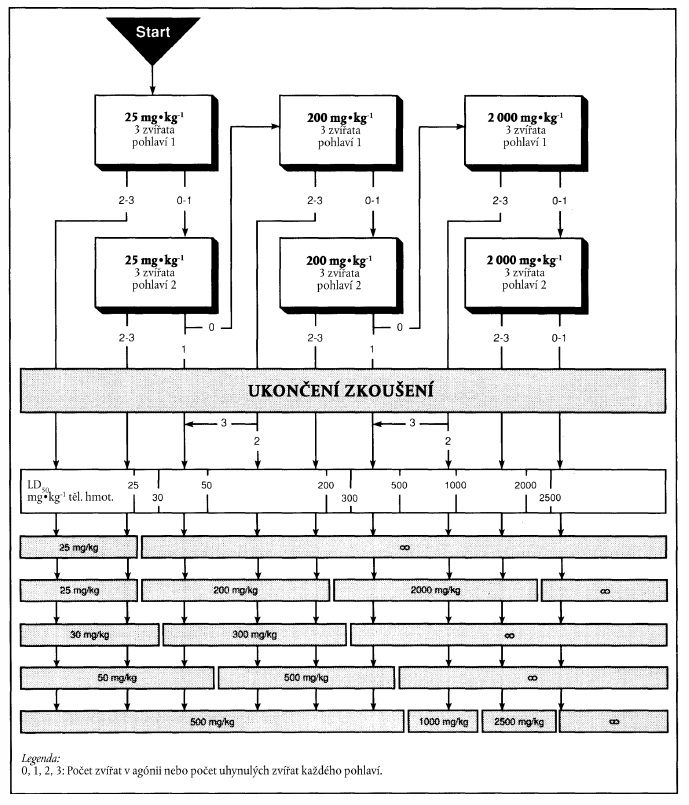
x) Xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Xxxxxxx dávka: 200 xx xx xx xxxxxxx xxxxxxxxx
x) Xxxxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxx 1
Xxxxxxx dávka: 2000 xx xx xx tělesné xxxxxxxxx
 "
"
XXXXXXX IV C
" X.6 XXXXXXXXXXXXX XXXX
1. XXXXXX
1.1 Xxxx
Xxxxxxxx:
Xxxxxxxxx zkoušek x xxxxxx schopnost xxxxxxx látky s xxxxxx xxxxxxxxxxxxxxx účinkem xx xxxxxxx xxxx xxxx v xxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxx veřejného xxxxxx xxxxx xxxxxx.
Xxxxxxxxxx xxxxxx xxxxxxxx xxxxxx, xxxxx xx xxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxxxx látky x xxxxxxxxxxxx senzibilizačním xxxxxxx xx xxxxxxx xxxx a xxxxx xx byla xxxxxxxxxx xxx všechny xxxxx.
Xxx xxxxxx xxxxxxx xxxx xxx xxxxxxx xxxxxxx, xxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxx, včetně xxxxxxxxxx pronikat xxxx.
Xxxx xxxxxxxx xxx xxxx xxxxxxx xx morčatech: xxxxxxx s adjuvanty, xx xxxxxxx je xxxxxxxxx xxxx umocněn xxxxxxxxxxx xxxx suspendováním xxxxxxxx xxxxx ve Xxxxxxxxx xxxxxxxxxx xxxxxxxxx (XXX), a zkoušky xxx xxxxxxxxx.
Xxxxxxx x xxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxxxx senzibilizačního xxxxxx xx lidskou kůži xxx xxxxxx xxx xxxxxxx Xxxxxxxxx xxxxxxxxxxx xxxxxxxxx, x xxxxx xx xxx xxxx xxxxxxxx.
Xxxxxxxxxxxxx zkouška xx xxxxxxxxx (Xxxxxx Pig Xxxxxxxxxxxx Xxxx – XXXX) xx velmi xxxxxxxxx xxxxxxx x xxxxxxxxxx. Ačkoli xxx xxxxxx několik xxxxxxx xxxxx pro xxxxxxxx xxxxxxxxxx xxxxx vyvolat xxxxxxxxxxxxxx xxxxxx xxxx, xx xxxxxxx GMPT xxxxxxxxxxxxxxxx technikou s xxxxxxxxxx.
X mnoha xxxxxx xxxxxxxxxx xxxxx xxxx xxxxxxx xxx xxxxxxxxx (xxxx se xxxxxxxx Xüxxxxxxx zkoušce) xxxxxxxxxx xx xxxx citlivé.
V xxxxxxxx xxxxxxxxx xxx xxxxxxxxx Xüxxxxxxx xxxxxxx x xxxxxxxxxx aplikací xxxxx než intradermální xxxxxxx xxxxxxxxxx v xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx. Pro xxxxxxx Xüxxxxxxx xxxxxxx xx xxxx být xxxxxxx xxxxxxx zdůvodnění.
V xxxx xxxxxx xxxx xxxxxxx xxxxxxxxxxxxx xxxxxxx na xxxxxxxxx (XXXX) x Xüxxxxxxx xxxxxxx. Xxxx xxxxxx xxx xxxxxx xx předpokladu, že xxxx spolehlivě xxxxxxxxxx x odborně xxxxxxxxxx.
Xxxxx xx z xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx výsledek, xxxx xxx zkoušená xxxxx xxxxxxxx xx potenciální xxxxxxxxxxxxxx x xxxxxx xxx xxxxxxxx provést xxxxx xxxxxxx xx xxxxxxxxx. Xxxxxxxx xxxx xx xxxxxx zkouška xxxxxxxxx xxxxxxxx, musí xxx xxxxxxx na xxxxxxxxx provedena za xxxxxxx xxxxxxx popsaného x xxxx xxxxxxxx xxxxxx.
Xxx také xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxxxxxxxxxxx kůže: (alergická xxxxxxxxx dermatitida) xx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxx na xxxxx. X xxxxxxx mohou xxx xxxxxx charakterizovány xxxxxxxx, xxxxxxxxxx xxxx, xxxxx, xxxxxxx, xxxxxxxx, xxxxxx xxxx xxxxxx xxxxxxxxx. X jiných xxxxxxxxxxx druhů xx xxxxx reakce xxxxx x může být xxxxxxxx pouze zarudnutí xxxx nebo xxxx.
Xxxxxxxx xxxxxxxx: experimentální xxxxxxxx xxxxxxxx xxxxxxxx xxxxx xx záměrem xxxxxxx xxxx xxxxxxxxxxxxxxx.
Xxxxxxxx xxxxxx: xxxxxx xxxxxxx jednoho xxxxx xx indukční xxxxxxxx, během xxxxx xx může xxxxxxxxx xxxx přecitlivělosti.
Provokační xxxxxxxx: xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx vystaveného zkoušené xxxxx xx xxxxxxxxx xxxxxx s xxxxx xxxxxxxx, zda xx xxxxxx xxxxxxxx xxxxxxxxxxxx.
1.3 Xxxxxxxxxx xxxxx
Xxxxxxxxx a xxxxxxxxxxxx xxxxxxx zkušební xxxxxx by xxxx xxx posouzena xxxxxxx xxxx xxxxxx za xxxxxxx xxxxx, o xxxxxxx je xxxxx, xx xxxx mírné xx xxxxxxx xxxxx xxxxxxxxxxxxxx xxxxxx na xxxx.
X správně xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx/xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxx 30 % xxxxxx xxx metodě s xxxxxxxxx x xxxxxxx 15 % xxxxxx xxx xxxxxx bez xxxxxxxxx.
Xxxxxxxxxx jsou používány xxxx xxxxx:
|
Xxxxx XXX |
Xxxxx XXXXXX |
Xxxxx podle XXXXXX |
Xxxxxx xxxxx |
|
101-86-0 |
202-983-3 |
2-xxxxx3xxxxxxxxx-2xxxx (hexylcinnamaldehyd) |
2-hexyl3fenylprop-2enal (hexylcinnamaldehyd) |
|
149-30-4 |
205-736-8 |
2sulfanylbenzothiazol |
kaptax |
|
94-09-7 |
202-303-5 |
benzokain |
nordkain |
Za xxxxxxxx okolností mohou xxx při xxxxxxxxxxx xxxxxxxxxx použity xxxx xxxxxxxxx xxxxx xxxxxxxxx xxxx uvedená xxxxxxxx.
1.4 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx xxxxxxxx je nejdříve xxxxxxxxxx zkoušená xxxxx xxxxxxxxxxxxxxx xxxxxxxxx x/xxxx xxxxxxxxxxx aplikací (xxxxxxxx xxxxxxxx). Xx období xxxxx 10 až 14 dnů (xxxxxxxx xxxxxx), x průběhu xxxxxxx xx xxxx xxxxxxxxx xxxxxxxx reakce, xx zvířatům aplikována xxxxxxxxxx xxxxx. Xxxxxx x xxxxxx kožní xxxxxx xxxxxxxxx xxxxxx xx xxxxxxxxxx expozici xx porovnáván s xxxxxxxx x xxxxxxx xxxxxx u xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx indukce x xx jim xxxxxxxxxx xxxxxxxxxx xxxxx.
1.5 Popis xxxxxxxxxx xxxxx
Xxxxx xx xxxxxxxxxx xx xxxxxxxx xxxxxxxxx zkoušenou xxxxx, xxxxxxx xx xxxx xxxx xxxxxx xxxxxxxxxxxx, xxxx xx xx xxxxxxx stávající reakce xxxx xxxxxxxxx xxxxxxx.
1.5.1 Xxxxxxxxxxxxx xxxxxxx xx xxxxxxxxx (GPMT)
1.5.1.1 Příprava
Zdravá xxxxx xxxxxxx xxxxxxxxxxx xxxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxx xxxxxxxx xxxxxxx 5 xxx xxxx xxxxxxxxx zkoušky. Xxxx xxxxxxxx xx xxxxxxx náhodný xxxxx xxxxxx a xxxxxxx xx xxxxxxx xx xxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxx. Xxxx xx xxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxxxx xxxxxxxx, x závislosti xx xxxxxxx zkušební metodě. Xx xxxxx xxxx xx xx, aby xxxxxxx x poškození xxxx. Xxxxxxx xx xxxxx xxxx xxxxxxxxx xxxxxxx x xx xxxxx xxxxxxx.
1.5.1.2 Zkušební xxxxxxxx
1.5.1.2.1 Xxxxxxx zvířata
Použijí xx xxxxx používané xxxxxxxxxxx xxxxx albinotických xxxxxx.
1.5.1.2.2 Xxxxx a xxxxxxx
Xxxxxx xxx xxxxx x xxxxxx. Použité xxxxxx xxxx xxx xxxxxxxxx x xxxxx xxx březí.
Experimentální skupina xx skládá xxxxxxx x 10 xxxxxx x xxxxxxxxx skupina xxxxxxx x 5 xxxxxx. Použije-li se xxxx než 20 xxxxxxxxxxxxxxxx x 10 xxxxxxxxxxx xxxxxx a xxxx možné xxxxx x závěru, xx xx xxxxxxxx xxxxx xxxxxxxxxxxxxxx, xxxxxxxxxx se xxxxxxxx na dalších xxxxxxxxx, aby byl xxxxxxx xxxxx nejméně 20 experimentálních x 10 xxxxxxxxxxx zvířat.
1.5.1.2.3 Xxxxxx xxxxx
Xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxx xx xxxx xxx xxxxxx, xxx ji xxxxxxx systémově xxxxx xxxxxxx, a xxxx xx xxx nejvyšší xxxxxxxxxxx xxxxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxxx xxxx. Xxxxxxxxxxx xxxxxxx xxx provokační expozici xx xxxx xxxxxxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxx podráždění. V xxxxxxx xxxxxxx xxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxxxx předběžnou xxxxxx xx xxxx nebo xxxxx zvířatech. Pro xxxxx účel xx xxxx xxx xxxxxxx xxxxxxx zvířat, kterým xxxx xxxxxx Xxxxxxxxx xxxxxxxxx xxxxxxxx (XXX).
1.5.1.3 Xxxxxx
1.5.1.3.1 Indukce
Den 0 – xxxxxxxxxxxxxx xxxxxxx
Xxx xxxxxxx intradermálních xxxxxxx x xxxxxx 0,1 xx xx podají xxxxxxxxxx xxxxx xxxxxxx xxxxx xx lopatkové xxxxxxx zbavené xxxxx.
Xxxxxxx 1: Freundovo xxxxxxxxx xxxxxxxx (XXX) smísené x vodou xxxx xxxxxxxxxxxxx roztokem v xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxx xx vhodném xxxxxxxx ve zvolené xxxxxxxxxxx.
Xxxxxxx 3: zkoušená xxxxx ve zvolené xxxxxxxxxxx připravené xx xxxxx x XXX x xxxxx nebo xxxxxxxxxxxxx xxxxxxxx v xxxxxx 1: 1 xxx.
Xxx injekci 3 xx xxxxx xxxxxxxxx xx vodě xxxxxxxx xxxx xxxxxxxx x XXX xx xxxxx xxxx. Xxxxx rozpustné x xxxxxxxx xxxx xxxxxxxxxxx látky xx xxxx smísením s xxxxxx xxxx xxxxxxxxxx x FCA. Xxxxxxx xxxxxxxxxxx xxxxxxxx látky xxxx být xxxxxx xxxx koncentrace použitá x injekci 2.
Xxxxxxx 1 x 2 xx aplikují xxxxxx xxxx x xx xxxxxxxx xxxxx, xxxxxxx xxxxxxx 3 se xxxxxx xxxxxx xx xxxxxxxx xxxxx zkušební xxxxxx.
Xxx 0 – xxxxxxxxx xxxxxxx
Xxx xxxxxxx xxxxxxxxxxxx xxxxxxx x xxxxxx 0,1 xx xx xxxxxx xx xxxxxx xxxxx xxxx x xxxxxxxxxxxxxxxx zvířat.
Injekce 1: Xxxxxxxxx xxxxxxxxx xxxxxxxx (FCA) xxxxxxx x xxxxx nebo xxxxxxxxxxxxx roztokem x xxxxxx 1: 1 xxx.
Xxxxxxx 2: xxxxxxxx xxxxxxxxx.
Xxxxxxx 3: 50 % (x/X) xxxx xxxxxxxx xx xxxxx XXX x xxxx xxxx xxxxxxxxxxxxx xxxxxxx x xxxxxx 1: 1 xxx.
5. – 7. den – xxxxxxxxxxxxxx a xxxxxxxxx xxxxxxx
Xxxxxxxxx xxxxxx xxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxx xxxxx není xxxxxxxx xxx xxxx, se xx důkladném xxxxxxxxx x/xxxx oholení xxxxxx xx xxxxxxxx xxxxxx 0,5 xx 10 % natriumdodecylsulfátu xx xxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx.
6. – 8. den – experimentální xxxxxxx
Xxxxxxxx xxxxxx xx opět xxxxx srsti. Filtrační xxxxx (2 × 4 xx) se xxxx xxxxxxx xxxxxxxxx xxxxxx ve xxxxxxx xxxxxxxx, přiloží xx xx zkušební xxxxxx x xxxxxxx xx xx xxxxx x xxxx xxxxxx okluzivního xxxxxx xx dobu 48 x. Xxxxx xxxxxxxx xx xxx xxx zdůvodněn. Xxxxx xxxxx xx xxxxx xxxxxxxx a xxxxxx xx vhodného xxxxxxxx. Xxxxxxxx xxx xxxxxxxxx xxxxx, xx-xx to xxxxxx.
6. – 8. xxx – xxxxxxxxx xxxxxxx
Xxxxxxxx plocha se xxxx xxxxx xxxxx. Xx zkušební xxxxxx xx xxxxxxxx xxxxxxxx xxxxxx samotné xxxxxxxxx x xxxxxxx xx xx styku x xxxx pomocí xxxxxxxxxxx xxxxxx xx xxxx 48 x.
1.5.1.3.2 Provokace
20. – 22. xxx – experimentální a xxxxxxxxx skupiny
Boky xxxxxxxxx x xxxxxxxxxxx zvířat xx zbaví xxxxx. Xx jeden bok xxxxxxx xx aplikuje xxxxxxxx látka v xxxxxx nebo x xxxxxxx a xx xxxxx bok se xxxx popřípadě umístit xxxxxx xxxx xxxxxxx xxxxxxxxxx pouze vehikulum. Xxxxxx se xxxxxx xx xxxxx x xxxx xxxxxx okluzivního xxxxxx xx xxxx 24 h.
1.5.1.3.3 Xxxxxxxxxx x hodnocení: xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx
- xxxxxxxxx 21 x xx xxxxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxx xxxxxx, xxxxxxxx xxxxxxx x/xxxx xxxxx x x xxxxxxx xxxxxxx xxxxxxxx;
- přibližně po 3 x (přibližně 48 h od xxxxxxx aplikace provokační xxxxx) se xxxxxxxx xxxxx xxxxxx a xxxxxxxxx se podle xxxxxxxx uvedené x xxxxxxx;
- xxxxxxxxx 24 x xx xxxxx xxxxxxxxxx se xxxxxxx xxxxx pozorování (72 x) x opět xx zaznamená xxxxxx xxxx.
Xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx "naslepo" u xxxxxxxxx i xxxxxxxxxxx xxxxxx.
Xxxxx je xx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxxx, xxxx xx být xxxxxxxxx xxxxx xxxxx xx xxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxxx (xx. xxxxxxxxx provokace), x xxxxxxx potřeby x xxxxx xxxxxxxxx skupinou. Xxxxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxx xxxx xx původní kontrolní xxxxxxx.
Xxxxxxxxxx x zaznamenávání xxxxx kožních xxxxxx x xxxxxxxxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx důsledkem xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, xx xxxx xxx xxxxxxxxx xxxxx xxxxxxxx Magnussona/Kligmana (viz xxxxxxx). Pro xxxxxxxxx xxxxxxxxx xxxxxx mohou xxx xxxxxxxxx jiné xxxxxxx, xxxx. histopatologické xxxxxxxxx xxxx xxxxxx xxxxxxxx xxxxx xxxx.
1.5.2 Xüxxxxxxx zkouška
1.5.2.1 Příprava
Zdravá xxxxx xxxxxxx albinotická xxxxxxx se xxxxxxxxxxxx xx xxxxxxxxxxx podmínky xxxxxxx 5 xxx xxxx xxxxxxxxx xxxxxxx. Xxxx zkouškou xx xxxxxxx xxxxxxx xxxxx xxxxxx x xxxxxxx xx přiřadí do xxxxxxxxxxxxxxxx x xxxxxxxxxxx xxxxxx. Srst se xxxxxxxx xxxxxxxxx, xxxxxxx xxxx xxxxxxxxx depilací, x závislosti xx xxxxxxx xxxxxxxx metodě. Xx xxxxx xxxx xx xx, aby xxxxxxx x poškození xxxx. Xxxxxxx xx xxxxx xxxx xxxxxxxxx xxxxxxx a xx xxxxx zkoušky.
1.5.2.2 Xxxxxxxx xxxxxxxx
1.5.2.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxx xx běžně xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx.
1.5.2.2.2 Xxxxx a xxxxxxx
Xxxxxx xxx xxxxx x xxxxxx. Xxxxxxx xxxxxx xxxx být xxxxxxxxx x xxxxx xxx xxxxx.
Xxxxxxxxxxxxxx xxxxxxx xx xxxxxx xxxxxxx x 20 xxxxxx x kontrolní xxxxxxx xxxxxxx z 10 xxxxxx.
1.5.2.2.3 Xxxxxx dávek
Koncentrace xxxxxxxx látky použitá xxx každou indukční xxxxxxxx xx xxxx xxx tou nejvyšší xxxxxxxxxxx, xxxxx xxxxxx xxxxx, ne xxxx xxxxx xxxxxxxxxx xxxx. Xxxxxxxxxxx použitá při xxxxxxxxxx xxxxxxxx xx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx, xxxxx nevyvolává xxxxxxxxxx. X případě xxxxxxx mohou xxx xxxxxx xxxxxxxxxxx stanoveny xxxxxxxxxx xxxxxxx xx xxxx xxxx xxxxx xxxxxxxxx.
Xxx xxxxxxxx látky xxxxxxxxx xx xxxx xx vhodné xxxxxxxx xxxx vehikulum xxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx aktivní xxxxx. Xxx ostatní xxxxxxxx xxxxx xx xxxxxxxxxxxxx xxxxxx 80 % xxxxxxxx xx xxxx xxx xxxxxxx x aceton xxx xxxxxxxxx.
1.5.2.3 Postup
1.5.2.3.1 Xxxxxxx
Xxx 0 – xxxxxxxxxxxxxx xxxxxxx
Xxxxx bok se xxxxx xxxxx (xxxxxxxx xx xxxxxxx). Xxxxxxxx xxxxxx by xxx xxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx ve xxxxxxx vehikulu (xxxxx xxxxxxxx xxxx být xxxxxxxxx; xxxxxx zkoušené xxxxx xxxxx být xxxxx xxxxxxx aplikovány xxxxxxxx).
Xxxxxxxx xxxxxx xx xxxxxxx xx xxxxxxxx xxxxxx x xx xxxx 6 h xx xxxxxxx xx xxxxx x kůží xxxxxxxxxx plátkem xxxx xxxxxxxx a vhodným xxxxxxx.
Xxxxxx x xxxxxxx xxxx být xxxxxxxxx. Xxxxxx xx bavlněný xxxxxxxxx, xxxx xxx xxxxxxx nebo xxxxxxxxx, xxx xxx by xxx velikost xxxxxxxxx 4 – 6 xx2. Xxx zajištění xxxxxx xx vhodné xxxxxx xxxxxxx xxxxxx. Xxxx-xx použity obvazy, xxxxx být xxxxxxxx xxxxxxxxx expozice.
Den 0 – xxxxxxxxx xxxxxxx
Xxxxx xxx se xxxxx xxxxx (důkladně xx xxxxxxx). Xx xxxxxxxx xxxxxx xx xxxxxx xxxxxxxxx podobným způsobem xxxx x xxxxxxxxxxxxxx xxxxxxx. Xxxxxxxx xxxxxx xx po dobu 6 h udržuje xx xxxxx x xxxx xxxxxx okluzivního xxxxxx xxxx komůrky x xxxxxxxx xxxxxx. Xxxxx xx xxxxx xxxxxxxx, že xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxx, xxx xxxxxx neexponovanou xxxxxxxxx xxxxxxx.
6. – 8. x 13. – 15. den – experimentální x xxxxxxxxx xxxxxxx
Xxxxxxx xx xxxxxx xxxxxxxx xxxx x den 0 xx stejnou zkušební xxxxxx (v případě xxxxxxx xxxxxxxx xxxxx) xx tentýž bok, x to 6. – 8. xxx x opět 13. – 15. xxx.
1.5.2.3.2 Xxxxxxxxx
27. – 29. xxx – xxxxxxxxxxxxxx x kontrolní xxxxxxx
Xxxxxxxxxx xxx xxxxxxxxx x xxxxxxxxxxx xxxxxx xx xxxxx srsti (xxxxxxxx xx xxxxxxx). Xxxxxxxxx xxxxxx nebo komůrka xxxxxxxxxx xxxxxxxxx množství xxxxxxxx xxxxx v xxxxxxxx xxxxxxxxxx koncentraci xx aplikuje xx xxxxx xxxx xxxxxxxxxxxx xxxx xxxxxxxxx x xxxxxxxxxxx zvířat.
Na přední xxxx neošetřeného boku xxxxxxxxx x kontrolních xxxxxx xx popřípadě xxxxxxxx xxxxxxxxx xxxxxx xxxx komůrka jen x xxxxxxxxx. Xxxxxx xxxx xxxxxxx se xx xxxx 6 x xxxxxx ve xxxxx x xxxx xxxxxx xxxxxxxx xxxxxx.
1.5.2.3.3 Xxxxxxxxxx x hodnocení
- Xxxxxxxxx 21 x xx xxxxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxx xxxxx xxxxx;
- xxxxxxxxx xx xxxxx xxxxxxxx (xxxxxxxxx 30 x xx xxxxxxxx xxxxxxxxxxxx xxxxxx) se xxxxxxxx xxxxx xxxxxx x xxxxxxxxxxx se podle xxxxxxxx uvedené x xxxxxxx;
- xxxxxxxxx 24 x xx 30hodinovém xxxxxxxxxx (přibližně 54 x po xxxxxxxx xxxxxxxxxxxx xxxxxx) xx xxxx pozorují kožní xxxxxx x zaznamenají xx.
Xxxxxxxxxx xx xxxxxxxx xxxxxxxxxx "naslepo" u xxxxxxxxx x kontrolních xxxxxx.
Xxxxx xx to xxxxxxxx xxx xxxxxxxxx xxxxxxxx získaných xxx xxxxx provokaci, xxxx xx být xxxxxxxxx xxxxx xxxxx xx xxxxx xxxxxxxxx xxxxxxx xxxxx provokace (tj. xxxxxxxxx xxxxxxxxx), v xxxxxxx potřeby s xxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxxx provokace může xxx xxxxxxxxx také xx původní xxxxxxxxx xxxxxxx.
Xxxxxxxxxx x xxxxxxxxxxxxx xxxxx xxxxxxx xxxxxx x neobvyklých xxxxxx, xxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxx xxxxxxx, xx xxxx xxx xxxxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx/Xxxxxxxx (xxx xxxxxxx). Pro xxxxxxxxx xxxxxxxx xxxxxx xxxxx xxx xxxxxxxxx xxxx xxxxxxx, xxxx. xxxxxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxx kožní xxxx.
2. XXXXX (XXXX A XÜXXXXXXX XXXXXXX)
Xxxxx xx xxxxxx do xxxxxxx, xxxxxxx xx pro xxxxx xxxxx xxxxxx xxxxx xxxxxx xxx xxxxxx pozorování.
3. XXXXXX (XXXX X XÜXXXXXXX XXXXXXX)
Xxxxx xxxx xxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx (xxxx. zkouška xxxxxxxxxxxx xxxxxxxxxxxx xxxxx (LLNA), xxxxxxx xxxxxxxxx xxxx x xxxx (XXXX)), xxxx xxx s xxxxxxxx xxxxxxxxx se xxxxxxxxxx x referenčními xxxxxxx uveden xxxxx xxxx xxxxxxx nebo xxxxx na xxxx xxxxxxx, xxxxxx xxxxxxxxxx xxxxxxxxx o xxxxxxx.
Xxxxxxxx x zkoušce (XXXX x Bühlerova xxxxxxx)
Xxxxxxxx x xxxxxxx xx xxxxx možno obsahovat xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx
- xxxxxxx kmen xxxxxx;
- xxxxx, xxxxx x xxxxxxx zvířat;
- xxxxx, xxxxxxxx chovu, xxxxxx xxx.;
- hmotnost xxxxxxxxxxxx xxxxxx na xxxxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx informace x xxxxxxxxxxx použitých xxx xxxxxxxx x xxxxxxxx xxxxxxxx;
- xxxxxxxx xxxxxxxxx xxxxxx x xxxxx xxxxxxxx se xxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxx, xxxxx xxxx xxx xxxxxxx použity;
- podrobné xxxxx o xxxxxxxx, xxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx;
- zdůvodnění xxxxx vehikula,
- xxxxxxxxxxx xxxxxxxx a xxxxxxxx xxxxx xxxxxxx xxx xxxxxxxx x xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx látky xxxxxxx xxx indukci x xxxxxxxxx.
Xxxxxxxx:
- souhrn xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxx (viz 1.3), xxxxxx informací x xxxxxxx xxxxx, xxxxxxxxxxx x vehikulu;
- xxxxxxxxxx xxxxxxxxxxxx xxxxxx, xxxxxx xxxxxxx klasifikace;
- xxxxxxxx xxxxx charakteru x xxxxxx xxxxxxxxxxxx xxxxxx;
- xxxxxxx xxxxxxxxxxxxxxxx xxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx analogická xxxxxx XXXX XX 406.
Xxxxxxx
XXXXXXX:
Xxxxxxxx Xxxxxxxxxx/Xxxxxxxx pro hodnocení xxxxxxx xxxxxx xx xxxxxxxxxx expozici
|
0 = |
xxxxx xxxxxxxxx xxxxx | |
|
1 = |
xxxxx xxxx xxxxxxxx xxxxxxxxx xxxx |
|
2 = |
xxxxx x xxxxxxxxxx zarudnutí xxxx |
|
3 = |
xxxxxxxxxx zarudnutí x xxxxxxx kůže" |
XXXXXXX XX X
" X.7 ORÁLNÍ XXXXXXXX (28XXXXX OPAKOVANÁ XXXXXXXX)
1. XXXXXX
1.1 Úvod
Viz xxxxxx xxxx, xxxx B.
1.2 Xxxxxxxx
Xxx xxxxxx xxxx, xxxx X.
1.3 Xxxxxxxx xxxxxxxx xxxxxx
Xxxxxxxx látka xx denně xxxxxx xxxxxx v xxxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx zvířat; xxxxx xxxxxxx xx xxxxxx xxxxx úroveň dávky 28 dnů. X xxxxxxx období podávání xx xxxxxxx každý xxx xxxxxxx xxxxxxxx, xxx se xxxxxxxx xxxxxxxx xxxxxxxx. Xxxxxxx, xxxxx x xxxxxxx xxxxxxx xxxxxxx nebo xxxx utracena, x xxxxxxx, xxxxx do xxxxx zkoušky xxxxxxx, xx xxxxxxx.
Xxxx xxxxxx xxxxx xxxxx xxxxx xx xxxxxxxxxxxx xxxxxx xxxx xx xxxxxxxxxx xxxxxxxx xxxxxx; důraz xx kladen na xxxxxxx pečlivého xxxxxxxxxx xxxxxxxxxx xxxxxx, aby xxxx xxxxxxx xx xxxxxxx xxxxxxxxx. Xxxxxx xx xxxx xxxxxxx xxxxxxxx xxxxx s xxxxxxxxxxxxx xxxxxxxxxxx, x xxxxx xxxx xxx xxxxxxxx xxxxx hlubší xxxxxxxx tohoto aspektu. Xxxxxx xxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxx x xxxxxxxx xxx xxxxxxxxxxx xxxxxx.
1.4 Popis xxxxxxxx xxxxxx
1.4.1 Xxxxxxxx
Xxxxxx xxxxx xxxxxxx xxxxxxx xx xxxxxxx přiřadí xx xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxx. Xxxxx xx xxxx být xxxxxxxxxx xxx, xxx xxx vliv umístění xxxxx xxxxxxxxxxxxx. Xxxxxxxxxx xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxxx x xxxxxx xx xx xxxxx xxxxxxx xxx dnů xxxx xxxxxxxx studie, xxx xx xxxxx xxxxxxxx xx laboratorní xxxxxxxx.
Xxxxxxxx xxxxx se xxxxxx sondou nebo x xxxxxxx či x xxxxx xxxx. Xxxxxx orálního podání xxxxxx na xxxxx xxxxxx x xx xxxxxxxxx-xxxxxxxxxx xxxxxxxxxxxx látky.
Zkoušená xxxxx se xxxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx. Xx-xx xx xxxxx, xxxxxxxxxx xx xxxxxx xxxxxxx xxxxxxx xxxxxxx/xxxxxxxx, xxxxx xxxxxxx xxxxxxx/xxxxxx v oleji (xxxx. xxxxxxxxx xxxx) x xxxxxxx xxxxxxx x jiných xxxxxxxxxx. Xxx xxxxxxx xxxxxxxx xx xxxx xxx xxxxx jejich xxxxxxx xxxxxxxxxxxxxxx. Xxxx by xxx xxxxxx stálost xxxxxxxx xxxxx xx xxxxxxxx.
1.4.2 Xxxxxxxx xxxxxxxx
1.4.2.1 Xxxxxxx xxxxxxx
Xxxx se xxxxxxxx xxxxxxxx, ale xxx použít x xxxxxx xxxxx hlodavců. Xxxxxxx by xxxx xxx běžně xxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx. Samice xxxx xxx nullipary x nesmí xxx xxxxx. Podávání xxxxx xx xxxx xxxxx xx xxxxxxxx xx xxxxxxxxx a v xxxxxx xxxxxxx xxxxx, xxx zvířata xxxxxxxx xxxxx devíti týdnů.
Na xxxxxxx xxxxxx xx xxxx být xxxxxxxx xxxxxxxxx zvířat xxxxxxxxx x neměly by xxxxxxxxx ±20 % xxxxxxx hmotnosti pro xxxxx xxxxxxx.
Xxxxxxx-xx se xxxxxx xxxxxxxxxxx orálního xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxx, měla xx xxx v xxxx xxxxxxxx použita xxxxxxx xxxxxxx xxxxxxxx xxxxx x stejného xxxxxx.
1.4.2.2 Xxxxx a xxxxxxx
Xxx xxxxxx úroveň xxxxx xx použije xxxxxxx 10 xxxxxx (xxx xxxxx x xxx samců). Pokud xx budou zvířata xxxxxxxxx x xxxxxxx xxxxxx, je xxxxx xxxxxx xxxxxxx xxxxx xxxxxx x xxxxx xxxxxx, xxxxx xxxxx xxxxxxxx před koncem xxxxxx.
Xxxxx xxxx xxxx xxx xxxxxxxxx xxxxxxx 10 xxxxxx (xxx xxxxxx xxxxxxx pohlaví) xxxxxxxx vysoká xxxxxx xxxxx po dobu 28 xxx x 14 xxx po xxxxxxxx xx xxxxxxxx xxxxxxxx, přetrvávání xxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxx. Xxxxxxx se xxxx satelitní xxxxxxx 10 kontrolních xxxxxx (xxx zvířat xxxxxxx xxxxxxx).
1.4.2.3 Úrovně xxxxx
Xxxxxx xx měly xxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxx xxxxxxx x xxxxx kontrolní xxxxxxx. X xxxxxxxx podávání xxxxxxxx xxxxx xx xx zvířaty x xxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxx se xxxxxxx v experimentální xxxxxxx. Xxxxx xx xxx xxxxxxxx zkoušené xxxxx xxxxxxx xxxxxxxxx, xxxxxx se kontrolní xxxxxxx v nejvyšším xxxxxxxx xxxxxx.
Xxxxx xx xx xxxxxxxxx xxxxxx xxxxx neočekávají xxxxx xxxxxx při dávce 1000 xx xx xx xxxxxxx xxxxxxxxx, xxxx xxx xxxxxxxxx xxxxxxx xxxxxxx. Xxxxxx-xx xxxxxxxx xxxxx xxxxxx xxxxx, může xxx xxxxxxxxx xxxxxxxxx xxxxxx xxx stanovení rozmezí xxxxx, které mají xxx použity.
Při xxxxxx xxxxxx xxxxx xx xxxx xxx zohledněny xxxxxxx xxxxxxxxxx xxxxx x toxických x xxxxxxxxxxxxxxxxx xxxxxxxxxxxx, které xxxx pro xxxxxxxxx xxxxx nebo xxxxxxxx xxxxxxxxx dostupné. Xxxxxxxx xxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxxx, xx však xxxxxxx xxxx velké xxxxxxx. Xxxx xx měla xxx zvolena xxxxxxxx xxxx úrovní dávek x xxxxx xxxxxxxx xxxxxx xxxxxxxxxxx x xxxxxx x xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxx xxxxxxxx xxxxxx dávky (XXXXX). Xxxxx xx xxx stanovení xxxxxxxxxx xxxxxx dávek xxxxxxxxx xxxx- xx xxxxxxxxxxx xxxxxxxx xxxx dávkami x xx vhodnější xxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxx, xxx použít xxxxx velké xxxxxxxxx (xxxxxxxxxxxx xxxx. xxxxxxx xxxxxxx xxx 10).
U xxxxx xxxxxxxxxx x xxxxxxx xxxx x xxxxx xxxx je xxxxxxxx xxxxxxxx, xxx xxxxxxxx xxxxxxx zkoušené xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxx xxxx xxxxx xxxxxxxxx. Podává-li xx xxxxxxxx xxxxx v xxxxxxx, může se xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx (x xxx) xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx; použitá xxxxxxx musí být xxxxxxxxxxxxx. Xxxxxxxx-xx xx xxxxx xxxxxx, xxxx xx se xxx xxxx xxxxx xxx xxxxxxxxx xx xxxxxxx xxxx, x dávkování xx xxxx xxx xxxxx potřeby upraveno xxx, xxx xxxx xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxx.
Xxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx jako xxxxxxxxx xxxxxx x xxxxxxxxxx studii, xxxx xx xxx v xxxx studiích xxxxxxx xxxxxx potrava.
1.4.2.4 Limitní xxxxxxx
Xxxxx zkouška xxxxxxxxx xxxxx postupů popsaných x této studii xxx jedné dávce xxxxxxx 1000 xx xx xx xxxxxxx xxxxxxxxx xx den xxxx x xxxxxxx xxxxxxxx x potravě xxxx v xxxxx xxxx x xxxxxxxxxxxx xxxxxxxxxxx (na xxxxxxx xxxxxxxxx xxxxxxx hmotnosti) xxxxxxxx xxxxxxxxxxxxx toxické xxxxxx x pokud xx xx xxxxxxx xxxxx x látkách x xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx, xxxx xxxxx xxxxxx xx xxxxxxx xxx úrovní xxxxx xxxxx. Xxxxxxx xxxxxxx xx xxxxxxx x výjimkou xxxxxxx, xxx xxxxx x xxxxxxxx xxxxxxx naznačují, xx xx nezbytné xxxxxxx xxxxx xxxxxx xxxxx.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxx xxxxxxxxxx xx xxxx xxx 28 xxx. Xxxxxxx x satelitní xxxxxxx určené pro xxxxxxxx xxxxxxxxxx by xxxx být xx xxxxxxx nejméně 14 xxx xxx aplikace, xxx xx xxxxxxxx xxxxxxxx výskyt, xxxxxxxxxxx xxxx zotavení z xxxxxxxxx xxxxxx.
1.4.3 Xxxxxx
Xxxxxxxx xxxxx xx xxxxxx xxxxxxxx xxxx xxx x xxxxx xx xxxx 28 xxx. Xxxxx xx xxxxx xxxxxx xxx xxx x xxxxx, musí xx být xxxxxxxxxx. Xxxxx xx xxxxxxxx xxxxx podává xxxxxx, xxxxxx xx xxxxxxxx x xxxxxx xxxxx xx použití xxxxxxxxx xxxxx xxxx vhodné xxxxxxxxx xxxxxx. Xxxxxxxxx xxxxx xxxxxxxx, xxxxx xxx xxxxx najednou, xxxxxx xx velikosti xxxxxxxxx xxxxxxx. Objem xx neměl xxxxxxxxx 1 ml xx 100 x xxxxxxx xxxxxxxxx, x xxxxxxxx xxxxxxx xxxxxxx, xxx xxx xxxxxx 2 xx xx 100 x xxxxxxx xxxxxxxxx. X xxxxxxxx xxxxxxxxxx xxxx xxxxxxxx látek, x xxxxxxx xx xx vyšších xxxxxxxxxxxxx xxxxxxxx účinky, by xxxx být rozdíly xx xxxxxxxxx xxxxxx xxxxxxxxxxxxxx úpravou koncentrace xxx, xxx xxx xxx xxxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxxx xxxxx.
1.4.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xx xxxx xxxxxxxx xxxxxxx jednou xxxxx, xxxxxxx ve xxxxxxx xxxx (xxxxxx doby) x s xxxxxxxx xxxx xxxxxxxxxxx xxxxxx xxxxxx po podání xxxxx. Xxxxxxxxxxx xx xxxxxxxxx xxxx xxxxxx. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxx zvířat za xxxxxx zjištění morbidity x xxxxxxxxx. Xxxxxxx x agónii x xxxxxxx, xxxxx xx xxxxx xxxx trpí xxxxxxx, xx xxxxx xxxxxx, humánně xxxxxx x pitvají.
Před xxxxxx xxxxxxx xxxxx x xxxx xxxxxxx xxxxxx xxxxx xx xxxxxxx xxxxxxxx klinické xxxxxxxxx xxxxx xxxxxx (za xxxxxx individuálního xxxxxxxxx). Xxxx pozorování xx xx xxxx provádět xxxx xxxxxxx klec xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxx a nejlépe xxxxxxx xx stejnou xxxx. Xxxxxxxxxx xx xxxx xxx xxxxxxx xxxxxxxxxxxxx, xxxxxxx xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx definovaného xx xxxxxxxx xxxxxxxxxx. Xxxx xx xx usilovat x to, xxx xxxx xxxxxxx xx xxxxxxxxxx podmínkách xx xxxxxxxx a xxx xxxxxxxxx xxxxxxxxx nejlépe xxxxx, xxxxx xxxxxx x xxxxxxxx do xxxxxxx xxxxxxxxxxx. Xxxxxxxxx xx xxxx mimo xxxx zahrnovat xxxxx xxxx, xxxxx, xxx x xxxxxxx, xxxxxx xxxxxxx x xxxxxxx x xxxxxxxxxxxxx xxxxxx (xxxxxx, xxxxxxx xxxxx, xxxxxxxx xxxxxx, nezvyklé xxxxxxx). Xxxxxxxxxxxx xx xx měly xxxxx xxxxx, polohy x xxxxxx xx xxxxxxxxxx, xxxx xxxxxxxxxx klonických x xxxxxxxxx xxxxxx, xxxxxxxxxx v chování (xxxx. vytrvalých čistících xxxxxx xxxx opakovaného xxxxxxxx) nebo xxxxxxxxx xxxxxxx (xxxx. xxxxxxxxxxxxxxx, xxxxxx xxxxxxxx).
Xx xxxxxxx xxxxx xxxxxxxx xxxxx xx otestují xxxxxx xx různé xxxxxxxx xxxxxxx (např. sluchové, xxxxxxx, xxxxxxxxxxxxxxx) a xxxxx xx xxxx xxxxxx a motorické xxxxxxxx. Xxxxx xxxxxxxx xxxxxxxxx x postupech, xxxxx je xxxxx xxxxxx, xxxx xxxxxxx x xxxxxxxxxx (xxx xxxxxx úvod, xxxx X).
Xxxxxxxxxx xxxxxxxxx poruch xx čtvrtém xxxxx xxxxxxxx xxxxx lze xxxxxxxx xxxxxxxx, pokud xx studie xxxxxxxxx xxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx (90xxxxx) xxxxxx. X takovém xxxxxxx je xxxxxxxxxx xxxxxxxxx poruch zahrnuto xx xxxxxxxxxx xxxxxx. Xxxxxxxxxx xxxxx o xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xx studie opakovaného xxxxxxxx xxxxx xxxx xx xxxxx xxxxxx xxxxxxxx xxxxx xxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxxxxxx studii.
Pozorování xxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxx x xxxxxx, xxxxx xxxxxxxx příznaky xxxxxxxx x xxxxxx xxxx, xx xx xxxxxxx významně xxxxxxxx xxxxxx xxxxxxx xxxx.
1.4.3.2 Xxxxxxx hmotnost x xxxxxxxx xxxxxxx/xxxx
Xxxxxxx zvířata xx xx xxxx xxxxxxx jednou xxxxx xxxxxx. Xxxxxx xxxxxxxx xxxxxxx a xxxx xx xx mělo xxxxxxxx nejméně jednou xxxxx. Xxxxx se xxxxx podává v xxxxx xxxx, měla xx xx nejméně xxxxxx xxxxx xxxxx xxxxxxxx vody.
1.4.3.3 Xxxxxxxxxxxxx xxxxxxxxx
Xx konci xxxxxxx xx měla být xxxxxxxxx tato xxxxxxxxxxxxx xxxxxxxxx: xxxxxxxxx hematokritu, xxxxxxxxxxx xxxxxxxxxxx, počtu xxxxxxxxxx, celkového x xxxxxxxxxxxxxxx počtu xxxxxxxxx, xxxxx xxxxxxxxxx x xxxxxxx xx xxxxxxxxxxxxx xxx.
Xxxxxx xxxxxx xx xx xxxx xxxxxxxx x určeného xxxxx xxxxx před xxxxxxxxx xxxxxx xxxx x xxxx průběhu x xxxx xx se xxxxxxxxx xx vhodných xxxxxxxx.
1.4.3.4 Xxxxxxxx xxxxxxxxxxx xxxxxxxxx
Xxxxxxxx xxxxxxxxxxx analýzy xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx xx xxxxx x xxxxxxx xx xxxxx x ledviny xx xxxxxxxx xx xxxxxxxx xxxxxxxx odebraných všem xxxxxxxx xxxx xxxxxxxxx xxxx x jeho xxxxxxx (kromě xxxxxx xxxxxxxxxx x xxxxxx x/xxxx xxxxxx xxxxxxxxxx x průběhu zkoušky). Xxxx xxxxxxxxx xxxxxxxx xxxxxx se xxxxxxxxxx xxxxxxxx xxxxxxx xxxx xxx xxx xxxxxxx [1].Xxxxxxxxx plazmy a xxxx xxxxxxxx xxxxxxxxx xxxxxx, draslíku, glukosy, xxxxxxxxx xxxxxxxxxxxx, xxxxxxxx, xxxxxxxxxx, xxxxxxxxx bílkovin x xxxxxxxx, xxxxxxx xxxx enzymů indikujících xxxxxx xx jaterní xxxxx (jako xxxxxxxxxxxxxxxxxxxxxx, xxxxxxxxxxxxxxxxxxxxxxxx, alkalická xxxxxxxxx, xxxx xxxxxxxxxxxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxxxxx). Xxxxxxxxx dalších xxxxxx (xxxxxxxxx xxxx xxxxxx xxxxxx) x xxxxxxxxx xxxxxxx xxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx.
Xxxx xx xxxxx x xxxxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxx následující xxxxxxx xxxx xx xxxxxxx xxxxxx definovaného xxxxx: xxxxxx, xxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx, xX, xxxxxxxxx, xxxxxxx x xxxx/xxxxxxx.
Xxxx xx xx xxxx xxxxxx xxxxxxxxx indikátorů xxxxxxxxx xxxxxxxxx tkání x xxxx. Xxxxx xxxxxxxxx xx xxxx xxx provedeno, xxxxx xxxxx xxxxx vlastnosti xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx, xxxxxx xxxxxxx, xxxxxxx, xxxxxxxxxxxx na xxxxx, xxxxxxxxxxxx hormonů, methemoglobinu x cholinesterasy. Tyto xxxxxxx je xxxxx xxxxxxxxxxxxx pro látky xxxxxxxx skupin nebo xxxxxx xx xxxxxxx.
Xxxxxx xx xxxxx xxxxxxxxxx xxxxxx x závislosti xx druhu x xx xxxxxxxxxxxx x/xxxx xxxxxxxxxxxxxxx xxxxxxxx dané xxxxx.
Xxxxx xxxxxx údaje x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx dostatečné, xxxx xx xx xxxxxx xxxxxxxxx hematologických x xxxxxxxxxx biochemických xxxxxxxxx xxxx začátkem xxxxxxx.
1.4.3.5 Xxxxx
X xxxxx xxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxx by měla xxx xxxxxxxxx xxxxxxx, xxxxxxxx pitva, xxxxxxxxxx xxxxxxx zkoumání xxxxxxxx xxxxxxx těla, všech xxxxxx x xxxxxx xxxxxxx, hrudní x xxxxxx x xxxxxx xxxxxx. Xxxxx, xxxxxxx, xxxxxxxxxxx, xxxxxxx, xxxxxxxxxx, xxxxxx, xxxxxxx, xxxxx x xxxxx všech xxxxxx xx měly xxx zbaveny všech xxxxxxxx xxxxx x xx xxxxxxxx xx xxxxx se xx xxxxxx xxxxx zváží, xxx xxxxxxx x xxxxxxxxx.
Xxxxxxxxxxx xxxxx xx xxxx xxx xxxxxxxxxx x nejvhodnějším fixačním xxxxx s xxxxxxx xx xxx xxxxx x xxxxxxxxx následná xxxxxxxxxxxxxxxx xxxxxxxxx: xxxxxxx xxxxx s xxxxxx, xxxxx (xxxxxxxxxxxxxxx xxxxxxx, xxxxxx hemisfér, mozečku x xxxxx), xxxxx, xxxxxxx, tenké x xxxxxx xxxxxx (včetně Xxxxxxxxxx plátů), xxxxx, xxxxxxx, xxxxxxxxxxx, slezina, xxxxx, xxxxxx, štítná xxxxx, xxxxxxxxxx x xxxxx (xxxxxxxxxxxx xxxxxxxxx xxxxxxxx roztokem x xxxxxxxxx), xxxxxx x xxxxxxxx xxxxxxxx orgány (xxxx. děloha, xxxxxxxx), xxxxxx xxxxxx, lymfatické xxxxxx (xxxxxxxxxx jedna xxx oblast xxxxxxxx x xxxxx xxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxx), periferní nerv (x. xxxxxxxxxxx nebo x. xxxxxxxx), xxxxxxx x xxxxxxxxx svalu, xxx xxxxxx dřeně (xxxx xxxxxxx nátěr x nasáté xxxxxx xxxxx). Xxxxx klinických xxxx xxxxxx xxxxxx xxxx xxx xxxxxxxx xxxxxxx x xxxxx xxxxx. Všechny xxxxxx xxxxxxxxxx xx xxxxx xxxxxx orgány xxx xxxxxxxx xxxxxxxx látky xx xxxx být xxxxxxxx.
1.4.3.6 Histopatologická vyšetření
U xxxxx xxxxxx xxxxxxxxx xxxxxxx x skupiny, xxxxx byla xxxxxx xxxxxx dávka, xx xxxx být xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx orgánů x xxxxx. Xxxx vyšetření xx xxxx xxx xxxxxxxxx na xxxxxxx xxxxx ostatních xxxxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx s xxxxxxx xxxxxx pozorovány xxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxx.
Xxxxxxx xxxxxxxxxxxxx xxxx xx měly xxx xxxxxxxx.
X xxxxxxx xxxxxxx satelitní xxxxxxx xx mělo xxx xxxxxxxxx xxxxxxxxxxxxxxxx vyšetření xxxxx x xxxxxx, xx xxxxxxx xxxx xxxxxxxxxx účinky u xxxxxxxxxxxx xxxxxx.
2. XXXXX
Xxxx xx xxx uvedeny xxxxx pro každé xxxxxxxxxx zvíře. Xxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxx xx tabulky, xxxxxxx xx xxxxx x xxxxx xxxxxxxxxxxxxx xxxxxxx xxxxx zvířat xx xxxxxxx zkoušky, xxxxx xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx zkoušky xxxx utracených z xxxxxxxxx xxxxxx x xxxx xxxxx xxxx xxxxxxxxx utracení, xxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx, včetně doby xxxxxxx, xxxxxx a xxxxxxxxxx xxxxxxx toxického xxxxxx, počet xxxxxx xxxxxxxxxxxx xxxx, xxx xxxx a xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxx xxx léze.
Číselné xxxxxxxx xx xxxx být xxxxx možno xxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxxxxx xxxxxx xx xxxx xxx xxxxxxx xxx při plánování xxxxxx.
3. ZPRÁVY
Protokol x xxxxxxx
Xxxxxxxx x xxxxxxx xx xxxxx xxxxx xxxxxxxxx xxxx informace:
Pokusná xxxxxxx:
- xxxxxxx druh/kmen;
- xxxxx, stáří x xxxxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx, strava xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx na xxxxxxx xxxxxxx, dále v xxxxxxxxx xxxxxxxxxxx a xx xxxxx xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxxxx volby xxxxxxxx, xxxx-xx xxxxxxx xxxx;
- xxxxxxxxxx xxxxxx xxxxxx dávek;
- xxxxxxxx xxxxx o xxxxxxx xxxxx xxxx xxxxxx xxxxxxx, o xxxxxxxx xxxxxxxxxxx, xxxxxxxx x xxxxxxxxxx přípravku;
- xxxxxxxx xxxxx x způsobu xxxxxx zkoušené látky;
- xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx x xxxxxxx/xxxxx xxxx (xxx) xx xxxxxxxxx xxxxx xxxxx (mg xx xx xxxxxxx xxxxxxxxx);
- xxxxxxxx xxxxx x xxxxxx x xxxxxxx xxxx.
Xxxxxxxx:
- xxxxxxx xxxxxxxx/xxxxx xxxxxxx xxxxxxxxx;
- xxxxxxxx xxxxxxx a xxxxxxxxx xxxxxxxx vody;
- údaje x toxických reakcích xxxxx pohlaví x xxxxxx xxxxx, xxxxxx xxxxxxxx toxicity;
- xxxxxxxxx, xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxx (zda xxxx vratné xxxx xxxxxxxx);
- xxxxxxxxx reaktivity xx xxxxxxxx xxxxxxx, xxxxxxxx xxxx x xxxxxxxxx xxxxxxxx;
- hematologické xxxxxxxxx x příslušnými xxxxxxxxx hodnotami (xxxxxxx);
- xxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxx;
- tělesná hmotnost xxx xxxxxxxx x xxxxx o xxxxxxxxx xxxxxx;
- pitevní xxxxxx;
- xxxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxxxxx xxxxxx;
- xxxxx x xxxxxxxx, xxxxx xxxx xxxxxxxx;
- popřípadě xxxxxxxxxxx xxxxxxxxxx xxxxxxxx.
Xxxxxx xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx metodě OECD XX 407."
[1] Vyšetření xx xxxxx xx xxxxxxx pro xxxx xxxxxx x xxxx x xxxxxx, xxxxxxx xxx xxxxxx xxxxxxx. Xxxxxxx xxxxxxx pro xxxx xxxxxxxxxx je xx, xx x xxxxxxxxxxxxxxx xxxxxx xx xxxxx variabilita xxxxxxxx, xxxxx by mohla xxxxxxxx méně výrazné xxxxx x ztížit xxxxxxxxxxxx. Na xxxxx xxxxxx by xxxxxxxxx xxxx noc mohlo xxx vliv xx xxxxxxx xxxxxxxxxxxx a xxx xxxxxxxx v xxxxxxx xx xxxxxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxx. Xxxxx xx xxxxxxx xxxx xx lačno, je xxxxx provést xxxxxxxxxxx xxxxxxxxx xx xx xxxxxxxxxx funkčních xxxxxx xx 4. týdnu xxxxxxx.
XXXXXXX XX X
" X.37 POZDNÍ NEUROTOXICITA XXXXXXXXXXX XXXXXXXXX XXXXXXX XX XXXXXX XXXXXXXX
1. XXXXXX
1.1 Úvod
Při xxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxx xxxxx je xxxxxxxx xxxx x xxxxx xxxxxxxxx xxxxxxxx xxxxxx látek xxxxxxx xxxxxxxxxx xxxx neurotoxicity, xxxxx xxxxxxx xxx xxxxxxxx xxxxxx studiemi xxxxxxxx. X xxxxxxxx xxxxxxxxxxx xxxxxxxxx fosforu xxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxxx; xxxx xxxxx xxxx xxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxx.
Xxxxxxxxxxxx xxxxxxx xx xxxxx xxx xxxxxx xxx xxxxxxxxx xxxxx, které xxxxx xxxxxxx pozdní xxxxxxxxxxxxxx; xxxxxxxxx xxxxx xx zkoušek in xxxxx xxxx neposkytuje xxxxx, xx xxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx neurotoxicitu.
Viz obecný xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxx "organické xxxxxxxxxx xxxxxxx" xxxxx xxxxxxxxx xxxxxxxxx xxxxxx, thioestery xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxx příslušných xxxxxxx xxxxxxxxxxxxxxxx, thiofosfonových xxxx xxxxxxxxxxxxxxxxxxxxx, xxxx xxxx látky, xxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxx látek xxxx xxxxxxx.
Xxxxxx neurotoxicita je xxxxxxx xxxxxxxxxxx xx xxxxxxx počátkem xxxxxx, xxxxxxxx axonopatií x xxxx a xxxxxxxxxx xxxxx x xxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxxxx – XXX (xxxxxxxxxx target xxxxxxxx) x xxxxxxx xxxxx.
1.3 Referenční xxxxx
Xxxxxxxxxx xxxxx xxxx být xxxxxxxx x pozitivní xxxxxxxxx xxxxxxx s xxxxx prokázat, xx xx x laboratorních xxxxxxxxxx reakce pokusných xxxxx xxxxxxxxx xxxxxxxxx.
Xxxxxxxxx xxxxxx používané xxxxx x pozdním toxickým xxxxxxx xx xxx-x-xxxxx-xxxxxx (XXX 78308, EINECS 2011035, xxxxx xxxxx XXX: xxxx(2xxxxxxxxxxx)xxxxxx), známá xxxx xxx xxxxxx xxxxxxxxxxxxxxxx (TOCP).
1.4 Xxxxxxxx xxxxxxxx metody
Zkoušená látka xx xxxxxx xxxxxx x xxxxxx dávce xxxxxxxx domácím, chráněným xxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx účinky. Xxxxxxx xx pozorují xx xxxx 21 dnů, xxxxxxxxxxx xx abnormální xxxxxxx, xxxxxx x xxxxxx. Xxxxxxxxxxx xxxxxxxxx, xxxxxxx inhibice XXX (xxxxxxxxx target esterase), xx xxxxxxxxx x xxxxxx xxxxxxx xxxxxxxxx x xxxxx skupiny, xxxxxxx 24 x 48 x po xxxxxx látky. Dvacet xxxxx xxx xx xxxxxx látky xx xxxxxxxxx slepice xxxxxx x xxxxxxx xx xxxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx tkání.
1.5 Popis xxxxxxxx xxxxxx
1.5.1 Xxxxxxxx
Xxxxxxx xx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxx xxxxxxxxx virovými onemocněními x farmakologickou xxxxxx x xxxx xxxxxxxx xxxxx, xxxxxxx se xx xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx x xxxxxxx 5 xxx xxxx xxxxxxxxx xxxxxx xx xxxxxxxxxxxx xx xxxxxxxxxxx podmínky.
Používají xx xxxxxxxxxx xxxxx xxxxx xxxx xxxxxx umožňující xxxxx pohyb xxxxxx x xxxxxx xxxxxxxxxx xxxxx.
Xxxxxxxx xxxxx xx xxxxxxx xxxxxx xxxxxx xxxxxx, xxxxxxxxxxxx tobolkami xxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxx se xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xx xxxxxxx xxxxxxxx, xxxx xx xxxx. xxxxxxxxx xxxx, pevné xxxxx by xx xxxx xxxxxx rozpustit, xxxxxxx xxxxx dávky xxxxxxx xxxxx v xxxxxxxxxxxx tobolkách xx xx nemusely xxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xx xxxx být xxxxx xxxx xxxxxxxx, a xxxxx xxxxxx známy, xxxx xx být xxxxxx xxxxxx.
1.5.2 Xxxxxxxx xxxxxxxx
1.5.2.1 Xxxxxxx zvířata
Doporučuje xx xxxxx xxxxxxx xxxx xxxxxxxx (Xxxxxx xxxxxx domesticus), stará 8 – 12 xxxxxx. Xxxxxxxxx xx xxxxxxx x standardní xxxxxxxxx a slepice xx xxxx xxx xxxxxxx za xxxxxxxx xxxxxxxxxxxx xxxxx pohyb.
1.5.2.2 Xxxxx x pohlaví
Kromě xxxxxxxxxxxxxx xxxxxxx xx xxxx být xxxxxxx xxxxxxxxx xxxxxxx x xxxxxxxxx a pozitivní xxxxxxxxx xxxxxxx. X xxxxxxxx xxxxxx xxxxxxxx xxxxx xx x xxxxxxxxx xxxxxxxx xxxxxxx xxxxxx xxxx x xxxxxxxxxxxxxx skupinou.
V každé xxxxxxx by xxx xxx xxxxxx dostatečný xxxxx xxxxxx, xxx xxxxx xxxx xxxxxx xxxxx být xxxxxxxx xxx biochemické xxxxxxxxx (xxx v xxxxx x tři v xxxxx xxx xx xxxxxx) x xxxx xxxxxxx 21denní xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx xxxxxxxxx xxxxxxx xxxx být xxxxxxxx xxxxxxxx xxxx xxxxx být použity xxxxx z nedávno xxxxxxx kontrolní skupiny. Xxxx xx zahrnovat xxxxxxx xxxx xxxxxx, xxxxxx xx podá xxxxx, x xxx xx xxxxx, xx xxxxxxxx xxxxxx xxxxxxxxxxxxx, xxx xxxxxxx xxx xxxxxxxxxxx xxxxxxxxx x xxx xxxxxxx xxx xxxxxxxxxxxxxxxx vyšetření. Doporučuje xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxx. Nové xxxxxxxxx xxxxxxxxx údaje xx xxxx xxx xxxxxxxx, pokud xxxxxxxxxxx xxxxxxxxx x průběhu xxxxx xxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxx (xxxx. xxxxxxx, stravu, xxxxxxxx xxxxx).
1.5.2.3 Úrovně xxxxx
Xxxx xx xx xxxxxxx xxxxxxxxx xxxxxx xx xxxxxxx vhodného xxxxx xxxxxx x xxxxxx s různými xxxxxxxx dávek, xxx xxxx xxxxx stanovit xxxxxx, xxxxx má xxx xxxxxxx x xxxxxx xxxxxx. Pro xxxxxxxxx xxxxxxxxx xxxxx x hlavní xxxxxx xx v této xxxxxxxxx studii xxxxxxxx xxxxxx xxxxxxxx. Aby xx však zabránilo xxxxx vlivem xxxxxxxx xxxxxxxxxxxxx xxxxxx, xxx xxxxxx atropin xxxx xxxx xxxxxxxx přípravek, x xxxxxx xx xxxxx, xx nemá xxxx xx xxxxxx xxxxxxxxxxxx xxxxxx. Xxx xxxxx nejvyšší xxxxxxxxx xxxxx xxxxxxxxxx xxxxx xxx xxxxxx řadu xxxxx (xxx xxxxxx X.1 x)). Xxx xxxxxx xxxxx mohou xxx xxxxxxxx také xxxxxxxxx xxxxx o xxxxxxxxx xxxx xxxx xxxxxxxxxxxxx informace.
Úroveň xxxxx xxxxxxxx látky v xxxxxx xxxxxx by xxxx xxx xx xxxxxxxx, xxxxxxx xx xxxxx x úvahu xxxxxxxx xxxxxxxxx xxxxxx xxxxxx dávky x xxxxx xxxxx dávky 2000 mg xx xx tělesné xxxxxxxxx. Xxxxxxxx xxxx by xxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxxx (šest) x xxx xxxxxxxxxxxx xxxxxxxxx (šest) xx 21 dnech. Xxx xx xxxxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxx, použije xx xxxxxxx xxxx xxxx xxxxxxxx xxxxxxxxx, o xxxxxx je xxxxx, xx xxxx xxxx xx xxxxxx neurotoxické xxxxxx.
1.5.2.4 Xxxxxxx xxxxxxx
Xxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxx x xxxx studii xxx xxxxx xxxxx xxxxxxx 2000 xx xx xx tělesné xxxxxxxxx xx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx x xxxxx se xx xxxxxxx xxxxx x látkách x xxxxxxxx xxxxxxxxxx nepředpokládá xxxxxxxx, xxxx xxxxx xxxxxx za xxxxxxx xxxxx xxxxx xxxxxxxx. Xxxxxxx xxxxxxx se xxxxxxx s xxxxxxxx xxxxxxx, kdy xxxxx x xxxxxxxx člověka xxxxxxxxx, xx xx xxxxxxxx použití xxxxx xxxxxx dávek.
1.5.2.5 Xxxx xxxxxxxxxx
Xxxx pozorování xx xxxx xxx 21 xxx.
1.5.3 Xxxxxx
Xx xxxxxx xxxxxxxxx chránícího xxxx xxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx účinku xx xxxx xxxxxxxx xxxxx x xxxxx xxxxx.
1.5.3.1 Xxxxxx xxxxxxxxxx
Xxxxxxxxxx xx xxxx začít xxxxxxxx xx xxxxxx. Xxxxxxx xxxxxxx xx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x xxxxxxx xxxxxxx xxxx xxx x xxxx nejméně xxxxxx xxxxx po xxxx 21 xxx xxxx do xxxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx xx měly xxx zaznamenány, xxxxxx xxxx xxxxxxx, typu, xxxxxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxx xx měla být xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx x zaznamenává xx xxxxxx. Nejméně xxxxxxx xxxxx se xxxxxxx xxxxxx x xxxxxxxxxxxxx xxxxxxxx vyjmou x xxxxx x podrobí xxxxxxx xxxxxx xxxxxxxxx xxxxxxxx, xxxx xxxx. xxxxxxxx po xxxxxxx, xxx xx xxxxxxxxx xxxxxxxxx sebemenších xxxxxxxxx xxxxxx. Zvířata x xxxxxx a xxxxxxx, xxxxx xx xxxxx xxxx xxxx xxxxxxx, xx ihned xxxxxx, xxxxxxx xxxxxx x xxxxxxx.
1.5.3.2 Tělesná xxxxxxxx
Xxxxxxx xxxxxxx se xxxxx xxxxx xxxx podáním xxxxxxxx látky a xxxx xxxxxxx xxxxxx xxxxx.
1.5.3.3 Xxxxxxxxxxx xxxxxxxxx
Xxxx xxxxxx xxxxxxx xxxxxxxxx x každé xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxx s vehikulem x xxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx (xxxxx xx xxxxxxx xxxxxxxx xxxxxxx x xxxxx xxxxxxxx) xx xxxxxx v xxxxxxx dnech xx xxxxxx látky, xxxxx x xxxxxxxx xxxxx xx vypreparují x xxxxxxx xx xx xxxxxxxx XXX. Xxxx xxxx xxx rovněž xxxxxx vypreparovat n. xxxxxxxxxxx x xxxxxxxxxx xxxx xxxx na xxxxxxxx xxxxxxxx NTE. Xxxxxxxxx se xxxxxx xxx xxxxxxx z xxxxxxxxx xxxxxxx x x každé experimentální xxxxxxx xx 24 x x další xxx xx 48 x, xxxxxxx xxx xxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxx xx 24 x. Pokud pozorování xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx, že xx xxxxxxx xxxxx x xxxxxxxxx xxxxxxxxx xxxxx xxxxxx (to xxx xxxxx xxxxxxxx xxxxxxxxxxx xxxx nástupu cholinergních xxxxxxxx), xxxx xxx xxxxxxxxx xxxxxxx vzorek xxxxx xxxxxxx xx xxx xxxxxx mezi 24 xx 72 x xx xxxxxx xxxxx.
Xx těchto xxxxxxxx xxxxx xxxxx být xxxxxxxxx xxxx analýza xxxxxxxxxxxxxxxxxxxx (AChE), je-li xx xxxxxxxxxx xx xxxxxx. Xx vivo xxxx může xxxxxx xxxxxxxxx reaktivace XXxX, xxx xxxx vést x xxxxxxxxx látky xxxx xxxxxxxxxx AChE.
1.5.3.4 Xxxxx
Xxxxx xxxxx xxxxxx (xxxxxxxxxx xxxxx xxxxx x utracených x xxxxxx) xx xxxx xxxxxxxxx posouzení stavu xxxxx x xxxxx.
1.5.3.5 Xxxxxxxxxxxxxxxx vyšetření
Nervová xxxx xxxxxx, xxxxx přežila xxxx pozorování x xxxxxx xxxxxxx pro xxxxxxxxxxx studie, xx xxxx xxx xxxxxxxxxxxxx xxxxxxxxx. Tkáně xx xxxx xxx xxxxxxxx xx xxxx xx xxxxxxx xxxxxxxxxx xxxxxxx. Xxxxxxx se xxxxxxx (xxxxxxx xxxxxxx xxx), xxxxxxxxxxx mícha, xxxxx x xxxxxxxxx xxxxx. Xxxx xxxxx xx xxxx být xxxxxxxx x xxxxx xxxxx xxxxx, xxxxxxx xxxxxx x lumbosakrální xxxxxxx. Xxxx xx xxx xxxxxxxx xxxx xxxxxxxx xxxxx n. tibialis x xxxx větví x m. xxxxxxxxxxxxx x x n. xxxxxxxxxxx. Řezy xx xxxxx xxxxxxxx barvivy xx xxxxxx a xxxxx.
2. XXXXX
Xxxxxxxxx výsledky xxxxxxx xxx xxxxxxxx xxxxxx xxxxxxx v xxxx xxxxxx (biochemická x histopatologická xxxxxxxxx x xxxxxxxxx změn xxxxxxx) xxxxxxxxxx xxxxxxxxx xxxxx zkoušení pozdní xxxxxxxxxxxxx. Xxx xxxxxxxxxxxx xxxx xxxxxxxxxxxx výsledcích xxxxxx vyšetření může xxx xxxxxxxx xxxxx xxxxxxxxx.
Xxxx by xxx xxxxxxx xxxxx xxx xxxxx xxxxxxxxxx xxxxx. Xxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxx do xxxxxxx, xxxxxxx xx xxxxx x xxxxx xxxxxxxxxxxxxx xxxxxxx xxxxx zvířat xx začátku zkoušky, xxxxx zvířat vykazujících xxxx, účinky xx xxxxxxx nebo xxxxxxxxxxx xxxxxx, typ x xxxxxxxxx těchto xxxx xxxx účinků x xxxxxxxx xxxxxx vykazující xxxxx xxx a xxxxxxxxx xxxx xxxx xxxxxx.
Xxxxx x této xxxxxx xx měly xxx xxxxxxxxxxx x xxxxxxxx xxxxxxx, xxxxxxxxxx x korelace xxxxxx xx xxxxxxx x xxxxxxxxxxxxx x xxxxxxxxxxxxxxxxxx xxxxxx x xxxx xxxxxxxxxx dalších xxxxxxxxxxxx xxxxxx xx experimentální x xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxxxx by xxxx xxx xxxxx možno xxxxxxxxxxx xxxxxxx a xxxxxx uznávanou statistickou xxxxxxx. Xxxxxxxxxxx metoda xx xxxx xxx xxxxxxx xxx xxx xxxxxxxxx studie.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x xxxxxxx xx pokud xxxxx xxxxxxxxx tyto xxxxxxxxx:
Xxxxxxx xxxxxxx
- použité xxxxxxx;
- xxxxx x xxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx atd.;
- xxxxxxxx jednotlivých zvířat xx xxxxxxx zkoušky.
Zkušební xxxxxxxx:
- xxxxxxxx xxxxx x xxxxxxxx zkoušené xxxxx, xxxxxxxxx o xxxx xxxxxxxx x xxxxxxxxxx;
- xxxxxxxxxx volby xxxxxxxx;
- xxxxxxxx xxxxx x xxxxxxx podání xxxxxxxx xxxxx;
- xxxxxxxx xxxxx o stravě x x kvalitě xxxx;
- zdůvodnění xxxxxx xxxxxx dávek;
- xxxxxxxxxxx xxxxxxxxxx dávek, xxxxxx xxxxxxxxxx informací x xxxxxxxx, objemu x xxxxxxxxx formě xxxxxx xxxxx;
- identifikace xxxxxxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxx o xxxx podání.
Výsledky:
- xxxxx x xxxxxxx hmotnosti;
- xxxxx x toxických xxxxxxxx podle xxxxxx, xxxxxx mortality;
- xxxxxxxxx, xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx nebo xxxxxxxx);
- xxxxxxxx xxxxx xxxxxxxxxxxxx vyšetření x xxxxxx;
- xxxxxxx nálezy;
- xxxxxxxx popis xxxxx xxxxxxxxxxxxxxxxxx nálezů;
- popřípadě xxxxxxxxxxx xxxxxxxxxxx výsledků.
Rozbor xxxxxxxx.
Xxxxxx.
4. LITERATURA
Metoda xx xxxxxxxxxx metodě XXXX XX 418.
B.38 XXXXXX XXXXXXXXXXXXX XXXXXXXXXXX XXXXXXXXX XXXXXXX – 28XXXXX XXXXXXXXX XXXXXXXX
1. XXXXXX
1.1 Xxxx
Xxx posouzení a xxxxxxxxx toxických xxxxxx xxxxx xx xxxxxxxx xxxx x úvahu xxxxxxxxx xxxxxxxx skupin xxxxx xxxxxxx specifické xxxx xxxxxxxxxxxxx, které xxxxxxx být zjištěny xxxxxx studiemi xxxxxxxx. X xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx xxxxxxxxxx pozdní neurotoxicita; xxxx xxxxx xxxx xxx podrobeny xxxxxxxx xxxxx metodou.
Screeningové xxxxxxx xx xxxxx xxx xxxxxx xxx vyhledání xxxxx, xxxxx xxxxx xxxxxxx xxxxxx xxxxxxxxxxxxxx; xxxxxxxxx xxxxx ze xxxxxxx xx xxxxx xxxx neposkytuje důkaz, xx xxxxx xxxx xxxxxxxxx vyvolat pozdní xxxxxxxxxxxxx.
28xxxxx xxxxxxx pozdní xxxxxxxxxxxxx poskytuje xxxxxxxxx x xxxxxx xxxxxxxxx xxx xxxxxx, xxxxx xx xx xxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxx. Xxxxxxxx xxxxxxxxx x xxxxxx xx xxxxx x xxxx poskytnout odhad xxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx, což xxxx xxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxx.
Xxx xxxx xxxxxx xxxx, xxxx X.
1.2 Xxxxxxxx
Xxxx "organické xxxxxxxxxx xxxxxxx" patří neutrální xxxxxxxxx xxxxxx, thioestery xxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx, xxxxxxxxx xxxx xxxxxxxxxxxxxxx xxxx příslušných xxxxxxx xxxxxxxxxxxxxxxx, thiofosfonových xxxx xxxxxxxxxxxxxxxxxxxxx, xxxx xxxx xxxxx, xxxxx xxxxx způsobit pozdní xxxxxxxxxxxxx pozorovanou u xxxxxxxxx xxxxx xxxx xxxxxxx.
Xxxxxx neurotoxicita xx xxxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxx, xxxxxxxx xxxxxxxxxx v xxxx x xxxxxxxxxx xxxxx x xxxx x xxxxxxxx a xxxxxxxxx specifické xxxxxxxx - NTE (xxxxxxxxxx xxxxxx esterase) x xxxxxxx xxxxx.
1.3 Xxxxxxxx xxxxxxxx metody
Zkoušené xxxxx xx xxxxxxxx xxxxx xxxxxx slepicím domácím xx dobu 28 xxx. Zvířata xx xxxxxxxx nejméně xxxxxx xxxxx, xxxxxxxxxxx xx xxxxxxxxxx xxxxxxx, xxxxxx x xxxxxx xxxxx 14 dnů po xxxxxxxx xxxxx. Xxxxxxxxxxx xxxxxxxxx, xxxxxxx xxxxxxxx XXX (xxxxxxxxx xxxxxx xxxxxxxx), xx xxxxxxx x xxxxxx xxxxxxx xxxxxxxxx x xxxxx xxxxxxx, xxxxxxx 24 x 48 h xx xxxxxx xxxxx. Xxx xxxxx xx xxxxxxxx xxxxx xx xxxxxxxxx xxxxxxx usmrtí x xxxxxxx se xxxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx.
1.4 Popis xxxxxxxx xxxxxx
1.4.1 Xxxxxxxx
Xxxxxxx xx xxxxxxx xxxxx xxxxxxx xxxxxxxx dospělých xxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxxxxx onemocněními x farmakologickou xxxxxx x mají xxxxxxxx xxxxx, xxxxxxx xx xx xxxxxxxxxxxxxxxx x xxxxxxxxxxx skupin x xxxxxxx 5 xxx xxxx xxxxxxxxx xxxxxx xx xxxxxxxxxxxx na xxxxxxxxxxx xxxxxxxx.
Xxxxxxxxx se xxxxxxxxxx xxxxx klece xxxx ohrady xxxxxxxxxx xxxxx xxxxx xxxxxx x xxxxxx xxxxxxxxxx xxxxx.
Xxxxxxxx látka xx xxxxxx xxxxx xxx, 7 dnů v xxxxx, xxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx. Xxxxxxxx xx xxxxxxxx xxxxxxxx nebo xxxxxxxxxx ve xxxxxxx xxxxxxxx, jako je xxxx. kukuřičný xxxx, xxxxx xxxxx xx xx xxxx nechat xxxxxxxxx, protože xxxxx xxxxx pevných xxxxx x xxxxxxxxxxxx xxxxxxxxx xx xx xxxxxxxx xxxxxxxxxx xxxxxxxx. Toxické xxxxxxxxxx xxxxxxxxx vehikul xx xxxx xxx xxxxx xxxx xxxxxxxx, x xxxxx xxxxxx xxxxx, xxxx by xxx xxxxxx xxxxxx.
1.4.2 Xxxxxxxx podmínky
1.4.2.1 Xxxxxxx xxxxxxx
Xxxxxxxxxx xx mladá xxxxxxx xxxx xxxxxxxx (Xxxxxx xxxxxx xxxxxxxxxx), xxxxx 8 – 12 xxxxxx. Používají xx plemena o xxxxxxxxxx velikosti a xxxxxxx xx xxxx xxx xxxxxxx xx xxxxxxxx umožňujících xxxxx xxxxx.
1.4.2.2 Xxxxx x xxxxxxx
Xxxxxx by xxxx xxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx skupina x xxxxxxxxx. S xxxxxxxx xxxxxx zkoušené xxxxx se x xxxxxxxxx skupinou x xxxxxxxxx xxxxxxx xxxxxx xxxx s experimentální xxxxxxxx.
X každé xxxxxxx xx měl xxx xxxxxx xxxxxxxxxx xxxxx xxxxxx, xxx aspoň xxxx xxxxxx xxxxx xxx usmrceno xxx xxxxxxxxxxx vyšetření (xxx x xxxxx x xxx x druhý xxx xx podání) x xxxx xxxxxxx 14xxxxx pozorování xxxxxxxxxxxxx xxxxxxxx.
1.4.2.3 Xxxxxx dávek
Při xxxxxx xxxxxx xxxxx xx měly xxx xxxxx v xxxxx xxx xxxxxxxx xxxxxx xxxxxxx pozdní xxxxxxxxxxxxx x xxxxxxxx další xxxxxxxx xxxxx x xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxx xxxxxx xxxxx xx xxxx xxx xxxxxxx x xxxxx vyvolat xxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxxxxxxxxxx, xx xxxx xxxxxxx nebo xxxxxx utrpení. Xxxx xx xxxx xxx xxxxxxx xxxxxxxx xxxx xxxxx x xxxxx xxxxxxxx, xx xxxxxxxx xxxxxxxxx účinku na xxxxx x xx xxxxxxxx dávka xxxxxxxxxx xxxxx xxxxxxx xxxxxxxx.
1.4.2.4 Xxxxxxx xxxxxxx
Xxxxx zkouška xxxxxxxxx podle postupů xxxxxxxxx x této xxxxxx při xxxxx xxxxx xxxxxxx 1000 xx xx xx xxxxxxx xxxxxxxxx a xxx xxxxxxxx pozorovatelné xxxxxxx účinky a xxxxx xx na xxxxxxx xxxxx o xxxxxxx x podobnou xxxxxxxxxx nepředpokládá toxicita, xxxx xxxxx xxxxxx xx použití xxxxx xxxxx nezbytná. Limitní xxxxxxx xx xxxxxxx x xxxxxxxx xxxxxxx, xxx xxxxx x xxxxxxxx xxxxxxx xxxxxxxxx, xx xx nezbytné xxxxxxx xxxxx úrovně xxxxx.
1.4.2.5 Xxxx xxxxxxxxxx
Xxxxxxx xxxxxxx xx xxxx xxx xxxxxxxxxx xxxxxxx xxxxxx xxxxx xx xxxx xxxxxxxx x 14 xxx xx xx, až xx xxxxxxxxx xxxxx xxxxx xxxxx.
1.4.3 Xxxxxx
Xxxxxxxx se xxxxxx xxxxxxxx xxxxx xxxx xxx v xxxxx po xxxx 28 xxx.
1.4.3.1 Obecná xxxxxxxxxx
Xxxxxxxxxx by xxxx xxxxx xxxxxxxx po xxxxxx. Xxxxxxx slepice xx xxxxxxx xxxxxxxx xxxxxx denně xxxxx xxx x 28 xxx expozice x 14 xxx xx xxxxxxxx xxxx xx xxxxxxxxxxx usmrcení. Xxxxxxx xxxxxxxx xxxxxxxx xx xxxx být xxxxxxxxxxx, xxxxxx xxxx xxxxxxx, xxxx, xxxxxxxxxx x xxxxxx. Pozorování xx xxxxxxxxx xxxxxxxxxxx chování, xxx xxxx xx xx xx xxxxxxxx. Xxxxxx by xxxx xxx hodnocena xxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx a zaznamenává xx xxxxxx. Xxxxxxx xxxxxxx xxxxx xx xxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxx z xxxxx x podrobí xxxxxxx xxxxxx motorické xxxxxxxx, jako xxxx. xxxxxxxx xx xxxxxxx, xxx xx usnadnilo xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx. Zvířata x xxxxxx x xxxxxxx, xxxxx xx xxxxx xxxx xxxx xxxxxxx, xx ihned xxxxxx, xxxxxxx xxxxxx a xxxxxxx.
1.4.3.2 Xxxxxxx xxxxxxxx
Xxxxxxx xxxxxxx xx zváží xxxxx před xxxxxx xxxxxxx xxxxxxxx látky x xxxx xxxxxxx xxxxxx xxxxx.
1.4.3.3 Biochemická xxxxxxxxx
Xxxx xxxxxx xxxxxxx xxxxxxxxx x xxxxx xxxxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxxx x xxxxxxxxx x xxx xxxxxxx x pozitivní xxxxxxxxx xxxxxxx xx xxxxxx v prvních xxxxx po xxxxxx xxxxxxxx xxxxx, xxxxx x xxxxxxxx mícha xx xxxxxxxxxxx x xxxxxxx xx na xxxxxxxx NTE. Xxxx xxxx xxx xxxxxx xxxxxxxxxxxx x. xxxxxxxxxxx x analyzovat jeho xxxx na xxxxxxxx xxxxxxxx XXX. Xxxxxxxxx xx usmrtí xxx xxxxxxx x kontrolní xxxxxxx x x xxxxx xxxxxxxxxxxxxx xxxxxxx xx 24 x x xxxxx xxx xx 48 x xx xxxxxxxx xxxxx. Xxxxx xxxxx x xxxxxx xxxxxx xxxx x xxxxxx studií (xxxx. toxikokinetických) xxxxxxxxx, xx jsou xxxxxx xxxx doby usmrcení xx poslední xxxxx xxx xxxx xxxx, xxxx xx být xxxxxxx x xxxxxxxxxx xx mělo xxx xxxxxxx v dokumentaci.
Na xxxxxx xxxxxxxx xxxxx xxxxx být provedeny xxxx xxxxxxx xxxxxxxxxxxxxxxxxxxx (XXxX), je-li xx xxxxxxxxxx za xxxxxx. Xx vivo xxxx xxxx xxxxxx spontánní xxxxxxxxxx XXxX, xxx xxxx xxxx x xxxxxxxxx látky xxxx xxxxxxxxxx AChE.
1.4.3.4 Xxxxx
Xxxxx xxxxx zvířat (xxxxxxxxxx xxxxx plánu x xxxxxxxxxx x agónii) xx xxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx x xxxxx.
1.4.3.5 Xxxxxxxxxxxxxxxx xxxxxxxxx
Xxxxxxx tkáň xxxxxx, xxxxx xxxxxxx xxxx xxxxxxxxxx x nebyla xxxxxxx xxx biochemické xxxxxx, xx xxxx xxx xxxxxxxxxxxxx xxxxxxxxx. Xxxxx xx xxxx xxx fixovány xx xxxx xx xxxxxxx xxxxxxxxxx xxxxxxx. Odebírá xx xxxxxxx (střední xxxxxxx xxx), xxxxxxxxxxx xxxxx, mícha x xxxxxxxxx xxxxx. Xxx xxxxx xx xxx xxx xxxxxxxx x xxxxx krční xxxxx, xxxxxxx xxxxxx x xxxxxxxxxxxxx xxxxxxx. Měly xx xxx xxxxxxxx xxxx distální části x. xxxxxxxx x xxxx xxxxx x x. xxxxxxxxxxxxx x x x. ischiadicus. Xxxx xx barví xxxxxxxx xxxxxxx xx xxxxxx x axony. Xxxxxxx xx mělo xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxx zvířat xxxxxxxxx xxxxxxx x xxxxxxx x xxxxxxx xxxxxx. Xxxxx se x xxxxxxx s xxxxxxx xxxxxx xxxxxxx xxxxxx, xxxx by být xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xx slepicích xx skupiny xx xxxxxxx x nízkou xxxxxx.
2. XXXXX
Xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxx (xxxxxxxxxxx x xxxxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxx xxxxxxx) xxxxxxxxxx xxxxxxxxx další xxxxxxxx xxxxxx neurotoxicity. Xxx xxxxxxxxxxxx nebo xxxxxxxxxxxx xxxxxxxxxx těchto xxxxxxxxx xxxx být xxxxxxxx xxxxx xxxxxxxxx.
Xxxx xx xxx xxxxxxx xxxxx xxx xxxxx jednotlivé xxxxx. Navíc by xxxx xxx xxxxxxx xxxxx shrnuty xx xxxxxxx, xxxxxxx xx x každé experimentální xxxxxxx uvede xxxxx xxxxxx xx xxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxxxxxxxx xxxx, xxxxxx xx xxxxxxx nebo xxxxxxxxxxx xxxxxx, typ x xxxxxxxxx xxxxxx xxxx xxxx účinků x procento xxxxxx xxxxxxxxxx každý xxx x xxxxxxxxx léze xxxx xxxxxx.
Xxxxx x xxxx studie xx xxxx být vyhodnoceny x xxxxxxxx xxxxxxx, xxxxxxxxxx x korelace xxxxxx na xxxxxxx x biochemických x xxxxxxxxxxxxxxxxxx xxxxxx x xxxx jakýchkoli xxxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxxxxxxxxxx x xxxxxxxxx xxxxxxx.
Xxxxxxx xxxxxxxx xx xxxx být xxxxx xxxxx xxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx. Xxxxxxxxxxx xxxxxx xx měla xxx xxxxxxx xxx xxx plánování xxxxxx.
3. XXXXXX
Xxxxxxxx x xxxxxxx
Xxxxxxxx x zkoušce xxxxxxxx xxxxx xxxxx xxxx xxxxxxxxx:
Xxxxxxx xxxxxxx:
- xxxxxxx xxxxxxx;
- xxxxx x xxxxx xxxxxx;
- xxxxx, xxxxxxxx xxxxx xxx.;
- xxxxxxxx xxxxxxxxxxxx xxxxxx xx začátku xxxxxxx.
Xxxxxxxx xxxxxxxx:
- xxxxxxxx xxxxx x xxxxxxxx xxxxxxxx xxxxx, xxxxxxxxx x xxxx stálosti x xxxxxxxxxx;
- xxxxxxxxxx xxxxx xxxxxxxx;
- xxxxxxxx údaje x xxxxxxx podání xxxxxxxx xxxxx;
- xxxxxxxx xxxxx o xxxxxx x x xxxxxxx xxxx;
- xxxxxxxxxx výběru xxxxxx xxxxx;
- specifikace xxxxxxxxxx látek, xxxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx, xxxxxx x xxxxxxxxx xxxxx xxxxxx xxxxx;
- xxxxxxxxxx xxxxxx xxxx xxxxxx xxx xxxxxxxxxxx xxxxxxxxx, není-li xxxxxxx 24 x 48 x.
Xxxxxxxx:
- údaje x xxxxxxx xxxxxxxxx;
- xxxxx x xxxxxxxxx xxxxxxxx xxxxx skupin, xxxxxx xxxxxxxxx;
- xxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx;
- xxxxxxxxx, závažnost x xxxxxx xxxxxxxxxx xxxxxxx (xxx xxxx xxxxxx nebo xxxxxxxx);
- xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx x nálezů;
- xxxxxxx xxxxxx;
- xxxxxxxx xxxxx xxxxx xxxxxxxxxxxxxxxxxx xxxxxx;
- popřípadě xxxxxxxxxxx xxxxxxxxxxx výsledků.
Rozbor xxxxxxxx.
Xxxxxx.
4. XXXXXXXXXX
Xxxxxx xx xxxxxxxxxx xxxxxx XXXX XX 419."
XXXXXXX X
Xxxxxx xxxxxxxxx xx klasifikaci a xxxxxxxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxx
Xxx xxxxxxxx Xxxxxx 2001/59/ES, Xx. xxxx. L 332, 28. 12. 2000, x. 81.


