Věstník MŽP ČR, částka 1/2017
Certifikovaná metodika
(Nmet)
Metodika vzorkování vnitřního prostředí pro analýzy vybraných emergentních polutantů
Masarykova univerzita, Přírodovědecká fakulta,
Centrum pro výzkum toxických látek v prostředí RECETOX
Metodika je výsledkem řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA.
Řešitelský tým projektu:
doc. Ing. Branislav Vrana, Ph.D.
prof. RNDr. Jana Klánová, Ph.D.
doc. RNDr. Pavel Čupr, Ph.D.
RNDr. Roman Prokeš, Ph.D.
RNDr. Jana Borůvková, Ph.D.
Ing. Jitka Bečanová, Ph.D.
Foppe Smedes
doc. Mgr. Klára Hilscherová, Ph.D.
Mgr. Jiří Novák, Ph.D.
Mgr. RNDr. Michal Bittner, Ph.D.
Mgr. Ondřej Sáňka, Ph.D.
Ing. Šimon Vojta, Ph.D.
RNDr. Ondřej Mikeš, Ph.D.
Mgr. Anežka Sharma
Mgr. Katarína Bányiová
Ing. Kateřina Šebková, Ph.D.
Mgr. Jakub Urík
Ing. Barbora Feixová
Výše uvedení členové týmu jsou z Centra pro výzkum toxických látek v prostředí RECETOX, Přírodovědecké fakulty MU - tedy z řešitelského pracoviště projektu. Jejich odborné zaměření je také patrné z odborných profilů na stránkách pracoviště: www.recetox.muni.cz
Citace: Čupr, P., Hilscherová, K., Vrana, B., Melymuk, L., Bányiová, K., Sharma, A., Chropeňová, M., Prokeš, R., Smedes, F., Borůvková, J., Bečanová, J., Novák, J., Bittner, M., Sáňka, O., Vojta, Š., Mikeš, O., Šebková, K., Urík, J., Karásková, P., Audy, O., Přibylová, P., Kohoutek, J., Feixová, B., Klánová, J., 2016. Certifikovaná metodika (Nmet). Metodika vzorkování vnitřního prostředí pro analýzy vybraných emergentních polutantů. Masarykova univerzita, RECETOX. RECETOX REPORT No. 599. Listopad 2016.
1. Seznam zkratek a symbolů
|
AZ-AHR |
lidská buněčná linie jaterního karcinomu - transfekovaná |
|
BEAS-2B |
lidská buněčná linie bronchiálního epitelu |
|
BFRs |
bromované zhášeče hoření |
|
BIOTEQ |
toxický ekvivalent |
|
DEX |
dexamethason |
|
EC |
efektivní koncentrace |
|
EEQ |
ekvivalent 17β-estradiolu |
|
GC |
plynová chromatografie |
|
HBCD |
hexabromcyklododekan |
|
HeLa |
lidská buněčná linie karcinomu děložního čípku |
|
HepG2 |
lidská buněčná linie jaterního karcinomu |
|
HPLC |
vysokoúčinná kapalinová chromatografie |
|
HRMS |
hmotnostní spektrometrie s vysokým rozlišením |
|
IC |
inhibiční koncentrace |
|
MCF-7 |
lidská buněčná linie prsního karcinomu |
|
MDA-kb2 |
lidská buněčná linie prsního karcinomu - transfekovaná |
|
MDA-MB-453 |
lidská buněčná linie prsního karcinomu |
|
MS |
hmotnostní spektrometrie |
|
MVLN |
lidská buněčná linie prsního karcinomu - transfekovaná |
|
PBDE |
polybromované difenylethery |
|
PFCs |
perfluorované látky |
|
PFOA |
perfluorooktanová kyselina |
|
PFOS |
perfluorooktansulfonát |
|
PTFE |
polytetrafluorethylen (teflon) |
|
PUF |
filtr z polyuretanové pěny |
|
PZ-TR |
lidská buněčná linie jaterního karcinomu |
|
QM-A |
filtr z křemenných mikrovláken |
|
RCP |
receptor |
|
RE |
responzivní element |
|
SPE |
extrakce na tuhou fázi |
|
TCDD |
2,3,7,8-tetrachlordibenzo-p-dioxin |
|
T3 |
trijodtyronin |
|
XAD |
adsorpční pryskyřice |
Klíčová slova
Vnitřní prostředí, pasivní vzorkovací zařízení, nízkoobjemové aktivní vzorkovače, emergentní polutanty, ovzduší ve vnitřním prostředí, prach, toxikologická analýza
Obsah
3.1 Vzorkovací lokality
3.2 Počet a typy vzorků
4.1 Vzorkování vzduchu ve vnitřním prostředí
4.1.1 Nízkoobjemové aktivní vzorkovače
4.1.2 Pasivní vzorkovače
4.1.3 Vzorkování prachových částic
5. Zpracování vzorků a laboratorní analýzy
5.1 Chemické analýzy
5.1.1 Bromované látky
5.1.2 Perfluorované látky
5.1.3 Analýza dat
5.1.4 Zajištění a řízení kvality (QA/QC)
5.2 Toxikologické analýzy
5.2.2 Principy biodetekce u použité sady biotestů
5.2.3 Aplikace sady biotestů
7. Zpracování a využívání dat o kontaminaci vnitřního prostředí
1. Úvod
Tento dokument popisuje metodiku vzorkování vnitřního prostředí pomocí aktivního a pasivního vzorkování včetně popisu paralelních chemických a toxikologických analýz pro zpřesnění hodnocení lidské expozice, efektů a následně potenciálních rizik plynoucích z expozice vybraným typům emergentních polutantů - bromovaným zhášečům hoření (BFRs: polybromované difenylethery (PBDEs) a hexabromcyklododekan (HBCD)) a perfluorovaným látkám (PFCs).
Kvalita vnitřního neprůmyslového prostředí je ovlivněna mnoha faktory, z nichž důležitým je zejména přítomnost polutantů vyskytujících se ve vybavení interiéru budovy, přičemž koncentraci látek ovlivňuje také aktuální koncentrace látek z vnějšího prostředí. Mnoho studií dokazuje, že právě vnitřní prostředí je zdrojem velkého počtu sorpčních materiálů, které jsou zdrojem emisí (Stapleton et al., 2009). Emergentní polutanty jsou definovány jako syntetické nebo přirozeně se vyskytující nové typy používaných chemických látek, které mají potenciál ke vstupu do životního prostředí a mohou vyvolat nežádoucí účinky na lidské zdraví (Geissen et al., 2015). Vnitřní prostředí tak může představovat významný expoziční zdroj mnohých skupin organických polutantů, včetně výše uvedených skupin emergentních látek. Pro člověka, který tráví ve vnitřním prostředí většinu svého života, může tato expozice představovat významné zdravotní riziko.
Pro hodnocení míry znečištění vnitřního prostředí těmito látkami a pro následné hodnocení expozice, potenciálních účinků a rizik pro člověka je potřeba uplatnit metodiku jejich vzorkování vycházející z interdisciplinárního přístupu s jasným výstupem pro následné řízení rizik.
2. Cíle metodiky
Tato certifikovaná metodika slouží k charakterizaci expozice člověka vybraným emergentním polutantům ve vnitřním prostředí. Správnou aplikací této metodiky lze pak provést následnou charakterizaci příspěvků potenciálních rizik při hodnocení inhalační, orální a případně i dermální expozice ve vnitřním prostředí.
Součástí metodiky jsou:
-
detailní popisy dílčích odběrových metod (hlavní cíl)
-
popisy navazujících metod stopové analýzy emergentních polutantů
-
popisy metod hodnocení potenciálních toxických účinků emergentních polutantů ve vnitřním prostředí (s důrazem na efekty hodnocené in vitro na lidských buňkách)
-
popis doplňkového dotazníkového šetření.
Tato metodika byla ověřena v různých typech rezidenčního vnitřního prostředí, škol, domácností a pracovních prostor. Metodika je zaměřena na bromované zhášeče hoření (BFRs), kam patří polybromované difenylethery (PBDEs) a hexabromcyklododekan (HBCD) a druhou skupinou látek jsou perfluorované látky (PFCs) - nejvýznamnější představitelé jsou perfluorooktansulfonát (PFOS) a perfluorooktanová kyselina (PFOA).
3. Popis metodiky
3.1 Vzorkovací lokality
Při vzorkování vnitřního prostředí pro současné hodnocení chemického znečištění a potenciálních toxických efektů je zásadní výběr reprezentativního místa odběru vzorků a to s ohledem na cíl studie. Prostředí musí být reprezentativní a relevantní z hlediska expozice, vzorkovací plán musí být navržen s ohledem na možné expoziční scénáře a cesty a také na délku expozice. Důležité je samotné vzorkování propojit s expozičními dotazníky relevantních participantů studie. Dotazníky pomohou identifikovat faktory ovlivňující lidskou expozici, ale zároveň pomohou určit jaký vliv má přítomnost člověka a jeho aktivity ve vnitřním prostředí na chemické znečištění. K vnitřnímu prostředí s možným zásadním vlivem na lidskou expozici patří např. kanceláře a jiné pracovní prostředí, školy, učebny, ubytovny, domácnosti apod., kde člověk tráví většinu času.
3.2 Počet a typy vzorků
Při vzorkování vnitřního prostředí s cílem paralelně hodnotit chemické znečištění a z něho pocházející potenciálně toxické účinky je potřeba vhodně naplánovat počet a typy vzorků, které jsou potřebné pro získání výsledků s dobrou vypovídací hodnotou. Počet a typy vzorků závisí na použitých vzorkovacích metodách, sledovaných látkách a počtu vzorkovaných lokalit. Je potřeba brát ohled na délku a typ expozice (inhalační, dermální, orální), prostorovou a časovou variabilitu výskytu sledovaných látek a detekční limity při použitých vzorkovacích metodách.
4. Metodika vzorkování
4.1 Vzorkování vzduchu ve vnitřním prostředí
Vnitřní prostředí je důležitým zdrojem expozice člověka emergentním organickým polutantům (Barber et al., 2007; Kim et al., 2012; Shoeib and Harner, 2002; Schlummer et al., 2013). Hladiny těchto látek a jejich rozdělení v jednotlivých odběrových matricích vnitřního prostředí jsou důležité pro hodnocení možného dopadu na zdraví člověka. Pasivní vzorkovače poskytují informaci o dlouhodobé průměrné úrovni chemické kontaminace (Klánová et al., 2006). V tom především spočívá jejich velká výhoda. Pro detailní proces hodnocení kontaminace vnitřního prostředí je doporučeno používat také aktivní vzorkovače zachycující dynamiku kvality ovzduší v rámci specifických činností. Aktivní odběr je možné zacílit na konkrétní aktivity ve vnitřním prostředí a definovat tak celkový profil expozice (Sarigiannis, 2015). Základní rozdíly aktivního a pasivního vzorkování ovzduší jsou popsány v tabulce č. 1.
Nejvhodnějším postupem pro komplexní zhodnocení výskytu výše uvedených emergentních polutantů je provedení kombinace pasivního a aktivního typu vzorkování ovzduší vždy s propojením s chemickou a toxikologickou analýzou vzorků.
Tab. 1: Porovnání aktivního a pasivního vzorkování ovzduší
|
Aktivní vzorkování |
Pasivní vzorkování |
|
vzorkování probíhá kratší dobu (řádově hodiny) |
dlouhodobější vzorkování (řádově dny), integruje aktuální hladinu znečištění |
|
přesné a spolehlivé výsledky |
výsledky mohou být ovlivněny místními podmínkami |
|
vyžaduje zdroj energie |
jednoduché na obsluhu, vzorkování nevyžaduje vnější zdroj energie |
|
výsledky v přesných jednotkách koncentrace |
výsledky v některých případech vyžadují přepočet |
|
poměrně drahé |
levné a jednoduché |
|
hlučnost při odběrech a náročné na velikost instalačního prostoru |
nenáročné na prostor, bezhlučné |
Schéma vzorkování vzduchu pomocí aktivních a pasivních vzorkovačů v hodnocených místnostech je uvedeno v tabulce č. 2. Během odběrové kampaně se doporučuje do každé místnosti umístit také detektor CO2, senzor vlhkosti, teploty (vhodný typ např. Wohler CDL210, Wohler, GER) a také zajistit kontinuální měření koncentrací prachových částic v reálném čase pomocí prachoměru (vhodný typ: např. Grimm 11E (Grimm Aerosol Technik, GER)).
Tab. 2: Schéma vzorkování vzduchu
|
Typ vzorkovače |
Typ sorbentu |
Vzorkované látky |
Typ analýzy |
|
Nízkoobjemové aktivní vzorkovače (průtok vzduchu 10 l/min) |
PUF1) a filtr z křemenných mikrovláken pro záchyt částic |
BFRs3) |
Chemická |
|
Toxikologická |
|||
|
PUF1)/XAD2)/PUF a filtr z křemenných mikrovláken pro záchyt částic |
PFCs4) |
Chemická |
|
|
Toxikologická |
|||
|
Pasivní vzorkovače |
PUF disk |
BFRs |
Chemická |
|
Toxikologická |
|||
|
XAD |
PFCs |
Chemická |
|
|
Toxikologická |
|||
|
Nový typ pasivního vzorkovače |
Silikonová pryž |
BFRs |
Chemická |
1) Polyuretanová pěna (typ T3037, Molitan a.s. ČR)
2) XAD pryskyřice (Supelpak-2, Supelco, USA)
3) Bromované zhášeče hoření
4) Perfluorované látky
5) Silikonová pryž (Altesil, Altec, UK)
4.1.1 Nízkoobjemové aktivní vzorkovače
Princip metody: Vzduch nasávaný čerpadlem prochází filtrem z křemenných mikrovláken
(QM-A), na kterém se zachycují prachové částice. Následuje záchyt látek v plynné frakci na sorbent (PUF pro BFRs nebo XAD pryskyřice pro PFCs). Množství vzorkovaného vzduchu je známo podle přečerpaného objemu.
Popis metody: Aktivní odběr vnitřního ovzduší je proveden pomocí nízkoobjemového aktivního vzorkovače s přesně definovaným průtokem (doporučuje se využití vzorkovače BGH 3-12, Obr. 2 nebo typ PM 10-35, Baghirra, ČR), s doporučeným průtokem 10 l/min. Průtok 10 l/min splňuje parametry pro vzorkování vnitřního ovzduší, kdy nedochází k vícenásobnému přečerpání objemu vzduchu dané místnosti. Navíc tento uvedený vzorkovač je velmi vhodný i z hlediska hlukových parametrů.
Při odběrech by mělo být dodržováno pravidlo 10 %: objem vzorku odebraný za 1 hodinu by měl být nižší než objem 10 % přirozené ventilace anebo by měl být menší než 10 % objemu měřené místnosti (ČSN EN ISO 16000-1, 2007, část 1).
Pro jednotlivé místnosti se doporučuje kontinuální odběr pro analýzu cílových polutantů po dobu 14 dní. Pro účely chemické i toxikologické analýzy se doporučuje paralelní vzorkování dvěma sadami vzorkovačů. S cílem nepodhodnotit koncentrace látek ve vzorkovaném ovzduší (i s ohledem na možné další expoziční cesty) je doporučeno využití vzorkovače pro odběr celkového množství suspendovaných částic (tedy odběr frakce TSP).
Postup přípravy vzorkování: Skleněná odběrová patrona pro analýzu BFRs je naplněna dvěma předčištěnými filtry z polyuretanové pěny (PUF filtr) s celkovými rozměry 10 cm (celkem tedy 2 x 5 cm) a průměru 44 mm. Filtry z polyuretanové pěny (Molitan a.s. ČR) jsou přečištěny v Soxhletově extraktoru 8 hodin v acetonu a 8 hodin v dichlormethanu. Po přečištění je nutné filtry vysušit a zabalit do dvou vrstev hliníkové fólie, označit, vložit do uzavíratelného polyetylénového sáčku a do expozice uložit v mrazicím boxu při teplotě -18°C.
Před PUF filtry je předřazen předvážený filtr z křemenných mikrovláken (QM-A) pro záchyt částicové frakce. Skleněná odběrová patrona pro analýzu PFCs je naplněna dvěma PUF filtry s celkovými rozměry 5 cm (celkem tedy 2 x 2,5 cm) a průměrem 44 mm, mezi kterými je vrstva 15 g XAD-2 pryskyřice se skelnou vatou pro jejich mechanickou separaci
(Obr. 3). XAD pryskyřice i PUF filtry jsou přečištěny v Soxhletově extraktoru 8 hodin v acetonu a 8 hodin v methanolu. Po přečištění se pryskyřice vysuší a je až do přípravy vzorkovací patrony uložena v čisté hermeticky uzavřené skleněné lahvi při laboratorní teplotě. Před tuto patronu je pro záchyt částicové frakce předřazen předvážený filtr z křemenných mikrovláken (QM-A).
Postup vzorkování: Ve vybraných místnostech je s ohledem na objem vzorkované místnosti umístěn aktivní vzorkovač s nízkým průtokem vzduchu. Po odběru je patrona v obou případech (BFRs i PFCs) zabalena do dvou vrstev hliníkové fólie, popsána příslušným odběrovým číslem a vložena do uzavíratelného sáčku. QM-A filtr je rovněž označen příslušným kódem, vložen do transportního obalu a po stabilizaci znovu zvážen. Z jeho navážky je následně vypočítána hmotnost prachových částic a až poté je exponovaný filtr analyzován pro zjištění koncentrace cílových analytů. Ke každému vzorku je vyplněn odběrový protokol (vzor odběrového protokolu je Přílohou č. 1 této metodiky). Transport vzorků do laboratoře je proveden pomocí transportní lednice s kontrolovanou teplotou. Exponované vzorky jsou až do zpracování uloženy v mrazicím boxu při teplotě -18°C. Dále jsou filtry zpracovány pro chemickou a toxikologickou analýzu (viz část 5.1 - Chemická analýza a část 5.2 - Toxikologická analýza).

Obr. 2: Nízkoobjemový aktivní vzorkovač.

Obr. 3: Vzorkovací patrona s PUF filtry, mezi kterými je vložená vrstva 15 g XAD-2 pryskyřice (a) Schéma skleněné odběrové patrony (b) pro odběr PFCs (sandwich).
4.1.2 Pasivní vzorkovače
Princip metody: Metoda pasivního vzorkování je založena na samovolné difuzi látek volně přítomných v ovzduší do sběrného média (sorbentu). Pro vzorkování emergentních polutantů ve vnitřním ovzduší se doporučuje používání následujících typů pasivních vzorkovačů:
1) Pasivní vzorkovač s PUF sorbentem (PUF disk) s možností aplikace ze spodní strany otevřeného nebo uzavřeného typu. Uzavřená konstrukce pasivního vzorkovače s PUF diskem se dvěma ochrannými nerezovými miskami je zobrazen na Obr. 4 (Čupr et al., 2015). Typ doporučený pro vzorkování BFRs ve vnitřním prostředí je na Obr 5.
2) Pasivní vzorkovač na bázi silikonové pryže je doplňkovou metodou stanovení BFRs, kdy je plát silikonu volně zavěšen ve vnitřním prostředí.
3) Jako doplňková pasivní vzorkovací metoda pro kvalitativní stanovení PFCs ve vnitřním ovzduší a vzájemné srovnání lokalit se doporučuje využití pasivního vzorkovače na bázi XAD-2 pryskyřice (Obr. 6).
Podrobný popis metody:
1) Pasivní vzorkovač s PUF sorbentem je možné použít v uzavřené (Obr. 4) nebo více otevřené (Obr. 5) variantě. Více otevřená varianta poskytuje vyšší vzorkovací rychlosti sledovaných látek (Venier et al., 2016) a její použití se doporučuje pro vnitřní prostředí a zejména pak pro kombinované chemické a toxikologické analýzy. Pro odběr se doporučuje použít disk z polyuretanové pěny (PUF disk) o průměru 150 mm a výšce 15 mm. PUF disk je předčištěn dle stejné metodiky jako v případě aktivního vzorkování vnitřního ovzduší. Vzorkovače by měly být umístěny, dle daných podmínek jednotlivých místností, v dýchací zóně člověka ve výšce 1 - 2 m.
Doba vzorkování se doporučuje minimálně 28 dní. Při práci se vzorkovači je nutné pracovat v jednorázových rukavicích a používat ochranné pomůcky (laboratorní plášť, ochranné brýle apod.). Zejména při práci se vzorky, které budou sloužit k analýze PFCs není možné používat materiály, které by způsobily kontaminaci vzorků (PTFE - teflon, některé druhy plastů apod.).
PUF disk je následně zabalen do dvou vrstev hliníkové fólie, popsán odběrovým číslem a vložen
do uzavíratelného sáčku. Ke každému vzorku je vyplněn odběrový protokol (vzor odběrového protokolu je Přílohou č. 1 této metodiky). Transport vzorků do laboratoře je prováděn pomocí transportní lednice s monitorovanou teplotou. Exponované vzorky jsou až
do zpracování uloženy v mrazicím boxu při teplotě -18°C. Celkový počet použitých vzorkovačů je koncipován s ohledem na sledované látky a plánované finální analýzy (chemické nebo/i toxikologické).
2) Pasivní vzorkovač na bázi silikonové pryže.
Pro stanovení BFRs ve vnitřním ovzduší se doporučuje také využití elastomeru - silikonové pryže (např. Altesil). Tato metoda je na základě optimalizačního měření doporučena jako doplňková metoda pro stanovení koncentrací látek v plynné fázi, speciálně pro bromované zhášeče hoření ve vnitřním prostředí. Metoda slouží pro srovnání relativní kontaminace sledovaných lokalit, vzorků a odběrových časů. Doporučená doba expozice je minimálně 28 dní, po této době je principielně možné detekovat koncentrace BFRs v ovzduší v jednotkách pg/m3. Vzorkování je pro většinu látek integrativní, tzn., že při konstantní koncentraci sledované látky v ovzduší dochází ke zvyšování vzorkovaného množství látky s dobou expozice.
Silikonová pryž s tloušťkou 0,5 mm je po nařezání na požadovanou velikost (doporučuje se alespoň 15 × 30cm) a vytvoření instalačních otvorů předčištěna. Oligomerní látky nacházející se v silikonové pryži jsou odstraněny pomocí Soxhletovy extrakce ethylacetátem po dobu minimálně 48 hodin a následného vytřepání pryže v methanolu po dobu minimálně 24 hodin. Pláty silikonové pryže jsou následně vloženy do skleněné lahve s uzávěrem doplněným septem z hliníkové fólie a uloženy v mrazicím boxu při teplotě -20°C. Při vzorkování je plát silikonové pryže volně zavěšen (např. na silonové niti nebo ocelovém drátu) v ovzduší v místnosti v dýchací zóně člověka po dobu minimálně 28 dní. Po této době jsou exponované pláty pryže uloženy do skleněné lahve s víčkem vyloženým hliníkovým septem a popsány odběrovým číslem. Ke každému vzorku je vyplněn odběrový protokol (vzor odběrového protokolu je Přílohou č. 1 této metodiky). Transport vzorků do laboratoře je proveden pomocí transportní lednice s monitorovanou teplotou (pomocí záznamníku teploty), ideálně by teplota měla být nižší než 7°C. Exponované vzorky jsou až do zpracování uloženy v mrazicím boxu při teplotě -18°C.
3) Vzorkování PFCs pomocí vzorkovače na bázi XAD-2 pryskyřice.
XAD-2 pryskyřice (XAD®-2; Supelpak™-2; 21130-U SUPELCO) (Obr. 6) je vložena do vzorkovače z nerezové oceli s vhodnou porozitou síta vzhledem ke struktuře XAD (ukázka vzorkovače je na Obr. 7). Doporučuje se tvar vzorkovače přizpůsobit tak, aby poměr plochy k objemu byl co nejvyšší (kvůli sorpci perfluorovaných látek zejména v povrchové vrstvě pryskyřice, která je nejvíce v kontaktu se vzduchem). Vzorkovací plocha by měla být minimálně 125 cm2. Vzorkovače jsou dle daných podmínek jednotlivých místností instalovány v dýchací zóně člověka. Minimální doba vzorkování je 28 dní. Po expoziční době jsou vzorkovače zabaleny do dvou vrstev hliníkové fólie, popsány odběrovým číslem a vloženy do uzavíratelného sáčku (bez obsahu PTFE). Ke každému vzorku je vyplněn odběrový protokol (vzor odběrového protokolu je Přílohou č. 1 této metodiky). Transport vzorků je pak dále zajištěn pomocí transportní lednice s monitorovanou teplotou. Exponované vzorky jsou až do zpracování uloženy v mrazicím boxu při teplotě -18°C.

Obr. 4: Vlevo - Pasivní vzorkovač s PUF diskem, uzavřená varianta. Vpravo - schéma pasivního vzorkovače. Dvě misky z nerezové oceli spojené kovovou osou, která slouží k uchycení vzorkovače a ukotvení sorbentového disku uvnitř vzorkovače. Rozdílná velikost misek umožňuje volné proudění vzduchu kolem sorbentu a difuzi látek.

Obr. 5: Pasivní vzorkovač s PUF diskem, instalace ve vnitřním prostředí, pro které je doporučená otevřená varianta (odkrytá spodní nerezová miska; horní miska zabraňuje gravitačnímu usazování prachových částic na povrchu PUF disku).

Obr. 6: XAD-2 pryskyřice připravena na laboratorní analýzu.

Obr. 7: XAD vzorkovač pro vzorkování PFCs.
4.1.3 Vzorkování prachových částic
Princip metody: Prachové částice jsou zachytávány pomocí filtru, který je umístěn ve vzorkovací hlavici nainstalované na hadici vysavače.
Postup: Odběr prachových částic z jednotlivých povrchů místností je proveden pomocí běžně dostupného vysavače, doplněného o odběrovou hlavici s předseparační nerezovou mřížkou, za kterou je instalován filtr z křemenných mikrovláken QM-A o průměru 70 mm (Obr. 8). Tento filtr je před samotným odběrem předvážen.
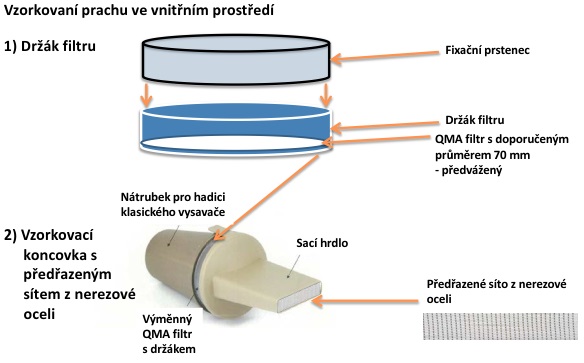
Obr. 8: Odběrová hlavice pro vzorkování prachu ve vnitřním prostředí.
Po instalaci filtru do odběrové hlavice je proveden odběr z jednotlivých povrchů místností. Výběr vzorkovaných ploch je prováděn s ohledem na cíle studie (sledování expozice, zdrojů znečištění, variability sledovaných látek v prostředí apod.), a také s ohledem na detekční limity sledovaných látek.
Doporučuje se odběr z plochy 10 - 20 m2, při plánování odběrového schématu je potřeba přizpůsobit velikost vzorkované plochy celkové velikosti místnosti a cílům studie. Sledovaným parametrem je velikost vzorkované plochy a hmotnost vzorkovaného prachu, protože množství odebraného prachu je závislé na velikosti sledované plochy a také na druhu podlahové krytiny. Odběry prachu je vhodné provádět až po ukončení vzorkovací kampaně aktivními a pasivními vzorkovači. Po odběru je filtr zabalen do dvou vrstev hliníkové fólie, popsán a vložen do přepravní skleněné lahve. Ke každému vzorku je vyplněn odběrový protokol (vzor odběrového protokolu je Přílohou č. 1 této metodiky). Po transportu do laboratoře je filtr po stabilizaci zvážen a až do analýzy uložen v mrazicím boxu při teplotě -18°C. Po odběru jsou vzorky upraveny pro chemickou a toxikologickou analýzu.
5. Zpracování vzorků a laboratorní analýzy
5.1 Chemické analýzy
Chemická analýza emergentních polutantů je závislá na typu cílových analytů.
5.1.1 Bromované látky
V případě analýzy bromovaných látek je vzorkovací matrice (PUF, QM-A, prach, silikonová pryž, atd.) v prvním kroku podrobena extrakci automatickým extrakčním systémem Büchi B-811 (Obr. 9). Vzorky jsou před vlastní extrakcí obohaceny roztokem extrakčních standardů. Pro extrakci bromovaných látek (PBDEs + HBCD) je použit nepolární typ rozpouštědla (např. a) cca 150 ml dichlormethanu, hexanu pro PUF, QM-A, prach; b) cca 150 ml acetonitrilu, methanolu pro silikonovou pryž). Samotná extrakce pomocí automatického extraktoru probíhá 1 hodinu a to ve dvou krocích (40 minut samotná extrakce vzorku horkým rozpouštědlem v Soxhletu, 20 minut promývání rozpouštědlem). Po ukončení extrakce se vzorek zkoncentruje na objem menší než 10 ml, převede se do hexanu, kvantitativně se převede do vialky a odpaří pod proudem dusíku na objem cca 1 - 2 ml. Čistění extraktu je realizováno pomocí sloupcové chromatografie s použitím aktivního sorbentu (Obr. 10). Nejčastěji se používá předčištěný aktivovaný silikagel (čištění použitím Soxhletu v dichlormethanu po dobu 8 hodin a aktivace v muflové peci po dobu 8 hodin při teplotě 130°C), čištěný silikagel modifikovaný kyselinou sírovou (22 ml koncentrované H2SO4 + 50 g aktivovaného silikagelu) a čištěný silikagel modifikovaný hydroxidem draselným (56 g KOH rozpuštěno ve 300 ml methanolu v baňce s plochým dnem o objemu 750-500 ml, promícháno na magnetické míchačce po dobu 1 - 2 hod při 60 - 70°C, následná dekantace a propláchnutí 2x 100 ml methanolu, 1x 100 ml dichlormethanu, sorbent je usušen v digestoři rozprostřený na hliníkové fólii, poté aktivován při 200°C po dobu 8 hod. v muflové peci).
Čistící kolona je používána v tomto uspořádání: 1 cm vrstvy čištěného aktivovaného silikagelu, 2 g silikagelu modifikovaného KOH, 1 cm vrstvy čištěného aktivovaného silikagelu modifikovaného kyselinou sírovou, 1 - 2 cm vrstvy neaktivovaného čištěného silikagelu. Na takto připravenou kolonu se kvantitativně aplikuje vzorek pomocí Pasteurovy pipety. Eluce se provádí 40 ml 50% směsi dichlormethan/hexan do 40 ml vialky. Vzorek je opět zakoncentrován pod proudem dusíku na finální objem 50 µl, převeden do označené minivialky a poté je přidán vnitřní standard pro bromovaný typ látek. Finálním instrumentálním krokem je plynová chromatografie s vysokorozlišovací hmotností spektrometrií (GC/HRMS).

Obr. 9: Automatický extrakční systém Büchi B-811.

Obr. 10: Sloupcová chromatografie s použitím aktivního sorbentu.
5.1.2 Perfluorované látky
V případě analýzy perfluorovaných látek je vzorkovací matrice (PUF, XAD, QM-A, prach, atd.) v prvním kroku podrobena rovněž extrakci automatickým extrakčním systémem (Obr. 9).
Vzorky jsou před vlastní extrakcí obohaceny roztokem izotopicky značených extrakčních standardů. Extrakce perfluorovaných látek je provedena pomocí polárního rozpouštědla (např. cca 200 ml methanolu a přídavkem octanu amonného - 1 g octanu amonného na 2,5 l methanolu). Samotná extrakce probíhá 1 hodinu ve dvou krocích (40 minut samotná extrakce vzorku horkým rozpouštědlem v Soxhletu, 20 minut promývání rozpouštědlem). Po ukončení extrakce se vzorek zkoncentruje na objem menší než 10 ml, kvantitativně se převede do vialky a odpaří pod proudem dusíku na objem cca 1 - 2 ml. Další kroky analýzy jsou závislé od míry znečištění vzorků. Pro mírně znečištěné vzorky se využívá filtrace vzorků pomocí nylonových stříkačkových filtrů, pro více znečištěné vzorky extrakce pevným sorbentem (SPE, OASIS WAX). Pro odstranění pevných nečistot je možné použít centrifugaci. Po konečném zakoncentrováním vzorků je finálním instrumentálním krokem kapalinová chromatografie s hmotnostní detekcí (HPLC/MS/MS).
5.1.3. Analýza dat
Množství látek odebraných pomocí vzorkovacích systémů (aktivních i pasivních) využívajících sorbenty nebo filtry na bázi PUF, QM-A, XAD-2 a silikonu je přepočteno na hmotnostní jednotky sledovaných látek a objemovou jednotku měřeného vzduchu (zpravidla m3) podle Přílohy č. 2 této metodiky. Pasivní vzorkování PFCs pomocí XAD-2 pryskyřice je vhodnou doplňkovou metodou k aktivnímu vzorkování pro potřeby kvalitativní analýzy a srovnání lokalit.
Množství látek ve filtrech z křemenných mikrovláken se doporučuje vyjádřit jako hmotnost sledované látky na hmotnostní jednotku prachu (přepočtenou podle hmotnosti filtru před a po expozici). Naměřené množství látek odebraných vysavačem se doporučuje vyjádřit jako hmotnost látky na hmotnostní jednotku prachu a i na jednotku plochy vzorkovaného povrchu. Všechny doporučené přepočty jsou součástí Přílohy č. 2 této metodiky.
5.1.4. Zajištění a řízení kvality (QA/QC)
Pro zabezpečení kvality vzorkování ve vnitřním prostředí je zapotřebí řada opatření řízení kvality. Patří mezi ně analýza rozpouštědel a použitých činidel (činidel pro slepé stanovení), kontroly, terénní kontroly a postupy pro určení výtěžnosti. Porovnání činidel pro slepé stanovení, laboratorních a terénních kontrol může pomoci identifikovat možné zdroje kontaminace a podniknout opatření potřebná k zajištění kvality. Pravidla zajištění a řízení kvality jsou detailně popsána v odborném článku Taverniers et al. (2004) a v normě ČSN EN 15549.
5.2 Toxikologické analýzy
V případě toxikologických analýz se vzorky extrahují paralelně se vzorky učenými pro chemickou analýzu, dle postupu z kapitoly 5.1.1 a 5.1.2. Není však možné použít žádné interní standardy. Po kvantitativním převedení do vialky se vzorky předají k toxikologické analýze.
Pro hodnocení toxického potenciálu vzorků vnitřního prostředí je nutné zvolit baterii testů, která je relevantní pro:
-
danou hodnocenou lokalitu
-
zvolenou primární matrici externí expozice
-
hlavní hodnocenou expoziční cestu
-
hodnocený typ látek, na který je daná studie zaměřena
Doporučenými biotesty pro sledování toxického potenciálu látek z vnitřního prostředí jsou testy založené na buněčných modelech lidského původu, které poskytují informace s vyšší relevancí ohledně působení látek a směsí na lidské zdraví. Narušení signálování receptorů (estrogenní, androgenní, aryl-hydrokarbonový, thyroidní receptor) hraje zásadní roli v celé řadě škodlivých účinků emergentních polutantů, zejména v endokrinní disrupci.
Pro látky ze skupiny emergentních polutantů je v této metodice doporučeno využití biotestů hodnotících estrogenní a antiestrogenní aktivitu, androgenní a antiandrogenní aktivitu a toxicitu dioxinového typu směsí polutantů v odebraných vzorcích. Tyto biotesty byly vybrány i z toho důvodu, že detekují polutanty s nejčastěji diskutovanými mechanismy účinku. S ohledem na rostoucí počet emergentních polutantů, které mohou působit i jinými mechanismy účinku, je vhodné sadu biotestů pro studie zatížení vnitřního prostředí rozšířit i o biotesty pro hodnocení thyroidní aktivity a biotest pro hodnocení cytotoxicity vzorků vůči buňkám dýchací soustavy. Tyto biotesty charakterizují celkový potenciál látek ve vzorku působit specifickými mechanismy toxicity, jejichž výsledky reflektují i působení neanalyzovaných látek a spolupůsobení celé směsi.
Pro detekci přítomnosti látek se specifickými mechanismy účinku ve vzorcích je třeba používat citlivé biodetekční systémy. Tato metodika uvádí příklady buněčných modelů vhodných pro studie zatížení vnitřního prostředí. Hodnocení estrogenní a antiestrogenní aktivity vzorků je prováděno za využití buněčné linie HeLa9903 připravené z lidské buněčné linie karcinomu děložního čípku HeLa transfekcí genem pro luciferázu pod kontrolou estrogenního receptoru (Ono, 2012). Alternativně je také používána buněčná linie MVLN připravená z lidské buněčné linie prsního karcinomu MCF-7 analogickou transfekcí genem pro luciferázu (Demirpence et al., 1993). Hodnocení androgenní a antiandrogenní aktivity vzorků je prováděno za využití buněčné linie MDA-kb2 připravené z lidské buněčné linie prsního karcinomu MDA-MB-453 transfekcí genem pro luciferázu pod kontrolou androgenního a glukokortikoidního receptoru (Wilson et al., 2002). Pro odlišení androgenní aktivity od možné glukokortikoidní aktivity je potenciální androgenní aktivita potlačena přidáním antiandrogenní látky flutamidu. Hodnocení toxicity dioxinového typu je prováděno za využití buněčné linie AZ-AHR připravené z lidské buněčné linie jaterního karcinomu HepG2 transfekcí genem pro luciferázu pod kontrolou aryl-hydrokarbonového receptoru (Novotna et al., 2011). Hodnocení thyroidní aktivity vzorků je prováděno za využití buněčné linie PZ-TR připravené z lidské buněčné linie jaterního karcinomu linie HepG2 transfekcí genem pro luciferázu, jehož exprese je řízena thyroidním receptorem (Illés et al., 2015). Pro detailní hodnocení cytotoxického potenciálu vzorků je využívána buněčná linie lidského bronchiálního epitelu BEAS-2B (Ovrevik et al., 2010). Principem biodetekce je fluorimetrické stanovení životaschopnosti buněk exponovaných testovaným vzorkům. Přehled všech těchto biotestů je uveden v tabulce č. 3.
Tab. 3 Příklady vhodných biotestů pro hodnocení toxicity vzorků vnitřního prostředí.
|
Studovaný efekt |
Označení buněčné linie |
Charakterizace buněčné linie |
Princip biodetekce |
|
Androgenní a antiandrogenní aktivita |
MDA-Kb2 |
Lidská buněčná linie prsního karcinomu připravená z linie MDAMB-453 transfekcí genem pro luciferázu. |
Luminometrické stanovení luciferázy exprimované po aktivaci androgenního receptoru. |
|
Estrogenní a antiestrogenní aktivita |
MVLN |
Lidská buněčná linie prsního karcinomu připravená z linie MCF-7 transfekcí genem pro luciferázu. |
Luminometrické stanovení luciferázy exprimované po aktivaci estrogenního receptoru. |
|
HeLa9903 |
Lidská buněčná linie karcinomu děložního čípku připravená z linie HeLa transfekcí genem pro luciferázu. |
Luminometrické stanovení luciferázy exprimované po aktivaci estrogenního receptoru. |
|
|
Aktivita dioxinového typu |
AZ-AHR |
Lidská buněčná linie jaterního karcinomu připravená z linie HepG2 transfekcí genem pro luciferázu. |
Luminometrické stanovení luciferázy exprimované po aktivaci aryl-hydrokarbonového receptoru. |
|
Thyroidní aktivita |
PZ-TR |
Lidská buněčná linie jaterního karcinomu připravená z linie HepG2 transfekcí genem pro luciferázu. |
Luminometrické stanovení luciferázy exprimované po aktivaci thyroidního receptoru. |
|
Cytotoxicita |
BEAS-2B |
Lidská buněčná linie bronchiálního epitelu. |
Fluorimetrické stanovení životaschopnosti buněk exponovaných testovaným vzorkům. |
5.2.2 Principy biodetekce u použité sady biotestů
Principem biodetekce za použití všech výše zmíněných transgenních buněčných linií je luminometrické stanovení luciferázy exprimované po aktivaci příslušného receptoru (Obr. 11). Kvantifikace přítomných polutantů se specifickým mechanismem účinku se provádí vyjádřením v ekvivalentech koncentrace modelové látky. Například při hodnocení estrogenity (linie HeLa9903 nebo MVLN) je modelovým estrogenem 17β-estradiol a množství látek ve vzorku působících estrogenním mechanismem účinku se vyjadřuje v ekvivalentech koncentrace této modelové látky, například v pg/m3 EEQ (EEQ = ekvivalent 17β-estradiolu), která by způsobila stejný účinek jako testovaný vzorek. Analogicky to platí i pro ostatní typy mechanismů účinku: androgenita vzorku se vyjadřuje v ekvivalentech koncentrace modelového androgenu dihydrotestosteronu (linie MDA-kb2). Toxicita dioxinového typu vzorku se vyjadřuje v ekvivalentech koncentrace modelové látky 2,3,7,8-tetrachlordibenzo-p-dioxinu (TCDD), tedy v tzv. toxických ekvivalentech (BIOTEQ). Thyroidní aktivita vzorku se vyjadřuje v ekvivalentech koncentrace modelového thyroidního hormonu trijodtyroninu (T3). Antagonistické účinky vzorků se hodnotí tak, že společně s testovaným vzorkem jsou buňky koexponovány i střední efektivní koncentrací (EC50) modelové látky příslušné pro daný typ mechanismu účinku. Například při stanovení antiestrogenní aktivity vzorku je modelovým estrogenem již zmíněný 17β-estradiol, který se přidává k testovanému vzorku v koncentraci 33 pmol/l (tato koncentrace přibližně odpovídá hodnotě EC50). Antiestrogenní efekt je pak vyjádřen jako ekvivalent koncentrace modelového antiestrogenu fulvestrantu. Stejný přístup se využívá i při hodnocení dalších typů antagonistických účinků, např. antiandrogenita vzorků se vyjadřuje jako ekvivalent modelového antiandrogenu flutamidu. Cytotoxicita vzorků stanovovaná pomocí linie BEAS-2B je vyjádřena jako index cytotoxicity, tj. inverzní hodnota koncentrace vzorku IC20 či IC50 vyvolávající 20% resp. 50% pokles životaschopnosti buněk vůči kontrole. V případě toxicity dioxinového typu se antagonistické účinky nestanovují, protože není znám žádný významný endogenní ligand, vzhledem ke kterému by se antagonistické účinky stanovovaly.
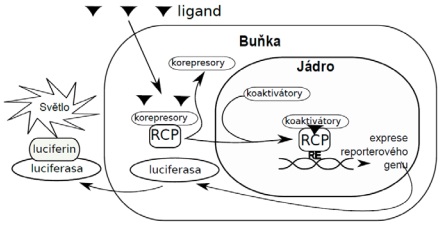
Obr. 11 Princip funkce biotestu s reportérovým genem. Ligand prochází přes buněčnou membránu a váže se na receptor (RCP). Aktivovaný receptor je přenesen do buněčného jádra, kde spouští expresi genů spojených s příslušným responzivním elementem (RE). Dochází k expresi genu pro luciferázu, jejíž množství je stanoveno luminometricky po přídavku luciferinu.
5.2.3 Aplikace sady biotestů
Práce se všemi biotesty vyžaduje zkušené pracovníky a zajištění sterilního prostředí - laminární boxy, sterilní kultivační média i veškerý laboratorní materiál.
Vzhledem k možnosti testování většího počtu vzorků, kdy se navíc každý vzorek testuje nezávisle nejméně dvakrát, pokaždé nejméně v pěti koncentračních hladinách a každá koncentrační hladina v triplikátu, je testování prováděno v 96-jamkových mikrodeskách. Kvůli možné přítomnosti cytotoxických látek ve vzorku je nutné každou biotestovou analýzu doplnit o hodnocení životaschopnosti (viability) exponovaných buněk. Tento krok je důležitý z důvodu eliminace falešně pozitivních výsledků, které by mohly být mylně přisuzovány antagonistickým efektům (kdy pokles specifické buněčné odpovědi může být způsoben cytotoxicitou vzorku a nikoliv přítomností polutantů se specifickou antagonistickou aktivitou). Použitým testem viability je např. Calcein AM (Brack et al., 2016), kdy v živých buňkách dochází k hydrolýze nefluorescenčního Calcein AM na zeleně fluoreskující Calcein. Toto fluorimetrické testování životaschopnosti se provádí na stejných buňkách, na kterých se následně luminometricky měří specifická buněčná odpověď. Toto platí pro všechny biotesty s transgenními buněčnými liniemi vyjma linie BEAS-2B. U této linie je konečným stanovovaným efektem cytotoxicita vzorků, která se měří třemi způsoby - zmíněnou metodou Calcein AM, dále pak metodami AlamarBlue® a NR-uptake (Brack et al., 2016; Schreer et al., 2005). Princip testu s AlamarBlue® spočívá v redukci nefluoreskujícího modrého barviva resazurinu na fluoreskující resorufin, což probíhá pouze v živých buňkách. Princip testu NRuptake spočívá v aktivním příjmu barviva neutrální červeně do lysozomů živých buněk, kde po opláchnutí zbytkové barvy a lýzi buněk lze spektrofotometricky stanovit míru životaschopnosti populace buněk v dané jamce 96-jamkové desky a tím odlišit cytotoxické a necytotoxické koncentrace vzorků.
6. Dotazníkové šetření
Dotazníkové šetření je důležitou součástí environmentálně expozičních studií (Nieuwenhuijsen, 2015). Metody vzorkování vnitřního prostředí je potřeba vhodně doplnit, kvalifikovat a kvantifikovat pomocí cílených otázek, maximálně pokrývajících možné expoziční cesty sledovaných látek, s přihlédnutím k délce možné expozice.
Dotazníkových metod existuje několik a každá má své přednosti i limitace. Dotazníky s vlastní administrací samotnými účastníky studie jsou nejlevnější a relativně jednoduchou formou získávání potřebných informací. Tento typ dotazníků může mít občas sníženou výpovědní hodnotu, z důvodu horší schopnosti účastníků rozpomenout se na jednotlivé detaily z historie (Brøgger et al., 2002). Nejdůležitější a zároveň nejtěžší částí tvorby dotazníku je správná formulace otázek, kdy nepochopení nebo špatné pochopení otázky vede k zavádějícím výsledkům, které špatně interpretují výsledky monitorovacích dat. Struktura otázek byla vytvořena s přihlédnutím k co největší srozumitelnosti (White et al., 2008) a jejich formulace byla testována na nezávislých pracovnících centra RECETOX. Množství otázek musí být korigováno přístupem „Nedotazuji se na něco, pro co později nebude konkrétní využití“. Nadměrné množství otázek vždy vede k nízké vyplněnosti dotazníků a snaze účastníků zjednodušit si odpovídání. Dotazník byl proto vytvořen, tak aby byl co nejvíce intuitivní. U menších studií by měl být dotazník předáván osobně s případnými vysvětlujícími detaily, což významně zvyšuje kvalitu šetření (Edwards et al., 2002). Z důvodů obtíží při vyhodnocování tzv. otevřených otázek (Teschke et al., 1994) byla otevřená otázka vytvořena pouze jedna, ostatní otázky jsou tzv. uzavřené, ať už formou výběru přednastavených odpovědí, označení frekvencí nebo celočíselných vyjádření. Dotazník je zaměřen na měřící kampaň kratšího rozsahu a soustřeďuje se významně, ale nejenom, na expozici v blízké minulosti. U větších epidemiologických studií nelze z časových důvodů provést metodu osobního nebo telefonního rozhovoru (Nieuwenhuijsen, 2015), proto je také tento dotazník připraven s ohledem k jeho budoucímu využití v podobných výzkumech. Po vyplnění dotazníku je vhodné s účastníky provést rozhovor týkající se jednotlivých částí vytvořeného dotazníku, čímž může dojít k jeho dalšímu zkvalitnění. Dotazník je navíc vytvořen s možností jednoduchého rychlého převodu do elektronické formy, která je stále víc využívána při moderních výzkumech.
Vzorové dotazníky vytvořené pro potřeby vzorkování popsaného v této metodice jsou uvedeny jako přílohy č. 3, 4 a 5 této metodiky. Dotazníky jsou vytvořeny ve třech variantách, které reflektují specifika odlišných lokalit. Nejobsáhlejší je dotazník pro domácnosti („Fortnight_varHome“, příloha č. 3), jelikož v domácnosti je největší množství různých typů expozic a k nim asociovaných vzorců chování. Další dva dotazníky jsou o téměř polovinu kratší, specifické pro kanceláře („varOffice“, příloha č. 4) a přednáškové místnosti/školní třídy („varRoom“ příloha č. 5). Každý dotazník obsahuje úvodní stránku, kde je tazatel názorně seznámen s pokyny k vyplnění odpovědí.
Tvorba dotazníků (přílohy č. 3, 4 a 5 této metodiky) byla založena na zkušenostech autorů z epidemiologických studií, na základě kontaktu se zahraničními pracovišti a metodice existujících kvalitních sledování expozic. Jejich výčet je uveden v následujícím seznamu:
-
Longitudinální studie ELSPAC-CZ, Česká Republika (http://www.elspac.cz/)
-
Longitudinální studie ALSPAC, Velká Británie (http://www.bristol.ac.uk/alspac/)
-
Longitudinální studie MoBA, Norsko (https://www.fhi.no/en/studies/moba/)
-
Expoziční dotazník ATDSR, USA (http://www.atsdr.cdc.gov/emes/index.html)
-
Marie Curie InitialTraining Network A-TEAM (http://www.ateamresearch.com/projects.php)
-
Studie znečištění vnitřního ovzduší, SZÚ, Česká Republika (http://www.szu.cz/uploads/documents/chzp/ovzdusi/Vnitrni_ovzdusi/indoor_2015_2016/Projekt_Indoor_2015_2016_akt_2_10.pdf)
-
SINPHONIE, komplexní výzkumný projekt, EU (http://www.sinphonie.eu/)
Skupiny otázek charakterizují časový harmonogram respondentů, detailního popisu místa vnitřního prostředí, účastníka a místa, kde probíhá studie.
Z etických důvodů je nutné používat v dotaznících pouze jejich kódové označení. Kódový klíč musí být uložen samostatně.
Data z vyplněných dotazníků je nejvhodnější ukládat elektronicky a dále vyhodnocovat pomocí statistických softwarů (SPSS, R, apod.). Otázky Ano/Ne klíčovat 1/0, číselné otázky (plochy, stáří apod.) ponechat, kategorické otázky rozdělit dle sledované expozice (větrání, užívání různých prostředků apod.) a ke jmenným otázkám (povolání apod.) volit vhodné referenční hodnoty nebo je porovnávat jednu po druhé.
Vytvořený dotazník je důležitou součástí propojení, kvantifikace a kvalifikace jednotlivých metod vzorkování. Dotazník, díky svému zpracování, může sloužit jako šablona pro jakékoliv vědecké projekty týkající se obdobných záměrů. Jeho nastavení na transfer do on-line verze může navíc snížit náklady studií (Hohwü et al., 2013). Podle zaměření studie lze některé otázky vypustit či přidat. Pokud nás například zajímá pouze domácnost, lze vynechat některé otázky ohledně práce jednotlivce, jízdy do práce a užívané kosmetiky.
Vytvořené dotazníky jsou součástí Certifikované metodiky, Přílohy č. 3, 4, 5.
7. Zpracování a využívání dat o kontaminaci vnitřního prostředí
Naměřená data je vhodné ukládat do centrální databáze GENASIS (www.genasis.cz) - výkonného a moderního globálního informačního systému pro uchování, sdílení, společnou prezentaci a další využití dat o výskytu a efektech toxických látek. GENASIS je nástroj, který v České republice významně přispívá k plnění úkolů vycházejících z Národního implementačního plánu v oblasti zpracování, prezentace a využívání dat o kontaminaci životního prostředí (Borůvková et al., 2016).
8. Cílová skupina potenciálních uživatelů
Tato metodika má pomoci realizovat odborné studie s cílem korektního hodnocení zdravotních rizik člověka, plynoucích z expozice emergentními polutanty ve vnitřním prostředí. Metodika je totiž specificky zaměřena na bromované zhášeče hoření (BFRs), kam patří polybromované difenylethery (PBDEs) a hexabromcyklododekan (HBCD) a druhou skupinou látek jsou perfluorované látky (PFCs) - perfluorooktansulfonát (PFOS) a perfluorooktanová kyselina (PFOA). Z tohoto specifického zaměření na tyto emergentní látky plyne podstata novosti metodiky. Při její realizaci pak výsledky umožňují základní charakterizaci příspěvků externí expozice, možných toxikologických efektů a také možnou identifikaci zdrojů znečištění těmito látkami. Je určena pro firmy a instituce zabývající se kvalitou a znečištěním vnitřního prostředí. V podmínkách ČR jsou to zejména výzkumné instituce, zdravotní ústavy, výrobci, zaměstnavatelé, místní samosprávy, hygienické stanice a společnosti zodpovědné za kvalitu a hygienický stav užívaných staveb.
Literatura
Barber, J.L., Berger, U., Chaemfa, C., Huber, S., Jahnke, A., Temme, C., Jones, K.C., 2007. Analysis of per- and polyfluorinated alkyl substances in air samples from Northwest Europe. J. Environ. Monit. 9, 530-541. doi:10.1039/b701417a
Borůvková, J., Gregor, J., Šebková, K., Bednářová, Z., Kalina, J., Hůlek, R., Dušek, L., Holoubek, I., Klánová, J., 2016. GENASIS-Global Environmental Assessment and Information System [WWW Document]. URL http://www.genasis.cz. (accessed
11.11.16).
Brack, W., Ait-Aissa, S., Burgess, R.M., Busch, W., Creusot, N., Di Paolo, C., Escher, B.I., Mark Hewitt, L., Hilscherova, K., Hollender, J., Hollert, H., Jonker, W., Kool, J., Lamoree, M., Muschket, M., Neumann, S., Rostkowski, P., Ruttkies, C., Schollee, J., Schymanski, E.L., Schulze, T., Seiler, T.B., Tindall, A.J., De Aragão Umbuzeiro, G., Vrana, B., Krauss, M., 2016. Effect-directed analysis supporting monitoring of aquatic environments - An in-depth overview. Sci. Total Environ. 544, 1073-1118. doi:10.1016/j.scitotenv.2015.11.102
Brøgger, J., Bakke, P., Eide, G.E., Gulsvik, A., 2002. Comparison of telephone and postal survey modes on respiratory symptoms and risk factors. Am. J. Epidemiol. 155, 572- 576.
ČSN EN ISO 16000-1, 2007. Česká technická norma.
Čupr, P., Prokeš, R., Přibylová, P., Chropeňová, M., Vaňková, L., Kalina, J., Šebková, K., Holoubek, I., Klánová, J., 2015. Pasivní vzorkování volného ovzduší - certifikovaná metodika (Nmet). Masaryk. univerzita, RECETOX. RECETOX Rep. No. 547.
Demirpence, E., Duchesne, M.J., Badia, E., Gagne, D., Pons, M., 1993. MVLN Cells - a Bioluminescent MCF-7-Derived Cell-Line to Study the Modulation of Estrogenic Activity. J. Steroid Biochem. Mol. Biol. 46, 355-364.
Edwards, P., Roberts, I., Clarke, M., DiGuiseppi, C., Pratap, S., Wentz, R., Kwan, I., Edwards, P., Clarke, M., DiGuiseppi, C., Pratap, S., Roberts, I., Wentz, R., Egger, M., Smith, G.D., Schneider, M., Minder, C., Clarke, M.J., Stewart, L.A., Schulz, K.F., Chalmers, I., Hayes, R.J., Altman, D.G., Engels, E.A., Schmid, C.H., Terrin, N., Olkin, I., Lau, J., Edwards, P., Roberts, I., Clarke, M., DiGuiseppi, C., Pratap, S., Wentz, R., Kwan, I., 2002. Increasing response rates to postal questionnaires: systematic review. BMJ 324, 1183. doi:10.1136/bmj.324.7347.1183
Geissen, V., Mol, H., Klumpp, E., Umlauf, G., Nadal, M., van der Ploeg, M., van de Zee, S.E. a. T.M., Ritsema, C.J., 2015. Emerging pollutants in the environment: A challenge for water resource management. Int. Soil Water Conserv. Res. 3, 57-65. doi:10.1016/j.iswcr.2015.03.002
Hohwü, L., Lyshol, H., Gissler, M., Jonsson, S.H., Petzold, M., Obel, C., 2013. Web-based versus traditional paper questionnaires: a mixed-mode survey with a Nordic perspective. J. Med. Internet Res. 15, e173. doi:10.2196/jmir.2595
Illés, P., Brtko, J., Dvořák, Z., 2015. Development and Characterization of a Human Reporter Cell Line for the Assessment of Thyroid Receptor Transcriptional Activity: A Case of Organotin Endocrine Disruptors. J. Agric. Food Chem. 63, 7074-83. doi:10.1021/acs.jafc.5b01519
Kim, S.K., Shoeib, M., Kim, K.S., Park, J.E., 2012. Indoor and outdoor poly- and perfluoroalkyl substances (PFASs) in Korea determined by passive air sampler. Environ. Pollut. 162, 144-150. doi:10.1016/j.envpol.2011.10.037
Klánová, J., Kohoutek, J., Hamplová, L., Urbanová, P., Holoubek, I., 2006. Passive air sampler as a tool for long-term air pollution monitoring: Part 1. Performance assessment for seasonal and spatial variations. Environ. Pollut. 144, 393-405. doi:10.1016/j.envpol.2005.12.048
Nieuwenhuijsen, M.J., 2015. Exposure Assessment in Environmental Epidemiology. Oxford University Press, New York. doi:10.1093/med/9780199378784.001.0001
Novotna, A., Pavek, P., Dvorak, Z., 2011. Novel stably transfected gene reporter human hepatoma cell line for assessment of aryl hydrocarbon receptor transcriptional activity: Construction and characterization. Environ. Sci. Technol. 45, 10133-10139. doi:10.1021/es2029334
Ono, A., 2012. Stably Transfected Estrogen Receptor Alpha Transactivation Assay Using HeLa9903 Cell Line as In Vitro Method to Screen the Endocrine Disruption Potentials of Chemicals. Vitr. Cell. Dev. Biol. 48, 13.
Ovrevik, J., Arlt, V.M., Oya, E., Nagy, E., Mollerup, S., Phillips, D.H., Låg, M., Holme, J.A., 2010. Differential effects of nitro-PAHs and amino-PAHs on cytokine and chemokine responses in human bronchial epithelial BEAS-2B cells. Toxicol. Appl. Pharmacol. 242, 270-80. doi:10.1016/j.taap.2009.10.017
Sarigiannis, D.A., 2015. Environmental Indicators, in: Armon, H.R., Hänninen, O. (Eds.), . Springer Netherlands, Dordrecht, pp. 827-841. doi:10.1007/978-94-017-9499-2{_}46
Shoeib, M., Harner, T., 2002. Characterization and comparison of three passive air samplers for persistent organic pollutants. Environ. Sci. Technol. 36, 4142-4151. doi:10.1021/es020635t
Schlummer, M., Gruber, L., Fiedler, D., Kizlauskas, M., Müller, J., 2013. Detection of fluorotelomer alcohols in indoor environments and their relevance for human exposure. Environ. Int. 57-58, 42-49. doi:10.1016/j.envint.2013.03.010
Schreer, A., Tinson, C., Sherry, J.P., Schirmer, K., 2005. Application of Alamar blue/5carboxyfluorescein diacetate acetoxymethyl ester as a noninvasive cell viability assay in primary hepatocytes from rainbow trout. Anal. Biochem. 344, 76-85. doi:10.1016/j.ab.2005.06.009
Stapleton, H.M., Klosterhaus, S., Eagle, S., Fuh, J., Meeker, J.D., Blum, A., Webster, T.F., 2009. Detection of Organophosphate Flame Retardants in Furniture Foam and US House Dust. Environ. Sci. Technol. 43, 7490-7495.
Taverniers, I., Loose, M. De, Bockstaele, E. Van, 2004. Trends in quality in the analytical laboratory. II. Analytical method validation and quality assurance. Trends Anal. Chem. 23. doi:10.1016/j.trac.2004.04.001
Teschke, K., Kennedy, S.M., Olshan, A.F., 1994. Effect of different questionnaire formats on reporting of occupational exposures. Am. J. Ind. Med. 26, 327-337.
Venier, M., Audy, O., Vojta, Š., Bečanová, J., Romanak, K., Melymuk, L., Krátká, M., Kukučka, P., Okeme, J., Saini, A., Diamond, M.L., Klánová, J., 2016. Brominated flame retardants in the indoor environment — Comparative study of indoor contamination from three countries. Environ. Int. 94, 150-160. doi:10.1016/j.envint.2016.04.029
White, E., Armstrong, B.K., Saracci, R., 2008. Principles of Exposure Measurement in Epidemiology. Oxford University Press. doi:10.1093/acprof:oso/9780198509851.001.0001
Wilson, V.S., Bobseine, K., Lambright, C.R., Gray, L.E., 2002. A novel cell line, MDA-kb2, that stably expresses an androgen- and glucocorticoid-responsive reporter for the detection of hormone receptor agonists and antagonists. Toxicol. Sci. 66, 69-81.


