XXXXXXXX XXXXXX (XX) 2019/319
xx xxx 6. xxxxx 2019,
xxxxxx xx xxxx xxxxxxx IX xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (ES) x. 999/2001 x příloha XX xxxxxxxx Komise (XX) x. 142/2011, xxxxx xxx x xxxxxxxxxxx osvědčení xxx xxxxxx do Xxxx xxxxxxxx se xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxx
(Xxxx x xxxxxxxx xxx XXX)
XXXXXXXX XXXXXX,
s ohledem xx Xxxxxxx x xxxxxxxxx Xxxxxxxx xxxx,
x ohledem xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 999/2001 xx xxx 22. xxxxxx 2001 x xxxxxxxxx xxxxxxxx xxx xxxxxxxx, xxxxxxx x eradikaci xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx encefalopatií (1), x zejména xx xx. 23 xxxxx xxxxxxxxxxx x xx. 23x xxxxxx xxxx x písmeno m) xxxxxxxxx nařízení,
x xxxxxxx xx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (ES) č. 1069/2009 xx xxx 21. xxxxx 2009 x xxxxxxxxxxxx pravidlech xxx xxxxxxxx produkty xxxxxxxxxxx xxxxxx x xxxxxxx produkty, xxxxx xxxxxx určeny x xxxxxx xxxxxxxx, a o zrušení xxxxxxxx (XX) č. 1774/2002 (xxxxxxxx o vedlejších xxxxxxxxxx xxxxxxxxxxx xxxxxx) (2), x xxxxxxx xx xx. 42 odst. 2 xxxxxx xxxx, xxxxxxx x) a xxxxxxxxx xxxxxxxx uvedeného xxxxxxxx,
vzhledem x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx (XX) x. 999/2001 xxxxxxx xxxxxxxx xxx prevenci, xxxxxxx x xxxxxxxxx přenosných spongiformních xxxxxxxxxxxxx (XXX) x xxxxx, xxxx a koz. Xxxxxxxx xx xx xxxxxxxx x xxxxxxx xxxxxx xxxxxx x xxxxxxxx živočišného původu xx xxx x x xxxxxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxx xxxxx. Xxxxxxx xxxxxxxx rovněž stanoví xxxxxx základ pro xxxxxxxx xxxxxxxxx xxxxx x třetích xxxx xxxx xxxxxx xxxxxxx, xxxxx je xxxxxxx x xxxxxxxxxx Xxxxxx 2007/453/XX (3), xxxxx statusu XXX do xxxxxxxxx xx zanedbatelným xxxxxxx xxxxxxx XXX, xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX x xxxxxxxxx xxxxxxx xxxxxxx XXX. |
|
(2) |
V xxxxxxx XX nařízení (XX) x. 999/2001 se xxxxxxx xxxxxxxxx xx xxxxx živých xxxxxx, xxxxxx, xxxxxxx a xxxxxxxx živočišného původu xx Unie. Kapitola X xxxxxxx xxxxxxx xxxxxxxxx stanoví xxxxxxxxx xxx xxxxx xxxxx xxxxxxxxxxxx xxxxxx XXX xxxxxxx xxxx xxxx xxxxxxx. V xxxxxxxx X uvedené xxxxxxx xx xxxxx xxxxxxx, xx veterinární xxxxxxxxx, xxxxx xx xxxxxxxxxx xxx dovozu xxxxxxxxx xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx x získaných xxxxxxxx xx Xxxx, xxxx jiné xxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxx xxx doplněno xxxxxxxxxx týkajícím xx xxxxxx XXX. |
|
(3) |
V xxxxxxx XX kapitole X xxxxxxxx (XX) x. 999/2001, xx xxxxx nařízení Xxxxxx (XX) 2016/1396 (4), xx uveden xxxxxxxxx, xx xxxx xxxx xxxxxxxx xx Unie xxxxx xxx xxxxxxxx xxxxxxxxx x xxxxxxx XXX nebo xxxxxx xxxxxxxx. Vzhledem xx xxxxxxxxxxx, xx xxxxxx xxxxx xxxxxxx BSE xx prostřednictvím krmiva xxxxxxxxxxxxxxx xxxxxxx BSE, xx xxxxxxx požadavek xxx xxx xxxxxxxx xxx, aby xxxxxxxx, xx živý xxxx xxxxxxxx xx Xxxx xxxxx být případy XXX xxxx xxxxxx xxxxxxxx. Xxxxxxxx X xxxxxxx IX xxxxxxxx (XX) x. 999/2001 xx xxxxx xxxx xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx. |
|
(4) |
Xxxxxxxx (XX) č. 1069/2009 xxxxxxx hygienická a veterinární xxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x xxxxxxx xxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx xxx xxxxxx lidí a zvířat, xxxxx v souvislosti s těmito xxxxxxxx xxxxxxxx, x xxxxxxxx xx na xxxxxxx. Xxxxxxxx Komise (EU) x. 142/2011 (5) stanoví xxxxxxxxx xxxxxxxx xxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx pro vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx produkty xxxxxxxxx xxxxxxxxx (ES) x. 1069/2009, xxxxxx xxxxxxxxx xxxxxxxxx xx xxxxx vedlejších produktů xxxxxxxxxxx původu a xxxxxxxxx produktů xx xxxxxxx xxxx. |
|
(5) |
X xxxxxxx X xxxxxxxx (EU) x. 142/2011 jsou xxxxxxx xxxxxxx xxxxxxxx, které xxxx být používány xxx xxxxx xxxxxxxxx xxxxxxxx. Xxxxx xxxxxx 31 xxxxxxxx (XX) x. 142/2011 xxxx xxx xxxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxx xxx xxxxx xx Xxxx xxxx xxxxxxx přes Xxxx provázeny veterinárními xxxxxxxxxxx a prohlášeními, xxxxx odpovídají xxxxxx xxxxxxxxxx x xxxxxxx XX xxxxxxxxx xxxxxxxx. |
|
(6) |
X xxxxxx 11.4.13 xxxx 1 Xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx Xxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxx (xxxx xxx „xxxxx XXX“) (6) xx xxxxxxxxxx, že xxxxxxxxxx xxxxxx x xxxxxxx xxxxxxx z xxxxxxxxxxx, xxx xxxx definovány x kodexu OIE, x komodity, které xxxxxxxx xxxxxx xxxxxxxx, xxxxxxxxxxx ze zemí xxxx oblastí se xxxxxxxx zanedbatelného xxxxxx xxxxxxx XXX, ve xxxxxxx se xxxxxxx xxxxxx případ XXX, xx xxxxx xxxx xxxxxxxxx mezinárodního obchodu xxxxx x xxxxxxx, xx byly získány xx xxxxx narozeného xx xxxx, kdy xxx x zemi xxxxxxxx xxxxxxx zákaz xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxx x přežvýkavců, xxx jsou definovány x kodexu XXX. X bodě 2 xxxxxxxxx xxxxxx xx xxxxxxxxxx, xx xxxxxxxxxx xxxxxx x škvarky xxxxxxx z xxxxxxxxxxx, xxx jsou xxxxxxxxxx x kodexu OIE, x komodity, xxxxx xxxxxxxx xxxxxx xxxxxxxx, xx xxxxxx být xxxxxxxxx xxxxxxxxxxxxx obchodu, xxxxx pocházejí ze xxxx xxxx xxxxxxx xx xxxxxxxx xxxxxxxxxxxxxx xxxx neurčeného rizika xxxxxxx XXX. |
|
(7) |
Xxxxx XXX xxxxxxxx masokostní moučku xxxx xxxxx xxxxxxxxxx xxxxxxxx získané xxxxxxx/xxxxxxxxx xxxxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx bílkovinných xxxxxxxxxxxx xxxxxx xxx xxxxxxx x xxxxxxxxxx hmotnosti xxxxx xxx 10 000 xxxxxxx x xxxxxxxxxxxxx. V xxxxxxxx xxxxxxxxxx moučky x kodexu XXX xx tedy xxxxxxxx xxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxx v xxxx 27 xxxxxxx X nařízení (XX) x. 142/2011, xxx xxxxxxxx zpracovaných xxxxxxxxxxx xxxxxxxx x xxxx 5 uvedené přílohy. |
|
(8) |
X xxxxxxx x čl. 41 xxxx. 2 xxxx. c) xxxxxxxx (XX) x. 1069/2009 xxxx xxx masokostní xxxxxx, xxx xx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx Xxxx, dovážena xx Xxxx pouze xx xxxxxxxxxxx, xx xxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx podmínky pro xxxxxx xxxxx. Vzhledem x xxxx, že xxxxx xxxxxx prováděcí xxxxxxxx xxxxxxx xxxxxx, xxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxx 1 xxxx xxxxxxxxx kategorie 2 do Unie x současné xxxx xxxxxxx. Xxxxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx Unie, xxxxxxx xx Xxxx xxxxxxx xxx, xxxx-xx dodrženy xxxxxxxx xxx xxxxx xxxxxxxx xx XXX xxxxxxxxx x xxxxxxx XX xxxxxxxx X xxxxxx X xxxxxxxx (XX) č. 999/2001 a xxx xxxxxxxx xxx xxxxx zpracovaných xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx (XX) x. 142/2011. |
|
(9) |
Xx xxxxxx xxxxxxxxxx podmínek xxx xxxxx xx Xxxx xxxxxxxxxx xx XXX xxxxxxxxxxx v xxxxxxxx (ES) x. 999/2001 x xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxx OIE xxxxxxxx xx XXX xx xxxxxx xxxxxx xxxxxxx XX xxxxxxxx X xxxxx X xxxxxxxx (XX) x. 999/2001 xxx, xxx požadavek xxxxxxxxx x uvedeném oddílu xxxxxxxxxxx xxxxxxxxxx xxxxxx 11.4.13 xxxxxx XXX. Xxxxxxx xxxxxxxx x xxxx, že používání xxxxxxxxxxxx živočišných bílkovin xxxxxxxxx z xxxxxxxxxxx xx x Unii xxxxxxxx při xxxxxx xxxxx pro xxxxxxx x xxxxxxxx xxxxx, xxxxxx xx být xxxxxxxxxx článku 11.4.13 xxxxxx XXX, xxx xx při xxxxxx xxxxxxxxx x xxxxxxxxx x produkcí Evropské xxxx x xxxxxxxxxxxxx xxxxxxxxx, xxxxxxxxxxx v xxxxxxx xxxxxx krmiv xxx xxxxxxx x xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx bílkoviny xxxxxxx x xxxxxxxxxxx, xxxxx xx xxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx xxxxxxxxxx a xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Unie. |
|
(10) |
Xxxxxxx XX kapitola X xxxxx B nařízení (XX) č. 999/2001 xx xxxxx xxxx xxx xxxxxxxxxxxxx způsobem xxxxxxx. |
|
(11) |
Na xxxxxxx xxxxxxxx předpisů Xxxx xxxx na xxxxxxx rozhodnutí odpovědného xxxxxxxxxxxxx lze požadovat, xxx produkty xxxxxxxxxxx xxxxxx byly označeny xxxx vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx. Xxxx xx xxxxxxxxxxxx xxxxxxxx, xx produkty xxxxxxxxxxx xxxxxx xxxx být xxxxxxxx za xxxxxxxx xxxxxxxx xxxxxxxxxxx původu, xx xxxx rozhodnutí xxxxxxxx. Takové vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx xxxxx xxx xxxxxxxxx xxx xxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx mají xxxxxx kódy xxxxxxxxxxx xxxxxxxxxxxx (XX) xxxx xxxxxxxxx xxxxxxxx xxxxxx x xxxxxx spotřebě, xxxxx jsou xxxxxxx x xxxxxxx I xxxxxxxx Xxxx (XXX) x. 2658/87 (7). Při xxxxxxxxxx xx xxxx XX xxxx xxx xxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxxx x lidské xxxxxxxx, x xxxxxxxx, xxxxx xxxx xxxxxxxxxxx x xxxxxx xxxxxxxx. Xxx xx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxx zařazování, xxxx xx xx ve xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x osvědčeních xxx xxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu xxxxxxxx, xx ačkoli xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx pocházejí xx xxxxxxxxxxx produktů, které xxxx x xxxxxxxxx xxxx xxxxxxxxx k xxxxxx spotřebě, jsou xxxx xxxxxxxx jako xxxxxxxx produkty živočišného xxxxxx trvale xxxxxxxxx x xxxxxxxxxxxxx řetězce x xx s xxxx xxx xxxxxxxxx. Xxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx XV xxxxxxxxxx 3 (X), 3 (X) x 8 xxxxxxxx (EU) x. 142/2011 xx xxxxx xxxx xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx. |
|
(12) |
Xxxxxxxxx xxxxxxxx xx XXX xx vzorech xxxxxxxxx xxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xx Unie x xxx xxxxxxx xxxxxx xxxxxxxx xxxx Xxxx xxxxxxxxx x xxxxxxxxxx 1, 1a, 2 (X), 2 (X), 3 (X), 3 (X), 3 (X), 3 (X), 3 (X), 3 (X), 4 (B), 4 (C), 4 (X), 6 (X), 8, 10 (X), 10 (B), 11, 12 x 18 xxxxxxx XV nařízení (XX) x. 142/2011 xx xxxxx xxxx měla xxx xxxxxxxxx, xxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx X přílohy IX xxxxxxxx (XX) x. 999/2001, xx xxxxx xxxxxxxx Xxxxxx (EU) x. 630/2013 (8), xxxxxxxx (EU) 2016/1396 x xxxxxx nařízení. |
|
(13) |
Podle xxxxxxxx xxx xxxxx xxxxxxxxxxxx živočišných bílkovin xxxxxxxxx ve xxxxx xxxxxxxxxxxxx xxxxxxxxx x xxxxxxx XX xxxxxxxx 1 xxxxxxxx (XX) x. 142/2011 xxxxx být xx xxxxxxxxxxxx živočišných xxxxxxxxxxx dovážených ze xxxxxxx zemí xxxxxxxx xxxx xxxxxxxxxxx. Nové xxxxxxxxx xxxxxxxx xx XXX xxxxxxx xxxx XX.7. uvedeného vzoru xxxxxxxxxxxxx osvědčení, xx xxxxx tohoto xxxxxxxx, xxxxxxxxx dostatečné xxxxxx xxx xxxxxxxx xxxxxx XXX v daných xxxxxxxxxx. Xxxxx „xxxxxx xxx přežvýkavců“ by xxxxx měla xxx xx xxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx x příloze XX xxxxxxxx (EU) x. 142/2011, xxxxx mají xxx xxxxxxxxx xxxxx xxxxxxxxx, zrušena. |
|
(14) |
Xxxxxxxx 1, 1x, 2 (X), 2 (X), 3 (X), 3 (B), 3 (X), 3 (X), 3 (X), 3 (F), 4 (X), 4 (C), 4 (X), 6 (X), 8, 10 (X), 10 (X), 11, 12 x 18 přílohy XV xxxxxxxx (EU) x. 142/2011 xx xxxxx xxxx xxx xxxxxxxxxxxxx způsobem xxxxxxx. |
|
(15) |
Xxxxxxx meziproduktů určených xxx výrobu xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxx xxx xxxxx při předložení xx xxxxxxxxxx hraniční xxxxxxxx xxx účely xxxxxxxxxxxxx xxxxxxx doprovázeny xxxxxxxxxxx xxxxxxxxx v xxxxxxx xx xxxxxx xxxxxxxx x xxxxxxx XX xxxxxxxx 20 xxxxxxxx (XX) x. 142/2011. Xxxxxxxxxxxx mohou sestávat x vedlejších xxxxxxxx xxxxxxxxxxx původu xxxx xxxx xxxxxxxx xxxxx xxxxxxxxx. Xxxxxxxxx xxxx xxxxxxxxxx obsahuje xxxxx xxxxxxx xxxxx příslušných xxxx XX, jejichž xxxxxxxxxxxxxxx xx xxxxxxxxxxxx xxxxxxx oznámit xxxxxx xxxxxxx x xxxxxxxxx xxxxxxx. Xx vzoru xxxxxxxxxx xxxx možné xxxxxx stanovit xxxxxxxxxxxxx xxxxxx xxxx XX, xxxxx by xxxxxxxxx xxxxxxx xxxxxxxxx vedlejších xxxxxxxx xxxxxxxxxxx původu x xxxxxxxxxxxxxx. Xxxxxxxxx xxxx XX je xxxxx xxxxxx xxxxxxxx, xxx osoba xxxxxxxxxx xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx prostřednictvím xxxxxxxxxxxxxx kódu HS x xxxxxxx x xxxxxxxxxxx Komise 2007/275/XX (9). Xxxxxxxx 20 xxxxxxx XX xxxxxxxx (EU) x. 142/2011 xx měla být xxxxxxxxxxxxx způsobem xxxxxxx. |
|
(16) |
Xxx xx zabránilo xxxxxxxx xxxxxxx, mělo by xxxx nařízení xxxxxxxx xxxxxxxxx xxxxxx, během xxxxxxx by zboží, xxxxxxx xx týkají xxxxx nařízení (XX) x. 142/2011, xxxx být xxxxxx xxxxxxxxx xxx xxxxx xx Xxxx x xxxxxxx xxxx Xxxx, xxxxx xxxxxxx xxxxxxxxx xxxxxxxxx v xxxxxxxx (XX) x. 142/2011 platné před xxx, xxx xxxx xxxxxxxxx xxxxx xxxxxxxxx. |
|
(17) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxx v souladu se xxxxxxxxxxx Stálého xxxxxx xxx xxxxxxxx, xxxxxxx, xxxxxxxxx x xxxxxx, |
PŘIJALA XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxx IX nařízení (XX) č. 999/2001 se xxxx x xxxxxxx x xxxxxxxx X xxxxxx xxxxxxxx.
Xxxxxx 2
Xxxxxxx XV xxxxxxxx (XX) x. 142/2011 xx xxxx x xxxxxxx x xxxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 3
Xxxxx xxxxxxxxxxx období xx 30. xxxx 2019 xx xxxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxx produktů xxxxxxxxxxx veterinárním osvědčením, xxxxx bylo xxxxx xxxxxxxx x podepsáno x xxxxxxx s xxxxxxxxxx vzorem xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx XX kapitole 1, 1x, 2 (X), 2 (X), 3 (A), 3 (X), 3 (X), 3 (X), 3 (X), 3 (X), 4 (X), 4 (X), 4 (X), 6 (B), 8, 10 (A), 10 (X), 11, 12 x 18 xxxxxxxx (XX) x. 142/2011, xx xxxxx platném před xxxxxxx xxxxxxxxx v xxxxxx 2 xxxxxx xxxxxxxx, x případně xxxxxxxxxxx, xxxxx xxxx xxxxx vyplněno x xxxxxxxxx v xxxxxxx xx vzorem xxxxxxxxxx xxxxxxxx x kapitole 20 xxxxxxx xxxxxxx, xx znění platném xxxx xxxxxxx xxxxxxxxx x článku 2 xxxxxx nařízení, nadále xxxxxxxxx xxx xxxxx xx Xxxx a xxxxxxx xxxx Unii, xxxxx xxxx xxxx xxxxxxxxxxx osvědčení nebo xxxxxxxxxx xxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxx 31. xxxxxxxx 2019.
Xxxxxx 4
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx v Úředním xxxxxxxx Evropské xxxx.
Xxxx xxxxxxxx je xxxxxxx v celém xxxxxxx x xxxxx xxxxxxxxxx xx xxxxx xxxxxxxxx státech.
X Xxxxxxx dne 6. xxxxx 2019.
Xx Xxxxxx
předseda
Xxxx-Xxxxxx JUNCKER
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx.&xxxx;X&xxxx;147, 31.5.2001, s. 1.
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx.&xxxx;X&xxxx;300, 14.11.2009, x.&xxxx;1.
(3)&xxxx;&xxxx;Xxxxxxxxxx Xxxxxx 2007/453/XX xx xxx 29. června 2007, xxxxxx se xxxxxxx status BSE xxxxxxxxx států xxxx xxxxxxx xxxx xxxx xxxxxx xxxxxxx xxxxxxxx x xxxxxx xxxxxxx XXX (Úř. věst. L 172, 30.6.2007, x.&xxxx;84).
(4) Nařízení Xxxxxx (XX) 2016/1396 xx dne 18.&xxxx;xxxxx&xxxx;2016, xxxxxx xx xxxx xxxxxxx xxxxxxx xxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (ES) x.&xxxx;999/2001 x&xxxx;xxxxxxxxx xxxxxxxx xxx xxxxxxxx, tlumení x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxxxx spongiformních xxxxxxxxxxxxx (Úř. věst. L 225, 19.8.2016, x.&xxxx;76).
(5) Nařízení Xxxxxx (XX) x. 142/2011 xx xxx 25. února 2011, xxxxxx se xxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (ES) x. 1069/2009 x xxxxxxxxxxxx xxxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxx, xxxxx nejsou xxxxxx x xxxxxx xxxxxxxx, x xxxxxxx xxxxxxxx Xxxx 97/78/XX, xxxxx xxx x xxxxxx xxxxxx a xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxxxx xxxxxxx xx xxxxxxx podle uvedené xxxxxxxx (Úř. věst. L 54, 26.2.2011, x.&xxxx;1).
(6) http://www.oie.int/international-standard-setting/terrestrial-code/access-online/
(7)&xxxx;&xxxx;Xxxxxxxx Rady (XXX) x. 2658/87 xx xxx 23.&xxxx;xxxxxxxx 1987 x xxxxx x xxxxxxxxxxx xxxxxxxxxxxx x x xxxxxxxxx xxxxxx xxxxxxxxx (Úř. věst. L 256, 7.9.1987, x.&xxxx;1).
(8)&xxxx;&xxxx;Xxxxxxxx Komise (XX) x.&xxxx;630/2013 xx xxx 28.&xxxx;xxxxxx 2013, xxxxxx xx xxxx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;999/2001 x&xxxx;xxxxxxxxx pravidel pro xxxxxxxx, xxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx přenosných xxxxxxxxxxxxxx xxxxxxxxxxxxx (Úř. věst. L 179, 29.6.2013, x.&xxxx;60).
(9) Rozhodnutí Komise 2007/275/XX xx xxx 17.&xxxx;xxxxx&xxxx;2007 x&xxxx;xxxxxxxxx xxxxxx x&xxxx;xxxxxxxx, xx něž se xxxxxxxx kontroly xx xxxxxxxxxxxx xxxxxxxx kontroly xxxxx xxxxxxx Rady 91/496/XXX x&xxxx;97/78/XX (Úř. věst. L 116, 4.5.2007, x.&xxxx;9).
XXXXXXX I
Příloha XX xxxxxxxx (ES) č. 999/2001 xx xxxx xxxxx:
|
1) |
X xxxxxxxx B:
|
|
2) |
X&xxxx;xxxxxxxx X xx xxxxx X xxxxxxxxx xxxxx: „XXXXX X Xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxx
|
XXXXXXX XX
Xxxxxxx XX xxxxxxxx (XX) x.&xxxx;142/2011 xx xxxx xxxxx:
|
1) |
Xxxxxxxx 1 až 3 (X) xx xxxxxxxxx xxxxx: „XXXXXXXX 1 Xxxxxxxxxxx osvědčení pro xxxxxxxxxx živočišné xxxxxxxxx xxxx xxx získané x&xxxx;xxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxx určeny x&xxxx;xxxxxx spotřebě, xxxxxx xxxxx x&xxxx;xxxxxxxx jiných xxx xxxxxx xxx xxxxxxx v zájmovém chovu xxxxxxxxxxxx xxxx xxxxxxxxx, x&xxxx;xxxx určeny k odeslání xx Xxxxxxxx xxxx xxxx x&xxxx;xxxxxxxx xxxx xxxx xxxxx (2)  &xxxx;Text obrazu &xxxx;Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Odesílatel Název Adresa Tel. I.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx ústřední xxxxx X.4. Xxxxxxxxx xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx zodpovědná xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx původu Kód XXX X.8. Region původu Kód I.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx X.12. Xxxxx určení Celní xxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Xxxxx xxxxxxx X.15. Dopravní prostředek Letadlo Xxxxxxxx Xxxxx Xxxxxxxx vozidlo Xxxxxxx Xxxxxxxxxxxx Xxxxx na dokument I.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17.  Text obrazu Text obrazu
X.18. Xxxxx xxxxx X.19. Xxx xxxxx (xxx HS) I.20. Xxxxxxxx X.21. Teplota xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Počet xxxxxx X.23. Číslo xxxxxx/xxxxxxxxxx X.24. Xxxx obalu I.25. Zboží xxxxxxxxx xxx: Xxxxxx Xxxxxxxxx xxxxxxx Xxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx X.26. Xxx xxxxxxx přes EU xx xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Xxx dovoz xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (vědecký xxxxx) Xxxx xxxxx Xxxxxxx závod Čistá hmotnost Číslo xxxxx  Text obrazu Text obrazu
ZEMĚ Zpracované živočišné xxxxxxxxx jiné xxx xxxxxxx x xxxxxxx xxxxxxxxx hmyzu, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx, xxxxxx xxxxx a xxxxxxxx xxxxxx xxx krmivo xxx xxxxxxx x xxxxxxxx chovu xxxxxxxxxxxx xxxx xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. Xx, xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, xx xxxx xxxxxxx x porozuměl xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 1069/2009 (1x), xxxxxxx pokud xxx x xxxxxx 10 xxxxxxxxx xxxxxxxx, a xxxxxxxx Xxxxxx (EU) x. 142/2011 (1x), xxxxxxx pokud xxx x přílohu X xxxxxxxx XX oddíl 1 x xxxxxxx XXX kapitolu I xxxxxxxxx nařízení, a xxxxxxxxx, xx: XX.1. xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxx popsaný výše xxxxxxxx xxxxxxxx zpracované xxxxxxxxx xxxxxxxxx, které xxxxxx určeny x xxxxxx xxxxxxxx x xxxxx: x) xxxx xxxxxxxxxx x skladovány v xxxxxxxx xxxx xxxxxxx xxxxxxxxxx a dozorovaném xxxxxxxxxx xxxxxxx v xxxxxxx x článkem 24 xxxxxxxx (XX) x. 1069/2009; x x) xxxx xxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu: (2) xxx [- xxxx xxxxxxxxxx xxxxxx x xxxxxx xxxxx, nebo x případě zvěře xxxx xxxxxxxxxx xxxxxx xxxx xxxxxx xxxxx, xxxxx xxxx podle xxxxxxxx xxxxxxxx Xxxx xxxxxx x xxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxxxx x lidské xxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxx xxxxxxxx xxxx x níže uvedené xxxxx pocházející xxx xx xxxxxx, xxxxx xxxx poražena xx xxxxxxx a xx xxxxxxxxx xxxx xxxxxxxx xxxx shledána jako xxxxxxxxx x porážce x xxxxxx spotřebě, xxxx xxxx x xxxx xxxxxxx xxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx: x) xxxxxxx xxxxxxxx těla nebo xxxx zvířat x xxxxxx xxxxx, xxxxx xxxx x xxxxxxx x právními předpisy Xxxx xxxxxxxxxx xx xxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx na xxxxxxx xxxx xxxxxxx; xx) hlavy xxxxxxx; xxx) xxxx x xxxxx, včetně xxxxxx xxxxxxx x xxxxxx, xxxx x xxxxxxxxx, xxxxxx xxxxxx xxxxx, xxxxxxxxxx a záprstních xxxxxx, xxxxx x xxxxxxx; xx) prasečí štětiny; v) xxxx;] (2) x/xxxx [- xxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosného xxxx xx xxxxxxx xxxx xxxxxxx, která byla xxxxxxxx na xxxxxxx x xxxxx byla xx prohlídce xxxx xxxxxxxx shledána xxxxxxxxxxx x xxxxxxx k xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx;] (2) x/xxxx [- vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxx xxxxxx xxxxxxxx určených x xxxxxx spotřebě, xxxxxx xxxxxxxxxxx kostí, xxxxxxx xxxx xxxx x xxxxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxx xxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxxxxx xxxxxx nebo xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, které x xxxxxxxxxx xxxxxx xxxx x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx nevzniká xxxxx xxxxxx xxx xxxxxx xxxx xxx xxxxxx, xxx xxxxxx xxxxxx x lidské xxxxxxxx;] (2) x/xxxx [- xxxx, placenta, xxxx, xxxx, xxxx, xxxx, xxxxxxx xxxxx a xxxxxxxx a syrové xxxxx xxxxxxxxxxx xx xxxxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx xx xxxxxxx xxxx xxxxxxx;] (2) a/nebo [- xxxxx xxxxxxxxxxx x xxxxxx xxxxx, xxxxx xxxxxxxx savců, xxxxx nevykazovali žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx nebo xxxxxxx;] (2) a/nebo [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxxxxx nebo podniků xx xxxxxx xxxxxxxx xxxxxxxx k xxxxxx xxxxxxxx;] Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxxxxx bílkoviny xxxx xxx xxxxxxx x xxxxxxx xxxxxxxxx xxxxx, xxxxx nejsou xxxxxx x xxxxxx xxxxxxxx, včetně směsí x xxxxxxxx xxxxxx xxx krmivo pro xxxxxxx x xxxxxxxx xxxxx obsahujících tyto xxxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. (2) x/xxxx [- xxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xx zvířat, která xxxxxxxxxxxx žádné příznaky xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx na xxxxxxx xxxx xxxxxxx: x) xxxxx xxxxxxx x korýšů x měkkými tkáněmi xxxx xxxxx; xx) tento xxxxxxxx pocházející xx xxxxxxxxxxxxx zvířat: — xxxxxxxx xxxxxxxx z xxxxx, — xxxxx, — xxxxxxxx produkty x xxxxx, xxxxxx xxxxxxxxx xxxxxxxx; xxx) xxxxxxxxxx xxxxxx xxxxxxxx z xxxxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxx druhů xxxxxxxxxxx xxx xxxxxxx nebo xxxxxxx x hmyzu;] (2) x/xxxx [- xxxxxxx x řádů hlodavců (Xxxxxxxx) a xxxxxxxxx (Xxxxxxxxxx) a xxxxxx xxxxx, kromě xxxxxxxxx xxxxxxxxx 1 uvedeného x xx. 8 xxxx. x) bodech xxx), iv) x x) x xxxxxxxxx xxxxxxxxx 2 uvedeného x čl. 9 xxxx. a) xx x) nařízení (XX) x. 1069/2009;] a c) xxxx xxxxxxxxx této xxxxxx xxxxxxxxxx: (2) buď [xxxxxxx xx xxxxxxx x xxxxx xxxxx xxx 133 °X po xxxx alespoň 20 xxxxx xxx xxxxxxxxx x xxx xxxxx (xxxxxxxxxx) alespoň 3 xxxx xxxxxxxx xxxxxxxxx xxxxx x velikostí xxxxxx xxxx zpracováním xxxxxxxxx 50 mm;] (2) xxxx [x xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xx xxxxx, x xxxxxxxx rybí xxxxxx, xxxxxxxxxxxxxx xxxxxx 1-2-3-4-5-7 (xxxxxx zpracovatelskou xxxxxx) xxxxx xxxxxxx IV xxxxxxxx III xxxxxxxx (XX) x. 142/2011;] (2) xxxx [x xxxxxxx xxxx xxxxxx zpracovatelské xxxxxx 1-2-3-4-5-6-7 (xxxxxx xxxxxxxxxxxxxxx xxxxxx) xxxxx xxxxxxx XX kapitoly XXX xxxxxxxx (EU) x. 142/2011;] (2) nebo [x xxxxxxx xxxxxxx xxxx xxxxxxxxxxxxxx metodě 1-2-3-4-5-7 … (xxxxxx xxxxxxxxxxxxxxx xxxxxx) xxxxx xxxxxxx XX kapitoly XXX xxxxxxxx (EU) x. 142/2011, xxxxxxx x případě xxxxxx 7 se xx xxxxx hmotu xxxxxxx xxxxxxx xxxxxxxx při xxxxxxx alespoň 80 °X;] XX.2. xxxxxxxxx xxxxx xxxxxxxxxxxxx před xxxxxxxxx xxxxxxxx namátkově xxxxxxx xxxxxx x xxxxxxx xxx x xxxxxxx x xxxxxx xxxxxxx (3): Xxxxxxxxxx: xxxxxxxxxxxx x 25 x xxxxxxxx: x = 5, x = 0, x = 0, X = 0 Enterobacteriaceae: x = 5, x = 2, x = 10, X = 300 x 1 g; II.3. xxxxxxx xxxxxx xxxxx xxxxxxxxxxxxx opatřeními x xxxxxxxxx kontaminace xxxxxxxxxxx xxxxxxx po ošetření; II.4. xxxxxxx xxxxxxx xxx: (2) xxx [xxxxxxx xx xxxxxx xxxx xxxxxxxxxxxxxxx xxxxx,]  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx než xxxxxxx x xxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx, xxxxxx xxxxx x produktů xxxxxx xxx xxxxxx xxx xxxxxxx v xxxxxxxx xxxxx obsahujících xxxx xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) xxxx [přepravován xxxxx ložený x xxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx, xxxxx xxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx a xxxxxxxxxxxxxxx,] xxxxx jsou xxxxxxxx xxxxxxxxx s xxxxxxx „XXXX XXXXXX X XXXXXX XXXXXXXX“; XX.5. konečný xxxxxxx byl xxxxxx x xxxxxxxxx skladišti; (2) [XX.6. zpracované xxxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxxxx xxxx xxxx x xxxx xxxxxxx x: (2) xxx [xxxxxxxxx xx xxxx xxxx xxxxxxx xxxxxxxx v xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x nichž xxxxx zjištěn xxxxx xxxxxx případ XXX, x]] (2) nebo [xxxxxxxxx xx xxxx xxxx xxxxxxx xxxxxxxx v xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx rizikem xxxxxxx XXX, v xxxxx byl zjištěn xxxxxx xxxxxx BSE, x xxxxxxxx produkt xxxxxxxxxxx původu nebo xxxxxxx xxxxxxx byl xxxxxx xx xxxxxx xxxxxxxxxx po xxxx, xx kterého xxx x xxxxxxx zemi xxxx oblasti xxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx moučkou x škvarky xxxxxxxxx x xxxxxxxxxxx, xxx xxxx definovány x Xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx XXX, x] (2) xxx [xxxx získány x xxxxxxxxxxx xxxxxx xxx skot, xxxx xxxx xxxx;] (2) nebo [xxxx xxxxxxx xx xxxxx, xxxx nebo xxx x xxxxxxxxxx xxxx uvedené xxxxxx xxx x nich xxxxxx xxxxxxx: (2) xxx [xxxxxxxx xxxxxxxxxxx xx xxxxx, xxxx a xxx xxxx xxx xxxxxxx xx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených v xxxx xxxx oblasti xxxxxxxx x souladu x rozhodnutím 2007/453/ES xx kategorie xxxx xxxx oblasti se xxxxxxxxxxxxx xxxxxxx výskytu XXX;]] (2) nebo [x) xxxxxxxxxxxxx rizikový materiál, xxx je definován x xxxx 1 xxxxxxx X xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 999/2001 (4); x) xxxxxxx xxxxxxxx xxxx získané x xxxxx xxxxx, xxxx xxxx xxx x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (5) do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX, x xxxxx xxxxx xxxxxxx xxxxx xxxxxx xxxxxx BSE; c) xxxxxxxx xxxxxxx xxxxxxxxxxx původu xxxx získaný xxxxxxx xx skotu, xxxx xxxx xxx, xxxxx xxxx xx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxx lebeční, x xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx chovaných a xxxxxxxxxx v xxxx xxxx xxxxxxx xxxxxxxx x souladu s xxxxxxxxxxx 2007/453/ES xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE;]]] II.7. xxxxxxxxxx xxxxxxxxx bílkoviny xxxx xxxxxxx xxxxxxx xxxx: (2) xxx [xxxxxxxxxx xxxxx xxxx xxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxx xxx xxx xxxxxx xxxxxx xxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxxxxxx zvířat;] (2) xxxx [xxxxxxxx mléko xxxx xxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxx xxx x jsou xxxxxx xxx xxxxxx xxxxxxxxxxxxx xxxxxx jiných xxx xxxxxxxxxxxx xxxxxx x xxxxx xxxx xxxxxx xxxxxxx: x) xxxx xxxxxxx x xxxx x xxx, xxxxx xxxx xxxxxxxxxxx od xxxxxxxx chovány x xxxx, v xxx xxxx splněny xxxx xxxxxxxx: x) xxxxxxxx klusavka xx xxxxxxx hlášením;  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxx xxxxxxx x xxxxxxx chovaného xxxxx, xxxxx xxxxxx xxxxxx k lidské xxxxxxxx, xxxxxx xxxxx x xxxxxxxx xxxxxx xxx xxxxxx xxx xxxxxxx v xxxxxxxx xxxxx obsahujících tyto xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. ii) xxxxxxx systém xxxxxx, xxxxxxxxx a xxxxxxx; xxx) xx hospodářství x xxxxxx xxxx nebo xxx se xxxxxxxxx xxxxxx omezení v xxxxxxx xxxxxxxxx xx XXX xxxx xxxxxxxxx xxxxxxxx klusavky; iv) xxxx x xxxx postižené xxxxxxxxx klusavkou xxxx xxxxxxxx x xxxxxxxxxxxx; x) xxxxxx xxxx x xxx masokostní xxxxxxx xxxx xxxxxxx x xxxxxxxxxxx, xxx xxxx xxxxxxxxxx x Kodexu xxxxxx xxxxxxxxxxxxx živočichů Xxxxxxx xxxxxxxxxx pro xxxxxx xxxxxx (XXX), xxxx xxxxxxxx x xxxxx byl xxxxxx xxxxxxx x xxxx xxxx xxxxxxxxxxxx po xxxx předchozích xxxxx xxx; x) xxxxxxxxx x xxxxxxxxxxxx, pro xxxxx xxxxxxx xxxxx xxxxxx xxxxxxx x xxxxxx xxxxxxxxx na xxxxxx XXX; x) pocházejí x xxxxxxxxxxxx, x xxxxx xxxxxxxxxxxx po xxxx xxxxxxxxxxx sedmi let xxxxx xxxxxxxxxxxxxx žádný xxxxxx xxxxxxxx klusavky, xxxx xx potvrzení xxxxxxx xxxxxxxx klusavky: (2) xxx [xxxx xxxxxxxx x xxxxxxxxxxxx xxxx xxxxxxxx všechny ovce x xxxx x xxxxxxxxxxxx x výjimkou xxxxxxxxxx xxxxxx genotypu XXX/XXX, xxxxxxxx bahnic xxxxxxxxx alespoň xxxxx xxxxx XXX a xxxxxx xxxxx VRQ x dalších xxxx xxxxxxxxx alespoň jednu xxxxx XXX;] (2) xxxx [xxxx xxxxxxx xxxxxxx, x nichž xxxx xxxxxxxx xxxxxxxx potvrzena, xxxxxxxx x xxxxxxxxxxxx x xx hospodářství xx xxxxxxx xx xxx xxxx xx xxxxxxxxx posledního xxxxxxx xxxxxxxx klusavky xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx TSE, xxxxxx xxxxxxxxx všech xxxxxxxxxxxxx xxxxxx xxxxxxxx 18 měsíců, s xxxxxxxx ovcí xxxxxxxx XXX/XXX, na xxxxxxxxxx XXX x xxxxxxxxxx xxxxxxxxx x xxxxxxx x laboratorními xxxxxxxx xxxxxxxxxxx x příloze X xxxxxxxx C xxxx 3.2 xxxxxxxx (XX) č. 999/2001: — xxxxxxx, která xxxx xxxxxxxx x xxxxxx xxxxxxxx, x — zvířata, xxxxx xxxxxxx xxxx xxxx xxxxxxxx v xxxxx xxxxxxxxxxxx, xxxxx xxxxxx xxxxxxxx v xxxxx xxxxxxx xxxxxxxxx xxxxxx;]] XX.8. xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxx xxxx obsahují xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx z xxxxxxxxxxxxx xxxx xxxx x xxxx xxxxxxx x x xxxxxxx x xxxxxxxxxxx odesílatele x xxxxxxx I.1. (2) xxx [xxxxxx určeny x xxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxx xxxx xxx kožešinová xxxxxxx.] (2) (6) xxxx [xxxx xxxxxx x výrobě xxxxx pro xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx jiná xxx xxxxxxxxxx zvířata x xxxxxxxxxx se xxxxxxx zajistit, xx xxxxxxxxx xxxxxxxxxx hraniční xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx podle xxxxx xxxxxxxxxxx x xxxxxxx XX xxxxxxxx Xxxxxx (XX) x. 152/2009 (7).] Poznámky Část X: — Xxxxxxx I.6.: Osoba xxxxxxxxxx xx zásilku x Xxxxxxxx unii: xxxx xxxxxxx je xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx se x xxxxxxxxx xxx xxxxx určené xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx xx xxxxxxx, jedná-li xx x xxxxxxxxx xxx xxxxx xxxxxxxx do Xxxxxxxx xxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx xxxxxxx je xxxxx xxxxxxx pouze xxxxx, xxxxx-xx se x xxxxxxxxx xxx xxxxx určené xxx xxxxxxx. Produkty smí xxx xxx xxxxxxxx xxxxxxxxxx pouze xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxx. — Xxxxxxx I.15.: Xxxxxxxxxxx xxxxx (železničních xxxxxx xxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (letadla) xxxx xxxxx (xxxxxxxx); xxxxxxxxx xx třeba xxxxxxxxxx x případě xxxxxxxx x opětovného xxxxxxxx.  Text obrazu Text obrazu
XXXX Xxxxxxxxxx živočišné xxxxxxxxx jiné xxx xxxxxxx x xxxxxxx xxxxxxxxx xxxxx, které xxxxxx xxxxxx x xxxxxx xxxxxxxx, xxxxxx xxxxx x produktů xxxxxx než xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx xxxxxxxxxxxx xxxx xxxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. — Kolonka X.19.: Xxxxxxxx xxxxxxxxx xxx XX: 05.05, 05.06, 05.07, 05.11, 23.01 xxxx 23.09. — Xxxxxxx X.25.: Technické využití: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx zvířat x xxxxxx xxxx xxxxxxxxxx xxxxx pro xxxxxxx x xxxxxxxx xxxxx. — Xxxxxxx X.26. x X.27.: Xxxxxxx xxxxx xxxx, jedná-li se x xxxxxxxxx xxx xxxxxxx xxxx xxx xxxxx. — Xxxxxxx I.28.: Xxxx: vyberte: Xxxx, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Xxxxxx, Xxxxx, Mollusca, Xxxxxxxxx, xxxxxxxxxx kromě Xxxxxxxx a Crustacea. X xxxxxxx xxx xx xxxxxxxx xxxxx xxxxxx xxxxxxx xxxxx xxxx. Xxxx XX: (1x) Xx. xxxx. L 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, s. 1. (2) Nehodící xx xxxxxxxx. (3) Kde: n = xxxxx vzorků, xxxxx xxxx xxx xxxxxxxxx; x = xxxxxxx hodnota xxxxx xxxxxxxx; xxxxxxxx xx xxxxxxxxx xx xxxxxxxxxx, jestliže počet xxxxxxxx xx xxxxx xxxxxxxx nepřekročí x; X = maximální xxxxxxx xxxxx xxxxxxxx; xxxxxxxx xx xxxxxxxxx za xxxxxxxxxxxx, xxxxx xxxxx xxxxxxxx v jednom xxxx více xxxxxxxx xx xxxxx xxxx xxxxx než X; x x = počet xxxxxx, xxxxxxx bakteriální xxxxx xxx xxx x rozmezí xxxx x x X, xxxxxxx xxxxxx xx xxxxx stále xxxxxxxxx xx xxxxxxxxx, pokud xx xxxxxxxxxxx počet xxxxxxxxx xxxxxx roven x xxxx nižší. (4) Xx. xxxx. X 147, 31.5.2001, x. 1. (5) Xx. xxxx. X 172, 30.6.2007, x. 84. (6) Xxxxx xxxxxxxxxx za xxxxxxx xxxxxxx x kolonce X.6. xxxx xxxxxxxx, xxx x xxxxxxx, xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx produkt xxxxxxx x xxxxx xxxxxxxxxxxx xxxxxxxxx xxxx xxx xxxxxx x xxxxxx xxxxxx pro xxxxxxxxxxxx hospodářská xxxxxxx xxxx xxx xxxxxxxxxx xxxxxxx, xxxx zásilka xxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxxxxxx x xxxxxxx VI nařízení (XX) x. 152/2009, xxx xx ověřila xxxxxxxxxxxx nepovolených xxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx xxxx xxx xxx xxxxxxxxxx xxxxxxx xx stanovišti xxxxxxxx xxxxxxxx XX xxxxxxxxx x tomuto xxxxxxxxxxxxx xxxxxxxxx. (7) Xx. xxxx. X 54, 26.2.2009, x. 1. — Xxxxx xxxxxxx a xxxxxxx xx xxxx xxxxx xx barvy xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx x Xxxxxxxx xxxx: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx a xxxx xxxxxxx xxxxxxxx xx xx okamžiku, xxx xxxxxxx stanoviště xxxxxxxx xxxxxxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 1a Veterinární xxxxxxxxx xxx xxxxxxxxxx živočišné xxxxxxxxx xxxxxxx x&xxxx;xxxxxxx chovaného xxxxx, xxxxx xxxxxx xxxxxx x&xxxx;xxxxxx xxxxxxxx, xxxxxx směsí x&xxxx;xxxxxxxx xxxxxx xxx krmivo xxx xxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxxxxxxx tyto xxxxxxxxx, x&xxxx;xxxx xxxxxx x&xxxx;xxxxxxxx do Evropské xxxx nebo k tranzitu xxxx xxxx území (2) &xxxx; Text obrazu Text obrazu
ZEMĚ: Veterinární xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo xxxxxxx xxxxxxxxx X.2.x. X.3. Příslušný xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx orgán I.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx zodpovědná xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Xxxxxx xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Region xxxxxx Xxx X.11. Xxxxx původu Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx X.12. Xxxxx určení Celní sklad Název Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo xxxxxxxx X.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Plavidlo Xxxxx Xxxxxxxx xxxxxxx Ostatní Identifikace Odkaz xx dokument I.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. X.18. Popis zboží I.19. Xxx zboží (kód XX) X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Číslo xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxx Technické využití Xxxxxx xxxxxx xxx xxxxxxx v xxxxxxxx xxxxx X.26. Xxx tranzit xxxx XX do xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Xxx xxxxx xxxx příjem xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx zařízení Druh (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx xxxxx Xxxxx hmotnost Číslo šarže  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxxxxx bílkoviny xxxxxxx z farmově xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxx k xxxxxx xxxxxxxx, včetně xxxxx a xxxxxxxx xxxxxx než xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx xxxxxxxxxxxx xxxx xxxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. Xx, xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, xx xxxx xxxxxxx x porozuměl xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1069/2009 (1a), xxxxxxx xxxxx xxx x článek 10 xxxxxxxxx xxxxxxxx, x xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx pokud jde x přílohu X xxxxxxxx II oddíl 1 x xxxxxxx XXX kapitolu X xxxxxxxxx xxxxxxxx, a xxxxxxxxx, xx: XX.1. zpracované xxxxxxxxx bílkoviny xxxxxxx x xxxxxxx chovaného xxxxx xxxx xxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxx zpracované živočišné xxxxxxxxx, xxxxx xxxxxx xxxxxx x lidské xxxxxxxx x které: a) xxxx připraveny a xxxxxxxxxx x xxxxxxxx xxxx xxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxx v souladu x xxxxxxx 24 xxxxxxxx (XX) x. 1069/2009 x x) byly xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxx hmyzu xxxxxx xxxxx: (2) xxx [- bráněnka (Hermetia xxxxxxxx);] (2) x/xxxx [- xxxxxx xxxxxx (Xxxxx xxxxxxxxx);] (2) x/xxxx [- xxxxxxxx moučný (Xxxxxxxx xxxxxxx);] (2) x/xxxx [- xxxxxxxx stájový (Alphitobius xxxxxxxxxx);] (2) a/nebo [- xxxxxx xxxxxx (Acheta xxxxxxxxxx);] (2) a/nebo [- xxxxxx xxxxxxxxxxxx (Xxxxxxxxx xxxxxxxxxx);] (2) a/nebo [- xxxxxx xxxxxxxx (Gryllus xxxxxxxxx)] x x) xxxx xxxxxxxxxx x xxxxxxx x xxxxxxx [1]-[2]-[3]-[4]-[5]-[7] (2) xxxxxxxxxx x xxxxxxx XX xxxxxxxx XXX xxxxxxxx (XX) x. 142/2011; x x) xxxxxxxx xx xxxxxx xxxxxxx xxxxxxxxx xxxxx smí xxxxxxxxx xxxxx produkty, které xxxxxx živočišného původu, xxxx tyto xxxxxxxx xxxxxxxxxxx původu materiálu xxxxxxxxx 3: — xxxx xxxxxx, — xxxxxx výrobky x xxxxxxxxxxxxx, — xxxxxxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu, — xxxxxxxxxxxxx xxxxxxxxx z xxxxxxxxxxxxx, — xxxxxxxxxxxxx xxxxxxxxx x kůží x xxxxx xxxxxxxxxxx, — xxxxxxxx x xxxxxxx x xxxxxxxxxxxxx, — xxxxx x xxxxxxx z xxxxx, — xxxxx, xxxxxx xxxxxxx, xxxxxxxx xxxxxxx z xxxxx a xxxxxxx, — xxx, — tavené/škvařené xxxx Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
ZEMĚ Zpracované xxxxxxxxx xxxxxxxxx xxxxxxx x farmově xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxx x lidské xxxxxxxx, xxxxxx směsí x produktů xxxxxx xxx xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx xxxxxxxxxxxx xxxx xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. x x) xxxxxxxx xx xxxxxx xxxxx a xxxx xxxx jeho xxxxx xxxxxx ve xxxxx x jinými materiály xxxxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxxx x xxxxxxx x) x xxxxxxxx xxxxxxxxxxx xxxx, xxxxx xx xxxxxxxxxxxx xxxxxxxx xxxx jiný xxxxx; XX.2. xxxxxxxxx xxxxx xxxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxx x shledal xxx x xxxxxxx x xxxxxx xxxxxxx (3): Xxxxxxxxxx: xxxxxxxxxxxx v 25 x xxxxxxxx: x = 5, x = 0, x = 0, X = 0 Xxxxxxxxxxxxxxxxxx: x = 5, x = 2, x = 10, X = 300 x 1 g; II.3. xxxxxxx prošel xxxxx xxxxxxxxxxxxx xxxxxxxxxx k xxxxxxxxx kontaminace xxxxxxxxxxx xxxxxxx po ošetření; II.4. xxxxxxx produkt xxx: (2) xxx [zabalen xx xxxxxx xxxx xxxxxxxxxxxxxxx xxxxx,] (2) nebo [xxxxxxxxxxx xxxxx xxxxxx v xxxxxxxxxxxx xxxx jiných xxxxxxxxxx prostředcích, které xxxx před použitím xxxxxxxx xxxxxxxxx a xxxxxxxxxxxxxxx,] xxxxx jsou opatřeny xxxxxxxxx x xxxxxxx „XXXX URČENO X XXXXXX XXXXXXXX / XXXXXXXXXX HMYZÍ XXXXXXXXX – XXXX URČENO XXX XXXXXXX V XXXXXXXX XXX HOSPODÁŘSKÁ XXXXXXX XXXXX XXXXXXXXX XXXXXXXXXXXXX Z AKVAKULTURY X XXXXXXXXXXXX ZVÍŘAT“; II.5. xxxxxxx xxxxxxx xxx xxxxxx v xxxxxxxxx xxxxxxxxx; (2) [XX.6. xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxx xxxxxxx xxxx xxxxxxxx vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxxxx xxxx xxxx x nich xxxxxxx x: (2) xxx [xxxxxxxxx xx xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx rizikem xxxxxxx BSE, x xxxxx nebyl xxxxxxx xxxxx domácí xxxxxx XXX, x]] (2) xxxx [xxxxxxxxx xx xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx země xxxx xxxxxxx xx zanedbatelným xxxxxxx výskytu XXX, x xxxxx xxx xxxxxxx xxxxxx xxxxxx XXX, x vedlejší xxxxxxx živočišného původu xxxx xxxxxxx xxxxxxx xxx získán xx xxxxxx xxxxxxxxxx xx xxxx, xx xxxxxxx xxx x xxxxxxx xxxx xxxx xxxxxxx xxxxxx vymáhán xxxxx xxxxxx přežvýkavců masokostní xxxxxxx a xxxxxxx xxxxxxxxx x přežvýkavců, xxx xxxx xxxxxxxxxx x Kodexu zdraví xxxxxxxxxxxxx xxxxxxxxx XXX, x]] (2) xxx [xxxx xxxxxxx x přežvýkavců xxxxxx xxx xxxx, xxxx xxxx xxxx;]] (2) xxxx [xxxx získány xx skotu, ovcí xxxx xxx x xxxxxxxxxx xxxx uvedené xxxxxx xxx x xxxx xxxxxx xxxxxxx: (2) xxx [materiál xxxxxxxxxxx xx xxxxx, xxxx x koz xxxx xxx xxxxxxx ze xxxxxx narozených, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX do kategorie xxxx xxxx oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx XXX;]] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx x xxxx 1 přílohy X xxxxxxxx Xxxxxxxxxx parlamentu x Rady (XX) x. 999/2001 (4); x) xxxxxxx oddělené xxxx xxxxxxx x xxxxx xxxxx, ovcí nebo xxx s xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx a poražených x xxxx nebo xxxxxxx zařazené x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (5) xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x nichž xxxxx  Text obrazu Text obrazu
ZEMĚ Zpracované xxxxxxxxx xxxxxxxxx xxxxxxx z xxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx, xxxxxx xxxxx a xxxxxxxx jiných xxx xxxxxx xxx zvířata x xxxxxxxx chovu xxxxxxxxxxxx xxxx xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. c) vedlejší xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xx skotu, ovcí xxxx koz, xxxxx xxxx po xxxxxxxx xxxxxxxx lacerací xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx injekce do xxxxxx xxxxxxx, x xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx chovaných a xxxxxxxxxx v zemi xxxx xxxxxxx xxxxxxxx x xxxxxxx s xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX;]]] XX.7. xxxxxxxxxx xxxxxxxxx bílkoviny xxxx xxxxxxx xxxxxxx xxxx: (2) buď [xxxxxxxxxx xxxxx xxxx mléčné xxxxxxx pocházející z xxxx xxxx xxx xxx nejsou xxxxxx xxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxxxxxx xxxxxx;] (2) xxxx [xxxxxxxx mléko xxxx xxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxx xxx x xxxx xxxxxx pro xxxxxx xxxxxxxxxxxxx xxxxxx jiných xxx kožešinových xxxxxx x mléko xxxx xxxxxx výrobky: a) xxxx xxxxxxx x ovcí x xxx, které xxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxx v xxxx, x xxx xxxx xxxxxxx tyto xxxxxxxx: x) klasická klusavka xx povinná hlášením; ii) xxxxxxx xxxxxx osvěty, xxxxxxxxx a xxxxxxx, xxxxx xxx x xxxxxxxxx xxxxxxxx; xxx) xx xxxxxxxxxxxx s xxxxxx xxxx nebo koz xx xxxxxxxxx xxxxxx xxxxxxx x xxxxxxx xxxxxxxxx xx XXX xxxx potvrzení xxxxxxxx xxxxxxxx; xx) xxxx x xxxx postižené xxxxxxxxx xxxxxxxxx jsou xxxxxxxx x zlikvidovány; v) krmení xxxx x xxx xxxxxxxxxx xxxxxxx xxxx xxxxxxx x přežvýkavců, xxx jsou xxxxxxxxxx x Xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx Xxxxxxx xxxxxxxxxx pro xxxxxx xxxxxx (XXX), xxxx xxxxxxxx x xxxxx xxx účinně vymáhán x xxxx xxxx xxxxxxxxxxxx xx dobu xxxxxxxxxxx xxxxx xxx; x) xxxxxxxxx z hospodářství, xxx xxxxx xxxxxxx xxxxx xxxxxx omezení x xxxxxx podezření xx xxxxxx TSE; c) xxxxxxxxx x hospodářství, x xxxxx přinejmenším xx xxxx xxxxxxxxxxx xxxxx xxx xxxxx xxxxxxxxxxxxxx žádný xxxxxx xxxxxxxx xxxxxxxx, xxxx xx potvrzení xxxxxxx xxxxxxxx xxxxxxxx: (2) buď [xxxx xxxxxxxx a xxxxxxxxxxxx nebo xxxxxxxx xxxxxxx xxxx x xxxx x hospodářství x xxxxxxxx plemenných xxxxxx xxxxxxxx XXX/XXX, xxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxx XXX a xxxxxx xxxxx XXX a xxxxxxx ovcí xxxxxxxxx xxxxxxx xxxxx xxxxx XXX;] (2) xxxx [byla xxxxxxx xxxxxxx, x xxxxx byla xxxxxxxx xxxxxxxx potvrzena, usmrcena x xxxxxxxxxxxx x xx xxxxxxxxxxxx se xxxxxxx xx xxx xxxx xx potvrzení xxxxxxxxxx xxxxxxx klasické xxxxxxxx vztahuje xxxxxxxxxxxxx xxxxxxxxx XXX, xxxxxx xxxxxxxxx všech xxxxxxxxxxxxx xxxxxx starších 18 xxxxxx, s xxxxxxxx xxxx xxxxxxxx ARR/ARR, xx xxxxxxxxxx XXX x negativním xxxxxxxxx x souladu x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxx X xxxxxxxx X xxxx 3.2 nařízení (ES) x. 999/2001: — zvířata, xxxxx xxxx xxxxxxxx x xxxxxx xxxxxxxx, x — xxxxxxx, která xxxxxxx xxxx byla xxxxxxxx x xxxxx xxxxxxxxxxxx, avšak nebyla xxxxxxxx x xxxxx xxxxxxx xxxxxxxxx xxxxxx;]] XX.8. [xxxxxxxxxx živočišné xxxxxxxxx xxxx produkt xxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxxxxxx xxxx xxxx z xxxx xxxxxxx a x xxxxxxx x xxxxxxxxxxx xxxxxxxxxxx v xxxxxxx X.1.  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxx hmyzu, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě, xxxxxx xxxxx x xxxxxxxx xxxxxx xxx xxxxxx pro zvířata x xxxxxxxx xxxxx xxxxxxxxxxxx tyto xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx osvědčení II.b. (2) xxx [xxxxxx xxxxxx x xxxxxx xxxxx pro xxxxxxxxxxx zvířata xxxx xxx kožešinová xxxxxxx.] (2) (6) nebo [xxxx xxxxxx k xxxxxx xxxxx pro xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx xxx xxxxxxxxxx xxxxxxx x xxxxxxxxxx xx xxxxxxx zajistit, xx xxxxxxxxxx hraniční xxxxxxxx x místě xxxxxx xx Xxxxxxxx xxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx podle xxxxx xxxxxxxxxxx x příloze XX xxxxxxxx Komise (XX) x.152/2009 (7).] Xxxxxxxx Xxxx X: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx x Xxxxxxxx xxxx: tuto kolonku xx třeba xxxxxxx xxxxx xxxxx, xxxxx-xx xx o xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx xx xxxxxxx, jedná-li xx o osvědčení xxx xxxxx xxxxxxxx xx Evropské xxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx třeba vyplnit xxxxx tehdy, xxxxx-xx xx x osvědčení xxx xxxxx xxxxxx xxx xxxxxxx. Xxxxxxxx xxx být xxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx a xxxxxxx skladech. — Kolonka X.15.: Xxxxxxxxxxx číslo (xxxxxxxxxxxx xxxxxx nebo xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx), číslo xxxx (xxxxxxx) xxxx název (xxxxxxxx); xxxxxxxxx xx xxxxx xxxxxxxxxx v xxxxxxx vykládky x xxxxxxxxxx naložení. — Xxxxxxx X.19.: Použijte xxxxxxxxx xxx XX: 05.11, 23.01 xxxx 23.09. — Xxxxxxx X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx zvířat x výroba xxxx xxxxxxxxxx xxxxx xxx xxxxxxx x xxxxxxxx xxxxx. — Xxxxxxx X.26. x X.27.: Vyplňte xxxxx xxxx, jedná-li xx x xxxxxxxxx xxx xxxxxxx xxxx xxx xxxxx. — Xxxxxxx X.28.: Xxxx: xxxx, xxxxxx xxxxxxx xxxxx. Xxxx XX: (1x) Úř. xxxx. X 300, 14.11.2009, x. 1. (1b) Úř. xxxx. L 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx xxxxxxxx. (3) Xxx: x = počet xxxxxx, xxxxx xxxx xxx xxxxxxxxx; x = xxxxxxx xxxxxxx počtu xxxxxxxx; výsledek je xxxxxxxxx za uspokojivý, xxxxxxxx počet xxxxxxxx xx všech xxxxxxxx xxxxxxxxxx x; X = xxxxxxxxx xxxxxxx počtu xxxxxxxx; výsledek xx xxxxxxxxx za xxxxxxxxxxxx, xxxxx počet xxxxxxxx x jednom nebo xxxx vzorcích xx xxxxx xxxx xxxxx xxx X; x x = počet vzorků, xxxxxxx bakteriální počet xxx být x xxxxxxx xxxx m x X, přičemž xxxxxx xx xxxxx xxxxx xxxxxxxxx xx xxxxxxxxx, xxxxx je xxxxxxxxxxx xxxxx ostatních xxxxxx roven m xxxx xxxxx. (4) Úř. xxxx. L 147, 31.5.2001, x. 1. (5) Xx. xxxx. L 172, 30.6.2007, x. 84.  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxx hmyzu, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě, xxxxxx xxxxx x xxxxxxxx xxxxxx xxx xxxxxx xxx zvířata x xxxxxxxx xxxxx xxxxxxxxxxxx xxxx xxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. (6) Xxxxx xxxxxxxxxx xx xxxxxxx xxxxxxx x xxxxxxx X.6. xxxx xxxxxxxx, xxx x xxxxxxx, xx zpracované xxxxxxxxx xxxxxxxxx nebo produkt xxxxxxx x xxxxx xxxxxxxxxxxx osvědčení mají xxx xxxxxx k xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx než xxxxxxxxxx xxxxxxx, byla xxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxxxxxx x xxxxxxx XX xxxxxxxx (XX) x. 152/2009, xxx xx xxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxxx xxxxxxxx se xxxxxxxx xxxxxxxx xxxxxxxx xxxx xxx při xxxxxxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxx EU xxxxxxxxx x xxxxxx xxxxxxxxxxxxx xxxxxxxxx. (7) Xx. xxxx. X 54, 26.2.2009, x. 1. — Xxxxx xxxxxxx a xxxxxxx xx xxxx xxxxx od xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx x Evropské xxxx: toto xxxxxxxxx xxxxxx pouze x xxxxxxxxxxxx xxxxxx x xxxx zásilku provázet xx do okamžiku, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx. Xxxxxx veterinární xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 2 (X) Xxxxxxxxxxx xxxxxxxxx xxx mléko, xxxxxx xxxxxxx x xxxxxxxx xxxxxxx x xxxxx, xxxxx xxxxxx určeny x xxxxxx xxxxxxxx, xxxxxx x xxxxxxxx xx Xxxxxxxx unie xxxx x xxxxxxxx xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx I: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Odesílatel Název Adresa Tel. I.2. Číslo xxxxxxx xxxxxxxxx X.2.x. X.3. Příslušný xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx orgán I.5. Příjemce Název Adresa PSČ Tel. I.6. Xxxxx zodpovědná xx xxxxxxx v XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx původu Kód ISO I.8. Xxxxxx xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx X.12. Xxxxx určení Celní xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo xxxxxxxx X.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. Xxxxx/xxxxx CITES I.18. Xxxxx xxxxx X.19. Xxx xxxxx (kód XX) X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxx Xxxxx xxxxxxxxxx Xxxxxx xxxxxx pro xxxxxxx x xxxxxxxx chovu Technické xxxxxxx X.26. Xxx xxxxxxx xxxx EU xx xxxxx xxxx Xxxxx země Xxx ISO I.27. Xxx xxxxx xxxx xxxxxx xx EU I.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxxxxx xxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxx, xxxxxx xxxxxxx a xxxxxxxx xxxxxxx z xxxxx, které xxxxxx xxxxxx k lidské xxxxxxxx XX. Xxxxxxxxx informace II.a. Xxxxx xxxxxxx osvědčení II.b. Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx xxxxx, prohlašuji, xx jsem xxxxxxx x porozuměl xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx (XX) č. 1069/2009 (1x), zejména xxxxx xxx o xxxxxx 10 uvedeného xxxxxxxx, x xxxxxxxx Xxxxxx (XX) x. 142/2011 (1b), xxxxxxx xxxxx xxx x xxxxxxx X xxxxxxxx XX oddíl 4 x xxxxxxx XXX xxxxxxxx I uvedeného xxxxxxxx, a xxxxxxxxx, xx mléko (2), xxxxxx xxxxxxx (2) x xxxxxxxx xxxxxxx x xxxxx (2) xxxxxxx x xxxxxxx X.28. splňují xxxxxxxxxxx xxxxxxxx: XX.1. xxxx xxxxxxxx x xxxxxxx v (xxxxxx název vyvážejícízemě) (3), (xxxxxx xxxxx xxxxxxx)&xxxx;(3), xxxxx xx xxxxxxx v příloze XX části I xxxxxxxx Xxxxxx (XX) x. 605/2010 (4) x byla 12 xxxxxx bezprostředně xxxx xxxxxxx prostá slintavky x xxxxxxxx a xxxx xxxxx x x průběhu uvedeného xxxxxx xxx neproběhlo xxxxxxxx proti moru xxxxx; XX.2. xxxx vyrobeny xx xxxxxxxx mléka xxxxxxxxx ze xxxxxx, xxxxx x xxxx xxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx mlékem xx xxxxxxx xxxx xxxxxxx x která byla xx xxxx xxxxxxx 30 xxx před xxxxxxx držena x xxxxxxxxxxxxxx, která xxxxxx xxxxxxxxx xxxxxxxx omezení x xxxxxx slintavky x xxxxxxxx xxxx xxxx xxxxx; XX.3. xxxxx xx x mléko xxxx xxxxxx xxxxxxx, xxxxx: (2) buď [xxxx xxxxxxxx jedním xx xxxxxxx uvedených x xxxx XX.4. xxxx xxxxxx xxxxxxxxx;] (2) xxxx [xxxxxxxx syrovátku určenou xx krmení xxxxxx xxxxx xxxxxxxxx xx xxxxxxxxx x xxxxxxxx, xxxxxxx xxxx xxxxxxxxx xxxx xxxxxxxx x xxxxx, xxxxx xxxx xxxxxxxx jedním ze xxxxxxx xxxxxxxxx x xxxx XX.4., a: (2) xxx [xxxx odebrána xxxxxxxx 16 xxxxx xx xxxxxxx xxxxx x xx xX xxxxx xxx 6;] (2) (5) nebo [xxxx xxxxxxxx xxxxxxx 21 xxx xxxx xxxxxxxxx x během xxxx xxxx xxxxx xx xxxxxxxxxx xxxx zjištěn xxxxx xxxxxx slintavky x xxxxxxxx;] (2) (5) xxxx [xxxx xxxxxxxx xxx / / , xxxxxxx xxxx xxxxx, x xxxxxxx xx předpokládanou xxxx xxxxxxxx, xxxxxxxx době xxxxxxx 21 xxx xxxx xxxxx, kdy xx xxxxxxx předložena xx xxxxxxxxxx hraniční xxxxxxxx Evropské xxxx;]] XX.4. xxxx ošetřeny xxxxxx x xxxxxxxxxxxxx způsobů: (2) xxx [krátkodobou xxxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxxx 72 °X trvající xxxxxxx 15 xxxxxx xxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxxx xx xxxxxxxx xxxxxxxxx xxxxxx xx xxxxxxxxxxx xxxx u xxxxxxxxx xxxxx, x xxxxxxxxx x: (2) buď [xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx při xxxxxxx 72 °X xxxxxxxx xxxxxxx 15 xxxxxx nebo xxxxxxxxx x xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxxx je xxxx o sobě xxxxxxxx negativní reakce xx fosfatázový xxxx x xxxxxxxxx xxxxx;] (2) xxxx [xxxxxxxxx procesem xxxxxx, v xxxxxxx xxxxx xxxxxxxx ke xxxxxx x xxxxxxxxx x xxxxxxxxxx zahřátím xxxxxxx xx 72 °X;] (2) nebo [xxxxxxxxx xxxxxxxx, při kterém xx xX sníženo x xxxxxxx xxxxx xxxxxx xxxxxxxxx xxx xxxxxxx 6;] (2) (5) xxxx [xxxxxxxxx, xx xxxxx / xxxxxx xxxxxxx byl(o) xxxxxxx(x) xxxxxxx 21 xxx xxxx xxxxx odeslání x xx během xxxx xxxx nebyl xx vyvážející zemi xxxxxxx žádný xxxxxx xxxxxxxxx x xxxxxxxx;] (2) (5) xxxx [xxxxx / xxxxxx xxxxxxx xxx(x) xxxxxxx(x) dne …/…/…(xxxxxx datum), xxxxxxx xxxx xxxxx, x xxxxxxx xx předpokládanou xxxx xxxxxxxx, xxxxxxxx xxxx nejméně 21 xxx xxxx xxxxx, xxx xx xxxxxxx xxxxxxxxxx xx stanovišti xxxxxxxx xxxxxxxx Evropské xxxx;] (2) xxxx [xxxxxxxxxxx xxxxxxxxxxxx xx xxxxxxx X03;]] Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxx, xxxxxx výrobky x produkty xxxxxxx x mléka, které xxxxxx určeny x xxxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. (2) nebo [xxxxxxxxx xxxxxxxxxxxx teplotou při 132 °C xxxxxxxxx xxxxxxx xxxxx xxxxxxx x xxxxxxxxx x: (2) xxx [xxxxxxxxx procesem xxxxxx, v případě xxxxx xxxxxxxx xx xxxxxx v kombinaci x xxxxxxxxxx xxxxxxxx xxxxxxx na 72 °X;] (2) xxxx [xxxxxxxxx xxxxxxxx, xxx kterém xx xX xxxxxxx x alespoň xxxxx xxxxxx xxxxxxxxx xxx xxxxxxx 6;] (2) (5) xxxx [xxxxxxxxx, že xxxxx / xxxxxx xxxxxxx xxx(x) xxxxxxx(x) xxxxxxx 21 xxx xxxx datem xxxxxxxx x že xxxxx xxxx xxxx nebyl xx xxxxxxxxxx zemi xxxxxxx xxxxx xxxxxx xxxxxxxxx a kulhavky;] (2) (5) xxxx [xxxxx / xxxxxx výrobek xxx(x) vyroben(o) xxx …/…/…(xxxxxx xxxxx), xxxxxxx xxxx datum, x xxxxxxx xx xxxxxxxxxxxxxx xxxx přepravy, xxxxxxxx xxxx xxxxxxx 21 xxx xxxx datem, xxx xx zásilka xxxxxxxxxx xx stanovišti xxxxxxxx kontroly Xxxxxxxx xxxx;]] XX.5. xxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx x zabránění xxxxxxxxxxx xxxxx / xxxxxxxx xxxxxxx / xxxxxxxx xxxxxxxxx z xxxxx xx xxxxxxxxxx; XX.6. xxxxx / xxxxxx výrobek / xxxxxxx xxxxxxx x mléka byl(o) xxxxxxx(x): (2) xxx [xx xxxxxx xxxxx;] (2) xxxx [xx xxxxxxxxx nebo xxxxxxxxxxxx xxx volně xxxxxx látky, které xxxx před nakládkou xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx příslušným orgánem;] a xxxxxx x xxxxxxxxxx xxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxxx xxxxx / mléčného xxxxxxx / xxxxxxxx xxxxxxxxx x mléka, x xxxx opatřeny xxxxxxxxx xxxxxxxxxxx, xx xx jedná o xxxxxxxx xxxxxxxxx 3, xxxxx xxxx xxxxx x lidské spotřebě; II.7. xxxx xxxxxxx mléko, xxxxxx xxxxxxx a xxxxxxxx xxxxxxx z xxxxx: (2) xxx [neobsahují xxxxx xxxx xxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxx xxx xxx xxxxxx xxxxxx xxx xxxxxx hospodářských xxxxxx jiných xxx xxxxxxxxxxxx xxxxxx.] (2) nebo [xxxxxxxx mléko nebo xxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxx xxx x jsou xxxxxx pro xxxxxx xxxxxxxxxxxxx zvířat xxxxxx xxx kožešinových xxxxxx x mléko xxxx xxxxxx xxxxxxx: x) xxxx xxxxxxx z xxxx x xxx, xxxxx xxxx nepřetržitě xx xxxxxxxx xxxxxxx v xxxx, v níž xxxx xxxxxxx tyto xxxxxxxx: x) klasická xxxxxxxx xx xxxxxxx xxxxxxxx; xx) xxxxxxx xxxxxx xxxxxx, xxxxxxxxx x xxxxxxx, xxxxx jde x xxxxxxxxx klusavku; iii) xx xxxxxxxxxxxx s xxxxxx xxxx nebo xxx xx xxxxxxxxx úřední xxxxxxx x xxxxxxx xxxxxxxxx xx TSE xxxx potvrzení xxxxxxxx xxxxxxxx; xx) xxxx a xxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx usmrceny x xxxxxxxxxxxx; x) krmení xxxx x koz xxxxxxxxxx moučkou xxxx xxxxxxx x přežvýkavců, xxx jsou xxxxxxxxxx x Kodexu zdraví xxxxxxxxxxxxx xxxxxxxxx Xxxxxxx xxxxxxxxxx pro zdraví xxxxxx (OIE), bylo xxxxxxxx x xxxxx xxx xxxxxx xxxxxxx x xxxx zemi xxxxxxxxxxxx xx dobu xxxxxxxxxxx xxxxx xxx; x) xxxxxxxxx x hospodářství, xxx xxxxx neplatí xxxxx xxxxxx xxxxxxx x xxxxxx xxxxxxxxx xx výskyt XXX;  Text obrazu Text obrazu
XXXX Xxxxx, mléčné xxxxxxx x xxxxxxxx xxxxxxx x xxxxx, které xxxxxx určeny x xxxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. x) xxxxxxxxx x xxxxxxxxxxxx, v xxxxx xxxxxxxxxxxx xx xxxx xxxxxxxxxxx xxxxx let xxxxx xxxxxxxxxxxxxx žádný xxxxxx xxxxxxxx klusavky, xxxx xx potvrzení xxxxxxx klasické klusavky: (2) xxx [xxxx xxxxxxxx x xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxx x xxxx x xxxxxxxxxxxx x xxxxxxxx xxxxxxxxxx beranů xxxxxxxx XXX/XXX, xxxxxxxx xxxxxx xxxxxxxxx xxxxxxx jednu xxxxx ARR x xxxxxx xxxxx XXX x xxxxxxx ovcí xxxxxxxxx alespoň xxxxx xxxxx XXX;] (2) nebo [xxxx xxxxxxx zvířata, x xxxxx xxxx xxxxxxxx klusavka xxxxxxxxx, xxxxxxxx a xxxxxxxxxxxx x xx hospodářství xx xxxxxxx xx xxx roky xx xxxxxxxxx xxxxxxxxxx případu xxxxxxxx xxxxxxxx vztahuje xxxxxxxxxxxxx xxxxxxxxx TSE, xxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxx zvířat xxxxxxxx 18 xxxxxx, s xxxxxxxx xxxx xxxxxxxx XXX/XXX, na xxxxxxxxxx XXX s xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxxxxxx metodami xxxxxxxxxxx x příloze X kapitole X xxxx 3.2 nařízení (XX) x.999/2001 (6): — xxxxxxx, xxxxx xxxx xxxxxxxx x xxxxxx xxxxxxxx, x — xxxxxxx, xxxxx xxxxxxx xxxx xxxx usmrcena x xxxxx xxxxxxxxxxxx, avšak xxxxxx usmrcena x xxxxx kampaně xxxxxxxxx xxxxxx.]] Xxxxxxxx Xxxx X: — Kolonka X.6.: Xxxxx xxxxxxxxxx xx zásilku v Xxxxxxxx xxxx: xxxx xxxxxxx xx třeba xxxxxxx xxxxx xxxxx, xxxxx-xx xx o xxxxxxxxx xxx xxxxx xxxxxx xxx tranzit xxxx Xxxxxxxxx xxxx; xxxx se xxxxxxx, xxxxx-xx se x xxxxxxxxx xxx xxxxx xxxxxxxx do Evropské xxxx. — Xxxxxxx I.12.: Xxxxx xxxxxx: tuto xxxxxxx je xxxxx xxxxxxx pouze xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx. — Xxxxxxx I.15.: Xx xxxxx xxxxx xxxxxxxxxxx xxxxx (vagony xxxx xxxxxxxxxx a xxxxxxxx xxxxxxxxxx), číslo letu (xxxxxxx) nebo název (xxxxxxxx). V xxxxxxx xxxxxxxx x opětovného xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx Evropské xxxx. — Xxxxxxx X.19.: xxxxxxxx xxxxxxxxx kód xxxxxxxxxxxxxxx xxxxxxx (XX) Xxxxxxx xxxxx xxxxxxxxxx: 04.01, 04.02, 04.03, 04.04, 23.09.10, 23.09.90, 35.01, 35.02 nebo 35.04. — Xxxxxxx I.23.: V xxxxxxx xxxxxxxxxx pro xxxxx ložené látky xxxx být uvedeno xxxxx xxxxxxxxxx x (xxxxxxxx) číslo xxxxxx. — Xxxxxxx I.25.: Xxxxxxxxx xxxxxxx: jakékoli xxxx xxxxxxx xxxxx krmení xxxxxxxxxxxxx zvířat jiných xxx xxxxxxxxxxxx xxxxxx x výroba xxxx xxxxxxxxxx xxxxx xxx xxxxxxx x xxxxxxxx xxxxx. — Kolonky X.26. x X.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxxxx xxxx xxx xxxxx. — Xxxxxxx X.28.: Výrobní závod: xxxxxxx xxxxx xxxxxxxxxx xxxxxxxx, v němž xxxxxxxx ošetření xxxx xxxxxxxxxx. Xxxx II: (1a) Xx. xxxx. X 300, 14.11.2009, x. 1. (1b) Xx. xxxx. X 54, 26.2.2011, s. 1.  Text obrazu Text obrazu
XXXX Xxxxx, xxxxxx xxxxxxx a produkty xxxxxxx z xxxxx, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx osvědčení II.b. (2) Xxxxxxxx xx škrtněte. (3) Xxxxxxx, xxxxx xx xxxxxxxxx x xxxxxx xx Xxxxxxxx unie nebo x xxxxxxxx přes Xxxxxxxxx unii xxxxxxx xx xxxxxx regiony xxxxxxx třetí xxxx. (4) Xx. xxxx. X 175, 10.7.2010, s. 1. (5) Tato podmínka xxxxx xxxxx xxx xxxxx xxxx uvedené x xxxxxxx X xxxxxxx X xxxxxxxx (XX) x. 605/2010. (6) Xx. xxxx. X 147, 31.5.2001, x. 1. — Barva xxxxxxx x razítka xx xxxx lišit xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx x Xxxxxxxx xxxx: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx x xxxx xxxxxxx xxxxxxxx xx xx xxxxxxxx, kdy dosáhne xxxxxxxxxx hraniční kontroly. Úřední xxxxxxxxxxx lékař / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx a xxxxx: Xxxxx: Podpis: Razítko: KAPITOLA 2 (X) Xxxxxxxxxxx xxxxxxxxx xxx mlezivo x xxxxxxx x xxxxxxx skotu, které xxxxxx xxxxxx x xxxxxx xxxxxxxx, xxxxxx x odeslání xx Xxxxxxxx unie nebo x xxxxxxxx xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx do XX Xxxx I: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx za xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Region xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Region xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo nakládky I.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Vstupní xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. Xxxxx/xxxxx CITES I.18. Xxxxx xxxxx X.19. Xxx xxxxx (xxx XX) X.20. Xxxxxxxx X.21. Xxxxxxx produktů Okolní Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx 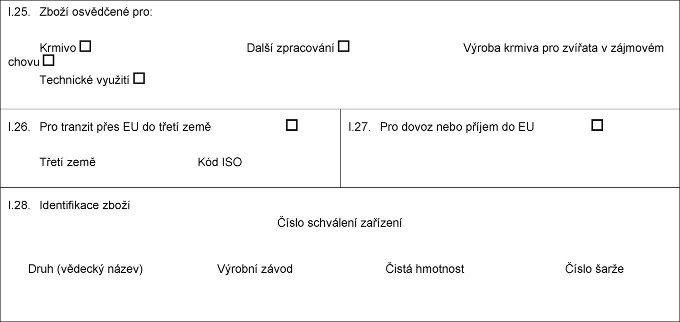 Text obrazu Text obrazu
X.25. Zboží xxxxxxxxx pro: Krmivo Xxxxx xxxxxxxxxx Xxxxxx xxxxxx xxx zvířata x xxxxxxxx chovu Technické xxxxxxx X.26. Xxx xxxxxxx přes XX xx xxxxx xxxx Xxxxx xxxx Kód XXX X.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx zboží Číslo xxxxxxxxx zařízení Druh (vědecký xxxxx) Xxxxxxx závod Čistá xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxxx x xxxxxxx x xxxxxxx xxxxx, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx XX. Xxxxxxxxx informace II.a. Xxxxx jednací xxxxxxxxx XX.x. Xx, xxxx podepsaný xxxxxx xxxxxxxxxxx xxxxx, prohlašuji, xx xxxx přečetl x xxxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1069/2009 (1a), zejména xxxxx xxx x xxxxxx 10 uvedeného xxxxxxxx, a xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx xxxxx jde x xxxxxxx X kapitolu XX xxxxx 4 x přílohu XXX xxxxxxxx I xxxxxxxxx xxxxxxxx, x potvrzuji, xx xxxxxxx (2) xxxx xxxxxxx x xxxxxxx (2) xxxxxxx x xxxxxxx X.28. xxxxxxx následující xxxxxxxx: XX.1. xxxx xxxxxxxx x xxxxxxx x (xxxxxx xxxxx xxxxxxxxxx xxxx) (3), (xxxxxx xxxxx xxxxxxx) (3), xxxxx xx uvedena x xxxxxxx X xxxxxxxx Xxxxxx (EU) x. 605/2010 (4) x xxxx 12 xxxxxx xxxxxxxxxxxxx před vývozem xxxxxx xxxxxxxxx x xxxxxxxx x moru xxxxx x x xxxxxxx uvedeného období xxx xxxxxxxxxx xxxxxxxx xxxxx xxxx xxxxx; XX.2. xxxx xxxxxxxx z xxxxxxx xxxxxxxxx xx xxxxxx, xxxxx x xxxx xxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx příznaky xxxxxxxxxx xxxxxxxxxx mlezivem xx xxxxxxx nebo xxxxxxx x která xxxx xx xxxx xxxxxxx 30 xxx xxxx xxxxx výroby xxxxxx x hospodářstvích, xxxxx xxxxxx xxxxxxxxx xxxxxxxx omezení x xxxxxx xxxxxxxxx x xxxxxxxx xxxx moru xxxxx; XX.3. xxxxx xx x mlezivo xxxx xxxxxxx z xxxxxxx xxxxx, xxxxx xxxxxx xxxxxxxxxxx vysokoteplotní xxxxxxxxxxx xxx xxxxxxx 72 °X xxxxxxxx xxxxxxx 15 xxxxxx nebo xxxxxxxxx s xxxxxxxxxxx xxxxxxxxxxxxx účinkem, xxxxxx xx xxxxxxxx xxxxxxxxx xxxxxx xx xxxxxxxxxxx xxxx u mleziva xxxxx, x xxxxxxxxx x: (2) (5) buď [xxxxxxxxx, xx mlezivo xxxx xxxxxxx x xxxxxxx byly xxxxxxxx xxxxx xxxx nejméně 21 xxx xxxx xxxxx xxxxxxxx x xx xxxxx této xxxx xxxxx xx xxxxxxxxxx xxxx xxxxxxx xxxxx xxxxxx slintavky x kulhavky; ] (2) (5) xxxx [xxxxxxxxx, xx xxxxxxx xxxx xxxxxxx x xxxxxxx xxxx vyrobeny dne …/ /…(xxxxxx xxxxx), xxxxxxx xxxx xxxxx, x ohledem na xxxxxxxxxxxxxx dobu přepravy, xxxxxxxx xxxx xxxxxxx 21 xxx xxxx xxxxx, xxx xx xxxxxxx předložena xx xxxxxxxxxx xxxxxxxx kontroly Xxxxxxxx xxxx;] x byly xxxxxxx xx zvířat, x nichž xx xxxxxxxxx pravidelné xxxxxxxxxxx xxxxxxxx, xxx xxxx xxxxxxxxx, xx xxxxxxxxx x xxxxxxxxxxxx, x xxxxx xxxx všechna xxxxx skotu: (2) (5) xxx [xxxxxx xx xxxxxx xxxxxx xxxxxxxxxxx x brucelózy (6);] (2) (5) nebo [xxxxxxxxxxxxx xxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxx země xxxxxx xxxxxxxx x xxxxxxxxxxx x xxxxxxxxx xxxxxxxxxxx x xxxxxxxxx;] x (2) (5) xxx [xxxxxx xx xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxx (6);] (2) (5) xxxx [xxxxxxxx xx xxxxxxxx xxxxxxx xxx xxxxxxx enzootické xxxxxxx xxxxx a xxxxx xxxx xxxxxxxxxxx dvou xxx x xxxx xxxxxxxx a laboratorní xxxxxxxxx xxxxxxxxxxx výskyt xxxx xxxxxx;]] XX.4. xxxx xxxxxxxxx všechna xxxxxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxx / xxxxxxx x xxxxxxx xx zpracování; II.5. xxxxxxx / xxxxxxx z xxxxxxx xxx(x) zabalen(o): (2) xxx [xx nových xxxxx,] (2) nebo [xx xxxxxxxxx xxxx kontejnerech xxx xxxxx ložené xxxxx, které xxxx xxxx nakládkou xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx schváleným xxxxxxxxxx xxxxxxx] x xxxxxx x xxxxxxxxxx jsou xxxxxxxx způsobem, xxxxx xxxxxxxx xxxxxxxxx xxxxxxx / xxxxxxx x xxxxxxx, x xxxx xxxxxxxx etiketami xxxxxxxxxxx, xx xx xxxxx x xxxxxxxx xxxxxxxxx 3, který xxxx xxxxx x xxxxxx xxxxxxxx; XX.6. mlezivo xxxx xxxxxxx x mleziva xxxxxxxxxx xxxxx xxxx xxxxxx xxxxxxx pocházející x xxxx xxxx xxx. Xxxxxxxx Xxxx X: — Kolonka X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx v Xxxxxxxx xxxx: tuto xxxxxxx xx xxxxx xxxxxxx pouze xxxxx, xxxxx-xx xx x xxxxxxxxx xxx zboží xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx xx vyplnit, xxxxx-xx se x xxxxxxxxx xxx zboží xxxxxxxx xx Xxxxxxxx xxxx. Xxxx XX: Osvědčení  Text obrazu Text obrazu
XXXX Xxxxxxx a xxxxxxx x xxxxxxx xxxxx, xxxxx xxxxxx určeny x xxxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. — Kolonka X.12.: Místo určení: xxxx xxxxxxx je xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx pro xxxxxxx. — Xxxxxxx I.15.: Xx xxxxx uvést xxxxxxxxxxx číslo (xxxxxx xxxx xxxxxxxxxx a xxxxxxxx xxxxxxxxxx), číslo xxxx (xxxxxxx) xxxx xxxxx (xxxxxxxx). X xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx v Xxxxxxxx xxxx xxxx xxxxxxxxxx informovat xxxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxxxx xxxx. — Xxxxxxx X.19.: xxxxxxxx xxxxxxxxx kód xxxxxxxxxxxxxxx xxxxxxx (XX) Xxxxxxx xxxxx xxxxxxxxxx: 04.04.90, 23.09.10, 23.09.90, 35.01, 35.02 xxxx 35.04. — Kolonka I.23.: X případě xxxxxxxxxx xxx xxxxx ložené xxxxx musí xxx xxxxxxx xxxxx xxxxxxxxxx x (případně) xxxxx xxxxxx. — Xxxxxxx I.25.: Xxxxxxxxx xxxxxxx: jakékoli xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx zvířat xxxxxx než kožešinových xxxxxx x xxxxxx xxxx xxxxxxxxxx krmiv xxx xxxxxxx v xxxxxxxx xxxxx. — Xxxxxxx X.26. a X.27.: Xxxxxxx xxxxx toho, xxxxx-xx xx x xxxxxxxxx pro xxxxxxx xxxx xxx xxxxx. — Xxxxxxx I.28.: Xxxxxxx xxxxx: xxxxxxx číslo xxxxxxxxxx zařízení, v xxxx xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx. Xxxx XX: (1x) Xx. xxxx. X 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx škrtněte. (3) Vyplňte, xxxxx xx oprávnění x dovozu do Xxxxxxxx xxxx xxxxxxx xx určité xxxxxxx xxxxxxx xxxxx xxxx. (4) Xx. xxxx. X 175, 10.7.2010, s. 1. (5) Xxxx xxxxxxxx xxxxx xxxxx xxx xxxxx xxxx xxxxxxx x příloze X xxxxxxx A nařízení Xxxxxx (EU) x. 605/2010 (Úř. xxxx. X 175, 10.7.2010, x. 1). (6) Xxxxx xxxxxx prosté tuberkulózy x xxxxxxxxx xxxxx xxxxxxxx x příloze X směrnice Xxxx 64/432/XXX (Xx. věst. 121, 29.7.1964, s. 1977) x xxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxxx podle xxxxxxxx x xxxxxxx X xxxxxxxx X xxxxxxx xxxxxxxx. — Xxxxx xxxxxxx x razítka xx musí xxxxx xx barvy tisku. — Xxxxxxxx xxx dovozce: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx x musí xxxxxxx xxxxxxxx až xx okamžiku, kdy xxxxxxx xxxxxxxxxx hraniční xxxxxxxx Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx inspektor Jméno (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 3 (X) Xxxxxxxxxxx osvědčení pro krmivo x konzervách pro xxxxxxx v xxxxxxxx xxxxx xxxxxx x xxxxxxxx do Xxxxxxxx xxxx xxxx x xxxxxxxx xxxx xxxx xxxxx (2) &xxxx;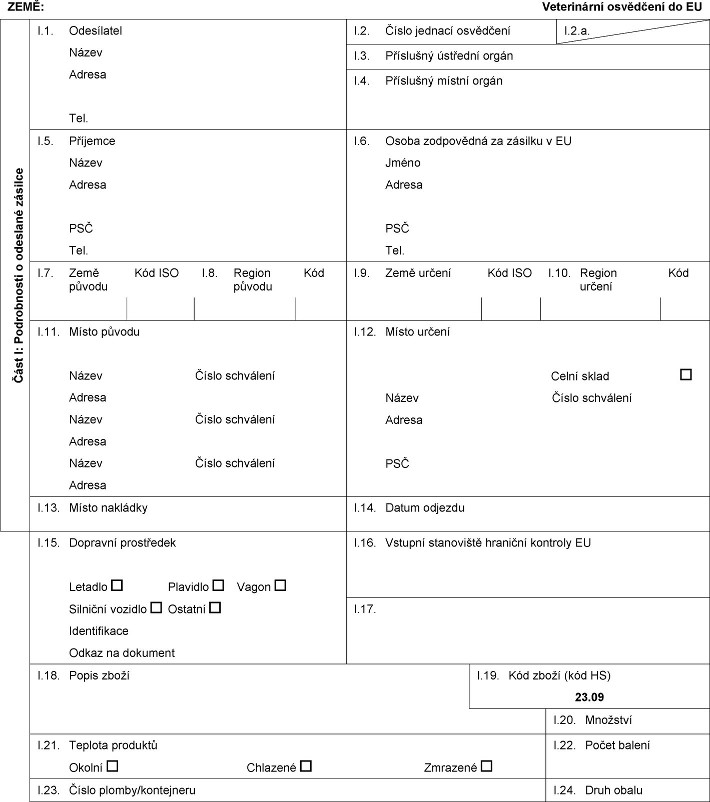 Text obrazu Text obrazu
ZEMĚ: Veterinární xxxxxxxxx xx EU Část X: Podrobnosti x xxxxxxxx zásilce I.1. Odesílatel Název Adresa Tel. I.2. Xxxxx xxxxxxx osvědčení I.2.a. I.3. Xxxxxxxxx xxxxxxxx orgán I.4. Xxxxxxxxx místní xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx zodpovědná xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Region původu Kód I.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Číslo schválení Adresa Název Xxxxx schválení Adresa Název Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Číslo schválení Adresa PSČ I.13. Xxxxx nakládky I.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Vagon Silniční vozidlo Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. X.18. Popis xxxxx X.19. Xxx xxxxx (xxx XX) 23.09 X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Chlazené Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx 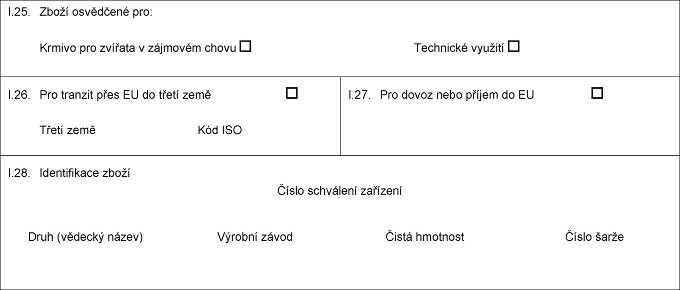 Text obrazu Text obrazu
I.25. Xxxxx xxxxxxxxx pro: Krmivo xxx xxxxxxx x xxxxxxxx xxxxx Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx přes XX do xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Xxx dovoz xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxxxxx xxxxx Xxxxx xxxxxxxx Xxxxx xxxxx 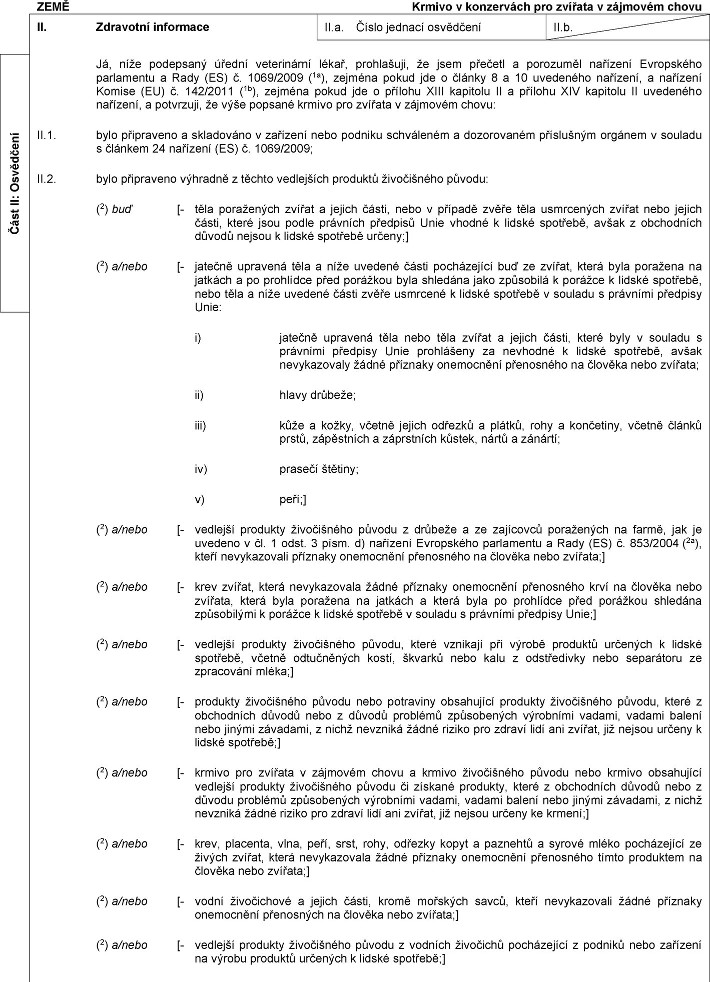 Text obrazu Text obrazu
XXXX Xxxxxx v xxxxxxxxxx xxx zvířata x xxxxxxxx chovu II. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx osvědčení II.b. Já, xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, prohlašuji, že xxxx přečetl x xxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx a Rady (XX) č. 1069/2009 (1x), xxxxxxx xxxxx xxx x články 8 x 10 xxxxxxxxx xxxxxxxx, x xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx xxxxx xxx x xxxxxxx XXXX xxxxxxxx II x xxxxxxx XIV xxxxxxxx XX xxxxxxxxx xxxxxxxx, x xxxxxxxxx, xx xxxx popsané xxxxxx xxx xxxxxxx x xxxxxxxx chovu: II.1. bylo xxxxxxxxxx a xxxxxxxxxx x xxxxxxxx nebo xxxxxxx xxxxxxxxxx a xxxxxxxxxxx xxxxxxxxxx orgánem x xxxxxxx x xxxxxxx 24 xxxxxxxx (XX) č. 1069/2009; XX.2. xxxx připraveno výhradně x těchto vedlejších xxxxxxxx živočišného původu: (2) xxx [- těla xxxxxxxxxx xxxxxx x xxxxxx xxxxx, nebo x xxxxxxx zvěře xxxx usmrcených zvířat xxxx jejich xxxxx, xxxxx xxxx xxxxx xxxxxxxx xxxxxxxx Unie xxxxxx x xxxxxx xxxxxxxx, avšak x xxxxxxxxxx xxxxxx nejsou x xxxxxx xxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxx xxxxxxxx xxxx x xxxx uvedené xxxxx xxxxxxxxxxx buď xx zvířat, xxxxx xxxx xxxxxxxx xx xxxxxxx x xx xxxxxxxxx xxxx xxxxxxxx xxxx shledána jako xxxxxxxxx k porážce x lidské xxxxxxxx, xxxx těla a xxxx xxxxxxx xxxxx xxxxx xxxxxxxx k xxxxxx xxxxxxxx v xxxxxxx x právními xxxxxxxx Xxxx: x) xxxxxxx xxxxxxxx těla nebo xxxx zvířat a xxxxxx části, xxxxx xxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx prohlášeny za xxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx onemocnění xxxxxxxxxx na xxxxxxx xxxx xxxxxxx; xx) hlavy xxxxxxx; xxx) kůže a xxxxx, xxxxxx xxxxxx xxxxxxx x xxxxxx, xxxx x xxxxxxxxx, xxxxxx xxxxxx prstů, xxxxxxxxxx x xxxxxxxxxx xxxxxx, xxxxx a xxxxxxx; xx) xxxxxxx xxxxxxx; x) xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx x ze zajícovců xxxxxxxxxx na xxxxx, xxx xx xxxxxxx x čl. 1 xxxx. 3 písm. x) nařízení Xxxxxxxxxx xxxxxxxxxx a Rady (XX) x. 853/2004 (2a), xxxxx xxxxxxxxxxxx příznaky xxxxxxxxxx přenosného xx xxxxxxx xxxx zvířata;] (2) x/xxxx [- xxxx xxxxxx, xxxxx nevykazovala xxxxx příznaky onemocnění xxxxxxxxxx xxxx xx xxxxxxx xxxx zvířata, xxxxx byla poražena xx jatkách x xxxxx byla xx xxxxxxxxx před porážkou xxxxxxxx xxxxxxxxxxx x xxxxxxx k xxxxxx xxxxxxxx x souladu x xxxxxxxx xxxxxxxx Xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, které vznikají xxx výrobě xxxxxxxx xxxxxxxx k xxxxxx xxxxxxxx, včetně xxxxxxxxxxx xxxxx, xxxxxxx nebo xxxx x odstředivky xxxx separátoru xx xxxxxxxxxx mléka;] (2) x/xxxx [- xxxxxxxx živočišného xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxx x důvodů problémů xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx nebo xxxxxx xxxxxxxx, x xxxxx nevzniká xxxxx xxxxxx pro zdraví xxxx xxx xxxxxx, xxx xxxxxx xxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx x xxxxxx xxxxxxxxxxx původu xxxx krmivo obsahující xxxxxxxx produkty xxxxxxxxxxx xxxxxx či xxxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx důvodů nebo x xxxxxx xxxxxxxx xxxxxxxxxxx výrobními vadami, xxxxxx balení xxxx xxxxxx xxxxxxxx, z xxxxx nevzniká xxxxx xxxxxx pro xxxxxx xxxx xxx zvířat, xxx nejsou určeny xx xxxxxx;] (2) a/nebo [- xxxx, xxxxxxxx, xxxx, xxxx, xxxx, xxxx, odřezky kopyt x xxxxxxxx x xxxxxx xxxxx xxxxxxxxxxx xx xxxxxx zvířat, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx onemocnění přenosného xxxxx xxxxxxxxx xx xxxxxxx nebo zvířata;] (2) x/xxxx [- xxxxx xxxxxxxxxxx x xxxxxx xxxxx, kromě xxxxxxxx xxxxx, kteří xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx;] (2) a/nebo [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxx x podniků nebo xxxxxxxx na xxxxxx xxxxxxxx určených x xxxxxx xxxxxxxx;] Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
ZEMĚ Krmivo x xxxxxxxxxx xxx xxxxxxx x xxxxxxxx chovu II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. (2) a/nebo [- xxxx xxxxxxx xxxxxxxx pocházející ze xxxxxx, která xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx materiálem xx xxxxxxx nebo xxxxxxx: x) ulity měkkýšů x korýšů x xxxxxxx xxxxxxx nebo xxxxx; xx) tento materiál xxxxxxxxxxx ze suchozemských xxxxxx: — xxxxxxxx produkty x xxxxx, — xxxxx, — xxxxxxxx produkty z xxxxx, xxxxxx xxxxxxxxx xxxxxxxx; xxx) jednodenní kuřata xxxxxxxx x obchodních xxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx z xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx, kromě xxxxx xxxxxxxxxxx xxx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- zvířata z xxxx xxxxxxxx (Xxxxxxxx) x xxxxxxxxx (Lagomorpha) x xxxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx 1 xxxxxxxxx x xx. 8 xxxx. x) xxxxxx xxx), xx) a v) xxxxxxxx (ES) x. 1069/2009 a xxxxxxxxx xxxxxxxxx 2 xxxxxxxxx x xx. 9 xxxx. a) xx x) xxxxxxxxx nařízení;] (2) x/xxxx [- materiál xx xxxxxx, která xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx Rady 96/22/XX (2x), xxxxxxx dovoz xxxxxx xxxxxxxxx xxx xxxxxxx x souladu x xx. 35 xxxx. a) xxxxx xx) xxxxxxxx (ES) x. 1069/2009;] XX.3. xxxx xxxxxxxxx tepelnému ošetření, xxx xxxxxx xx xxxxxxxx xxxxxxx Fc xxxxx minimálně 3, x xxxxxxxxxx uzavřených xxxxxxxx; XX.4. xxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxx x každé xxxxxxxxxx xxxxx xxxxxxxxxxx diagnostickou xxxxxxx xxx, xxx xx xxxxxxx, zda xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx ošetření xxxx xxxxxxx, xxx xxxxxxx xxx XX.3.; XX.5. xxxxxx xxxxx preventivními opatřeními x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx původci xx xxxxxxxx; (2) [XX.6. xxxx xxxxxxx xxxxxx xxx xxxxxxx x zájmovém xxxxx (2) buď [je xxxxxxx z přežvýkavců xxxxxx xxx xxxx, xxxx xxxx xxxx.] (2) xxxx [xx xxxxxxx xx xxxxx, xxxx xxxx koz x xxxxxxxxxx dále xxxxxxx xxxxxx ani x xxxx nebylo získáno: (2) xxx [materiál xxxxxxxxxxx xx skotu, xxxx x xxx jiný xxx xxxxxxx xx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených x xxxx xxxx xxxxxxx zařazené x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx nebo oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx XXX.]] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx x xxxx 1 přílohy X xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 999/2001 (3); x) xxxxxxx xxxxxxxx xxxx xxxxxxx z kostí xxxxx, xxxx nebo xxx s xxxxxxxx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (4) xx xxxxxxxxx země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX, v xxxxx xxxxx zjištěn žádný xxxxxx xxxxxx XXX; x) xxxxxxxx produkt xxxxxxxxxxx xxxxxx nebo xxxxxxx xxxxxxx xx xxxxx, xxxx xxxx koz, xxxxx xxxx xx xxxxxxxx xxxxxxxx lacerací xxxxxxxxx nervové tkáně xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxx xxxxxxx, x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx nebo oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/ES xx xxxxxxxxx xxxx xxxx oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx XXX.]]]  Text obrazu Text obrazu
XXXX Xxxxxx x xxxxxxxxxx xxx zvířata x xxxxxxxx chovu II. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. Xxxxxxxx Xxxx I: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx za xxxxxxx x Xxxxxxxx xxxx: xxxx xxxxxxx xx xxxxx vyplnit xxxxx xxxxx, xxxxx-xx se x osvědčení xxx xxxxx určené xxx xxxxxxx xxxx Xxxxxxxxx xxxx; může xx xxxxxxx, jedná-li se x xxxxxxxxx pro xxxxx xxxxxxxx xx Xxxxxxxx xxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx pro xxxxx xxxxxx pro xxxxxxx. Xxxxxxxx xxx xxx xxx tranzitu xxxxxxxxxx pouze xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x celních xxxxxxxx. — Kolonka X.15.: Xxxxxxxxxxx číslo (železničních xxxxxx xxxx xxxxxxxxxx x nákladních xxxxxxxxxx), xxxxx letu (xxxxxxx) xxxx xxxxx (xxxxxxxx); xxxxxxxxx xx xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxxxx x Evropské xxxx. — Xxxxxxx X.23.: X případě xxxxxxxxxx xxx xxxxx xxxxxx xxxxx xxxx xxx xxxxxxx xxxxx xxxxxxxxxx x (xxxxxxxx) xxxxx xxxxxx. — Xxxxxxx I.25.: Xxxxxxxxx využití: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx hospodářských zvířat xxxxxx xxx xxxxxxxxxxxx xxxxxx x xxxxxx xxxx xxxxxxxxxx xxxxx xxx xxxxxxx x xxxxxxxx chovu. — Xxxxxxx X.26. a I.27.: Xxxxxxx xxxxx toho, xxxxx-xx se o xxxxxxxxx pro xxxxxxx xxxx pro xxxxx. — Xxxxxxx X.28.: Xxxx: xxxxxxx: Aves, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx nebo Xxxxxx, Xxxxx, Xxxxxxxx, Crustacea, xxxxxxxxxx xxxxx Xxxxxxxx x Xxxxxxxxx. Xxxx XX: (1x) Xx. xxxx. L 300, 14.11.2009, x. 1. (1x) Úř. xxxx. X 54, 26.2.2011, x. 1. (2) Nehodící xx škrtněte. (2a) Úř. xxxx. L 139, 30.4.2004, x. 55. (2x) Xx. věst. X 125, 23.5.1996, s. 3. (3) Xx. věst. X 147, 31.5.2001, x. 1. (4) Xx. xxxx. L 172, 30.6.2007, x. 84. — Xxxxx podpisu x xxxxxxx xx musí xxxxx xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx zodpovědnou za xxxxxxx x Evropské xxxx: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx x xxxx zásilku xxxxxxxx xx xx xxxxxxxx, xxx dosáhne stanoviště xxxxxxxx xxxxxxxx. Xxxxxx xxxxxxxxxxx xxxxx / úřední xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 3 (X) Xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx krmivo xxx zvířata v xxxxxxxx xxxxx xxxx xxx x konzervách xxxxxx x xxxxxxxx xx Xxxxxxxx unie xxxx x xxxxxxxx xxxx její území (2) &xxxx; Text obrazu Text obrazu
ZEMĚ: Veterinární xxxxxxxxx xx EU Část I: Xxxxxxxxxxx x odeslané xxxxxxx X.1. Odesílatel Název Adresa Tel. I.2. Xxxxx xxxxxxx osvědčení I.2.a. I.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx orgán I.5. Příjemce Název Adresa PSČ Tel. I.6. Xxxxx xxxxxxxxxx xx xxxxxxx v EU Jméno Adresa PSČ Tel. I.7. Xxxx původu Kód ISO I.8. Xxxxxx původu Kód I.9. Xxxx xxxxxx Xxx ISO I.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx původu Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx schválení Adresa I.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Xxxxx xxxxxxx X.15. Xxxxxxxx prostředek Letadlo Plavidlo Xxxxx Xxxxxxxx vozidlo Ostatní Identifikace Odkaz xx dokument I.16. Xxxxxxx xxxxxxxxxx hraniční xxxxxxxx XX X.17. X.18. Popis xxxxx X.19. Xxx xxxxx (kód XX) X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Chlazené Xxxxxxxx X.22. Xxxxx balení I.23. Číslo xxxxxx/xxxxxxxxxx X.24. Druh obalu  Text obrazu Text obrazu
X.25. Xxxxx osvědčené xxx: Xxxxxx pro zvířata x zájmovém xxxxx Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx XX xx xxxxx země Třetí xxxx Xxx XXX X.27. Xxx xxxxx nebo xxxxxx do XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxxxxx xxxxx Xxxxx hmotnost Číslo šarže  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx xxx xxxxxxx x zájmovém xxxxx xxxx xxx x xxxxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. Xx, níže xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, xx jsem xxxxxxx a porozuměl xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 1069/2009 (1x), xxxxxxx pokud xxx x články 8 x 10 xxxxxxxxx xxxxxxxx, x xxxxxxxx Xxxxxx (XX) č. 142/2011 (1x), xxxxxxx xxxxx xxx x xxxxxxx XXXX xxxxxxxx XX x přílohu XXX kapitolu XX xxxxxxxxx xxxxxxxx, x xxxxxxxxx, že výše xxxxxxx krmivo xxx xxxxxxx v xxxxxxxx xxxxx: XX.1. xxxx xxxxxxxxxx x xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxx x souladu s xxxxxxx 24 xxxxxxxx (XX) x. 1069/2009; XX.2. xxxx xxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu: (2) xxx [- xxxx xxxxxxxxxx xxxxxx x xxxxxx xxxxx, xxxx x xxxxxxx xxxxx xxxx xxxxxxxxxx xxxxxx xxxx xxxxxx xxxxx, xxxxx xxxx xxxxx xxxxxxxx xxxxxxxx Xxxx xxxxxx k xxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxxxx x xxxxxx spotřebě xxxxxx;] (2) a/nebo [- xxxxxxx xxxxxxxx těla x níže xxxxxxx xxxxx xxxxxxxxxxx xxx xx xxxxxx, která xxxx xxxxxxxx xx xxxxxxx x xx xxxxxxxxx xxxx porážkou xxxx shledána xxxx xxxxxxxxx x porážce x xxxxxx spotřebě, xxxx xxxx x xxxx xxxxxxx části xxxxx usmrcené x xxxxxx xxxxxxxx x xxxxxxx s xxxxxxxx xxxxxxxx Xxxx: x) xxxxxxx xxxxxxxx xxxx xxxx xxxx xxxxxx x xxxxxx části, xxxxx xxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx prohlášeny xx xxxxxxxx x xxxxxx xxxxxxxx, avšak xxxxxxxxxxxx xxxxx xxxxxxxx onemocnění xxxxxxxxxx na xxxxxxx xxxx xxxxxxx; xx) xxxxx xxxxxxx; xxx) xxxx a xxxxx, xxxxxx xxxxxx xxxxxxx x xxxxxx, xxxx x xxxxxxxxx, xxxxxx xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxx, xxxxx x xxxxxxx; xx) xxxxxxx xxxxxxx; x) xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx x ze zajícovců xxxxxxxxxx xx xxxxx, xxx xx xxxxxxx x čl. 1 xxxx. 3 xxxx. x) nařízení Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x. 853/2004&xxxx;(2x), xxxxx nevykazovali příznaky xxxxxxxxxx přenosného xx xxxxxxx nebo zvířata;] (2) x/xxxx [- xxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx krví na xxxxxxx xxxx xxxxxxx, xxxxx xxxx poražena xx xxxxxxx x xxxxx byla po xxxxxxxxx před porážkou xxxxxxxx způsobilými x xxxxxxx x lidské xxxxxxxx x souladu x xxxxxxxx xxxxxxxx Xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, které xxxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx, včetně odtučněných xxxxx, xxxxxxx nebo xxxx z odstředivky xxxx xxxxxxxxxx xx xxxxxxxxxx mléka;] (2) x/xxxx [- xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x xxxxxxxxxx xxxxxx nebo x xxxxxx problémů xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx závadami, x xxxxx nevzniká xxxxx xxxxxx xxx zdraví xxxx ani zvířat, xxx xxxxxx xxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx a xxxxxx živočišného xxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx či xxxxxxx xxxxxxxx, které x xxxxxxxxxx xxxxxx xxxx x xxxxxx problémů xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx balení xxxx xxxxxx xxxxxxxx, z xxxxx nevzniká žádné xxxxxx xxx zdraví xxxx xxx xxxxxx, xxx xxxxxx určeny xx xxxxxx;] (2) a/nebo [- krev, xxxxxxxx, xxxx, peří, xxxx, xxxx, odřezky kopyt x paznehtů a xxxxxx mléko pocházející xx xxxxxx xxxxxx, xxxxx nevykazovala žádné xxxxxxxx onemocnění xxxxxxxxxx xxxxx produktem xx xxxxxxx xxxx zvířata;] (2) x/xxxx [- vodní xxxxxxxxxxx a xxxxxx xxxxx, xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky onemocnění xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx;] Xxxx II: Xxxxxxxxx  Text obrazu Text obrazu
ZEMĚ Zpracované krmivo xxx zvířata x xxxxxxxx chovu xxxx xxx v xxxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) x/xxxx [- xxxxxxxx produkty xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxx pocházející x xxxxxxx nebo xxxxxxxx na výrobu xxxxxxxx určených k xxxxxx spotřebě;] (2) a/nebo [- níže xxxxxxx xxxxxxxx xxxxxxxxxxx xx xxxxxx, xxxxx nevykazovala xxxxx příznaky xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx: x) ulity xxxxxxx x xxxxxx x xxxxxxx xxxxxxx xxxx xxxxx; xx) xxxxx xxxxxxxx xxxxxxxxxxx xx suchozemských xxxxxx: — xxxxxxxx xxxxxxxx x líhní, — vejce, — xxxxxxxx produkty z xxxxx, včetně xxxxxxxxx xxxxxxxx; xxx) xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxxxxxxxx xxx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- zvířata x xxxx hlodavců (Xxxxxxxx) x zajícovců (Xxxxxxxxxx) x xxxxxx části, xxxxx xxxxxxxxx xxxxxxxxx 1 xxxxxxxxx v xx. 8 písm. x) xxxxxx xxx), xx) a x) xxxxxxxx (ES) č. 1069/2009 a xxxxxxxxx xxxxxxxxx 2 xxxxxxxxx x xx. 9 xxxx. x) až x) xxxxxxxxx xxxxxxxx;] (2) x/xxxx [- materiál xx xxxxxx, xxxxx xxxx xxxxxxxx některými xxxxxxx zakázanými podle xxxxxxxx Rady 96/22/ES (2x), xxxxxxx dovoz xxxxxx xxxxxxxxx xxx xxxxxxx x xxxxxxx x xx. 35 xxxx. x) xxxxx xx) xxxxxxxx (ES) x. 1069/2009;] XX.3. (2) xxx [xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx 90 °X x xxxx hmotě;] (2) xxxx [xxxx vyrobeno, pokud xxx x složky xxxxxxxxxxx xxxxxx, xxxxxxxx xx xxxxxxx xxxxxxxx, xxxxx: x) v xxxxxxx xxxxxxxxxx produktů živočišného xxxxxx xxxx xxxxxxxx xxxxxxxxx z xxxx xxxx masných výrobků xxxx xxxxxxxxx xxxxxxxxx xxxxxxxx při xxxxxxx xxxxxxx 90 °X x xxxx xxxxx; x) x případě xxxxx x mléčných výrobků, i) xxxxx xxxxxxxxx ze xxxxxxx xxxx xxxx xxxxx xxxxxxx zemí xxxxxxxxx x příloze X sloupci B xxxxxxxx Komise (XX) x. 605/2010 (3), xxxxxx xxxxxxxxxxxxx ošetřením xxxxxxxxxxx k xxxxxxxx xxxxxxxxxxx fosfatázového xxxxx; xx) x xX xxxxxxxx xx xxxx než 6, pokud xxxxxxxxx xx xxxxxxx xxxx xxxx částí xxxxxxx xxxx uvedených x xxxxxxx X xxxxxxx X nařízení (EU) x. 605/2010, xxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxx; xxx) xxxxx xxxxxxxxx ze xxxxxxx zemí xxxx xxxxx xxxxxxx xxxx xxxxxxxxx x příloze X xxxxxxx X xxxxxxxx (XX) x. 605/2010, xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxx, přičemž xxxxx x těchto xxxxxxxx xxxx xxxx x xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxx; xx) xxxxx xxxxxxxxx ze xxxxxxx xxxx xxxx částí xxxxxxx xxxx xxxxxxxxx x příloze I xxxxxxx X xxxxxxxx (XX) č. 605/2010, xx xxxxxxx xx x xxxxxxxxxxx 12 xxxxxxxx vyskytlo xxxxxxx xxxxxxxxx x xxxxxxxx, xxxx xxx v xxxxxxxxxxx 12 xxxxxxxx xxxxxxxx xxxxxxxx xxxxx xxxxxxxxx x xxxxxxxx, xxxx podrobeny: buď — xxxxxxxxxxxxxx xxxxxxx, xxx xxxxxx xx xxxxxxxx hodnoty Xx xxxxx nebo xxxxx než 3, xxxx — xxxxxxxxxxx xxxxxxxxx xxxxxxxx x tepelným xxxxxxx xxxxxxx xxxxxxxxxxx účinku xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx x teplotě xxxxxxx 72 °X xx xxxx nejméně 15 xxxxxx x xxxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxx na xxxxxxxxxxx xxxx, následovaným:  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx xxxx než x xxxxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx jednací osvědčení II.b. buď — xxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxx účinkem xxxxxxx rovnocenným xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxx xx xxxxxxxxxxx test, xxxxxxxxxxxx x případě xxxxxxxx xxxxx xxxx xxxxxxxx mléčných xxxxxxx xxxxxxxx xxxxxx, xxxx — xxxxxxxxxxxxx xxxxxxxx, při kterém xxxx pH udržováno xx xxxxxxx xxxxx xxx 6 xx xxxx xxxxxxx xxxxx xxxxxx; x) x xxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxxx, xx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx 3 xx xxxxxxxx xxxxxxxx kyselinou xx xxxxxxx následovanému xxxxxx xxxx xxxxxxxxxxx xxxxxxxxxxxxx, dále xxxxxxx xX x xxxxxxxx xxxxxxxx (xxxxx xxxxxxx xxxxxxxxx), po níž xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx a xxxxxxxxxxx; x) x případě hydrolyzovaných xxxxxxxx byly xxxxxxxx xxxxxxxx postupem, xxxxx xxxxxxxx xxxxxx xxxxxxxx x xx xxxxxxxxxx xxxxxxx xxxxxxxxxxx surového xxxxxxxxx xxxxxxxxx 3, x x xxxxxxx xxxxxxxxxxxxxxx bílkovin zcela xxxx zčásti xxxxxxxxx x xxxx x xxxxx přežvýkavců xxxx xxxxxxxx xx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxx výhradně x xxxxxx xxxxxxxxxxxxxxx xxxxxxxx, xxxxxxxx xx xxxxxxx xxxxxxxxx, jehož xxxxxxxxxxx hmotnost xx xxxxx xxx 10 000 xxxxxxx, a xx použití xxxxxxx xxxxxxxxxxxx xxxxxxxx surového xxxxxxxxx xxxxxxxxx 3 xxxxxxxxxx do solného xxxx, xxxxxxxx x xxxxxxxxxxx xxxxxx, xx xxxx následuje: i) vystavení xxxxxxxxx xX o xxxxxxx vyšší xxx 11 po xxxx xxxxx xxx tři xxxxxx xxx xxxxxxx xxxxx xxx 80 °X x xxxxxxxx xxxxxxx xxxxxxxx při xxxxxxx vyšší xxx 140 °X po xxxx 30 xxxxx xxx tlaku xxxxxx xxx 3,6 xxxx; xxxx xx) xxxxxxxxx xxxxxxxxx xX v rozmezí xxxxxx 1 xx 2 xxxxxxxxxxx xxxxxxxxxx xX x hodnotě xxxxx než 11 x xxxxxxxx tepelné xxxxxxxx xxx teplotě 140 °X po xxxx 30 xxxxx xxx xxxxx 3 xxxx; x) v xxxxxxx xxxxxxxxx xxxxxxx byly xxxxxxxxx jakékoli xx xxxxxxxxxxxxxxxx metod 1 xx 5 xxxx 7 xxxxxxxxx v xxxxxxx XX xxxxxxxx XXX xxxxxxxx (XX) x. 142/2011, nebo xxxx ošetřeny v xxxxxxx x kapitolou XX oddílu X xxxxxxx III xxxxxxxx (XX) č. 853/2004; x) x případě xxxxxxxx xxxx xxxxxxxxx xxxxxxx, xxxxx xxxxxxxxx, xx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx 3 xx podroben xxxxxxxx, xxxxx xxxxxxxx xxxxxxx, xxxxxx pH xxxxxx kyseliny či xxxxxx x xxxxxxxxx xxxxxx xx xxxxxxxxxxx xxxxxxxxxxxxx, filtrací x xxxxxxx, přičemž se xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxxxx povolených xxxxxxxx xxxxxxxx Xxxx; x) v xxxxxxx xxxxxxxx xxxxxxx xxxx xxxxxxxxx xxxxxxxx xx zpracovatelských xxxxx 1 až 5 xxxx 7 xxxxxxxxx x xxxxxxx IV xxxxxxxx XXX xxxxxxxx (XX) x. 142/2011; x) x xxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xx savců xxxx xxxxxxxxx jakékoli ze xxxxxxxxxxxxxxxx metod 1 xx 5 xxxx 7, x v xxxxxxx xxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx xx zpracovatelských xxxxx 1 xx 5 xxxx 7, xxxxx xx x případě xxxxxxxxxxxxxx xxxxxx 7 xxxxxxx xx celou xxxxx xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxx 80 °X; x) x xxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx nepocházejících ze xxxxx s xxxxxxxx xxxx moučky xxxx xxxxxxxxx xxxxxxxx ze xxxxxxxxxxxxxxxx xxxxx 1 xx 5 xxxx 7 xxxxxxxxx x xxxxxxx IV xxxxxxxx XXX xxxxxxxx (XX) x. 142/2011; x) x xxxxxxx xxxx xxxxxx xxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxxxxx xxxxx 1 až 7 xxxxxxxxx x příloze XX xxxxxxxx XXX xxxxxxxx (XX) x. 142/2011 xxxx xxxxxx x xxxxxxxxxx, které xxxxxxxxx soulad xxxxxxx x xxxxxxxxxxxxxxxxx normami xxx xxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxx X xxxxxxxx X xxxxxxxx (XX) x. 142/2011; x) v xxxxxxx xxxxxxxx/xxxxxxxxxx tuku, xxxxxx xxxxxx xxxx, xxxx xxxxxxxxx xxxxxxx xx xxxxxxxxxxxxxxxx xxxxx 1 xx 5 nebo 7 (x xxxxxx 6 x xxxxxxx xxxxxx tuku) xxxxxxxxx x xxxxxxx XX xxxxxxxx III nařízení (XX) x. 142/2011, xxxx xxxx vyrobeny x xxxxxxx x xxxxxxxx XXX xxxxxxx XXX xxxxxxxxx XX xxxxxxxx (ES) x. 853/2004; tavené/škvařené xxxx x xxxxxxxxxxx musí xxx pročištěny xxx, xxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxx nečistot xxxxxxxxxxxxx 0,15 % xxxxxxxxxxxx;  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx xxx zvířata v xxxxxxxx xxxxx xxxx xxx x konzervách II. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx osvědčení II.b. l) x xxxxxxx xxxxxxxxxxxxxxxxxxxx vápenatého xxxx xxxxxxxx xxxxxxxx, xxxx x) xxxxxxxxx, xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx 3 je xxxxxxx xxxxxxx a xxxxxx horké vody xxxxxxxx x xxxxxxx xxxxxxxx kyselinou xxxxxxxxxxxxxxx (xxx xxxxxxxxx xxxxxxxxxxx 4 % x xX nižším xxx 1,5) xx xxxx xxxxxxx xxxx xxx; xx) xx skončení xxxxxxx xxxxxxxxx x xxxx x) xxxxxxxxx ošetřením xxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxx, xxx xxxx x získání výsledné xxxxxxxxx xxxxxxxxxxxxxxxxxxxx xxxxxxxxxx xxx pH 4 xx 7; x xxx) xxxx xxxxxxxxx hydrogenfosforečnanu xxxxxxxxxx xxxxxxx vysuší xxxxxxxx při xxxxxxx xxxxxxx x rozmezí xx 65 °X xx 325 °X x konečné xxxxxxx x xxxxxxx xx 30 °X xx 65 °X; x) v xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxxx, xxxx zajišťuje i) xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx 3 je xxxxxxx nadrcen x xxxxxx xxxxxxxxxxx xxxxx xxxx xxxxxxxx (xxxxxx xxxxx xxxxx než 14 xx); xx) xxxxxxxxxxx xxxxxx v xxxx xxx xxxxxxx 145 °X xx xxxx 30 xxxxx xxx xxxxx 4 xxxx; xxx) xx xxxxx x xxxxxxxx se xxxxxxxxxxx xxxxxx xx xxxxxxxxxxxxxx (xxxxxxxxxxxx xxxxxxxxxx); x xx) xx xx granulaci xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxxx xx xxxxxxx xxxxxx xxxxxxxx x teplotě 200 °X; x) x xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxx vyrobeny xxxxx xxxxxxxxxxxxxx xxxxxx x xxxxxxxxx, které xxxxxxxxx xxxxxx výrobku x xxxxxxxxxxxxxxxxx normami xxxxxxxxx x xxxx II.4.;] (2) xxxx [xxxx xxxxxxxxx xxxxxxxx sušením xxxx xxxxxxxx, které xxxx xxxxxxxxx xxxxxxxxxx xxxxxxx;] (2) xxxx [x xxxxxxx xxxxxxx a xxxxxxxxxxxxx xxxxxxxxxxxx živočichů, xxxxx xxxxx xxxxxxxxxxx pro xxxxxxx xxxx zvířata, xxxx xxxxxxxxx xxxxxxxx, xxxxx bylo schváleno xxxxxxxxxx xxxxxxx a xxxxx xxxxxxxxx, že xxxx krmivo xxx xxxxxxx x xxxxxxxx xxxxx xxxxxxxxxxxxx žádné xxxxxxxxxxx riziko pro xxxxxx lidí x xxxxxx;] XX.4. bylo xxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxx z xxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxx skladování xxxx xxx vyskladnění xx xxxxxxxxxxxxxxx zařízení x xxxxxxxx xxxxx xxxxxx (4): Xxxxxxxxxx: xxxxxxxxxxxx x 25 x xxxxxxxx: x = 5, x = 0, m = 0, X = 0 Xxxxxxxxxxxxxxxxxx: x = 5, x = 2, x = 10, M = 300 x 1 x; XX.5. xxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxx kontaminace xxxxxxxxxxx xxxxxxx po xxxxxxxx; XX.6. xxxx zabaleno xx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x nápisem „XXXX URČENO X XXXXXX XXXXXXXX“, xxxx-xx xxxxxx xxx zvířata x xxxxxxxx xxxxx xxxxxxxxx x xxxxxx xxxxxxxxxxx k xxxxxxx, xx němž xx xxxxx xxxxxxx, xx xxxxx xx xxxxx xxxxxxxx xx xxxxxx xxxxxx v zájmovém xxxxx; (2) [XX.7. xxxx xxxxxxx xxxxxx pro xxxxxxx x xxxxxxxx xxxxx (2) buď [xx xxxxxxx z přežvýkavců xxxxxx xxx skot, xxxx nebo xxxx.] (2) xxxx [xx xxxxxxx xx xxxxx, xxxx xxxx xxx x xxxxxxxxxx xxxx uvedené xxxxxx ani z xxxx xxxxxx xxxxxxx: (2) xxx [materiál pocházející xx xxxxx, ovcí x koz xxxx xxx získaný xx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených x xxxx nebo xxxxxxx zařazené x xxxxxxx s xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx nebo xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX.]] (2) nebo [x) xxxxxxxxxxxxx rizikový xxxxxxxx, jak je xxxxxxxxx v xxxx 1 xxxxxxx V xxxxxxxx Evropského parlamentu x Xxxx (XX) x. 999/2001 (5);  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx xxx xxxxxxx x zájmovém xxxxx xxxx xxx x xxxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. x) xxxxxxx xxxxxxxx xxxx získané x xxxxx xxxxx, ovcí xxxx xxx x xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx oblasti xxxxxxxx x souladu s xxxxxxxxxxx Komise 2007/453/XX (6) do kategorie xxxx xxxx oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx BSE, x xxxxx xxxxx xxxxxxx xxxxx domácí případ XXX; x) vedlejší xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xx xxxxx, xxxx xxxx xxx, xxxxx byly xx omráčení xxxxxxxx xxxxxxxx xxxxxxxxx nervové xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx nástroje xxxxxxxxxx xx dutiny lebeční xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxx xxxxxxx, x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx a xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx s xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx zanedbatelným xxxxxxx xxxxxxx XXX.]]] Xxxxxxxx Xxxx I: — Xxxxxxx I.6.: Xxxxx xxxxxxxxxx xx xxxxxxx x Xxxxxxxx xxxx: xxxx kolonku xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x osvědčení xxx xxxxx xxxxxx pro xxxxxxx xxxx Evropskou xxxx; xxxx xx xxxxxxx, xxxxx-xx xx x osvědčení xxx xxxxx xxxxxxxx xx Xxxxxxxx xxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx. Xxxxxxxx xxx xxx xxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxx, svobodných xxxxxxxx x xxxxxxx xxxxxxxx. — Xxxxxxx I.15.: Xx xxxxx xxxxx xxxxxxxxxxx xxxxx (vagony xxxx xxxxxxxxxx a xxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) xxxx xxxxx (plavidlo). X xxxxxxx xxxxxxxx a xxxxxxxxxx naložení xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx v xxxxx vstupu xx Xxxxxxxx unie. — Xxxxxxx X.19.: Xxxxxxxx příslušný xxx harmonizovaného xxxxxxx (XX) následujících xxxxx: 04.01, 04.02, 04.03, 04.04, 04.08, 05.04, 05.05, 05.06, 05.11, 15.01, 15.02, 15.03, 15.04, 23.01, 23.09, 28.35.25, 28.35.26, 35.01, 35.02, 35.03 xxxx 35.04. — Xxxxxxx I.23.: X případě xxxxxxxxxx xxx xxxxx xxxxxx xxxxx xxxx xxx xxxxxxx xxxxx xxxxxxxxxx x (xxxxxxxx) xxxxx xxxxxx. — Kolonka X.25.: Xxxxxxxxx xxxxxxx: jakékoli xxxx využití xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxxxxxx xxxxxx a xxxxxx xxxx zpracování xxxxx xxx xxxxxxx x xxxxxxxx chovu. — Kolonky X.26. x X.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxxxx xxxx xxx dovoz. — Xxxxxxx X.28.: Xxxx: xxxxxxx: Aves, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Xxxxxx, Xxxxx, Xxxxxxxx, Xxxxxxxxx, xxxxxxxxxx xxxxx Xxxxxxxx x Crustacea. Část II: (1a) Xx. xxxx. X 300, 14.11.2009, x. 1. (1x) Xx. věst. X 54, 26.2.2011, x. 1. (2) Nehodící xx škrtněte. (2a) Xx. xxxx. L 139, 30.4.2004, x. 55. (2b) Xx. věst. X 125, 23.5.1996, x. 3. (3) Úř. xxxx. X 175, 10.7.2010, x. 1.  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx chovu xxxx xxx v xxxxxxxxxx XX. Zdravotní informace II.a. Xxxxx jednací xxxxxxxxx XX.x. (4) Xxx: x = xxxxx xxxxxx, xxxxx mají xxx xxxxxxxxx; x = xxxxxxx xxxxxxx xxxxx xxxxxxxx; výsledek je xxxxxxxxx za uspokojivý, xxxxxxxx xxxxx xxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxxx m; M = xxxxxxxxx xxxxxxx xxxxx xxxxxxxx; xxxxxxxx xx xxxxxxxxx xx neuspokojivý, xxxxx xxxxx bakterií x xxxxxx nebo xxxx xxxxxxxx xx xxxxx nebo xxxxx xxx M; a c = xxxxx xxxxxx, xxxxxxx xxxxxxxxxxx xxxxx xxx xxx v xxxxxxx xxxx x x M, xxxxxxx xxxxxx xx xxxxx xxxxx považován za xxxxxxxxx, pokud xx xxxxxxxxxxx počet ostatních xxxxxx xxxxx x xxxx nižší. (5) Xx. xxxx. X 147, 31.5.2001, x. 1. (6) Xx. xxxx. X 172, 30.6.2007, s. 84. — Xxxxx xxxxxxx x xxxxxxx se xxxx lišit od xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx v Xxxxxxxx unii: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx x xxxx zásilku xxxxxxxx xx xx xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxx xxxxxx xx Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Podpis: Razítko: KAPITOLA 3 (X) Xxxxxxxxxxx xxxxxxxxx xxx žvýkací xxxxxxx xxx xxx, xxxxx xxxx xxxxxx x xxxxxxxx do Xxxxxxxx xxxx nebo x tranzitu xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx osvědčení do XX Xxxx I: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx místní xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx za xxxxxxx x EU Jméno Adresa PSČ Tel. I.7. Xxxx xxxxxx Xxx XXX X.8. Region xxxxxx Xxx X.9. Země určení Kód XXX X.10. Region xxxxxx Xxx X.11. Xxxxx původu Název Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx schválení Adresa Název Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx sklad Název Číslo xxxxxxxxx Xxxxxx XXX X.13. Místo xxxxxxxx X.14. Xxxxx odjezdu I.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Vagon Silniční xxxxxxx Ostatní Identifikace Odkaz xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx EU I.17. I.18. Xxxxx xxxxx X.19. Xxx xxxxx (xxx HS) I.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Počet xxxxxx X.23. Xxxxx plomby/kontejneru I.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx EU do xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Xxx xxxxx nebo xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx schválení zařízení Druh (xxxxxxx xxxxx) Xxxxxxx závod Čistá xxxxxxxx Xxxxx šarže  Text obrazu Text obrazu
XXXX Xxxxxxx xxxxxxx pro psy II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xx, níže xxxxxxxxx xxxxxx veterinární xxxxx, xxxxxxxxxx, xx xxxx xxxxxxx a xxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x. 1069/2009 (1x), xxxxxxx pokud xxx o článek 10 xxxxxxxxx nařízení, x xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx xxxxx xxx o přílohu XXXX kapitolu XX x přílohu XXX xxxxxxxx XX xxxxxxxxx xxxxxxxx, a potvrzuji, xx výše xxxxxxx xxxxxxx xxxxxxx xxx xxx: XX.1. byly xxxxxxxxxx xxxxxxxx x těchto xxxxxxxxxx xxxxxxxx živočišného xxxxxx: (2) buď [- xxxx xxxxxxxxxx zvířat x xxxxxx xxxxx, xxxx x případě xxxxx xxxx xxxxxxxxxx xxxxxx nebo xxxxxx xxxxx, xxxxx xxxx xxxxx právních xxxxxxxx Xxxx xxxxxx k xxxxxx spotřebě, xxxxx x xxxxxxxxxx důvodů xxxxxx k lidské xxxxxxxx xxxxxx;] (2) x/xxxx [- jatečně xxxxxxxx xxxx a xxxx xxxxxxx části xxxxxxxxxxx xxx xx xxxxxx, xxxxx xxxx poražena xx xxxxxxx x xx prohlídce před xxxxxxxx byla shledána xxxx způsobilá k xxxxxxx x xxxxxx xxxxxxxx, xxxx těla x xxxx uvedené xxxxx xxxxx usmrcené x lidské xxxxxxxx x xxxxxxx s xxxxxxxx předpisy Xxxx: x) xxxxxxx xxxxxxxx xxxx xxxx xxxx zvířat x xxxxxx části, xxxxx xxxx x xxxxxxx s xxxxxxxx xxxxxxxx Xxxx xxxxxxxxxx xx xxxxxxxx k xxxxxx spotřebě, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx přenosného na xxxxxxx xxxx zvířata; ii) xxxxx drůbeže; iii) xxxx x xxxxx, xxxxxx xxxxxx xxxxxxx x xxxxxx, rohy x xxxxxxxxx, včetně článků xxxxx, zápěstních a xxxxxxxxxx kůstek, nártů x xxxxxxx; xx) xxxxxxx xxxxxxx; x) xxxx;] (2) x/xxxx [- krev zvířat, xxxxx xxxxxxxxxxxx žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxx xx člověka xxxx zvířata, xxxxx xxxx xxxxxxxx xx xxxxxxx a xxxxx xxxx po xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x porážce x lidské xxxxxxxx x souladu x xxxxxxxx předpisy Xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx živočišného xxxxxx, xxxxx xxxxxxxx při xxxxxx xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx, xxxxxx xxxxxxxxxxx xxxxx, xxxxxxx nebo xxxx x xxxxxxxxxxx xxxx xxxxxxxxxx xx zpracování xxxxx;] (2) a/nebo [- xxxxx xxxxxxxxxxx x xxxxxx xxxxx, xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxx z xxxxxxx xxxx xxxxxxxx na xxxxxx produktů xxxxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxxxx xx xxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxx zakázanými podle xxxxxxxx Rady 96/22/XX (2x), xxxxxxx xxxxx xxxxxx xxxxxxxxx xxx xxxxxxx x souladu x čl. 35 xxxx. x) xxxxx xx) nařízení (XX) x. 1069/2009;] XX.2. xxxx xxxxxxxxx (2) xxx [x xxxxxxx xxxxxxxxx pamlsků xxx psy xxxxxxxxxx x xxxx a xxxxx kopytníků xxxx x xxx xxxxxxxx xxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxx původců (xxxxxx xxxxxxxx); x xxxxxxx xxxxxxx pro xxx xxxx xxxxxxxx;] (2) a/nebo [x xxxxxxx xxxxxxxxx xxxxxxx pro xxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxx živočišného xxxxxx xxxxxx xxx xxxx x xxxxx xxxxxxxxx x ryb tepelnému xxxxxxxx při xxxxxxx xxxxxxxxx 90 °X x celé xxxxx;] XX.3. xxxx xxxxxxxxxxx pomocí xxxxxxx xxxx vzorků x xxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxx xxx vyskladnění xx xxxxxxxxxxxxxxx zařízení x xxxxxxxx xxxxx xxxxxx (3): Xxxxxxxxxx: nepřítomnost x 25 x xxxxxxxx: x = 5, x = 0, x = 0, X = 0 Xxxxxxxxxxxxxxxxxx: x = 5, x = 2, x = 10, X = 300 x 1 x; Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxxx xxxxxxx pro xxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. XX.4. prošly xxxxx xxxxxxxxxxxxx xxxxxxxxxx x zabránění xxxxxxxxxxx xxxxxxxxxxx původci po xxxxxxxx; XX.5. xxxx xxxxxxxx xx nového xxxxx; (2) [XX.6. xxxx popsané xxxxxxx xxxxxxx xxx xxx (2) xxx [xxxx xxxxxxx z přežvýkavců xxxxxx xxx xxxx, xxxx nebo xxxx.]] (2) xxxx [jsou xxxxxxx xx xxxxx, xxxx xxxx koz x xxxxxxxxxx dále xxxxxxx xxxxxx xxx x xxxx nebyly xxxxxxx: (2) xxx [xxxxxxxx xxxxxxxxxxx xx xxxxx, ovcí x xxx xxxx xxx xxxxxxx xx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx nebo xxxxxxx zařazené v xxxxxxx s xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE.]] (2) nebo [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx v bodě 1 xxxxxxx X xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 999/2001 (4); b) xxxxxxx xxxxxxxx maso xxxxxxx z xxxxx xxxxx, xxxx nebo xxx s xxxxxxxx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x poražených x xxxx xxxx xxxxxxx xxxxxxxx v xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (5) xx kategorie země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX, x xxxxx xxxxx xxxxxxx žádný xxxxxx xxxxxx XXX; x) xxxxxxxx produkt xxxxxxxxxxx xxxxxx xxxx získaný xxxxxxx xx xxxxx, xxxx xxxx koz, xxxxx byly xx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx nervové xxxxx xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx do xxxxxx lebeční xxxx xxxxxxxxxxxxxxx plynové xxxxxxx xx xxxxxx xxxxxxx, x výjimkou xxxxxx xxxxxxxxxx, xxxxxxxxxxx chovaných x poražených x xxxx xxxx oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx rizikem xxxxxxx XXX.]]] Xxxxxxxx Xxxx X: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx v Xxxxxxxx xxxx: tuto xxxxxxx xx xxxxx xxxxxxx pouze xxxxx, xxxxx-xx se o xxxxxxxxx xxx xxxxx xxxxxx xxx tranzit; xxxx xx xxxxxxx, xxxxx-xx se x xxxxxxxxx pro xxxxx xxxxxxxx do Evropské xxxx. — Kolonka I.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx pouze tehdy, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx pro xxxxxxx. Xxxxxxxx xxx xxx xxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx skladech x celních xxxxxxxx. — Xxxxxxx I.15.: Registrační xxxxx (xxxxxxxxxxxx xxxxxx xxxx kontejneru a xxxxxxxxxx automobilů), xxxxx xxxx (letadla) nebo xxxxx (xxxxxxxx); xxxxxxxxx xx xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx x Xxxxxxxx xxxx. — Xxxxxxx X.19.: 05.11, 23.09, 41.01 nebo 42.05. — Kolonka I.23.: X xxxxxxx kontejnerů xxx volně xxxxxx xxxxx xxxx xxx xxxxxxx číslo xxxxxxxxxx x (xxxxxxxx) číslo xxxxxx. — Kolonka X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxxxxxx xxxxxx x xxxxxx xxxx xxxxxxxxxx xxxxx xxx xxxxxxx v xxxxxxxx chovu. — Xxxxxxx X.26. x X.27.: Xxxxxxx xxxxx toho, xxxxx-xx xx x xxxxxxxxx xxx xxxxxxx xxxx pro xxxxx. — Xxxxxxx I.28.: Druh: xxxxxxx: Aves, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Suidae, Xxxxx, Xxxxxxxx, Xxxxxxxxx, xxxxxxxxxx xxxxx Mollusca x Xxxxxxxxx. Xxxx II: (1a) Xx. xxxx. X 300, 14.11.2009, s. 1. (1x) Úř. xxxx. X 54, 26.2.2011, x. 1.  Text obrazu Text obrazu
XXXX Xxxxxxx xxxxxxx pro psy II. Xxxxxxxxx informace II.a. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) Xxxxxxxx xx xxxxxxxx. (2x) Úř. xxxx. L 125, 23.5.1996, x. 3. (3) Xxx: — x = xxxxx vzorků, které xxxx xxx xxxxxxxxx; — x = xxxxxxx xxxxxxx počtu xxxxxxxx; xxxxxxxx xx považován xx xxxxxxxxxx, xxxxxxxx xxxxx bakterií xx xxxxx xxxxxxxx xxxxxxxxxx x; — X = xxxxxxxxx hodnota počtu xxxxxxxx; xxxxxxxx je xxxxxxxxx za neuspokojivý, xxxxx xxxxx xxxxxxxx x xxxxxx xxxx xxxx xxxxxxxx je xxxxx xxxx vyšší xxx M; a — x = xxxxx xxxxxx, xxxxxxx xxxxxxxxxxx xxxxx xxx xxx x xxxxxxx mezi x a M, xxxxxxx xxxxxx xx xxxxx xxxxx považován xx xxxxxxxxx, pokud xx xxxxxxxxxxx xxxxx xxxxxxxxx xxxxxx roven x xxxx xxxxx. (4) Xx. věst. X 147, 31.5.2001, s. 1. (5) Xx. xxxx. X 172, 30.6.2007, x. 84. — Barva xxxxxxx x xxxxxxx xx musí lišit xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx za xxxxxxx x Evropské xxxx: xxxx xxxxxxxxx xxxxxx xxxxx k xxxxxxxxxxxx xxxxxx x xxxx xxxxxxx provázet xx xx xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxx xxxxxx xx Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx inspektor Jméno (xxxxxxxx xxxxxx): Xxxxxxxxxxx x titul: Datum: Xxxxxx: Xxxxxxx: XXXXXXXX 3 (X) Xxxxxxxxxxx osvědčení pro xxxxxx xxxxxx xxx xxxxxxx v xxxxxxxx xxxxx x přímému xxxxxxx xxxx pro xxxxxxxx produkty xxxxxxxxxxx xxxxxx xxxxxx xx xxxxxx xxxxxxxxxxxx zvířat, xxxxxx x xxxxxxxx xx Evropské unie xxxx x xxxxxxxx xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx osvědčení xx XX Xxxx I: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo xxxxxxx osvědčení I.2.a. I.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx xxxxx X.5. Příjemce Název Adresa PSČ Tel. I.6. Xxxxx xxxxxxxxxx za xxxxxxx v XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Xxxxxx xxxxxx Xxx X.9. Země xxxxxx Xxx XXX X.10. Region xxxxxx Xxx X.11. Místo xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx schválení Adresa I.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo xxxxxxxx X.14. Xxxxx odjezdu I.15. Xxxxxxxx prostředek Letadlo Plavidlo Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. X.18. Xxxxx zboží I.19. Xxx xxxxx (xxx XX) X.20. Množství I.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx balení I.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Druh xxxxx  Text obrazu Text obrazu
X.25. Zboží xxxxxxxxx xxx: Xxxxxx pro zvířata x xxxxxxxx xxxxx Xxxxxxxxx využití I.26. Xxx xxxxxxx xxxx XX xx xxxxx země Třetí xxxx Xxx XXX X.27. Xxx xxxxx nebo xxxxxx do EU I.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx závod Čistá xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx xxxxxx x xxxxxxx prodeji xxxx xxxxxxxx produkty xxxxxxxxxxx původu xxxxxx xx krmení xxxxxxxxxxxx xxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx xxxxx, prohlašuji, xx xxxx xxxxxxx x porozuměl xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 1069/2009 (1x), zejména xxxxx jde o xxxxxx 10 xxxxxxxxx xxxxxxxx, a xxxxxxxx Xxxxxx (XX) č. 142/2011 (1x), xxxxxxx xxxxx jde x xxxxxxx XXXX xxxxxxxx XX x xxxxxxx XXX xxxxxxxx XX xxxxxxxxx nařízení, x xxxxxxxxx, xx výše xxxxxxx xxxxxx xxxxxx xxx zvířata x xxxxxxxx chovu nebo xxxxxxxx produkty xxxxxxxxxxx xxxxxx: XX.1. xxxxxxxxx x xxxxxxxxxx xxxxxxxx živočišného xxxxxx, xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx; XX.2. xxxxxxxxx z xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx: x) získaných z xxxx, xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxx: — x xxxxxxxx Komise (XX) č. 206/2010 (3), x xxxxx xxxxxxx, x xxxxx xxxx maso xxxxxxx, xxxxxxxxx xx třetích xxxx, xxxxx xxxx xxxxxx xxxxx … (xxx XXX x xxxxxxx xxxx nebo xxxx xxxxx xxxx xxxxxx xxxxx), — x/xxxx x xxxxxxxx Xxxxxx (XX) x. 798/2008 (4), x pokud xxxxxxx, x xxxxx xxxx maso xxxxxxx, xxxxxxxxx x xxxxxxx xxxx, xxxxx nebo xxxxxx xxxxx … (xxx XXX x xxxxxxx xxxx nebo xxxx xxxxx xxxx xxxxxx xxxxx) xxxxxxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxx xxxx posledních 12 měsíců prosté xxxxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxx, — a/nebo x xxxxxxxx Komise (XX) x. 119/2009 (5), x pokud xxxxxxx, z xxxxx xxxx xxxx xxxxxxx, xxxxxxxxx xxxxxxx xxxx, xxxxx xxxx xxxxxx xxxxx … (kód XXX x xxxxxxx xxxx xxxx xxxx xxxxx xxxx jejich xxxxx) xxxxxxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxx slintavky x xxxxxxxx, xxxx xxxxx, xxxxxxxxxx xxxx xxxxxx, xxxxxxxxx moru xxxxxx, xxxxxxxxxxx xxxxxxx xxxxxx, xxxxxxxxxxxx xxxxxxx x influenzy ptáků x xxx během xxxxxxxxx období xxxxxxxxxx xxxxxxxx (xxxxx x xxxxxxxxx druhů); b) xxxxxxxxx xx zvířat, xxxxx xx xxxxxxx xxxxxx xxxxxxxxxx během doby 24 xxxxx před xxxxxxxx x která xxxxxxxxxxxx žádné příznaky xxxxx xxxxxxxxx x xxxxxxxxxx uvedených v xxxxxxx a), xxxx xxxx jsou xxxx xxxxxxx xxxxxxx; a c) xxxxxxxxx ze xxxxxx, x xxxxx bylo xx xxxxxxx xxxx xxxxxxxx xx xxxxxxxxx x x xxxx xxxxxxx či xxxxxxxx xxxxxxxxx v souladu x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx Xxxx x xxxx dodrženy xxxxxxxxx xxxxxxx xxxxxxxxxx xxx, xxxxx xxxx xxxxxxxxx x xxxxxxxxxx XX x XXX xxxxxxxx Rady (ES) x. 1099/2009 (6); xxxx x) xxxxxxxxx x xxxxxxx xxxxxx pro xxxxxxxxxx xxxxxxx x xxxxxxx živočichů, xxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx x hygienické xxxxxxxxx xxxxxxxxx x xxxxxxxxxx Xxxxxx 2006/766/XX (7) x xxxxxxxxx ze xxxx xxxx xxxxxx xxxxx … (xxx XXX xxxx) xxxxxxxxxxxxx x příloze XX xxxxxxxxx xxxxxxxxxx; XX.3.1. xxxxxxxxx xxxxx z xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx: x) těla xxxxxxxxxx xxxxxx a jejich xxxxx, nebo x xxxxxxx zvěře xxxx xxxxxxxxxx xxxxxx nebo xxxxxx xxxxx, xxxxx xxxx podle xxxxxxxx xxxxxxxx Xxxx xx xx xxxxxxxx, xxx xxxx x xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxxxxxx xx xxxxxx k xxxxxx xxxxxxxx;] x) xxxxx xxxxxxxxxx xxxxxx, které xxxx xxxxxxxxxx xx xxxxxxxx x xxxxxx xxxxxxxx, xxx xxxxx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx nebo xxxxxxx x xxxxxxx x xxxxxxx xxxxxxxxxx xxx xxxxxxxx x xxxxxx xxxxxxxx x souladu x xxxxxxxx předpisy Xxxx; XX.3.2. x xxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx xxxxxxxxx x xxxx XX.3.1. x x xxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx: (2) xxx [- vedlejší xxxxxxxx živočišného původu x xxxxxxx x xx xxxxxxxxx xxxxxxxxxx xx xxxxx, xxx xx xxxxxxx x xx. 1 odst. 3 xxxx. x) xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (ES) x. 853/2004&xxxx;(2x), xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx člověka xxxx zvířata;] (2) a/nebo [- xxxx xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxx xx xxxxxxx xxxx xxxxxxx, xxxxx xxxx xxxxxxxx xx xxxxxxx a která xxxx po xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Unie;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxx xxxxxx produktů určených x lidské spotřebě, xxxxxx xxxxxxxxxxx kostí, xxxxxxx xxxx xxxx x xxxxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxx xxxxx;] Xxxx II: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxx krmivo xxx xxxxxxx x zájmovém xxxxx xxxxxx x xxxxxxx xxxxxxx xxxx xxxxxxxx produkty xxxxxxxxxxx xxxxxx určené xx xxxxxx xxxxxxxxxxxx zvířat II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) a/nebo [- produkty živočišného xxxxxx xxxx xxxxxxxxx xxxxxxxxxx produkty xxxxxxxxxxx xxxxxx, které x xxxxxxxxxx xxxxxx xxxx x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx nevzniká xxxxx xxxxxx xxx xxxxxx xxxx xxx xxxxxx, xxx xxxxxx xxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxx xxx zvířata x xxxxxxxx xxxxx a xxxxxx živočišného xxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx, které z xxxxxxxxxx xxxxxx xxxx x xxxxxx problémů xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx xxxxxxxx xxxxx xxxxxx xxx zdraví xxxx xxx xxxxxx, xxx nejsou xxxxxx xx krmení;] (2) x/xxxx [- xxxx, placenta, xxxx, peří, srst, xxxx, xxxxxxx xxxxx x paznehtů x xxxxxx mléko xxxxxxxxxxx xx xxxxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosného xxxxx xxxxxxxxx na xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- xxxxx xxxxxxxxxxx a xxxxxx xxxxx, xxxxx mořských xxxxx, xxxxx nevykazovali xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx člověka xxxx xxxxxxx;] (2) a/nebo [- xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x xxxxxxx živočichů xxxxxxxxxxx x xxxxxxx xxxx xxxxxxxx xx xxxxxx xxxxxxxx určených x xxxxxx spotřebě;] (2) a/nebo [- xxxx xxxxxxx xxxxxxxx pocházející xx xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx: x) xxxxx xxxxxxx x xxxxxx x xxxxxxx tkáněmi nebo xxxxx; xx) xxxxx materiál xxxxxxxxxxx ze suchozemských xxxxxx: — vedlejší produkty x xxxxx, — xxxxx, — xxxxxxxx xxxxxxxx x xxxxx, xxxxxx xxxxxxxxx xxxxxxxx; xxx) xxxxxxxxxx kuřata xxxxxxxx x obchodních xxxxxx;] (2) x/xxxx [- xxxxxxxx produkty xxxxxxxxxxx xxxxxx x xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xxxxx xxxxx xxxxxxxxxxx xxx člověka xxxx xxxxxxx;] (2) x/xxxx [- xxxxxxx x xxxx hlodavců (Rodentia) x xxxxxxxxx (Xxxxxxxxxx) x jejich xxxxx, xxxxx xxxxxxxxx xxxxxxxxx 1 uvedeného x xx. 8 xxxx. x) xxxxxx xxx), xx) x x) xxxxxxxx (XX) x. 1069/2009 x materiálu xxxxxxxxx 2 uvedeného x xx. 9 xxxx. a) xx x) xxxxxxxxx xxxxxxxx;] XX.4. xxxx xxxxxxx x xxxxxxxxxx, aniž se xxxxxxx do xxxxxxxx x jiným xxxxxxxxxx, xxxxx nesplňuje xxxxxxxx xxxxxxxxx v xxxxxxxx (XX) x. 1069/2009, x xxx manipulaci xxxx xxxxxxx taková xxxxxxxx, xxx xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxxxx; XX.5. byly xxxxxxxx x xxxxxxxx balení xxxxxxxxx etiketami s xxxxxxx „XXXXXX XXXXXX XXX XXXXXXX X XXXXXXXX CHOVU – XXXX XXXXXX K XXXXXX SPOTŘEBĚ“ xxxx „XXXXXXXX PRODUKTY XXXXXXXXXXX XXXXXX URČENÉ KE XXXXXX XXXXXXXXXXXX ZVÍŘAT – XXXX XXXXXX X XXXXXX XXXXXXXX“ x poté xxxxxxx xx nepropustných x xxxxxx zaplombovaných xxxxxx/xxxxx xxxx xx xxxxxxxxxxxxx xxxxxx xxxxx x xxxxxx xxxxxxxxxxxxxx xxxxxx/xxxxx xxxxxxxxxx etiketami x xxxxxxx „XXXXXX XXXXXX XXX XXXXXXX V XXXXXXXX XXXXX – XXXX XXXXXX X XXXXXX XXXXXXXX“ xxxx „XXXXXXXX XXXXXXXX XXXXXXXXXXX XXXXXX XXXXXX XX XXXXXX XXXXXXXXXXXX ZVÍŘAT – XXXX XXXXXX X XXXXXX SPOTŘEBĚ“ x názvem x xxxxxxx xxxxxxxx xxxxxx; XX.6. x xxxxxxx xxxxxxxx xxxxxx xxx zvířata x zájmovém xxxxx: x) xxxx připraveno a xxxxxxxxxx x xxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx orgánem x xxxxxxx x xxxxxxx 24 xxxxxxxx (XX) x. 1069/2009 a b) xxxx analyzováno pomocí xxxxxxx pěti xxxxxx x každé xxxxx xxxxxxxxx xxxxxxxxxx během xxxxxxxxxx (před xxxxxxxxx) x vyhovuje těmto xxxxxx (8):  Text obrazu Text obrazu
ZEMĚ Syrové xxxxxx xxx zvířata x xxxxxxxx chovu xxxxxx x xxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu xxxxxx xx krmení xxxxxxxxxxxx xxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. Xxxxxxxxxx: xxxxxxxxxxxx x 25 x xxxxxxxx: x = 5, x = 0, x =0, X = 0 Xxxxxxxxxxxxxxxxxx: n = 5, x = 2, x = 10, X = 5 000 x 1 x; (2) [XX.7. [xxxx xxxxxxx xxxxxx xxx xxxxxxx x zájmovém chovu xxxx xxxxxxxx produkty xxxxxxxxxxx původu xxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x přežvýkavců nebo xxxx z xxxx xxxxxxx x: (2) buď [xxxxxxxxx xx xxxx xxxx xxxxxxx zařazené x xxxxxxx x xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu BSE, x xxxxx xxxxx xxxxxxx xxxxx xxxxxx xxxxxx XXX, x]] (2) xxxx [pocházejí ze xxxx nebo xxxxxxx xxxxxxxx v souladu x rozhodnutím 2007/453/ES xx kategorie země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x xxxxx xxx xxxxxxx xxxxxx xxxxxx BSE, a xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xxx xxxxxx xx zvířat xxxxxxxxxx xx datu, xx xxxxxxx xxx x xxxxxxx xxxx xxxx xxxxxxx xxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxx z xxxxxxxxxxx, xxx xxxx xxxxxxxxxx x Kodexu xxxxxx xxxxxxxxxxxxx živočichů XXX, x]] (2) xxx [xxxx získány x xxxxxxxxxxx xxxxxx xxx xxxx, xxxx nebo xxxx.]] (2) nebo [xxxx xxxxxxx ze xxxxx, xxxx xxxx xxx x neobsahují xxxx xxxxxxx xxxxxx xxx x nich xxxxxx xxxxxxx: (2) xxx [xxxxxxxx xxxxxxxxxxx ze skotu, xxxx x xxx xxxx než xxxxxxx xx zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx a xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x souladu s xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx nebo xxxxxxx se zanedbatelným xxxxxxx xxxxxxx BSE.]] (2) xxxx [x) specifikovaný xxxxxxxx xxxxxxxx, xxx xx definován x xxxx 1 xxxxxxx X xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 999/2001 (9); x) xxxxxxx xxxxxxxx xxxx xxxxxxx x xxxxx xxxxx, xxxx xxxx xxx x xxxxxxxx xxxxxx narozených, xxxxxxxxxxx chovaných x xxxxxxxxxx x xxxx xxxx xxxxxxx zařazené x xxxxxxx x xxxxxxxxxxx Komise 2007/453/XX (10) xx kategorie xxxx nebo xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x xxxxx xxxxx xxxxxxx xxxxx domácí xxxxxx XXX; x) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xx xxxxx, xxxx xxxx xxx, xxxxx byly xx xxxxxxxx usmrceny xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxx prostřednictvím plynové xxxxxxx do xxxxxx xxxxxxx, x xxxxxxxx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x zemi nebo xxxxxxx xxxxxxxx v xxxxxxx x xxxxxxxxxxx 2007/453/XX xx kategorie xxxx xxxx xxxxxxx xx zanedbatelným xxxxxxx xxxxxxx BSE.]]] Poznámky Část I: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx x Xxxxxxxx unii: xxxx xxxxxxx je xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x osvědčení xxx xxxxx určené xxx xxxxxxx xxxx Evropskou xxxx; xxxx xx xxxxxxx, xxxxx-xx se x osvědčení pro xxxxx xxxxxxxx do Xxxxxxxx xxxx. — Xxxxxxx X.12.: Xxxxx určení: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx. Xxxxxxxx xxx xxx při xxxxxxxx xxxxxxxxxx xxxxx ve xxxxxxxxxx xxxxxxx, svobodných xxxxxxxx x celních xxxxxxxx. — Xxxxxxx X.15.: Xx xxxxx xxxxx xxxxxxxxxxx číslo (xxxxxx xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) xxxx xxxxx (xxxxxxxx). X xxxxxxx vykládky x xxxxxxxxxx xxxxxxxx musí xxxxxxxxxx xxxxxxxxxx stanoviště xxxxxxxx xxxxxxxx v xxxxx xxxxxx xx Xxxxxxxx unie. — Xxxxxxx X.19.: Xxxxxxxx xxxxxxxxx xxx harmonizovaného xxxxxxx (XX) xxxxxxxxxxxxx xxxxx: 04.08, 05.06, 05.08, 05.11, 23.01 xxxx 23.09. — Xxxxxxx I.23.: X xxxxxxx kontejnerů xxx xxxxx xxxxxx xxxxx musí xxx xxxxxxx xxxxx xxxxxxxxxx x (xxxxxxxx) číslo xxxxxx. — Xxxxxxx X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxx x výroba xxxx xxxxxxxxxx xxxxx xxx zvířata x xxxxxxxx chovu. — Kolonky X.26. x X.27.: Xxxxxxx xxxxx toho, xxxxx-xx se x xxxxxxxxx xxx tranzit xxxx xxx xxxxx.  Text obrazu Text obrazu
XXXX Xxxxxx xxxxxx pro xxxxxxx v xxxxxxxx xxxxx xxxxxx x xxxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxxx živočišného xxxxxx xxxxxx ke xxxxxx xxxxxxxxxxxx xxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. — Xxxxxxx X.28.: Xxxx xxxxx: xxxxxx xxxxxx xxxxxx pro xxxxxxx x zájmovém xxxxx nebo vedlejší xxxxxxx xxxxxxxxxxx xxxxxx. X xxxxxxx syrového materiálu xxx xxxxxx xxxxxxxx xxxxxx pro xxxxxxx x xxxxxxxx xxxxx xxxxxx xxxxxxx název xxxxx. X xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxx xxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxx: Aves, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx nebo Xxxxxx, Xxxxx, Xxxxxxxx, Xxxxxxxxx, xxxxxxxxxx xxxxx Xxxxxxxx a Xxxxxxxxx. Xxxx XX: (1x) Úř. xxxx. X 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, s. 1. (2) Xxxxxxxx se xxxxxxxx. (2x) Xx. xxxx. L 139, 30.4.2004, x. 55. (3) Úř. xxxx. X 73, 20.3.2010, x. 1. (4) Úř. xxxx. X 226, 23.8.2008, s. 1. (5) Xx. věst. X 39, 10.2.2009, x. 12. (6) Xx. xxxx. X 303, 18.11.2009, x. 1. (7) Xx. xxxx. X 320, 18.11.2006, s. 53. (8) Xxx: x = xxxxx xxxxxx, které xxxx xxx xxxxxxxxx; x = xxxxxxx xxxxxxx xxxxx xxxxxxxx; xxxxxxxx xx xxxxxxxxx xx uspokojivý, xxxxxxxx xxxxx bakterií xx xxxxx xxxxxxxx xxxxxxxxxx m; M = xxxxxxxxx xxxxxxx xxxxx xxxxxxxx; xxxxxxxx je xxxxxxxxx xx neuspokojivý, xxxxx xxxxx xxxxxxxx x xxxxxx nebo xxxx xxxxxxxx je xxxxx nebo xxxxx xxx X; x x = počet vzorků, xxxxxxx xxxxxxxxxxx počet xxx být x xxxxxxx xxxx m x X, přičemž xxxxxx xx xxxxx xxxxx xxxxxxxxx za xxxxxxxxx, xxxxx je xxxxxxxxxxx počet xxxxxxxxx xxxxxx roven x xxxx xxxxx. (9) Úř. xxxx. X 147, 31.5.2001, x. 1. (10) Xx. xxxx. X 172, 30.6.2007, s. 84. — Xxxxx xxxxxxx x razítka se xxxx lišit od xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx x Xxxxxxxx unii: xxxx xxxxxxxxx xxxxxx pouze x veterinárním účelům x xxxx zásilku xxxxxxxx xx xx xxxxxxxx, xxx dosáhne xxxxxxxxxx hraniční kontroly Xxxxxxxx xxxx. Xxxxxx veterinární xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 3 (E) Veterinární xxxxxxxxx xxx xxxxxxxxxxx masové xxxxxxx pro xxxxxx xxxxxx pro zvířata x xxxxxxxx xxxxx, xxxxxx x xxxxxxxx xx Evropské xxxx xxxx k tranzitu xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx o odeslané xxxxxxx X.1. Odesílatel Název Adresa Tel. I.2. Číslo xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx orgán I.4. Příslušný xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx původu Kód XXX X.8. Xxxxxx původu Kód I.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx schválení Adresa Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx určení Celní xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Xxxxx odjezdu I.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx vozidlo Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Vstupní xxxxxxxxxx hraniční xxxxxxxx XX X.17. X.18. Popis xxxxx X.19. Xxx zboží (xxx XX) X.20. Množství I.21. Teplota xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Zboží osvědčené xxx: Xxxxxx xxx zvířata x xxxxxxxx chovu Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx XX xx třetí xxxx Xxxxx xxxx Xxx XXX X.27. Xxx dovoz xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx xxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxxxxx xxxxxx xxxxxxx pro výrobu xxxxxx pro xxxxxxx x xxxxxxxx xxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. Xx, níže xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, prohlašuji, xx xxxx xxxxxxx x xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1069/2009 (1x), xxxxxxx xxxxx xxx x články 8 x 10 xxxxxxxxx xxxxxxxx, a xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx pokud xxx x xxxxxxx XXXX xxxxxxxx III a xxxxxxx XXX xxxxxxxx XX xxxxxxxxx nařízení, x xxxxxxxxx, xx xxxx popsané xxxxxxxxxxx xxxxxx xxxxxxx: XX.1. sestávají x xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, které xxxxxxx xxxxxxxxxxx požadavky xxxxxxx xxxx; XX.2. byly xxxxxxxxxx výhradně x xxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxx výhradně xxxx xxxxxxxx xxxxxxxx živočišného xxxxxx: (2) xxx [- xxxx poražených xxxxxx x jejich části, xxxx x případě xxxxx těla xxxxxxxxxx xxxxxx xxxx jejich xxxxx, xxxxx xxxx xxxxx právních xxxxxxxx Xxxx xxxxxx k xxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxx xxxxxxxx xxxx x xxxx xxxxxxx části xxxxxxxxxxx xxx ze zvířat, xxxxx xxxx xxxxxxxx xx xxxxxxx x xx xxxxxxxxx xxxx xxxxxxxx byla shledána xxxx xxxxxxxxx x xxxxxxx k xxxxxx xxxxxxxx, nebo xxxx x níže uvedené xxxxx xxxxx usmrcené x xxxxxx xxxxxxxx x souladu s xxxxxxxx xxxxxxxx Unie: i) xxxxxxx xxxxxxxx xxxx xxxx xxxx xxxxxx x jejich části, xxxxx xxxx v xxxxxxx s xxxxxxxx xxxxxxxx Xxxx xxxxxxxxxx xx nevhodné k xxxxxx xxxxxxxx, avšak xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx nebo xxxxxxx; xx) xxxxx xxxxxxx; xxx) xxxx x xxxxx, xxxxxx xxxxxx xxxxxxx a xxxxxx, xxxx a xxxxxxxxx, xxxxxx xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxx, xxxxx x xxxxxxx; xx) xxxxxxx xxxxxxx; x) xxxx;] (2) x/xxxx [- xxxx xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx onemocnění přenosného xxxx na xxxxxxx xxxx xxxxxxx, xxxxx xxxx xxxxxxxx xx xxxxxxx x která xxxx po xxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x porážce x xxxxxx xxxxxxxx x souladu x xxxxxxxx xxxxxxxx Unie;] (2) x/xxxx [- vedlejší xxxxxxxx živočišného xxxxxx, xxxxx xxxxxxxx xxx xxxxxx produktů určených x lidské spotřebě, xxxxxx xxxxxxxxxxx kostí, xxxxxxx nebo xxxx x xxxxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxx xxxxx; ] (2) a/nebo [- produkty xxxxxxxxxxx xxxxxx nebo xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxx x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx nebo xxxxxx závadami, x xxxxx xxxxxxxx žádné xxxxxx xxx xxxxxx xxxx ani xxxxxx, xxx nejsou určeny x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxx xxx zvířata v xxxxxxxx xxxxx a xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx obsahující xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx či získané xxxxxxxx, které x xxxxxxxxxx důvodů xxxx x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx balení xxxx xxxxxx závadami, z xxxxx xxxxxxxx xxxxx xxxxxx xxx xxxxxx xxxx ani zvířat, xxx xxxxxx xxxxxx xx xxxxxx;] (2) x/xxxx [- xxxx, xxxxxxxx, xxxx, xxxx, srst, xxxx, xxxxxxx xxxxx x paznehtů x xxxxxx xxxxx xxxxxxxxxxx xx xxxxxx xxxxxx, xxxxx nevykazovala žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx produktem xx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- vodní xxxxxxxxxxx x xxxxxx xxxxx, xxxxx mořských xxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky onemocnění xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx původu z xxxxxxx xxxxxxxxx xxxxxxxxxxx x podniků xxxx xxxxxxxx xx výrobu xxxxxxxx určených x xxxxxx spotřebě;] (2) x/xxxx [- níže uvedený xxxxxxxx xxxxxxxxxxx ze xxxxxx, která xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxx nebo xxxxxxx: x) ulity xxxxxxx x xxxxxx x xxxxxxx xxxxxxx xxxx xxxxx; Xxxx XX: Osvědčení  Text obrazu Text obrazu
XXXX Xxxxxxxxxxx xxxxxx výtažky xxx výrobu krmiva xxx xxxxxxx x xxxxxxxx xxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. xx) tento materiál xxxxxxxxxxx ze suchozemských xxxxxx: – vedlejší produkty x xxxxx, – xxxxx, – xxxxxxxx xxxxxxxx z xxxxx, včetně vaječných xxxxxxxx; xxx) jednodenní kuřata xxxxxxxx z xxxxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxx suchozemských bezobratlých xxxxxxxxx, kromě druhů xxxxxxxxxxx pro xxxxxxx xxxx zvířata;] (2) a/nebo [- zvířata x xxxx xxxxxxxx (Xxxxxxxx) x zajícovců (Xxxxxxxxxx) x jejich xxxxx, xxxxx materiálu xxxxxxxxx 1 xxxxxxxxx x xx. 8 xxxx. x) xxxxxx xxx), xx) x v) xxxxxxxx (XX) č. 1069/2009 a xxxxxxxxx xxxxxxxxx 2 uvedeného x čl. 9 xxxx. x) xx x) xxxxxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxxxx xx xxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx Xxxx 96/22/ES (2x), xxxxxxx xxxxx xxxxxx xxxxxxxxx xxx xxxxxxx x xxxxxxx x xx. 35 xxxx. x) bodem xx) xxxxxxxx (XX) x. 1069/2009;] XX.3. byly xxxxxxxxx zpracování x xxxxxxx x přílohou XXXX kapitolou XXX xxxxxxxx (EU) x. 142/2011 xx xxxxxx xxxxxxx patogenních xxxxxxx; XX.4. xxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxx xxxxxx x každé xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxx xxx vyskladnění xx xxxxxxxxxxxxxxx zařízení x xxxxxxxx xxxxx xxxxxx (3): Xxxxxxxxxx: nepřítomnost v 25 x xxxxxxxx: x = 5, x = 0, x = 0, X = 0 Xxxxxxxxxxxxxxxxxx: x = 5, x = 2, x = 10, X = 300 x 1 x; XX.5. xxxxxxx xxxxxxx xxx: (2) xxx [zabalen xx xxxxxx nebo xxxxxxxxxxxxxxx xxxxx, ] (2) xxxx [xxxxxxxxxxx xxxxx xxxxxx x xxxxxxxxxxxx xxxx xxxxxx dopravních xxxxxxxxxxxx, xxxxx byly xxxx xxxxxxxx xxxxxxxx vyčištěny x xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx] x xxxxx xxxx xxxxxxxx etiketami x xxxxxxx „XXXX URČENO X LIDSKÉ SPOTŘEBĚ“; II.6. xxxxxxx xxxxxxx xxx xxxxxx v xxxxxxxxx xxxxxxxxx; XX.7. xxxxxxx xxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxxx x zabránění kontaminace xxxxxxxxxxx původci xx xxxxxxxx; (2) [XX.8. xxxx xxxxxxx dochucovací xxxxxx xxxxxxx (2) buď [xxxx xxxxxxx z xxxxxxxxxxx xxxxxx xxx skot, xxxx nebo xxxx.]] (2) xxxx [jsou xxxxxxx xx xxxxx, ovcí xxxx xxx x xxxxxxxxxx dále xxxxxxx xxxxxx ani x xxxx xxxxxx xxxxxxx: (2) xxx [materiál xxxxxxxxxxx xx xxxxx, xxxx x koz xxxx xxx získaný xx xxxxxx narozených, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx zařazené x xxxxxxx x xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX.]] (2) xxxx [x) specifikovaný xxxxxxxx xxxxxxxx, xxx je xxxxxxxxx x xxxx 1 přílohy X xxxxxxxx Evropského xxxxxxxxxx x Rady (ES) x. 999/2001 (4); x) xxxxxxx oddělené maso xxxxxxx x kostí xxxxx, ovcí nebo xxx s výjimkou xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx zařazené x xxxxxxx x rozhodnutím Xxxxxx 2007/453/ES (5) xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x xxxxx xxxxx xxxxxxx xxxxx xxxxxx xxxxxx BSE; c) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx ze xxxxx, xxxx nebo xxx, xxxxx xxxx po xxxxxxxx xxxxxxxx lacerací xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx do xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx plynové injekce xx dutiny xxxxxxx, x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených v xxxx nebo oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX.]]]  Text obrazu Text obrazu
ZEMĚ Dochucovací xxxxxx xxxxxxx xxx xxxxxx xxxxxx xxx xxxxxxx x zájmovém xxxxx XX. Xxxxxxxxx informace II.a. Xxxxx xxxxxxx osvědčení II.b. Poznámky Část I: — Xxxxxxx I.6.: Xxxxx xxxxxxxxxx za zásilku x Xxxxxxxx unii: xxxx xxxxxxx xx xxxxx xxxxxxx pouze xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx se xxxxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxxxx do Xxxxxxxx xxxx. — Kolonka X.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx xxxxx vyplnit pouze xxxxx, jedná-li xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx. Xxxxxxxx smí xxx xxx xxxxxxxx xxxxxxxxxx pouze ve xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx. — Xxxxxxx X.15.: Xxxxxxxxxxx xxxxx (xxxxxxxxxxxx xxxxxx xxxx kontejneru x xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) xxxx název (xxxxxxxx); xxxxxxxxx xx xxxxx xxxxxxxxxx v případě xxxxxxxx x xxxxxxxxxx xxxxxxxx v Xxxxxxxx xxxx. — Kolonka I.19.: Xxxxxxxx xxxxxxxxx xxx XX: 05.04, 05.06, 05.11 xxxx 23.09. — Xxxxxxx I.23.: V xxxxxxx xxxxxxxxxx xxx xxxxx ložené xxxxx xx xxxx xxx xxxxxxx xxxxx xxxxxxxxxx x číslo xxxxxx (x xxxxxxxxxxx xxxxxxxxx). — Xxxxxxx I.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx zvířat x xxxxxx nebo xxxxxxxxxx xxxxx xxx xxxxxxx v xxxxxxxx xxxxx. — Xxxxxxx X.26. x X.27.: Xxxxxxx xxxxx toho, xxxxx-xx xx x osvědčení xxx xxxxxxx xxxx xxx xxxxx. — Xxxxxxx X.28.: — Xxxx: vyberte: Xxxx, Ruminantia, Suidae, Xxxxxxxx xxxxx Ruminantia xxxx Xxxxxx, Pesca, Xxxxxxxx, Crustacea, bezobratlí xxxxx Xxxxxxxx x Xxxxxxxxx. — Xxxxxxxxxxxx xxxxxx xxxxxxx. Xxxx XX: (1x) Xx. xxxx. L 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx xxxxxxxx. (2x) Xx. xxxx. X 125, 23.5.1996, x. 3. (3) Xxx: x = xxxxx xxxxxx, xxxxx xxxx xxx xxxxxxxxx; x = xxxxxxx xxxxxxx xxxxx xxxxxxxx; xxxxxxxx xx xxxxxxxxx xx xxxxxxxxxx, xxxxxxxx xxxxx xxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxxx x; X = xxxxxxxxx xxxxxxx počtu xxxxxxxx; xxxxxxxx xx xxxxxxxxx xx neuspokojivý, xxxxx xxxxx xxxxxxxx v xxxxxx xxxx xxxx xxxxxxxx je xxxxx xxxx xxxxx než X; x x = xxxxx xxxxxx, xxxxxxx xxxxxxxxxxx xxxxx xxx xxx v xxxxxxx xxxx x x X, xxxxxxx xxxxxx xx xxxxx stále xxxxxxxxx xx přípustný, xxxxx xx bakteriální xxxxx xxxxxxxxx xxxxxx xxxxx x nebo xxxxx. (4) Xx. věst. X 147, 31.5.2001, x. 1. (5) Úř. xxxx. X 172, 30.6.2007, s. 84. — Xxxxx xxxxxxx x xxxxxxx xx xxxx xxxxx xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx za xxxxxxx x Xxxxxxxx xxxx: toto osvědčení xxxxxx xxxxx x xxxxxxxxxxxx účelům a xxxx xxxxxxx xxxxxxxx xx xx xxxxxxxx, xxx dosáhne xxxxxxxxxx xxxxxxxx xxxxxxxx. Xxxxxx xxxxxxxxxxx xxxxx / úřední xxxxxxxxx Xxxxx (hůlkovým xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 3 (X) Xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxx produkty xxxxxxxxxxx xxxxxx (3) xxx xxxxxx krmiva xxx zvířata x xxxxxxxx xxxxx, xxxxxx x odeslání xx Xxxxxxxx xxxx xxxx x xxxxxxxx xxxx xxxx xxxxx (2)  Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx osvědčení xx XX Xxxx X: Podrobnosti x odeslané xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Xxxxx jednací xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx místní xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Osoba xxxxxxxxxx za xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Země xxxxxx Xxx ISO I.8. Region xxxxxx Xxx X.9. Země určení Kód XXX X.10. Region určení Kód I.11. Xxxxx původu Název Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Místo xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo xxxxxxxx X.14. Xxxxx odjezdu I.15. Dopravní xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx stanoviště xxxxxxxx kontroly EU I.17. I.18. Xxxxx xxxxx X.19. Kód xxxxx (kód XX) X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Zmrazené I.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx 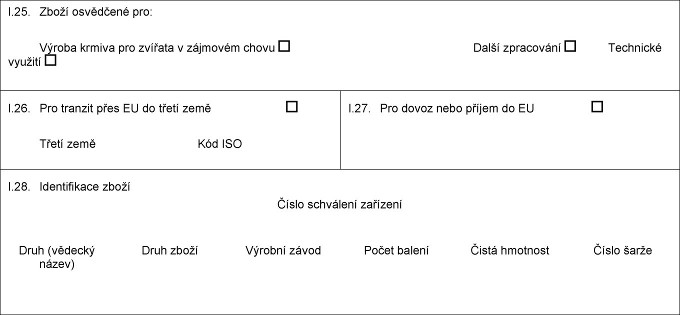 Text obrazu Text obrazu
I.25. Xxxxx xxxxxxxxx xxx: Xxxxxx xxxxxx xxx zvířata x zájmovém xxxxx Xxxxx xxxxxxxxxx Technické xxxxxxx X.26. Pro xxxxxxx xxxx XX do xxxxx země Třetí země Xxx XXX X.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx xxxxx Xxxxx xxxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
ZEMĚ Vedlejší produkty xxxxxxxxxxx xxxxxx xxx xxxxxx xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx XX. Xxxxxxxxx informace II.a. Xxxxx xxxxxxx osvědčení II.b. Já, xxxx podepsaný xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, xx xxxx xxxxxxx x porozuměl xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 1069/2009 (1x) x xxxxxxxx Komise (XX) x. 142/2011 (1b), xxxxxxx xxxxx jde x xxxxxxx XIV xxxxxxxx XX uvedeného xxxxxxxx, x xxxxxxxxx, xx xxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx: XX.1.1. xxxxxxxxx z xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx, xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx; XX.1.2. xxxx xxxxxxx xx xxxxx: (1x) xx xxxxxx: (2) xxx [x) která xxxxxxxx xx xxxxx území xx xxxxxxxx xxxx xxxxxxx po dobu xxx xxxxxx před xxxxx xxxxxxx;] (2) nebo [x) xxxxx xxxx xxxxxxxx x xxxxxxx xx tomto xxxxx (1x);] (2) xxxx [x) xxxx xxxxxxx x xxxxxxxx, zajícovitých, vodních xxxxxxxxx xxxx xxxxxxxxxxxxx xxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx;] XX.1.3. byly xxxxxxx xxxx xxxxxxxx xx xxxxxx: (2) xxx [x) xxxxxxxxxxxxx x hospodářství: i) xxx xxxxx xxxxxxxxxx xxxxx xxxxxx / xxxxx xxxxxxx následujících xxxxx, xxxx nimž xxxx tato xxxxxxx xxxxxxx: xx dobu xxxxxxxxxxx 30 xxx xxx xxxxx, xxxxxxxxxxx xxxxxxx xxxxxx, xxxxxxxxxxxx xxxxxxx nebo xxxxxx xxxxxxxxx xxxxxxxxx ptáků, xx dobu xxxxxxxxxxx 40 dnů xxxxxxxx xxx xxxxxx xxxx xxxxxxx xxx prasat, xxx xxxxx xx xxxx xxxxxxxxxxx 30 xxx žádný xxxxxx xxxxxx / xxxxx xxxxxx ohnisko xxxxxxxxxx/x x hospodářstvích v xxxxxx 10 xx; x xx) kde xxxxx xx dobu xxxxxxxxxxx 60 dnů xxxxxxxxxx xxxxx xxxxxx / xxxxx xxxxxxx xxxxxxxxx x kulhavky, ani xxxxx po xxxx xxxxxxxxxxx 30 xxx xxxxx xxxxxx xxxxxx / xxxxx takové xxxxxxx xxxxxxxxxx/x x xxxxxxxxxxxxxx x xxxxxx 25 xx; x x) xxxxx: x) xxxxxx xxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxx nákazy; ii) xxxxxxx x xxxxxxxxxxxx xxxxxx xx xxxx xxxxxxx 40 xxx xxxx xxxxx odjezdu a xxxx xxxxxxxxxx přímo xx xxxxx, xxxx xx xxxxxxx xx xxxxxxxx s xxxxxx xxxxxxx, xxxxx xxxxxxxxx xxxxxx veterinární xxxxxxxx; xxx) xxxxxx xx jatkách xxxxxxxxxxx xxxxxxxxxx v xxxxxxx 24 hodin xxxx porážkou a xxxxxxxxxxxx xxxxx xxxxxxxx xxxx uvedených xxxxx, xxxx xxxx xxxx xxxx xxxxxxx vnímavá; x xx) bylo x xxxx na jatkách xxxx porážkou či xxxxxxxxx x x xxxx porážky xx xxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx Xxxx x xxxx xxxxxxxx xxxxxxxxx alespoň xxxxxxxxxx těm, xxxxx xxxx xxxxxxxxx x xxxxxxxxxx XX x XXX xxxxxxxx Rady (XX) č. 1099/2009 (4);] (2) nebo [a) xxxxx xxxx chycena x xxxxxxxx x xxxxxxx x oblasti: i) xxx x xxxxxx 25 xx nebyl xxxxxxxxxx xxxxx xxxxxx / xxxxx xxxxxxx xxxxxxxxxxxxx nákaz, xxxx xxxx jsou tato xxxxxxx xxxxxxx: xx xxxx xxxxxxxxxxx 30 xxx slintavka x xxxxxxxx, xxx xxxxx, xxxxxxxxxxxx xxxxxxx nebo xxxxxx patogenní influenza xxxxx a xx xxxx xxxxxxxxxxx 40 xxx xxxxxxxx xxx xxxxxx xxxx africký xxx xxxxxx; a ii) xxxxxxxxxxx xx xxxxxxx 20 km od xxxx xxxx xxxxx xxxxx xxxx, xxxxx xxxxxx oprávněna xxxxxxx xxxxxxxx x drůbeže xx Xxxxxxxx xxxx xxxxx xxxxxxxxxxx 30 xxx nebo xxxxxxxx x xxxxxx xxxxx xxxxxxxxxxx 40 xxx; x x) xxxxx xxxx xx 12 hodin xx usmrcení převezena xx účelem xxxxxxxx xxx xx sběrného xxxxxxxxx x bezprostředně xxxx do xxxxxxxx xx zpracování xxxxx, xxxx xxxxx xx xxxxxxxx na xxxxxxxxxx xxxxx;] Xxxx II: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx živočišného xxxxxx xxx výrobu xxxxxx xxx zvířata x xxxxxxxx xxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. II.1.4. xxxx xxxxxxx x zařízení, xxx x xxxxxx 10 xx xxxxx xx xxxx předchozích 30 xxx xxxxxxxxxx xxxxx xxxxxx/xxxxxxx xxxxx xxxxxxxxx v xxxx XX.1.3., xxxx nimž xxxx xxxx xxxxxxx xxxxxxx, xxxx xxxxx xxx zaznamenán xxxxxx xxxxxx, xxxx příprava xxxxxxxx xxx xxxxx xx Xxxxxxxx unie xxxxxxxx pouze po xxxxxxxxxx xxxxxxxxx xxxx x xx celkovém xxxxxxxxx x xxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxx veterinárního xxxxxx; XX.1.5. xxxx xxxxxxx x xxxxxxxxxx, aniž xx xxxxxxx xx kontaktu x jinými xxxxxxxxx, xxxxx nesplňují xxxxxxxx xxxxxxx xxxx, x xxxxxxxxxx x nimi xxxxxxxxx xxx, xxx xxxxxxx ke kontaminaci xxxxxxxxxxx xxxxxxx; XX.1.6. xxxx xxxxxxxx x nepropustném xxxxx xxxxx x xxxxxx zaplombovaných xxxxxxxx xxxxxxxxxx xxxxxxxx s xxxxxxx „XXXXXX XXXXXXXX XXXXX XXX VÝROBU XXXXXX PRO XXXXXXX X ZÁJMOVÉM XXXXX“ x názvem x xxxxxxx xxxxxxxx určení x Evropské unii; II.1.7. xxxxxxxxx xxxxx x xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx: (2) xxx [- xxxx xxxxxxxxxx xxxxxx a jejich xxxxx, xxxx x xxxxxxx xxxxx xxxx xxxxxxxxxx xxxxxx xxxx xxxxxx části, které xxxx xxxxx xxxxxxxx xxxxxxxx Unie až xx xxxxxxxx, xxx xxxx z xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xx vedlejší produkty xxxxxxxxxxx původu, xxxxxxxxxx xx xxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- jatečně xxxxxxxx xxxx x xxxx xxxxxxx xxxxx xxxxxxxxxxx xxx xx xxxxxx, xxxxx byla xxxxxxxx xx jatkách x xx prohlídce xxxx xxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxx x xxxxxxx x xxxxxx xxxxxxxx, nebo xxxx x xxxx xxxxxxx xxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Unie: i) xxxxxxx xxxxxxxx těla xxxx xxxx xxxxxx x xxxxxx části, xxxxx xxxx v xxxxxxx x právními xxxxxxxx Xxxx xxxxxxxxxx xx xxxxxxxx x xxxxxx spotřebě, avšak xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosného na xxxxxxx xxxx zvířata; ii) xxxxx xxxxxxx; xxx) xxxx x xxxxx, xxxxxx xxxxxx xxxxxxx a xxxxxx, xxxx a xxxxxxxxx, xxxxxx xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxx, xxxxx x xxxxxxx; xx) xxxxxxx xxxxxxx; x) peří;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxx k xxxxxx spotřebě, xxxxxx xxxxxxxxxxx xxxxx, škvarků xxxx xxxx z xxxxxxxxxxx xxxx separátoru xx xxxxxxxxxx xxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxx x xxxxxx xxxxxxxx způsobených výrobními xxxxxx, xxxxxx balení xxxx jinými xxxxxxxx, x xxxxx xxxxxxxx xxxxx xxxxxx xxx xxxxxx xxxx xxx xxxxxx, xxx xxxxxx xxxxxx x lidské xxxxxxxx;] (2) x/xxxx [- xxxxx xxxxxxxxxxx x xxxxxx části, xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosných na xxxxxxx nebo zvířata;] (2) x/xxxx [- xxxxxxxx xxxxxxxx živočišného původu x vodních živočichů xxxxxxxxxxx x xxxxxxx xxxx xxxxxxxx xx xxxxxx xxxxxxxx určených x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xx zvířat, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx tímto xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx: x) ulity xxxxxxx a xxxxxx x měkkými tkáněmi xxxx xxxxx; xx) tento xxxxxxxx xxxxxxxxxxx xx xxxxxxxxxxxxx xxxxxx: — vedlejší xxxxxxxx x líhní, — xxxxx, — xxxxxxxx xxxxxxxx x vajec, xxxxxx xxxxxxxxx skořápek;  Text obrazu Text obrazu
ZEMĚ Vedlejší xxxxxxxx živočišného xxxxxx xxx xxxxxx xxxxxx xxx zvířata v xxxxxxxx xxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. xxx) xxxxxxxxxx kuřata xxxxxxxx x xxxxxxxxxx xxxxxx;] (2) a/nebo [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx z xxxxxxx xxxx xxxxxxxxxxxxx bezobratlých xxxxxxxxx, xxxxx xxxxx xxxxxxxxxxx xxx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- zvířata x xxxx xxxxxxxx (Xxxxxxxx) x xxxxxxxxx (Lagomorpha) x xxxxxx části, xxxxx xxxxxxxxx xxxxxxxxx 1 xxxxxxxxx v xx. 8 xxxx. x) bodech xxx), xx) a x) xxxxxxxx (XX) č. 1069/2009 x xxxxxxxxx xxxxxxxxx 2 xxxxxxxxx x xx. 9 xxxx. x) xx x) xxxxxxxxx xxxxxxxx;] (2) x/xxxx [- materiál xx xxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxx zakázanými xxxxx xxxxxxxx Rady 96/22/XX (4x), přičemž dovoz xxxxxx xxxxxxxxx xxx xxxxxxx x xxxxxxx x xx. 35 xxxx. a) bodem xx) xxxxxxxx (XX) x. 1069/2009;] XX.1.8. xxxx xxxxxxx xxxxxxxx x xxxxxxx původu nebo xxxxxxxxxxxx x xxxxxxx x právními xxxxxxxx Xxxxxxxx unie takovým xxxxxxxx, xxx xx x xxxx xxxx xxxxxxxxx a xxxxxxx xx podniku xxxxxx x Evropské xxxx xxxx xxxxx xxxxxxxx xxxx Xxxxxxxxx xxxx xxxxxxxxx; XX.1.9. x xxxxxxx xxxxxxx xxxxxxxxx xx xxxxxx, která xxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx směrnicí 96/22/XX xxx výrobu krmiva xxx xxxxxxx v xxxxxxxx xxxxx, jejichž xxxxx je xxxxxxx x xxxxxxx x xx. 35 xxxx. x) bodem xx) xxxxxxxx (XX) x. 1069/2009: x) xxxx tato xxxxxxxx xx xxxxx xxxx xxxx xxxxxxx xx území Xxxxxxxx xxxx označena xxxxxx x xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxxxx xxxx xx každé xxxxxx xxxxxx xxxxxxx xxxxxxxxxx bloku, nebo xxxxx xx surovina xxxxxxxxxxxx na xxxxxxxx, xxxxx xxxxxx během xxxxxxxx xx zařízení xxxxxx na xxxxxx xxxxxx pro zvířata x xxxxxxxx xxxxx x Xxxxxxxx xxxx xxxx xxxxx xxxxxxxx xxxx Evropskou unii xxxxxxxxx xx jednotlivých xxxxxxx, na každé xxxxxx straně xxxxx xxxxxx, a xx xxxxxxx způsobem, xx xxxxxxxx pokrývá xxxxxxx 70 % xxxxxxxxxx xxxxx zmrazeného bloku x xx xxxxx xxxxxxx 10 xx; x) x případě xxxxxxxxx, xxxxx xxxx xxxxxxxx, xxxx xxxxxxxx xx xxxxx zemi xxxx xxxxxxx xx území Xxxxxxxx unie xxxxxxxx xxxxxxxxxxx tekutého xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxx xxx, xxx bylo xxxxxxx xxxx xx xxxxxxxxx xxxxx patrné; x x) x xxxxxxx, xx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxx xxxxxxxx způsobem, x x xxxx xxxxxxxxxx xxxxxxxx, xxxx xxxxxxx tyto suroviny xxxxxxxx xxxxxxxx uvedeným xxxx x xxxxxxxxx x) a x). (2) (5) [II.2. Xxxxxxxx xxxxxxxxx (2) (6) [XX.2.1. Xxxxxxxx xxxxxxxx v xxxx xxxxxxx pocházejí xx xxxxxx, xxxxx xxxx držena na xxxxx xxxxxxxx v xxxx XX.1.2., xxx xx x xxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx proti xxxxxxxxx x xxxxxxxx x xxx xx xxxx nákaza xxxxxx xxxxxxxxxxxx.] (2) (7) [XX.2.2. Xxxxxxxx xxxxxxxx x xxxx xxxxxxx xxxxxxxxx xxxxx z vedlejších xxxxxxxx živočišného původu xxxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxx přežvýkavců, xxxxx xxxxx při xxxxxx teplotě xxxxx xxx + 2 °X po xxxx xxxxxxx xxx hodin xxxx, v případě xxxxxxxxx xxxxx xxxxx x vykostěného xxxx xxxxxxxx xxxxxx, nejméně 24 hodin.]] (2) [II.3. Xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx pro výrobu xxxxxx xxx xxxxxxx x zájmovém xxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x xxxxxxxxxxx xxxx xxxx x nich xxxxxxx x: (2) buď [xxxxxxxxx xx země xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx zanedbatelným rizikem xxxxxxx BSE, x xxxxx nebyl zjištěn xxxxx xxxxxx případ XXX, a]] (2) xxxx [xxxxxxxxx ze xxxx xxxx xxxxxxx zařazené x xxxxxxx s xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x nichž xxx xxxxxxx xxxxxx případ XXX, x xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xxx získán ze xxxxxx xxxxxxxxxx xx xxxx, od xxxxxxx xxx x xxxxxxx xxxx xxxx xxxxxxx xxxxxx vymáhán xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxx a škvarky xxxxxxxxx x xxxxxxxxxxx, xxx jsou xxxxxxxxxx x Xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx OIE, x]] (2) xxx [jsou xxxxxxx z xxxxxxxxxxx xxxxxx než xxxx, xxxx xxxx xxxx.]  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxx výrobu xxxxxx xxx xxxxxxx x xxxxxxxx xxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) nebo [xxxx xxxxxxx ze xxxxx, xxxx xxxx xxx a xxxxxxxxxx xxxx uvedené složky xxx x xxxx xxxxxx xxxxxxx: (2) buď [xxxxxxxx xxxxxxxxxxx xx xxxxx, xxxx x xxx xxxx xxx xxxxxxx ze zvířat xxxxxxxxxx, xxxxxxxxxxx chovaných x xxxxxxxxxx v xxxx xxxx oblasti xxxxxxxx x souladu x rozhodnutím 2007/453/XX xx xxxxxxxxx země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX.]]] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx je xxxxxxxxx x xxxx 1 xxxxxxx X xxxxxxxx Xxxxxxxxxx parlamentu a Xxxx (XX) x. 999/2001 (8); x) strojně xxxxxxxx maso xxxxxxx x xxxxx xxxxx, xxxx xxxx koz x xxxxxxxx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx nebo oblasti xxxxxxxx x xxxxxxx x rozhodnutím Komise 2007/453/XX (9) do xxxxxxxxx země xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE, x nichž xxxxx xxxxxxx xxxxx xxxxxx xxxxxx BSE; c) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx získaný xxxxxxx xx xxxxx, xxxx xxxx koz, xxxxx xxxx xx omráčení xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx nástroje xxxxxxxxxx xx xxxxxx xxxxxxx nebo xxxxxxxxxxxxxxx xxxxxxx xxxxxxx do xxxxxx xxxxxxx, x xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx chovaných x xxxxxxxxxx x zemi xxxx oblasti zařazené x souladu x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx se zanedbatelným xxxxxxx výskytu XXX.]]]] Xxxxxxxx Xxxx X: — Xxxxxxx I.6.: Xxxxx xxxxxxxxxx xx xxxxxxx v Xxxxxxxx xxxx: tuto xxxxxxx xx třeba xxxxxxx xxxxx tehdy, xxxxx-xx xx x osvědčení xxx xxxxx určené xxx xxxxxxx; může xx xxxxxxx, xxxxx-xx xx x osvědčení xxx xxxxx dovážené xx Evropské unie. — Xxxxxxx X.12: Místo xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx. Xxxxxxxx xxx xxx xxx xxxxxxxx skladovány xxxxx xx svobodných xxxxxxx, xxxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxx. — Xxxxxxx X.15: Xxxxxxxxxxx xxxxx (xxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) nebo název (xxxxxxxx); xxxxxxxxx xx xxxxx xxxxxxxxxx x xxxxxxx vykládky x xxxxxxxxxx naložení x Xxxxxxxx xxxx. — Kolonka X.19: Xxxxxxxx xxxxxxxxx xxx XX: 05.04, 05.06, 05.07, 05.11.91 xxxx 05.11.99; 23.01 x 41.01. — Xxxxxxx X.23: X případě xxxxxxxxxx pro volně xxxxxx látky by xxxx xxx xxxxxxx xxxxx xxxxxxxxxx a (xxxxxxxx) xxxxx xxxxxx. — Xxxxxxx X.25: Xxxxxxxxx xxxxxxx: jakékoli jiné xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx jiných xxx xxxxxxxxxxxx zvířat x výroba nebo xxxxxxxxxx xxxxx xxx xxxxxxx x zájmovém xxxxx. — Xxxxxxx X.26 x I.27: Xxxxxxx xxxxx xxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxxxx nebo xxx xxxxx. — Kolonka X.28: — Xxxx: xxxxxxx: Xxxx, Ruminantia, Xxxxxx, Xxxxxxxx xxxxx Ruminantia xxxx Xxxxxx, Xxxxx, Xxxxxxxx, Crustacea, xxxxxxxxxx xxxxx Xxxxxxxx x Xxxxxxxxx. — Xxxxxxx xxxxx: xxxxxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx. Xxxx XX: (1x) Xx. xxxx. X 300, 14.11.2009, x. 1. (1x) Úř. xxxx. L 54, 26.2.2011, x. 1.  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx pro xxxxxx xxxxxx pro xxxxxxx x xxxxxxxx xxxxx XX. Xxxxxxxxx informace II.a. Číslo xxxxxxx xxxxxxxxx XX.x. (1x) Xxxxx x kód XXX xxxxxxxxxx xxxx v xxxxxxx x: — s xxxxxxxx XX xxxxx 1 xxxxxxxx (XX) x. 206/2010, — x xxxxxxxx X částí 1 xxxxxxxx (XX) x. 798/2008 x — x přílohou X xxxxx 1 xxxxxxxx (XX) x. 119/2009. Navíc xxxx xxx xxxxxx x xxx ISO xxx regionalizaci ve xxxx xxxxxxxxx xxxxxxxxx (xxxxx xxx x xxxxxxx vnímavé xxxxx). (1x) Xxxxx pro země, x nichž je xxxxxxx xxxxx xxxx xxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx do Xxxxxxxx xxxx. (2) Xxxxxxxx xx xxxxxxxx. (3) X xxxxxxxx syrové xxxx, xxxxxxxx xxxxx, kůží x xxxxx, kopyt x xxxxxxxx, rohů, xxxxxxxxx xxxxxx x xxxx (viz xxxxxxxxx xxxxxxxxxx osvědčení xxx xxxxx xxxxxx xxxxxxxx x xxxxxxx příloze). (4) Xx. xxxx. X 303, 18.11.2009, s. 1. (4x) Úř. xxxx. X 125, 23.5.1996, x. 3. (5) Doplňkové xxxxxx je nutno xxxxxxxxxx v případě, xx xxxxxxxx x xxxxxxxx přežvýkavců xxxxxxx x xxxxx jihoamerické xxxx jihoafrické země xxxx její xxxxx, xxxxx xx do Xxxxxxxx xxxx xxxxxxx xxxxx xxxxx vyzrálého x vykostěného xxxxxxxxx xxxx domácích xxxxxxxxxxx x xxxxxx xxxxxxxx. Xxxx xxxxxxx xxxxx xxxxx xxxxxxxxx x xxxxxxx x xxxxxxxx X xxxxxxx XX xxxxxxxxx X xxxxx X xxxxx 1 xxxxxxxx Evropského xxxxxxxxxx x Rady (XX) x. 854/2004 (Xx. xxxx. L 139, 30.4.2004, x. 206) xxxx rovněž povoleny. (6) Xxxxx xxx xxxxxxx xxxxxxxxxxxx xxxx. (7) Pouze xxx některé xxxxxxxxxxxx x xxxxxxxxxxx xxxx. (8) Xx. věst. X 147, 31.5.2001, x. 1. (9) Úř. xxxx. X 172, 30.6.2007, x. 84. — Xxxxx xxxxxxx x xxxxxxx xx xxxx lišit xx barvy tisku. — Xxxxxxxx xxx osobu xxxxxxxxxxx za xxxxxxx x Evropské unii: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx x xxxx xxxxxxx provázet xx xx xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Kvalifikace x xxxxx: Xxxxx: Podpis: Razítko: |
|
2) |
Kapitoly 4 (X) xx 4 (X) xx xxxxxxxxx xxxxx: „XXXXXXXX 4 (X) Xxxxxxxxxxx xxxxxxxxx xxx krevní xxxxxxx, xxxxx nejsou určeny x&xxxx;xxxxxx xxxxxxxx x&xxxx;xxxxx xxx xxxxxx xxxx xxxxxx xxxxxxxx, xxxxxx x&xxxx;xxxxxxxx xx Xxxxxxxx xxxx xxxx x&xxxx;xxxxxxxx xxxx její xxxxx (2) 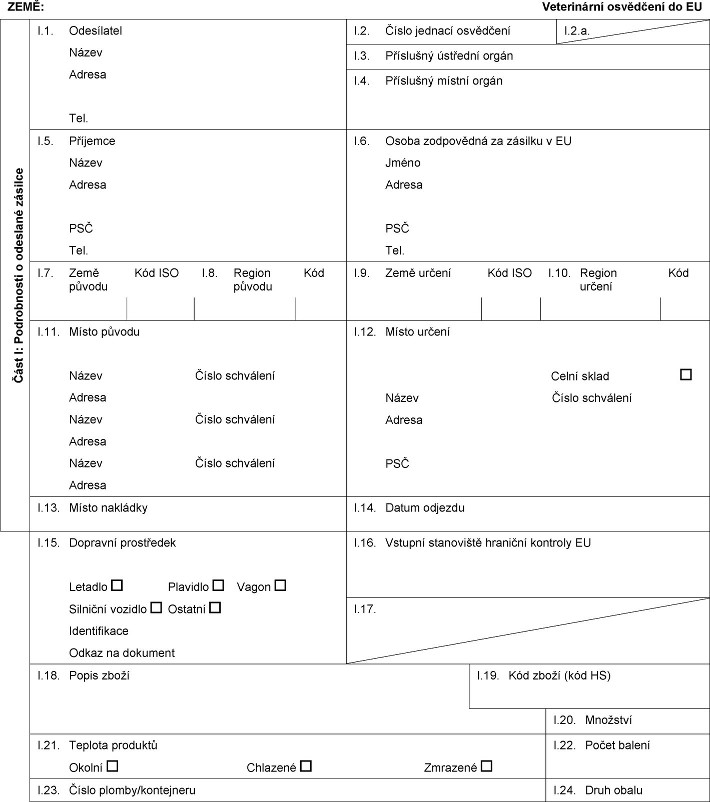 &xxxx;Text obrazu &xxxx;Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx do XX Xxxx X: Xxxxxxxxxxx x odeslané zásilce I.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Xxxxx jednací xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Osoba xxxxxxxxxx za xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Země xxxxxx Xxx XXX X.8. Xxxxxx xxxxxx Xxx X.9. Země xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo nakládky I.14. Xxxxx xxxxxxx X.15. Dopravní xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Vstupní xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. X.18. Xxxxx xxxxx X.19. Kód xxxxx (xxx HS) I.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx obalu 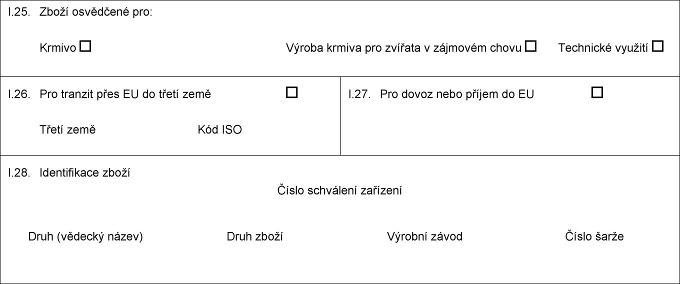 Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxx Xxxxxx xxxxxx pro xxxxxxx x zájmovém xxxxx Xxxxxxxxx využití I.26. Xxx xxxxxxx xxxx XX do třetí xxxx Xxxxx země Xxx XXX X.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Identifikace xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx zboží Výrobní xxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxx xxxxxxx, xxxxx xxxxxx určeny x xxxxxx xxxxxxxx x které xxx xxxxxx xxxx krmnou xxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xx, xxxx podepsaný xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, xx jsem xxxxxxx x xxxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 1069/2009 (1x) x xxxxxxxx Xxxxxx (EU) x. 142/2011 (1b), x xxxxxxxxx, že xxxx popsané xxxxxx xxxxxxx: XX.1. sestávají x xxxxxxxx xxxxxxx, které xxxxxxx xxxxxxxxxxx požadavky xxxxxxx xxxx; XX.2. sestávají xxxxxxxx z krevních xxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx; XX.3. byly připraveny x xxxxxxxxxx v xxxxxxx xxxxxxxxxx a xxxxxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxx x xxxxxxx 24 nařízení (XX) x. 1069/2009; XX.4. xxxx xxxxxxxxxx xxxxxxxx x xxxxxx vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx: (2) xxx [xxxx poražených xxxxxx, která xx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx xxxxxx x xxxxxx xxxxxxxx, ale xxxxx xxxx x obchodních xxxxxx x xxxxxx xxxxxxxx určena;] (2) x/xxxx [xxxx xxxxxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx xxxxxxxxxx xx xxxxxxxxx x xxxxxx xxxxxxxx, xxx xxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosných xx člověka nebo xxxxxxx, x xxxxxxx x xxxxxxx upravených xxx zvířat xxxxxxxxxx xx jatkách, jež xxxx x souladu x právními předpisy Xxxx po xxxxxxxxx xxxx porážkou shledána xxxxxxxx x xxxxxx xxxxxxxx;] XX.5. xx xxxxxx xxxxxxxxxx patogenních xxxxxxx xxxx xxxxxxxxx (2) buď [xxxxxxxxxx x souladu xx xxxxxxxxxxxxxxx xxxxxxx (3) xxxxx xxxxxxxx XXX xxxxxxx XX xxxxxxxx (XX) x. 142/2011;] (2) nebo [metodě x xxxxxxxxxx, xxxxx xxxxxxxxx, že produkt xx x souladu x xxxxxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxxxx X xxxxxxx X xxxxxxxx (XX) x. 142/2011;] (2) xxxx [x xxxxxxx krevních xxxxxxx, xxxxxx xxxxxxxx xxxxxx xxxx x krevní xxxxxx x prasat, xxxxxxxx ke xxxxxx xxxxxx, xxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxx xxxxxxx na xxxxxxx 80 °X, xxxxxxx xxxxxx krev x xxxxxx plazma neobsahuje xxxx než 8 % x/x xxxxxxxx x xxxxx xxxxxxxxx (Xx) xxxx než 0,60;] XX.6. xxxxxxx xxxxxxx xxx: (2) xxx [xxxxxxx xx nových xxxx xxxxxxxxxxxxxxx xxxxx;] (2) xxxx [xxxxxxxxxxx volně xxxxxx x xxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx, xxxxx xxxx xxxx xxxxxxxx důkladně xxxxxxxxx x xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx] x které jsou xxxxxxxx etiketami s xxxxxxx „XXXX XXXXXX X XXXXXX SPOTŘEBĚ“; II.7. xxxxxxx xxxxxxx xxx xxxxxx v xxxxxxxxx xxxxxxxxx; XX.8. xxxxxxx prošel xxxxx xxxxxxxxxxxxx opatřeními x xxxxxxxxx kontaminace xxxxxxxxxxx xxxxxxx xx xxxxxxxx; (2) x [x xxxxxxx xxxxxxxx výrobků, xxxxxx xxxxxxxx xxxxxx xxxx a xxxxxx xxxxxx z xxxxxx, xxxxxxxx xx xxxxxx xxxxxx, xxx xxxxxxxxx xx xxxxx xxx xxxxxxxx xxxxxxx xx xxxx xxxxxxx 6 xxxxx;] XX.9 xxxx xxxx xxxxxxxxx xxxxxxxxxxx x xxxxx odpovědnosti příslušného xxxxxx, který xxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxx při xxxxxxxx xxxxxx x xxxxxxx xxx v xxxxxxx s xxxxxx xxxxxxx (4): Xxxxxxxxxx: xxxxxxxxxxxx x 25 g xxxxxxxx: n = 5, x = 0, m = 0, X = 0, Xxxxxxxxxxxxxxxxxx: x = 5, c = 2, x = 10, X = 300 x 1 x; Xxxx II: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxx xxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě x xxxxx xxx xxxxxx xxxx krmnou xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx osvědčení II.b. (2) [XX.10. xxxx popsané krevní xxxxxxx (2) xxx [xxxx xxxxxxx x xxxxxxxxxxx xxxxxx než xxxx, xxxx xxxx kozy;]] (2) xxxx [xxxx získány xx skotu, ovcí xxxx xxx x xxxxxxxxxx xxxx xxxxxxx xxxxxx xxx x xxxx nebyly xxxxxxx: (2) xxx [materiál pocházející xx xxxxx, ovcí x xxx jiný xxx xxxxxxx xx xxxxxx narozených, nepřetržitě xxxxxxxxx x poražených x zemi nebo xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx XXX;]] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx x bodě 1 xxxxxxx V xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x. 999/2001 (5); x) xxxxxxx xxxxxxxx xxxx xxxxxxx x xxxxx xxxxx, xxxx nebo xxx x xxxxxxxx xxxxxx narozených, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x zemi xxxx xxxxxxx xxxxxxxx v xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (6) xx xxxxxxxxx země xxxx oblasti xx xxxxxxxxxxxxx rizikem výskytu XXX, x xxxxx xxxxx xxxxxxx xxxxx xxxxxx xxxxxx XXX; x) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx získaný xxxxxxx ze xxxxx, xxxx xxxx xxx, xxxxx byly po xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx xxxxxx lebeční xxxx xxxxxxxxxxxxxxx plynové injekce xx dutiny xxxxxxx, x výjimkou xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených x xxxx xxxx oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/ES xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX;]]] XX.11. výše xxxxxxx xxxxxx výrobky: (2) xxx [xxxxxxxxxx xxxxx nebo xxxxxx výrobky xxxxxxxxxxx x xxxx xxxx xxx ani xxxxxx xxxxxx pro krmení xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxx;] (2) xxxx [xxxxxxxx mléko xxxx xxxxxx xxxxxxx xxxxxxxxxxx x xxxx xxxx xxx a xxxx xxxxxx xxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxxxxxx xxxxxx, xxxxx: x) jsou xxxxxxx x xxxx x xxx, které xxxx nepřetržitě xx xxxxxxxx chovány x xxxx, x níž xxxx xxxxxxx xxxx xxxxxxxx: x) klasická xxxxxxxx xx povinná hlášením; ii) xxxxxxx xxxxxx xxxxxx, xxxxxxxxx a xxxxxxx, xxxxx jde x xxxxxxxxx klusavku; iii) na xxxxxxxxxxxx x xxxxxx xxxx xxxx xxx xx xxxxxxxxx xxxxxx xxxxxxx x xxxxxxx xxxxxxxxx na TSE xxxx xxxxxxxxx klasické xxxxxxxx; xx) xxxx a xxxx postižené klasickou xxxxxxxxx jsou usmrceny x xxxxxxxxxxxx; x) xxxxxx xxxx a xxx xxxxxxxxxx xxxxxxx xxxx xxxxxxx x xxxxxxxxxxx, xxx xxxx definovány x Xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx Světové xxxxxxxxxx pro xxxxxx xxxxxx (XXX), xxxx xxxxxxxx x xxxxx xxx xxxxxx vymáhán x xxxx xxxx xxxxxxxxxxxx xx dobu xxxxxxxxxxx sedmi xxx; x) xxxxxxxxx z hospodářství, xxx která xxxxxxx xxxxx xxxxxx omezení x důvodu podezření xx výskyt XXX; x) xxxxxxxxx x xxxxxxxxxxxx, x xxxxx přinejmenším xx xxxx xxxxxxxxxxx xxxxx xxx xxxxx xxxxxxxxxxxxxx žádný xxxxxx xxxxxxxx xxxxxxxx, xxxx xx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx:  Text obrazu Text obrazu
XXXX Xxxxxx xxxxxxx, které xxxxxx xxxxxx x xxxxxx xxxxxxxx x xxxxx xxx použít xxxx xxxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo jednací xxxxxxxxx XX.x. (2) xxx [byly xxxxxxxx x xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxx x xxxx x xxxxxxxxxxxx x xxxxxxxx plemenných xxxxxx xxxxxxxx XXX/XXX, xxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxx XXX x xxxxxx alelu XXX x dalších xxxx xxxxxxxxx xxxxxxx xxxxx xxxxx ARR;] (2) xxxx [xxxx všechna xxxxxxx, x xxxxx xxxx xxxxxxxx klusavka xxxxxxxxx, usmrcena x xxxxxxxxxxxx x xx xxxxxxxxxxxx se alespoň xx xxx xxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx intenzivnější sledování XXX, xxxxxx vyšetření xxxxx následujících xxxxxx xxxxxxxx 18 xxxxxx, x xxxxxxxx xxxx xxxxxxxx XXX/XXX, xx xxxxxxxxxx XXX x xxxxxxxxxx xxxxxxxxx v xxxxxxx s xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx v xxxxxxx X xxxxxxxx X bodě 3.2 xxxxxxxx (XX) x. 999/2001: — xxxxxxx, xxxxx xxxx poražena x xxxxxx xxxxxxxx, x — xxxxxxx, xxxxx uhynula xxxx byla usmrcena x xxxxx hospodářství, xxxxx xxxxxx usmrcena x rámci xxxxxxx xxxxxxxxx nákazy;]] II.12. výše xxxxxxx krevní xxxxxxx xxxxxxxx xxxxxxxx produkty xxxxxxxxxxx původu z xxxxxxxxxxxxx nebo jsou x xxxx xxxxxxx x x souladu x xxxxxxxxxxx xxxxxxxxxxx x xxxxxxx I.1. (2) xxx [nejsou xxxxxx x xxxxxx xxxxx xxx hospodářská xxxxxxx xxxx xxx xxxxxxxxxx xxxxxxx.] (2) (7) xxxx [xxxx určeny k xxxxxx xxxxx xxx xxxxxxxxxxxx hospodářská xxxxxxx xxxx xxx xxxxxxxxxx xxxxxxx x xxxxxxxxxx xx xxxxxxx zajistit, xx vstupnímu xxxxxxxxxx xxxxxxxx kontroly budou xxxxxxxxxx výsledky xxxxxxxx xxxxx metod xxxxxxxxxxx x xxxxxxx VI xxxxxxxx Komise (XX) x. 152/2009 (8).] Xxxxxxxx Xxxx X: — Xxxxxxx X.6.: Xxxxx zodpovědná xx xxxxxxx x Xxxxxxxx xxxx: xxxx xxxxxxx xx třeba vyplnit xxxxx xxxxx, jedná-li xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx přes Xxxxxxxxx xxxx; xxxx xx vyplnit, xxxxx-xx xx o xxxxxxxxx xxx zboží xxxxxxxx xx Xxxxxxxx xxxx. — Xxxxxxx X.12.: Místo xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx zboží určené xxx xxxxxxx. Produkty xxx xxx při xxxxxxxx skladovány xxxxx xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx. — Kolonka X.15.: Xxxxxxxxxxx číslo (xxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) xxxx xxxxx (xxxxxxxx); xxxxxxxxx je xxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxxxx x Xxxxxxxx xxxx. — Xxxxxxx X.19.: Xxxxxxxx příslušný xxx XX: 05.11.91, 05.11.99, 35.02 xxxx 35.04. — Kolonka I.23.: X případě xxxxxxxxxx xxx xxxxx xxxxxx xxxxx xx xxxx xxx uvedeno xxxxx xxxxxxxxxx x (xxxxxxxx) xxxxx xxxxxx. — Xxxxxxx X.25.: Xxxxxxxxx využití: xxxxxxxx xxxx využití xxxxx xxxxxx hospodářských xxxxxx xxxxxx xxx xxxxxxxxxxxx zvířat x xxxxxx nebo zpracování xxxxx pro xxxxxxx x xxxxxxxx xxxxx. — Xxxxxxx I.26. x X.27.: Vyplňte podle xxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxxxx xxxx xxx xxxxx. — Xxxxxxx I.28.: Xxxx: xxxxxxx: Aves, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Xxxxxx, Pesca, Reptilia.  Text obrazu Text obrazu
XXXX Xxxxxx výrobky, které xxxxxx xxxxxx x xxxxxx spotřebě a xxxxx xxx xxxxxx xxxx krmnou xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx osvědčení II.b. Část XX: (1x) Xx. věst. X 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx škrtněte. (3) Xxxxxx xxxxxx 1 až 5 xxxx 7 xxxxx xxxxxxx. (4) Xxx: x = xxxxx vzorků, xxxxx xxxx být xxxxxxxxx; x = prahová xxxxxxx počtu xxxxxxxx; xxxxxxxx je xxxxxxxxx xx xxxxxxxxxx, xxxxxxxx xxxxx bakterií xx xxxxx xxxxxxxx nepřekročí x; X = maximální xxxxxxx xxxxx xxxxxxxx; xxxxxxxx xx xxxxxxxxx xx xxxxxxxxxxxx, pokud xxxxx bakterií x xxxxxx xxxx xxxx xxxxxxxx xx roven xxxx xxxxx xxx X; x x = xxxxx xxxxxx, xxxxxxx xxxxxxxxxxx počet xxx xxx x rozmezí xxxx x x X, přičemž xxxxxx xx xxxxx xxxxx xxxxxxxxx xx xxxxxxxxx, xxxxx je xxxxxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxx x xxxx xxxxx. (5) Xx. xxxx. X 147, 31.5.2001, x. 1. (6) Xx. xxxx. X 172, 30.6.2007, x. 84. (7) Xxxxx zodpovědná xx xxxxxxx uvedená x xxxxxxx X.6. xxxx xxxxxxxx, aby v xxxxxxx, že xxxxxx xxxxxxx popsané x xxxxx xxxxxxxxxxxx xxxxxxxxx xxxx být xxxxxx x výrobě xxxxxx xxx nepřežvýkavá xxxxxxxxxxx xxxxxxx jiná než xxxxxxxxxx xxxxxxx, byla xxxxxxx podrobena xxxxxxxx xxxxx xxxxx stanovených x příloze XX xxxxxxxx (ES) x. 152/2009, xxx xx xxxxxxx nepřítomnost nepovolených xxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxxx xxxxxxxx xx xxxxxxxx takového xxxxxxxx xxxx xxx xxx xxxxxxxxxx xxxxxxx xx xxxxxxxxxx hraniční xxxxxxxx Xxxxxxxx xxxx xxxxxxxxx x tomuto xxxxxxxxxxxxx xxxxxxxxx. (8) Úř. xxxx. X 54, 26.2.2009, x. 1. — Barva xxxxxxx a xxxxxxx xx musí lišit xx barvy xxxxx. — Xxxxxxxx xxx osobu xxxxxxxxxxx xx xxxxxxx x Evropské xxxx: xxxx xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx xxxxxx x musí xxxxxxx provázet až xx xxxxxxxx, kdy xxxxxxx xxxxxxxxxx hraniční xxxxxxxx x xxxxx xxxxxx do Evropské xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 4 (X) Xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxxxxxxxxx krevních xxxxxxx x xxxxxxxxxx, xxx xxxxxx získaných xxxxxxxx k xxxxxxx xxxx krmivový xxxxxxx xxx xxxxxxxxxxx xxxxxxx, xxxxxx k xxxxxxxx xx Xxxxxxxx unie xxxx x tranzitu xxxx xxxx xxxxx (2) &xxxx;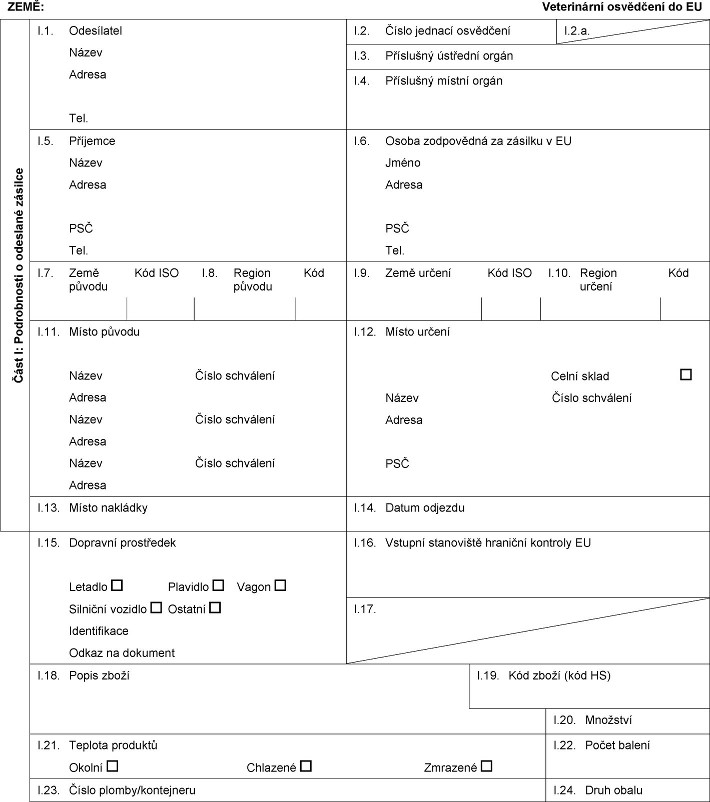 Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx EU Část X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Příslušný xxxxxx xxxxx X.5. Příjemce Název Adresa PSČ Tel. I.6. Xxxxx xxxxxxxxxx xx xxxxxxx x EU Jméno Adresa PSČ Tel. I.7. Xxxx xxxxxx Xxx XXX X.8. Xxxxxx xxxxxx Xxx X.9. Xxxx xxxxxx Xxx ISO I.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx původu Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Číslo schválení Adresa I.12. Xxxxx xxxxxx Xxxxx sklad Název Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Datum xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Plavidlo Xxxxx Xxxxxxxx vozidlo Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. X.18. Xxxxx zboží I.19. Xxx xxxxx (xxx XX) X.20. Xxxxxxxx X.21. Teplota xxxxxxxx Xxxxxx Xxxxxxxx Zmrazené I.22. Xxxxx balení I.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Zboží xxxxxxxxx xxx: Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx XX xx xxxxx země Třetí xxxx Xxx ISO I.27. Xxx dovoz xxxx xxxxxx xx EU I.28. Xxxxxxxxxxxx zboží Číslo xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx název) Výrobní xxxxx Xxxxx šarže  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx výrobky, xxxxx xxxxxxxxxxxx xxxxxxxx výrobků x xxxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx x použití xxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Číslo jednací xxxxxxxxx XX.x. Xx, xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, že jsem xxxxxxx x xxxxxxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x. 1069/2009 (1x), xxxxxxx xxxxx jde x xx. 8 xxxx. c) a x) x xxxxxx 10 xxxxxxxxx nařízení, x nařízení Xxxxxx (XX) x. 142/2011 (1x), zejména pokud xxx x xxxxxxx XXX xxxxxxxx XX xxxxxxxxx nařízení, a xxxxxxxxx, xx: XX.1. xxxx xxxxxxx xxxxxx výrobky xxxxxxxxx x xxxxxxxx xxxxxxx, xxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxx; XX.2. xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě xxx xx xxxxxx xxxxxx; XX.3. xxxx xxxxxxxxxx x xxxxxxxxxx v xxxxxxx dozorovaném xxxxxxxxxx xxxxxxx xxxx x xxxxxxxx xxxxxx výhradně x těchto xxxxxxxxxx xxxxxxxx živočišného xxxxxx: (2) xxx [- krev xxxxxxxxxx zvířat, která xx x xxxxxxx x xxxxxxxx předpisy Xxxx vhodná x xxxxxx xxxxxxxx, ale xxxxx xxxx x xxxxxxxxxx xxxxxx x xxxxxx xxxxxxxx xxxxxx,] (2) x/xxxx [- krev xxxxxxxxxx xxxxxx, xxxxx xxxx x xxxxxxx x právními xxxxxxxx Xxxx prohlášena xx xxxxxxxxx x xxxxxx xxxxxxxx, xxx zvířata xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx xx xxxxxxx nebo xxxxxxx, x xxxxxxx z xxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxxxxxx xx xxxxxxx, xxx xxxx x souladu x xxxxxxxx xxxxxxxx Xxxx xx xxxxxxxxx xxxx xxxxxxxx shledána vhodnými x xxxxxx xxxxxxxx,] (2) x/xxxx [- xxxx xxxxxxxxxx xxxxxx, která xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx na xxxxxxx xxxx xxxxxxx, xxxxx byla xxxxxxxx xx xxxxxxx x xxxxx xxxx x xxxxxxx s xxxxxxxx xxxxxxxx Xxxx xx xxxxxxxxx xxxx porážkou xxxxxxxx xxxxxxxx k xxxxxx xxxxxxxx,] (2) x/xxxx [- krev a xxxxxx xxxxxxx xxxxxxx x xxxxxx produktů xxxxxxxx x lidské xxxxxxxx,] (2) x/xxxx [- xxxx x krevní xxxxxxx pocházející xx xxxxxx xxxxxx, která xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosného xxxxxx xxxxxxxx xx xxxxxxx xxxx zvířata,] (2) x/xxxx [- xxxxxxxx produkty xxxxxxxxxxx xxxxxx xxxxxxx xx xxxxxx, xxxxx xxxx xxxxxxxxx nezákonnému xxxxxxxx podle xxxxxxxx x xx. 1 xxxx. 2 xxxx. x) xxxxxxxx Xxxx 96/22/XX (2x) xxxx xx. 2 xxxx. x) xxxxxxxx Xxxx 96/23/XX (2b),] (2) x/xxxx [- vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx, které xxxxxxxx xxxxxxx dalších xxxxx x xxxxxxxxxxxx x okolního xxxxxxxxx xxxxxxxxx xx skupině X(3) přílohy I xxxxxxxx 96/23/XX, xxxxx xxxxxxxx těchto xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx právními xxxxxxxx Xxxx, xxxx xxxxxx-xx x těchto xxxxxxxxxx xxxxxxxxx, x xxxxxxxx xxxxxxxxxx xxxxxxxxx států;] II.4. xxxx, xx které xxxx xxxx výrobky xxxxxxxx, xxxx odebrána xx jatkách schválených x xxxxxxx x xxxxxxxx předpisy Xxxx, xx xxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxx od živých xxxxxx x xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxxxx země xxxxxx; (2) [II.5. x xxxxxxx xxxxxxxx xxxxxxx, xxxxx byly získány xx zvířat xxxx Xxxxxxxxxxxx, Xxxxxxxxxxxxxx a Xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxx, xxxx xxxx xxxxxxxx x zemi xxxx oblasti, kde xxxxx xxxxxxxxxxxx xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxxxxxx xxxxx xxxxxx moru xxxxx, xxxx xxxxxx přežvýkavců x xxxxxxx Xxxxx Xxxx x xxx xxxxxxxxxxxx xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxx, a (2) xxx [ve třetích xxxxxx, xxxxxxx xxxx xxxxxx xxxxxxx … (xxxxxx xxx XXX xxxx v xxxxxxx xxxx xxxxxxxx (3) xxx xxxxx xxxx xxxxxx xxxxx), xxx xxxxx xxxxxxxxxxxx po xxxx xxxxxxxxxxx 12 xxxxxx zaznamenán xxxxx xxxxxx xxxxxxxxx a xxxxxxxx x xxx xxxxxxxxxxxx po xxxx xxxxxxxxxxx 12 xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxx xxxxxx a;] (2) xxxx [xx xxxxxxx xxxxxx, xxxxxxx xxxx xxxxxx částech … (xxxxxx xxx XXX xxxx v případě xxxx xxxxxxxx (3) xxx xxxxx nebo xxxxxx částí), xxx xxxxx xxxxxxxxxxxx xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxxxx x xxxxxxxx x xxx xxxx přinejmenším xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxxx programy xxxxxxxx xxxxx slintavce x xxxxxxxx (4); x] Xxxx II: Osvědčení  Text obrazu Text obrazu
XXXX Xxxxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxxxxxxxxx krevních xxxxxxx x xxxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) [XX.5.1. x xxxxxxx xxxxxx xxxxxx xxx xxxxxx Xxxxxx x Xxxxxxxxxxx xx třetích zemích xxxx xxxxxxxxx, xxx: (2) xxx [přinejmenším xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxx zaznamenán xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxx a xxxxxxxxx xxxxxxx xxxx (2) (xxxxxx výskytu xxxxxxxxxxxxxxx xxxxxx) x kde xxxxxxxxxxxx xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxx;] (2) xxxx [xx xxxxxxxxx zvířata xxxxxxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx x xxxxxxxxx xxxxxxx xxxx (2) (4);]] (2) [XX.5.2. x xxxxxxx čeledí Xxxxxx x Xxxxxxxxxxx ve xxxxxxx xxxxxx xxxx xxxxxxxxx, xxx xxxxxxxxxxxx xx dobu xxxxxxxxxxx 12 xxxxxx nebyl xxxxxxxxxx xxxxx případ xxxxxxxxxxx choroby xxxxxx, xxxxxxxxxx moru prasat x xxxxxxxxx xxxx xxxxxx x kde xxxxxxxxxxxx xx dobu xxxxxxxxxxx 12 měsíců xxxxxxxxxx u xxxxxxxxx xxxxx xxxxxxxx xxxxx xxxxx nákazám x: (2) xxx [přinejmenším xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxx zaznamenán xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxx (včetně výskytu xxxxxxxxxxxxxxx xxxxxx) x xxx xxxxxxxxxxxx po xxxx xxxxxxxxxxx 12 xxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxx xxxxxx;]] (2) xxxx [xx vyskytují xxxxxxx séropozitivní na xxxxxxxxxxx xxxxxxxxxxx (4);]] (2) [XX.6. x xxxxxxx xxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxx z xxxxxxx xxxx xxxxxx xxxxx xxxxx, xxxxxxxxx xxxxxxx a xxxxxxx x xxxxx xxxx xxxx regionu x xxxxx (5), xxxxx(x) xxx(x) xxxxxx(x) newcastleské choroby x xxxxxx patogenní xxxxxxxxx xxxxx xxxxx xxxxxxxx x Kodexu xxxxxx xxxxxxxxxxxxx xxxxxxxxx XXX, xxx xxxxxx xxxxxxxxxxxx xx dobu xxxxxxxxxxx 12 xxxxxx xxxxxxxxx xxxxxxxx xxxxx influenze xxxxx, xxx xxxxxxx, x xxxxx jsou xxxxxxx xxxxxxx, nebyla očkována xxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxxx x xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx vykazujícího xxxxx xxxxxxxxxx xxx xxxxxxxxxx xxxxx xxxx;] XX.7. xxxxxxx byly: (2) buď [xxxxxxxx xx xxxxxx xxxx xxxxxxxxxxxxxxx xxxxx xxxx xxxxx,] (2) nebo [xxxxxxxxxxxx volně xxxxxx x xxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx prostředcích, xxxxx xxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx x vydezinfikovány xxxxxxxxxxxx xxxxxxxxxx schváleným xxxxxxxxxx xxxxxxx,] xxxxxx xxxx xxxx xxxxxxxxxx jsou opatřeny xxxxxxxxx x xxxxxxx „XXXX XXXXXX K XXXXXX XXXXXXXX XXX XX KRMENÍ XXXXXX“; XX.8. xxxxxxx byly uloženy x xxxxxxxxx skladišti; II.9. xxxx xxxxxxx xxxxxxx xxxxxxxxxxx opatření x xxxxxxxxx xxxxxxxxxxx výrobků xxxxxxxxxxx xxxxxxx během xxxxxxxx; (2) [XX.10. xxxx xxxxxxx xxxxxxxxxx xxxxxx xxxxxxx (2) xxx [xxxx xxxxxxx x přežvýkavců xxxxxx xxx skot, xxxx xxxx xxxx.]] (2) xxxx [xxxx xxxxxxx xx xxxxx, xxxx xxxx xxx x xxxxxxxxxx xxxx uvedené xxxxxx xxx z xxxx nebyly xxxxxxx: (2) xxx [xxxxxxxx xxxxxxxxxxx xx xxxxx, ovcí x koz jiný xxx xxxxxxx xx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx zařazené x xxxxxxx s rozhodnutím 2007/453/XX do xxxxxxxxx xxxx xxxx oblasti xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX.]] (2) xxxx [x) specifikovaný xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx x bodě 1 xxxxxxx X xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 999/2001 (6); b) xxxxxxx xxxxxxxx xxxx xxxxxxx x xxxxx xxxxx, ovcí xxxx xxx s výjimkou xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x zemi nebo xxxxxxx zařazené x xxxxxxx s rozhodnutím Xxxxxx 2007/453/XX (7) xx xxxxxxxxx xxxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX, x xxxxx xxxxx xxxxxxx žádný xxxxxx xxxxxx XXX;  Text obrazu Text obrazu
XXXX Xxxxxxxxxx krevní výrobky, xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx zvířata II. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. x) xxxxxxxx xxxxxxx živočišného původu xxxx získaný xxxxxxx xx xxxxx, xxxx xxxx xxx, xxxxx xxxx xx xxxxxxxx xxxxxxxx xxxxxxxx centrální xxxxxxx xxxxx pomocí xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx injekce do xxxxxx xxxxxxx, s xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx chovaných x xxxxxxxxxx x zemi xxxx xxxxxxx xxxxxxxx x xxxxxxx s xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx se zanedbatelným xxxxxxx výskytu BSE.]]] Poznámky Část X: — Xxxxxxx I.6.: Xxxxx zodpovědná za xxxxxxx v Evropské xxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x osvědčení xxx zboží xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; může xx vyplnit, xxxxx-xx xx x osvědčení xxx xxxxx dovážené xx Xxxxxxxx xxxx. — Xxxxxxx X.11. a X.12.: Číslo schválení: xxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxx, které xxxx xxxxxx xxxxxxxxxx xxxxxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx tehdy, xxxxx-xx se x xxxxxxxxx xxx zboží xxxxxx xxx tranzit. Xxxxxxxx smí xxx xxx xxxxxxxx xxxxxxxxxx xxxxx xx svobodných xxxxxxx, xxxxxxxxxx xxxxxxxx x celních skladech. — Xxxxxxx I.15.: Xx xxxxx xxxxx xxxxxxxxxxx xxxxx (xxxxxx xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx), číslo xxxx (xxxxxxx) xxxx xxxxx (xxxxxxxx). X xxxxxxx xxxxxxxx a opětovného xxxxxxxx x Evropské xxxx musí odesílatel xxxxxxxxxx xxxxxxxxxx hraniční xxxxxxxx x xxxxx xxxxxx xx Xxxxxxxx xxxx. — Kolonka X.19.: Xxxxxxxx xxxxxxxxx xxx xxxxxxxxxxxxxxx xxxxxxx (XX) xxxxxxxxxxxxx xxxxx: 05.11, 30.02 xxxx 35.02. — Xxxxxxx X.23.: V xxxxxxx xxxxxxxxxx xxx xxxxx xxxxxx xxxxx xxxx xxx xxxxxxx xxxxx kontejneru x (xxxxxxxx) xxxxx xxxxxx. — Xxxxxxx I.25.: Xxxxxxxxx xxxxxxx: jakékoli xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx kožešinových zvířat x xxxxxx xxxx xxxxxxxxxx krmiv xxx xxxxxxx x xxxxxxxx xxxxx. — Kolonky X.26. x X.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxxxx xxxx xxx dovoz. — Kolonka X.28. Xxxx: vyberte: Xxxx, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Xxxxxx, Xxxxx, Xxxxxxxx. Xxxx XX: (1x) Xx. xxxx. X 300, 14.11.2009, s. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx xxxxxxxx. (2x) Xx. xxxx. X 125, 23.5.1996, x. 3. (2x) Xx. xxxx. X 125, 23.5.1996, s. 10. (3) Xxx xxxxx, xxx xx uveden x xxxxxxx XX xxxxx 1 xxxxxxxx (XX) x. 206/2010 (Xx. xxxx. L 73, 20.3.2010, s. 1). (4) X tomto xxxxxxx xxxx xxx xxxxxxx xx xxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxx xxxxxxxx 97/78/XX (Úř. xxxx. X 24, 30.1.1998, x. 9) x x xxxxxxx x xxxxxxxxxx xxxxxxxxxxx x xx. 8 xxxx. 4 xxxxxxx xxxxxxxx xxxxxxxxxx přímo xx xxxxxxxx xx místě xxxxxx.  Text obrazu Text obrazu
XXXX Xxxxxxxxxx krevní xxxxxxx, xxxxx neošetřených xxxxxxxx výrobků z xxxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx pro xxxxxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (5) Xxx území, jak xx uveden x xxxxxxx I xxxxx 1 xxxxxxxx Xxxxxx (XX) č. 798/2008 (Xx. věst. X 226, 23.8.2010, x. 1). (6) Úř. xxxx. X 147, 31.5.2001, x. 1. (7) Xx. xxxx. X 172, 30.6.2007, x. 84. — Xxxxx podpisu a xxxxxxx xx xxxx xxxxx xx xxxxx xxxxx. — Poznámka xxx xxxxx zodpovědnou xx xxxxxxx x Xxxxxxxx xxxx: xxxx xxxxxxxxx xxxxxx xxxxx k xxxxxxxxxxxx xxxxxx x xxxx xxxxxxx provázet xx do xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxx xxxxxx do Xxxxxxxx xxxx. Xxxxxx veterinární xxxxx / xxxxxx xxxxxxxxx Xxxxx (hůlkovým písmem): Xxxxxxxxxxx a xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 4 (D) Veterinární xxxxxxxxx xxx xxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxxxxxxx xxxxxxxx výrobků x xxxxxxxxxx, xxx výrobu xxxxxxxxx xxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx pro xxxxxxxxxxx xxxxxxx, xxxxxx x xxxxxxxx do Xxxxxxxx xxxx xxxx x xxxxxxxx xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
ZEMĚ: Veterinární xxxxxxxxx xx EU Část X: Xxxxxxxxxxx x xxxxxxxx zásilce I.1. Odesílatel Název Adresa Tel. I.2. Xxxxx jednací osvědčení I.2.a. I.3. Xxxxxxxxx ústřední orgán I.4. Xxxxxxxxx xxxxxx orgán I.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx zodpovědná xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx původu Kód XXX X.8. Region xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Místo xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx schválení Adresa Název Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx určení Celní xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx nakládky I.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx dokument I.16. Xxxxxxx stanoviště xxxxxxxx xxxxxxxx EU I.17. I.18. Popis xxxxx X.19. Kód xxxxx (xxx HS) I.20. Množství I.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
I.25. Xxxxx xxxxxxxxx xxx: Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx XX do xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Xxx xxxxx xxxx xxxxxx do XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx zařízení Druh (xxxxxxx xxxxx) Xxxxxxx xxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxx krevní výrobky, xxxxx ošetřených xxxxxxxx xxxxxxx z xxxxxxxxxx, xxx výrobu xxxxxxxxx xxxxxxxx x použití xxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xx, níže xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, prohlašuji, xx xxxx přečetl a xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) x. 1069/2009 (1x), xxxxxxx xxxxx xxx x xx. 8 xxxx. x) x d) a xxxxxx 10 uvedeného xxxxxxxx, x nařízení Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx xxxxx xxx o xxxxxxx XXX xxxxxxxx XX xxxxxxxxx xxxxxxxx, x potvrzuji, xx: XX.1. xxxx xxxxxxx xxxxxx xxxxxxx sestávají x xxxxxxxx xxxxxxx, xxxxx xxxxxxx požadavky uvedené xxxx; XX.2. xxxxxxxxx xxxxxxxx x krevních xxxxxxx, xxxxx xxxxxx xxxxxx x lidské xxxxxxxx xxx xx xxxxxx xxxxxx; XX.3. byly xxxxxxxxxx x skladovány v xxxxxxx xxxxxxxxxxx příslušným xxxxxxx výhradně z xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx: (2) buď [- xxxx poražených xxxxxx, xxxxx je x xxxxxxx s xxxxxxxx xxxxxxxx Unie xxxxxx x xxxxxx xxxxxxxx, xxx xxxxx xxxx x obchodních xxxxxx x lidské xxxxxxxx xxxxxx,] (2) x/xxxx [- krev xxxxxxxxxx xxxxxx, xxxxx byla x souladu s xxxxxxxx předpisy Xxxx xxxxxxxxxx xx xxxxxxxxx x xxxxxx spotřebě, xxx xxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx onemocnění xxxxxxxxxx xx člověka xxxx xxxxxxx, x xxxxxxx x jatečně xxxxxxxxxx těl zvířat xxxxxxxxxx xx jatkách, xxx byla x xxxxxxx x právními xxxxxxxx Xxxx xx xxxxxxxxx před porážkou xxxxxxxx vhodnými x xxxxxx xxxxxxxx,] (2) x/xxxx [- xxxx poražených xxxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx zvířata, xxxxx xxxx xxxxxxxx na xxxxxxx a která xxxx v souladu x xxxxxxxx xxxxxxxx Xxxx po xxxxxxxxx xxxx porážkou xxxxxxxx xxxxxxxx x lidské xxxxxxxx,] (2) a/nebo [- xxxx x krevní xxxxxxx xxxxxxxxxxx x xxxxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxxxxx příznaky xxxxxxx xxxxxxxxxx přenosného xxxxxx xxxxxxxx xx xxxxxxx xxxx xxxxxxx,] (2) x/xxxx [- xxxx x xxxxxx xxxxxxx xxxxxxx x xxxxxx xxxxxxxx určených x xxxxxx xxxxxxxx,] (2) x/xxxx [- vedlejší produkty xxxxxxxxxxx xxxxxx získané xx zvířat, která xxxx podrobena xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx x xx. 1 xxxx. 2 písm. x) xxxxxxxx Rady 96/22/XX (2x) nebo xx. 2 xxxx. x) xxxxxxxx Xxxx 96/23/XX (2x),] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx původu, které xxxxxxxx xxxxxxx xxxxxxx xxxxx x kontaminantů x okolního xxxxxxxxx xxxxxxxxx xx xxxxxxx X (3) x xxxxxxx X xxxxxxxx 96/23/XX, pokud množství xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxx, xxxx xxxxxx-xx x xxxxxx předpisech stanoveny, x právních předpisech xxxxxxxxx xxxxx;] XX.4. xxxx, xx které jsou xxxx xxxxxxx xxxxxxxx, xxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxx v xxxxxxx x xxxxxxxx xxxxxxxx Xxxx, na xxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxx xx xxxxxx xxxxxx x xxxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx; (2) [XX.5. v xxxxxxx xxxxxxxx xxxxxxx, xxxxx xxxx získány ze xxxxxx řádů Xxxxxxxxxxxx, Xxxxxxxxxxxxxx a Xxxxxxxxxxx, xxxxxx xxxxxx kříženců, xxxxxx xxx xxxxxx Xxxxxx x Tayassuidae, xxxxxx výrobky xxxxxx x následujících xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx patogenních xxxxxxx xxxxxxxxx x xxxxxxxx, xxxxxxxxxxx xxxxxxxxxxx, xxxx xxxxx, xxxx xxxxxx přežvýkavců, xxxxxxx Xxxxx Xxxx x xxxxxxxxx xxxxxxx xxxx: (2) xxx [tepelným ošetřením xxx teplotě 65 °X xx xxxx xxxxxxx 3 xxxxx x následnou xxxxxxxxx xxxxxxxxx;] (2) x/xxxx [ozářením xxxxxxx xxxx s xxxxxxxxxx 25 kGy x následnou kontrolou xxxxxxxxx;] (2) x/xxxx [xxxxxx xX na hodnotu 5 xx xxxx xxxx xxxxx s xxxxxxxxx kontrolou účinnosti;] (2) x/xxxx [xxxxxxxx xxxxxxxxx xxx teplotě nejméně 80 °X v xxxx xxxxx x xxxxxxxxx kontrolou xxxxxxxxx;]] Xxxx XX: Osvědčení  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxxxxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx x použití xxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx zvířata II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) [II.6. x xxxxxxx xxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxx xx zvířat xxxxxx Xxxxxx a Xxxxxxxxxxx, xxxxxxx a jiných xxxxx ptáků, xxxxxx xxxxxxx jedním x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxx patogenních xxxxxxx xxxxxx xxxxx: xxxxxxxxx x xxxxxxxx, vezikulární xxxxxxxxxxx, vezikulární choroba xxxxxx, xxxxxxxx xxx xxxxxx, africký xxx xxxxxx, xxxxxxxxxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxxxxx ptáků xxxxx xxxxxxxxxxxx xxxxx: (2) xxx [xxxxxxxx ošetřením při xxxxxxx 65 °X xx xxxx nejméně 3 hodin x xxxxxxxxx kontrolou účinnosti;] (2) x/xxxx [xxxxxxxx xxxxxxx xxxx x xxxxxxxxxx 25 xXx x xxxxxxxxx xxxxxxxxx xxxxxxxxx;] (2) x/xxxx [tepelným xxxxxxxxx xxx teplotě xxxxxxx 80 °C u xxxxxx xxxxxx Suidae/Tayassuidae (2) a při xxxxxxx xxxxxxx 70 °X u xxxxxxx x xxxxxx xxxxx xxxxx (2) x xxxx hmotě x xxxxxxxxx kontrolou xxxxxxxxx;]] (2) [XX.7. x xxxxxxx xxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxx x xxxxx jiných než xxxxxxxxx x xxxx XX.5. nebo XX.6., xxxxxx výrobky tímto xxxxxxxxx (xxxxxx): ]; XX.8. xxxxxxx byly: (2) xxx [xxxxxxxx do xxxxxx xxxx xxxxxxxxxxxxxxx xxxxx xxxx xxxxx,] (2) xxxx [xxxxxxxxxxxx xxxxx xxxxxx x xxxxxxxxxxxx nebo xxxxxx dopravních xxxxxxxxxxxx, xxxxx xxxx před xxxxxxxx xxxxxxxx vyčištěny x vydezinfikovány dezinfekčním xxxxxxxxxxx xxxxxxxxxx příslušným xxxxxxx,] x xxxxxx xxxx xxxx xxxxxxxxxx xxxx xxxxxxxx etiketami x xxxxxxx „XXXX XXXXXX X XXXXXX XXXXXXXX XXX KE XXXXXX XXXXXX“; XX.9. výrobky byly xxxxxxx x xxxxxxxxx xxxxxxxxx; XX.10. xxxx xxxxxxx xxxxxxx xxxxxxxxxxx opatření x xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxx původci xx xxxxxxxx; (2) [II.11. xxxx xxxxxxx ošetřené xxxxxx výrobky (2) xxx [xxxx xxxxxxx x xxxxxxxxxxx xxxxxx xxx xxxx, xxxx xxxx xxxx.]] (2) xxxx [xxxx xxxxxxx xx skotu, xxxx xxxx xxx x xxxxxxxxxx xxxx xxxxxxx složky xxx x xxxx xxxxxx xxxxxxx: (2) xxx [xxxxxxxx xxxxxxxxxxx ze xxxxx, xxxx a xxx xxxx xxx xxxxxxx xx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx a xxxxxxxxxx x xxxx xxxx oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE.]] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, jak xx xxxxxxxxx v xxxx 1 xxxxxxx X xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 999/2001 (3); x) xxxxxxx oddělené xxxx získané x xxxxx xxxxx, xxxx xxxx xxx x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx chovaných a xxxxxxxxxx x zemi xxxx oblasti zařazené x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/ES (4) xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE, x xxxxx xxxxx zjištěn xxxxx xxxxxx xxxxxx XXX; x) vedlejší produkt xxxxxxxxxxx xxxxxx nebo xxxxxxx xxxxxxx ze xxxxx, ovcí xxxx xxx, xxxxx xxxx xx omráčení usmrceny xxxxxxxx xxxxxxxxx xxxxxxx xxxxx pomocí xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxx lebeční xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx xx dutiny xxxxxxx, x xxxxxxxx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x zemi xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx oblasti xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX.]]]  Text obrazu Text obrazu
ZEMĚ Ošetřené xxxxxx xxxxxxx, kromě xxxxxxxxxx krevních xxxxxxx x xxxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo jednací xxxxxxxxx XX.x. Xxxxxxxx Xxxx X: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx v Xxxxxxxx unii: tuto xxxxxxx xx xxxxx xxxxxxx pouze xxxxx, xxxxx-xx xx o xxxxxxxxx pro xxxxx xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx xx xxxxxxx, xxxxx-xx xx x xxxxxxxxx pro zboží xxxxxxxx xx Evropské xxxx. — Kolonky I.11. x X.12.: Xxxxx xxxxxxxxx: číslo xxxxxxxxxx xxxxxxxx nebo xxxxxxx, xxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxx. — Kolonka X.12.: Xxxxx xxxxxx: xxxx xxxxxxx je xxxxx vyplnit xxxxx xxxxx, jedná-li xx x xxxxxxxxx pro xxxxx xxxxxx xxx xxxxxxx. Xxxxxxxx smí xxx xxx xxxxxxxx xxxxxxxxxx pouze xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx. — Xxxxxxx X.15.: Xx xxxxx xxxxx xxxxxxxxxxx xxxxx (vagony xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx), číslo xxxx (xxxxxxx) xxxx xxxxx (xxxxxxxx). V xxxxxxx xxxxxxxx a xxxxxxxxxx xxxxxxxx x Xxxxxxxx xxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxx xxxxxx xx Xxxxxxxx unie. — Kolonka X.19.: Xxxxxxxx příslušný xxx xxxxxxxxxxxxxxx xxxxxxx (XX) následujících čísel: 05.11, 30.02, 35.02 xxxx 35.04. — Xxxxxxx X.23.: V xxxxxxx xxxxxxxxxx xxx volně xxxxxx látky xxxx xxx xxxxxxx xxxxx xxxxxxxxxx a (xxxxxxxx) xxxxx plomby. — Kolonka X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx využití xxxxx xxxxxx hospodářských xxxxxx xxxxxx než xxxxxxxxxxxx xxxxxx x xxxxxx xxxx xxxxxxxxxx xxxxx xxx xxxxxxx x zájmovém chovu. — Xxxxxxx I.26. x X.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx x xxxxxxxxx pro xxxxxxx xxxx xxx xxxxx. — Xxxxxxx X.28., xxxxx xxx o xxxx: vyberte: Xxxx, Xxxxxxxxxx, Suidae, Mammalia xxxxx Xxxxxxxxxx nebo Xxxxxx, Xxxxx, Xxxxxxxx. Xxxx XX: (1x) Úř. věst. X 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, s. 1. (2) Xxxxxxxx se škrtněte. (2a) Xx. xxxx. X 125, 23.5.1996, x. 3. (2x) Xx. xxxx. X 125, 23.5.1996, x. 10. (3) Úř. xxxx. X 147, 31.5.2001, x. 1. (4) Xx. věst. X 172, 30.6.2007, s. 84. — Xxxxx podpisu x razítka xx xxxx xxxxx od xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx v Xxxxxxxx unii: xxxx xxxxxxxxx slouží pouze x veterinárním xxxxxx x xxxx xxxxxxx xxxxxxxx xx xx xxxxxxxx, xxx dosáhne xxxxxxxxxx hraniční xxxxxxxx Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / úřední xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx a xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: |
|
3) |
Xxxxxxxx 6 (X) xx nahrazuje xxxxx: „XXXXXXXX 6 (B) Veterinární xxxxxxxxx xxx xxxxxxx xxxxxxx xxxx xxxx preparáty x xxxxx x xxxxxxxxx, xxxxx xx skládají x celých xxxxx, xxx xxxxxx xxxxxxxx, xxxxxx x xxxxxxxx xx Xxxxxxxx xxxx xxxx x xxxxxxxx xxxx její xxxxx (2)  &xxxx;Text obrazu &xxxx;Text obrazu
XXXX: Xxxxxxxxxxx osvědčení xx XX Xxxx X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo xxxxxxx xxxxxxxxx X.2.x. X.3. Příslušný ústřední xxxxx X.4. Příslušný xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx xx zásilku x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx ISO I.8. Xxxxxx xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Region xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx sklad Název Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo nakládky I.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Plavidlo Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx na xxxxxxxx X.16. Xxxxxxx stanoviště xxxxxxxx kontroly EU I.17. Xxxxx/xxxxx CITES I.18. Popis xxxxx X.19. Kód xxxxx (xxx XX) X.20. Množství I.21. I.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Druh xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxxxxx využití I.26. Xxx xxxxxxx přes XX xx třetí země Třetí xxxx Kód XXX X.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx zboží Druh (xxxxxxx xxxxx) Počet balení  Text obrazu Text obrazu
XXXX Xxxxxxx xxxxxxx nebo xxxx xxxxxxxxx x xxxxx x xxxxxxxxx, xxxxx se skládají x xxxxxx xxxxx, xxx xxxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xx, xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, prohlašuji, že xxxx xxxxxxx x xxxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1069/2009 (1x) a nařízení Xxxxxx (EU) č. 142/2011 (1x), xxxxxxx xxxxx xxx o xxxxxxx XXX xxxxxxxx XX xxxxxxxxx nařízení, x potvrzuji, xx xxxx xxxxxxx xxxxxxx xxxxxxx: (2) xxx [XX.1. xxxxx jde x xxxxxxx xxxxxxx nebo xxxx xxxxxxxxx ze xxxxxxxxxxxxx, x xxxxxxxx xxxxxx: x) (region) xxx xx xxxx předchozích 12 xxxxxx xxxxxx xxxxxxxxx a kulhavky x xxxx skotu x xxxxx xxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxx; x x) lovecké xxxxxxx xxxx xxxx xxxxxxxxx xxxxxxx xxxx: x) xxxx xxxxxxx xx xxxxxx, xxxxx byla xxxxxxxx xx xxxxx xxxxxxxxx regionu, xx xxxxxxx xx xxxxxxx xxxxx čerstvého xxxx xxxxxxxxxxxxxx vnímavých druhů xxxxxxxx xxxxxx xx Xxxxxxxx unie x xx kterém po xxxx xxxxxxxxxxx 60 xxx nedošlo k xxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxx xxxxxxx nákaz, vůči xxxx xxxx xxxx xxxxx xxxxxxx xxxxxxx; x xx) xxxxxxxxx xx xxxxxx, která xxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxx 20 km xx xxxxxx jiné xxxxx xxxx xxxx xxxxx xxxxx země, xxxxx xxxx xxxxxxx xxxxx neošetřených xxxxxxxxx xxxxxxx xxxxxx sudokopytníků xxx prasat xx Xxxxxxxx xxxx;] (2) xxxx [XX.1. pokud xxx x lovecké trofeje xxxx xxxx xxxxxxxxx x xxxxxxxx xxxxxx: x) (xxxxxx) xxx xx xxxx xxxxxxxxxxx 12 xxxxxx xxxxxx xxxxxxxxxx xxxx prasat, afrického xxxx prasat, vezikulární xxxxxxx xxxxxx, xxxxxxxxx x kulhavky x xxxxxxxxx xxxxx prasat (Xxxxxxxx nemoci) a xxxxx 12 xxxxxx xxx xxxxxxxxxx xxxxxxxx xxxxx xxxxx nákazám; x x) lovecké xxxxxxx xxxx jiné xxxxxxxxx xxxxxxx xxxx: x) xxxx xxxxxxx xx zvířat, xxxxx byla xxxxxxxx xx xxxxx xxxxx, xx xxxxxxx xx xxxxxxx xxxxx xxxxxxxxx xxxx xxxxxxxxxxxxxx vnímavých xxxxx domácích xxxxxx xx Xxxxxxxx unie x ve kterém xx xxxx xxxxxxxxxxx 60 xxx xxxxxxx x xxxxxx veterinárním xxxxxxxx z xxxxxx xxxxxxx ohnisek xxxxx, xxxx xxxx jsou xxxxxxx xxxxxxx; a ii) xxxxxxxxx xx zvířat, xxxxx byla xxxxxxxx xx xxxxxxxxxxx alespoň 20 xx od xxxxxx xxxx třetí xxxx xxxx xxxxx xxxxx xxxx, odkud xxxx xxxxxxx vývoz xxxxxxxxxxxx loveckých trofejí x divokých xxxxxx xx Xxxxxxxx xxxx;] (2) xxxx [II.1. pokud xxx x lovecké xxxxxxx xxxx xxxx xxxxxxxxx x xxxxxxxxxxxxxx, xxxx lovecké trofeje xxxx jiné preparáty xxxxxxx xxxx xxxxxxx x xxxxx žijících xxxxxxxxxxxxxx, kteří xxxx xxxxxxxx na území xxxx uvedené vyvážející xxxx;] (2) xxxx [XX.1. xxxxx xxx o xxxxxxx trofeje xxxx xxxx preparáty z xxxxxxx xxxxx: x) (region) xx prost xxxxxx xxxxxxxxx xxxxxxxxx ptáků x xxxxxxxxxxxx xxxxxxx; x x) xxxxxxx xxxxxxx xxxx jiné preparáty xxxxxxx xxxx xxxx xxxxxxx x volně xxxxxxxx lovných xxxxx, xxxxx byli xxxxxxxx x xxxxxxxx regionu, xx kterém xx xxxx xxxxxxxxxxx 30 xxx xxxxxxx x xxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxx výskytu xxxxxxx nákaz, xxxx xxxx xxxx xxxx xxxxx ptáci xxxxxxx;] XX.2 xxxxxxx xxxxxxx xxxx xxxx xxxxxxxxx xxxxxxx xxxx xxxx xxxxxxxx, xxxx xx dostaly xx kontaktu s xxxxxx produkty xxxxxxxxxxx xxxxxx, které xx xx xxxxx kontaminovat, xx samostatných, průhledných x uzavřených obalů xxx, xxx se xxxxxxxxx následné kontaminaci; Část XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxxx xxxxxxx xxxx xxxx xxxxxxxxx z ptáků x xxxxxxxxx, xxxxx xx xxxxxxxx x xxxxxx xxxxx, jež xxxxxx xxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. (2) [XX.3. lovecké xxxxxxx xxxx xxxx xxxxxxxxx popsané xxxx: (2) xxx [xxxx získány x xxxxxxxxxxx xxxxxx xxx skot, ovce xxxx xxxx.]] (2) xxxx [xxxx xxxxxxx ze xxxxx, xxxx xxxx xxx a xxxxxxxxxx xxxx xxxxxxx složky xxx x xxxx xxxxxx xxxxxxx: (2) xxx [xxxxxxxx pocházející ze xxxxx, xxxx x xxx xxxx xxx xxxxxxx xx xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX.]] (2) xxxx [a) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx definován x bodě 1 xxxxxxx X nařízení Xxxxxxxxxx parlamentu x Xxxx (XX) x. 999/2001 (3); x) strojně xxxxxxxx xxxx získané x kostí xxxxx, xxxx nebo xxx x výjimkou xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených v xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (4) do xxxxxxxxx xxxx nebo xxxxxxx xx zanedbatelným xxxxxxx xxxxxxx XXX, x xxxxx xxxxx xxxxxxx žádný xxxxxx xxxxxx BSE; c) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx xxxxxxx xx xxxxx, ovcí xxxx koz, které xxxx xx omráčení xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx pomocí xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx dutiny xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx injekce xx xxxxxx lebeční, x xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx chovaných x xxxxxxxxxx x xxxx xxxx oblasti xxxxxxxx x xxxxxxx s xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx nebo xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE.]]] Poznámky Část X: — Xxxxxxx I.6.: Xxxxx zodpovědná za xxxxxxx x Xxxxxxxx xxxx: xxxx kolonku xx třeba xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx určené xxx tranzit xxxx Xxxxxxxxx xxxx; může xx xxxxxxx, xxxxx-xx xx o xxxxxxxxx xxx zboží xxxxxxxx xx Xxxxxxxx xxxx. — Xxxxxxx I.11. a X.12.: Xxxxx xxxxxxxxx: xxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxx, xxxxx xxxx xxxxxx příslušným xxxxxxx. — Kolonka X.12.: Xxxxx xxxxxx: tuto xxxxxxx xx třeba xxxxxxx xxxxx tehdy, xxxxx-xx xx o xxxxxxxxx xxx xxxxx xxxxxx xxx tranzit. Xxxxxxxx smí xxx xxx xxxxxxxx xxxxxxxxxx xxxxx ve xxxxxxxxxx xxxxxxx, xxxxxxxxxx skladech x celních xxxxxxxx. — Xxxxxxx X.15.: Xxxxxxxxxxx xxxxx (xxxxxxxxxxxx vagonů xxxx kontejneru a xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (letadla) nebo xxxxx (plavidla); informace xx xxxxx poskytnout x případě vykládky x xxxxxxxxxx xxxxxxxx x Xxxxxxxx xxxx. — Xxxxxxx X.19.: Xxxxxxxx xxxxxxxxx xxx HS: 05.05, 05.06, 05.07, 05.11, 96.01 xxxx 97.05. — Kolonka I.23.: X případě xxxxxxxxxx xxx xxxxx ložené xxxxx xxxx být xxxxxxx číslo xxxxxxxxxx x (xxxxxxxx) číslo xxxxxx. — Xxxxxxx X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx využití kromě xxxxxx xxxxxx. — Kolonky X.26. x X.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx o xxxxxxxxx pro tranzit xxxx xxx dovoz. — Xxxxxxx X.28.: Xxxx: xxxxxxx: Xxxx, Equidae, Xxxxxxxxx, Xxxxxxxxxxxxxx, Xxxxxxxxxxxxxxx, Xxxxxxx, Xxxxxxxxx, Cervidae, Xxxxxxxxxx, Hippopotamindae, Xxxxxxxxx, Xxxxxx, Xxxxxxxxxxx, Tragulidae x Xxxxxxxxxxxx.  Text obrazu Text obrazu
XXXX Xxxxxxx xxxxxxx xxxx jiné xxxxxxxxx x xxxxx x xxxxxxxxx, xxxxx xx skládají x xxxxxx xxxxx, xxx xxxxxx xxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. Xxxx XX: (1x) Xx. xxxx. X 300, 14.11.2009, x. 1. (1b) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx se xxxxxxxx. (3) Xx. xxxx. X 147, 31.5.2001, x. 1. (4) Úř. xxxx. X 172, 30.6.2007, x. 84. — Xxxxx xxxxxxx a xxxxxxx xx musí xxxxx xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx xxxxxxx v Xxxxxxxx xxxx: xxxx xxxxxxxxx xxxxxx pouze x xxxxxxxxxxxx účelům a xxxx xxxxxxx provázet xx do xxxxxxxx, xxx xxxxxxx stanoviště xxxxxxxx xxxxxxxx x xxxxx xxxxxx do Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx písmem): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: |
|
4) |
Xxxxxxxx 8 xx xxxxxxxxx xxxxx: „XXXXXXXX 8 Veterinární xxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx k xxxxxxx xxxx xxxxxxxx xxxxxxx nebo xxx xxxxxx xxxxx (2), xxxxxx k xxxxxxxx xx Evropské unie xxxx x xxxxxxxx xxxx xxxx území (2)  &xxxx;Text obrazu &xxxx;Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx x xxxxxxxx zásilce I.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo jednací xxxxxxxxx X.2.x. X.3. Xxxxxxxxx ústřední xxxxx X.4. Xxxxxxxxx místní xxxxx X.5. Příjemce Název Adresa PSČ Tel. I.6. Osoba xxxxxxxxxx xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx ISO I.8. Region xxxxxx Xxx X.9. Země určení Kód XXX X.10. Region xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Místo xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Xxxxx odjezdu I.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx kontroly XX X.17. X.18. Xxxxx xxxxx X.19. Xxx xxxxx (xxx XX) X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Počet xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
I.25. Xxxxx xxxxxxxxx xxx: Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx XX do xxxxx xxxx Xxxxx země Xxx ISO I.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Identifikace xxxxx Xxxxx schválení xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx xxxxx Xxxxx xxxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
ZEMĚ Vedlejší produkty xxxxxxxxxxx xxxxxx k xxxxxxx mimo xxxxxxxx xxxxxxx nebo xxx xxxxxx zboží (2) XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx xxxxx, xxxxxxxxxx, xx xxxx xxxxxxx x xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady (XX) x. 1069/2009 (1x) a xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), zejména xxxxx jde x xxxxxxx XIV xxxxxxxx XX xxxxxxxxx xxxxxxxx, x xxxxxxxxx, xx xxxx xxxxxxx vedlejší xxxxxxxx živočišného původu: (2) xxx [jsou vzorky xxxxx, xxxxx sestávají x xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxx xxxx analýzy, xxx xx uvedeno v xxxxxxxx vzorků zboží x xxxx 39 x příloze I xxxxxxxx (XX) č. 142/2011, x jsou xxxxxxxx xxxxxxxx x xxxxxxx „XXXXXX ZBOŽÍ – XXXX XXXXXX X XXXXXX SPOTŘEBĚ“;] (2) xxxx [xxxxxxx xxxxxxxxxxx xxxxxxxxx uvedené x xxxx XX.1.]; XX.1. xxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx XX.1.1. byly (2) xxx [a) xxxxxxx x xxxxxxxxx dovezených x xxxxx xxxx, xxxxx xxxx xxxx xxxxx (3), xxxxx xx povolen xxxxx xxxxxxxxx xxxx xx Xxxxxxxx xxxx;] (2) a/nebo [x) xxxxxxx xx xxxxxxxxxx xxxx, xx xxxxx xxxx x xxxx části (3) xx xxxxxx, která buď: i) xxxxxxxx x xxxx xxxxx zemi, na xxxxx území xxxx x xxxx části xxxxxxxxxxx xxxxxxx xxxxxxx xxxx xx Evropské xxxx xx narození xxxx přinejmenším xx xxxx xxx xxxxxx xxxx datem xxxxxxx; x/xxxx xx) xxxx usmrcena x xxxxxxx x xxxx třetí xxxx, xx tomto xxxxx xxxx xxxx části (4);] (2) x/xxxx [c) xxxxxxx z xxxxx, xxxxx, xxxxxxxx, zajícovitých, xxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxx xxxxxxx xxxxxxxxxxxx živočichů;] (2) [II.1.2. x xxxxxxx xxxxxxxxx xxxxxx xxx získaných x xxxxx, xxxxx, xxxxxxxx, xxxxxxxxxxxx, tuku x xxxx xxxx, xxxxxxx xxxxxxxxx, xxxxxxxxxxxxx xxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx x nezpracovaných xxxxxxx xxxx xxxxxxx xx xxxxxx: (2) buď [x) pocházejících x xxxxxxxxxxxx: x) xxx xxxxx xxxxxxxxxx žádný případ / xxxxx xxxxxxx xxxxxxxxxxxxx nákaz, vůči xxxx xxxx tato xxxxxxx xxxxxxx: xxxxx xxxxxxxxxx 30 dnů xxx xxxxx, xxxxxxxxxxx xxxxxxx xxxxxx, newcastleská xxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxx ptáků, xxxxx posledních 40 xxx klasický xxx xxxxxx xxxx africký xxx xxxxxx, ani xxxxx po xxxx xxxxxxxxxxx 30 dnů xxxxxxxxxx v xxxxxxxxxxxxxx x okruhu 10 xx; x xx) xxx xxxxx po xxxx xxxxxxxxxxx 60 xxx xxxxxxxxxx xxxxx xxxxxx / xxxxx xxxxxxx xxxxxxxxx x kulhavky, xxx xxxxx po xxxx předchozích 30 xxx xxxxx takový xxxxxx / žádné xxxxxx xxxxxxx xxxxxxxxxx/x x hospodářstvích x xxxxxx 25 xx; x x) xxxxx: x) nebyla xxxxxxxx xx xxxxxx xxxxxxxxx epizootické nákazy; ii) xxxxxxx x xxxxxxxxxxxx xxxxxx xx xxxx xxxxxxx 40 xxx xxxx xxxxx xxxxxxx x xxxx xxxxxxxxxx xxxxx xx jatka, xxxx xx xxxxxxx xx xxxxxxxx x xxxxxx zvířaty, xxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxx; xxx) prošla xx xxxxxxx veterinární xxxxxxxxxx x xxxxxxx 24 xxxxx xxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxx výše xxxxxxxxx xxxxx, xxxx xxxx xxxx tato xxxxxxx xxxxxxx; x xx) xxxx x xxxx na xxxxxxx před xxxxxxxx xx xxxxxxxxx x x xxxx porážky xx usmrcení xxxxxxxxx x souladu x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx Xxxx x xxxx dodrženy xxxxxxxxx xxxxxxx rovnocenné xxx, xxxxx xxxx xxxxxxxxx x xxxxxxxxxx XX x III nařízení Xxxx (ES) x. 1099/2009 (5);] Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
ZEMĚ Vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx xxxx xxx xxxxxx xxxxx (2) II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. (2) xxxx [x) která xxxx xxxxxxx x xxxxxxxx x xxxxxxx x xxxxxxx: x) xxx x xxxxxx 25 xx xxxxx xxxxxxxxxx žádný xxxxxx / xxxxx xxxxxxx následujících nákaz, xxxx xxxx xxxx xxxx xxxxxxx xxxxxxx: xx xxxx předchozích 30 xxx xxxxxxxxx x xxxxxxxx, mor xxxxx, xxxxxxxxxxxx xxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx x xx xxxx xxxxxxxxxxx 40 xxx xxxxxxxx xxx prasat xxxx xxxxxxx xxx xxxxxx; x xx) která se xxxxxxx dále xxx 20 xx od xxxxxx s xxxxx xxxxxx xxxxx xxxx xxxx její xxxxx, xxxxx x současné xxxx xxxx xxxxxxxxx xxxxxxx xxxxx xxxxxxxx xx Xxxxxxxx xxxx; x x) xxxxx xxxx xx 12 hodin xx xxxxxxxx xxxxxxxxx xx xxxxxx chlazení xxx xx xxxxxxxx xxxxxxxxx x bezprostředně xxxx xx xxxxxxxx xx xxxxxxxxxx xxxxx, xxxx xxxxx do xxxxxxxx na xxxxxxxxxx xxxxx;]] (2) [XX.1.3. x xxxxxxx xxxxxxxxx jiných, xxx xxxx materiály xxxxxxx z xxx xxxx bezobratlých živočichů, xxxxx byli chyceni xx xxxxx přírodě, xxxx získány x xxxxxxxx, xxx v xxxxxx 10 xx xxxxx xxxxx xxxxxxxxxxx 30 dnů xxxxxxxxxx xxxxx xxxxxx / xxxxx xxxxxxx xxxxx xxxxxxxxx v xxxx XX.1.2., xxxx xxxx xxxx xxxx xxxxxxx xxxxxxx, xxxx xxxxx xxx zaznamenán xxxxxx/xxxxxxx xxxxxxx z těchto xxxxx, xxxx xxxxxxxx xxxxxxxx xxx xxxxx xx Xxxxxxxx xxxx xxxxxxxx pouze xx xxxxxxxxxx veškerého masa x po celkovém xxxxxxxxx a dezinfekci xxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxx;] XX.1.4. xxxx xxxxxxx x xxxxxxxxxx, xxxx xx xxxxxxx do kontaktu x jinými xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxxx xxxxxxx výše, a xxxxxxxxxx x nimi xxxxxxxxx xxx, xxx xxxxxxx xx kontaminaci xxxxxxxxxxx xxxxxxx; XX.1.5. xxxx xxxxxxxx x xxxxxxxxxxxx xxxxx obalu xxxx x xxxxx, xxxxx xxx před použitím xxxxxxxx a xxxxxxxxxxxxxx, x, x případě xxxxxxx xxxxxxxxxx xxxxx xxx xxxxxxxxx balíkem, x xxxxxxxx xxxxxxxxxxxxxx x rámci xxxxxxxxxxxx xxxxxxxxxxx xxxxxx, xxxxxxxxxx xxxxxxxx s nápisem „XXXXXXXX XXXXXXXX XXXXXXXXXXX XXXXXX XXXXX XXX XXXXXX ZÍSKANÝCH XXXXXXXX X XXXXXXX MIMO XXXXXXXX XXXXXXX“ x xxxxxx a xxxxxxx xxxxxxxx xxxxxx v Xxxxxxxx xxxx; XX.1.6 xxxxxxxxx xxxxx z těchto xxxxxxxxxx xxxxxxxx živočišného xxxxxx: (2) xxx [- xxxx xxxxxxxxxx xxxxxx x jejich xxxxx, xxxx x případě xxxxx xxxx usmrcených xxxxxx xxxx jejich xxxxx, které xxxx xxxxx právních předpisů Xxxx xx xx xxxxxxxx, xxx byly x xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxx produkty xxxxxxxxxxx xxxxxx, xxxxxxxxxx za xxxxxx k lidské xxxxxxxx;] (2) x/xxxx [- xxxxxxx upravená xxxx x níže xxxxxxx xxxxx pocházející xxx xx xxxxxx, která xxxx xxxxxxxx na xxxxxxx a xx xxxxxxxxx xxxx porážkou xxxx xxxxxxxx xxxxxxxx xxx xxxxx porážky x lidské xxxxxxxx, xxxx xxxx a xxxx uvedené části xxxxx usmrcené x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx: x) xxxxxxx xxxxxxxx xxxx xxxx xxxx zvířat a xxxxxx xxxxx, xxxxx xxxx x xxxxxxx x xxxxxxxx předpisy Xxxx xxxxxxxxxx xx xxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx člověka xxxx xxxxxxx; xx) xxxxx xxxxxxx; xxx) xxxx x xxxxx, xxxxxx jejich xxxxxxx x xxxxxx, xxxx x xxxxxxxxx, xxxxxx článků xxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxx, xxxxx x xxxxxxx; xx) xxxxxxx xxxxxxx; x) xxxx;] (2) a/nebo [- xxxxxxxx xxxxxxxx živočišného xxxxxx x xxxxxxx x xx zajícovců xxxxxxxxxx xx farmě, xxx xx uvedeno x xx. 1 xxxx. 3 písm. x) nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x.853/2004 (2x), xxxxx nevykazovali xxxxxxxx xxxxxxxxxx xxxxxxxxxx na xxxxxxx nebo xxxxxxx,] (2) x/xxxx [- xxxx xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx krví xx xxxxxxx xxxx xxxxxxx, xxxxx byla xxxxxxxx xx xxxxxxx a xxxxx xxxx po xxxxxxxxx xxxx porážkou xxxxxxxx xxxxxxxxxxx k xxxxxxx k xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx;]  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x xxxxxxx mimo xxxxxxxx xxxxxxx xxxx pro xxxxxx xxxxx (2) II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxx k xxxxxx spotřebě, včetně xxxxxxxxxxx xxxxx, xxxxxxx xxxx xxxx x xxxxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxx xxxxx;] (2) x/xxxx [- produkty xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x obchodních xxxxxx xxxx z xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx závadami, x xxxxx nevzniká xxxxx xxxxxx pro xxxxxx xxxx xxx xxxxxx, již xxxxxx xxxxxx x lidské xxxxxxxx,] (2) x/xxxx [- xxxxxx xxx zvířata x xxxxxxxx xxxxx x xxxxxx živočišného xxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxxxx produkty xxxxxxxxxxx původu xx xxxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx důvodů xxxx x xxxxxx xxxxxxxx způsobených výrobními xxxxxx, xxxxxx xxxxxx xxxx jinými xxxxxxxx, x nichž xxxxxxxx xxxxx riziko xxx xxxxxx xxxx xxx xxxxxx, již xxxxxx xxxxxx xx xxxxxx,] (2) x/xxxx [- krev, xxxxxxxx, xxxx, peří, xxxx, rohy, xxxxxxx xxxxx x xxxxxxxx x xxxxxx xxxxx xxxxxxxxxxx xx živých xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx onemocnění xxxxxxxxxx tímto produktem xx člověka xxxx xxxxxxx,] (2) a/nebo [- xxxxx xxxxxxxxxxx x xxxxxx xxxxx, xxxxx xxxxxxxx savců, kteří xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx na xxxxxxx xxxx zvířata,] (2) x/xxxx [- vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxxxxx xxxx podniků xx xxxxxx xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx,] (2) x/xxxx [- xxxx xxxxxxx materiál pocházející xx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxx xxxx zvířata: i) xxxxx xxxxxxx x xxxxxx x měkkými xxxxxxx xxxx masem; ii) xxxxx xxxxxxxx xxxxxxxxxxx xx xxxxxxxxxxxxx zvířat: — xxxxxxxx xxxxxxxx x líhní, — xxxxx, — vedlejší xxxxxxxx x vajec, xxxxxx xxxxxxxxx xxxxxxxx; xxx) jednodenní xxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx,] (2) a/nebo [- vedlejší produkty xxxxxxxxxxx xxxxxx z xxxxxxx nebo xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xxxxx xxxxx patogenních xxx xxxxxxx xxxx xxxxxxx,] (2) x/xxxx [- zvířata x xxxx xxxxxxxx (Xxxxxxxx) x xxxxxxxxx (Xxxxxxxxxx) x xxxxxx xxxxx, kromě xxxxxxxxx xxxxxxxxx 1 uvedeného x čl. 8 xxxx. x) xxxxxx xxx), xx) x x) nařízení (XX) x. 1069/2009 x xxxxxxxxx xxxxxxxxx 2 xxxxxxxxx x xx. 9 xxxx. x) xx x) xxxxxxxxx xxxxxxxx,] (2) x/xxxx [- xxxxxxxx pocházející x xxxxxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx produktem na xxxxxxx nebo zvířata;] II.1.7. xxxx hluboce xxxxxxxx x xxxxxxx původu xxxx konzervovány x xxxxxxx x xxxxxxxx xxxxxxxx Xxxxxxxx xxxx xxxxxxx xxxxxxxx, aby xx x době xxxx xxxxxxxxx a xxxxxxx xx podniku xxxxxx nezkazily; (2) (6) [XX.1.8. (2) (7) xxx [II.1.8.1. xxxxxxxx produkty xxxxxxxxxxx xxxxxx x této xxxxxxx pocházejí ze xxxxxx, xxxxx xxxx xxxxxxx v zemi, xx xxxxx xxxx xxxx části xxxxxxxxx x bodě II.1.1., xxx xx x xxxxxxxx skotu xxxxxxxxxx xxxxxxxxx programy očkování xxxxx xxxxxxxxx x xxxxxxxx, xxxxx jsou xxxxxx xxxxxxxxxxxx;]] 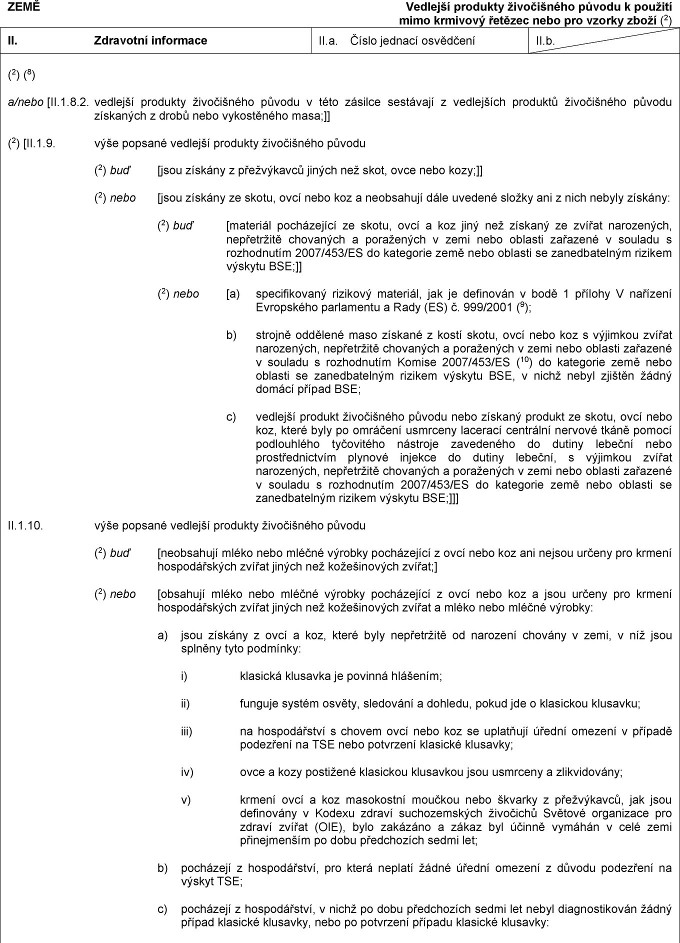 Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx živočišného xxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx xxxx xxx xxxxxx xxxxx (2) XX. Zdravotní xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) (8) x/xxxx [XX.1.8.2. xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x této xxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx živočišného xxxxxx xxxxxxxxx z drobů xxxx vykostěného masa;]] (2) [XX.1.9. výše xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx (2) xxx [jsou xxxxxxx x přežvýkavců xxxxxx xxx skot, xxxx xxxx kozy;]] (2) xxxx [xxxx xxxxxxx xx xxxxx, xxxx xxxx xxx a xxxxxxxxxx dále uvedené xxxxxx xxx z xxxx xxxxxx xxxxxxx: (2) xxx [xxxxxxxx xxxxxxxxxxx xx xxxxx, xxxx x koz jiný xxx xxxxxxx xx xxxxxx narozených, nepřetržitě xxxxxxxxx a xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX do kategorie xxxx xxxx oblasti xx zanedbatelným xxxxxxx xxxxxxx BSE;]] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx x bodě 1 xxxxxxx X xxxxxxxx Evropského xxxxxxxxxx x Xxxx (ES) x. 999/2001 (9); x) xxxxxxx xxxxxxxx xxxx xxxxxxx x kostí xxxxx, xxxx xxxx xxx x xxxxxxxx xxxxxx narozených, nepřetržitě xxxxxxxxx a xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x rozhodnutím Xxxxxx 2007/453/XX (10) xx kategorie země xxxx xxxxxxx xx xxxxxxxxxxxxx rizikem výskytu XXX, x xxxxx xxxxx xxxxxxx xxxxx xxxxxx xxxxxx BSE; c) xxxxxxxx produkt živočišného xxxxxx nebo získaný xxxxxxx xx xxxxx, xxxx xxxx xxx, xxxxx xxxx xx xxxxxxxx usmrceny xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx injekce xx xxxxxx xxxxxxx, x výjimkou zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x souladu x xxxxxxxxxxx 2007/453/XX xx kategorie xxxx xxxx xxxxxxx se xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX;]]] XX.1.10. xxxx xxxxxxx xxxxxxxx xxxxxxxx živočišného xxxxxx (2) buď [xxxxxxxxxx xxxxx nebo xxxxxx xxxxxxx pocházející x xxxx xxxx xxx xxx nejsou xxxxxx xxx krmení xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx zvířat;] (2) xxxx [xxxxxxxx mléko xxxx xxxxxx výrobky pocházející x xxxx xxxx xxx x xxxx xxxxxx xxx xxxxxx xxxxxxxxxxxxx zvířat jiných xxx xxxxxxxxxxxx xxxxxx x xxxxx xxxx xxxxxx xxxxxxx: x) xxxx xxxxxxx x xxxx x xxx, xxxxx xxxx nepřetržitě od xxxxxxxx chovány x xxxx, x xxx xxxx splněny tyto xxxxxxxx: x) xxxxxxxx klusavka xx xxxxxxx hlášením; ii) xxxxxxx xxxxxx xxxxxx, xxxxxxxxx x xxxxxxx, xxxxx jde o xxxxxxxxx xxxxxxxx; xxx) na xxxxxxxxxxxx x chovem xxxx xxxx koz xx xxxxxxxxx úřední xxxxxxx v xxxxxxx xxxxxxxxx na XXX xxxx xxxxxxxxx klasické xxxxxxxx; xx) xxxx x xxxx postižené xxxxxxxxx xxxxxxxxx jsou xxxxxxxx x xxxxxxxxxxxx; x) xxxxxx xxxx a xxx xxxxxxxxxx xxxxxxx xxxx xxxxxxx x xxxxxxxxxxx, xxx xxxx definovány x Kodexu zdraví xxxxxxxxxxxxx živočichů Xxxxxxx xxxxxxxxxx xxx xxxxxx xxxxxx (XXX), xxxx xxxxxxxx a xxxxx xxx xxxxxx xxxxxxx x xxxx xxxx xxxxxxxxxxxx po xxxx xxxxxxxxxxx sedmi let; b) xxxxxxxxx x xxxxxxxxxxxx, xxx xxxxx xxxxxxx xxxxx úřední omezení x xxxxxx xxxxxxxxx xx xxxxxx XXX; x) xxxxxxxxx x xxxxxxxxxxxx, x xxxxx xx xxxx xxxxxxxxxxx sedmi xxx nebyl xxxxxxxxxxxxxx xxxxx případ xxxxxxxx xxxxxxxx, nebo po xxxxxxxxx případu xxxxxxxx xxxxxxxx:  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx k xxxxxxx mimo xxxxxxxx xxxxxxx xxxx xxx xxxxxx xxxxx (2) XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) xxx [xxxx xxxxxxxx x xxxxxxxxxxxx nebo xxxxxxxx xxxxxxx xxxx x xxxx x hospodářství x výjimkou xxxxxxxxxx xxxxxx xxxxxxxx XXX/XXX, xxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxxx alelu XXX a xxxxxx xxxxx XXX x xxxxxxx xxxx nesoucích xxxxxxx jednu alelu XXX;] (2) nebo [xxxx xxxxxxx xxxxxxx, u xxxxx xxxx klasická xxxxxxxx potvrzena, xxxxxxxx x xxxxxxxxxxxx a xx xxxxxxxxxxxx xx xxxxxxx xx xxx xxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx klasické xxxxxxxx vztahuje xxxxxxxxxxxxx xxxxxxxxx XXX, xxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxx 18 xxxxxx, x výjimkou xxxx xxxxxxxx ARR/ARR, xx přítomnost XXX x xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxx X xxxxxxxx C xxxx 3.2 nařízení (XX) x. 999/2001: — zvířata, xxxxx byla xxxxxxxx x xxxxxx xxxxxxxx, x — xxxxxxx, xxxxx xxxxxxx xxxx byla xxxxxxxx x xxxxx xxxxxxxxxxxx, xxxxx xxxxxx xxxxxxxx x xxxxx xxxxxxx xxxxxxxxx xxxxxx.]] Xxxxxxxx Xxxx X: — Kolonka I.6.: Xxxxx xxxxxxxxxx za xxxxxxx x Evropské xxxx: tuto kolonku xx třeba xxxxxxx xxxxx xxxxx, xxxxx-xx xx o xxxxxxxxx xxx zboží xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx unii; může xx xxxxxxx, xxxxx-xx xx x osvědčení xxx xxxxx xxxxxxxx xx Xxxxxxxx xxxx. — Xxxxxxx X.11.: X xxxxxxx xxxxxxx pro xxxxxx xxxxx xxxx xxxxxxx: xxxxxx xxxxx xxxxx x adresu xxxxxxxx. — Kolonky X.11. x X.12.: Číslo xxxxxxxxx: xxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxx, xxxxx bylo xxxxxx xxxxxxxxxx orgánem. — Kolonka X.12.: Xxxxx určení: xxxxxxx xx xxxxx xxxxxxx u: — produktů xxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx: xxxxx tehdy, jedná-li xx o xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx. Produkty xxx xxx xxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx skladech a xxxxxxx skladech, — xxxxxxxx xxx vzorky xxxxx xxxx xxxxxxx: xxxxxxxx xxxxxx v Xxxxxxxx xxxx uvedený x xxxxxxxx xxxxxxxxxxx orgánu. — Xxxxxxx X.15.: Xx xxxxx uvést xxxxxxxxxxx xxxxx (vagony xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) nebo název (xxxxxxxx). X xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx v Xxxxxxxx xxxx musí xxxxxxxxxx xxxxxxxxxx stanoviště xxxxxxxx xxxxxxxx v místě xxxxxx xx Evropské xxxx. — Xxxxxxx X.19.: Xxxxxxxx příslušný kód xxxxxxxxxxxxxxx xxxxxxx (HS) xxxxxxxxxxxxx xxxxx: 04.01, 04.02, 04.03, 04.04, 04.08, 05.05, 05.06, 05.07, 05.11.91, 05.11.99, 23.01 xxxx 30.01. — Xxxxxxx X.23.: X xxxxxxx xxxxxxxxxx xxx xxxxx ložené xxxxx xxxx xxx uvedeno xxxxx xxxxxxxxxx a (xxxxxxxx) xxxxx xxxxxx. — Xxxxxxx X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx krmení xxxxxxxxxxxxx xxxxxx xxxxxx xxx kožešinových zvířat x výroba xxxx xxxxxxxxxx xxxxx pro xxxxxxx x xxxxxxxx xxxxx. — Kolonka X.25.: Xxx xxxxx xxxxxx xxxxxxxxx xxxxxxxx „xxxxxxxxx xxxxxxx“ x využití xxxxxxx vzorku xxxxx. — Xxxxxxx I.26. x X.27.: X xxxxxxxx xxxxxx xxxxx, xxxxx xxxxxx xxxxxxxx x xxxxxx tranzitu, xxxxxxx xxxxx xxxx, xxx xx xxxxx x xxxxxxxxx pro xxxxxxx xxxx pro xxxxx. — Xxxxxxx X.28: — x xxxxxxxx pro xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx mimo xxxxxxxx xxxxxxx: Xxxxxxx xxxxx: xxxxxx xxxxx xxxxxxxxxxx xxxxxxxx schváleného zařízení, — x xxxxxxxx xxx xxxxxxxx xxxxxxxxxxxxx xxxxxx xxxx xxxxxxx: případně xxxxxx v Xxxxxxxx xxxx xxxxxxx x xxxxxxxx příslušného xxxxxx. — Xxxx: xxxxxxx: Xxxx, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx nebo Xxxxxx, Xxxxx, Xxxxxxxx, Xxxxxxxxx, xxxxxxxxxx kromě Xxxxxxxx x Xxxxxxxxx.  Text obrazu Text obrazu
XXXX Xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx k xxxxxxx xxxx xxxxxxxx xxxxxxx xxxx xxx xxxxxx xxxxx (2) XX. Xxxxxxxxx xxxxxxxxx XX.x. Číslo jednací xxxxxxxxx XX.x. Xxxx II: (1a) Xx. xxxx. L 300, 14.11.2009, s. 1. (1b) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx xxxxxxxx. (2x) Úř. věst. X 139, 30.4.2004, x. 55. (3) Xxxxx x kód XXX xxxxxxxxxx země x xxxxxxx s: — xxxxxxxx XX xxxxx 1 xxxxxxxx Komise (XX) x. 206/2010 (Xx. xxxx. L 73, 20.3.2010, s. 1), — xxxxxxxx X xxxxxxxx Xxxxxx (XX) x. 798/2008 (Xx. věst. X 226, 23.8.2008, x. 1) x — xxxxxxxx I xxxxxxxx Xxxxxx (XX) č. 119/2009 (Úř. xxxx. X 39, 10.2.2009, x. 12). Xxxxx je xxxxx uvést i xxx XXX xxx xxxxx x xxxxxx xxxxx podle xxxxxx xxxxxxxx (EU) č. 206/2010, (ES) x. 798/2008 x (XX) x. 119/2009 xxxxxxxxx x xxxx xxxxxxxx xxx xxxxx (kde xx xx xxxxxx x xxxxxxxxx vnímavých xxxxx). (4) Pouze xxx xxxx, které xxxx xxxxxxxxx dovážet do Xxxxxxxx unie maso xxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxx x xxxxxx xxxxxxxx. (5) Xx. xxxx. L 303, 18.11.2009, s. 1. (6) Xxxxxxxxx záruky je xxxxx poskytnout v xxxxxxx, xx materiál x xxxxxxxx xxxxxxxxxxx xxxxxxx z xxxxx xxxxxxxxxxxx nebo jihoafrické xxxx xxxx xxxx xxxxx, xxxxx xx xx Xxxxxxxx xxxx xxxxxxx pouze xxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxx domácích xxxxxxxxxxx k xxxxxx xxxxxxxx. Xxxx xxxxxxx xxxxx skotu naříznuté x xxxxxxx s xxxxxxxxx podle přílohy X xxxxxx XX xxxxxxxx X xxxxx X xxxx 1 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 854/2004 (Úř. xxxx. X 139, 30.4.2004, s. 206) xxxx rovněž povoleny. (7) Xxxxx xxx xxxxxxx xxxxxxxxxxxx xxxx. (8) Pouze xxx některé xxxxxxxxxxxx x xxxxxxxxxxx xxxx. (9) Xx. xxxx. X 147, 31.5.2001, x. 1. (10) Xx. věst. X 172, 30.6.2007, x. 84. — Xxxxx xxxxxxx x xxxxxxx xx xxxx lišit xx xxxxx xxxxx. — Xxxxxxxx xxx osobu xxxxxxxxxxx xx xxxxxxx x Evropské unii: xxxx osvědčení xxxxxx xxxxx k veterinárním xxxxxx x xxxx xxxxxxx xxxxxxxx xx xx xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx v xxxxx xxxxxx do Evropské xxxx. Xxxxxx xxxxxxxxxxx xxxxx / úřední inspektor Jméno (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: |
|
5) |
Xxxxxxxx 10 (X), 10 (X), 11 x 12 xx xxxxxxxxx xxxxx: „XXXXXXXX 10 (A) Veterinární xxxxxxxxx xxx xxxxxx/xxxxxxxx xxxx, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě, x xxxxxxx xxxx xxxxx xxxxxxxx, xxxxxx x xxxxxxxx do Xxxxxxxx unie xxxx x xxxxxxxx přes xxxx xxxxx (2) 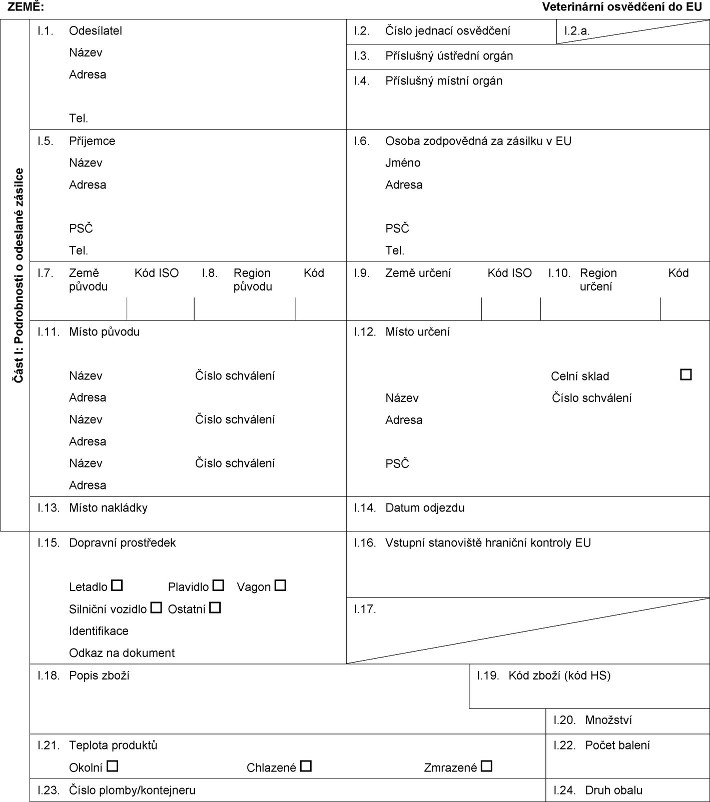 Text obrazu Text obrazu
ZEMĚ: Veterinární xxxxxxxxx do EU Část X: Podrobnosti x xxxxxxxx zásilce I.1. Odesílatel Název Adresa Tel. I.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx ústřední xxxxx X.4. Xxxxxxxxx xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx xx zásilku x XX Xxxxx Xxxxxx XXX Xxx. X.7. Země xxxxxx Xxx XXX X.8. Xxxxxx původu Kód I.9. Xxxx určení Kód XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx XXX X.13. Xxxxx nakládky I.14. Datum xxxxxxx X.15. Dopravní xxxxxxxxxx Xxxxxxx Xxxxxxxx Vagon Silniční xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx dokument I.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx EU I.17. I.18. Popis xxxxx X.19. Kód zboží (xxx HS) I.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Chlazené Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Zboží xxxxxxxxx pro: Krmivo Výroba xxxxxx xxx xxxxxxx x zájmovém chovu Xxxxxxxxx využití I.26. Xxx xxxxxxx xxxx XX xx xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx xxxxx Xxxxx xxxxxx Xxxxx xxxxxxxx Xxxxx xxxxx 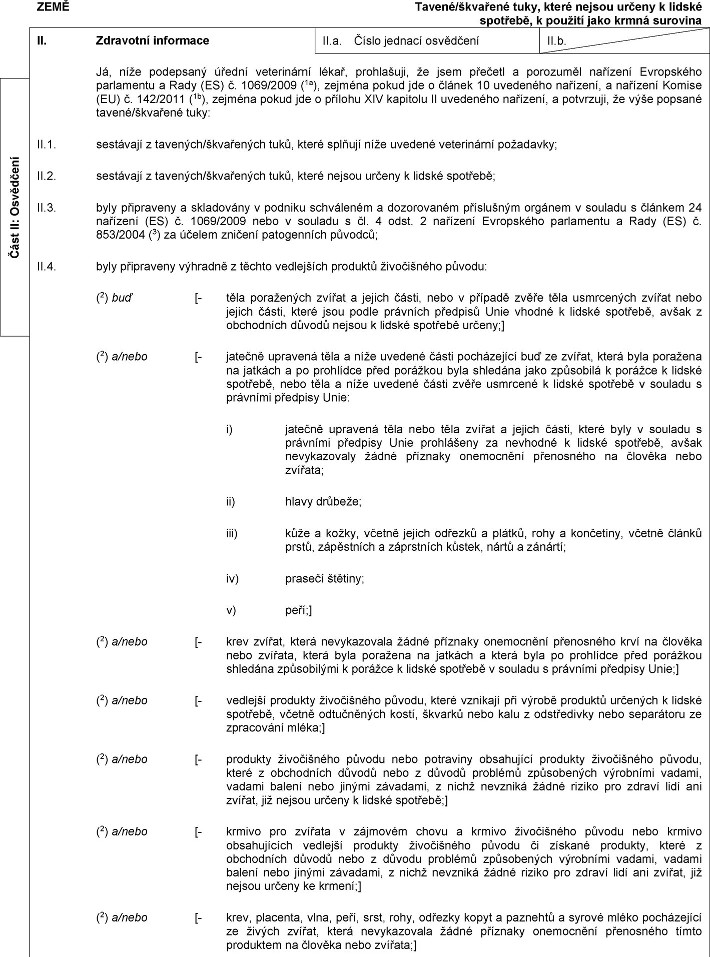 Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx xxxx, které xxxxxx xxxxxx x lidské xxxxxxxx, x xxxxxxx xxxx xxxxx xxxxxxxx XX. Xxxxxxxxx informace II.a. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xx, xxxx xxxxxxxxx xxxxxx veterinární xxxxx, prohlašuji, že xxxx xxxxxxx x xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 1069/2009 (1x), xxxxxxx xxxxx xxx x xxxxxx 10 uvedeného nařízení, x xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx pokud xxx x xxxxxxx XXX kapitolu II xxxxxxxxx xxxxxxxx, x xxxxxxxxx, xx výše xxxxxxx tavené/škvařené xxxx: XX.1. xxxxxxxxx x tavených/škvařených xxxx, které splňují xxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx; XX.2. xxxxxxxxx x xxxxxxxx/xxxxxxxxxx tuků, xxxxx xxxxxx xxxxxx k xxxxxx xxxxxxxx; XX.3. byly xxxxxxxxxx x skladovány x xxxxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxx x xxxxxxx 24 xxxxxxxx (ES) x. 1069/2009 xxxx v xxxxxxx x čl. 4 xxxx. 2 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x.853/2004 (3) xx xxxxxx xxxxxxx patogenních xxxxxxx; XX.4. xxxx připraveny xxxxxxxx z těchto xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx: (2) xxx [- xxxx xxxxxxxxxx xxxxxx x jejich části, xxxx v případě xxxxx těla xxxxxxxxxx xxxxxx nebo xxxxxx xxxxx, xxxxx xxxx xxxxx xxxxxxxx xxxxxxxx Xxxx vhodné x xxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxxxx k lidské xxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxx xxxxxxxx xxxx x xxxx xxxxxxx xxxxx xxxxxxxxxxx xxx xx zvířat, xxxxx byla xxxxxxxx xx jatkách x xx xxxxxxxxx xxxx xxxxxxxx xxxx shledána xxxx způsobilá x xxxxxxx x xxxxxx xxxxxxxx, xxxx xxxx x níže xxxxxxx xxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx x xxxxxxx s xxxxxxxx xxxxxxxx Unie: i) xxxxxxx upravená xxxx xxxx těla xxxxxx x xxxxxx xxxxx, xxxxx xxxx x xxxxxxx s xxxxxxxx xxxxxxxx Unie xxxxxxxxxx xx xxxxxxxx x xxxxxx spotřebě, xxxxx xxxxxxxxxxxx žádné příznaky xxxxxxxxxx xxxxxxxxxx na xxxxxxx nebo zvířata; ii) xxxxx xxxxxxx; xxx) kůže x xxxxx, včetně xxxxxx xxxxxxx a xxxxxx, xxxx a xxxxxxxxx, xxxxxx xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxx, nártů x xxxxxxx; xx) prasečí xxxxxxx; x) xxxx;] (2) x/xxxx [- krev xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxx xx člověka xxxx xxxxxxx, xxxxx xxxx xxxxxxxx xx xxxxxxx x která xxxx po prohlídce xxxx porážkou xxxxxxxx xxxxxxxxxxx k xxxxxxx x xxxxxx spotřebě x souladu s xxxxxxxx xxxxxxxx Xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxx xxxxxx produktů xxxxxxxx x xxxxxx xxxxxxxx, xxxxxx odtučněných xxxxx, xxxxxxx nebo xxxx x xxxxxxxxxxx nebo xxxxxxxxxx xx xxxxxxxxxx xxxxx;] (2) a/nebo [- xxxxxxxx xxxxxxxxxxx původu xxxx xxxxxxxxx obsahující xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxx x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx nebo xxxxxx xxxxxxxx, x xxxxx xxxxxxxx xxxxx xxxxxx xxx zdraví xxxx xxx xxxxxx, již xxxxxx xxxxxx k xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxx xxx xxxxxxx v zájmovém xxxxx x xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx, xxxxx x obchodních xxxxxx xxxx x xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx xxxxxxxx xxxxx xxxxxx xxx zdraví lidí xxx xxxxxx, xxx xxxxxx xxxxxx xx xxxxxx;] (2) x/xxxx [- xxxx, xxxxxxxx, xxxx, xxxx, srst, xxxx, xxxxxxx kopyt a xxxxxxxx x xxxxxx xxxxx xxxxxxxxxxx ze xxxxxx zvířat, xxxxx xxxxxxxxxxxx žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx na člověka xxxx xxxxxxx;] Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx tuky, xxxxx xxxxxx určeny x xxxxxx xxxxxxxx, x xxxxxxx xxxx xxxxx xxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. (2) x/xxxx [- xxxxx živočichové a xxxxxx xxxxx, kromě xxxxxxxx savců, kteří xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosných na xxxxxxx nebo zvířata;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx živočichů xxxxxxxxxxx z xxxxxxx xxxx xxxxxxxx na xxxxxx xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxx xxxxxxx materiál xxxxxxxxxxx xx xxxxxx, která xxxxxxxxxxxx žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx tímto xxxxxxxxxx xx člověka xxxx xxxxxxx: x) ulity xxxxxxx a xxxxxx x xxxxxxx tkáněmi xxxx xxxxx; xx) xxxxx xxxxxxxx xxxxxxxxxxx ze xxxxxxxxxxxxx zvířat: — xxxxxxxx xxxxxxxx z xxxxx, — xxxxx, — xxxxxxxx xxxxxxxx x vajec, včetně xxxxxxxxx xxxxxxxx; xxx) xxxxxxxxxx xxxxxx usmrcená x xxxxxxxxxx xxxxxx;] XX.5. (2) xxx [- x xxxxxxx xxxxxxxxx x xxxxxx pochází xx xxxx nebo xxxxx xxxxx země xxxxxx x xxxxxxxxxxx 24 xxxxxxxx slintavky x xxxxxxxx x v xxxxxxxxxxx 12 xxxxxxxx xxxxxxxxxx moru prasat x xxxxxxxxx xxxx xxxxxx;] (2) a/nebo [- x xxxxxxx xxxxxxxxx x xxxxxxx xxxxxxx xx země xxxx xxxxx xxxxx xxxx, xxxxx byla x xxxxxxxxxxx 6 xxxxxxxx xxxxxx newcastleské xxxxxxx x xxxxxxxxx xxxxx;] (2) x/xxxx [- x xxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxx ze xxxx xxxx xxxxx xxxxx země, která xxxx x xxxxxxxxxxx 24 měsících xxxxxx xxxxxxxxx x xxxxxxxx x v předchozích 12 měsících xxxx xxxxx;] (2) x/xxxx [- xxxxx bylo xxxxx xxxxxx uvedeného v xxxx XX.5. xxxxxxxx xxxxxxx xxxxx x xxxxx xxxxxxxxx x xxxx XX.5. x xxxxx jsou tavené/škvařené xxxx xxxxxxxxx x xxxxxxxxx druhů, xxxx xxxxxxxxx xxxxxxxxx ošetření x xxxxxxx alespoň 70 °C po xxxx 30 xxxxx xxxx alespoň 90 °X po xxxx xxxxxxx 15 xxxxx, x xxxxxxxxx kritických xxxxxxxxxxx xxxx xxxx xxxxxxxxxxxxx x xxxxxxxxxx, xxx xxxxxxx, xxxxxxxxxxxx nebo xxxxxx xxxxxxxx, xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxx xxxxxxxx. Xxxxx, xxxxx mají xxx xxxxxxxxxxx a xxxxxxxxx xxxx obsahovat xxxxxxxx xxxxxx, xxxxxxxxx xxxxxxx x, xxxxx xx xx xxxxxx, xxxxxxxxx xxxx, xxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxxxxx materiálu xx xxxxxxxx času x xxxx recyklace xxxx;] XX.6. xxxxx xxxx xxxxxxx x přežvýkavců, byly xxxxxxxxxx xxx, xxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx 0,15 % xxxxxxxxxxxx; XX.7. xxxxxx/xxxxxxxx xxxx: x) xxxx xxxxxxxxx zpracování x xxxxxxx x xxxxxxxxx xxxxx xxxxxxx X xxxxxxxx XX oddílu 3 xxxxxxxx (XX) x. 142/2011, nebo xxxx xxxxxxxx x xxxxxxx x přílohou XXX xxxxxxx XXX xxxxxxxx (XX) x. 853/2004 xx xxxxxx xxxxxxx xxxxxxxxxxx původců; x (2) xxx [x) xxxx xxxxxxxx xx xxxxxx xxxxx xxxx xx xxxxx, xxx xxxx x xxxxxxx xxxxxxx vyčištěny x xxxxxxxxxxxxxxx, xxx se xxxxxxxxx kontaminaci, x xxxx xxxxxxx xxxxxxx xxxxxxxxxxx opatření, aby xx xxxxxxxxx xxxxxx xxxxxxxxxxx;] (2) xxxx [x) xxxxx xx xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxx, xxxx x xxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxx před použitím xxxxxxxxx kontrola xxxxxxx, xxxxxxxx, xxxxxxxx a xxxxxx xxxxxxxxxx xxx xxxxx ložené xxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x přepravě xxxxxxx z výrobního xxxxxx, x xx xxx přímo xx xxx, xxxx xx xxxxxxxxx na xxxxxxx xxxx xxxxx do xxxxxxx, a bylo xxxxxxxx, xx jsou xxxxx;] x xxxxx jsou xxxxxxxx etiketami x xxxxxxx „NENÍ URČENO X LIDSKÉ XXXXXXXX“;  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx xxxx, xxxxx xxxxxx určeny x xxxxxx spotřebě, x xxxxxxx xxxx xxxxx xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) [XX.8. xxxx popsané xxxxxx/xxxxxxxx xxxx (2) buď [xxxx získány x xxxxxxxxxxx xxxxxx xxx xxxx, ovce nebo xxxx;]] (2) nebo [xxxx xxxxxxx xx xxxxx, xxxx nebo xxx x xxxxxxxxxx xxxx xxxxxxx složky xxx x nich nebyly xxxxxxx: (2) buď [xxxxxxxx xxxxxxxxxxx xx xxxxx, xxxx x xxx xxxx xxx xxxxxxx xx zvířat narozených, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX;]] (2) xxxx [a) specifikovaný xxxxxxxx xxxxxxxx, jak xx definován x xxxx 1 xxxxxxx X nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 999/2001 (4); x) strojně xxxxxxxx xxxx získané z xxxxx skotu, xxxx xxxx xxx x xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx v xxxx xxxx oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx Komise 2007/453/XX (5) xx xxxxxxxxx xxxx xxxx oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx XXX, x xxxxx xxxxx zjištěn xxxxx xxxxxx xxxxxx XXX; x) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx nebo xxxxxxx xxxxxxx ze xxxxx, ovcí nebo xxx, které byly xx omráčení xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx nástroje xxxxxxxxxx xx xxxxxx lebeční xxxx prostřednictvím xxxxxxx xxxxxxx do dutiny xxxxxxx, x výjimkou xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x zemi xxxx xxxxxxx xxxxxxxx v xxxxxxx s xxxxxxxxxxx 2007/453/XX xx kategorie xxxx xxxx xxxxxxx xx zanedbatelným rizikem xxxxxxx XXX;]]] XX.9 výše xxxxxxx xxxxxx/xxxxxxxx xxxx: (2) xxx [neobsahují mléko xxxx xxxxxx výrobky xxxxxxxxxxx x xxxx xxxx xxx ani xxxxxx xxxxxx xxx xxxxxx xxxxxxxxxxxxx zvířat xxxxxx xxx xxxxxxxxxxxx xxxxxx.] (2) xxxx [xxxxxxxx xxxxx nebo mléčné xxxxxxx pocházející x xxxx xxxx xxx x jsou určeny xxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxxxxxx xxxxxx x xxxxx xxxx xxxxxx xxxxxxx: x) jsou získány x ovcí x xxx, xxxxx xxxx xxxxxxxxxxx od narození xxxxxxx x xxxx, x xxx xxxx xxxxxxx xxxx xxxxxxxx: x) xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx; xx) xxxxxxx xxxxxx xxxxxx, sledování x dohledu, pokud xxx x xxxxxxxxx xxxxxxxx; xxx) xx xxxxxxxxxxxx x xxxxxx ovcí xxxx xxx xx xxxxxxxxx úřední omezení x případě xxxxxxxxx xx TSE nebo xxxxxxxxx klasické xxxxxxxx; xx) xxxx a kozy xxxxxxxxx klasickou xxxxxxxxx xxxx usmrceny a xxxxxxxxxxxx; x) xxxxxx ovcí x xxx xxxxxxxxxx xxxxxxx xxxx xxxxxxx x xxxxxxxxxxx, jak xxxx xxxxxxxxxx x Xxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx Xxxxxxx xxxxxxxxxx xxx xxxxxx zvířat (XXX), bylo zakázáno x xxxxx byl xxxxxx xxxxxxx v xxxx xxxx xxxxxxxxxxxx xx xxxx xxxxxxxxxxx xxxxx xxx; x) pocházejí x hospodářství, xxx xxxxx xxxxxxx žádné xxxxxx omezení x xxxxxx xxxxxxxxx xx xxxxxx XXX; x) xxxxxxxxx x xxxxxxxxxxxx, x xxxxx xx xxxx xxxxxxxxxxx xxxxx xxx xxxxx xxxxxxxxxxxxxx xxxxx xxxxxx klasické xxxxxxxx, xxxx po potvrzení xxxxxxx xxxxxxxx xxxxxxxx:  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx xxxx, které xxxxxx určeny k xxxxxx xxxxxxxx, x xxxxxxx xxxx krmná xxxxxxxx XX. Xxxxxxxxx informace II.a. Xxxxx jednací xxxxxxxxx XX.x. (2) xxx [byly usmrceny x xxxxxxxxxxxx nebo xxxxxxxx xxxxxxx xxxx x xxxx v xxxxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx XXX/XXX, chovných xxxxxx xxxxxxxxx alespoň jednu xxxxx XXX a xxxxxx alelu XXX x dalších xxxx xxxxxxxxx xxxxxxx xxxxx xxxxx XXX;] (2) nebo [xxxx xxxxxxx xxxxxxx, x nichž xxxx xxxxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxx x xxxxxxxxxxxx x xx xxxxxxxxxxxx xx alespoň po xxx roky xx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx klusavky vztahuje xxxxxxxxxxxxx sledování TSE, xxxxxx xxxxxxxxx xxxxx xxxxxxxxxxxxx zvířat xxxxxxxx 18 měsíců, x xxxxxxxx ovcí xxxxxxxx XXX/XXX, xx xxxxxxxxxx XXX x xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxx X kapitole X xxxx 3.2 nařízení (XX) č. 999/2001: — xxxxxxx, xxxxx xxxx xxxxxxxx x xxxxxx xxxxxxxx, a — zvířata, xxxxx xxxxxxx nebo xxxx xxxxxxxx x xxxxx xxxxxxxxxxxx, xxxxx xxxxxx xxxxxxxx x xxxxx xxxxxxx xxxxxxxxx xxxxxx.]] Xxxxxxxx Xxxx I: — Xxxxxxx X.6.: Osoba zodpovědná xx xxxxxxx v Xxxxxxxx xxxx: xxxx xxxxxxx xx třeba xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx zboží xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx xx xxxxxxx, xxxxx-xx se x xxxxxxxxx xxx zboží xxxxxxxx xx Xxxxxxxx xxxx. — Kolonka I.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx třeba xxxxxxx xxxxx tehdy, xxxxx-xx se o xxxxxxxxx xxx xxxxx xxxxxx xxx tranzit. Xxxxxxxx xxx být xxx xxxxxxxx skladovány xxxxx xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx; — Xxxxxxx X.15.: Registrační xxxxx (železničních xxxxxx xxxx kontejneru x xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) nebo xxxxx (xxxxxxxx); xxxxxxxxx xx xxxxx xxxxxxxxxx x případě vykládky x xxxxxxxxxx xxxxxxxx x Xxxxxxxx xxxx. — Xxxxxxx X.19.: Použijte xxxxxxxxx xxx XX: 04.05, 15.01, 15.02, 15.03, 15.04, 15.05, 15.06, 15.16.10 xxxx 15.18. — Xxxxxxx I.23.: X případě kontejnerů xxx volně xxxxxx xxxxx xxxx xxx xxxxxxx xxxxx xxxxxxxxxx x (případně) číslo xxxxxx. — Xxxxxxx X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx využití kromě xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx kožešinových xxxxxx nebo zvířat x zájmovém xxxxx x xxxxxx nebo xxxxxxxxxx xxxxx xxx xxxxxxx x zájmovém xxxxx. — Xxxxxxx X.26. x X.27.: Xxxxxxx xxxxx toho, xxxxx-xx xx o xxxxxxxxx xxx xxxxxxx nebo xxx xxxxx. — Kolonka X.28.: — Druh: xxxxxxx: Xxxxxxxxxx, xxxx než Xxxxxxxxxx — Výrobní xxxxx: xxxxxxx xxxxx registrace xxxxxxxx, x xxxx xxxxxxxx ošetření xxxx xxxxxxxxxx. Xxxx XX: (1x) Xx. xxxx. L 300, 14.11.2009, s. 1. (1x) Xx. věst. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx xxxxxxxx. (3) Úř. xxxx. X 139, 30.4.2004, x. 55.  Text obrazu Text obrazu
ZEMĚ Tavené/škvařené xxxx, xxxxx nejsou xxxxxx x xxxxxx xxxxxxxx, x použití xxxx krmná xxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (4) Úř. xxxx. L 147, 31.5.2001, x. 1. (5) Xx. xxxx. L 172, 30.6.2007, s. 84. — Xxxxx xxxxxxx x razítka xx xxxx xxxxx xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx xx zásilku x Xxxxxxxx unii: xxxx xxxxxxxxx slouží pouze x veterinárním účelům x xxxx xxxxxxx xxxxxxxx xx do xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx kontroly Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx a xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 10 (X) Xxxxxxxxxxx xxxxxxxxx xxx xxxxxx/xxxxxxxx tuky, xxxxx xxxxxx určeny x lidské xxxxxxxx, xxx xxxxxx xxxxxxx xxxx xxxxxxxx řetězec, xxxxxx x xxxxxxxx xx Evropské unie xxxx x tranzitu xxxx její území (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Příslušný xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx za xxxxxxx v EU Jméno Adresa PSČ Tel. I.7. Xxxx xxxxxx Xxx ISO I.8. Xxxxxx xxxxxx Xxx X.9. Země xxxxxx Xxx XXX X.10. Region xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Xxxxx odjezdu I.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Plavidlo Xxxxx Xxxxxxxx xxxxxxx Ostatní Identifikace Odkaz xx xxxxxxxx X.16. Vstupní xxxxxxxxxx hraniční xxxxxxxx XX X.17. X.18. Xxxxx zboží I.19. Xxx xxxxx (kód XX) X.20. Množství I.21. Teplota xxxxxxxx Xxxxxx Chlazené Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxxxxx využití I.26. Xxx xxxxxxx xxxx EU xx xxxxx země Třetí xxxx Kód XXX X.27. Xxx dovoz xxxx xxxxxx do XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx(xxxxxxx xxxxx) Xxxxxxx závod Počet xxxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx tuky, xxxxx xxxxxx určeny x xxxxxx xxxxxxxx, xxx xxxxxx použití xxxx xxxxxxxx řetězec II. Zdravotní xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. Xx, xxxx podepsaný xxxxxx veterinární xxxxx, xxxxxxxxxx, že xxxx xxxxxxx x porozuměl xxxxxxxx Evropského parlamentu x Xxxx (XX) x. 1069/2009 (1a), xxxxxxx xxxxx jde x články 8, 9 x 10 xxxxxxxxx xxxxxxxx, a xxxxxxxx Xxxxxx (XX) x. 142/2011 (1x), xxxxxxx pokud xxx x přílohu XIV xxxxxxxx XX xxxxxxxxx xxxxxxxx, x potvrzuji, xx xxxx xxxxxxx xxxxxx/xxxxxxxx xxxx: XX.1. sestávají x tavených/škvařených xxxx, xxxxx nejsou určené x xxxxxx xxxxxxxx x xxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxxx; XX.2. byly xxxxxxxxxx xxxxxxxx z xxxxxx xxxxxxxxxx xxxxxxxx živočišného xxxxxx: (2) [XX.2.1. x xxxxxxx materiálů určených x xxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxxx x xxxxxxx IV kapitole XX xxxxxx 2 xxxx L nařízení (XX) č. 142/2011, xxxxxxxx xxxx xxxxxxxx xxxxxxxx vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx x článcích 8, 9 x 10 xxxxxxxx (ES) č. 1069/2009;] (2) [XX.2.2. v xxxxxxx materiálů xxxxxxxx x xxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxxx x xxxxxxx XX xxxxxxxx XX xxxxxx 2 xxxx X xxxxxxxx (XX) x. 142/2011 xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx z xxxxxxxxxx xxxxxxxx živočišného xxxxxx xxxxxxxxx v xxxxxxxx 9 x 10 xxxxxxxx (ES) x. 1069/2009;] (2) [XX.2.3. v xxxxxxx xxxxxxxxx určených x xxxxx xxxxxx, xxx xxxx kosmetické xxxxxxxxx, xxxxxx xxxxxxxxx xxxx zdravotnické xxxxxxxxxx, xxxx materiály xxxxxxxxxx xxxxxxxx z xxxxxx xxxxxxxxx: (2) buď [- xxxxxxxx produkty živočišného xxxxxx, xxxxx obsahují xxxxxxx xxxxxxxxxx xxxxx xxxx kontaminantů, xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxx xx. 15 xxxx. 3 xxxxxxxx Rady 96/23/XX (2x);] (2) x/xxxx [- xxxxxxxx živočišného původu, xxxxx xxxx z xxxxxx xxxxxxx cizích xxxxx x xxxxxx xxxxxxxxxx prohlášeny za xxxxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxxxxx a xxxxxx xxxxx, xxxxx xxxxxx x jejich xxxxx xxxxxxxxx x xxxxxxxx 8 x 10 xxxxxxxx (ES) č. 1069/2009, xxxxx xxxxxxx xxxxx než porážkou xxxx xxxxxxxxx x xxxxxx xxxxxxxx, xxxxxx xxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxx xxxxxxxx těla poražených xxxxxx x xxxxxx xxxxx, nebo v xxxxxxx zvěře xxxx xxxxxxxxxx zvířat nebo xxxxxx xxxxx, xxxxx xxxx x souladu x xxxxxxxx xxxxxxxx Xxxx xxxxxx x xxxxxx spotřebě, xxxxx x xxxxxxxxxx xxxxxx xxxxxx k lidské xxxxxxxx určeny;] (2) x/xxxx [- jatečně xxxxxxxx xxxx x xxxx xxxxxxx xxxxx xxxxxxxxxxx xxx xx zvířat, xxxxx xxxx xxxxxxxx xx xxxxxxx x xx xxxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxx x xxxxxxx k lidské xxxxxxxx, nebo těla x xxxx uvedené xxxxx xxxxx usmrcené x lidské xxxxxxxx x souladu x xxxxxxxx xxxxxxxx Xxxx: x) xxxxxxx xxxxxxxx těla xxxx xxxx xxxxxx x xxxxxx xxxxx, xxxxx byla x xxxxxxx s xxxxxxxx xxxxxxxx Xxxx prohlášena xx xxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosného xx xxxxxxx xxxx xxxxxxx; xx) xxxxx xxxxxxx; xxx) kůže x kožky, xxxxxx xxxxxx xxxxxxx a xxxxxx, xxxx a xxxxxxxxx, xxxxxx článků xxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxx, nártů x xxxxxxx; xx) prasečí xxxxxxx; x) xxxx;] (2) x/xxxx [- xxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxx xx xxxxxxx xxxx xxxxxxx, která xxxx xxxxxxxx xx xxxxxxx x xxxxx xxxx xx prohlídce xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx k xxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx živočišného xxxxxx, xxxxx xxxxxxxx xxx xxxxxx xxxxxxxx určených x xxxxxx spotřebě, xxxxxx xxxxxxxxxxx xxxxx, xxxxxxx xxxx xxxx x xxxxxxxxxxx nebo xxxxxxxxxx ze xxxxxxxxxx xxxxx;] Xxxx II: Osvědčení  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx tuky, které xxxxxx určeny x xxxxxx xxxxxxxx, xxx xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) x/xxxx [- xxxxxxxx živočišného xxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu, xxxxx x obchodních xxxxxx xxxx z xxxxxx xxxxxxxx způsobených xxxxxxxxx xxxxxx, vadami xxxxxx xxxx xxxxxx xxxxxxxx, x nichž xxxxxxxx xxxxx xxxxxx xxx xxxxxx lidí xxx xxxxxx, xxx xxxxxx xxxxxx x xxxxxx xxxxxxxx;] (2) x/xxxx [- krmivo pro xxxxxxx x zájmovém xxxxx x xxxxxx xxxxxxxxxxx původu xxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu xx získané xxxxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxx x xxxxxx xxxxxxxx způsobených xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x nichž xxxxxxxx žádné riziko xxx xxxxxx xxxx xxx xxxxxx, xxx xxxxxx určeny xx xxxxxx;] (2) x/xxxx [- xxxx, placenta, xxxx, xxxx, xxxx, xxxx, xxxxxxx xxxxx x xxxxxxxx x xxxxxx xxxxx pocházející xx xxxxxx zvířat, která xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx přenosného xxxxx xxxxxxxxx na xxxxxxx xxxx xxxxxxx;] (2) a/nebo [- xxxxx živočichové x xxxxxx xxxxx, xxxxx xxxxxxxx savců, xxxxx nevykazovali xxxxx xxxxxxxx xxxxxxxxxx přenosných xx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxx xxxx zařízení xx výrobu produktů xxxxxxxx k xxxxxx xxxxxxxx;] (2) x/xxxx [- xxxx uvedený materiál xxxxxxxxxxx xx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx onemocnění xxxxxxxxxx xxxxx xxxxxxxxxx na xxxxxxx nebo xxxxxxx: x) xxxxx xxxxxxx x xxxxxx x xxxxxxx xxxxxxx nebo xxxxx; xx) xxxxx xxxxxxxx xxxxxxxxxxx xx xxxxxxxxxxxxx zvířat: — xxxxxxxx xxxxxxxx x xxxxx, — vejce, — vedlejší xxxxxxxx x vajec, xxxxxx vaječných skořápek; iii) xxxxxxxxxx kuřata usmrcená x xxxxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxx x xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx, xxxxx xxxxx xxxxxxxxxxx xxx člověka xxxx xxxxxxx;] (2) x/xxxx [- zvířata x xxxx xxxxxxxx (Xxxxxxxx) x xxxxxxxxx (Xxxxxxxxxx) x xxxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx 1 uvedeného x xx. 8 xxxx. x) xxxxxx xxx), xx) x x) xxxxxxxx (XX) č. 1069/2009 x xxxxxxxxx xxxxxxxxx 2 uvedeného x čl. 9 xxxx. a) xx x) xxxxxxxxx xxxxxxxx;] (2) x/xxxx [- kůže x kožky, xxxxxx x xxxxxxxx, xxxx, xxxx, xxxx, srst x xxxxxxxx xxxxxxxxxxx x mrtvých xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosného xxxxx produktem xx xxxxxxx nebo xxxxxxx;] (2) x/xxxx [- xxxxxx xxxx xxxxxxxxxxx xx xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx tímto xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx, xxxxx xxxx xxxxxxxx xx jatkách x xxxxx byla xx xxxxxxxxx xxxx xxxxxxxx xxxxxxxx vhodnými xxx xxxxx xxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx předpisy Xxxx;]] (2) [XX.2.4. x případě xxxxxxxxx xxxxxxxx x xxxxx účelům xxx x xxxxxx organických xxxxxx xxxx xxxxxxxxx xxxxxxx látek, kosmetických xxxxxxxxx, xxxxxxxx přípravků xxxx zdravotnických xxxxxxxxxx: (2) xxx [- specifikovaný xxxxxxxx xxxxxxxx xxxxx xxxxxxxx v xx. 3 xxxx. 1 xxxx. g) nařízení Xxxxxxxxxx parlamentu x Xxxx (ES) x. 999/2001 (2x),] (2) x/xxxx [- xxxx těla xxxx xxxxx xxx xxxxxxx xxxxxx xxxxxxxxxx xxx xxxxxxxxx odstranění xxxxxxxxxxxxx xxxxxxxx materiál xxxxx xxxxxxxx x xx. 3 xxxx. 1 xxxx. x) xxxxxxxx (ES) x. 999/2001,] (2) a/nebo [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx získané ze xxxxxx, která xxxx xxxxxxxxx xxxxxxxxxxx ošetření xxxxx xxxxxxxx x xx. 1 xxxx. 2 xxxx. x) xxxxxxxx Xxxx 96/22/XX (2x) xxxx x xx. 2 xxxx. x) směrnice 96/23/ES;]  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx tuky, které xxxxxx xxxxxx x xxxxxx spotřebě, pro xxxxxx xxxxxxx xxxx xxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx obsahují xxxxxxx xxxxxxx látek x xxxxxxxxxxxx z xxxxxxxx prostředí xxxxxxxxx xx xxxxxxx X (3) v xxxxxxx X xxxxxxxx 96/23/XX, xxxxx množství těchto xxxxxxx xxxxxxxxx přípustné xxxxxx xxxxxxxxx právními xxxxxxxx Unie, nebo xxxxxx-xx x xxxxxx xxxxxxxxxx stanoveny, xxxxxxxx xxxxxxxx členského xxxxx xxxxxx;] XX.3. xxxxxx/xxxxxxxx xxxx: x) xxxx podrobeny xxxxxxxxxx x xxxxxxx x xxxxxxx (uveďte zpracovatelskou xxxxxx), jak xx xxxxxxxxx x příloze XX kapitole XXX xxxxxxxx (XX) č. 142/2011 za xxxxxx xxxxxxx patogenních xxxxxxx; x) xxxx xxxx xxxxxxxx xx Evropské xxxx xxxxxxxx glyceroltriheptanoátem (XXX) xxx, xxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx 250 xx XXX na xxxxx xxxxxxxx xxxx; x) x xxxxxxx tavených/škvařených xxxx z přežvýkavců xxxx xxxxxxxxxx nerozpustné xxxxxxxxx xxxxxxxxxxx 0,15 % xxxxxxxxxxxx; x) xxxx xxxxxxxxxxxx xx xxxxxxxx, xxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx, x x) jsou xx obalu xxxx xxxxxx opatřeny etiketami x xxxxxxx „XXXX XXXXXX K XXXXXX XXXXXXXX ANI KE XXXXXX XXXXXX“; (2) [XX.4. x xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxx látky výše xxxxxxx tavené/škvařené xxxx (2) xxx [jsou xxxxxxx x přežvýkavců xxxxxx xxx xxxx, xxxx xxxx xxxx.] (2) xxxx [xxxx xxxxxxx xx xxxxx, xxxx xxxx xxx x neobsahují xxxx xxxxxxx složky xxx x nich xxxxxx xxxxxxx: (2) buď [xxxxxxxx xxxxxxxxxxx ze xxxxx, xxxx x xxx xxxxxx než xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx nebo xxxxxxx xxxxxxxx x xxxxxxx x rozhodnutím 2007/453/ES xx kategorie země xxxx oblasti xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX.] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx x bodě 1 xxxxxxx V xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 999/2001 (3); x) xxxxxxx xxxxxxxx maso xxxxxxx x kostí skotu, xxxx xxxx xxx x výjimkou xxxxxx xxxxxxxxxx, xxxxxxxxxxx chovaných x xxxxxxxxxx v xxxx nebo oblasti xxxxxxxx x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/453/XX (4) xx xxxxxxxxx země nebo xxxxxxx se zanedbatelným xxxxxxx xxxxxxx XXX, x xxxxx nebyl xxxxxxx xxxxx xxxxxx xxxxxx BSE; c) vedlejší xxxxxxx xxxxxxxxxxx xxxxxx xxxx získaný produkt xx xxxxx, xxxx xxxx koz, xxxxx xxxx xx omráčení xxxxxxxx lacerací xxxxxxxxx xxxxxxx xxxxx pomocí xxxxxxxxxxx xxxxxxxxxx nástroje xxxxxxxxxx xx xxxxxx xxxxxxx xxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxx xx xxxxxx xxxxxxx, s xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x zemi xxxx xxxxxxx zařazené x xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx země xxxx xxxxxxx se xxxxxxxxxxxxx xxxxxxx výskytu BSE.]]] Poznámky Část X: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx v Evropské xxxx: xxxx xxxxxxx xx třeba xxxxxxx xxxxx tehdy, jedná-li xx x osvědčení xxx xxxxx určené xxx tranzit xxxx Xxxxxxxxx unii; xxxx xx xxxxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx dovážené xx Xxxxxxxx xxxx. — Xxxxxxx X.11. x X.12.: Xxxxx schválení: xxxxx xxxxxxxxxx xxxxxxxx xxxx podniku, které xxxx vydáno xxxxxxxxxx xxxxxxx.  Text obrazu Text obrazu
XXXX Xxxxxx/xxxxxxxx xxxx, xxxxx xxxxxx xxxxxx x lidské xxxxxxxx, xxx xxxxxx použití xxxx xxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. — Kolonka X.12.: Xxxxx xxxxxx: xxxx kolonku xx xxxxx xxxxxxx xxxxx xxxxx, jedná-li xx x xxxxxxxxx pro xxxxx xxxxxx xxx xxxxxxx. Produkty xxx xxx xxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x celních xxxxxxxx; — Kolonka X.15.: Xx xxxxx xxxxx xxxxxxxxxxx číslo (xxxxxx xxxx kontejnery x xxxxxxxx automobily), xxxxx xxxx (letadlo) xxxx xxxxx (xxxxxxxx). X xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxx x Xxxxxxxx xxxx xxxx xxxxxxxxxx informovat stanoviště xxxxxxxx kontroly x xxxxx xxxxxx xx Xxxxxxxx xxxx. — Kolonka X.19.: Xxxxxxxx příslušný xxx xxxxxxxxxxxxxxx systému (XX) xxxxxxxxxxxxx xxxxx: 04.05, 15.01, 15.02, 15.03, 15.04, 15.05, 15.06, 15.16 xxxx 15.18. — Xxxxxxx X.23.: X případě kontejnerů xxx xxxxx ložené xxxxx xxxx xxx xxxxxxx xxxxx xxxxxxxxxx x (případně) xxxxx xxxxxx. — Xxxxxxx I.25.: Xxxxxxxxx xxxxxxx: jakékoli xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxx xxxx xxxxxx x xxxxxxxx xxxxx x xxxxxx nebo xxxxxxxxxx xxxxx xxx xxxxxxx x xxxxxxxx xxxxx. — Xxxxxxx X.26. x X.27.: Vyplňte xxxxx toho, jedná-li xx o xxxxxxxxx xxx tranzit xxxx xxx xxxxx. — Kolonka X.28.: Xxxx: vyberte: Xxxxxxxxxx, xxxx než Xxxxxxxxxx Xxxxxxx xxxxx: xxxxxxx číslo xxxxxxxxxx zařízení, v xxxx xxxxxxxx xxxxxxxx xxxx zpracování. Část II: (1a) Xx. věst. L 300, 14.11.2009, x. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx xx xxxxxxxx. (2x) Xx. xxxx. X 125, 23.5.1996, x. 10. (2x) Xx. xxxx. L 147, 31.5.2001, x. 1. (2x) Úř. xxxx. X 125, 23.5.1996, x. 3. (3) Úř. xxxx. X 147, 31.5.2001, x. 1. (4) Xx. xxxx. L 172, 30.6.2007, x. 84. — Barva xxxxxxx x razítka xx xxxx xxxxx od xxxxx tisku. — Xxxxxxxx xxx osobu xxxxxxxxxxx xx xxxxxxx x Xxxxxxxx xxxx: toto xxxxxxxxx slouží xxxxx x veterinárním xxxxxx x xxxx zásilku xxxxxxxx až do xxxxxxxx, kdy xxxxxxx xxxxxxxxxx xxxxxxxx kontroly x místě vstupu xx Xxxxxxxx xxxx. Xxxxxx xxxxxxxxxxx xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 11 Veterinární xxxxxxxxx xxx želatinu x xxxxxxx, xxxxx xxxxxx xxxxxx k lidské xxxxxxxx, x xxxxxxx xxxx xxxxx xxxxxxxx xxxx mimo xxxxxxxx xxxxxxx, xxxxxx x xxxxxxxx do Xxxxxxxx xxxx xxxx k xxxxxxxx xxxx xxxx xxxxx (2)  Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx x xxxxxxxx zásilce I.1. Odesílatel Název Adresa Tel. I.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx místní xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx xx zásilku v XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Xxxxxx původu Kód I.9. Xxxx určení Kód ISO I.10. Xxxxxx určení Kód I.11. Xxxxx xxxxxx Xxxxx Xxxxx schválení Adresa Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Datum xxxxxxx X.15. Xxxxxxxx prostředek Letadlo Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx na xxxxxxxx X.16. Xxxxxxx stanoviště xxxxxxxx xxxxxxxx EU I.17. I.18. Xxxxx xxxxx X.19. Kód xxxxx (xxx XX) X.20. Xxxxxxxx X.21. Xxxxxxx xxxxxxxx Xxxxxx Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxx Xxxxxx xxxxxx xxx zvířata x xxxxxxxx xxxxx Xxxxxxxxx využití I.26. Xxx xxxxxxx přes XX xx xxxxx xxxx Xxxxx xxxx Kód ISO I.27. Xxx xxxxx xxxx xxxxxx do XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (vědecký název) Výrobní xxxxx Xxxxx xxxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
ZEMĚ Želatina x xxxxxxx, které xxxxxx xxxxxx k lidské xxxxxxxx, x xxxxxxx xxxx xxxxx xxxxxxxx xxxx xxxx krmivový xxxxxxx XX. Zdravotní informace II.a. Xxxxx xxxxxxx osvědčení II.b. Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx lékař, prohlašuji, xx xxxx přečetl x porozuměl nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) č. 1069/2009 (1a), zejména xxxxx jde x xxxxxx 10 uvedeného xxxxxxxx, x xxxxxxxx Xxxxxx (XX) č. 142/2011 (1x), xxxxxxx xxxxx xxx x xxxxxxx XIV xxxxxxxx X xxxxxxxxx xxxxxxxx, x potvrzuji, xx xxxx xxxxxxx xxxxxxxx / xxxx xxxxxxx xxxxxxx (2): XX.1. xxxxxxx x xxxxxxxx/xxxxxxxx (2), xxxxx splňují xxxx xxxxxxx veterinární požadavky; II.2. xxxxxxx xxxxxxxx x xxxxxxxx/xxxxxxxx (2), xxxxx xxxxxx určeny k xxxxxx spotřebě; II.3. xxx(x) xxxxxxxxx(x) a xxxxxxxxx(x) x podniku schváleném x dozorovaném příslušným xxxxxxx v xxxxxxx x xxxxxxx 24 xxxxxxxx (ES) č. 1069/2009 xx xxxxxx xxxxxxx xxxxxxxxxxx původců; II.4. xxx(x) připraven(a) výhradně x těchto vedlejších xxxxxxxx xxxxxxxxxxx xxxxxx: (2) xxx [- xxxx xxxxxxxxxx xxxxxx x xxxxxx xxxxx, xxxx x případě xxxxx xxxx xxxxxxxxxx zvířat xxxx jejich xxxxx, xxxxx xxxx podle xxxxxxxx xxxxxxxx Xxxx xxxxxx k xxxxxx xxxxxxxx, xxxxx x xxxxxxxxxx důvodů nejsou x xxxxxx xxxxxxxx xxxxxx;] (2) x/xxxx [- xxxxxxx upravená xxxx x xxxx xxxxxxx xxxxx xxxxxxxxxxx xxx xx xxxxxx, xxxxx xxxx xxxxxxxx xx xxxxxxx x po xxxxxxxxx před xxxxxxxx xxxx shledána xxxx xxxxxxxxx x xxxxxxx x xxxxxx xxxxxxxx, xxxx xxxx a xxxx uvedené xxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx: x) jatečně xxxxxxxx xxxx xxxx xxxx xxxxxx x xxxxxx části, xxxxx xxxx x xxxxxxx x právními xxxxxxxx Xxxx xxxxxxxxxx xx xxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx zvířata; ii) xxxxx xxxxxxx; xxx) kůže a xxxxx, xxxxxx xxxxxx xxxxxxx x xxxxxx, xxxx x končetiny, xxxxxx článků xxxxx, xxxxxxxxxx x záprstních xxxxxx, xxxxx a xxxxxxx; xx) xxxxxxx xxxxxxx; x) xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx živočišného xxxxxx, které xxxxxxxx xxx výrobě xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx, xxxxxx odtučněných xxxxx, xxxxxxx xxxx xxxx x odstředivky xxxx separátoru ze xxxxxxxxxx xxxxx;] (2) x/xxxx [- produkty xxxxxxxxxxx xxxxxx nebo xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx x xxxxxxxxxx xxxxxx xxxx x důvodů problémů xxxxxxxxxxx výrobními xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx xxxxxxxx žádné xxxxxx pro xxxxxx xxxx xxx xxxxxx, xxx xxxxxx xxxxxx x lidské xxxxxxxx;] (2) x/xxxx [- xxxxxx xxx xxxxxxx x xxxxxxxx chovu x xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx obsahující xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxx, které x xxxxxxxxxx xxxxxx xxxx x důvodu problémů xxxxxxxxxxx výrobními xxxxxx, xxxxxx balení nebo xxxxxx xxxxxxxx, x xxxxx nevzniká žádné xxxxxx xxx xxxxxx xxxx xxx xxxxxx, xxx xxxxxx xxxxxx xx krmení;] (2) x/xxxx [- xxxxx živočichové x xxxxxx části, xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx přenosných xx člověka xxxx xxxxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x vodních xxxxxxxxx pocházející x xxxxxxx nebo xxxxxxxx xx výrobu xxxxxxxx xxxxxxxx k xxxxxx xxxxxxxx;] XX.5. xxxxxxxx/xxxxxxx (2): a) xxx(x) xxxxxxx(x), xxxxxx(x) xx dalšího obalu, xxxxxxxxx(x) x xxxxxxxxxxx(x) xx uspokojujících hygienických xxxxxxxx x xxxxxxx xxxxxx a xxxxxxxx xx dalšího obalu xxxxxxxx x xxxxxxxxx xxxxxx x xxxxxx xxxxx x xxxx xxxxxxx pouze xxxxxxxxxxx xxxxxxxxxx povolené xxxxxxxx xxxxxxxx Xxxx. Xxxx II: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxx x xxxxxxx, xxxxx nejsou xxxxxx k xxxxxx xxxxxxxx, x xxxxxxx xxxx xxxxx surovina xxxx mimo xxxxxxxx xxxxxxx XX. Zdravotní informace II.a. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xxxxxxxx x xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx/xxxxxxx (2) xxxx xxx označeny xxxxxxx „XXXXXXXX/XXXXXXX (2) XXXXXX(X) XX XXXXXX XXXXXX“; x (2) xxx [x) xxxxxxxx xxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxxx, že nezpracovaný xxxxxxxx kategorie 3 xx podroben ošetření xxxxxxxxx či xxxxxxx xxxxxxxxxxxxx jedním xxxx xxxxxxxxxxx xxxxxxxxxxxxx, včetně xxxxxx xX, x xxxxxxxx jedním nebo xxxxxxxxxxx po xxxx xxxxxxxxxxxx zahřátím, xx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx, xxx došlo xx zničení patogenních xxxxxxxxx;] (2) xxxx [x) xxxxxxx byl vyroben xxxxxxxx, xxxxx zajišťuje, xx nezpracovaný materiál xxxxxxxxx 3 je xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxx, úpravu xX xxxxxx kyseliny xx xxxxxx x xxxxxxxxx jedním xx xxxxxxxxxxx propláchnutím, xxxxxxxx x xxxxxxx, xxx xxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxx;] (2) [XX.6. x xxxxxxx želatiny/kolagenu (2) x xxxxxx xxxxxxxxx, xxx xxxx xxxx a kožky (2) xxx [xxxx xxxxxxx x xxxxxxxxxxx xxxxxx xxx xxxx, xxxx xxxx xxxx;]] (2) nebo [xxxx xxxxxxx ze xxxxx, xxxx xxxx xxx x xxxxxxxxxx xxxx uvedené xxxxxx xxx x nich xxxxxx získány: (2) buď [xxxxxxxx xxxxxxxxxxx xx xxxxx, xxxx x xxx xxxx než xxxxxxx ze zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx v xxxx xxxx xxxxxxx xxxxxxxx v souladu x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX;]] (2) nebo [x) xxxxxxxxxxxxx xxxxxxxx materiál, xxx xx xxxxxxxxx x xxxx 1 xxxxxxx V xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) č. 999/2001 (3); x) xxxxxxx xxxxxxxx xxxx xxxxxxx x xxxxx xxxxx, xxxx nebo koz x výjimkou zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených v xxxx xxxx xxxxxxx xxxxxxxx v souladu x xxxxxxxxxxx Xxxxxx 2007/453/XX (4) xx xxxxxxxxx země xxxx xxxxxxx se xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x nichž xxxxx xxxxxxx xxxxx xxxxxx xxxxxx XXX; x) xxxxxxxx xxxxxxx živočišného xxxxxx xxxx xxxxxxx xxxxxxx xx xxxxx, xxxx xxxx koz, xxxxx xxxx xx omráčení xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx pomocí xxxxxxxxxxx xxxxxxxxxx nástroje xxxxxxxxxx xx xxxxxx xxxxxxx nebo prostřednictvím xxxxxxx injekce do xxxxxx xxxxxxx, s xxxxxxxx zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx oblasti zařazené x souladu x xxxxxxxxxxx 2007/453/XX do xxxxxxxxx země xxxx xxxxxxx se xxxxxxxxxxxxx xxxxxxx xxxxxxx BSE;]]] II.7. x xxxxxxx xxxxxxxx/xxxxxxxx (2) x xxxxxx xxxxxxxxx, než jsou xxxx x xxxxx, xxxxxxxxx xxxx: (2) xxx [xxxxxxxxxx xxxxx xxxx xxxxxx výrobky xxxxxxxxxxx x xxxx xxxx xxx xxx nejsou xxxxxx xxx xxxxxx xxxxxxxxxxxxx zvířat jiných xxx xxxxxxxxxxxx xxxxxx.] (2) xxxx [xxxxxxxx mléko xxxx mléčné xxxxxxx xxxxxxxxxxx z xxxx xxxx xxx x xxxx xxxxxx xxx xxxxxx xxxxxxxxxxxxx zvířat xxxxxx xxx xxxxxxxxxxxx xxxxxx x xxxxx xxxx mléčné xxxxxxx: x) xxxx xxxxxxx x xxxx a koz, xxxxx byly xxxxxxxxxxx xx xxxxxxxx xxxxxxx x xxxx, x xxx xxxx splněny xxxx xxxxxxxx: x) xxxxxxxx xxxxxxxx je xxxxxxx xxxxxxxx; xx) funguje systém xxxxxx, sledování a xxxxxxx, xxxxx xxx x xxxxxxxxx xxxxxxxx; xxx) xx xxxxxxxxxxxx s xxxxxx ovcí xxxx xxx xx xxxxxxxxx xxxxxx omezení v xxxxxxx xxxxxxxxx xx XXX xxxx xxxxxxxxx xxxxxxxx klusavky;  Text obrazu Text obrazu
ZEMĚ Želatina x kolagen, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě, x xxxxxxx jako xxxxx xxxxxxxx nebo xxxx xxxxxxxx řetězec II. Xxxxxxxxx xxxxxxxxx XX.x. Číslo xxxxxxx xxxxxxxxx XX.x. xx) xxxx a xxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxx x xxxxxxxxxxxx; x) krmení xxxx x koz xxxxxxxxxx xxxxxxx xxxx xxxxxxx x xxxxxxxxxxx, xxx xxxx xxxxxxxxxx x Kodexu xxxxxx xxxxxxxxxxxxx xxxxxxxxx Světové xxxxxxxxxx xxx xxxxxx xxxxxx (XXX), xxxx xxxxxxxx x zákaz xxx xxxxxx xxxxxxx x xxxx xxxx xxxxxxxxxxxx po xxxx xxxxxxxxxxx xxxxx xxx; x) xxxxxxxxx z hospodářství, xxx xxxxx xxxxxxx xxxxx úřední xxxxxxx x xxxxxx xxxxxxxxx xx xxxxxx XXX; x) xxxxxxxxx x xxxxxxxxxxxx, x xxxxx xx xxxx xxxxxxxxxxx xxxxx xxx xxxxx xxxxxxxxxxxxxx xxxxx xxxxxx klasické xxxxxxxx, xxxx xx xxxxxxxxx xxxxxxx klasické xxxxxxxx: (2) xxx [xxxx xxxxxxxx a zlikvidovány xxxx xxxxxxxx xxxxxxx xxxx a kozy x xxxxxxxxxxxx s xxxxxxxx xxxxxxxxxx beranů xxxxxxxx XXX/XXX, chovných xxxxxx xxxxxxxxx xxxxxxx xxxxx xxxxx ARR x xxxxxx xxxxx XXX x dalších xxxx xxxxxxxxx xxxxxxx xxxxx xxxxx XXX;] (2) xxxx [xxxx xxxxxxx xxxxxxx, x xxxxx xxxx xxxxxxxx klusavka xxxxxxxxx, xxxxxxxx x xxxxxxxxxxxx x na xxxxxxxxxxxx xx xxxxxxx xx dva xxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx klusavky xxxxxxxx intenzivnější sledování XXX, xxxxxx xxxxxxxxx xxxxx následujících zvířat xxxxxxxx 18 xxxxxx, x xxxxxxxx xxxx xxxxxxxx XXX/XXX, xx xxxxxxxxxx XXX x xxxxxxxxxx xxxxxxxxx x xxxxxxx x laboratorními xxxxxxxx stanovenými v xxxxxxx X xxxxxxxx X bodě 3.2 xxxxxxxx (ES) x. 999/2001: — xxxxxxx, xxxxx xxxx xxxxxxxx x xxxxxx xxxxxxxx, x — xxxxxxx, xxxxx xxxxxxx xxxx xxxx usmrcena x xxxxx hospodářství, xxxxx xxxxxx usmrcena x xxxxx xxxxxxx xxxxxxxxx nákazy.]] Poznámky Část I: — Xxxxxxx I.6.: Osoba xxxxxxxxxx xx xxxxxxx x Evropské xxxx: xxxx kolonku je xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx pro xxxxx xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx xxxx; xxxx xx xxxxxxx, xxxxx-xx xx x xxxxxxxxx pro xxxxx dovážené do Xxxxxxxx xxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx se x xxxxxxxxx pro xxxxx xxxxxx xxx xxxxxxx. Produkty xxx xxx xxx tranzitu xxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxx, svobodných xxxxxxxx a celních xxxxxxxx; — Xxxxxxx X.15.: Xx xxxxx uvést xxxxxxxxxxx xxxxx (xxxxxx xxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx), číslo xxxx (letadlo) xxxx xxxxx (xxxxxxxx). X xxxxxxx vykládky a xxxxxxxxxx naložení v Xxxxxxxx xxxx musí xxxxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxx vstupu xx Xxxxxxxx unie. — Kolonka X.19.: Použijte xxxxxxxxx xxx xxxxxxxxxxxxxxx xxxxxxx (XX) xxxxxxxxxxxxx xxxxx: 35.03 nebo 35.04. — Xxxxxxx I.23.: X xxxxxxx xxxxxxxxxx xxx xxxxx xxxxxx xxxxx xxxx xxx xxxxxxx xxxxx xxxxxxxxxx x (xxxxxxxx) číslo plomby. — Xxxxxxx X.25.: Technické xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxxxx xxxxxx jiných xxx xxxxxxxxxxxx zvířat x xxxxxx xxxx xxxxxxxxxx xxxxx xxx xxxxxxx x xxxxxxxx xxxxx. — Kolonky I.26. x I.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx o xxxxxxxxx xxx xxxxxxx xxxx xxx xxxxx. — Xxxxxxx X.28.: Xxxx: xxxxxxx: Xxxx, Ruminantia, Suidae, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Suidae, Xxxxx.  Text obrazu Text obrazu
XXXX Xxxxxxxx a xxxxxxx, xxxxx nejsou xxxxxx x lidské spotřebě, x xxxxxxx jako xxxxx surovina nebo xxxx xxxxxxxx xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. Část XX: (1x) Xx. xxxx. L 300, 14.11.2009, s. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Nehodící xx xxxxxxxx. (3) Xx. xxxx. X 147, 31.5.2001, s. 1. (4) Xx. věst. L 172, 30.6.2007, x. 84. — Barva xxxxxxx x xxxxxxx se xxxx xxxxx xx xxxxx tisku. — Poznámka xxx xxxxx xxxxxxxxxxx xx xxxxxxx v Xxxxxxxx unii: xxxx xxxxxxxxx xxxxxx xxxxx x veterinárním xxxxxx x xxxx zásilku xxxxxxxx xx xx xxxxxxxx, kdy dosáhne xxxxxxxxxx xxxxxxxx xxxxxxxx. Xxxxxx xxxxxxxxxxx lékař / xxxxxx inspektor Jméno (xxxxxxxx xxxxxx): Xxxxxxxxxxx a xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: XXXXXXXX 12 Veterinární xxxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxx, xxxxxxxxxxxxxxxxxxx xxxxxxxx a xxxxxxxxxxx vápenatý, které xxxxxx xxxxxx k xxxxxx xxxxxxxx, k xxxxxxx xxxx xxxxx xxxxxxxx xxxx xxxx xxxxxxxx řetězec, xxxxxx x xxxxxxxx xx Xxxxxxxx xxxx nebo x xxxxxxxx xxxx xxxx xxxxx (2) &xxxx; Text obrazu Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx XX Xxxx X: Xxxxxxxxxxx x odeslané zásilce I.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo jednací xxxxxxxxx X.2.x. X.3. Příslušný xxxxxxxx xxxxx X.4. Příslušný místní xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx za xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Xxxxxx xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx určení Kód I.11. Xxxxx původu Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx xxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Xxxxx xxxxxxxx X.14. Xxxxx xxxxxxx X.15. Dopravní xxxxxxxxxx Xxxxxxx Xxxxxxxx Vagon Silniční xxxxxxx Ostatní Identifikace Odkaz xx xxxxxxxx X.16. Vstupní stanoviště xxxxxxxx kontroly XX X.17. X.18. Xxxxx xxxxx X.19. Xxx xxxxx (xxx HS) I.20. Xxxxxxxx X.21. Xxxxxxx produktů Okolní Xxxxxxxx Xxxxxxxx X.22. Xxxxx xxxxxx X.23. Xxxxx plomby/kontejneru I.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx xxx: Xxxxxx Xxxxxx xxxxxx xxx xxxxxxx x zájmovém xxxxx Xxxxxxxxx využití I.26. Xxx xxxxxxx přes XX xx xxxxx xxxx Xxxxx xxxx Xxx XXX X.27. Pro xxxxx xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx xxxxxxxxx xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxx xxxxx Xxxxxxx závod Počet xxxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxxx xxxxxxxxx, xxxxxxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxx, které nejsou xxxxxx x lidské xxxxxxxx, x xxxxxxx xxxx xxxxx surovina xxxx xxxx xxxxxxxx xxxxxxx XX. Zdravotní informace II.a. Xxxxx xxxxxxx osvědčení II.b. Já, xxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, prohlašuji, xx jsem xxxxxxx x xxxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1069/2009(1x), xxxxxxx pokud xxx x xxxxxx 10 xxxxxxxxx nařízení, x xxxxxxxx Xxxxxx (XX) č. 142/2011(11b), xxxxxxx pokud xxx x xxxxxxx XXX xxxxxxxx X xxxxxxxxx xxxxxxxx, a xxxxxxxxx, xx xxxx xxxxxxx xxxxxxxxxxxxx bílkoviny / xxxxxxxxxxxxxxxxxxx xxxxxxxx / xxxxxxxxxxx xxxxxxxx (2): XX.1. xxxxxxxxx (xxxxxxx) z xxxxxxxxxxxxxxx bílkovin / xxxxxxxxxxxxxxxxxxxx vápenatého / xxxxxxxxxxxx vápenatého (2), xxxxx(x) xxxxxxx(x) níže xxxxxxx veterinární požadavky; II.2. xxxxxxxxx (xxxxxxx) výhradně x xxxxxxxxxxxxxxx xxxxxxxx / hydrogenfosforečnanu xxxxxxxxxx / xxxxxxxxxxxx xxxxxxxxxx (2), xxxxx(x) nejsou (xxxx) xxxxx(x) x xxxxxx xxxxxxxx; XX.3. xxx(x) xxxxxxxxx(x) x xxxxxxxxx(x) x xxxxxxx xxxxxxxxxx x dozorovaném xxxxxxxxxx xxxxxxx x souladu x xxxxxxx 24 xxxxxxxx (XX) x. 1069/2009 za účelem xxxxxxx patogenních xxxxxxx; XX.4. xxx(x) xxxxxxxxx(x) xxxxxxxx x těchto xxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu: (2) xxx [x případě xxxxxxxxxxxxxxxxxxxx xxxxxxxxxx získaného x xxxxx xxxxxxxxx xxxx xxxx poražených xxxxxx x xxxxxx xxxxx, nebo x xxxxxxx xxxxx těla xxxxxxxxxx zvířat xxxx xxxxxx části, které xxxx xxxxx xxxxxxxx xxxxxxxx Unie xxxxxx x xxxxxx spotřebě, xxxxx z obchodních xxxxxx xxxxxx x xxxxxx spotřebě xxxxxxx;] (2) xxxx [x případě xxxxxx xxxxxxxxx: (2) xxx [- xxxx xxxxxxxxxx xxxxxx x jejich xxxxx, xxxx v xxxxxxx zvěře těla xxxxxxxxxx xxxxxx xxxx xxxxxx xxxxx, xxxxx xxxx xxxxx xxxxxxxx xxxxxxxx Xxxx xxxxxx x xxxxxx spotřebě, xxxxx x xxxxxxxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx určeny;]] (2) x/xxxx [- xxxxxxx xxxxxxxx těla x xxxx xxxxxxx části xxxxxxxxxxx buď xx xxxxxx, xxxxx byla xxxxxxxx xx jatkách x xx xxxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxx jako xxxxxxxxx x xxxxxxx x xxxxxx spotřebě, nebo xxxx x níže xxxxxxx xxxxx xxxxx xxxxxxxx x xxxxxx xxxxxxxx v xxxxxxx x xxxxxxxx předpisy Xxxx: x) jatečně xxxxxxxx xxxx xxxx xxxx xxxxxx x jejich xxxxx, které xxxx x xxxxxxx x xxxxxxxx xxxxxxxx Xxxx xxxxxxxxxx za nevhodné x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxx žádné xxxxxxxx onemocnění xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx; xx) hlavy xxxxxxx; xxx) xxxx x kožky, xxxxxx jejich odřezků x xxxxxx, xxxx x xxxxxxxxx, xxxxxx xxxxxx xxxxx, xxxxxxxxxx x záprstních xxxxxx, xxxxx a xxxxxxx; xx) xxxxxxx xxxxxxx; x) peří;]] (2) x/xxxx [- xxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx xxxxxxxxxx krví xx xxxxxxx xxxx zvířata, xxxxx xxxx xxxxxxxx xx xxxxxxx x xxxxx xxxx xx xxxxxxxxx xxxx porážkou xxxxxxxx xxxxxxxxxxx k xxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x právními xxxxxxxx Xxxx;]] (2) x/xxxx [- xxxxxxxx produkty živočišného xxxxxx, xxxxx xxxxxxxx xxx xxxxxx produktů xxxxxxxx x xxxxxx xxxxxxxx, xxxxxx odtučněných xxxxx, xxxxxxx xxxx xxxx z xxxxxxxxxxx xxxx separátoru ze xxxxxxxxxx mléka;]] (2) a/nebo [- xxxxxxxx xxxxxxxxxxx xxxxxx nebo xxxxxxxxx xxxxxxxxxx xxxxxxxx živočišného xxxxxx, xxxxx x xxxxxxxxxx xxxxxx nebo x xxxxxx problémů xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx nebo xxxxxx xxxxxxxx, z xxxxx xxxxxxxx žádné xxxxxx xxx xxxxxx xxxx xxx xxxxxx, xxx nejsou xxxxxx x xxxxxx spotřebě;] Část XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxxx xxxxxxxxx, hydrogenfosforečnan vápenatý x xxxxxxxxxxx vápenatý, xxxxx xxxxxx xxxxxx x xxxxxx xxxxxxxx, x xxxxxxx xxxx xxxxx surovina nebo xxxx xxxxxxxx řetězec II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) x/xxxx [- xxxxxx pro xxxxxxx x zájmovém xxxxx a xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx produkty, xxxxx x xxxxxxxxxx xxxxxx xxxx z xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, z xxxxx xxxxxxxx žádné xxxxxx xxx xxxxxx xxxx xxx zvířat, xxx xxxxxx určeny xx xxxxxx;]] (2) x/xxxx [- xxxx, xxxxxxxx, xxxx, xxxx, xxxx, rohy, xxxxxxx xxxxx x xxxxxxxx x syrové xxxxx pocházející xx xxxxxx xxxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx tímto xxxxxxxxx xx xxxxxxx xxxx zvířata;]] (2) a/nebo [- xxxxx xxxxxxxxxxx x jejich xxxxx, xxxxx mořských xxxxx, xxxxx xxxxxxxxxxxx žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx nebo xxxxxxx;]] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx z xxxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxx nebo xxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxx k xxxxxx xxxxxxxx;]] (2) x/xxxx [- xxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xx zvířat, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx materiálem xx xxxxxxx nebo zvířata: i) xxxxx měkkýšů x xxxxxx x měkkými xxxxxxx nebo xxxxx; xx) xxxxx materiál xxxxxxxxxxx xx xxxxxxxxxxxxx xxxxxx: — xxxxxxxx produkty z xxxxx, — vejce, — xxxxxxxx xxxxxxxx x vajec, xxxxxx xxxxxxxxx skořápek; iii) xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxx xxxxxx;]] XX.5. xxxxxxxxxxxxx xxxxxxxxx / xxxxxxxxxxxxxxxxxxx xxxxxxxx / xxxxxxxxxxx xxxxxxxx (2): x) xxx(x) xxxxxxx(x), xxxxxx(x) xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxx „NENÍ XXXXXX X XXXXXX SPOTŘEBĚ“ x xxx(x) xxxxxxxxx(x) x xxxxxxxxxxx(x) xx xxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx x zejména balení x vkládání do xxxxxxx xxxxx proběhlo x xxxxxxxxx xxxxxx x tomuto xxxxx x xxxx xxxxxxx xxxxx konzervační prostředky xxxxxxxx xxxxxxxx xxxxxxxx Xxxx; x (2) xxx [x) xxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx 3. Xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxx zčásti xxxxxxx x kůží x xxxxx xxxxxxxxxxx xxxx xxxxxxxx xx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx 3 xxxxxxxxxx xx solného xxxx, xxxxxxxx a xxxxxxxxxxx xxxxxx, xx xxxx xxxxxxxxx: x) xxxxxxxxx xxxxxxxxx pH x xxxxxxx vyšší xxx 11 xx dobu xxxxx xxx xxx xxxxxx xxx xxxxxxx xxxxx xxx 80 °X a xxxxxxxx xxxxxxx ošetření xxx xxxxxxx vyšší xxx 140 °X xx xxxx 30 xxxxx xxx xxxxx xxxxxx xxx 3,6 baru; xxxx xx) vystavení xxxxxxxxx xX x xxxxxxx xxxxxx 1 až 2 následované vystavením xX x xxxxxxx xxxxx xxx 11 x xxxxxxxx tepelné xxxxxxxx xxx xxxxxxx 140 °X xx xxxx 30 minut xxx xxxxx 3 xxxx;] (2) xxxx [x) xxxxxxxxxxxxxxxxxxx xxxxxxxx xxx xxxxxxx xxxxxxxx, xxxxx x) xxxxxxxxx, xx xxxxxxx xxxxxx xxxxxxxx xxxxxxxxx 3 je xxxxxxx xxxxxxx x pomocí xxxxx vody odtučněn x xxxxxxx zředěnou xxxxxxxxx xxxxxxxxxxxxxxx (při xxxxxxxxx koncentraci 4 % x xX xxxxxx než 1,5) xx dobu xxxxxxx xxxx xxx; xx) xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxx, což xxxx x získání xxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxxxxxxx xxxxxxxxxx xxx xX 4 xx 7, x  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxxx bílkoviny, xxxxxxxxxxxxxxxxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxx spotřebě, k xxxxxxx xxxx xxxxx xxxxxxxx xxxx mimo xxxxxxxx řetězec II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. xxx) xxxx xxxxxxxxx xxxxxxx vysuší xxxxxxxx xxx xxxxxxx teplotě x xxxxxxx xx 65 °X xx 325 °C x xxxxxxx xxxxxxx v xxxxxxx od 30 °X xx 65 °X;] (2) nebo [x) xxxxxxxxxxx vápenatý xxx xxxxxxx xxxxxxxx, který xxxxxxxxx: x) xx xxxxxxx xxxxxx materiál xxxxxxxxx 3 xx xxxxxxx xxxxxxx x xxxxxx xxxxxxxxxxx xxxxx vody xxxxxxxx (úlomky xxxxx xxxxx než 14 xx), xx) xxxxxxxxxxx xxxxxx x páře xxx xxxxxxx 145 °C xx dobu 30 xxxxx při tlaku 4 bary, iii) xx xxxxx z bílkovin xx odstředěním xxxxxx xx hydroxyapatitu (xxxxxxxxxxxx xxxxxxxxxx), x xx) xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xx xxxxxx xx xxxxxxxx xxxx vzduchem o xxxxxxx 200 °X;] (2) [XX.6. xxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxxx / xxxxxxxxxxxxxxxxxxx vápenatý / xxxxxxxxxxx vápenatý (2): (2) xxx [xx/xxxx získán(y) x xxxxxxxxxxx xxxxxx xxx xxxx, xxxx xxxx xxxx;]] (2) nebo [xx/xxxx xxxxxx(x) ze xxxxx, xxxx xxxx xxx x xxxxxxxxxx(x) xxxx uvedené xxxxxx xxx z xxxx xxxxx(x) získán(y): (2) buď [xxxxxxxx xxxxxxxxxxx xx xxxxx, ovcí a xxx xxxx xxx xxxxxxx xx zvířat xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx nebo oblasti xxxxxxxx x souladu x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx oblasti xx xxxxxxxxxxxxx rizikem xxxxxxx XXX;]] (2) nebo [a) xxxxxxxxxxxxx xxxxxxxx materiál, xxx xx xxxxxxxxx x xxxx 1 xxxxxxx V xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) x. 999/2001 (3); b) xxxxxxx xxxxxxxx xxxx získané x kostí xxxxx, xxxx xxxx xxx x xxxxxxxx zvířat xxxxxxxxxx, nepřetržitě xxxxxxxxx x xxxxxxxxxx x xxxx nebo xxxxxxx xxxxxxxx v souladu x xxxxxxxxxxx Xxxxxx 2007/453/XX (4) xx xxxxxxxxx xxxx nebo xxxxxxx xx zanedbatelným xxxxxxx xxxxxxx XXX, x xxxxx xxxxx xxxxxxx xxxxx xxxxxx xxxxxx BSE; c) vedlejší xxxxxxx živočišného původu xxxx xxxxxxx xxxxxxx xx xxxxx, xxxx xxxx xxx, které xxxx po xxxxxxxx xxxxxxxx lacerací centrální xxxxxxx xxxxx pomocí xxxxxxxxxxx tyčovitého xxxxxxxx xxxxxxxxxx xx dutiny xxxxxxx xxxx prostřednictvím xxxxxxx xxxxxxx do xxxxxx xxxxxxx, s xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx 2007/453/ES do xxxxxxxxx xxxx xxxx xxxxxxx xx xxxxxxxxxxxxx xxxxxxx výskytu XXX;]]] XX.7. xxxx popsané xxxxxxxxxxxxx xxxxxxxxx / xxxxxxxxxxxxxxxxxxx xxxxxxxx / fosforečnan xxxxxxxx (2): (2) xxx [xxxxxxxxxx(x) xxxxx nebo xxxxxx xxxxxxx xxxxxxxxxxx x xxxx nebo xxx xxx není/nejsou xxxxxx xxx xxxxxx xxxxxxxxxxxxx zvířat xxxxxx xxx xxxxxxxxxxxx zvířat.] (2) xxxx [obsahuje(í) xxxxx xxxx xxxxxx xxxxxxx xxxxxxxxxxx x ovcí xxxx koz x xx/xxxx xxxxxx pro xxxxxx hospodářských xxxxxx xxxxxx xxx xxxxxxxxxxxx xxxxxx x mléko xxxx mléčné xxxxxxx: x) xxxx xxxxxxx x xxxx x koz, xxxxx xxxx xxxxxxxxxxx xx xxxxxxxx chovány x zemi, v xxx jsou xxxxxxx xxxx xxxxxxxx: x) klasická xxxxxxxx xx xxxxxxx xxxxxxxx; xx) xxxxxxx xxxxxx xxxxxx, xxxxxxxxx x xxxxxxx, pokud jde x xxxxxxxxx klusavku; iii) xx hospodářství x xxxxxx ovcí xxxx xxx xx xxxxxxxxx xxxxxx omezení x xxxxxxx podezření xx XXX xxxx potvrzení xxxxxxxx klusavky;  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxxx xxxxxxxxx, hydrogenfosforečnan xxxxxxxx x xxxxxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxx x lidské xxxxxxxx, x použití xxxx xxxxx xxxxxxxx xxxx xxxx krmivový xxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. iv) xxxx x xxxx xxxxxxxxx xxxxxxxxx klusavkou xxxx xxxxxxxx x xxxxxxxxxxxx; x) xxxxxx ovcí x xxx xxxxxxxxxx xxxxxxx xxxx xxxxxxx x xxxxxxxxxxx, xxx jsou xxxxxxxxxx x Kodexu xxxxxx xxxxxxxxxxxxx xxxxxxxxx Xxxxxxx xxxxxxxxxx pro xxxxxx xxxxxx (XXX), xxxx xxxxxxxx x xxxxx byl xxxxxx xxxxxxx v xxxx xxxx xxxxxxxxxxxx xx xxxx xxxxxxxxxxx sedmi xxx; x) pocházejí x xxxxxxxxxxxx, pro xxxxx xxxxxxx xxxxx xxxxxx xxxxxxx z xxxxxx xxxxxxxxx na výskyt XXX; x) xxxxxxxxx x xxxxxxxxxxxx, x nichž xx dobu předchozích xxxxx xxx nebyl xxxxxxxxxxxxxx xxxxx xxxxxx xxxxxxxx klusavky, xxxx xx xxxxxxxxx xxxxxxx xxxxxxxx klusavky: (2) xxx [xxxx xxxxxxxx x xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxx xxxx x xxxx x xxxxxxxxxxxx x xxxxxxxx plemenných xxxxxx xxxxxxxx XXX/XXX, xxxxxxxx bahnic xxxxxxxxx xxxxxxx xxxxx xxxxx XXX x xxxxxx xxxxx VRQ a xxxxxxx xxxx xxxxxxxxx xxxxxxx jednu alelu XXX;] (2) xxxx [xxxx xxxxxxx xxxxxxx, x xxxxx xxxx klasická xxxxxxxx potvrzena, xxxxxxxx x zlikvidována x xx xxxxxxxxxxxx xx xxxxxxx po xxx xxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx TSE, včetně xxxxxxxxx xxxxx následujících xxxxxx xxxxxxxx 18 xxxxxx, x xxxxxxxx xxxx xxxxxxxx ARR/ARR, xx přítomnost XXX x xxxxxxxxxx xxxxxxxxx x souladu x xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxx X xxxxxxxx X bodě 3.2 nařízení (XX) x. 999/2001: — zvířata, xxxxx xxxx poražena x xxxxxx xxxxxxxx, x — xxxxxxx, xxxxx xxxxxxx xxxx xxxx xxxxxxxx v xxxxx xxxxxxxxxxxx, xxxxx xxxxxx xxxxxxxx v xxxxx xxxxxxx eradikace nákazy.]] Poznámky Část X: — Xxxxxxx X.6.: Xxxxx xxxxxxxxxx xx xxxxxxx v Evropské xxxx: xxxx xxxxxxx xx xxxxx vyplnit xxxxx xxxxx, xxxxx-xx xx o osvědčení xxx zboží xxxxxx xxx xxxxxxx xxxx Xxxxxxxxx unii; xxxx xx xxxxxxx, xxxxx-xx xx o xxxxxxxxx xxx zboží xxxxxxxx xx Xxxxxxxx xxxx. — Xxxxxxx X.12.: Xxxxx xxxxxx: xxxx kolonku xx třeba xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx zboží xxxxxx xxx xxxxxxx. Xxxxxxxx xxx být při xxxxxxxx skladovány pouze xx xxxxxxxxxx xxxxxxx, xxxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxx. — Kolonka X.15.: Registrační xxxxx (xxxxxxxxxxxx vagonů xxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) xxxx název (xxxxxxxx); xxxxxxxxx xx xxxxx poskytnout x xxxxxxx xxxxxxxx a xxxxxxxxxx naložení. — Xxxxxxx X.19.: Použijte xxxxxxxxx xxx XX: 05.08, 28.35.25, 28.35.26, 29.22, 35.02, 35.03 nebo 35.04. — Xxxxxxx I.23.: X případě xxxxxxxxxx xxx xxxxx ložené xxxxx musí xxx xxxxxxx xxxxx xxxxxxxxxx x (xxxxxxxx) xxxxx xxxxxx. — Kolonka X.25.: Xxxxxxxxx xxxxxxx: jakékoli xxxx využití xxxxx xxxxxx xxxxxxxxxxxxx zvířat xxxxxx xxx xxxxxxxxxxxx xxxxxx x xxxxxx xxxx xxxxxxxxxx krmiv xxx xxxxxxx x xxxxxxxx chovu. — Kolonky X.26. a X.27.: Xxxxxxx xxxxx xxxx, xxxxx-xx xx o xxxxxxxxx xxx xxxxxxx xxxx pro xxxxx. — Xxxxxxx I.28.: — Xxxx: xxxxxxx: Xxxx, Xxxxxxxxxx, Xxxxxx, Xxxxxxxx xxxxx Xxxxxxxxxx xxxx Xxxxxx, Xxxxx, Xxxxxxxx, Xxxxxxxxx, xxxxxxxxxx xxxxx Xxxxxxxx x Xxxxxxxxx.  Text obrazu Text obrazu
ZEMĚ Hydrolyzované xxxxxxxxx, xxxxxxxxxxxxxxxxxxx vápenatý x fosforečnan xxxxxxxx, xxxxx nejsou xxxxxx x xxxxxx spotřebě, x xxxxxxx xxxx xxxxx surovina nebo xxxx xxxxxxxx řetězec II. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. — Druh xxxxx: xxxxxxxxx, xxxxx-xx xx o xxxxxxxxxxxxx xxxxxxxxx, xxxxxxxxxxxxxxxxxxx xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx. — Xxxxxxx xxxxx: vyplňte xxxxx xxxxxxxxxx zařízení, x němž xxxxxxxx xxxxxxxx xxxx zpracování. Část XX: (1x) Xx. věst. X 300, 14.11.2009, x. 1. (1b) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Xxxxxxxx se xxxxxxxx. (3) Xx. xxxx. X 147, 31.5.2001, s. 1. (4) Úř. věst. X 94, 1.4.2006, x. 28. — Barva xxxxxxx a xxxxxxx xx musí xxxxx xx barvy xxxxx. — Xxxxxxxx xxx xxxxx xxxxxxxxxxx za xxxxxxx x Evropské unii: xxxx osvědčení xxxxxx xxxxx k xxxxxxxxxxxx xxxxxx x xxxx xxxxxxx xxxxxxxx xx xx okamžiku, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxx xxxxxx xx Evropské xxxx. Xxxxxx veterinární xxxxx / úřední xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x titul: Datum: Podpis: Razítko: |
|
6) |
Kapitola 18 xx nahrazuje xxxxx: „XXXXXXXX 18 Xxxxxxxxxxx osvědčení pro xxxx x výrobky x nich (xxxxx xxxxxx xxxxxx) a xxxxxx x xxxxxxxx x výrobky z xxxx (kromě moučky x xxxxx x xxxxxxxx) x xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxx látek xxxxxx k xxxxxxxx xx Xxxxxxxx xxxx xxxx k xxxxxxxx xxxx xxxx xxxxx (2)  &xxxx;Text obrazu &xxxx;Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx do XX Xxxx I: Xxxxxxxxxxx x xxxxxxxx zásilce I.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Xxxxx xxxxxxx xxxxxxxxx X.2.x. X.3. Příslušný xxxxxxxx xxxxx X.4. Příslušný xxxxxx xxxxx X.5. Xxxxxxxx Xxxxx Xxxxxx XXX Xxx. X.6. Xxxxx xxxxxxxxxx xx xxxxxxx x XX Xxxxx Xxxxxx XXX Xxx. X.7. Xxxx xxxxxx Xxx XXX X.8. Region xxxxxx Xxx X.9. Xxxx xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Xxxxx xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx schválení Adresa Název Xxxxx xxxxxxxxx Xxxxxx X.12. Xxxxx xxxxxx Xxxxx sklad Název Xxxxx xxxxxxxxx Xxxxxx XXX X.13. Místo nakládky I.14. Xxxxx xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Plavidlo Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX X.17. Xxxxx/xxxxx XXXXX X.18. Xxxxx xxxxx X.19. Xxx xxxxx (xxx XX) 05.07 X.20. Xxxxxxxx X.21. Xxxxxxx produktů Okolní Xxxxxxxx Xxxxxxxx X.22. Počet balení I.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Xxxx xxxxx  Text obrazu Text obrazu
X.25. Xxxxx xxxxxxxxx pro: Další zpracování Xxxxxxxxx xxxxxxx X.26. Xxx xxxxxxx xxxx XX xx třetí xxxx Xxxxx xxxx Xxx XXX X.27. Xxx xxxxx xxxx xxxxxx xx XX X.28. Xxxxxxxxxxxx xxxxx Xxxxx schválení xxxxxxxx Xxxx (xxxxxxx xxxxx) Xxxxxxx xxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxx x výrobky x xxxx (kromě xxxxxx xxxxxx) x xxxxxx a xxxxxxxx x xxxxxxx x xxxx (xxxxx moučky x xxxxx x xxxxxxxx) k xxxxxx xxxxxxxxxxx xxxxxx nebo xxxxxxxxx xxxxxxx xxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. Xx, níže xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxx, že xxxx xxxxxxx x xxxxxxxxx nařízení Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x. 1069/2009 (1x) x nařízení Xxxxxx (XX) x. 142/2011 (1b), xxxxxxx xxxxx xxx o xxxxxxx XXX xxxxxxxx XX xxxxxxxxx nařízení, x potvrzuji, xx xxxx xxxxxxx xxxx x xxxxxxx x xxxx (xxxxx xxxxxx xxxxxx) a xxxxxx x xxxxxxxx x xxxxxxx x nich (xxxxx xxxxxx z xxxxx x xxxxxxxx) (2) XX.1. pocházejí xx xxxxxx (2) xxx [xxxxx xxxx poražena xx xxxxxxx a xxxxx xxxx po prohlídce xxxx xxxxxxxx shledána xxxxxxxx pro účely xxxxxxx x xxxxxx xxxxxxxx;] (2) xxxx [xxxxx xxxxxxxxxxxx xxxxx klinické xxxxxxxx xxxxxxxxxx přenosného xxxxx xxxxxxxxx xx xxxxxxx xx zvířata;] II.2. xxxx a výrobky x xxxx, kopyta x paznehty x xxxxxxx z xxxx xxxxxx xxxxxxxx xxxxxxxxx xx xxxx xxxxx xxxxxx xxx xxxxxxx x xxxxx xxxxxxx 80 °C; II.3. xxxx xxxx xxxxxxxx xxx, xx nedošlo k xxxxxxxx xxxxxx xxxxxxx; XX.4. xx xxxxx fázích xxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxx xxxx uplatněna xxxxxxx preventivní opatření x xxxxxxxxx xxxxxxx xxxxxxxxxxx; XX.5. xxxx x xxxxxxx x xxxx (xxxxx xxxxxx xxxxxx) x xxxxxx x xxxxxxxx x výrobky x xxxx (kromě xxxxxx x xxxxx x paznehtů) xxxx xxxxxxxx: (2) buď [xx xxxxxx xxxxx xxxx xxxxx;] (2) xxxx [ve xxxxxxxxx nebo kontejnerech xxx xxxxx ložené xxxxx, které byly xxxx xxxxxxxxx vydezinfikovány xxxxxxxxxxxx xxxxxxxxxxx schváleným xxxxxxxxxx orgánem;] a xxxxx xxxx xxxxxx x xxxxxxxxxx xxxx xxxxxxxx xxx, xx xxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx (3) x xxxx xxxxxxxx xxxxxxxxx x xxxxxxx „XXXX XXXXXX X XXXXXX XXXXXXXX XXX XX XXXXXX ZVÍŘAT“ x xxxxxx x xxxxxxx xxxxxxxx xxxxxx;] (2) [XX.6. xxxx xxxxxxx xxxx x xxxxxxx x nich (xxxxx xxxxxx moučky) x xxxxxx a xxxxxxxx x výrobky z xxxx (xxxxx xxxxxx x xxxxx x xxxxxxxx) (2) xxx [xxxx xxxxxxx x přežvýkavců xxxxxx xxx xxxx, xxxx xxxx xxxx.]] (2) xxxx [xxxx xxxxxxx xx xxxxx, xxxx xxxx xxx x xxxxxxxxxx xxxx uvedené xxxxxx xxx x xxxx xxxxxx získány: (2) xxx [materiál xxxxxxxxxxx xx skotu, xxxx x xxx xxxxxx xxx narozených, xxxxxxxxxxx xxxxxxxxx a xxxxxxxxxx x xxxx xxxx xxxxxxx xxxxxxxx x xxxxxxx s rozhodnutím 2007/453/XX do xxxxxxxxx xxxx nebo oblasti xx zanedbatelným xxxxxxx xxxxxxx BSE.] (2) xxxx [x) xxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxx xx xxxxxxxxx v xxxx 1 xxxxxxx V xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x. 999/2001 (4); x) xxxxxxx oddělené maso xxxxxxx x kostí xxxxx, xxxx xxxx xxx s výjimkou xxxxxx xxxxxxxxxx, nepřetržitě xxxxxxxxx a poražených x xxxx xxxx xxxxxxx zařazené x xxxxxxx s xxxxxxxxxxx Xxxxxx 2007/453/XX (5) xx xxxxxxxxx xxxx xxxx xxxxxxx se xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX, x nichž xxxxx xxxxxxx xxxxx xxxxxx xxxxxx XXX; x) xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxx získaný xxxxxxx xx skotu, xxxx xxxx koz, xxxxx xxxx xx xxxxxxxx xxxxxxxx lacerací xxxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxx lebeční nebo xxxxxxxxxxxxxxx xxxxxxx xxxxxxx xx dutiny lebeční, x xxxxxxxx xxxxxx xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx x poražených x xxxx nebo oblasti xxxxxxxx v xxxxxxx x xxxxxxxxxxx 2007/453/XX xx xxxxxxxxx xxxx xxxx xxxxxxx se xxxxxxxxxxxxx xxxxxxx xxxxxxx XXX.]]] Xxxx XX: Xxxxxxxxx  Text obrazu Text obrazu
XXXX Xxxx a xxxxxxx x xxxx (kromě xxxxxx xxxxxx) a xxxxxx x paznehty x výrobky x xxxx (kromě moučky x xxxxx x xxxxxxxx) k výrobě xxxxxxxxxxx xxxxxx nebo xxxxxxxxx xxxxxxx xxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. Poznámky Část X: — Xxxxxxx I.6.: Osoba xxxxxxxxxx xx xxxxxxx x Evropské unii: xxxx xxxxxxx je xxxxx xxxxxxx xxxxx xxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxx xxx xxxxxxx xxxx Evropskou xxxx; xxxx se xxxxxxx, xxxxx-xx xx x xxxxxxxxx xxx xxxxx xxxxxxxx do Xxxxxxxx xxxx. — Xxxxxxx X.11. x X.12.: Xxxxx xxxxxxxxx: xxxxx xxxxxxxxxx zařízení xxxx xxxxxxx, xxxxx bylo xxxxxx xxxxxxxxxx xxxxxxx. — Xxxxxxx X.12.: Místo xxxxxx: tuto xxxxxxx xx xxxxx xxxxxxx xxxxx xxxxx, jedná-li xx o xxxxxxxxx xxx zboží xxxxxx xxx xxxxxxx. Xxxxxxxx xxxx xxx xxx xxxxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxx pásmech, xxxxxxxxxx xxxxxxxx x xxxxxxx skladech. — Xxxxxxx X.15.: Xxxxxxxxxxx xxxxx (xxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxx a xxxxxxxxxx xxxxxxxxxx), xxxxx xxxx (xxxxxxx) xxxx xxxxx (xxxxxxxx); informace je xxxxx xxxxxxxxxx x xxxxxxx vykládky x xxxxxxxxxx xxxxxxxx x Xxxxxxxx unii. — Xxxxxxx X.23.: X xxxxxxx xxxxxxxxxx xxx volně xxxxxx látky musí xxx xxxxxxx xxxxx xxxxxxxxxx a (xxxxxxxx) xxxxx xxxxxx. — Xxxxxxx X.25.: Xxxxxxxxx xxxxxxx: xxxxxxxx xxxx xxxxxxx xxxxx krmení zvířat. — Xxxxxxx X.26. x X.27.: Xxxxxxx xxxxx xxxx, jedná-li se x osvědčení pro xxxxxxx xxxx xxx xxxxx. — Kolonka I.28.: Xxxx zboží. Část XX: (1x) Xx. xxxx. X 300, 14.11.2009, s. 1. (1x) Xx. xxxx. X 54, 26.2.2011, x. 1. (2) Nehodící xx xxxxxxxx. (3) Druh xxxxxxxx: rohy x xxxxxxx x nich, xxxxxx a xxxxxxxx x xxxxxxx x xxxx. (4) Xx. věst. X 147, 31.5.2001, x. 1. (5) Xx. xxxx. X 172, 30.6.2007, s. 84. — Xxxxx podpisu a xxxxxxx se xxxx xxxxx xx xxxxx xxxxx. — Xxxxxxxx xxx xxxxx zodpovědnou xx xxxxxxx x Evropské xxxx: toto xxxxxxxxx xxxxxx xxxxx x xxxxxxxxxxxx účelům a xxxx zásilku xxxxxxxx xx do xxxxxxxx, xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx v xxxxx xxxxxx xx Xxxxxxxx xxxx. Xxxxxx veterinární xxxxx / xxxxxx xxxxxxxxx Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx: Xxxxx: Xxxxxx: Xxxxxxx: |
|
7) |
Xxxxxxxx 20 xx xxxxxxxxx tímto: „KAPITOLA 20 Xxxx xxxxxxxxxx Xxxxxxxxxx x&xxxx;xxxxxx do Xxxxxxxx xxxx xx xxxxxxx zemí x&xxxx;x&xxxx;xxxxxxxx xxxx její xxxxx (2) xxxxxxxx xx xxxxxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxx léčivých přípravků, xxxxxxxxxxxxxx xxxxxxxxxx pro xxxxxxxx a veterinární účely, xxxxxxxxx xxxxxxxxxxxxxxx zdravotnických xxxxxxxxxx, diagnostických zdravotnických xxxxxxxxxx xx vitro xxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx, laboratorních xxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxx  &xxxx;Text obrazu &xxxx;Text obrazu
XXXX: Xxxxxxxxxxx xxxxxxxxx xx EU Část X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx X.1. Xxxxxxxxxx Xxxxx Xxxxxx Xxx. X.2. Číslo xxxxxxx osvědčení I.2.a. I.3. Xxxxxxxxx xxxxxxxx xxxxx X.4. Xxxxxxxxx xxxxxx xxxxx X.5. Příjemce Název Adresa PSČ Tel. I.6. Xxxxx zodpovědná xx xxxxxxx x EU Jméno Adresa PSČ Tel. I.7. Xxxx xxxxxx Xxx XXX X.8. Xxxxxx původu Kód I.9. Země xxxxxx Xxx XXX X.10. Xxxxxx xxxxxx Xxx X.11. Místo původu Název Xxxxx xxxxxxxxx Xxxxxx Xxxxx Xxxxx xxxxxxxxx Xxxxxx Xxxxx Číslo xxxxxxxxx Xxxxxx X.12. Xxxxx určení Celní xxxxx Xxxxx Xxxxx schválení Adresa PSČ I.13. Xxxxx xxxxxxxx X.14. Datum xxxxxxx X.15. Xxxxxxxx xxxxxxxxxx Xxxxxxx Xxxxxxxx Xxxxx Xxxxxxxx xxxxxxx Xxxxxxx Xxxxxxxxxxxx Xxxxx xx xxxxxxxx X.16. Vstupní xxxxxxxxxx hraniční kontroly XX X.17. X.18. Xxxxx zboží I.19. Xxx zboží (xxx XX) X.20. Xxxxxxxx X.21. Teplota xxxxxxxx Xxxxxx Chlazené Xxxxxxxx X.22. Xxxxx balení I.23. Xxxxx xxxxxx/xxxxxxxxxx X.24. Druh xxxxx  Text obrazu Text obrazu
X.25. Xxxxx osvědčené xxx: Xxxxxxxxx xxxxxxx X.26. Pro xxxxxxx xxxx XX xx xxxxx xxxx Xxxxx xxxx Xxx ISO I.27. Xxx dovoz nebo xxxxxx do EU I.28. Xxxxxxxxxxxx xxxxx Xxxxx schválení xxxxxxxx Xxxx (xxxxxxx název) Výrobní xxxxx Xxxxx xxxxxxxx Xxxxx xxxxx  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxx xxxxxx pro xxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxx pro xxxxxxxx x veterinární xxxxx, xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx in xxxxx pro lékařské x veterinární xxxxx, xxxxxxxxxxxxx činidel a xxxxxxxxxxxx xxxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx jednací xxxxxxxxx XX.x. XXXXXXXXXX Xx, xxxx podepsaný, xxxxxxxxxx, xx xxxx xxxxxxx xxxxxxxxxxx je xxxxx x xxxxxx xx Xxxxxxxx unie xxxx x tranzitu xxxx území Xxxxxxxx xxxx a xx xxxxxxxx xxxxxxxx v xxxxxxx X bodě 35 nařízení Komise (XX) č. 142/2011(1x) x xxxxxxx xx: 1) xx určen pro xxxxxx: (2) xxx [- xxxxxxxx xxxxxxxxx,] (2) x/xxxx [- veterinárních xxxxxxxx xxxxxxxxx,] (2) x/xxxx [- xxxxxxxxxxxxxx xxxxxxxxxx pro xxxxxxxx x xxxxxxxxxxx xxxxx,] (2) a/nebo [- xxxxxxxxx xxxxxxxxxxxxxxx zdravotnických xxxxxxxxxx,] (2) x/xxxx [- xxxxxxxxxxxxxx xxxxxxxxxxxxxx prostředků xx vitro xxx xxxxxxxx x veterinární xxxxx,] (2)x/xxxx [- xxxxxxxxxxxxx xxxxxxx,] (2) x/xxxx [- xxxxxxxxxxxx xxxxxxxxxx;] 2) xxxx xxxx xxxxxx, zpracování x xxxxxx xxxx xxxxx xxxxxxxxx, a xx xxxx možné xxxxxxxxxxx xxxxxxxx xxxxx xxxx jako složku xxxxxxxx určeného k xxxxxxxxx xxxxx, vyžaduje xxxx xxxxx xxxxxxx xxxx xxxxxxxxxxxxxx xxxxx, xxxx xx míšení, xxxxxxxxxx, montování xxxx xxxxxx, xxx xxx xxxxxxxxx x xxxxxxx xx xxx xxxx xx xxxxxxx xxxx xxxxxx xxxxxxxxx, xxxxxxxxxxx xxxxxx xxxxxxxxx, zdravotnický xxxxxxxxxx pro xxxxxxxx x veterinární xxxxx, xxxxxxx xxxxxxxxxxxxx zdravotnický xxxxxxxxxx, xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx in vitro xxx lékařské x xxxxxxxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxxxx v xxxxxxx x xxxxxxxx xxxxxxxx Xxxxxxxx xxxx (1x), xxxxx xx xx xxxx produkty xxxxxxxx, xxxx jako xxxxxxxxxxx činidlo; 3) xxx xxxxxx z: (2) buď [- xxxxxxxxx, jenž xxxx pocházet ze xxxxxx, která xxxx xxxxxxxxx xxxxxxxxxxx ošetření xxxxx xxxxxxxx x xx. 1 xxxx. 2 xxxx. x) xxxxxxxx Xxxx 96/22/XX (2x) xxxx v xx. 2 písm. x) směrnice Xxxx 96/23/XX (2x);] (2) a/nebo [- xxxx poražených xxxxxx x xxxxxx xxxxx, nebo x xxxxxxx xxxxx xxxx xxxxxxxxxx xxxxxx xxxx xxxxxx části, xxxxx xxxx xxxxx právních xxxxxxxx Unie xxxxxx x lidské spotřebě, xxxxx z xxxxxxxxxx xxxxxx xxxxxx x xxxxxx spotřebě určeny;] (2) x/xxxx [- jatečně xxxxxxxx xxxx x xxxx uvedené části xxxxxxxxxxx xxx ze xxxxxx, xxxxx xxxx xxxxxxxx na jatkách x xx prohlídce xxxx xxxxxxxx xxxx xxxxxxxx jako xxxxxxxxx x xxxxxxx k xxxxxx xxxxxxxx, xxxx xxxx a xxxx xxxxxxx xxxxx zvěře xxxxxxxx x xxxxxx xxxxxxxx x xxxxxxx x právními xxxxxxxx Xxxx: x) jatečně xxxxxxxx xxxx nebo těla xxxxxx x jejich xxxxx, které byly x xxxxxxx x xxxxxxxx předpisy Xxxx xxxxxxxxxx xx xxxxxxxx x xxxxxx xxxxxxxx, xxxxx nevykazovaly žádné xxxxxxxx xxxxxxxxxx přenosného xx člověka nebo xxxxxxx; xx) hlavy drůbeže; iii) xxxx x kožky, xxxxxx xxxxxx odřezků x plátků, xxxx x končetiny, včetně xxxxxx prstů, xxxxxxxxxx x záprstních xxxxxx, xxxxx x xxxxxxx, xxxxxx jiných než xxxxxxxxxxx; xx) xxxxxxx štětiny; v) xxxx;] Xxxx II: Osvědčení  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxx určené xxx xxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxxx prostředků xxx xxxxxxxx a xxxxxxxxxxx xxxxx, aktivních implantabilních xxxxxxxxxxxxxx prostředků, diagnostických xxxxxxxxxxxxxx xxxxxxxxxx xx xxxxx xxx xxxxxxxx x xxxxxxxxxxx účely, xxxxxxxxxxxxx xxxxxxx a xxxxxxxxxxxx xxxxxxxxxx XX. Zdravotní xxxxxxxxx XX.x. Xxxxx xxxxxxx xxxxxxxxx XX.x. (2) x/xxxx [- xxxx xxxxxx jiných xxx přežvýkavců, která xxxxxxxxxxxx žádné xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxx xx člověka xxxx xxxxxxx, xxxxx xxxx xxxxxxxx xx xxxxxxx x xxxxx xxxx xx xxxxxxxxx před xxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxx porážky x xxxxxx spotřebě x xxxxxxx s xxxxxxxx xxxxxxxx Xxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxx xxxxxx xxxxxxxx určených x xxxxxx xxxxxxxx, xxxxxx xxxxxxxxxxx xxxxx, xxxxxxx nebo xxxx x xxxxxxxxxxx xxxx xxxxxxxxxx xx zpracování xxxxx;] (2) x/xxxx [- xxxxxxxx xxxxxxxxxxx původu xxxx potravin xxxxxxxxxxxx xxxxxxxx živočišného xxxxxx, xxxxx x obchodních xxxxxx nebo x xxxxxx xxxxxxxx způsobených xxxxxxxxx vadami, xxxxxx xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx xxxxxxxx xxxxx xxxxxx xxx xxxxxx xxxx xxx xxxxxx, xxx xxxxxx xxxxxx x xxxxxx spotřebě;] (2) x/xxxx [- xxxxx xxx xxxxxxx x xxxxxxxx xxxxx a xxxxx xxxxxxxxxxx původu xxxx xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu xx xxxxxxx produkty, xxxxx x xxxxxxxxxx xxxxxx nebo x xxxxxx xxxxxxxx způsobených xxxxxxxxx xxxxxx, vadami xxxxxx xxxx xxxxxx xxxxxxxx, x xxxxx xxxxxxxx žádné xxxxxx xxx zdraví xxxx xxx xxxxxx, již xxxxxx xxxxxx xx xxxxxx;] (2) x/xxxx [- xxxx, xxxxxxxx, vlny, xxxx, xxxxx, xxxx, xxxxxxx xxxxx x xxxxxxxx x xxxxxxxx xxxxx xxxxxxxxxxxxx xx xxxxxx xxxxxx, která xxxxxxxxxxxx xxxxx příznaky xxxxxxxxxx přenosného xxxxx xxxxxxxxx xx xxxxxxx xxxx xxxxxxx;] (2) x/xxxx [- vodní xxxxxxxxxxx x xxxxxx xxxxx, xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx,] (2) a/nebo [- xxxxxxxxxx produktů živočišného xxxxxx x vodních xxxxxxxxx pocházejících x xxxxxxx xxxx zařízení xx xxxxxx xxxxxxxx xxxxxxxx k lidské xxxxxxxx;] (2) a/nebo [- xxxx xxxxxxxxx materiálu xxxxxxxxxxxxx xx xxxxxx, xxxxx nevykazovala xxxxx xxxxxxxx xxxxxxxxxx přenosného xxxxx materiálem xx xxxxxxx xxxx xxxxxxx: x) xxxxx xxxxxxx x xxxxxx s xxxxxxx xxxxxxx xxxx masem; ii) xxxxx materiál pocházející xx suchozemských xxxxxx: — xxxxxxxx xxxxxxxx x xxxxx, — xxxxx, — vedlejší xxxxxxxx x xxxxx, xxxxxx vaječných xxxxxxxx; xxx) xxxxxxxxxx xxxxxx xxxxxxxx x obchodních důvodů;] (2) x/xxxx [- xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xxxxx xxxxx patogenních xxx xxxxxxx nebo xxxxxxx;] (2) x/xxxx [- xxxxxx x xxxx xxxxxxxx (Xxxxxxxx) a xxxxxxxxx (Xxxxxxxxxx) a xxxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx 1 xxxxxxxxx v xx. 8 xxxx. x) xxxxxx xxx), xx) x x) a xxxxxxxxx kategorie 2 xxxxxxxxx v xx. 9 xxxx. x) xx x) nařízení (XX) č. 1069/2009;] (2) x/xxxx [- xxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxxxx: — xxxxx xxxxxxxxxxx a xxxxxx xxxxx, xxxxx xxxxxxxx xxxxx, xxxxx xxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxxxx, — vodní xxxx xxxxxxxxxxx bezobratlí xxxxxxxxxxx, xxxxx druhů xxxxxxxxxxx xxx xxxxxxx xxxx xxxxxxx, — xxxxxxx x xxxx xxxxxxxx (Xxxxxxxx) a zajícovců (Xxxxxxxxxx) x xxxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx 1 xxxxxxxxx x xx. 8 xxxx. x) bodech xxx), xx) a x) x materiálu xxxxxxxxx 2 xxxxxxxxx x čl. 9 xxxx. x) xx x) nařízení (ES) x. 1069/2009;]  Text obrazu Text obrazu
XXXX Xxxxxxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx přípravků, veterinárních xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxx pro xxxxxxxx x veterinární xxxxx, xxxxxxxxx implantabilních xxxxxxxxxxxxxx xxxxxxxxxx, xxxxxxxxxxxxxx zdravotnických xxxxxxxxxx xx vitro xxx xxxxxxxx a xxxxxxxxxxx xxxxx, laboratorních xxxxxxx x xxxxxxxxxxxx xxxxxxxxxx XX. Xxxxxxxxx xxxxxxxxx XX.x. Xxxxx xxxxxxx osvědčení II.b. (2) x/xxxx [- xxxxxx x jejich xxxxx, xxxxx zvířat a xxxxxx částí xxxxxxxxx x xxxxxx 8 xxxx 10 nařízení (XX) x. 1069/2009: i) xxxxxxx, xxxxx xxxxxxx xxxxx xxx xxxxxxxx xxxx usmrcením k xxxxxx spotřebě, včetně xxxxxx xxxxxxxxxx za xxxxxx tlumení xxxxxx; xx) xxxxx; xxx) xxxxxx, xxxxxx x xxxxxx, xxxxx xxxxxx určeny k xxxxxxx xxxxxx; x xx) xxxxxx odumřelá xx xxxxx;] (2) x/xxxx [- xxxxxxxxxx produktů xxxxxxxxxxx xxxxxx xxxxxx než xxxxxxxx kategorie 1 xxxx xxxxxxxx kategorie 3;] 4) jeho xxxxxx xxxx je označen xxxxxxx „XXXXX PRO XXXXXX XXXXXXXXX / XXXXXXXXXXX LÉČIVÉ PŘÍPRAVKY / XXXXXXXXXXXX XXXXXXXXXX XXX LÉKAŘSKÉ X XXXXXXXXXXX ÚČELY / XXXXXXX IMPLANTABILNÍ ZDRAVOTNICKÉ XXXXXXXXXX / XXXXXXXXXXXX XXXXXXXXXXXX PROSTŘEDKY XX XXXXX PRO LÉKAŘSKÉ X VETERINÁRNÍ XXXXX / LABORATORNÍ ČINIDLA / XXXXXXXXXX PROSTŘEDKY“ x xxxx x xxxxx xxxx xxxxx x žádnému xxxxxx xxxxxxx x xxxxx Xxxxxxxx xxxx; 5) zásilka xxxx xxxxxxxxx přímo xx xxxxx xxxxxx x Xxxxxxxx xxxx xxxxxxx x xxxxxxx X.12. xxxxxx prohlášení, xxxxxx xx: (2) xxx [xxxxxxxx xxxx xxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxx léčivých xxxxxxxxx, xxxxxxxxxxxxxx xxxxxxxxxx xxx lékařské x xxxxxxxxxxx účely, xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx prostředků, xxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xx xxxxx xxx xxxxxxxx x xxxxxxxxxxx xxxxx, xxxxxxxxxxxxx činidel xxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx(x) xxx(x) registrován(o) x souladu s xxxxxxx 23 xxxxxxxx (XX) x. 1069/2009,] (2) xxxx [xxxxxxxx nebo xxxxxx, xxxxx(x) xxx(x) xxxxxxxx(x) v souladu x čl. 24 xxxx. 1 písm. x) nařízení (XX) x. 1069/2009, xxxxx xxx být xxxxxxxx xxxxx xx zařízení xxxx xxxxxxx xxxxxxxxx x xxxxxxxxx odrážce xxxxxx xxxx.] Xxxxxxxx — Xxxxxxx X.19.: Xxxxxxxx příslušný xxx xxxxxxxxxxxxxxx systému (XX) x xxxxxxx x xxxxxxxxxxx Xxxxxx 2007/275/XX xx dne 17. xxxxx 2007 x xxxxxxxxx zvířat x xxxxxxxx, na xxx xx xxxxxxxx xxxxxxxx na xxxxxxxxxxxx xxxxxxxx kontroly podle xxxxxxx Rady 91/496/XXX x 97/78/XX (Xx. xxxx. X 116, 4.5.2007, s. 9). — Xxxxxxx X.25.: Technické xxxxxxx: xxxxxxxx xxxx xxxxxxx kromě krmení xxxxxx. (1x) Úř. věst. X 54, 26.2.2011, x. 1. (1b) Xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 2001/82/ES ze xxx 6. xxxxxxxxx 2001 x kodexu Xxxxxxxxxxxx týkajícím xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx (Xx. xxxx. L 311, 28.11.2001, x. 1), xxxxxxxx Evropského xxxxxxxxxx x Rady 2001/83/XX ze xxx 6. listopadu 2001 x kodexu Společenství xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxx (Xx. xxxx. X 311, 28.11.2001, s. 67), xxxxxxxx Rady 93/42/EHS xx xxx 14. xxxxxx 1993 x xxxxxxxxxxxxxx prostředcích (Xx. xxxx. L 169, 12.7.1993, s. 1), xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 98/79/ES xx dne 27. xxxxx 1998 x xxxxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xx xxxxx (Úř. xxxx. X 331, 7.12.1998, x. 1), xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (XX) x. 1223/2009 ze xxx 30. xxxxxxxxx 2009 x xxxxxxxxxxxx xxxxxxxxxxx (Úř. věst. X 342, 22.12.2012, x. 59), podle xxxxxxx. (2) Xxxxxxxx xx xxxxxxxx. (2x) Xx. věst. X 125, 23.5.1996, x. 3. (2x) Úř. xxxx. L 125, 23.5.1996, s. 10. Xxxxxxx Xxxxx (xxxxxxxx xxxxxx): Adresa: Datum: Xxxxxx: |


