XXXXXXXX KOMISE (ES) x.&xxxx;429/2008
xx dne 25. dubna 2008
x&xxxx;xxxxxxxxxxx pravidlech k nařízení Xxxxxxxxxx parlamentu x&xxxx;Xxxx (XX) x.&xxxx;1831/2003, xxxxx xxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx xxxxx
(Xxxx x&xxxx;xxxxxxxx xxx XXX)
XXXXXX EVROPSKÝCH XXXXXXXXXXXX,
x&xxxx;xxxxxxx na Xxxxxxx x&xxxx;xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
x&xxxx;xxxxxxx xx xxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (ES) x.&xxxx;1831/2003 xx dne 22.&xxxx;xxxx 2003 o doplňkových xxxxxxx používaných xx xxxxxx xxxxxx (1), x&xxxx;xxxxxxx xx čl. 7 xxxx.&xxxx;4 x&xxxx;5 uvedeného xxxxxxxx,
xx xxxxxxxxxx x&xxxx;Xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;7 xxxx.&xxxx;4 x&xxxx;5 xxxxxxxx (XX) x.&xxxx;1831/2003,
xxxxxxxx k těmto důvodům:
|
(1) |
Je xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx jde x&xxxx;xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxxx xxxxxxxx (XX) x.&xxxx;1831/2003, xxxxxx xxxxxxxx pro vypracování x&xxxx;xxxxxxxx žádostí x&xxxx;xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx. Xxxx pravidla xxxx nahradit ustanovení x&xxxx;xxxxxxx směrnice Rady 87/153/XXX (2), kterou se xxxxxxx hlavní xxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxx xxxxxx. |
|
(2) |
Xxxx pravidla by xxxx xxxxxxxx xxxxxxxxx, xxxxx xxxx splňovat xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx. Xxxx xx xxxxxxx xxxxx vědecké xxxxx, xxxxx xxxx být xxxxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx doplňkové látky, x&xxxx;xxxxxx, xxx xxxx xxx předloženy s cílem xxxxxxxx její účinnost x&xxxx;xxxxxxxxxx pro xxxxxxx, xxxxxxx x&xxxx;xxxxxxx prostředí xx xxxxxx xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx Xxxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxxxxx (xxxx xxx „xxxx“). |
|
(3) |
Xxxxx xxxxxx xxxxxxxxx látky xxxx xxxxxxxxxxxx xxxxxxxx xxx xxxxx xx xxxx xxxxxx xxxxxx potřebných x&xxxx;xxxxxxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxx lišit. Xxxxxxxx xx xxxxx měly xxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx, xxxxx xxx o druh studií x&xxxx;xxxxxxxxx, jež xxxx xxx předloženy k prokázání xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx. Subjekty, xxxxx využijí xxxx xxxxxxxxx, by xxxx x&xxxx;xxxxxxxxxxx xxxx výběr xxxxxxxxx. |
|
(4) |
Xxxx xx měl xxx možnost xxxxxxxxx xxxxxxxxx doplňkové xxxxxxxxx, xxx mohl určit, xxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxx xxxxxxxx podle článku 5 xxxxxxxx (XX) x.&xxxx;1831/2003. |
|
(5) |
Xx xxxxxxxx používat xxxxxxxxx xxxxx xxxxxxx při xxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xxxxx určené x&xxxx;xxxxxxx x&xxxx;xxxxxx (krmivech) xxxx xxxx, xxx xxxx zajištěno, že xxxxxxxx laboratorních xxxxxxx xxxxxx xxxxxxxxxxx. |
|
(6) |
X&xxxx;xxxxxxx xxxxxxxx xx měly být xxxxxxxxx xxxxxxxx xxxxxxxxx xxx jednotlivé xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxx x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 nařízení (XX) x.&xxxx;1831/2003. |
|
(7) |
X&xxxx;xxxxx xxxxxxxx xxxxx o získání povolení xxx menšinové druhy xxx současném xxxxxxxxx xxxxxxxx úrovně bezpečnosti xx xxxx xxx xxxxxxxxx zvláštní xxxxxxxx xxx xxxxxxxxxxx k možnosti xxxxxxxxxxx výsledků xxxxxx xxxxxxxxxxx xx většinových xxxxxxx na xxxxx xxxxxxxxx. |
|
(8) |
Xxxxxxxxx pravidla týkající xx xxxxxxx o povolení xx měla vzít x&xxxx;xxxxx xxxxx xxxxxxxxx xx zvířata xxxxxx x&xxxx;xxxxxxxx potravin x&xxxx;xxxxxxx xxxxxxx, xxx xxx xxxxxxx týkající xx xxxxxxxxxxx xxxxxxxxxxx pro xxxxxxx xxxx spotřebitele xxxxxx xxxxxxxx. |
|
(9) |
Xxxxxxx xxxxxxx xxxxxxxxxxxx používání laboratorních xxxxxx x&xxxx;xxxxxxxx xx xxxxx vědeckým xxxxxx x&xxxx;xxxxxxxxx na zvířatech xxxxx xxxxxxxx Rady 86/609/XXX xx dne 24.&xxxx;xxxxxxxxx 1986 x&xxxx;xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xx ochrany xxxxxx xxxxxxxxxxx xxx xxxxxxx x&xxxx;xxxx xxxxxxx xxxxx (3) xx xxxx být xxxxxxxxx. |
|
(10) |
Xxx se xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx, xxxx xx xxx xxxxxxxxx zjednodušené xxxxxxx xxx povolování doplňkových xxxxx, které xxx xxxx xxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxxxxx. |
|
(11) |
Xx xx xxxx xxxxxxxxxxx xxxxx, xxxxx xxxx xxxxx xxxxxxxx Rady 70/524/XXX (4) xxxxxxxx bez časového xxxxxxx, xxxx xx xxx popřípadě xxxxxxxxx xxxxxxx, xxx x&xxxx;xxxxxxx, xx xxxxxx x&xxxx;xxxxxxxxx xxxxx xxxxxx, xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxx, xxxxx xxxx x&xxxx;xxxxxxxxx k prokázání xxxxxxxxx, zejména materiálů xxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx dotyčné xxxxxxxxx látky. |
|
(12) |
Je xxxxx xxxxxxxx pravidla xxx xxxxxxx o změny xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;13 xxxx.&xxxx;3 xxxxxxxx (ES) č. 1831/2003. |
|
(13) |
Je xxxxx stanovit xxxxxx xxxxxxxx pro xxxxxxx x&xxxx;xxxxxxxx povolení podle xxxxxx&xxxx;14 xxxxxxxx (ES) x.&xxxx;1831/2003. |
|
(14) |
Xx xx xxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx, xxx xx xxxxx xxxxxxx na xxxxxxx xxxxxxx, xx xxxxxxxx stanovit xxxxxxxxx xxxxxx, xxxxx něhož xx xxxxx nadále xxxxxxxx xxxxxxxxx pravidla. X&xxxx;xxxxxxxx xxxxxxxx před xxxxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx xx xx xxxx i nadále xxxxxxxx x&xxxx;xxxxxxx s přílohou xxxxxxxx 87/153/XXX. Xxxxx xxx x&xxxx;xxxxxxx podané xxxxx xxxxxxxx období xx xxxxxx x&xxxx;xxxxxxxx, žadatelé xx xxxxxxxx x&xxxx;xxxxxx xxxx xxxxxxxx xxx xxxxxxx xxxxxx xxxx xxx xxxxxxx výběru xxxx pravidly xxxxxxxxxxx x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx 87/153/XXX. Prováděcí xxxxxxxx xxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxxx a technických xxxxxxxx x&xxxx;x&xxxx;xxxxxxx nutnosti xx xxxx být xxxxxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx x&xxxx;xxxx xxxxxxx. |
|
(15) |
Xxxxxxxx tohoto xxxxxxxx xxxx x&xxxx;xxxxxxx xx stanoviskem Xxxxxxx xxxxxx pro xxxxxxxxxxx xxxxxxx x&xxxx;xxxxxx zvířat, |
PŘIJALA XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxx
Xxx xxxxx xxxxxx xxxxxxxx xx použijí xxxx definice:
|
1. |
„xxxxxxx x xxxxxxxx xxxxx x xxxxxxxxx zvířaty, xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx“ se xxxxxx xxxxxxx druhů, xxx xxxx xxxxxxxx xxxxxx, xxxxxxx xxxx xxxxxx xxxxxxxx, xxxxxx xxxx xxxxxx pro xxxxxxx xxxxxxxx, vyjma xxxx; |
|
2. |
„xxxxxxxxxxx xxxxx“ xx xxxxxx zvířata xxxxxx x xxxxxxxx xxxxxxxx xxxx xxx xxxx (xxxxxxx xxxxxxx xxx xxxxx x xxxx, xxxxxx xxxxx), xxxx (xxxxxxx xxxxxxx xxx xxxx), xxxxxxx, xxxxxx (xxxxxx xxxxxx), xxxxx x xxxx druhu Xxxxxxxxxx. |
Xxxxxx 2
Xxxxxx
1. Xxxxxx o povolení xxxxxxxxx xxxxx xxxxx článku 7 xxxxxxxx (ES) x. 1831/2003 xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx v příloze I.
X xxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxx xxxxxx 3 (xxxx xxx „dokumentace“), xxxxx xxxxxxxx xxxxx a dokumenty xxxxxxx x xx. 7 odst. 3 xxxxxxxx (ES) x. 1831/2003.
2. Xxxxx xxxxxxx x xxxxxxx x xxxxxxx 18 xxxxxxxx (ES) č. 1831/2003 xxxxxxxx, aby xx x xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxx 1 xxxxxxxxx xxxx x xxxxxxxxx xxxxx, xxxxxxxx xxx každý xxxxxxxx xxxx xxxx xxxxxxxxx ověřitelné xxxxxxxxxx, xx xxxxxxxxxx xxxxxx xxxxxxxxx xx xxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxxxx vůči xxxxxxxxxxx. Xxxxxxx části xxxxxxxxxxx xxxx xxx xxxxxxxxxx xxxxxxxx od xxxxxx xxxxxxxxxxx a nesmí xxx xxxxxxxx v souhrnu dokumentace xxxxx čl. 7 xxxx. 3 xxxx. x) xxxxxxxx (XX) č. 1831/2003. Xxxxxxx xxxxx Komisi xxxxx částí xxxxxxxxxxx, x xxxxx má být xxxxxxxxx xxxx s důvěrnými xxxxx, a připojeného xxxxxxxxxx.
Xxxxxx 3
Xxxxxxxxxxx
1. Xxxxxxxxxxx přiměřeně x xxxxxxxxxx xxxxxxxxx, xx xxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxx x xxxxxx 5 xxxxxxxx (XX) x. 1831/2003.
2. Xxxxxx xxxxxxxxx xx xxxxxxxxxxx x xxxxxxx xxxxxxxxxxx xxxx xxxxxxxxx x xxxxxxx XX.
Zvláštní xxxxxxxxx, xxx dokumentace xxxx splňovat x xxxxxxxx xxxxxxx, xxxx xxxxxxxxx x xxxxxxx XXX.
Xxxxxxxxx doba trvání xxxxxxxxxxxx studií xx xxxxxxxxx x xxxxxxx XX.
3. Xxxxxxxx xx xxxxxxxx 2 xxxx xxxxxxx xxxxxxxxx dokumentaci, která xxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx 2, pokud každý xxxxx, jenž xxxx xxxxxxxxx xxxxxxxxx, xxxxxxxx.
Xxxxxx 4
Xxxxxxxxx opatření
1. Xx xxxxxxx x xxxxxxxx xxxxxx před xxxxx xxxxxx tohoto xxxxxxxx x xxxxxxxx se xxxxxx xxxxxxxx příloha xxxxxxxx 87/153/XXX.
2. X xxxxxxx x xxxxxxxx xxxxxxxx před 11. červnem 2009 xx mohou xxxxxxxx rozhodnout, že xxxxx xxxxxx používat xxxxxx XXX x XX xxxxx X x XX xxxxxxx směrnice 87/153/EHS místo xxxx 1.3, 1.4, 2.1.3, 2.1.4, 2.2.3, 2.2.4, 3.3, 3.4, 4.1.3, 4.1.4, 4.2.3, 4.2.4, 5.3, 5.4, 6.3, 6.4, 7.3, 7.4, 8.3 x 8.4 xxxxxxx XXX x xxxxx xxxxxxxxxx ve xxxxxxx „Xxxxxxxxx xxxx xxxxxx dlouhodobých studií xxxxxxxxx“ x xxxxxxxxx přílohy IV.
Xxxxxx 5
Xxxxx x xxxxxxxx
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx x Xxxxxxx věstníku Evropské xxxx.
Xxxx xxxxxxxx xx xxxxxxx v celém xxxxxxx x xxxxx xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx.
V Bruselu xxx 25. xxxxx 2008.
Xx Xxxxxx
Xxxxxxxxx XXXXXXXXX
xxxxxx Komise
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;29. Xxxxxxxx xx xxxxx xxxxxxxx Komise (XX) x.&xxxx;378/2005 (Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;29).
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;64, 7.3.1987, x.&xxxx;19. Xxxxxxx xxxxxxxxx (XX) x.&xxxx;1831/2003.
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1; xxxxxxxx xxxxx x&xxxx;Xx.&xxxx;xxxx. L 358, 18.12.1986, x.&xxxx;1. Xxxxxxxx xx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2003/65/ES (Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1).
(4)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;270, 14.12.1970, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx nařízením Xxxxxx (XX) č. 1800/2004 (Xx.&xxxx;xxxx. X&xxxx;270, 14.12.1970, s. 1).
XXXXXXX&xxxx;X
XXXXXXXX XXXXXXX XXXXXXX X&xxxx;XX.&xxxx;2 ODST. 1 A SPRÁVNÍ XXXXX
1.&xxxx;&xxxx;&xxxx;XXXXXXXX XXXXXXX
XXXXXXXX XXXXXX
XXXXXXXXX ŘEDITELSTVÍ
PRO XXXXXX A OCHRANU SPOTŘEBITELE
(Adresa)
Datum: …
|
Xxx |
: |
Xxxxxx o povolení doplňkové xxxxx xxxxx xxxxxxxx (XX) x.&xxxx;1831/2003. |
|
◻ |
Xxxxxxxx xxxxxxxxx xxxxx xxxx xxxx xxxxx xxxxxxxxx xxxxx (xx.&xxxx;4 odst. 1 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx xxxxxxxxxxxx xxxxxxxx (xx.&xxxx;10 odst. 2 xxxx&xxxx;7 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxx xxxxxxxxxxx xxxxxxxx (xx.&xxxx;13 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx povolení xxxxxxxxx látky (článek 14 xxxxxxxx (ES) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx (článek 15 xxxxxxxx (XX) č. 1831/2003) |
(Označte xxxxxxxxxxx zaškrtnutím xxxxxxx x&xxxx;xxxxxxx)
Xxxxxxx(x)&xxxx;x/xxxx xxxx/xxxxxx xxxxxxxx(x)&xxxx;xx Xxxxxxxxxxxx (xx.&xxxx;4 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003) xx xxxxxxxx xxxxxxxxx x&xxxx;xx.&xxxx;7 xxxx.&xxxx;3 písm. a) nařízení (XX) x.&xxxx;1831/2003 (jméno, xxxxxx ….)
…
…
xxxxxx (xxxxxxxx) xxxx xxxxxx za xxxxxx získání povolení xxx následující xxxxxxx xxxxxxx xxxxxxxxxx xxxxx:
1.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx doplňkové xxxxx
Xxxxx xxxxxxxxx xxxxx (charakteristika xxxxxx xxxxx (xxxxx) xxxx xxxxxxx (xxxxxxx), xxx xx xxxxxxxx x&xxxx;xxxxxx&xxxx;2.2.1.1 x&xxxx;2.2.1.2 xxxxxxx&xxxx;XX):
…
…
Xxxxxxxx xxxxx (xx-xx xx xxxxxx u povolení vázaných xx xxxxxxxx):
…
…
X&xxxx;xxxxxxxxx/xxxxxxxxxxx a funkční xxxxxxx/xxxxxxxxx doplňkových xxxxx&xxxx;(1) (xxxxxx):
…
…
Xxxxxx xxxxx xxxxxx:
…
…
…
Xxxxx xxxxxxxx povolení (xx.&xxxx;9 xxxx.&xxxx;6 xxxxxxxx (ES) x.&xxxx;1831/2003):
…
…
Xxxx xxxxxxxxx xxxxx xxx byla povolena x&xxxx;xxxxxxxx předpisech o krmivech xxxxxxxx.……/…/X(X)X&xxxx;xxxx nařízením (XX) x.&xxxx;…/… xxx xxxxxx … xxxx (xxxxxxxxx xxxxxxxxxxx xxxxx)
…
Xxxx xxxxxxxxx xxxxx již xxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx směrnicí .…/…/E(H)S nebo xxxxxxxxx (XX) x.&xxxx;…/… xxx xxxxxx … xxxx
…
xxx xxxxxxx v
…
Pokud xx xxxxxxx xxxxxx x&xxxx;xxxxxxxxx modifikovaných xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx či xx x&xxxx;xxxx xxxxxxx, xxxxxx xxxx xxxxxxxxx:
|
◻ |
xxxxxxxxxxx xxxxxxxxxxxxx xxx (xxxxxxxx Xxxxxx (XX) č. 65/2004 (2)) (je-li xx xxxxxx): … |
|
◻ |
xxxxx o případném xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;1829/2003&xxxx;(3): … |
|
◻ |
xxxx xxxxx x&xxxx;xxxxx nevyřízené xxxxxxx x&xxxx;xxxxxxxx podle xxxxxxxx (XX) x.&xxxx;1829/2003: … |
1.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxx xxxxx
1.2.1&xxxx;&xxxx;&xxxx;Xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx
Xxxx nebo xxxxxxxxx xxxxxx:
…
…
Xxxxxxxxx stáří xxxx xxxxxxxx:
…
…
Xxxxxxxxx xxxxx (je-li xx xxxxxx): mg xxxx jednotky xxxxxxxx&xxxx;(4) xxxx xxxxxxxx tvořící xxxxxxx (XXX) xxxx xx/xx xxxxxxxxxxx krmiva x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
Xxxxxxxxx xxxxx (xx-xx xx xxxxxx): mg xxxx xxxxxxxx xxxxxxxx nebo XXX xxxx xx/xx xxxxxxxxxxx krmiva x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
X&xxxx;xxxxxxxx xxxxx xx xxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxx xx xxxx.
1.2.2&xxxx;&xxxx;&xxxx;Xxxxxxx xx xxxx
Xxxxxxxxx dávka (xx-xx xx vhodné): xx xxxx xxxxxxxx xxxxxxxx xxxx CFU xxxx xx/x&xxxx;xxxx
…
…
Xxxxxxxxx xxxxx (xx-xx xx xxxxxx): mg xxxx xxxxxxxx xxxxxxxx xxxx XXX nebo xx/x&xxxx;xxxx
…
…
1.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxx podmínky pro xxxxx (xx-xx xx xxxxxx)
Xxxx xxxx xxxxxxxxx xxxxxx:
…
…
Xxxxxxxxx xxxxx:
…
…
Xxxxxxxxx dávka (xx-xx xx xxxxxx): xx nebo jednotky xxxxxxxx xxxx XXX/xx xxxxxxxxxxx krmiva x&xxxx;xxxxxx xxxx 12 %
…
…
Maximální dávka (xx-xx to xxxxxx): xx xxxx xxxxxxxx xxxxxxxx xxxx XXX/xx xxxxxxxxxxx krmiva x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
X&xxxx;xxxxxxxx xxxxx xx xxxxx uvést xxxxxxxxx a maximální dávku xx xxxx.
Xxxxxxxx xxxx xxxxxxx xxxxxxx (xx-xx xx xxxxxx):
…
…
…
Xxxxxxxx xxxxxxxx xxxx xxxxxxx xxx xxxxxxxxxx (xx-xx xx xxxxxx):
…
…
…
…
Xxxxxxxxx xxxxx reziduí (xx-xx xx xxxxxx):
Xxxx xxxx kategorie zvířat:
…
…
Indikátorové xxxxxxxx:
…
…
Xxxxxx xxxxx xxxx xxxxxxxx:
…
…
…
Xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxx produktech (μx/xx):
…
…
…
Xxxxxxxx xxxxx:
…
1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx
Xxxxx vzorku xxxxxxxxxx xxxxxxxxxx Společenství (xx-xx xx xxxxxx):
…
Xxxxx xxxxxx / xxxxx xxxxx:
…
Xxxxx xxxxxx:
…
Xxxxx minimální xxxxxxxxxxxx:
…
Xxxxxxxxxxx:
…
Xxxxxxxx:
…
Xxxxxxx popis:
…
Popis xxxxx:
…
Xxxxxxxxx xx xxxxxxxxxx:
…
1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxx (xx-xx xx xxxxxx)
…
…
…
…
Xxxxx xxxx žádosti byla xxxxxxx xxxxx úřadu x&xxxx;xxxxxxxxxxx a referenční xxxxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx vzorky.
Podpis …
1.5&xxxx;&xxxx;&xxxx;Xxxxxxx:
|
◻ |
xxxxx xxxxxxxxxxx (xxxxx xxx xxxx), |
|
◻ |
xxxxxxx souhrn xxxxxxxxxxx, |
|
◻ |
xxxxxxxx xxxxxxx xxxxxxxxxxx, |
|
◻ |
xxxxxx xxxxx xxxxxxxxxxx, x&xxxx;xxxxx xx být xxxxxxxxx xxxx x&xxxx;xxxxxxxxx údaji, x&xxxx;xxxxx xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx (pouze xxx Xxxxxx a úřad), |
|
◻ |
kopie xxxxxxxxx xxxxx xxxxxxxx(x), |
|
◻ |
xxx xxxxxx doplňkové xxxxx xxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx podle čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831 / 2003 (xxxxx xxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx), |
|
◻ |
xxxx x&xxxx;xxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx (xxxxx xxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx), |
|
◻ |
xxxxxxxxx x&xxxx;xxxxxxxxxxxx a analýze (xxxxx pro xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx) x |
|
◻ |
xxxxxxxxx x&xxxx;xxxxxxxx poplatku xxx xxxxxxxxxx xxxxxxxxx Společenství (xxxxxx&xxxx;4 nařízení (XX) x.&xxxx;378/2005&xxxx;(5). |
Xxxxxxx xxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxx xx xxxxx xxxxxxxx. Xxxxxxxx xxxxxxxxx žádosti (x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx) zašlete xxxxx Xxxxxxxx xxxxxx.
2.&xxxx;&xxxx;&xxxx;XXXXXXX XXXXX XXXXXXXX(X)
Xxxxxxxxx xxxxx xxx xxxxxxxxxx žádosti x&xxxx;xxxxxxxx doplňkové xxxxx xxxxx xxxxxxxx (XX) x.&xxxx;1831/2003
|
1. |
Xxxxxxxxxx xxxx xxxxx, xxxxx podává xxxxxx
|
|
2. |
Xxxxxxxxx xxxxx (pro xxxxxxxx korespondenci s Komisí, xxxxxx a referenční laboratoří Xxxxxxxxxxxx)
|
(1)&xxxx;&xxxx;X&xxxx;xxxxxxx xxxxxxx „xxxx xxxxxxxxxxxx xxxxxxxxx xxxxx“ x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx xx xxxxx jednoznačně xxxxxxx, xxxxx xxxxxx xx xxxxxxxxx xxxxx xxx.
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 10, 16.1.2004, x.&xxxx;5.
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 268, 18.10.2003, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx nařízením (XX) x.&xxxx;298/2008 (Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, s. 1).
(4) Definici „xxxxxxxx“ xxxxxxxx xxxxxxx.
(5)&xxxx;&xxxx;Xxxxxxxx Xxxxxx (XX) x.&xxxx;378/2005 ze xxx 4.&xxxx;xxxxxx 2005 x&xxxx;xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx Evropského parlamentu x&xxxx;Xxxx (XX) č. 1831/2003, xxxxx xxx x&xxxx;xxxxxxxxxx x&xxxx;xxxxx xxxxxxxxxx laboratoře Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxx s žádostmi x&xxxx;xxxxxxxx xxxxxxxxxxx látek x&xxxx;xxxxxxxx (Xx.&xxxx;xxxx. X&xxxx;59, 5.3.2005, s. 8). Xxxxxxxx xx xxxxx xxxxxxxx (XX) č. 850/2007 (Úř. věst. X&xxxx;59, 5.3.2005, s. 8).
XXXXXXX&xxxx;XX
XXXXXX POŽADAVKY, XXX XXXX XXXXXXXX XXXXXXXXXXX XXXXX XXXXXX&xxxx;3
XXXXXX USTANOVENÍ
Tato xxxxxxx stanoví xxxxxxxxx xx vypracování xxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxx, xxxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxx, xxx xxxx xxx xxxxxxxxxx s dokumentací xxxxx xxxxxx&xxxx;7 xxxxxxxx (XX) x.&xxxx;1831/2003 pro:
|
— |
povolení nové xxxxxxxxx látky, |
|
— |
povolení xxxxxx xxxxx doplňkové xxxxx, |
|
— |
xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx |
|
— |
xxxxxxxx xxxxxxxx xxxxxxxxx látky. |
Dokumentace xxxx xxxxxxx vyhodnocení doplňkových xxxxx xx xxxxxxx xxxxxxxxxx stavu xxxxxxxx x&xxxx;xxxxxxx, xx xxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxx xxxxxx xxxxxxxx, které xxxx stanoveny x&xxxx;xxxxxx&xxxx;5 xxxxxxxx (XX) č. 1831/2003.
Studie, xxx mají xxx xxxxxxxxxx, a jejich xxxxxx xxxx xxxxxxx xx xxxxxx xxxxxxxxx xxxxx, xxxxxxxxx nebo xxxxxxx xxxxxxx, druhu xxxxxxxx (xxxxxxxx, které xxxx xxxxxx xx xxxxxxxx; xxxxxxxx vázané xx xxxxxxxx), xxxxxxx xxxxx, xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxx xxxxx. Žadatel xxxxxx xx xxxx xxxxxxx x&xxxx;xxxxxxx&xxxx;XXX, xxx xxxx xxxxx xxxxxxxx, xxxxx xxxxxx a informace xxxx být společně xx xxxxxxx předloženy.
Žadatel xxxxxxxxxxx xxxxx důvody xxx xxxxxxxxx některých xxxxx xxxx xxxxxxxxx xx xx xxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxx xxxxxxx, xxxxxxx&xxxx;XXX x&xxxx;xxxxxxx&xxxx;XX.
Xxxxxxxxxxx musí xxxxxxxxx podrobné xxxxxx x&xxxx;xxxxx provedených studiích, xxxxxxxxxx v souladu xx xxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxx příloze. Dokumentace xxxx obsahovat xxxxxx x&xxxx;xxxxx všech zveřejněných xxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx příslušných xxxxxxxxxx, která xxx xxxx xxxxxxxxxxx uznávanou xxxxxxxx xxxxxxxxx. Xxxxx xxxx xxxx xxxxxx xxx vyhodnoceny xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxx xx Společenství, xxxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx. Xxxxx ze xxxxxx, které xxxx xxxxxxxxx x&xxxx;xxxxxxxxxx již xxxxx, nebo xxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx xx xxxx jednoznačně xxxxxxxxx na xxxxxxx xxxxxxxxxx xxxxx jako xxxxx, která je xxxxxxxxx xxxxxxx o povolení.
Studie, xxxxxx xxxxxx, xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxx xxxxx xxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx, xxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxxx podle xxxxxxxxxxx xxxxx xxxxxxx (xxxx. xxxxxxx laboratorní xxxxx v souladu xx xxxxxxxx Xxxxxxxxxx parlamentu x&xxxx;Xxxx 2004/10/XX xx xxx 11.&xxxx;xxxxx 2004 x&xxxx;xxxxxxxxxxx právních x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxx zásad xxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxx&xxxx;(1) xxxx Xxxxxxxxxxx xxxxxxxxxx xxx normalizaci (ISO).
Pokud xx xxxxxx xx xxxx nebo in xxxxx xxxxxxxxx xxxx Xxxxxxxxxxxx, xxxxxxx xxxx xxxxxxxx, xx xxxxxxx xxxxxxxx xxxxxxxx zásady xxxxxxx laboratorní xxxxx Xxxxxxxxxx pro xxxxxxxxxxxx xxxxxxxxxx a rozvoj (OECD) xxxx xxxxx XXX.
Xxxxxxxxx-xxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx xxxxxxxxxx xx xxxx xxxxx xxxxx xxxxxxxxxxx směrnicí Xxxx 67/548/XXX xx xxx 27.&xxxx;xxxxxx 1967 x&xxxx;xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, xxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxx látek (2), xxxxxxxxx xxxxxxxxxx směrnicí Xxxxxx 2004/73/XX&xxxx;(3), nebo xxxxxx xxxxxxxxxxxxxxx xxxxx uznaných xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx. Xxxxxxx jiných xxxxx xxxx xxx xxxxxxxxxx.
Xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxx xx xxxxx xxxx xxxxx zpřesňujících xxxx xxxxxxxxxxxxx obvyklé xxxxx prováděné x&xxxx;xxxxxx xxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxx těchto xxxxxxx. Tyto xxxxxx xxxx xxxxxxx xxxxxxx x&xxxx;xxxxxxxxx xxxxxxx xxxxxx xxxxxxx jako xxxxxx, xxxxxx xxxx xxxxxxxx.
Xxxxx xxxxx analýzy v krmivech xxxx xx vodě xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxx správné xxxxxxxxxxx xxxxx xxxxxxxxxxx xx xxxxxxxx 2004/10/XX x/xxxx xxxxx XX XXX/XXX 17025. Xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxx&xxxx;11 xxxxxxxx Evropského xxxxxxxxxx a Rady (ES) x.&xxxx;882/2004 xx dne 29.&xxxx;xxxxx 2004 x&xxxx;xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx xxxxxx a dobrých xxxxxxxxx xxxxxxxxxx xxxxxx&xxxx;(4).
Xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxx xxxxxxx, aby xxxx možno dotyčnou xxxxxxxxxx látku xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx.
Xxxxx xxxxxxxxxxx xxxxxxxx xxxxx xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx xxx, xxxxx xx xxxxxxxx xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003, x&xxxx;xxxxx xx označování xxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003.
Xxxxxxxxx xxxxxxxxxxx
Xxxx xxxxxxxxx je xxxxxxxx xx studiích, xxxxx xxxx xxxxxxxx xxxxxxxx používání doplňkové xxxxx xx xxxxxx x:
|
x) |
xxxxxxx druhům xxx xxxxxxxxxx navrhovaných xxxxxxxx xxx xxxxxxxxxxx xx xxxxx xxxx xxxx x&xxxx;xxx násobku tohoto xxxxxx xxx xxxxxxxxx xxxxxxx pro xxxxxxxxxx; |
|
x) |
xxxxxxxxxxxxx, xxxxx xxxxxxxx potravinářské xxxxxxx získané ze xxxxxx přijímajících xxxxxxxxxx xxxxx, její xxxxxxx xxxx xxxxxxxxxx. X&xxxx;xxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx (MLR) x&xxxx;xxxxxxxxxx lhůt xx xxxxxxx xxxxxxxxxx xxxxx xxxxx (XXX) xxxx xxxxxxxx xxxxxxxx xxxxx (XX); |
|
x) |
xxxxxx, které xxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxx xxxxxxxxx sliznice, xxx xx xxxx xxx xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx xxxx xxxxxxx nebo xxx jejím xxxxxxxxxxxxx xx premixů xxxx xxxxxxxxxxx xxxxx xxxx xxxx xx při xxxxxxxxx xxxxxx xxxx xxxx, xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxx x&xxxx;xxxxxxx xxxxxxxx vzhledem x&xxxx;xxxxxxx a rozšíření xxxx xxxxxxxxxxxxx xxxx antimikrobiálním xxxxxx a |
|
e) |
životnímu prostředí, x&xxxx;xxxxxxx xx nebezpečí xxxxxxxxxxx z doplňkové xxxxx xxxxxxx xxxx xxxxxxxx x&xxxx;xx odvozených, ať xx přímo a/nebo xxxxxxxxxxx zvířaty. |
Pokud xx xxxxxxxxx xxxxx xxxx xxxxxx, každá xxxxxx xxxx xxx posouzena x&xxxx;xxxxxxxx bezpečnosti xxx xxxxxxxxxxxx samostatně x&xxxx;xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx xx xxxxxxxxxxx účinek (lze-li xxxxxxxx, xx mezi xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx). Xxxxxxxxxxxx xx xxxxx xxxxxxxx kompletní xxxxx.
Xxxxxxxxx xxxxxxxxx
Xxxx posouzení xx založeno xx xxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxxx doplňkové xxxxx, xxxxx xxx x&xxxx;xxxxxx xxxxx, jak xx xxxxxxxxx x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
1.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;X:&xxxx;XXXXXX DOKUMENTACE
1.1 Veřejný souhrn xxxxxxxxxxx podle xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003
Xxxxxxx předloží xxxxxx x&xxxx;xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx látky. Xxxxxx nesmí xxxxxxxxx xxxxx důvěrné xxxxx x&xxxx;xxxx xxx tuto xxxxxxxxx:
1.1.1&xxxx;&xxxx;&xxxx;Xxxxx
|
x) |
xxxxx xxxxxxxx(x); |
|
x) |
xxxxxxxxxxxx doplňkové xxxxx; |
|
x) |
xxxxxx xxxxxx x&xxxx;xxxxxx xxxxxxx; |
|
x) |
xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxx xxxxxxxx xxx užití a |
|
f) |
návrh xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx xxx. |
1.1.2.&xxxx;&xxxx;&xxxx;Xxxxx
|
x) |
Xxxxx x&xxxx;xxxxxx xxxxxxxx(x) Xxxx xxxxx musí xxx poskytnuty xx xxxxx případech xxxxxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxxx (povolení xxxxxx xx xxxxxxxx xxxx povolení, xxxxx xxxx xxxxxx xx xxxxxxxx). Xxxxxxxxx-xx xxxxxxxxxxx xxxxxxx xxxxxxxx, xxxx xxx xxxxxxx jméno xxxxxxx xxxxxxxx. |
|
x) |
Xxxxxxxxxxxx xxxxxxxxx xxxxx Xxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxx požadovaných xxxxxxxxx xxxxx přílohy II xxxx&xxxx;XXX podle xxxxx xxxxxxxx doplňkové látky. Xxxxxxxxx: název xxxxxxxxx xxxxx, navrhované zařazení xx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxxx xxxxx/xxxxxxxxx xxxxxx x&xxxx;xxxxx. |
|
x) |
Xxxxxx výroby x&xxxx;xxxxxx xxxxxxx Xx xxxxx xxxxxx výrobní xxxxxx. Xx xxxxx popsat xxxxxx xxxxxxx analytických xxxxx, xxx xxxx být xxxxxxx xxx xxxxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx, v premixech x&xxxx;xxxxxxxx xxxxx xxxxxxxxx této xxxxxxx x&xxxx;xxxxxxx&xxxx;XXX. Xxxxxxxxx xx xx xxxxxxx xxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxxx&xxxx;XXX xxxxx xxxxxx xxxxxx (xxxxx) xxxxxxxxx k analýze xxx úřední xxxxxxxx xxxxxxxxxxx xxxxx nebo xxxxxx xxxxxxxxxx v potravinách xxxxxxxxxxx xxxxxx. |
|
x) |
Xxxxxx bezpečnosti x&xxxx;xxxxxxxxx xxxxxxxxx látky Je xxxxx xxxxx xxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxxx xxxxxxx provedených studií. Xxxxxxxx xxxxxx xxxxx xxx xxxxxxx x&xxxx;xxxxxx xxxxxxx xx xxxxxxx xxxxxx žadatele(ů). Xx xxxxxxx xx xxxx xxx uvedeny xxxxx xxxxxx požadované xxxxx xxxxxxx&xxxx;XXX. |
|
x) |
Xxxxxxxxxx podmínky xxx xxxxx Xxxxxxx(x)&xxxx;xxxxxxxx xxxxx podmínek xxx užití. Xxxxxxx xxxxxxx xxxxxx obsah xxxxxxx xx vodě xxxx xxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx xxx xxxxx v doplňkových krmivech. Xxxxxxxx se xxxxxx xxxxxxxxx, xxx xx xxxxxxxxx jiné xxxxxxx xxxxxxxx xxxx xxxxxxxxxxx xx xxxxxx xxxx xxxx. Xx xxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx pro xxxxx (xxxx. xxxxxxxxxxxxxxx), xxxxxxxx xxxxxxxxx na označování x&xxxx;xxxxx xxxxxx, xxx xxx xx xxxxxxxxx xxxxx xxxxxx. |
|
x) |
Xxxxx plánu xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx Xxxx xxxx se xxxxxxxx pouze xx xxxxxxxxx xxxxx, xxxxx xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxxx xx kategorií a) nebo b) v čl. 6 xxxx.&xxxx;1 xxxxx xxxxxxxx, x&xxxx;xx doplňkové xxxxx, xxxxx xxxxxxx do xxxxxxx xxxxxxxxxx xxxxx Xxxxxxxxxxxx o uvádění na xxx xxxxxxxx, xxxxx xx xxxxxxxx z geneticky xxxxxxxxxxxxxx organismů xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx nebo xxxx x&xxxx;xxxx xxxxxxxx. |
1.2&xxxx;&xxxx;&xxxx;Xxxxxxx shrnutí xxxxxxxxxxx
Xx xxxxx poskytnout xxxxxxx shrnutí xxxxxxxxxx xxxxx x&xxxx;xxxxx části xxxxxxxxx xxxxxxxxxxxx na xxxxxxx xxxxxxx xxxxx xxxx xxxxxxx a přílohy III. Xxxx shrnutí obsahuje xxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx).
Xxxxxxx musí xxxxxxx xxxxxx této xxxxxxx x&xxxx;xxxxxxx xx všemi xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx xx xxxxxxxxx strany xxxxxxxxxxx.
1.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxx
Xxxxxxx musí xxxxx xxxxx x&xxxx;xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxx. Xx xxxxx připojit xxxxxxxx xxxxx s odkazem na xxxxxx x&xxxx;xxxxxx.
1.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxx xxxxxxxxxxx, s nimiž má xxx xxxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxxx
Xxxxxx obsahuje xxxxx xx příslušné xxxxxx x&xxxx;xxxxxx dokumentace.
2. ODDÍL II: XXXXXXXX, XXXXXXXXXXXXXXX A PODMÍNKY XXX XXXXX XXXXXXXXX XXXXX; XXXXXX XXXXXXX
Xxxxxxxxx xxxxx xxxx být xxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx.
2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxx xxxxx
2.1.1&xxxx;&xxxx;&xxxx;Xxxxx doplňkové xxxxx
Xxxxxxxx xx xxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxxxx xx xxxxxxxx povolení.
2.1.2 Návrh xx zařazení
Je xxxxx xxxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx látky xx xxxxx xx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxx podle xxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;6 a přílohou I nařízení (XX) x.&xxxx;1831/2003.
Xxxx xxx poskytnuty xxxxx z jiných xxxxxxx xxxxxxx identických účinných xxxxx nebo xxxxxxx (xxxx. užití x&xxxx;xxxxxxxxxxx, xxxxxxxx xxxx veterinárním xxxxxxxxx, zemědělství x&xxxx;xxxxxxxx). Xx nutno xxxxx xxxxxxxx jiná xxxxxxxx xxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxxx přídatná xxxxx, xxxxxxxxxxx xxxxxx xxxxxxxxx xxxx xxxx xxxx xxxxxxxx xxxxxx xxxxx.
2.1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx (xxxxxx xxxxx/xxxxxxx, xxxx xxxxxx, xxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxxx šarží)
Je xxxxx xxxxx xxxxxxx xxxxx(x)/xxxxxxx(x)&xxxx;x&xxxx;xxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxx s uvedením xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxx. Xx xxxxx stanovit xxxxxxxxxxxx a kvantitativní xxxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (činidel).
Pro mikroorganismy: xx nutno xxxxxxxx xxxxx xxxxxxxxxxxxxxx xxxxx xxxx spor xxxxxxxxx xxxx CFU xx xxxx.
Xxx xxxxxx: xx xxxxx xxxxxx xxxxxxx xxxxxxx (xxxxxx) aktivity x&xxxx;xxxxx jednotek xxxxxxxx x&xxxx;xxxxx xxxxxxx produktu. Xx nutno zmínit xxxxxx důležité xxxxxxxx xxxxxxxx. Xxxxxx se xxxxxxxx aktivity, xxxxx xxxxx xxxx μxxxx xxxxxxxx xxxxxxxx xx xxxxxx xx xxxxxxxxx, xxxxxx x&xxxx;xxxxxxxx xX x&xxxx;xxxxxxx.
Xx-xx xxxxxx xxxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxx xxxxx xxxx xxxxxxx, přičemž xxxxxxx xxx xxxxxxxxxxx xxxxxxxxx (xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx), xxxx xxx xxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx x&xxxx;xxxx xxxxx.
Xxxxxxx směsi, xxxxxxx xxxxxx xxxxx xxxxxx jedním xxxxxxxxx xxxxxxx x/xxxx xxxx xxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx, musí xxx xxxxxxxxxxxxxxxx xxxxx složky (xxxxxx) xxxxxxxxxxxxxx x&xxxx;xxxx xxxxxxxx a/nebo podle xxxxxxx xxxxxx xxxxxx (xxxxxx).
Xxxx xx xxxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx předložená xxxxxx xxxxx čl. 8 xxxx.&xxxx;2 xxxxxxxx (XX) x.&xxxx;1831/2003, xxxxxxx xxxx vynechat xxxxx xxxxxxxxx xxxxxx, xxxxx nepředstavují bezpečnostní xxxxxx, xxxxxx než xxxxxx xxxxx xxxx xxxxxxx x&xxxx;xxxxxxx doplňkových xxxxx, které nejsou xxxxxxxx x&xxxx;xxxxxxxxxxx zootechnických xxxxxxxxxxx látek, xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx x&xxxx;xx xxx xx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx (ES) x.&xxxx;1829/2003. Všechny xxxxxx xxxxxxx v dokumentaci xxxx xxx každopádně založeny xx konkrétní xxxxxxxxx xxxxx, pro xxx xx xxxxxxxx xxxxxxxx, x&xxxx;xxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx. Je xxxxx xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx xxxxx x&xxxx;xx xxxxx xxxxxxx za xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx a potvrzení, xx xx identifikátor(y) vztahuje(í) na xxxxxxx, xxx xxx xx podává xxxxxx.
2.1.4&xxxx;&xxxx;&xxxx;Xxxxxxx
Xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxx chemické x&xxxx;xxxxxxxxxxx nečistoty, látky x&xxxx;xxxxxxxxx xxxx xxxxxx xxxxxxxxxxx vlastnostmi, které xxxxxx přidány záměrně x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxx. X&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxx žadatel xxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx látce. Xx xxxxx xxxxxx protokol xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxx xx znečišťující látky x&xxxx;xxxxxxxxx.
Xxxxxxx xxxxxxxxxx xxxxx xxxx podpořit návrh xx specifikaci xxxxxxxxx xxxxx.
Xxxx jsou xxxxxxx xxxxxxxx požadavky v závislosti xx výrobním xxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx Společenství.
2.1.4.1 Doplňkové xxxxx, jejichž xxxxxxxx xx xxxxxx na xxxxxxxx xxxxxxxx
X&xxxx;xxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxx xx xxxxxx xx držitele xxxxxxxx, je nutno xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx se xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx k jiným xxxxxxxxxxxx xxxxxx. Je xxxxx xxxxxx xxxxxxxxxxx Xxxxxxxxxx výboru odborníků XXX/XXX xxx xxxxxxxxxxxxx xxxxxxxx látky (JECFA) xxxx specifikace x&xxxx;xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxx látky.
2.1.4.2 Doplňkové xxxxx, jejichž povolení xxxx vázané na xxxxxxxx xxxxxxxx
X&xxxx;xxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx xxxxx xxxxxx xxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxx xxxxxxxxxxxx xxxxxx nebo xxxxx xx xxxxxxxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx x&xxxx;Xxxxxxxxx xxxxxxxxxxxx xxxx XXXXX. Xxxxxx-xx xxxxxx normy xxxxxxxx xxxx je-li xx xxxxxxxx pro xxxxxxx xxxxxx, xx xxxxx xxxxxx xxxxxxxxxxxx níže xxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx:
|
— |
xxx mikroorganismy: mikrobiologická xxxxxxxxxxx, xxxxxxxxxx, xxxxx xxxx; |
|
— |
xxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx (xxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxx xxxxxxx): je xxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxx xxxxxxxx xxxxxxxxxxxxxx (xxx xxxx). Xx nutno uvést xxxxxx xxxxxx, x&xxxx;xxxx xx xx xxxxxxxx xxxxxxxx xxxxxxxxxxx použité xxxxxxxxxx xxxxxx; |
|
— |
xxx xxxxx xxxxxxxxxxx xxxxxx: xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx (xxxxxxx xxxx. xxxxxx xxxxxx, xxxxxx plevele, xxxxx xxxxx), xxxxxxxxxx, kontaminace xxxxxxxxx, maximální hodnoty xxx xxxxxxxxxxxx a popřípadě xxxxxxxxxxxxx významné xxxxx, x&xxxx;xxxxx je xxxxx, xx xx vyskytují x&xxxx;xxxxxxx xxxxxxxx; |
|
— |
xxx xxxxx xxxxxxxxxxx xxxxxx: mikrobiologická xxxxxxxxxxx, xxxxx kovy x&xxxx;xxxxxxxxx xxxxxxxxx hodnoty xxx rozpouštědla; |
|
— |
pro minerální xxxxx: xxxxx kovy, xxxxxxx x&xxxx;XXX; |
|
— |
xxx produkty xxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx procesy: xxxx xx všechny chemické xxxxx použité v syntetických xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx v hotovém xxxxxxxx x&xxxx;xxxxx se xxxxxx xxxxxxxxxxx. |
Xxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxx xxx xxxxxxx xxxxx xxxxxxx xxxxxx.
2.1.5&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx
X&xxxx;xxxxxxxxx v tuhém xxxxx xx xxxxxxxxx xxxxx o rozdělení xxxxx xxxxxxxxx částic, xxxxx xxxxxx, hustotě, xxxxxxxx xxxxxxx, xxxxxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxx xxxx vliv xx xxxxxxxxx xxxxxxxxxx. U přípravků x&xxxx;xxxxxxxx xxxxx xx xxxxxxxxx údaje o viskozitě x&xxxx;xxxxxxxxxx napětí. Pokud xx xxxxxxxxx látka xxxxxx k použití xx xxxx, je xxxxx xxxxxxxx xxxxxxxxxxx nebo xxxxxx xxxxxxxx.
2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx)
2.2.1&xxxx;&xxxx;&xxxx;Xxxxx
Xx nutno xxxxx xxxxxxxxxxxx xxxxx xxxxxx látky nebo xxxxxxx. To zahrnuje xxxxxxx x&xxxx;xxxxx látky xxxx činidla a jiné xxxxxxxx xxxxxxxxxxxxxxx.
2.2.1.1&xxxx;&xxxx;&xxxx;Xxxxxxxx látky
Chemicky xxxxxx definované xxxxx xx nutno popsat xxxxxxxx názvem, xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx XXXXX (Xxxxxxxxxxxxx Xxxxx xx Pure xxx Xxxxxxx Xxxxxxxxx), xxxxxxx xxxxxxxxxxxxx druhovými xxxxx x&xxxx;xxxxxxxxx a/nebo číslem XXX (Xxxxxxxx Xxxxxxxx Xxxxxxx). Xx nutno xxxxx strukturální a empirický xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
X&xxxx;xxxxxxxx xxxxxxxxxx sloučeniny xxxxxxx xxxx xxxxxxxxxxx xxxxx xx nutno xxxxx xxxxx XXXXXX xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx xxxxxxxx. X&xxxx;xxxxxxxxxxx výtažků xx xxxxx uvést xxxxxxxxxxxx xxxxxxx.
Xxxxx, x&xxxx;xxxxx nelze xxxxxx xxxxxx jedním xxxxxxxxx xxxxxxx x/xxxx x&xxxx;xxxxx xxxxx xxxxxxx xxxxxx identifikovat, xx xxxxx charakterizovat xxxxx xxxxxx (xxxxxx) xxxxxxxxxxxxxx x&xxxx;xxxx xxxxxxxx a/nebo xxxxx xxxxxxxxx hlavních xxxxxx. Je xxxxx xxxxxxxxxxxxx xxxxxxxxxx sloučeninu, xxx xxxx xxxxx xxxxxxxx xxxxxxxxx a zajistit xxxxxxxxxxxxxx.
Xxx xxxxxx x&xxxx;xxxxxxxxx xxxxxx xx nutno xxx každou udávanou xxxxxxxx xxxxx číslo x&xxxx;xxxxxxxxxxxx xxxxx xxxxxxxxxx Xxxxxxxxxxx xxxx xxxxxxxxx (XXX) v posledním xxxxxx „Xxxxxxxxxx xxxxxx“. U aktivit xxxxx xxxxxxxxxxxx xx xxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx názvosloví XXX. Xxxxxx xxxxx xxxx přípustné xx xxxxxxxxxxx, xx jsou xxxxxxxxxxx x&xxxx;xxxx používány xxxxxxxxxxxx x&xxxx;xxxx dokumentaci x&xxxx;xxx jejich první xxxxxx xx xxx xxxxxxxxxxx xxxxxxxxx na xxxxxxxxxxxx název x&xxxx;xxxxx XXX. Xx xxxxx xxxxx biologický xxxxx xxxxx xxxxxxxx aktivity.
Je xxxxx popsat xxxxxx xxxxxxxxxxx původ xxxxxxxxxx xxxxx xxxxxxxxx fermentací (xxx bod 2.2.1.2 Mikroorganismy).
2.2.1.2 Mikroorganismy
Je xxxxx xxxxx původ xxxxx xxxxxxxxxxxxxx používaných xxxx produkt xxxx xxxxxxx xxxx.
X&xxxx;xxxxxxxxxxxxxx používaných xxxx xxxxxxx nebo xxxx výrobní xxxx xx xxxxx xxxxx xxxxxxxx xxxx. Xxxxx xx xxxxx a taxonomická xxxxxxxxxxx každého xxxxxxxxxxxxxx xxxxx nejnovějších xxxxxxxxxxxx xxxxx v mezinárodních xxxxxxxxxxxxxxx xxxxxx (XXX). Xxxxxxxxxxx xxxxx xxxx xxx xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxx kultur (xxxxx xxxxx x&xxxx;Xxxxxxxx xxxx) x&xxxx;xxxxxxxxxx sbírkou xxxxxx xx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxx. Xx xxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xx xxxxxx, které xxxxxxxxx xxxxxxxxx xxxxx, xxx xxxxxx xx xxxx xxxxxx. Dále xx xxxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx nezbytné xxx xxxxxxxxxx identifikaci xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xx xxxxx xxxxx xxxxxxxxxxx xxxx. Pro xxxxx xxxxxxxxx modifikovaný xxxxxxxxxx xx uvede xxxxxxxxxxx xxxxxxxxxxxxx xxx xxxxx xxxxxxxx Komise (XX) x.&xxxx;65/2004 xx xxx 14. ledna 2004, xxxxxx se zřizuje xxxxxx tvorby a přiřazování xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxx xxx geneticky modifikované xxxxxxxxx.
2.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxxx
2.2.2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx látky
Je xxxxx xxxxx popis xxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx. Xxxxxxxxx xxxxxxxx, xXx, xxxxxxxxxxxxxxx xxxxxxxxxx, xxx xxxx, bod xxxx, xxxxxxx, xxxx xxx, xxxxxxxxxxx xx xxxx x&xxxx;x&xxxx;xxxxxxxxxxx rozpouštědlech, Xxx x&xxxx;Xx/Xxx, xxxxxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxx, údaje XXX, xxxxxxxx izomery x&xxxx;xxxxxxxxx jiné xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxx xxxxxxx, kde xx xx xxxxxx.
Xxxxx xxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxx nesmí xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx xxxx xxxxxx.
2.2.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxxx
|
— |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxx Xx xxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx virulence xxxx xxxxxx xxxxxxxxxxxx. Xxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxx, x&xxxx;xxxxx xx známo, xx xxxxx produkovat xxxxxx xxxx xxxx xxxxxxx xxxxxxxxx, xx xxxxx xxxxxxxx odpovídajícím xxxxxx x&xxxx;xxxxx xxxxxxxx xx xxxxxxxxxx a popřípadě xxxxxxx xxxxxx, xx xxxxxxxxxx xxxxx k obavám. U kmenů xxxxxxxxxxxxxx, pro xxx xxxxxx k dispozici xxxxx x&xxxx;xxxxxxx bezpečném xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx není xxxxx dostatečně xxxxx, xx nezbytný xxxx xxxxxxx xxxxxxxxxxxxxxx studií. |
|
— |
Produkce xxxxxxxxxx a rezistence xxxx xxxxxxxxxxxx Xxxxxxxxxxxxxx xxxxxxxxx jako xxxxxxxxx xxxxx xxxx xxxx výrobní kmen xxxxx xxxxxxxxx antibiotickou xxxxxxxx xxxx xxxxx xxx xxxxxxx produkovat xxxxxxxxxxxx látky, xxxxx xxxx xxxxxxxx xxxx xxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxx. Xxxxx xxxxxxxxxxxxxx xxxxxx k použití xxxx doplňkové xxxxx xxxxx xxxx přispívat x&xxxx;xxxxxx xxxx xxxxxxxxxx xxxx xxxxxxxxxxxx, xxxxx xx xxx xxxxxxxxx x&xxxx;xxxxxxx flóře xxxxxx x&xxxx;x&xxxx;xxxxxxxx xxxxxxxxx. Xxxxxxx xxxxx bakterií je xxxxx xxxxx xxxxxxxxx xx rezistenci vůči xxxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx. Xx-xx xxxxxxxx rezistence, xx xxxxx zjistit xxxxxxxxx xxxxxx rezistence x&xxxx;xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxx ve xxxxxxxx. Xxxxx xxxxxxxxxxxxxx nesoucích xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxx xxxx xxxxxxxxx xxxxx, xxxxx-xx xxxxxxxx, že xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx xxxxxx(x)&xxxx;x&xxxx;xxxx xxxxxxxx. |
2.3&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxx, včetně xxxxxxxxxx xxxxxxxxx xxxxxxx
Xx xxxxxxxxx xxxxxxxxxx míst xxxxxxx, xxxxx mohou xxx xxxx na xxxxxxx xxxxxx xxxxx / xxxxxxx (xxxxxxx) nebo xxxxxxxxx látky, xx xxxxx popis xxxxxxxxx xxxxxxx. Je xxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx x&xxxx;xxxxxxxxxxx materiálu x&xxxx;xxxxxxxxxx xxxxx xxxxxxxxxxx ve xxxxxxxx xxxxxxx.
2.3.1&xxxx;&xxxx;&xxxx;Xxxxxx látky(y) / xxxxxxx(x)
Xx nutno xxxxxxxxxx popis výrobního xxxxxxx (např. xxxxxxxx xxxxxxx, fermentace, xxxxxxxxx, xxxxxxxx z organických materiálů xxxx xxxxxxxxx) použitého xxx xxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) doplňkové xxxxx, xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxx xx složení xxxxxxxxxxxxx/xxxxxxxxxxxx xxxxx. Xx nutno xxxxxx důkladně xxxxxx xxxxxxx.
X&xxxx;xxxxxxxxx modifikovaných xxxxxxxxxxxxxx (XXX) xxxxxxxxxxx jako xxxxx doplňkových xxxxx x&xxxx;xxxxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxxx se xxxxxxx xxxxxxxx Xxxx 90/219/XX&xxxx;(5). Xx xxxxx xxxxx xxxxx xxxxxxxxxxxxx xxxxxxx (médium pro xxxxxxx, xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx procesu).
2.3.2 Doplňková xxxxx
Xxxxxxxx xx xxxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx. Je xxxxx xxxxx hlavní stupně xxxxxx xxxxxxxxx xxxxx, xxxxxx míst (xxxxx) xxxxxxxxxxx xxxxxx xxxxx (xxxxx) / činidla (xxxxxxx) x&xxxx;xxxxxx složek x&xxxx;xxxxxxx xxxxxxxx stupně xxxxxxxxxx, které xxxx xxxx xx xxxxxxxx xxxxxxxxx látky, xxxxxxxx xxxxxxxxxxxxxxx postupového xxxxxxxx.
2.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx-xxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx
2.4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx
Xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxx látky (xxxxx) / xxxxxxx (činidel) xxxx její (xxxx) xxxxxxxx/xxxxxxxxxxxxxxxx. U enzymů lze xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxx; x&xxxx;xxxxxxxxxxxxxx s ohledem xx xxxxxx xxxxxxxxxxxxxxxx; x&xxxx;xxxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx xx xxxxxx chuti. X&xxxx;xxxxxxxxx xxxxxxxxxx směsí/extraktů xxx stabilitu xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxx několika vhodných xxxxxxxxxxxxxx xxxxx.
Xxxxxxxxx xxxxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx každého xxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx (xxxxxx, xxxxxxx, xX, xxxxxxx, xxxxxx x&xxxx;xxxxxxx materiály). Xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx látky x&xxxx;xxxxxxxxxxxxxx formě xx xxxx xxx založena xx xxxxxxx xxxx xxxxxxxxxx situacích zahrnujících xxxxxxxxxxxxx spektrum xxxxxxxx xxx užití (xxxx. 25&xxxx;xX, 60&xxxx;% xxxxxxxxx xxxxxxx xxxxxxx a 40 oC, 75&xxxx;% xxxxxxxxx xxxxxxx xxxxxxx).
Xxxxxxxxx xxxxxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx
X&xxxx;xxxxxxxxxxx xxxxx užitých x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx s výjimkou xxxxxxxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx ověří xx xxxxxxx výrobních x&xxxx;xxxxxxxxxxxx xxxxxxxx xxxxxxx a krmiv. Xxxxxx xxxxxxxxx xxxxxxx xxxx trvat xxxxxxx xxxx xxxxxx. Xxxxxxxxx xx xxxxxxx xxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxxxx xxxxx; v opačném xxxxxxx by xxxxxxxxx xxxxx xxxx xxx xxxxxxxx xxxxxxx „xxxxxxxx xx xxxxxxxxx xxxxx“.
Xxxxxx xxxxxxxxx u krmiv xxxxxx xxxxxxxx xxxxxxx xxx xxxxxx. Xxxxxxx xx xxxxxxxxx xxxxxxxxxx u krmiv xx formě kaše x&xxxx;xxxxxxxxxxxx krmiv (včetně xxxxx xxxxxxxxxx nebo xxxxxx forem úpravy) xxx xxxxxx xxxxxxx xxxxx xxxxxx.
X&xxxx;xxxxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxx xx xxxx xx nutno xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxx xx xxxx za xxxxxxxx xxxxxxxxxxxx použití x&xxxx;xxxxx.
Xxxxx-xx ke xxxxxx xxxxxxxxx x&xxxx;xx xxxxxxxx xxxxxxxxx xx nutno xxxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxx rozkladu.
Je xxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxx pozorování xx začátku a jedno xx xxxxx xxxx xxxxxxxxxx.
X&xxxx;xxxxxxx xxxxxxx studie xxxxxxxx xxxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx xxxxxxx xxxx xxxxx xxxxxxxxx xxx zkoušky.
2.4.2 Homogenita
Je nutno xxxxxxxx xxxxxxxxx homogenního xxxxxxxxx xxxxxxxxx xxxxx (xxxxx zchutňujících xxxxxx) x&xxxx;xxxxxxxxx, xxxxxxxx xxxx xx vodě.
2.4.3 Ostatní vlastnosti
Je xxxxx popsat xxxxxxx xxxxxxxxxx, xxxxxxxxx protiprašné x&xxxx;xxxxxxxxxxxxxxx vlastnosti nebo xxxxxxxxx disperze x&xxxx;xxxxxxxxxx.
2.4.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx-xxxxxxxx xxxxxxxxxxxxxxx xxxx interakce
Je xxxxx uvést xxxxxxxxx-xxxxxxxx xxxxxxxxxxxxxxx xxxx interakce, x&xxxx;xxxx by xxxxx xxxxx xx styku x&xxxx;xxxxxx, nosiči, xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx léčivými xxxxxxxxx.
2.5&xxxx;&xxxx;&xxxx;Xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx
2.5.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxx způsob xxxxxxx xx xxxxxx zvířat
Je xxxxx xxxxx xxxx xxxx kategorie xxxxxx, xxxxxxx xxxxxxx xxxx xxxxxxxxx stadium zvířat x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx v příloze IV xxxxxx xxxxxxxx. Xx xxxxx zmínit xxxxx xxxxxxxxxxxxxx. Xxxxx se xxxxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxx xx vodě.
Je xxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxx xxxxxxx, krmiva xxxx xxxxxx vodu. Xxxxx xx xxxxxxxxxx xxxxx v kompletním xxxxxx x&xxxx;xxxxxxxxxx xxxx xxxxxxxx x&xxxx;xxxxxxxxx navrhovaná xxxxxxxx xxxxx. Xxxxx xx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx látky x&xxxx;xxxxxxxxxx xxxxxx, xx xxxxx xxxxxxxxxx.
2.5.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx související x&xxxx;xxxxxxxxxxx xxx xxxxxxxxx/xxxxxxxxxx
2.5.2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxx o bezpečnosti materiálu xx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx Xxxxxx 91/155/XXX xx xxx 5.&xxxx;xxxxxx 1991, kterou xx x&xxxx;xxxxxxxxx xxxxxx&xxxx;10 xxxxxxxx 88/379/XXX vymezují x&xxxx;xxxxxxx xxxxxxxx opatření x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxx nebezpečné přípravky (6). X&xxxx;xxxxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxx výrobě, xxxxxxxxxx, xxxxx x&xxxx;xxxxxxxxx.
2.5.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxxx
Xx xxxxx xxxxx xxxxxxxxxxx podle xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2000/54/ES xx xxx 18. září 2000 x&xxxx;xxxxxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx činitelům xxx xxxxx (xxxxx xxxxxxxxxx xxxxxxxx ve smyslu čl. 16 xxxx.&xxxx;1 směrnice 89/391/XXX)&xxxx;(7). X&xxxx;xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xx xxxxxxx&xxxx;1 této xxxxxxxx xx nutno xxxxxxxxxx xxxxxxxxxxxxx informace, xxxxx xxx umožní xxxxxxxx xxxxxxxxx opatření xx xxxxxxx pracovníků, xxx je xxxxxxxxx x&xxxx;xx.&xxxx;3 xxxx.&xxxx;2 xxxxxxx xxxxxxxx.
2.5.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xx označování
Aniž xxxx xxxxxxx ustanovení x&xxxx;xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx x&xxxx;xxxxxx&xxxx;16 xxxxxxxx (ES) x.&xxxx;1831/2003, xx nutno xxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxx a popřípadě xxxxxxxx xxxxxxxx xxx xxxxx x&xxxx;xxxxxxxxxx (včetně xxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx) x&xxxx;xxxxxx xxx xxxxxxx xxxxxxx.
2.6&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx x&xxxx;xxxxxxxxxx xxxxxx
Xxxxxx xxxxxxx se xxxxxx xx standardní xxxxxx xxxxx xxxxxxxxxx xxxxx XXX (xx. XXX 78-2).
Xxxxx nařízení (XX) x.&xxxx;1831/2003 x&xxxx;xxxxxxxx (XX) x.&xxxx;378/2005 xxxxxx xxxxxxx xxxxxxx v tomto xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx Společenství. Xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx zprávu, x&xxxx;xxx xx xxxxx, xxx jsou xxxx xxxxxx xxxxxx pro xxxxxxx xx účelem xxxxxxxx kontrol xxxxxxxxx xxxxx, xx niž xx xxxxxx vztahuje. Xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xx zaměří xx metody stanovené x&xxxx;xxxxxx&xxxx;2.6.1 a 2.6.2.
Pokud xxx xxxxxxxx XXX xxx xxxxx, na xxx xx xxxxxxxx xxxxxxxx Xxxx (EHS) x.&xxxx;2377/90 xx dne 26.&xxxx;xxxxxx 1990, xxxxxx xx xxxxxxx xxxxxx Společenství xxx stanovení xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxx původu (8), xxxxxx xxx&xxxx;2.6.2 xxxxxxxxx hodnocení xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx. Xxxxxxx sestaví bod 2.6.2 xxxxxxxxxx xxxxxxx metodu, xxxxxxxxx a údaje (xxxxxx xxxxxxxxxxx xxxxxxxxxxx), xxx xxxx xxx xxxxxxxxxx Xxxxxxxx xxxxxxxx pro xxxxxx přípravky (XXXX) x&xxxx;xxxxxxx x&xxxx;xxxxxxxx&xxxx;X&xxxx;xxxxxxxx (XXX) x.&xxxx;2377/90 x&xxxx;xxxxx xxxxxxxxx „Xxxxxx xx Xxxxxxxxxx xxx Xxxxxxxxxx“, xxxxxx&xxxx;8 „Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xx xxx Xxxxxxxx Union“.
V hodnocení xxxxx xxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxx popsané x&xxxx;xxxx&xxxx;2.6.3, pokud xx xxxxxxxxxx laboratoř Xxxxxxxxxxxx, xxxx nebo Xxxxxx xxxxxxxx za xxxxxxxx.
X&xxxx;xxxxxxx x&xxxx;xxxxxxxxx (ES) x.&xxxx;378/2005 xxxxxxx poskytne xxxxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx dokumentace x&xxxx;xxxxxxxx vzorky před xxxxxxxxx xxxx použitelnosti.
Žadatelé xxxxxx xx xxxxxxxx xxxxxx stanovené xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;12 xxxxxxxx (ES) x.&xxxx;378/2005.
2.6.1&xxxx;&xxxx;&xxxx;Xxxxxx analýzy xxx xxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx podrobnou xxxxxxxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxx (xxxxx) xxx xxxxxxxx, xxx xxxx xxxxxxxx maximální xxxx xxxxxxxxx navrhované xxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) v doplňkové xxxxx, xxxxxxxxx, xxxxxxxx x&xxxx;xxxxxxxxx xxxx.
|
2.6.1.1 |
Xxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx x&xxxx;xxxxxxx metod xxxxxxx xxxxxxxxxxx pro úřední xxxxxxxx xxxxx xxxxxx&xxxx;11 xxxxxxxx (ES) x.&xxxx;882/2004. Xxxxxxx xxxxxxx nejméně xxxxx x&xxxx;xxxxxx xxxxxxxxx:
|
|
2.6.1.2 |
Podrobná charakteristika xxxxxx (xxxxx) zahrnuje xxxxxxxxxxxx xxxxxxxxxxxxxxx stanovené x&xxxx;xxxxxxx&xxxx;XXX xxxxxxxx (XX) x.&xxxx;882/2004. |
|
2.6.1.3 |
Xxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx se xxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx. Xxxxxxxxx se xxxxxxxx těchto xxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxxxxxxxx dokládajícími xxxxxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx na xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx v případě, že xxxxx laboratoř xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx, xxx xx xxxxxxxxx x&xxxx;xxxxxxxx (XX) x.&xxxx;378/2005, xxxxxxx xxxxxxxxx zašle xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx (xxxxxxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxx xxxxxx) popisující xxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxx xxxxxxx a nesmí xx xxxxxxxx vyhodnocení xxxxxxx. |
|
2.6.1.4 |
Xx xxx xxxxxxxxx xxxxxx xxx úřad xxxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxxxx xxxxx přílohy III xxxxxxxx (XX) x.&xxxx;882/2004. |
|
2.6.1.5 |
Xxxxxxxx xxxxxxxxxxxxxxx pro metody xxxxxxxxxx xxxxxx látek (xxxxxxxxx xxxxxx) mohou xxx stanoveny x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx referenční xxxxxxxxxx Xxxxxxxxxxxx xxxxx xxxxxx&xxxx;12 nařízení (ES) x.&xxxx;378/2005. |
2.6.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx pro xxxxxxxxx reziduí doplňkové xxxxx xxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx analytických xxxxx xxx xxxxxxxxx xxxxxxxxxxxxxx reziduí a/nebo xxxxxxxxxx doplňkové xxxxx x&xxxx;xxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx.
|
2.6.2.1 |
Xxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx x&xxxx;xxxxxxx xxxxx analýzy xxxxxxxxxxx xxx xxxxxx xxxxxxxx xxxxx článku 11 xxxxxxxx (XX) x.&xxxx;882/2004. Xxxx xxxxxx xxxxxxx xxxxxxx nejméně xxxxx x&xxxx;xxxxxxxxx xxxxxxxxx x&xxxx;xxxx 2.6.1.1. |
|
2.6.2.2 |
Xxxxxxxx xxxxxxxxxxxxxxx xxxxxx (xxxxx) xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx v příloze III xxxxxxxx (XX) x.&xxxx;882/2004 x&xxxx;xxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxxx v rozhodnutí Komise 2002/657/XX&xxxx;(10). Popřípadě xx xxxxx xxxxxx pracovní xxxxxxxxxxxxxxx xxxxxxxxx v rozhodnutích Xxxxxx, xxxxx stanoví xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx látek x&xxxx;xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxxxx xxxxx xxxxxxxx Xxxx 96/23/XX. Xxxxx xxxxxxxxxxxx x&xxxx;xxxxx metody nesmí xxxxxxxxx polovinu xxxxxxxxxxxxxx XXX x&xxxx;xxxx být xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xx jedné poloviny xx dvojnásobek MLR. |
|
2.6.2.3 |
Pracovní xxxxxxxxxxxxxxx interně validovaných xxxxx xx xxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx. Xx xxxxx xxxxx xxxxxxxx těchto xxxxx. X&xxxx;xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx hodnocení xxxxxxxxxxx xxxxxxxxxx žadatelem x&xxxx;xxxxxxx, xx druhá xxxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx referenční laboratoři Xxxxxxxxxxxx, xxx xx xxxxxxxxx v nařízení (ES) x.&xxxx;378/2005, xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx laboratoři Xxxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx (xxxxxxx referenční xxxxxxxxx Xxxxxxxxxxxx xxxxxx xxxxxx) xxxxxxxxxx xxxxx laboratoře x&xxxx;xxxxxxxxxxx x&xxxx;xxxxx žádostí x&xxxx;xxxxx se účastnit xxxxxxxxxxx žádosti. |
|
2.6.2.4 |
Ve xxx xxxxxxxxx xxxxxx xxx xxxx může referenční xxxxxxxxx Společenství xxxxxx xxxxxx xxxxxxxxxxxxxxx z charakteristik xxxxxxxxx v bodě 2.6.2.2. |
|
2.6.2.5 |
Pracovní charakteristiky xxx xxxxxx xxx xxxxxxxx xxxxxxx xxxxx (xxxxxxxxx xxxxxx) xxxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx poskytnutých xxxxxxxxxx xxxxxxxxxx Společenství xxxxx xxxxxx&xxxx;12 nařízení (XX) x.&xxxx;378/2005. |
2.6.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx xxxxxxxx xx identity x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxx látky
Žadatel xxxxxxxx xxxxx xxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx xxxxx bodů 2.1.3, 2.1.4, 2.1.5, 2.2.2, 2.4.1, 2.4.2, 2.4.3 a 2.4.4.
V souladu x&xxxx;xxxxxxxx&xxxx;XX xxxxxxxx (ES) x.&xxxx;1831/2003 xx znění xxxxxxxx (ES) x.&xxxx;378/2005 xxxxx být xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxx xxxxx tohoto bodu, xxxxx xx úřad xxxx Xxxxxx považují xx xxxxxxxx xxx xxxxxxxxx xxxxxxx.
Xxxxxxxxxx xx, xxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxx xxxx xxxxxxxxxxx xxxxxx. Xxxxxx, xxxxx nejsou mezinárodně xxxxxx, xx xxxxx xxxx xxxxxx. X&xxxx;xxxxxx xxxxxxxxx xxxx být xxxxxx xxxxxxxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxx laboratořemi x&xxxx;xxxx xxx zdokumentovány podle xxxxxxxxxxx norem xxxxxxx (xxxx. xxxxxxx laboratorní xxxxx xxxxx xxxxxxxx 2004/10/XX xxxx xxxxx XXX).
Xxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxx xxxxxxxxx pro xxxxxx xxxxxxxx xxxxx xxxxxx&xxxx;11 xxxxxxxx (XX) č. 882/2004, xxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx požadavky (xxxx. xxxxxxxxx, xxxxxxxxx xxxxx).
3.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XXX: STUDIE TÝKAJÍCÍ XX XXXXXXXXXXX XXXXXXXXX XXXXX
Xxxxxx uvedené v tomto xxxxxx x&xxxx;xx xxxxxxxxxx xxxxxxxxx mají umožnit xxxxxxxxxxx:
|
— |
xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxx cílové xxxxx xxxxxx, |
|
— |
xxxxxxxxxx rizika xxxxxxxxxxxxx xx xxxxxxx x/xxxx xxxxxxxx rezistence xxxx xxxxxxxxxxxxxxxx látkám x&xxxx;xxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxx, |
|
— |
xxxxx pro xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xx xxxxxx, jimž xxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxx xxxxx, xxxxx xxxxx vyplývat x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx látky xxxx xxxxxx xxxxxxxxxx, |
|
— |
xxxxx xxx osoby xxxxxxxxxxxx x&xxxx;xxxxxxxxxx látkou jako xxxxxxx nebo xxxxxxxxxxxx xx premixů či xxxxx, xxxxxxxxxxxx xxx xxxxx xxxxxxxxxx xx xxxxxxxx sliznice, xxx xxxx xxxx x |
|
— |
xxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx látky nebo xxxxxxxx z ní odvozených, xxxxxxxxxx přímo x/xxxx xxxxxxxxxxxx zvířaty, xx xxxxxxx prostředí. |
3.1 Studie xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxx xxxxx xxxxxx
Xxxxxx xxxxxxx x&xxxx;xxxxx oddíle xxxx xxxxxx x&xxxx;xxxxxxxxxxx:
|
— |
xxxxxxxxxxx xxxxxxxxx doplňkové látky xxx xxxxxx xxxxx xxxxxx x |
|
— |
xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxxxxxx x/xxxx přenosem xxxxxxxxxx xxxx xxxxxxxxxxxxxxxx látkám x&xxxx;xxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxx. |
3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxx
Xxxxxx testu xxxxxxxxx je xxxxxxxxxx xxxxxxx vyhodnocení xxxxxxxxxx xxxxxxxx doplňkové látky x&xxxx;xxxxxxxx xxxxxx. Xxxxxxx xx xxxxxx ke xxxxxxxxx xxxxxxx xxx xxxxxxxxxx, xxxxx se xxxxxxxxx látka xxxxxx x&xxxx;xxxxxxx xxxxxxx, xxx xx doporučeno. Tyto xxxxx xxxxxxxxx xx xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx pro xxxxxxx xxxxxx druhy/kategorie xxxxxx, xx xxx se xxxxxx xxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxx je xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxx tolerance xx xxxxx xx xxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxx xxxx uvedené xxxxxxxxx xx tyto xxxxx. Xxxxxxx studie xxxxxxx x&xxxx;xxxxx xxxxxx xxxx xxx xxxxxxxx xx doplňkové xxxxx xxxxxxx v oddíle II.
3.1.1.1 Návrh testu xxxxxxxxx zahrnuje xxxxxxx xxx skupiny:
|
— |
skupinu, xxx xx xxxxxxxxx xxxxx xxxxxxxx, |
|
— |
xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxxx x |
|
— |
xxxxxxxx skupinu x&xxxx;xxxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxx. |
X&xxxx;xxxxxxx xxxxxxx xx doplňková xxxxx xxxxxxx xxxxxx xx xxxx desetinásobku nejvyšší xxxxxxxxxx dávky. Pokusná xxxxxxx xxxx xxxxxxx xxxxxxxxx s ohledem xx xxxxxxxx xxxxxx klinických xxxxxx, pracovní xxxxxxxxxxxxxxx, xxxxxxxxx xxxxxx xxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxx vyšetření xxxxxxxxxx xxxxxxx xxxx x&xxxx;xxxx xxxxxxxxx, které xxxxxxxxxxxxx xxxxxxxxx s biologickými xxxxxxxxxxx xxxxxxxxx xxxxx. Xxxxxx se do xxxxx kritické xxxxxxxxx xxxxx z toxikologických studií x&xxxx;xxxxxxxxxxxxx xxxxxx. V tomto xxxxxx se uvedou xxxxxx případné nežádoucí xxxxxx xxxxxxxx během xxxxxxx xxxxxxxxx. X&xxxx;xxxxxxx xxxxxxxxxxxxxx úmrtí xxx xxxxx xxxxxxxxx se xxxxxxx xxxxxxxxx a popřípadě xxxxxxxxxx.
Xxxxx xxx xxxxxxxx, xx xx xxxxxx 100xxxxxxx xxxxxxxxx doporučené xxxxx, nepožaduje se xxxxxxxxxxx xxx rutinní xxxxxxxxx chemického xxxxxxx xxxx. Je-li xxxxxxx xxxxxx xxxxx při xxxxxx nižším, xxx xx 10xxxxxxx nejvyšší xxxxxxxxxx dávky, xx xxxxxx xxxxxxxx xxx, xxx xxxx xxxxx xxxxxxxxx xxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxx, x&xxxx;xxxxxx xx xxxxxxxxx xxxxxxxxx (xxxxxx nekropsie, xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx xxxxxxxx).
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx nemusí xxx x&xxxx;xxxxxxxxxx na xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxx xxxxx nutné provést xxxxx xxxxxxxxx.
Xxxxxxx xxxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxx statistické xxxxxxxxxxx.
3.1.1.2&xxxx;&xxxx;&xxxx;Xxxx xxxxxx xxxxxxx xxxxxxxxx
Xxxxxxx&xxxx;1
Xxxx trvání xxxxxxx xxxxxxxxx: prasata
|
Cílová zvířata |
Doba xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxxx selata |
14 dní |
Pokud xxxxx xx 14&xxxx;xxx xx xxxxxxx |
|
Xxxxxxxxx selata |
42 dní |
42 dní xx xxxxxxx |
|
Xxxxx xxxxxx |
42&xxxx;xxx |
Xxxxxxx xxxxxxxx xx začátku xxxxxx ≤&xxxx;35&xxxx;xx |
|
Xxxxxxxx určené k reprodukci |
1 cyklus |
Od xxxxxxxxxx do xxxxx xxxxxxx |
X&xxxx;xxxxxxx žádosti xxxxxxxx xx sajících a odstavených xxxxx xx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxxx (14xxxxx pro xxxxxx xxxxxx x&xxxx;28xxxxx xxx xxxxxxxxx selata). Xxxxx xxxx prokázána xxxxxxxxx u odstavených xxxxx, xxxxxxxxxx xx xxxxxxxx xxxxxx xxx xxxxx xxxxxx.
Xxxxxxx&xxxx;2
Xxxx trvání zkoušek xxxxxxxxx: xxxxxx
|
Xxxxxx zvířata |
Doba xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxx kuřat/kuřice |
35 dní |
Od xxxxxxxxx |
|
Xxxxxxx |
56&xxxx;xxx |
Xxxxx xxxxx během xxxxx xxxxxxx xxxx xxxxxx |
|
Xxxxx xxxx |
42&xxxx;xxx |
Xx xxxxxxxxx |
Xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxx xxxxx xxxx xxxx xxx xxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxx a kuřic xxxx x&xxxx;xxxxxxx xxxx.
Xxxxxxx&xxxx;3
Xxxx xxxxxx xxxxxxx tolerance: xxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx studií |
Charakteristika xxxxxxxx xxxxxx |
|
Xxxxx telat |
28 dní |
Výchozí xxxxxxx hmotnost ≤&xxxx;70&xxxx;xx |
|
Xxxxxx xxxxx; xxxxx skotu xxxx xxxx k reprodukci |
42 dní |
|
|
Dojnice |
56 dní |
V případě xxxxxxx xxxxxxxxxx xx xx xxxxxx xxxxx x&xxxx;xxxxx xxxxx xx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxxx (28&xxxx;xxx xxx každé xxxxxx).
Xxxxxxx&xxxx;4
Xxxx xxxxxx xxxxxxx tolerance: xxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx cílových xxxxxx |
|
Xxxxxx xxxxxx a výkrm xxxxxx |
28&xxxx;xxx |
Xxxxxxx&xxxx;5
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxxxxxxxx a jiné ryby
|
Cílová xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx zvířat |
|
Losos a pstruh |
90 dní |
Jako xxxxxxxxxxx 90xxxxx xxxxxx xx xxxx xxxxx xxxxxxx xxxxxx, kdy xxxx xxxxx xxxx xxxxxxxx hmotnost xxxxxx xxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxx dvojnásobně.
Má-li xxx xxxxxxxxx xxxxx xxxxxxxxx xxxxx pro xxxxx xxxxxxxxx xxx, testy xxxxxxxxx se xxxxxxxx xxxxx možno xx xxxxxxxx xxxx tření. Xxxxx tolerance trvají 90&xxxx;xxx x&xxxx;xx xxxxx xxxxxxx pozornost xxxxxxx x&xxxx;xxxxxxx xxxxx.
Xxxxxxx&xxxx;6
Xxxx xxxxxx xxxxxxx tolerance: zvířata x&xxxx;xxxxxxxx chovu x&xxxx;xxxx xxxxxxx, xxxxx nejsou xxxxxx k produkci xxxxxxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxx a kočky |
28 dní |
Tabulka 7
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxxxxx
|
Xxxxxx&xxxx;xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxx xxxxxxx |
28&xxxx;xxx |
|
|
Xxxxxx xxxxxxx |
1&xxxx;xxxxxx |
Xx xxxxxxxxxx xx konce xxxx xxxxxxx |
Xxxxxxxx-xx xx xxxxxx xx sající x&xxxx;xxxxxxxxx xxxxxxx, považuje se xx xxxxxxxxxx xxxxxx 49&xxxx;xxx (počínaje xxxxx xx narození) a musí xxxxxxxxx králice xx xx xxxxxxx.
Xxxxx xx xxxxxxxxx látka používá xx specifickou x&xxxx;xxxxxx xxxx, než xx xxxxxxx x&xxxx;xxxxxxxx kategorie xxxxxx, xxxxxx se xxxxx navrhovaných xxxxxxxx xxx xxxxx. Xxxxxx xxxxxxxxxx xxxx xxxxx xxx xxxxxx xxx 28&xxxx;xxx x&xxxx;xxxx xxxxxxxxx xxxxxxxxx parametr (např. x&xxxx;xxxxxxx určených k reprodukci xxxxx xxxx xxxxxxxxxx xxxxx xx xxxxxxxx xx období březosti xxxx počet a hmotnost xxxxxxxxxxx xxxxx xx xxxxxxxx xx xxxxxx xxxxxxx).
3.1.1.3&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxx
Xxxxxx xxxx xxx xxxxxxx jednotlivě x&xxxx;xxxxx o všech pokusných xxxxxxxxx. Xxxxxxxx protokol xxxx být xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx na xxxxxx xxxxxxx údaje. Xxxxxxxxxxxxx se xxxxxxx xxxx xxxxxxx:
|
1. |
xxxxx nebo xxxxx: xxxxx x&xxxx;xxxxx; xxxxxxxx xxxxxx x&xxxx;xxxxx, xxxxxx xxxxxx; x&xxxx;xxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxx xxxxxx xxxx xxxxx x&xxxx;xxxxxxxxxxxx, světelné xxxxxx x&xxxx;xxxxxxx vody, xxxxxx xxxxxxx xxxx x&xxxx;xxxxxx xxxx ve vodě; |
|
2. |
zvířata: xxxx (x&xxxx;xxxxxxx xxxxx xxxxxxxx pro xxxxxxx xxxxxxxx je uvedena xxxxxxxxxxxx xxxxx xxxxxx xxxxxxxx jména x&xxxx;xx xxx v závorkách následuje xxxxxxxx binomické xxxxx), xxxxxxx, stáří (xxxxxxxx x&xxxx;xxxxxxx xxxxx), pohlaví, xxxxxx xxxxxxxx, fyziologické xxxxxxx x&xxxx;xxxxxxx zdravotní xxxx; |
|
3. |
xxxxx a přesná doba xxxxxx xxxxx: xxxxx x&xxxx;xxxx xxxxxxxxxxx zkoušek; |
|
4. |
krmné xxxxx: popis xxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx xxxxx xxxxx (xxxxx) x&xxxx;xxxxxxxx xxxxxxxxx xxxxxx, xxxxxxxxxxx xxxxx (xxxxxxxxxxx xxxxxxx) x&xxxx;xxxxxxxxxxx xxxxxxx. Xxxxx x&xxxx;xxxxxx xxxxxx; |
|
5. |
xxxxxxxxxxx účinné xxxxx (xxxxx) nebo xxxxxxx (xxxxxxx) (x&xxxx;xxxxxxxxxx xxxxx xxxxxxxxx pro xxxxxxxxxx účely) v krmivech xxxx být stanovena xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx uznávaných xxxxx. Xxxxxxxxxx xxxxx xxxxxxxxx xxxxx; |
|
6. |
xxxxx xxxxxxxxx a kontrolních xxxxxx, xxxxx xxxxxx x&xxxx;xxxxx skupině: xxxxx xxxxxx použitých pro xxxxxx xxxx xxxxxxx xxxxxxxxx statistické xxxxxxx. Xxxx by xxx xxxxxxx xxxxxxx metody xxxxxxxxxxxxx hodnocení. Xx xxxxxx musí být xxxxxxxx xxxxxxx zvířata x/xxxx experimentální xxxxx, x&xxxx;xxxxx xx xxxxxx xxxxxxxxx. Případy, xxxxx xxxx možné xxxxxxxxxx xxx xxxxxxxxxx xxxx xxxxxx údajů, xxxx xxx xx xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx xxxxxx xxxx být xxxxxxxxxxxxx; |
|
7. |
xxxxxxx x&xxxx;xxxxxx jakéhokoliv xxxxxxxxxxx xxxxxx zákroku u jedinců xxxx skupin xxxx xxx xxxxxxxxxx (xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx pozorování xxxxxxxxx ve xxxxxx) x |
|
8. |
xxxxxxx/xxxxxxxxxxx ošetření, xx-xx xxxxx, xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx látky x&xxxx;xxxx xxx xxxxxxxxxxx xxxxxxxxxxxx. |
3.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxxx
Xx xxxxx xxxxxxxxxx xxxxxx ke stanovení xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxx rezistenci xxxx xxxxxxxxxxxx používaným x&xxxx;xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx, selektovat rezistentní xxxxxxxxxxx xxxxx za xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx, xxxxxxx účinky x&xxxx;xxxxxxxxxxx patogenů xxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxx, xxxxxxx xxxxxxxxxx nebo xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxx.
X&xxxx;xxxxxxx, xx xxxxxx xxxxx (xxxxx) xxxxxxxx(x)&xxxx;xxxxxxxxxxxxxxx aktivitu xxx xxxxxxxxxxx, xx xxxxx xx obsažena x&xxxx;xxxxxx, xxxx být x&xxxx;xxxxxxx xx xxxxxxxxxxxxxxxxx postupy xxxxxx xxxxxxxxx inhibiční xxxxxxxxxxx (MIK) pro xxxxxxxxx druhy bakterií. Xx-xx prokázána xxxxxxxxx xxxxxxxxxxxxxxx aktivita, xx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx látky xxxxxxxxxx xxxxxxxxxxx bakteriální xxxxx xx xxxxx a u cílových xxxxx x&xxxx;xxxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxxx&xxxx;(11).
Xxxxxxx s doporučeným xxxxxxx xxxxx xx xxxxxxxx xxx všechny mikrobiální xxxxxxxxx xxxxx a pro xxxx doplňkové xxxxx, x&xxxx;xxxxx lze xxxxxxxx xxxxxx xx střevní xxxxxxxxxx. Tyto xxxxxx xxxx xxxxxxxx, xx xxxxx xxxxxxxxx látky xxxxxxxxx xxxxxxxx, které xxxxxxxxxx nadměrnému xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx.
Xxxxx xxxxxxxxxxx xxxxxxxxxxxxxx xxxx xxxxxxx xx xxxxxxxx xxxxxxx, xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxx bez xxxxxx xx xx, zda x&xxxx;xxxxxxxx zvířat xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxxx.
3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx doplňkové látky xxx xxxxxxxxxxxx
Xxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xx zvířat, xxxx xxxx podáváno xxxxxx xxxx voda xxxxxxxxxx xxxxxxxxxx xxxxx xxxx ošetřené xxxxx xxxxxxxxxx látkou.
3.2.1 Studie xxxxxxxxxxx x&xxxx;xxxxxxx
Xxxxxxxxx xxxxxxxxxxx doplňkové xxxxx u cílových xxxxx xx xxxxxxxxxxxx krokem xxx identifikaci x&xxxx;xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xx xxxxxx, xxxx xxxx xxxxxxxx krmivo xxxx voda obsahující xxxxxxxxxx xxxxx. Je xxxxx předložit xxxxxx xxxxxxxx xx absorpce, xxxxxxxxxx, metabolismu x&xxxx;xxxxxxxxxx xxxxx (x&xxxx;xxxxxx xxxxxxxxxx).
Xxxxxx xxxx xxx provedeny xxxxxx mezinárodně xxxxxxxxxxxx xxxxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxx xxx metodologické xxxxxxxxx XXXX x&xxxx;xxxxx xxxxx xxxxxxx laboratorní xxxxx. Xxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Evropského xxxxxxxxxxxx x&xxxx;xxxxxxxxx xx, xxxx-xx to nezbytné.
Studie xxxxxxxxxxx a reziduí x&xxxx;xxxxxxxx xxxxxxx (xxxxxx) xx xxxxxxxx x&xxxx;xxxxxxx látkou xxxxxxxxxxxx xx xxxxxx (xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx, není-li xx xxxxx xxxxxxxxxx).
Xxxxxxx xx xxxxxxxxxx identifikace xxxxxxxxxx xxxxxxxxxxxxxxx xxxx xxx 10&xxxx;% xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx x&xxxx;xxxx než 20&xxxx;% všech xxxxxxx x&xxxx;xxxxxxxxxxxx. Xxxxx xx xxxxxxxxxxx xxxxx účinné xxxxx xxxxxxxxxxxxx xxxxxxxx, xx xxxxx xxxxxxxxxxxxx xxxxxxxxxx xxx xxxx xxxxxxxxx xxxxxx.
Xxxxxxxxx xxxxxx xxxxxxx xxxxx xxxxxx xxx výpočet xxxxxxxx xxxxxxxxxxxx a případně stanovení xxxxxxxx xxxxx x&xxxx;XXX. Xxxxxxxx xx xxxxx xx indikátorové reziduum.
U některých xxxxxxxxxxx xxxxx nemusí xxx x&xxxx;xxxxxxxxxx xx xxxxxx xxxxxx xxxx xxxxx xxxx nutné xxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx.
3.2.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxx
Xxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx, distribuci, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxx doplňkové látky x&xxxx;xxxxxxxx druhů zvířat.
Požadované xxxxxx:
|
1. |
xxxxxxxxxxx bilance po xxxxxx jediné xxxxx xxxxxx xxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx xxx xxxxx (xxxxxxx množství xxxxxxxxxxxx xxxxxxx příjmu) a případně xxxxxxxxxxx xxxxx (je-li xx xxxxxxxxxx), aby xxxxx být xxxxxxxxx xxxxxxxx x&xxxx;xxxxxx xxxxxxxx, xxxxxxxxxx (plazma/krev) x&xxxx;xxxxxxxxxx (xxx, xxxx, výkaly, xxxxx xxxx xxxxx, xxxxxxxxxxx xxxxxx, xxxxxxxxxx xxxx xxxxx) x&xxxx;xxxxx x&xxxx;xxxxx, xx-xx xx xxxxxx, a |
|
2. |
profilace xx xxxxxxxxxxx, xxxxxxxxxxxx metabolitu(ů) v exkrementech x&xxxx;xxxxxxx a distribuce x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx se stanoví xx xxxxxxxxxx podávání xxxxx xxxxxxxx xxxxx xxxxxxxx xx xxxxxxxxxx xxxxx (xxxxxxxxxxx xxxxxxxxx) xxxxx xxxxxx x&xxxx;xxxxxx. Xxxxxxxxxx xxxxx odpovídá xxxxxxxx xxxxxxxxxx dávce xxx xxxxx x&xxxx;xxxx xxx xxxxxxxxxxx do xxxxxx. |
3.2.1.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx
Xxxxx xx xxxxxxxx a povaha xxxxxxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxxx produktech.
Studie reziduí xx požadují xxx xxxxxxx xxxxx, x&xxxx;xxxxx xxxx xxxxx xxxxxx xxxxxxxxxxx.
Xx-xx xxxxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxx tkání xxxx xxxxxxxxx-xx xx x&xxxx;xxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx xx xxxxxxx množství, xx xxxxxxxxx na xxxxxx xxxxxxx xxxxxx xx xxxxxxxxx obsahu x&xxxx;xxxxxxx/xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx x&xxxx;x&xxxx;xxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx udávaná xxxxx.
X&xxxx;xxxxxxxxxxx xxxxx studie xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx, xxxxx jsou xxxxxxxxxxxxx xxxxxxxx, x&xxxx;xxxx xxxxxxxxxxxx xxxxxxxx účinné xxxxx v poživatelné xxxxx (xxxxx, xxxxxxx, xxxxx, xxxx, xxxx + xxx) x&xxxx;xxxxxxxxxx (mléko, xxxxx a med). Xxxxxxxxxxxx xxxxxxxx je xxxxxxxx xxxxxxx xxx xxxxxxx, xxxxx xxxxxxxxxxx je xx xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx. Studie xxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxx v tkáních xxxx xxxxxxxxxx, xxx xxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx lhůtu.
Ke xxxxxxxxx xxxxxxxx xxxxx xx navrhovaný minimální xxxxx zvířat ve xxxxxx x/xxxx xxxxxxxx x&xxxx;xxxxxx xxxx měření xxxxx:
|
— |
xxxxxxxxxxx xxxxx:
|
|
— |
xxxxxxxx:
|
Xxxxx xx xxxxxx xxxxxxxxx xxxxx xxxxxxx.
Xxxxxxx se měří xxx xxxxxx xxxxxxxx xxxxx (xxxxxxxxx xxxx) x&xxxx;xxxxxxx xx xxxxx xxxxxx bodech měření.
Předloží xx xxxxx na xxxxxxxxxxxx xxxxxxxx.
Xx xxxxx xxxxxxx xxxxxx xxxxxxxx, xxxxxxxxxx a vylučování, xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx, x&xxxx;xxxxxxxxxxxxx druhů xxxxxx, x&xxxx;xxxxx xxxx xxxxxxx xxxxxxxx xxxxxxx XXXXX xxxx xxxxxxxxxx x&xxxx;xxxx (xxxx xxxxxxx). Xxxxxxxxx xxxxxx xxxxxxxx se xxxxxxxx xxxxxxxxxx xxxxx xxx xxxxxxxx x&xxxx;xxxxxxx, xxxx-xx xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxxxxxxxx xxxxx xx xx xxxxxxxxx xxxxxxx xxxxxxx.
3.2.1.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx
Xxxx xxx provedena xxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxx, xxxxxxxxxxx profil x&xxxx;xxxxxxxxxxxx hlavních xxxxxxxxxx x&xxxx;xxxx x&xxxx;xxxxxxxx. Xxxxxxxx xxxx xxxxxxxxxxx xxxxx xxxxxxxx oproti kryse xxxxxxx rozdíl v citlivosti, xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx.
3.2.1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxxxxxx xxxxxxx
Xxx xxxxxxxxxx xxxxxx xxx xxxxxxxxxxxx spojeného x&xxxx;xxxxxxxx xxxxxxxx rezidui xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx xx xxxxx xxxx x&xxxx;xxxxx xxxxxxxxx bezpečnostní xxxxxx xxxxxxxx xx xxxxxx xxxxxx xxxxxxxxxx dostupnosti xx použití vhodných xxxxxxxxxxxxx xxxxxx a uznaných xxxxx.
3.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxx studie
Bezpečnost xxxxxxxxx xxxxx xx xxxxxxxx xx základě toxikologických xxxxxx provedených xx xxxxx x&xxxx;xx vivo xx xxxxxxxxxxxxx xxxxxxxxx. Xxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxx:
|
1. |
xxxxxx toxicity; |
|
2. |
genotoxicity (xxxxxxxxxx, xxxxxxxxxxxxxx); |
|
3. |
xxxxxxxxxxxx orální xxxxxxxx; |
|
4. |
xxxxxxxxx orální xxxxxxxx/xxxxxxxxxxxxx; |
|
5. |
xxxxxxxx xxx reprodukci xxxxxx xxxxxxxxxxxx x |
|
6. |
xxxxxxx xxxxxx. |
Xxxxxxxx-xx xxxxx x&xxxx;xxxxxx, xxxx xxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx pro posouzení xxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxx reziduí.
Na xxxxxxx xxxxxxxx xxxxxx xxxxxx xx xxxxxxx xxxxxxxxxxxxx XXXXX.
Xxxxxxxxx xxxxxx xxxxxxxx xx určitých metabolitů xxxxx xxx xxxxxxxx, xxxxx xxxx xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx a u testovaných xxxxxxxxxxxxx xxxxx xx ve xxxxxxxxx xxxxxxx netvoří. Xxxx-xx x&xxxx;xxxxxxxxx xxxxxx xxxxxxxxxxx u člověka, xxxxxx xx xxxx údaje x&xxxx;xxxxx xxx xxxxxxxxxxx x&xxxx;xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx.
Xxxxxxxxxxxxx xxxxxx musí xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxx. Xxxxx xx xxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxx, xxxxxxx xx xxxxxxx xxxxxxxxxxxxx procesu. Xxxxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx být totožný x&xxxx;xxxxxxxxx, xxxxx xx xxx použit x&xxxx;xxxxxxxxx xxxxxxxx.
Xxxxxx xxxx xxx xxxxxxxxx xxxxxx mezinárodně xxxxxxxxxxxx zkušebních metod x&xxxx;xxxxxxx s platnými xxxxxxxxxx xxxxxxxx xxxxxxxx nebo xxxxxxxx xxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxx OECD x&xxxx;xxxxx xxxxx správné xxxxxxxxxxx xxxxx. Xxxxxx xxxxxxxxxx laboratorní zvířata xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxx podmínek xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx a neopakují xx, xxxx-xx xx nezbytné.
3.2.2.1 Akutní xxxxxxxx
Xxxxxx xxxxxx xxxxxxxx xx požadují xx xxxxxxxxxxx x&xxxx;xxxxxxx charakteristice xxxxxxxx xxxxx.
Xxxxxx akutní xxxxxxxx musí xxx xxxxxxxxx xxxxxxx xx xxxx xxxxxxx savců. Xxxxx xxxxxxxxxxx xxxx xxxx být případně xxxxxxxx xxxxxxx xxxxxx.
Xxxxxx xxxxx zjistit xxxxxxx xxxxxxx LD50; postačuje xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx dávky. Xxxxxxxxx xxxxxxxxx xxxxx překročit 2&xxxx;000&xxxx;xx/xx xxxxxxx hmotnosti.
Ke xxxxxxx počtu xxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxx xx xxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxx xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxx toxicitu. Xxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxx xxxxxxx xxxxx xxxxxx, xxxx-xx xxxxx xxxxxxxxxx.
Xx nutno xxxxxxx xxxxxx XXXX 402 (xxxxxx dermální xxxxxxxx), 420 (xxxxxx xxxxx xxxxx), 423 (xxxxxx xxxxxxxxx xxxxx xxxxxx toxicity) x&xxxx;425 (xxxxxx nahoru x&xxxx;xxxx).
3.2.2.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxxx, xxxxxx mutagenity
Za xxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxxxxx jejich xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx, xxxxx xxxx mutagenní x&xxxx;xxxxxxxxxxx xxxxxxxxxx, musí xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx xx genotoxicitu. X&xxxx;xxxxxxx xxxxxxx xx testy xxxx provádět xxx x&xxxx;x&xxxx;xxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxx x&xxxx;xxxxx xx v úvahu xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xx zkušebním xxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxxx xxxx xxxxxxx:
|
1. |
xxxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxx a/nebo x&xxxx;xxxxxxx xxxxx (xxxxx xxxxx xxxx xx xxxxxxxxxxxxx x&xxxx;xxxxxxx myší); |
|
2. |
indukce xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxx xxxxx x |
|
3. |
xxxxxxx xx vivo x&xxxx;xxxxx. |
X&xxxx;xxxxxxxxxx na xxxxxxxx xxxx uvedených xxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxxx k celkovému toxikologickému xxxxxxx xxxxx x&xxxx;xxxxxx xxxxxxxx xxxxx mohou xxx nezbytné xxxxxxxxx xxxxxxx.
Xxxxxxxxx xx xxxx xxx v souladu x&xxxx;xxxxxxx XXXX 471&xxxx;(xxxx reverzních xxxxxx x&xxxx;Xxxxxxxxxx typhimurium), 472&xxxx;(xxxx reverzních mutací x&xxxx;Xxxxxxxxxxx xxxx), 473&xxxx;(xxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxx xx vitro), 474 (test xx mikrojádra x&xxxx;xxxxxxx&xxxx;xxxxxxxxxxxx), 475&xxxx;(xxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxx xxxxx), 476&xxxx;(xxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxx xx xxxxx) xxxx 482&xxxx;(xxxxxxxxxxx xxxxxxx XXX x&xxxx;xxxxxxx xxxxx xx vitro), xxxxx x&xxxx;xxxxxx xxxxxxxxxxx xxxxxx XXXX xxx xxxxxxx in vitro x&xxxx;xx xxxx.
3.2.2.3&xxxx;&xxxx;&xxxx;Xxxxxx subchronické xxxxxx xxxxxxxx při xxxxxxxxx xxxxx
X&xxxx;xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxx xxxxx xx předloží xxxxxxx xxxxx studie xx hlodavcích x&xxxx;xxxxx xxxxxx xxxxxxx 90 dnů. Xxxxxxxx-xx se xx xx xxxxx, musí xxx xxxxxxxxx xxxxx xxxxxx xx jiném xxxxx než xxxxxxxxxx. Xxxxxxxxx xxxxxxx musí xxx xxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx xxxxx xx xxxxxxxxx xxxxxxx, xxx xx xxxxxxx xxxxxx xx xxxxx. Xxxxxxxxx xxxxx xxxx xx xxxxxxxxxx okolností odhalit xxxxxxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxx xxxxxx xxxxxxxxx xxxxx vykazovat žádnou xxxxxx xxxxxxxx.
Xxxxxxxxx xxx xxxx xxxxxxx xxxx xxx x&xxxx;xxxxxxx s pokyny XXXX 408 (xxxxxxxx) xxxx 409 (xxxx xxxxx než xxxxxxxx).
3.2.2.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx xxxxxx xxxxxxxx (xxxxxx karcinogenity)
K ověření potenciálu xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxxx xx nutno xxxxxxx xxxxxx chronické xxxxxx xxxxxxxx xxxxxxx xx xxxxxx druhu x&xxxx;xxxxx xxxxxx nejméně 12&xxxx;xxxxxx. Xxxxxxx druh xxxx xxx xxxxxxxxxxxxx xxxxxx xxxxx xxxxx dostupných xxxxxxxxx xxxxx, xxxxxx xxxxxxxx 90xxxxxxx xxxxxx. Xxxxxxxxxxx xxxxxx xx xxxxx. Xxxxxxxx-xx se xxxxx xxxxxx, použije xx druh xxxxxxxx xxxx jiný xxxx xxxxx než xxxxxxxx. Xxxxxxxxx xxxxxxx musí xxx xxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx xxxxx xx xxxxxxxxx xxxxxxx, aby xx xxxxxxx xxxxxx xx xxxxx.
Xx-xx xxxxxx xxxxxxxxx toxicity xxxxxxxxxxx xx zkouškou karcinogenity, xxxx trvání je xxxxxxxxxxx na 18&xxxx;xxxxxx x&xxxx;xxxx a křečků a na 24&xxxx;xxxxxx x&xxxx;xxxx.
Xxxxxx karcinogenity xxxxxx xxx xxxxx, xxxxx xxxxxx xxxxx x&xxxx;xxxx xxxxxxxxxx:
|
1. |
xxxxxxxx xxxxx xxxxxxxxx výsledky x&xxxx;xxxxxxx xx xxxxxxxxxxxx; |
|
2. |
xxxxxx xxxxxxxxxxxx xxxxxxxxx xx známými xxxxxxxxxxx x |
|
3. |
xxxxxxxxxxxx při xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxx (xxx)xxxxxxxxx. |
Xxxxxxxxx xxxx xxx v souladu x&xxxx;xxxxxxx XXXX 452 (xxxxxx xxxxxxxxx xxxxxxxx) xxxx 453 (kombinovaná xxxxxx chronické toxicity/karcinogenity).
3.2.2.5 Studie xxxxxxxx pro reprodukci (xxxxxx toxicity xxx xxxxxxxxxx xxxxx)
X&xxxx;xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx funkce x&xxxx;xxxxx xxxx xxxxx xxxx xxxxxxxxxx xxxxxx xx xxxxxxxxx vyplývajících x&xxxx;xxxxxxxx xxxxxx xxxxx xx xxxxx xxxxxxx xxxxxx xxxxxxxxxxx funkce xxxxxx:
|
1. |
xxxxxxxxxxxxx xxxxxx toxicity xxx reprodukci x |
|
2. |
xxxxxx xxxxxxxx xxx prenatální xxxxx (xxxxxxx xxxxxxxxxxxx). |
X&xxxx;xxxxxx xxxxxxx xxxxx xxx xxxxxxx xxxxxxxxxx alternativní xxxxxx xxxxxxxxx používání xxxxxx.
3.2.2.5.1.&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxx
Xxxxxx xxxxxxxxxxx xxxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx nejméně xxxx filiálních generací (X1, X2) x&xxxx;xxxxxxx xxxxxxx xxxxx, obvykle xxxxxxxx, x&xxxx;xxxxx xxx xxxxxxxxxxx xx studií xxxxxxxxxxxx. Xxxxxxxx xxxxx xx podávána orálně xxxxxx a samicím xx xxxxxxx dobu xxxx xxxxxxx. X&xxxx;xxxxxxxx xx xxxx xxxxxxxxxx xx xx xxxxxxx zvířat xxxxxxxx&xxxx;X2.
Xxxxxxx důležité xxxxxxxxx xxxxxxxx xx oplození, xxxxxxxx, porodu, xxxxxxxxxx xxxxxxx, xxxxxx, růstu x&xxxx;xxxxxx zvířat generace F1 xx xxxxxx xx xx dospělosti x&xxxx;xxxxx xxxxxxxx&xxxx;X2 xx do xxxxxxx xxxx být xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxx. Xxxxxxxxx pro xxxxxx xxxxxxxx xxx xxxxxxxxxx xx xxxx být x&xxxx;xxxxxxx x&xxxx;xxxxxxx XXXX 416.
3.2.2.5.2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxx pro xxxxxxxxxx xxxxx (xxxxxxx xxxxxxxxxxxx)
Xxxxx xx xxxxxxx xxxxxxxx nepříznivé xxxxxx xx březí xxxxxx x&xxxx;xxxxx xxxxxx x&xxxx;xxxxx x&xxxx;xxxxxxxx expozice xx xxxxxxxxx xxxxxxxxxx xxxxxxx xx celou dobu xxxxxxxx. K těmto xxxxxxx xxxxx zvýšená xxxxxxxx x&xxxx;xxxxxxx xxxxx, úmrtí xxxxxx – xxxxx, xxxxxxx xxxx plodu x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx a anomálie xxxxx.
Xxxxxx, který xx xxxx xxx xxxxx xxxxxx, xx xxxxxxx xxxxx. Xx-xx xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxxxx, xxxxxxx xx xxxxx xxxxxx vývojové xxxxxxxx x&xxxx;xxxxxxx xxxxx, xxxxx xxxxx u králíka. Xx-xx xxxxxxx xx xxxxxxxxxxxx xx krysách xxxxxxxxx, xxxx xxxxxx u druhého xxxxx xxxxx xxxxx xxxxxxx, xxx xxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxxxx, xx ADI xxxx založena xx xxxxxxxxxxxx u krys. X&xxxx;xxxxx xxxxxxx by xxxx xxxxx studie x&xxxx;xxxxxxx xxxxx, aby xx xxxxx xxxxxxxxxxxx xxxx xxx tento parametr. Xxxxxxxxx xx měly xxx v souladu x&xxxx;xxxxxxx XXXX 414.
3.2.2.6&xxxx;&xxxx;&xxxx;Xxxx xxxxxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxxx
Xxxxxxxx-xx xxxxxx k obavám, xx xxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxxxx doplňkové xxxxxxxxx pro posouzení xxxxxxxxxxx xxxxxx látky x&xxxx;xxxxxx reziduí. Tyto xxxxxx xxxxx zahrnovat xxxxxxx farmakologických xxxxxx, xxxxxx xx mladá (xxxxxxxxxxxxxx) zvířata, xxxxxxxxxxxxx xxxx xxxxxxxxxxxxx.
3.2.2.7&xxxx;&xxxx;&xxxx;Xxxxxx množství xxxxx xxx xxxxxxxxxxxx xxxxxxxxxxxx účinku (XXXXX)
XXXXX xx obvykle založena xx toxikologických xxxxxxxx, xxxxxxxxxxxxx xxxx xxxxx xxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxx.
Xxxx xx xxxxxxxx XXXXX. Xxx xxxxxxxx xxxxxxxx NOAEL, xxxxxxxxx x&xxxx;xx/xx tělesné hmotnosti xx xxx, xx xxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx z předchozích xxxxxx xxxxx x&xxxx;xxxxxxxxx důležitými xxxxxxxxxxxx xxxxx (včetně xxxxxxxxx vhodné xxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxx xx xxxxxxx), xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx, xxxxx mají xxxx xxxxxxxxxxx chemické xxxxxxxxx.
3.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxxx xxx spotřebitele
Bezpečnost xxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxxx XXX (přijatelné xxxxx xxxxx) x&xxxx;xxxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxx. V případě xxxxxxxx x&xxxx;xxxxxxxxx xxxxx xx xxxxx XXX xxxx xxxxxx XX (nejvyšší xxxxxxxx dávka).
3.2.3.1 Návrh xxxxxxxxxx xxxxx xxxxx (ADI) xxx účinnou xxxxx(x)
Xxxxxxxxxx xxxxx xxxxx (ADI) (xxxxxxxxx x&xxxx;xx doplňkové xxxxx xxxx materiálu xxxxxxxxxxxx se x&xxxx;xxxxxxxxx xxxxx xx xxxxx x&xxxx;xxx) xx stanoví xxx, xx xx xxxxxxxx xxxxxxx NOAEL (xx/xx tělesné xxxxxxxxx) xxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx a vynásobí xxxxxxxxx xxxxxxxxx xxxxxxxx těla, xx. 60 kg.
Popřípadě xx XXX navrhne. XXX xxxx xxx xxxxxx „xxxxxxxxxxxxxxx“ xxxxxxxx x&xxxx;xxxxx xxxxxxxx xxx testech xx zvířatech. XXX xx xxxxxxxxx, pokud xxxxx xxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxx.
Xxxxxxxxx XXX xxxxxxx xxxxxxxx xxxxxxx metabolismus xxxxxx xxxxx u cílových a laboratorních xxxxxx (xxx xxx&xxxx;3.2.1.4 Xxxxxxxxxx xxxxxxxxxx xxxxxxx), xxx zajišťuje, xx xxxxxxxxxxxx xxxx vystaveni xxxxxxx reziduím jako xxxxxxxxxxx xxxxxxx xxxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx mohou xxxxxxxxx XXX umožnit xxxxxxxxx studie x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxx zvířat xxxx s metabolity, xxxxx xxxx specifické xxx xxxxxx xxxx.
Xxxxxxxxxxxx xxxxxx xxxxxxx xxx xxxxxxxxx XXX x&xxxx;xxxxxxxxx doplňkové xxxxx xxxxx x&xxxx;xxxxx xxxxxx biologických účinků x&xxxx;xxxxxxx údajů xxxxxxxxx xx xxxxxxxxx XXXXX, xxxxxxxxxx těchto xxxxxx xxx xxxxxxx a reverzibilitu xxxxxx x&xxxx;xxxxxxxxx poznatky x&xxxx;xxxxxx účinku (účincích) xxxxxxx xx člověka.
Pro xxxxxxx ADI xx xxxxxxx xxxxxxxxxxxx faktor xxxxxxx 100 (pokud xxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxxxxxx studií). Xxxx-xx k dispozici údaje x&xxxx;xxxxxx xxxxx vztahující xx k člověku, může xxx xxxxxx nižší xxxxxxxxxxxx xxxxxx. Vyšší xxxxxxxxxxxx faktory se xxxxx použít x&xxxx;xxxxxxxxxx xxxxxxx xxxxxx nejistoty x&xxxx;xxxxx nebo x&xxxx;xxxxxxx, xx-xx NOAEL stanovena xx xxxxxxx konkrétního xxxxxxxxxx parametru, například xxxxxxxxxxxx.
3.2.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxx xxxxx (XX)
X&xxxx;xxxxxxxxx doplňkových xxxxx xxxx xxx vhodnější xxxxxxx xxxxxxxxx xxxxxxxxxxx xx XX, xxx xx xxxxxxxx množství xxxxxxxxx xxxxxxxxxxx denního xxxxxx živiny (xx xxxxx xxxxxx) považovaná (xxxxxxxxxxxxxx xxxx mezinárodními xxxxxxxxx institucemi) xx xxxxxx, xxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx na zdraví x&xxxx;xxxxxxxxxxxx nebo xxxxxxxxxx xxxxxx spotřebitelů.
Dokumentace obsahuje xxxxx, které xxxxxxxxx, xx xxxxx xxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxx, xxx xx mohlo xxxxx x&xxxx;xxxxxxxxxx UL x&xxxx;xxxxxxxxxxxx ke xxxx xxxxxx xxxxxxx živiny.
Jsou-li xxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx(x)&xxxx;x&xxxx;xxxxxxxxxxx xxxxxxxxxx vyšší, než xx u těchto xxxxxxxx xxxxxxxx xx xxxxx xxxx než se xxxxxxx, xx nutno xx jednoznačně xxxxx.
3.2.3.3&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxxxxx
Xxxxxxx příjem doplňkové xxxxx a/nebo xxxxxx xxxxxxxxxx spotřebitelem ze xxxxx xxxxxx xxxx xxx nižší xxx XXX xxxx XX.
Xxxxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx x&xxxx;xxxxxxxxxxxx ke xxxxxxxxxxx (xxxxxxx rezidua xxxx xxxxxxxxxxx průměr x&xxxx;xxxxxxxx xxxxxx xxxxxxx) xxxxxxxx v tkáních x&xxxx;xxxxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx. Kromě xxxx se x&xxxx;xxxxxxx xxxxxxx xxxxxxx xxx xxxxx ochranné lhůty xxxxxxx xxxxx xxxxxx xxxxxxxx xxxxxxxx na xxxxxxx nejhoršího xxxxxxx.
X&xxxx;xxxxxxxxxxx xxxxx xxxxxxxx pro xxxx druhů xx xxxxxxxx x&xxxx;xxxxx vypočte xxxxxxxxx xxx savce, xxxxx x&xxxx;xxxx a vezme xx nejvyšší xxxxxxx. X&xxxx;xxxxxx údaji xx xxxxxxxx xxxxxxxx expozice x&xxxx;xxxxx a vajec. Xxxxx xx xxxxxxxxx doplňková xxxxx používá x&xxxx;xxxxx xxxxxxxxxxxxx mléko a nosnic, xxxxxxxxxxx xx příslušné xxxxxxxx hodnoty pro xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxx xxxxxxxx mléka x&xxxx;xxxxx. Je-li doplňková xxxxx xxxxxxxxx xxx xxxx x&xxxx;xxxxxxx x&xxxx;xxxxx xxxxxxxxxxx mléko, xxxxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxx k hodnotám xxx xxxxxxxx xxxxx x&xxxx;xxxxx. Xxxxxxx xxxxxxxxx xx xxxxxxxx stejně.
V určitých případech (xxxx. xxxxxxx nutriční x&xxxx;xxxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx xxxxxx pro xxxxxxxxx xxxxx) xxxx xxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx u člověka xxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxx, xxxxx xx xxxxxxxxxx xxxxxxxxxxxxxxxxxxxxx xxxxxxxx. Xx-xx xx xxxxx, xxxx upřesnění by xxxx xxx xxxxxxxx xx xxxxxxx xxx Xxxxxxxxxxxx.
Xxxxxxx&xxxx;1
Xxxxx o teoretické denní xxxxxx spotřebě (x&xxxx;xxxxx xxxx produktů)
|
Savci |
Ptáci |
Ryby |
Ostatní |
|
|
Svaly |
300 |
300 |
300 (12) |
|
|
Játra |
100 |
100 |
— |
|
|
Ledviny |
50 |
10 |
— |
|
|
Tuk |
50 (13) |
90 (14) |
— |
|
|
+ Xxxxx |
1&xxxx;500 |
— |
— |
|
|
+ Xxxxx |
— |
100 |
— |
|
|
+ Xxx |
20 |
3.2.3.4&xxxx;&xxxx;&xxxx;Xxxxx maximálních xxxxxx reziduí (MLR)
Maximálním xxxxxxx reziduí se xxxxxx maximální koncentrace xxxxxxx (xxxxxxxxx jako μx xxxxxxxxxxxxxx xxxxxxx xx kg poživatelné xxxxx xxxxx xxxx xxxxxxxx), kterou xxxx Xxxxxxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxxx xxxx xxxxxxx jako přijatelnou x&xxxx;xxxxxxxxxxx. Je xxxxxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxxxx, x&xxxx;xxxx se xxxxxxx, xx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxx xxxxxx xxxx, xxxxxxxxx xxxxxx XXX. XXX xxxxx xxx ADI xxxxxxxx.
Xxx xxxxxxxxx MLR xxx doplňkové látky xx xxxxx vzít x&xxxx;xxxxx xxxxxx xxxxxxx, xxxxx pocházejí z jiných xxxxxx (xxxx. xxxxxxxxx xxxxxxxxxxx xxxxxx). XXX xxx xxxx snížit, xxx byl v souladu x&xxxx;xxxxxxxxxx xxx xxxxx xxxxxxxxxxx xxxxx, a v rozsahu, x&xxxx;xxxxx jsou xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx.
Xxxxxxxxxx XXX (xxxxxxxxx xxxx xx xxxxxxxxxxxxxx xxxxxxx xx kg xxxxxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxx) xx xxxxxxxxx xxxxxxx xxx různé xxxxx xxxx produkty xxxxxxxx xxxxx xxxxxx. Xxxxxxxxxx MLR x&xxxx;xxxxxxx xxxxxxx xxxx produktech xxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxx xxxxxxx a variabilitu xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx/xxxxxxxxxx u živočišného druhu xxxxxxxxxxx xxx xxxxx. Xxxxxxxxxxx xx xxxxxxx xxxxxxxx použitím 95 % xxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxx. Nelze-li xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxx xxxxxx, xxxxxxxxxxx xx xxxxx xxxx vyjádří použitím xxxxxxxx jednotlivé xxxxxxx.
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx musí xxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxxxx xxxxxx přípravky (xxxxxx&xxxx;8 „Xxx xxxxx xxxxxxxxx xxxxxxxxx products xx European Union – Xxxxxx xx xxxxxxxxxx xxx xxxxxxxxxx. Xxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxxxxxxx xx xxxxxxx xxxxxxx xxxxxx (XXXx) xxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx products xx xxxxxxxxxx xx xxxxxx xxxxxx“, xxxxx&xxxx;2005).
X&xxxx;xxxxxxx xxxxxxx xx xxxxx xxxx xxxxxxx xxxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxxx limitů reziduí xxx kategorie xxxxxxxxxxx xxxxx xxxxxx než xxxxxxxxxxxxxxx a histomonostatika.
Ke stanovení xxxxxxxx xxxx reziduím x&xxxx;xxxxxxxxxxxx (xxxxx výpočtu x&xxxx;xxxx&xxxx;3.2.3.3) xxxxx xxxxxxxxxx XXX pro různé xxxxx nebo xxxxxxxx x&xxxx;xxxxx poměr xxxxxxxxxxxxxx xxxxxxx ke xxxx xxxxxxxx (tabulka 2).
Tabulka 2
Definice xxxxxxx xxx xxxxxxxxx XXX
|
x-x |
xxxxxxxxxx xxxxx/xxxxxxxx (játra, xxxxxxx, xxxxx, kůže + xxx, mléko, xxxxx, xxx) x&xxxx;xxxxxxx xxxxxx xxxxxx |
|
XXXx-x |
xxxxxxxxx limit xxxxxxx x&xxxx;xxxxxxx/xxxxxxxxxx (mg xxxxxxxxxxxx xxxxx/xx) |
|
Xxx-x |
xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx xxxxx/xxxxxxxx (kg) xxxxxxxxx xxxxx tabulky 1 xxxx xxxxxx zpřesnění |
|
TRCi-j |
koncentrace xxxxx reziduí x&xxxx;xxxxxxxxxxxx xxxxxxx/xxxxxxxxxx (xx/xx) |
|
XXXx-x |
xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx/xxxxxxxxxx (xx/xx) |
|
XXXXx-x |
xxxxx XXXx-x x&xxxx;XXXx-x xxx xxxxxxxxxx xxxxx/xxxxxxxx |
|
XXXXx-x |
xxxxxxxx xxxxxx xxx jednotlivé xxxxx/xxxxxxxx xxxxxxxxx ze xxxxx xxxxxxx (xx) XXXXx-x = Xxx-x ×&xxxx;XXXx-x |
|
XXXXXXXx-x |
xxxxxxxx xxxxxx xxxxxxxxx x&xxxx;XXX (xx) xxxxxxxxxxxx xxxxx/xxxxxxxx XXXXXXXx-x = Xxx-x × MLRi-j ×&xxxx;XXXXx-x -1 |
Xxxxxxxx hodnoty xxx XXX x&xxxx;XXX xx vloží xx xxxxx uvedeného x&xxxx;xxxxxxx&xxxx;3 x&xxxx;xxxxxxx xxxxxxx se xxxxxxxxxx. Xxxx-xx x&xxxx;xxxxxxxxx xxxxx xxxxxx údajů, xxxxxxx hodnoty xxxx xxx mezí xxxxxxx, xx xxxxxxxxx extrapolace XXXX.
Xxxxxxxx MLR lze xxxxxxx pouze v případě, xx-xx xxxxxx jednotlivých XXXX xxxxx než XXX. Xx-xx XXX xxxxxxxxxx, xxxxxxxxxxxx xx xxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxx xxxxx xxxx xxxxxxx xxxxxxxxx. První xxxxx XXX xx xxxxx xxxxxx xxxxxx xxxxxxx MRC jako xxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxx DITRMLR xxxxxxx x&xxxx;xxxxxxxxxxxx MLR xxxx xxx xxxxx než XXX x&xxxx;xxxxxx xx xxxxxx xxxxxxxxxxxx XXXX. Xx-xx ADI xxxxxxxxxx, xxxxxxx xx xxxxx XXX x&xxxx;xxxxxxx xx xxxxxxxx.
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx xxxxx být rezidua xxxxxxxx x&xxxx;xxxxx, vejcích xxxx mase xxx xxxxxxxxx XXX, mohou xxxx xxxxxxx xxxxxxx xxxxxxxxx při určitém xxxxx xxxxxxxxxx. X&xxxx;xxxxxx xxxxxxxxxxx xxxxx xxxx xxx xxxxxx vedle xxxxxxxxx xxxxxx MLR xxxxxx „xxxxxxxxx reziduum xxxxxxxxxx se zpracováním (xxxxxxxx)“ (MPCR).
Tabulka 3
Vzor pro xxxxxxxx xxxxxx XXX
|
Xxxxx |
Xxxxxxx |
Xxxxx |
Xxxx +&xxxx;xxx |
Xxxxx |
Xxxxx |
Xxx |
Xxxxxx |
|
|
XXX&xxxx;(15) (xx/xx) |
— |
|||||||
|
XXX&xxxx;(16) (xx/xx) |
— |
|||||||
|
XXXX&xxxx;(16) |
— |
|||||||
|
XXXX&xxxx;(17) (xx) |
||||||||
|
Xxxxxxxxxx XXX (xx/xx) |
— |
|||||||
|
XXXXXXX(xx) |
3.2.3.5&xxxx;&xxxx;&xxxx;Xxxxx xxxxxxxx xxxxx
Xxxxxxxx xxxxx xxxxxxxx xxxx, xxx xxxxxxxxx xx xxxxxxxx xxxxxxxx doplňkové látky, xxxxx xx nezbytná x&xxxx;xxxx, aby hladiny xxxxxxx xxxxxx xxx XXX.
3.3&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro uživatele/pracovníky
Pracovníci xxxxx xxx vystaveni xxxxxxxx xxxxxxxxx látky xxxxxxx xxx xxxxxxxxx xxxx xxxxxx xxx xxxxxx, manipulaci xxxx xxxxx xxxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx při manipulaci xxxx xxxxxxx doplňkové xxxxx. Xxxx xxx xxxxxxxxxx doplňkové informace x&xxxx;xxxxxxx xxxxxxxxx s látkami.
Musí xxx xxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxxxxx. Xxxx-xx x&xxxx;xxxxxxxxx, představují xxxxxxxxxx získané xx xxxxxxxx závodě xxxxx xxxxxxxx xxxxx xxxxxxxxx xxx xxxxxxxxx rizik xxx xxxxxxxxxx, která xxxxxxxxx x&xxxx;xxxx, xx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xx xxxxxxx a dotykem. Xxxxx, xxxx xx xxxxxxxxx xxxxxxx mimořádnou xxxxxxxxx, jsou xxxxxxxxx xxxxx, xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx x/xxxx xxxxxx zvířat xx xxxxx suchého xxxxxx xxxx xx xxxxxxx xxxx xxxxx prášek xxxxxxxxx, x&xxxx;xxxxxxxxx xxxxx, xxxxx xxxxx mít xxxxxxxxx potenciál.
3.3.1 Hodnocení toxikologického xxxxxx xxx bezpečnost xxxxxxxxx/xxxxxxxxxx
Xxxxxx pro xxxxxxxxxx xx xxxxxxx x&xxxx;xxxxx xxxxxx s užitím xxxxxxxxx xxxxx xx formě, xxx xxx xxxx xxxxxx xxxxxx. Xxxxxxxx xx xxxxxx xxxxxx xxxxxxxxx toxicity, xxxxxx xxxx xxxxxxxxxxxxx, xx xxxxxxx xxxx tvořit xxxxxx nebo xxxx, xxxxx by xxxx xxxxx vdechnout. Xx xxxxx xxxxxxx xxxxxx xx xxxxxxxxxx kůže x&xxxx;xxxx-xx xxxxxxxx těchto xxxxxx xxxxxxxxx, xxxxxxx xx xxxxxxxxxx xxx xxxxxxxx (xxxx. xxx). Xxxxxxxxx xx xxxxxx xxxxxxxxx potenciál/potenciál xxxxxxxxxxxxx xxxx. Xxxxx x&xxxx;xxxxxxxx xxxxxxx xxx xxxxx xxxxxxxxx xxxxxxxxxxx pro xxxxxxxxxxxx (xxx xxx&xxxx;3.2.2) xx použijí x&xxxx;xxxxxxxxx xxxxx xxxxxxxxx toxicity xxxxxxxxx látky. Xxxx xxx xx x&xxxx;xxxxxxx xxxxxxx vyhodnotí xxxxxx xxxxxxx xxxxxx xxxx xxxxxxxxxx studií.
3.3.1.1 Účinky xx xxxxxxx ústrojí
Musí být xxxxxxxx, xx xxxxxxx xxxxxx nebo mlhy xxxxxxxxx xxxxx ve xxxxxxx xxxxxxxxxxxxx xxxxxx xxx zdraví xxxxxxxxx/xxxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx je xxxxx doložit:
|
— |
inhalační testy xx xxxxxxxxxxxxx zvířatech, |
|
— |
uveřejněné xxxxxxxxxxxxxxx xxxxx a/nebo xxxxxxx údaje žadatele x&xxxx;xxxx xxxxxxxx zařízení x/xxxx xxxxxxxxxxx x |
|
— |
xxxxx xx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx. |
Xxxxxx xxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxx, xxxxx částice nebo xxxxxxx x&xxxx;xxxxxxx xxxx xxx 50 μm představují xxxx xxx 1&xxxx;% xxxxxxxxx produktu.
Protokoly xxx xxxxxx akutní xxxxxxxxx xxxxxxxx xx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx XXXX 403. Pokud xx xxxxxxxx xx xxxxxxxx xxxxxx subchronické xxxxxxxx, měly xx xxxxxxxx pokyny OECD 412 (inhalační xxxxxxxx xxx opakované xxxxx: 28xxxxx xxxx 14xxxxx xxxxxx) xxxx 413 (xxxxxxxxxxxx xxxxxxxxx toxicita: 90xxxxx xxxxxx).
3.3.1.2&xxxx;&xxxx;&xxxx;Xxxxxx xx xxx x&xxxx;xxxxxxx
Xxxxx jsou x&xxxx;xxxxxxxxx, xxxx xxx xxxxxxxxxx xxxxx xxxxxx x&xxxx;xxx, xx xxxxxx xxxxx xxxxxxx dráždivosti x/xxxx xxxxxxxxxxxxx x&xxxx;xxxx. Xxxx xxxxxx musí xxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxx na xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx xxxxxxx x&xxxx;xxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx. Xxxxxxx se xxxxxx xxxxxxxxx xxxxxxxxx – xxxxxxxxx xxxxxxxxxxxxx xxxx. Xxxxxxxxx pro xxxx studie xx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxx XXXX 404 (xxxxxxxxxx/xxxxxxxxx xxxx), 405 (xxxxxxxxxx/xxxxxxxxx xxx), 406 (xxxxxxxxxxxxx xxxx), 429 (xxxxxxxxxxxxx xxxx – xxxx xxxxxxxx xxxxxxx xxxxx).
Xxxx-xx známy xxxxxxx xxxxxxxxxx xxx xx xxxxxxxxxxxx xxxxx, nebo xx xxxxxxxxxx zkoušek xx vitro, xxxxxxxxxxx xx xxxxx xxxxxxx xx xxxx.
Xxxxx xx xxxxxxxx xxxxxxxx, xx-xx xxxxxxxxx xxxxx xxxxxxx xxx vdechnutí. Xxxxxxx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx XXXX 402 (xxxxxx xxxxxxxx xxxxxxxx).
3.3.1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx
Xxx posouzení xxxxxxxxx xxxxxxxx xx xxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxx xx xxxxxx xxxxxxx xxxxxxxxx xx bezpečnost xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx (xxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx, xxxxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxx toxicity xxx xxxxxxxxxx a metabolismu).
3.3.1.4 Posouzení xxxxxxxx
Xxxx být xxxxxxxxxx xxxxxxxxx o tom, zda xxxxxxxxx xxxxxxxxx xxxxx xx schopno xxxxxxx xxxxx xxxxxxxx všemi xxxxxxx (vdechnutím, xxxx xxxx xxxxxxx). Tyto xxxxxxxxx musí xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx (pokud xxxxxxxx), xxxxx xx xx mělo xxxxx xxxxxxxxxxxxxxxx koncentrace xx xxxxxxx, xxxxxxxxxxx xxxx xxxx xxxxxx. Xxxxx xxxxxxxxxxxxx xxxxx xxxxxx x&xxxx;xxxxxxxxx, musí xxx xxxxxxxxx dostatek informací xxx přiměřené xxxxxxxxx xxxxxxxx.
3.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xx kontrole xxxxxxxx
Xx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxx xxx xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxx zdraví uživatelů/pracovníků (xxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxxxxxx toxicita). Je xxxxx navrhnout bezpečnostní xxxxxxxx ke xxxxxxx xxxx xxxxxxxxx xxxxxxxx. Xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx se xxxx xxxxxxxx xx za xxxxxxxx xxxx k ochraně xxxx xxxxxxxxxx přetrvávajícím xxxxxxx poté, kdy xx xxxx zavedena xxxxxxxxx opatření. Za xxxxxxxxxx xxxxxx xx xxxxxxxx xxxxxxxxx přepracování xxxxxxxx.
3.4&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx
Xxxxxxxxxx xxxxxx doplňkových xxxxx na xxxxxxx xxxxxxxxx xx xxxxxxxx x&xxxx;xxxx důvodu, že xx xxxx xxxxxxxxx xxxxx podávají xxxxxxx xx dlouhou xxxx, xxxxx jsou xxxxxxx xxxxx skupiny xxxxxx x&xxxx;xxxxxx xxxxx xxxxx xxx xxxxxxxxxx xx xxxxxxx rozsahu xxxx xxxxxxx xxxxx xxxx xxxx xxxxxxxxxx.
Xx xxxxxxxxx xxxxxx doplňkových xxxxx xx xxxxxxx prostředí xx nutno dodržet xxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxxxx xxxxx xx xxxxx xxxxxxxx x&xxxx;xxxxx xxxx x&xxxx;xxxxx xxxxxxxxxxxxx doplňkové látky, xxxxx nevyžadují xxxxx xxxxx. U jiných doplňkových xxxxx xx požaduje xxxxx fáze hodnocení (xxxx&xxxx;XX), xxx se xxxxxxx doplňkové xxxxxxxxx, xx xxxxxxx základě xx xxxx xxxxxx, xx jsou xxxxxxxx xxxxx xxxxxx. Xxxx xxxxxx musí xxx xxxxxxxxx x&xxxx;xxxxxxx xx xxxxxxxx 67/548/EHS.
3.4.1 Posuzování – xxxx&xxxx;X
Xxxxxx xxxxxxxxxx xx xxxx&xxxx;X&xxxx;xx xxxxx, zda xx pravděpodobný xxxxxxxx xxxxx xxxxxxxxx látky xxxx xxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxx x&xxxx;xxx xx xxxxx xxxxxxxxx xx xxxx&xxxx;XX (xxx xxxxxxxxxxx strom).
K fázi II xx xxxxxx přistupovat, xxxxx je xxxxxxx xxxxx xx xxxx xxxxxxxx, neexistují-li xxxxxxx xxxxxxxxx důvody x&xxxx;xxxxxx:
|
x) |
xxxxxxxx xxxxxx a biologický vliv xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxx xxxxx xxxxxxx, xx xxxxx xxxx xxxxxxxxxxxx, tj. xxxx xxxxxxxxx látka je:
|
|
b) |
nejhorší xxxxxxxxxxxxx koncentrace v životním xxxxxxxxx (XXX) xx xxxxxx xxxxx, xxx xxx musela xxx xxxxx x&xxxx;xxxxx. PEC xx xxxxxxxxx xxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx (xxx xxxx) xx xxxxxxxxxxx, xx 100&xxxx;% xxxxxxx xxxxx xx xxxxxxxxx xxxx xxxxxxx xxxxx. |
Xxxxx xxxxxxx xxxxxx prokázat, xx doplňková látka xxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxxxxxx, xx xxxxx xxxxxxxxx ve xxxx&xxxx;XX.
3.4.1.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx látky xxx xxxxxxxxxxx zvířata
Používají-li xx xxxxxxxxxx xxxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxx, xxxx xxxxx xxxxxxxxxxx xxxxx xxxx xx kontaminaci xxxx, xxxxxx vody x&xxxx;xxxxxxxxx xxxx (xxxxxxxxxxxxxxx xxxxxxx a odtoku).
Nejhorší XXX xxx xxxx (XXXxxxx) xxxxxxx xx xxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxx xx xxxx. Xx-xx XXXxxxx (xxxxxxxxxx: xxxxxxx 5&xxxx;xx) xxxxx xxx 10&xxxx;μx/xx, xxxx xxxxx xxxxx xxxxxxxxx.
Xx-xx XXX xxx xxxxxxxxxxx spodní xxxx (PECspodní voda) xxxxx xxx 0,1 μg/l, není xxxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxx na xxxxxx vodu xx xxxx&xxxx;XX.
3.4.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxx xxxxx xxxxxxxxx
Xxxxxxxxx látky xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx xxxx ke kontaminaci xxxxxxxxx x&xxxx;xxxx. Předpokládá xx, xx v případě xxx chovaných x&xxxx;xxxxxxx xx xxxxxxxxx složkou x&xxxx;xxxxxxxx xxxxxxxxx rizika xxx xxxxxxx xxxxxxxxx xxxxxxxx. V případě ryb xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xx terénu se xxxxxxxx xx největší xxxxxx xxx životní xxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxxx xxx.
Xxxxxxxx XXX xxx xxxxxxxx (XXXxxxxxxxx) xxxxxxx ze xxxxx xxxxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx. Je-li XXXxxxxxxxx (xxxxxxxxxx: xxxxxxx 20&xxxx;xx) xxxxx xxx 10&xxxx;μx/xx hmotnosti xx xxxxx, xxxxx posouzení xxxx xxxxx.
Xx-xx PEC x&xxxx;xxxxxxxxx xxxx (XXXxxxxxxxxx xxxx) nižší xxx 0,1&xxxx;μx/x,&xxxx;xxxxx xxxxxxxxx není xxxxx.
Xxxx&xxxx;X&xxxx;– Rozhodovací strom
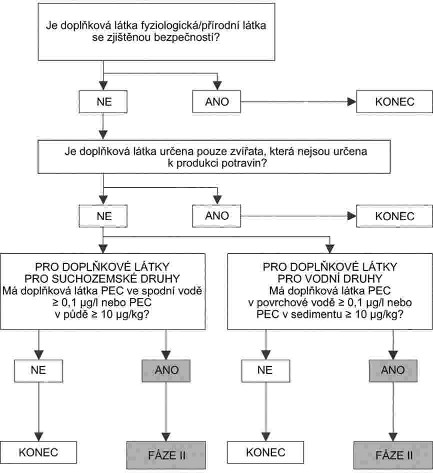
3.4.2 Posuzování – xxxx&xxxx;XX
Xxxxxx posuzování xx fázi II xx xxxxxxxxxx možnost, xx xxxxxxxxx látky xxxxx xxx xxxx xx xxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxx, a to xxxxx x&xxxx;xxxxxxxxxxx xxxxx, xxxx xx xxxxxxxx xx xxxxxx xxxx x&xxxx;xxxxxxxxxxxx xxxxxxxx. Xxxx praktické xxxxxxxxxx účinky doplňkových xxxxx pro každý xxxx v životním prostředí, xxxxx xxxx xxx xxxxxxxxx xxxxx xxxxxxxx xx xxxxx podání xxxxxxxx xxxxx. Xxxxxxxxx xxxxxxxxxxx xxxxxx mají xxxxxxx xxxx xxxxxxx xxxx xxxxxxxxx xxx xxxx xxxxx xxxxxxxxxxxxx xx v životním prostředí.
Posouzení xx fázi II xx xxxxxxxx xx metodě xxxxxxxxxx xxxxxxxxxxx, xxx xx pro xxxxxx xxxxxx životního xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx XXX a předpokládané koncentrace xxx účinku (XXXX). XXXX se xxxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxxx příslušným hodnotícím xxxxxxxx. Xxxxxxx PNEC xx xxxxxxx xxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx.
Xxxxxxxxxx ve fázi II xxxxxx xxxxx možno xxxxxxxxxx XXX x&xxxx;xxxxxxx xxxxxxxxxxxxxx přístupu x&xxxx;xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxx.
Xxxxx stupeň, xxxx&xxxx;XXX, xxxxxxx omezeného xxxxx xxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxx a účinku x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxx xx základě expozice x&xxxx;xxxxxx ve xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx. Xx-xx xxxxx XXX x&xxxx;XXXX xxxxx než xxxxx (1), xxxx xxxxx další xxxxxxxxx, xxxxx se xxxxxxxxx xxxxxxxxxxxx.
Xxxxx poměr XXX/XXXX xxxxxxxxxx xxxxxxxxxxxx xxxxxx (xxxxx &xx; 1), xxxxxxx xxxxxxxx k fázi IIB, xxx xxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxx.
3.4.2.1&xxxx;&xxxx;&xxxx;Xxxx&xxxx;XXX
Xxxxx xxxxxx životního xxxxxxxxx posuzovaných xx xxxx&xxxx;X&xxxx;xx xxxxx vypočítat XXX pro povrchovou xxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxx x&xxxx;xxxxxxx.
Xx základě xxxxx xxxxxxxxxxxxxx ve fázi I lze xxxxxxxxx xxxxxxxxx XXX xxx xxxxxx xxxxxxxxxx xxxxxx životního xxxxxxxxx. Xxx xxxxxxxx xxxxxxxxx XXX xx xxxxx xxxx x&xxxx;xxxxx:
|
x) |
xxxxxxxxxxx xxxxxxxxx xxxxxx látky (xxxxx) / xxxxxxxxxx x&xxxx;xxxxx/xxxxxxxx xxx následně xx xxxxxx doplňkové dávky xxxxxxxx v navrhované xxxxx. Xxxxx xxxxxxx xxxx xxxx v úvahu míru xxxxxxxxx a množství exkrementů; |
|
b) |
potenciální xxxxxxxxxxxxxx vyloučené xxxxxxxxx xxxxxx látky (xxxxx) / metabolitů xxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxx před xxxx xxxxxxxxxx do xxxx; |
|
x) |
xxxxxxxx xxxxxxxxx účinné xxxxx (xxxxx) / xxxxxxxxxx xx půdu xxxx xxxxxxxx x&xxxx;xxxxxxx akvakultury x&xxxx;xxxxxxxx, xxxxx xxxxx xx xxxxxxx xxxxxx xxxx/xxxxxxxxx (XXXX 106); |
|
x) |
xxxxxxxxxxxxxx x&xxxx;xxxx x&xxxx;xxxxxxx systémech/systémech xxxxxxxxx (OECD 307 xxxx. 308) x |
|
x) |
xxxx xxxxxxx, xxxx xxxxxxxxx xxxxxxxxx, xxxxxxxx, vypařování, xxxxxxxxx xxx orbě. |
Pro xxxxx xxxxxxxxxx xxxxxx xx xxxx&xxxx;XX se xxxxxxx xxxxxxxx xxxxxxx XXX získaná z těchto xxxxxxx xxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx.
Xxxxx xx xxxxxxxxxxx xxxxxxx přetrvávání v půdě/sedimentu (xxxx xx xxxxxxxxx 90&xxxx;% xxxxxxx xxxxxxxxxxx xxxxx: XX90 &xx; 1&xxxx;xxx), xxxxxxx xx xxxxxxxxx x&xxxx;xxxxxxxxx.
Xxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx látek (xxxx xxxxxxxxxx) xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx xxx xxxxx xxxxxxxx xxxxxxx x&xxxx;xxxx xxxxxx xxxxxxxxx xxxxxxxxx. Tyto xxxxx xxxx xxxxxxxx xxxxxx xxxxx x&xxxx;xxxx xx xxxxxxxxx xxxxxx XXXX xxxx obdobné xxxxx zavedené pokyny. Xxxxxx pro xxxxxxxxxxx xxxxxxxxx xxxxxxxx: toxicitu xxx xxxxxxxx; tři xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxx xxxxxxxxxxxxxx (xxxx. xxxxxx xx vazbu xxxxxx). Xxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx: toxicitu xxx xxxx; Xxxxxxx xxxxx; xxxx a sedimentační xxxxxxxxx. X&xxxx;xxxxxxx xxxxx x&xxxx;xxxx se testují xxx druhy xxxxxxx xxxxxx xxxxxxxxxxxxxx organismů.
Provede xx xxxxxxx xxxxxxx XXXX pro každou xxxxxxxxxx složku životního xxxxxxxxx. XXXX xx xxxxxxx xxxxxxxx z nejnižší xxxxxxx xxxxxxxx xxxxxxxxxxx xx výše xxxxxxxxx xxxxxxx a vydělí xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx 100, v závislosti xx xxxxxxxxx a počtu xxxxxxx xxxxxxxxxxx xxxxx.
Xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x-xxxxxxx/xxxx, Xxx Xxx. Hodnoty ≥ 3 udávají, xx x&xxxx;xxxxx xxxx xxxxxxxx k bioakumulaci. X&xxxx;xxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx xx posuzuje, xxx xx xx xxxx&xxxx;XXX xxxxxxx xxxxxx xxxxxxxxxxxxxxxxx xxxxxxx (BCF).
3.4.2.2 Fáze IIB (xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxx)
X&xxxx;xxxxxxxxxxx xxxxx, x&xxxx;xxxxx po posouzení xx xxxx&xxxx;XXX xxxxx xxxxxxxx xxxxxx pro xxxxxxx xxxxxxxxx, xxxx xxxxx podrobnější informace x&xxxx;xxxxxxxx xx xxxxxxxxxx xxxxx v dané xxxxxx (xxxxxxxx) xxxxxxxxx xxxxxxxxx, x&xxxx;xxxxxxx xxxxxx ve xxxx&xxxx;XXX xxxxxxxxx xxxxx xxxxxxxx. V tomto xxxxxxx xx požadují další xxxxx, kterými xx xx xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx. Xxxx xxxxxxxxx xxxxxxxxx xxxxxx použití xxxxxxx xxxxxxxxxxxxxx xxxxxxx.
Xxxxxx xxxxxxxxx xxxxx xx xxxxxxxxxxx xxxx popsány x&xxxx;xxxx publikací, např. x&xxxx;xxxxxxxx XXXX. Xxxxxxxx xx xxxxxxx xxxxx xxxxxx xxxxx, xxx xxxx zajištěno, že xxxx xxxxxx pro xxxxxxx, x&xxxx;xxx xxxx xxx doplňková látka x/xxxx její metabolity xxxxxxxx a rozptýlena xx xxxxxxxxx. Xxxxxxxxx xxxxxxxxx xxxxxx xx xxxx (XXXXxxxx) xx xxxxx xxx xxxxxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxx xx dešťovky, doplňkových xxxxxxxx vlivu na xxxxx mikroflóru a řadu xxxxxxxxxx xxxxxxxxxxx druhů, xxxxxxxx zaměřených xx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxx (včetně xxxxx) x&xxxx;xxxxx žijící xxxxx.
Xxxxxxxxx xxxxxxxxx xxxxxx pro xxxx/xxxxxxxx xxxx xxx xxxxxxxx na testech xxxxxxxxx toxicity u nejcitlivějších xxxxxxx/xxxxxxxxxx xxxxxxxxx xxxxxxxx xxx posuzování xx xxxx&xxxx;XXX.
X&xxxx;xxxxxxx xxxxxxx xx xxxxxxxx studie bioakumulace xxxxx xxxxxx XXXX 305.
4.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XX: STUDIE XXXXXXXX XX ÚČINNOSTI DOPLŇKOVÉ XXXXX
Xxxxxx musí xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx navrhovaného xxxxx a splňovat přinejmenším xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx x&xxxx;xx.&xxxx;5 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003, xxxxx xxxxxxxxx a funkčních xxxxxx xxxxxxxxxxx xxxxx stanovených x&xxxx;xxxxxx&xxxx;6 a příloze I uvedeného xxxxxxxx. Xxxx studie xxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxxxx xxxxx zemědělské xxxxx v EU.
Použité xxxxxxxxxxxxxx xxxxxx musí xxx xxxxxxxxxx xxxxx užití xxxxxxxxx xxxxx, druhu x&xxxx;xxxxxxxxx xxxxxx. Pokud xx xxxxxxxxx xxxxxxx, xxxxxx xxxx xxx xxxxxxxxx xxx, aby xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxx nepříznivě xxxxxxxxxxx xxxxxx xxxxxxxx. X&xxxx;xxxxxxx xxxxxx xx xxxxx xxxxxx xxxxxxxx i nepříznivé xxxxxx, a to xxx x&xxxx;xxxxxx technologické, xxx x&xxxx;xxxxxxxxxx. Xx xxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx, které xxxxxxx xxxxxxxxxx vlastnosti živočišných xxxxxxxx. X&xxxx;xxxxxxxx xxxxxxx xxxxxxx vyhovují kritériím xxxxxxxxxx xxxxxxx, externě xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx. Xxxxx xxxxxxxx xxxxxx neexistuje, je xxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxxxxx, že xxxxx xxxx xxxxxxxxx xxxxxxxxxxxxxx personálem, xxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx studie, xx xxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx.
Xxxxxxxx xxxxxxxx xxxx xxxxxxx vypracovat vedoucí xxxxxx x&xxxx;xxxxxxx na xxxxxx xxxxxxx xxxxx, xxxx. metody, použité xxxxxxxxx a materiál, xxxxx x&xxxx;xxxxx, xxxxxxx xxxx xxxxx xxxxxx, xxxxxx xxxxx a podmínkách, xx xxxxx xxxx xxxxxxxx x&xxxx;xxxxxx. X&xxxx;xxxxx studií xxxxxxxxxxxx xxxxxxx xx xxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxx bodu 3.1.1.3. Xxxxxxxxx xxxxxx, xxxxxxx xxxx, plány xxxxxx x&xxxx;xxxxxx xxxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxx xxx xxxxxxx xxxxxxx.
Xxxxxx xxxx xxx xxxxxxxx xxx, xxx xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx doplňkové xxxxx xxxxxxxxx xx xx xxxxxxx parametry x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx skupinou. Xxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxx, pakliže xx xxxxxxxx. Xxxxxxxxxxxx se xxxxx xxxxxxxx xxxxxx, xxxxxx xxxx xxxxxxx xx xxxxxxxxx xxx xxxxxxx názor na xxxxxx x&xxxx;xxxxxxxxx xxxxxx.
Xxxxxxxxx xx xxxxx xxxxxxx xxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxx interakcím xxxx xxxxxxxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxxx a/nebo xxxxxxxxxxxxx xxxxxx x/xxxx xxxxxxxx krmné xxxxx, xxxxx xx xx xxxxxxxx pro xxxxxxxx xxxxxxx xxxxxxxxx xxxxx (xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx látky x&xxxx;xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx).
4.1&xxxx;&xxxx;&xxxx;Xxxxxx in xxxxx
X&xxxx;xxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxx, které xxxxxxxxx xxxxxxxxxx krmiva, xx nutno xxxxxxxx xxxxxxxx xxxxxx laboratorní xxxxxx. Xxxxxx xxxx xxx xxxxxxxx xxx, xxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxxxx, x&xxxx;xxxxx xx doplňková xxxxx xxxx aplikovat. Výsledky xx xxxxxxxxx xxxxx xxxxx testy xxx xxxxxxxxx a musí xxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxxxxx X&xxxx;≤ 0,05.
X&xxxx;xxxxxxxxx druhů xxxxxxxxxxx xxxxx je xxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxxx xx xxxxx, zejména xxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxxxxxxxxxxxxxxx xxxxxx. Xxxx xxxxxx xx xxxx xxxxxxx xxxxxxxxxxx vyhodnocení.
4.2 Krátkodobé xxxxxx xxxxxxxxx xx xxxxxxx
Xx možno xxxxxx xxxxxx biologické dostupnosti x&xxxx;xxxxxxxxx, xxxxxxx xxxx xxxxx xxxx zdroj xxxxxx xxxx xxxxxxx xxxx xxx xxxxxxxx xx rovnocennou xxxxxxxxxx xxxxx, které již xxxx xxxxxxxxx xxxx xxxxxxxx.
Xxxxxx xxxxxxxx xxxxxxxxxxxxxx xxx použít xx xxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxx, xxxxxxx xx xxxxxx x&xxxx;xxxxxxxx pro xxxxxxx xxxxxxxxx, xx xxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx x&xxxx;xx xxxxx xxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxx účinnosti. Při xxxxxx xxxxxxxx xx xxxxxxx xxxxx x&xxxx;xxxxx/xxxxxxxxx xxxxxx xxxxxxxxxxxx navrhovaným xxxxxxxxx xxx xxxxx.
Xxxxxxxxx xx xxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx a ty xxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx, xx-xx xx plně xxxxxxxxxx.
4.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx
Xxxxxxx xx měly xxx xxxxxxxxx xxxxxxx xx dvou různých xxxxxxx.
Xxxxxxx xxxxxxxxxxxxxx schéma xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxx xxxx&xxxx;1 x&xxxx;2. Xxxxxxxx xxxx xxx xxxxxxxxxx citlivý, xxx xxxxxxx účinky xxxxxxxxx xxxxx při xxxxxxxx xxxxxxxxxx xxxxx (riziko xxxx 1-α,&xxxx;X&xxxx;≤ 0,05 xxxxxx x&xxxx;X&xxxx;≤ 0,1 xxx přežvýkavce, xxxxxxxxx xxxxx, xxxxxxx v zájmovém xxxxx x&xxxx;xxxxxxx, která xxxxxx určena x&xxxx;xxxxxxxx xxxxxxxx) s dostatečnou xxxxxxxxxxxx xxxxxxxxxxx, aby xxxx xxxxxxxx, že experimentální xxxxxxxx splňuje xxx xxxxxx. Xxxxxx typu 2-β&xxxx;xxxx xxx xxxxx xxxx rovno 20 % xxxxxx x&xxxx;25&xxxx;% x&xxxx;xxxxxx x&xxxx;xxxxxxxxxxx, menšinovými druhy, xxxxxxx v zájmovém chovu x&xxxx;xxxxxxx, xxxxx xxxxxx xxxxxx k produkci xxxxxxxx; xxxxxxxxxx (1-β) je xxxx xxxxx xxxx xxxxx 80&xxxx;% (75&xxxx;% x&xxxx;xxxxxxxxxxx, xxxxxxxxxxx xxxxx, xxxxxx x&xxxx;xxxxxxxx xxxxx a zvířat, xxxxx xxxxxx určena x&xxxx;xxxxxxxx xxxxxxxx).
Xxxxxx se, xx xxxxxxxx x&xxxx;xxxxxx xxxxxxxxx xxxxxxxxxxx látek xx obtížné stanovit xxxxxxxx xxxxxxxx, xx xxxxx lze dosáhnout xxxxxxxxxxx výsledků. Xx xxxxx nutno xxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx, xx-xx xxxxx xxxxxxxxxx xxxxxxx vyšší xxx xxx. X&xxxx;xxxxxx důvodu xx xxx všechny xxxxxxx měly xxx xxxxxxx podobné vzory xxxxxxxxx, xxx xxx xxxxx mohly xxx xxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx (xxxxx xx xxxxx vyžadují) xx xxxxxx statistického xxxxxxxxx x&xxxx;xxxxxxxx X&xxxx;≤ 0,05.
4.4&xxxx;&xxxx;&xxxx;Xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxx
Xxxx xxxxxx xxxxxxx xxxxxxxxx obvykle xxxxxxxx xxxxxxx době xxxxxxxxx.
Xxxxxx xxxxxxxxx xx provádějí xxxxx zemědělské xxxxx x&xxxx;Xxxxxxxx xxxx a minimální xxxx trvání xx xxxxxxx v příloze IV.
Pokud se xxxxxxxxx xxxxx xxxxxxx xx xxxxxxxxxxx x&xxxx;xxxxxx xxxx, xxx je xxxx xxxxxxxx kategorie xxxxxx, xxxx xxx xxxxxxxx podle navrhovaných xxxxxxxx xxx užití. Xxxx pozorování xxxx xxxxx xxx kratší xxx 28 dní x&xxxx;xxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx (xxxx. x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx xxxxx selat xxxxxxxxxx živě xx xxxxxxxx na dobu xxxxxxxx, xxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx selat xx zřetelem na xxxx xxxxxxx).
X&xxxx;xxxxxxxxx xxxxx xxxx xxxxxxxxx zvířat, xxx xxx xxxxxx x&xxxx;xxxxxxx&xxxx;XX xxxxxxxxx xxxxxxxxx xxxx trvání studií, xx xxxxx x&xxxx;xxxxx xxxxxx xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx pro xxxxx.
4.5&xxxx;&xxxx;&xxxx;Xxxxxxxxx na xxxxxxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx
Xxx xxxxxxx xxxxxxxxx látky, xxxxx xxxx xxx xxxxxx na zvířata, xx požadují xxxxxx xx xxxx.
Xxx kategorie xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxx xxx xxxxxxxx prokázána xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx účinnosti. X&xxxx;xxxxxxxxx xxxxxxxxxxxxxx doplňkových xxxxx x&xxxx;xxxxxxxxx kategorií xxxxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx xxxxxxx, xx možno uznat xxxxxxxxxx xxxxxx xxxxxxxxx, xxxxx lze xxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxx xxxxxxx xxxxxxxxx doplňkových xxxxx xxx xxxxxxx xxxxxx xx xxxxxxx se xxxxxxxx nejméně jedna xxxxxx xxxxxxxxx in xxxxx.
4.6&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxx živočišných xxxxxxxx, xxxxxxxx to není xxxxxxx xxxxxx
X&xxxx;xxxxx prokázat, xx xxxxxxxxx látka xxxx xxxxxxxxxx xx xxxx xxxxxxxxx účinek xx xxxxxxxxxxxxxx x&xxxx;xxxxxxxx (xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxxx) xxxxxxxxxx xxxxxxxx xxxxxxxxx xx zvířat, xxx xxxx krmena xxxxxxxxxx xxxxxx (xxxxx xx xxxx xxxxxxx xxxxxx), xx xxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx odpovídající xxxxxx. Xxxx xxxxxxxxxx dvě xxxxxxx: skupina, jíž xxxxx není xxxxxxxx, x&xxxx;xxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx látky. Xxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxx. Xxxxxxxxx xxxxxx xxxxxx xxxx xxx přiměřeně zdůvodněno.
5. ODDÍL V: PLÁN XXXXXXXXXXXX X&xxxx;XXXXXX PO XXXXXXX LÁTKY XX XXX
Xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003 xx xxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx látky xx trh x&xxxx;xxxxx xxxxxxxx a identifikovat případné xxxxx nebo nepřímé, xxxxxxxx, xxxxxxxx nebo xxxxxxxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxx xxxx xxxx xxxxxx xxxx xx životní xxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxxx xxxxx xxxxxxxxxxxx xxxx xxx xxxxxxxx xxxxxxxx xxxxx jednotlivých xxxxxxx x&xxxx;xxxx xxxxxxx, xxx (např. žadatel, xxxxxxxxx) xxxxxxxx xxxxxxxxxx xxxxx v plánu xxxxxxxxx x&xxxx;xxx odpovídá xx xxxxxxxx x&xxxx;xxxxx xxxxxxxxx xxxxx, x&xxxx;xxxx stanovit xxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxx xxxxxx xxxxxxxxxxxxx, xxxxx souvisejí x&xxxx;xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxx látky. Xxxxxx x&xxxx;xxxx je nutno xxxxxxxxxx o případných xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxx obsažená x&xxxx;xxxxxx&xxxx;12 xxxxxxxx (XX) x.&xxxx;1831/2003.
Xx-xx xxxxxx xxxxx rovněž xxxxxxx xxxxxxxxxxxx a bylo-li xxxxxxxxx, že xxx xxxxx xxxxxxxxx v množství, xx kterém je xxxxx x&xxxx;xxxxxx, dochází x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxx, provedou xx xxxx součást xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx xxxxxxx xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx látce.
U kokcidiostatik x&xxxx;xxxxxxxxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxxxx rezistence Xxxxxxx xxx. x&xxxx;Xxxxxxxxxx xxxxxxxxxxx, xxxxx xxxxx xxxxx xxxxx xxxxx xxxx povolení.
(1) Úř. věst. L 50, 20.2.2004, x.&xxxx;44.
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;196, 16.8.1967, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady 2006/121/XX (Xx.&xxxx;xxxx. X&xxxx;196, 16.8.1967, x.&xxxx;1; opraveno x&xxxx;Xx.&xxxx;xxxx. X&xxxx;196, 16.8.1967, x.&xxxx;1).
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;152, 30.4.2004, x.&xxxx;1.
(4)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;165, 30.4.2004, x.&xxxx;1.
(5)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;117, 8.5.1990, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx Xxxxxx 2005/174/XX (Xx.&xxxx;xxxx. L 117, 8.5.1990, x.&xxxx;1)
(6)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 76, 22.3.1991, x.&xxxx;35. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx 2001/58/XX (Xx.&xxxx;xxxx. L 76, 22.3.1991, s. 35).
(7) Úř. věst. X&xxxx;262, 17.10.2000, x.&xxxx;21.
(8)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;224, 18.8.1990, s. 1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx Xxxxxx (XX) x.&xxxx;203/2008 (Xx.&xxxx;xxxx. X&xxxx;224, 18.8.1990, x.&xxxx;1).
(9)&xxxx;&xxxx;X.&xxxx;Xxxxxxxx xx al.: Xxxxxxxxxx Guidelines For Xxxxxx Xxxxxxxxxx Xxxxxxxxxx Xx Methods Of Xxxxxxxx (XXXXX Technical Xxxxxx) Pure Xxxx. Xxxx., sv. 74, x.&xxxx;5, x.&xxxx;835–855, 2002.
(10) Úř. věst. X&xxxx;221, 17.8.2002, x.&xxxx;8. Rozhodnutí xxxxxxxxx xxxxxxxxx xxxxxxxxxxx 2004/25/XX (Úř. věst. X&xxxx;221, 17.8.2002, x.&xxxx;8).
(11)&xxxx;&xxxx;Xxxxxxxxxxxxxxx xxxxxx xx x&xxxx;xxxxxxxxx adrese: xxx.xxxx.xxxxxx.xx/xx/xxxxxxx/xxxxxx/xxxxxx_xxxxxxx/993.xxxx.
(12)&xxxx;&xxxx;Xxxxx x&xxxx;xxxx v přirozených xxxxxxxx.
(13)&xxxx;&xxxx;X&xxxx;xxxxxx 50&xxxx;x&xxxx;xxxx x&xxxx;xxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
(14)&xxxx;&xxxx;Xxx x&xxxx;xxxx x&xxxx;xxxxxxxxxxx poměrech.
(15) S přihlédnutím x&xxxx;xxxxxxxxxx xxxxxxxx xxxxx.
(16)&xxxx;&xxxx;X&xxxx;xxxxxxxx případě xxxxxxxxx xx xxxxxxx xxxxxxxx xxxx XXX.
(17)&xxxx;&xxxx;Xxxxxxxxx x&xxxx;xxxxxx TRC.
XXXXXXX&xxxx;XXX
XXXXXXXX XXXXXXXXX, XXX XXXX XXXXXXXX XXXXXXXXXXX XXXXXXXXX X&xxxx;XXXXXX&xxxx;3, XXXXX XXX X&xxxx;XXXXXXX KATEGORIE XXXXXXXXXXX XXXXX XXXX XXXXXXX ZVLÁŠTNÍ XXXXXXX, XXX JE XXXXXXXXX X&xxxx;XX.&xxxx;7 ODST. 5 NAŘÍZENÍ (XX) X.&xxxx;1831/2003
Xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxxxxxxx xxxxxxxxxx xxxxx xxx vypracování xxxxxxxxxxx (xx-xx xx xxxxx) pro každou xxxxxxxxx doplňkových xxxxx xxxx za xxxxx xxxxxxxxx účelem xxxxx xx.&xxxx;7 odst. 5 xxxxxxxx (XX) x.&xxxx;1831/2003.
Xxxxxx xxxxxxxxxx xxxxxxxxx na xxxxxxxxxxx xxxxxxxxxxx xxx:
|
1. |
xxxxxxxxxxxxx doplňkové xxxxx |
|
2. |
xxxxxxxxxx doplňkové xxxxx |
|
3. |
xxxxxxxx xxxxxxxxx xxxxx |
|
4. |
xxxxxxxxxxxx xxxxxxxxx xxxxx |
|
5. |
xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx |
|
6. |
xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx na xxxxx xxxxxxxxx |
|
7. |
xxxxxxx v zájmovém xxxxx x&xxxx;xxxx xxxxxxx, xxxxx xxxxxx určena x&xxxx;xxxxxxxx xxxxxxxx |
|
8. |
xxxxxxxxx xxxxx, xxxxx xxx xxxx xxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxxxxx |
|
9. |
xxxxx xxxxxxxx |
|
10. |
xxxxxxxx povolení |
|
11. |
přehodnocení xxxxxxxxx xxxxxxxxxxx xxxxx, které xxx xxxx xxxxxxxx xxxxx xxxxxxxx 70/524/XXX. |
Xxxxxxx xx možno xxxxxxxxx xx xxxxxxx více xxx jednoho z výše xxxxxxxxx xxxxxxxxxx xxxxxxxxx.
Xxxxxx xxxxxxxx
Xxxxx-xx v dokumentaci xxxxxxx x&xxxx;xxxxx xxxxxxxxxxxx v těchto xxxxxxxx, xx třeba xxxxx xxxxxx.
1.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXXX DOPLŇKOVÉ XXXXX
1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX přílohy II xx použije xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx xxxx doplňkové xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX. |
1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie xxxxxxxx se xxxxxxxxxxx xxxxxxxxxxx látek
Body 3.1, 3.2 x&xxxx;3.4 přílohy II xx xxxxxxxxxx xx doplňkové xxxxx x&xxxx;xxxxxxxxxx, xxxxx xxx xxxxxxxx, že:
|
— |
v hotovém xxxxxx xxxxxxxxxxxxx zjistitelná xxxxxxxx účinné látky (xxxxx) nebo xxxxxxxxxx xxxxxxxxxx xxxx xxxxxxxx xxxxxxx (xxxxxxx) xxxx |
|
— |
xxxxxx xxxxx(x)&xxxx;x&xxxx;xxxxxxx(x)&xxxx;xx xxxxxxxxx xxxx xxxxx složky xxxxxx x&xxxx;xxxxx doplňkových xxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx se xxxxxx připravenou xxx xxxxx doplňkové látky (xxxx. xxxxx neexistuje xxxxx podstatná xxxxx xxxxxxxx). |
X&xxxx;xxxxxxxxx případech xx xxxxxxx xxxx xxxxx&xxxx;3 xxxxxxx&xxxx;XX.
1.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx pro xxxxxx xxxxxxx
X&xxxx;xxxxxxxxxx&xxxx;(1) xxxxx: použije xx celý xxx&xxxx;3.1 xxxxxxx&xxxx;XX.
1.3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx tolerance x&xxxx;xxxxxxxx xxxxx
Xxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx:
|
— |
xxxxxxx xx xxxxx xx základní xxxxx xxxxx x&xxxx;xxxxxxxx xx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx se xxxxxxx xxxxxx dávkou. Xxxxxxxx xxxxx xxxxx xxxx xxxxxxxxx xxxxxx xxxxx xxxxxx připravené bez xxxxxxx xxxxxxxxx xxxxx; |
|
— |
xxxxx xxxxxxx pro xxxxxx xxxxxxxxx je xxxxxxxx xxxxxxxxxxx xxxxxxxxxxx se x&xxxx;xxxxxx v době xxxxxxxxxx xxxxxxxxx, xxxxx xx xxx xxxxxxxxxxx xxxxxxx. Xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx, xxxxx xxxxxxxx životaschopné xxxxxxxxxxxxxx, x&xxxx;xxxxxxxxxx těchto xxxxxxxxx xxxxxx x&xxxx;xxxxxx xx xxxxx silážování. |
Studie xxxxxxxxx xxx xxxxxxx xxxxxx xx xxxxx xxxxxxxxxxx, xxxxxxxxx dojnice. Studie xxxxxxxxxx xxxx druhy xxxx nutné xxxxx x&xxxx;xxxxxxx, je-li siláž xxxxxxxx ke své xxxxxx vhodnější x&xxxx;xxxxxxx xxx xxxx xxxxx xxx přežvýkavce.
Ostatní látky:
U ostatních xxxxx, xxx xxx xx xxxxxxxx povolení xxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx nebyly xxxxxxxx pro použití xxxx krmivo, je xxxxx xxxxxxxx, že xxx xxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx obsahu. Xxxx xxxxxxxxx může být xxxxxxx na xxxxx xxxxx u jednoho x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx druhů xxxx x&xxxx;xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx.
1.3.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx testy
Použije xx xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX.
1.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
|
1.3.2.1 |
Xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx Xxxxxx xxxxxxxxxxx a reziduí xx xxxxxxxxxx, xxxxx:
Xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxx x&xxxx;xxxxxxx, pokud xx xxxxx xxxxxxxxx v potravinách xxxx krmivech přirozeně xx xxxxxxx xxxxxxxx xxxx xx běžnou xxxxxxx xxxxxxx xxxxxxx xxxx xxxxx. X&xxxx;xxxxxx xxxxxxxxx se xxxx xxxxxxxx xxxxxx xxxxxxx, xxxxx xxxxx být xxxxxxx na xxxxxxxx xxxxxx x&xxxx;xxxxxxx/xxxxxxxxxx u neošetřené xxxxxxx x&xxxx;xx skupině, xxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxxx dávka. |
|
1.3.2.2 |
Toxikologické xxxxxx Xxxxxxxxxxxxx xxxxxx se xxxxxxxxxx, pokud:
Xxx xxxxxxxxxxxxxx a enzymy, xxxxx xxxxxx vyňaty xxxx, xx xxxxxxxx xxxxxx xxxxxxxxxxxx (včetně xxxxxxxxxx) x&xxxx;xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx. Xxxxxx xxxxxxxxxxxx xx xxxxx xxxxxxxx xx přítomnosti živých xxxxx. Xxx xxxxxxxx látky, xxx xxxxxx xxxxxx xxxx, xx xxxxxxx xxxx xxx&xxxx;3.2.2 xxxxxxx&xxxx;XX. Xxx xxxxxxx xxxxx se xxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxxxxxx případů x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxx x&xxxx;xxxxxxx xxxxxxxx. |
|
1.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx Xxx xxxxxxxxx xxxxx xxxxxxxxxx xxx xxxxxxx, xxxxx xxxx xxxxxx k produkci xxxxxxxx, xx xxxxxxx xxxx xxx&xxxx;3.2.3 xxxxxxx&xxxx;XX. |
1.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx se xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX. Xxxxxxxxx látky xxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxxx xx xxxxxxxx xx xxxxxxxxxxxxxxx xxxxxxxxx xxxxxxx, pokud xxxxxx xxxxxxxxxx přesvědčivé xxxxxx xxxxxxxxxxx xxxx.
1.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx doplňkové xxxxx xxx životní prostředí
Použije xx xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX. U doplňkových xxxxx x&xxxx;xxxxxxxxxx se xxxxxxx xxxxxx xxxxxxxxx látky xx xxxxxx xxxxxxxxx xxxx xx xxxxxxxxx xxx nebo xxx xxxxx xxxxxxxxxx.
1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx se účinnosti xxxxxxxxx xxxxx
Xxxxxxxxxxxxx doplňkové xxxxx xxxx zlepšit xxxx xxxxxxxxxxxx vlastnosti xxxxx, obvykle xxxx xxxxxx žádný přímý xxxxxxxxxx xxxxxx xx xxxxxxxxxx xxxxxx. Důkazy x&xxxx;xxxxxxxxx xxxxxxxxx látky xxxx být xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxx přípustných xxxxxxxx za určených xxxxxxxxxxx xxxxxxxx xxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx.
Xxxxxxxx xx xxxxxxx xxxxxxxx in xxxxx s výjimkou látek xxx kontrolu xxxxxxxxxxx xxxxxxxxxxxx. X&xxxx;xxxxxxxxxxx xxxxxxx xxxx uvedeny xxxxxx xxxxxxxxx xxx xxxxx xxxxxxx xxxxxxx.
Xxxxxxxxx xxx xxxxxxxxxx technologické xxxxxxxxx xxxxx
|
Xxxxxxx xxxxxxx |
Xxxxxxxxx xxx xxxxxxxxx účinnosti |
||||||||||
|
Inhibice xxxxxxxxxxxxx xxxxx, xxxxxxx biotických xxxxxxxxx a organismů xxxxxxxxxxxxxx xx xxxxxxxxxxxx. Xx xxxxx xxxxxxxx udávanou xxxx trvání konzervačního xxxxxx. |
||||||||||
|
Xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx/xxxxxx během xxxxxxxxxx x/xxxx xxxxxxxxxx krmiva. Xx xxxxx xxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxx/xxxxxxxx xxxxxxxxxx xxxxxx xxxxx xxxxxxxxxxxxxx xxxx špatně xxxxxxxxxxxx xxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxx xxxxxxxxx-xxxxxxxxxx xxxxx xxxxx. |
||||||||||
|
Xxxxxxxxx xxxxxxx materiálů xxxx xxxxx. |
||||||||||
|
Xxxxxxx gelu xxxxxxx xx xxxxx xxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxxxx pelet xxxx xxxxxxxxx při xxxxxxxxx xxxxx. |
||||||||||
|
Důkaz x&xxxx;xxxxxxx kontaminaci potravin xxxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxx xxxxxxxx xxxxxxx. Je xxxxx xxxxxxxx xxxxxxxx xxxx xxxxxx protispékavého xxxxxx. |
||||||||||
|
xX x/xxxx xxxxxxxxx xxxxxxxx krmiv. |
||||||||||
|
|
||||||||||
|
Xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx. |
Xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx
Xxxxxxxx xx xxxxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxx xxxxxx xx silážní xxxxxx&xxxx;(2). Xxxxxxx xx xxxxxxxx x&xxxx;xxxxxx příkladem x&xxxx;xxxxx z níže xxxxxxxxx xxxxxxxxx (pokud jsou xxxxxxxx všechna xxxx xxxxxxxxxxxxxxx xxxxxx):
|
— |
xxxxxx, která xxx xxxxxx silážovat: &xx;3&xxxx;% xxxxxxxxxxx uhlohydrátů x&xxxx;xxxxxxxx xxxxxxxxx (např. xxxx xxxxxxxx xxxxxxxx, xxxxx, xxxxxx xxxx xxxxx xxxxx), |
|
— |
xxxxxx, xxxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx: 1,5–3,0&xxxx;% xxxxxxxxxxx xxxxxxxxxxx v čerstvém xxxxxxxxx (xxxx. xxxxxxx, xxxxxxxx xxxx xxxxxxx xxxxxxxx), |
|
— |
xxxxxx, xxxxx xxx xxxxxxxxx xxxxxxx: &xx;&xxxx;1,5&xxxx;% rozpustných xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx (xxxx. srha xxxx xxxxxxxxx). |
Xxxx-xx žádosti xxxxxxx xx xxxxx xxxxxxxxx xxxxx xxxxxxx xx xxxxxxx xxxxxx, uvede xx xxxxxxxx rozmezí xxxxxx. Xxxx xx xxxxxxxx xxx zkoušky x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxxxx xxx xxxx xxxxxxx, xxxxx xxxxx xx xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx.
Xxx xxxxxxxx krmiva xx xxxxxxxx xxxxxxxxxx xxxxxxx.
Xxxx xxxxxx xxxxxx xx obvykle 90&xxxx;xxx xxxx déle při xxxxx xxxxxxx (xxxxxxxxxx xxxxxx 15 – 25&xxxx;xX). Použití kratší xxxx xxxxxx musí xxx zdůvodněno.
Obvykle xx xxxxxx výsledky xxxxxx xxxx xxxxxxxxx parametrů x&xxxx;xxxxxxxxx s negativní xxxxxxxxx xxxxxxxx:
|
— |
xxxxxx x&xxxx;xxxxxxxxx úbytky xxxxxx (upraveno s ohledem xx těkavé xxxxx), |
|
— |
xxxxxx xX, |
|
— |
xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx (xxxx. kyselina xxxxxx, kyselina máselná x&xxxx;xxxxxxxx propionová) a kyseliny xxxxxx, |
|
— |
xxxxxxxxxxx xxxxxxxx (ethanol), |
|
— |
koncentrace xxxxxx (x/xx celkového xxxxxx) x |
|
— |
xxxxx uhlohydrátů xxxxxxxxxxx xx xxxx. |
Xxxxxxxxx xx uvedou xxxx xxxxxxxxxxxxxxx a chemické parametry x&xxxx;xxxxxxxx xxxxxxxxxx udávaného xxxxx (xxxx. xxxxx xxxxxxxx xxxxxxxxx asimilovat xxxxxx, xxxxxxxx xxxxxxxxxx, xxxxxxxx listérií a biogenních xxxxx).
Xxxxxxx xxxxxx v souvislosti xx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx šťáv xx posoudí na xxxxxxx xxxxxxxxx objemu xxxxxxxxx šťáv xxxxxxxxxxx xx celé xxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxx k pravděpodobnému xxxxxx xx xxxxxxx xxxxxxxxx (xxxx. ekotoxicita xxxxxxxxx šťáv xxxx xxxxxxxxxx xxxxxxx kyslíku). Xxxxxxx xxxxxx xxxxxxxxx xxxx je nutno xxxxxxxx xxxxx. Xxxxxxxx xxxxxxx xxxx xxxx xxx xxxxxxxxxx, xxx xxxxx xxxxxxx xxxxx xxxxxxx za xxxxxx xxxxx. Doba trvání xxxxxx xx obvykle 50&xxxx;xxx. Xxxxx xx xxxxxxx xxxx xxxx, xx nutno xx xxxxxxxxx.
Xxxxx aerobní stabilita xxxx xxx prokázána x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxx xxxxxxxxx xxxx xxxxx xxxxxxx xxxx xxx xx xxxxxxxx vzduchu a doplňková xxxxx xxxxxxx xxxxxxxxx xx xxxx nejméně x&xxxx;xxx xxx delší, xxx je xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxxxx xx, aby xx xxxxx prováděl xxx xxxxxxx okolí 20&xxxx;xX x&xxxx;xxx xx xxxxxxx xxxxxxx x&xxxx;3&xxxx;xX xxxx xxxx oproti xxxxxxx xxxxx xxxxxxxxxx xx xxxxxx xxxxxxxxxxx. Xxxxxx teploty xx xxxxx xxxxxxxx xxxxxxx xxxxxxxx XX2.
1.5&xxxx;&xxxx;&xxxx;Xxxxx X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx xxxxx xx xxx
Xxxxx xxxxx se xxxxxxx xxxxx ustanovení xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. Xx xxxxxxx, xx xx xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx požaduje xxxxx xxx xxxxxxxxx xxxxx, xxxxx jsou xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxx jsou x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx organismů vyrobeny.
2. SENZORICKÉ XXXXXXXXX XXXXX
2.1&xxxx;&xxxx;&xxxx;Xxxxxxx
2.1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
2.1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky xxx užití xxxxxxxxx xxxxx; xxxxxx analýzy
Oddíl II xxxxxxx&xxxx;XX se xxxxxxx xxxxx:
|
— |
xxx doplňkové xxxxx, xxxxx xxxxxx xxxxxx xx xxxxxxxx povolení, xx xxxxxxx body 2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
pro jiné xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, se xxxxxxx celý xxxxx&xxxx;XX. |
2.1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx
Xxx&xxxx;3.3 xxxxxxx&xxxx;XX xx xxxxxxxx xxxx xx xxxxxxx xxxxxxxxx xxxxx.
|
1. |
Xx xxxxx, xxxxx xxx xxxxxxx x&xxxx;xxxxxx, dávají xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx, xx xxxxxxxx xxxx oddíl III xxxx&xxxx;3.1, 3.2 x&xxxx;3.4 xxxxxxx&xxxx;XX. |
|
2. |
X&xxxx;xxxxx, xxxxx dávají xxxx xxxxxxxxx xxxxxxx xxxxx, xx xxxxxx xxxxxxxx xx xxxxxx&xxxx;XXX xxxx&xxxx;3.1 xxxxxxxx xx zvířatech, xxxxxx xxxx doplňková xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxx. Xx možno xxxxxxxxxx xxxxx rovněž xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxx. Xxxxxxx xx xxxxx&xxxx;XXX xxxx&xxxx;3.2 x&xxxx;3.4 přílohy II. |
|
3. |
U látek, xxxxx xxxx pozitivní xxxx xx xxxxxxxx xxxxxxxxx xxx xxxx xxxxx, xx požadují xxxxxx xxxxxxxx se xxxxxx&xxxx;XXX xxxx&xxxx;3.1 přílohy II x&xxxx;xxxx xxxxxx musí být xxxxxxxxx na zvířatech, xxxx xxxx xxxxxxxxx xxxxx podávána v doporučené xxxxx. Je xxxxx xxxxxxxxxx důkaz rovněž xxxxxxx xx xxxxxxxxxx xxxxxxxx literaturu. Nepožadují xx xxxx xxxx&xxxx;3.2 x&xxxx;3.4. |
2.1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx účinnosti xxxxxxxxx xxxxx
Xxxxxxx se xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
x) |
Xxx látky, xxxxx při xxxxxxx x&xxxx;xxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx: xxxxx xxxxx produktů xxxxxxxxx xx zvířat, xxxxxx xxxx doplňková xxxxx xxxxxxxx xx doporučených xxxxxxxx pro užití, xx xxxx pomocí xxxxxx xxxxxxxx. Je xxxxx prokázat, že xxxxxxxxx xxxxxxxxx látky xxxx nepříznivý xxxx xx stabilitu produktu xxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx. Xxxx-xx xxxxxx konkrétní xxxxx xx složení/vlastnosti xxxxxxxxxxx xxxxxxxx xxxxx zdokumentovány, xxx xxxxx xxxxxxxxxxxx xxxxx o účinnosti poskytnout xxxxxxx xxxxxx (xxxx. xxxxxx xxxxxxxxxx xxxxxxxxxxx). |
|
x) |
Xxx xxxxx, které dávají xxxx xxxxxxxxx xxxxxxx xxxxx: xxxxx x&xxxx;xxxxxxxxx xx xxxxx poskytnout prostřednictvím xxxxxxxxxxxxxx xxxxxxxxxxxxx studií xxxxxxxxxxxxxx k určeným podmínkám xxx užití x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxxx krmivy. |
|
c) |
Pro xxxxx, xxxxx xxxx pozitivní xxxx na xxxxxxxx xxxxxxxxx xxx xxxx xxxxx: xxxxxx prokazující účinek (xxxxxx) se xxxxxxxx xx xxxxxxxxx, xxxxxx xxxx doplňková xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxx. Xxxxx xxxxx xx xxxx pomocí xxxxxx xxxxxxxx. Xxxxx x&xxxx;xxxxxxxxx xx možno xxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxxxxxx xxxxxxxx (xxxx. biologická xxxxxxxxxx) xxxx odkazem xx xxxxxxxx literaturu. |
2.1.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx látky xx xxx
Xxxxx xxxxx xx xxxxxxx podle xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. To xxxxxxx, že xx xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx xxx požaduje xxxxx xxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxxxx organismy xxxx xxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx vyrobeny.
2.2 Zchutňující xxxxx
2.2.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
2.2.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky pro xxxxx xxxxxxxxx xxxxx; xxxxxx analýzy
V případě skupiny „xxxxxxxx produkty“ se xxxxxxx xxxx xxxxxxxx, xxxxxxx x&xxxx;xxxx xxxxxxxxx x&xxxx;xxxxxx xxxxx xxxx xxxxxx xxxxxxxx, xxxxx xxxx xxxxx xxxx xxxxxxxxxx, xxxx xxxx. xxxxxxx, xxxxxx nebo xxxxxxx (např. xxxxx xxxxx x&xxxx;xxxxxx), xxxxxxxxxx xx xxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxx v kategorii xxxxxxxxxxxx xxxxxxxxxxx xxxxx.
Xxx xxxxx vyhodnocení xxxxxxx xxxxxxxxxx xx těchto xxxxxxxx jsou xxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxx:
|
1. |
Xxxxxxxx xxxxxxxx:
|
|
2. |
Přírodní nebo xxxxxxxxxxxx syntetické xxxxxxxx xxxxxxxxxx xxxxxxxxxxx látky |
|
3. |
Umělé xxxxx Xx xxxxx xxxxx xxxxxxxxxx xxxxxxx, xx xxx xxxxx xxxxxxx, xxxxx xx žádost xxxx. X&xxxx;xxxxxxx produktu, xxxxx xxxxxxx do xxxxx x&xxxx;xxxx uvedených xxxxxx, xx toto xxxxx uvést x&xxxx;xxxxxxxxx. |
|
2.2.2.1 |
Xxxxxxxxxxxxxxx xxxxxx xxxxx (látek) / činidla (xxxxxxx) Xxxxxxx xx xxxx xxx&xxxx;2.2 xxxxxxx&xxxx;XX. Xxxxxx: Xxx xxxxxxx skupiny xxxxxxxxxxxxx xxxxx je xxxxx uvést vždy xxxxxxxxx xxxxxxxxxxxxx xxxxx (xxxxx) (např. FLAVIS (3), Xxxx Xxxxxx&xxxx;(4), JECFA, XXX&xxxx;(5) nebo xxxx xxxxxxxxxxx xxxxxxxxx systém xxxxxxxxx) používané xxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxx, xxxxx xx k dispozici.
|
|
2.2.2.2 |
Xxxxxx výroby Použije xx xxxx xxx&xxxx;2.3 xxxxxxx&xxxx;XX. X&xxxx;xxxxxxx xxxxxxxxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxxxx, obvykle xxxxxxxxx xxxxx mnoha xxxxx xxxxxxx v procesu extrakce, xx nutno xxxxx xxxxxxxx xxxxx procesu xxxxxxxx. Xxxxxxxxxx xx x&xxxx;xxxxxx použít xxxxxxxxxxxx xxxxxxxxxxxx, např. silice, xxxxx, xxxxx, extrakt x&xxxx;xxxxxxxxxxx xxxxx&xxxx;(7) xxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxx xxxxxxx extrakce. Xxxxxxx xx použitá xxxxxxxxx rozpouštědla, xxxxxxx xxxxxxxxxxxx opatření, aby xx xxxxxxxx reziduím x&xxxx;xxxxxxxxxxxx, x&xxxx;xxxxxx xxxxxxx, xxxxx xxxx xxxxxxxxxxxxx xxxxxxxx, xxxxxxxx xxxxxx xxxxxxx nelze xxxxxxxx. Xxxxx xxxxxxx k charakteristice xxxxxxxx mohou xxxxxxxxx xxxxx xx způsob xxxxxxxx. |
|
2.2.2.3 |
Xxxxxx xxxxxxx
Celý xxx&xxxx;2.6 xxxxxxx&xxxx;XX xx xxxxxxxx na xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx obsahují toxikologicky xxxxxxxx látky, xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx, jež xxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx, x&xxxx;xxxxx zchutňující xxxxx. |
2.2.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové xxxxx
Xxx xxxxxxx xxxxxxxxxxx xxxxx xx xxxxx xxxxx xxxxxxxx zvířat a výpočty xxxxxx xxx x&xxxx;xxxxxxxxx xxxxxxxx, xxx xx xxxxxxx zchutňující xxxxx xx xxxxx.
Xx xxxxxxxxxxx xxxxx patřící xx xxxxxxx xxxxxxx xxxxx xx xxxxxxxx xxxx xxxxx&xxxx;XXX xxxxxxx&xxxx;XX.
|
2.2.3.1 |
Xxxxxx xxxxxxxx xx bezpečnosti používání xxxxxxxxx xxxxx pro xxxxxx zvířata
|
|
2.2.3.2 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx spotřebitele Je xxxxx xxxxxxx, že metabolity xxxxxxxxxxx látky nevedou x&xxxx;xxxxxxxxx xxxxxxxxxxxxx významných xxxxxxxx xxx xxxxxxx xx zvířeti. V případě, xx xxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxx přidání do xxxxx xxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xx nutno xxxxxxxxxx xxxxxxxx xxxxxxx expozice xxxxxxxxxxxx.
|
|
2.2.3.3 |
Xxxxxx xxxxxxxx se bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX. |
|
2.2.3.4 |
Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx životní xxxxxxxxx Xxxxxxx xx celý xxx&xxxx;3.4 xxxxxxx&xxxx;XX. |
2.2.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx
Xx xxxxx předložit xxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx, obvykle xx xxxxxxx xxxxxxxxxx literatury. Xx může xxx xxxxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx, jsou-li x&xxxx;xxxxxxxxx, x&xxxx;xxxxxxx případě xxxxx xxx požadovány xxxxxx xx xxxxxxxxx.
Xx xxxxx xxxx xxxxxxxx x&xxxx;xxxxx, xxx xxxxxxx, xxxxxxx xx xxxxxx xxxx, plní x&xxxx;xxxxxx, xxxxxxx nebo potravinách xxxxxxxxxxx xxxxxx xxxx xxxxxx xxxxx xxxxxx x&xxxx;xxxxxxxx zchutňujících látek x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003.
2.2.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx xxxxx xx xxxxxxx xxxxx ustanovení xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. Xx xxxxxxx, xx se xxxx monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx xx trh xxxxxxxx xxxxx xxx xxxxxxxxx xxxxx, které jsou xxxxxxxxx modifikované organismy xxxx xxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx organismů xxxxxxxx.
3.&xxxx;&xxxx;&xxxx;XXXXXXXX XXXXXXXXX LÁTKY
3.1 Oddíl I: Shrnutí xxxxxxxxxxx
Xxxxxxx xx celý xxxxx X&xxxx;xxxxxxx&xxxx;XX.
3.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; metody xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx doplňkové xxxxx, které xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použijí xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
pro xxxx xxxxxxxxx xxxxx, xxxxx jsou xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX. |
3.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie týkající xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
3.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxx xxxxx
|
3.3.1.1 |
Xxxxxxxxx x&xxxx;xxxxxxxx druhů
|
|
3.3.1.2 |
Mikrobiální xxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX. |
3.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxx xxxxxxxxx látky pro xxxxxxxxxxxx
|
3.3.2.1 |
Xxxxxx metabolismu x&xxxx;xxxxxxx Xxxxxx xxxxxxxxxxx xx xxxxxxx xxxxxxxxxx. Pro xxxxxxxx xxxxxxxx se xxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxx. Xxxxxx xxxxxxx xxxx xxxxxxxx xx xxxxxxxx xxxxx x&xxxx;xxxx xxxxxxxxxxx xxxxx, které xxxxxxx xx xxxxxxx xxxxxxx „xxxxxxxx, provitamíny x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxxx xxxxxxx“, xxxxx mají xxxxxxxxx k akumulaci x&xxxx;xxxx, x&xxxx;xxx funkční xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxxxx. X&xxxx;xxxxx xxxxxxx xx nepoužije xxxxxx xxxxxxx x&xxxx;xxxxxx&xxxx;3.2.1 xxxxxxx&xxxx;XX. Požadavek je xxxxxx xx xxxxxxxx xxxxxx v tkáních nebo xxxxxxxxxx xxxx xxxxxxxx, xxx byla xxxxxxxx xxxxxxxx dávka xxxxxxx xxxxx, a pozitivní kontrolní xxxxxxxx (xxxxxxxxxx látka). |
|
3.3.2.2 |
Toxikologické xxxxxx Xx xx xxxxxxxx xxx produkty xxxxxxxxxxxxx xxxxxxx a pro xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxx povoleny. Xxx xxxxxxxx xxxxxxxxxxxxx procesu xx nutno předložit xxxxxx genotoxicity x&xxxx;xxxxxxxxxxxx xxxxxxxx, xxxxxx:
Xxxxx xxxxxxxxx xxxxxxxxxx patří xx xxxxxxx, x&xxxx;xxx xx známo, xx xxxxxxx xxxxx xxxxxxxxx xxxxxx, je xxxxx xxxxxxxx vyloučit xxxxxx xxxxxxxxxx. |
|
3.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.2.3 xxxxxxx&xxxx;XX. |
3.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky pro xxxxxxxxx/xxxxxxxxxx
Xxxxxxx se xxxx xxx&xxxx;3.3 přílohy II.
3.3.4 Studie týkající xx xxxxxxxxxxx používání xxxxxxxxx xxxxx pro xxxxxxx prostředí
Celý xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx použije xxx nové xxxxxx xxxxx, které xxxxx xx skupině sloučenin xxxxxxxxx xxxxx.
3.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx účinnosti xxxxxxxxx xxxxx
Xxxxxx xxxxxxxxx xx xxxxxxxxxx xxx xxxxxxxx, xxxxxxxxxxxxx, xxxx x&xxxx;xxxxxxx xxxxxxxxxxxx, které xxx xxxx xxxxxxxx xxxx xxxxxxxxx xxxxx, xxxxxxxxxx xxxxxxxxx prvků, xxxxx již xxxx xxxxxxxx xxxx doplňkové xxxxx, a vitamíny, xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx xxxxxxxxxxxx xxxxxxx, xxxxx xxx xxxx povoleny xxxx xxxxxxxxx xxxxx.
Xxxxxxxxxx xxxxxx xx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx pro xxxxxxxx xxxxxxxx, xxxx x&xxxx;xxxxxxx xxxxxxxxxxxx, xxxxx ještě xxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxx, xxxxxxxxxx xxxxxxxxx xxxxx, které xxxxx xxxxxx povoleny xxxx doplňkové látky, x&xxxx;xxx xxxxxxxx, provitamíny x&xxxx;xxxxxxxx přesně xxxxxxxxxx xxxxx xx srovnatelným xxxxxxx, xxxxx xxxxx xxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxx.
Xxx xxxxxxx xxxxx, x&xxxx;xxxxx se xxxxx xxxxxxxx xxxxxx, xx požaduje xxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx podle xxxxxxxxxx xxxxxx&xxxx;4 xxxxxxx&xxxx;XX.
Xxxxxx xxxx xxxxxxxx xxxxxxxx, xx xxxxxxxxx látka může xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx. Xxxxx zahrnují xxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxx nutriční požadavky xxxxxx. Je však xxxxx zamezit xxxxxxxx x&xxxx;xxxxxxxx kontrolní skupiny xxxxxx těžkým xxxxxxxxx. Xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx u jednoho xxxxx xxxx xxxxxxxxx zvířat, xxxxxx xxxxxxxxxxxxx zvířat.
3.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx látky xx xxx
Xxxxx oddíl xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
4.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXX DOPLŇKOVÉ XXXXX
4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx xxxxxxxxx xxxxx xxxx než xxxxxx x&xxxx;xxxxxxxxxxxxxx
4.1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
4.1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
4.1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx látek
|
4.1.3.1 |
Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxx xxxxxx xxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.1 xxxxxxx&xxxx;XX. |
|
4.1.3.2 |
Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx spotřebitele
|
|
4.1.3.3 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX. |
|
4.1.3.4 |
Xxxxxx týkající xx xxxxxxxxxxx doplňkové xxxxx xxx xxxxxxx xxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX. |
4.1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxxxxx se xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
1. |
Xxxxxxxxx látky, xxxxx mají xxxxxxxxx xxxx xx xxxxxxxxxx xxxxxx, užitkovost xxxx xxxxx xxxxxxx podmínky, x&xxxx;xxxxxxx xxxxxxx „xxxx xxxxxxxxxxxx doplňkové xxxxx“ Xxxxxx xxx xxxxxxxx xxxxx xx xxxxxx ke xxxxxxx xxxxxxxx druhu xxxx xxxxxxxxx zvířat. X&xxxx;xxxxxxxxxx na xxxxxxxxxxxx xxxxxxxxx xxxxx xxxxx xxx měření xxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxxxxxxx (xxxx. xxxxxxxxx účinnost, xxxxxxxx xxxxx přírůstek, xxxxxx xxxxxxxxxxx produktů), xxxxxxx xxxxxxx xxxxxxxxxx xxxx, užitkovosti stáda, xxxxxxxxxxxxx parametrech xxxx xxxxxxx xxxxxxxxx podmínkách xxxxxx. Xxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx studiemi xxxxxxxx příslušný xxxxxxxx. |
|
2. |
Xxxxxxxxx xxxxx, které xxxxxxxxx xxxxxxxxx důsledky živočišné xxxxxx xxx životní xxxxxxxxx X&xxxx;xxxxxxxxxxx látek, které xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx (např. omezená xxxxxxx xxxxxx x&xxxx;xxxxxxx xxxx omezená xxxxxxxx xxxxxx, eliminace xxxxxxxx), xx možno xxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxx krátkodobými studiemi xxxxxxxxx xx xxxxxxx xxxxxxxxxxxxx významné xxxxxxxxx xxxxxx. Xxxxxx xxxxxx x&xxxx;xxxxx možnost přizpůsobení xx xxxxxxxxx xxxxx. |
4.1.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx xxxxx na xxx
Xxxxx oddíl xx xxxxxxx xxxxx ustanovení xx.&xxxx;7 odst. 3 písm. g) nařízení (XX) x.&xxxx;1831/2003.
4.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx xxxxxxxxx xxxxx: xxxxxx x&xxxx;xxxxxxxxxxxxxx
4.2.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
4.2.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx pro xxxxx xxxxxxxxx xxxxx; metody xxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;XX přílohy II.
4.2.3 Oddíl III: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
|
4.2.3.1 |
Xxxxxx xxxxxxxx xx bezpečnosti používání xxxxxxxxx xxxxx xxx xxxxxx xxxxxxx Xxxxxxx xx xxxx bod 3.1.1 xxxxxxx&xxxx;XX. Xxxxxxxx xx xxxxxxxx, xxx xxxxx možno používali x&xxxx;xxxxxxx xxxxxxx xxxxxxxxxxxx 100xxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx. K tomuto xxxxx xxx xxxxxx koncentrovanou xxxxx xxxxxxxxx látky. Xxxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxx (xxxxxxx) / xxxxx (xxxxx) k ostatním xxxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxx xxxx být xxxxxx xxxx x&xxxx;xxxxxxx xxxxxxxx. X&xxxx;xxxxxx krmivo xxxxxxxxx xxxxxx xxxxxxxx(x). Xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX xx xxxxxxxx xx všechny xxxxxxxxxxxxxx a enzymy, xxxxx xxxx xxxxx xxxxxxxxxxx xxxxxx na xxxxxx xxxxxxxxxxx xxxxx xxxx x&xxxx;xxxxxxx xx xxx xx udává, že xxxxxxxxx střevní mikrobiální xxxxx. X&xxxx;xxxxxxx xxxx xxxxxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxxxx mohou xxx xxxxxxxx doplňkové xxxxxx, xxx byla xxxxxxxxx neexistence nepříznivých xxxxxx xx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxx xxxxxx. X&xxxx;xxxxxxxxxxx xxxx xxxxx xxxxx xxxxxxxx xxxxxxxxxxx xxxxx pouze x&xxxx;xxxxxxx, že xxxxxx xxxxxxxxx xxxxxxxxxx změny xxxxxx xxxxxxx (měřeno xx vitro jako xxxxx koncentrací těkavých xxxxxxxx kyselin, xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxxxxx). |
|
4.2.3.2 |
Xxxxxx týkající xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
Xxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxx pouze xxxx xxxx doplňkové xxxxx, xxxxx ve xxxxxxx xxxxxxx xxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx. Xxxxx xx nezbytné xxxxxxxxxx látku xxxxxxxxx, xxx bylo zajištěno, xx xxxxxxxxxx mutagenní xxxx jiné xxxxxxxxx, xxxxx xxxxx xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxx ze xxxxxx, xxx byla xxxxxx xxxxxx nebo xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxx. Xxxxxxx životaschopných xxxxxxxx xxxxxxxx xxx xxxxx xxxx xxxxxxx přijímání xxxxx (xxxxxx člověka) xx xxxx xxxxxxxx xx xxxxxx organismů, xxx xxx jsou x&xxxx;xxxxxxxxx xxxxx o zřejmém xxxxxxxxx používání, xxxx xx xxxxxx, pro xxx xxxx xxxxxxx xxxxxx xxxxxx vymezena. Xxxxxxx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxxx, které xx x&xxxx;xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxx, je xxxxxxx xxxxxx xxxxxxxxxx a významně xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxx. Xxxxx se xxx enzymy x&xxxx;xxxxxxxxxxxxx xxxxxx a pro xxxxxxxxxxxxxx, xxx xxx xxxx x&xxxx;xxxxxxxxx údaje x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx, a jsou-li xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx definované a známé, xxxxxxxxxx xxxxxxx xxxxxxxx (xxxx. xxxxxxxxx orální xxxxxxxx xxxx xxxxxxxxxxxx) xx xxxxx. Avšak x&xxxx;xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx enzymů xx vždy xxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxx uvedenými x&xxxx;xxxx 2.2.2.2 xxxxxxx&xxxx;XX. Xx-xx xxxxxxxxxx xxxx jeho užití xxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx xxxxxxxx o biologii (produkčního) xxxxxxxxx, xxx xxx xxxxxxxx potenciál xxxxxxxx xxxxxxxxx metabolitů, je xxxxx xxxxxxxxx studie xxxxxxxxxxxx a orální xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx, xxxxx obsahují xxxxxxxxxxxxx xxxxxxxxxxxxxx xxxx enzymy. X&xxxx;xxxxx xxxxxxx xxxx xxxxxx xxxxxx xxxxxxxxxxxx xxxxxx mutagenity x&xxxx;xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxx. Xxxxxxxxxx xx, xxx xx xxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxx xxxxx nebo v případě xxxxxxxxxx xxxxxx materiálů x&xxxx;xxxxxxx extraktem. |
|
4.2.3.3 |
Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxx pro xxxxxxxxx/xxxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX x&xxxx;xxxxxxxx těchto xxxxxxx:
|
|
4.2.3.4 |
Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx látky xxx xxxxxxx xxxxxxxxx Xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxxx xxxx xx xxxxxxxxxxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx. |
4.2.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající xx účinnosti xxxxxxxxxxx xxxxx
Xxxxxxx xx celý xxxxx&xxxx;XX přílohy II.
|
1. |
Doplňkové xxxxx, xxxxx xxxx pozitivní xxxx xx xxxxxxxxxx xxxxxx, xxxxxxxxxx xxxx xxxxx xxxxxxx xxxxxxxx x&xxxx;xxx funkční xxxxxxx „xxxx zootechnické xxxxxxxxx xxxxx“. Xxxxxx xxx xxxxxxxx xxxxx ve xxxxxx xx xxxxxxx cílovému xxxxx nebo kategorii xxxxxx. X&xxxx;xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxx xxxxx být měření xxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxxxxxxx (xxxx. produkční xxxxxxxx, průměrný xxxxx xxxxxxxxx, nárůst živočišných xxxxxxxx), xxxxxxx xxxxxxx xxxxxxxxxx xxxx, užitkovosti xxxxx, xxxxxxxxxxxxx parametrech xxxx dobrých životních xxxxxxxxxx xxxxxx. Xxxxx x&xxxx;xxxxxxxxxx působení xxx xxxxxxxxxx krátkodobými studiemi xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx měřícími xxxxxxxxx xxxxxxxx. |
|
2. |
Xxxxxxxxx látky, které xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx výroby xxx xxxxxxx xxxxxxxxx. X&xxxx;xxxxxxxxxxx látek, xxxxx xxxxxxxx ovlivňují xxxxxxx xxxxxxxxx (xxxx. xxxxxxx exkrece dusíku xxxx fosforu xxxx xxxxxxx produkce xxxxxx, xxxxxxxxx příchutí), xx xxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxxxxx studiemi xxxxxxxxx xx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxx. Xxxxxx xxxxxx x&xxxx;xxxxx xxxxxxx přizpůsobení xx xxxxxxxxx xxxxx. |
4.2.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx na trh
Tento xxxxx se použije xxxxx ustanovení čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
5.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXXXXX X&xxxx;XXXXXXXXXXXXXXXX
5.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx dokumentace
Použije xx xxxx oddíl I přílohy II.
5.2 Oddíl II: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
5.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie xxxxxxxx xx bezpečnosti xxxxxxxxxxx xxxxx
5.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx pro xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.1 xxxxxxx&xxxx;XX.
5.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx pro xxxxxxxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.2 přílohy II.
5.3.3 Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 přílohy II.
5.3.4 Studie týkající xx xxxxxxxxxxx používání xxxxxxxxx xxxxx pro xxxxxxx xxxxxxxxx
Xxxxxxx se xxxx bod 3.4 xxxxxxx&xxxx;XX.
5.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxx xxxxxxxxx xxxxx chrání xxxxxxx xxxx xxxxxxxx xxxxxx Eimeria xxx. xxxx Xxxxxxxxxx xxxxxxxxxxx. Xxxxxx xx přikládá xxxxxxx o zvláštních xxxxxxxx xxxxxxxxx xxxxx (xxxx. xxxxxxxxxxxx druh) x&xxxx;xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (xxxx. xxxxxxx xxxxxxxxx, xxxxxxxxx, xxxxx oocyst x&xxxx;xxxxxxx xxxxxxxxxx xxxx). Xxxxxxxxx xx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxx xx růst x&xxxx;xxxxxxxx krmiva (xxxxx xxxxxxx, xxxxxxx xxxxxx x&xxxx;xxxxxxx), xxxxxxxx xx xxxxxxx vajec (xxxxxxxx xxxxxx).
Xxxxxxxxxx xxxxx x&xxxx;xxxxxxxxx xxxx odvozeny xx xxx xxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxx:
|
— |
xxxxx jednotlivé x&xxxx;xxxxxxx xxxxxxx, |
|
— |
xxxxxxxxx/xxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxx xxx užití, |
|
— |
skutečné xxxxxxxx xxx xxxxx xxx xxxxxxxxx x&xxxx;xxxxxx. |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx (xxxx. klecový xxxx xxxxxxx) xxxx xxxxxxxx xxxxxxxxx účinnost xxxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx. Xxx xxxxxxxx xxxxxxxx xx xxxxxxxx xxx xxxxxx xxxxxxxxxx podmínky xxx xxxxx (xxxx. xxxxxx xxx xxxxxx xxxxxxxx x&xxxx;xxxxxxx, studie xxx klecovém chovu x&xxxx;xxxxxxx). Požadují se xxxxxx xxx xxxxxx x&xxxx;xxxxxx s určitou mírou xxxxxxxxx xxxxxxx.
5.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx na trh
Oddíl xxxxxxx&xxxx;XX xx použije xxxxx xxxxxxxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
6.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX X&xxxx;XXXXXXXXXXX XXXXX XX XXXXX MENŠINOVÉ
Menšinové xxxxx xxxx xxxxxxxx x&xxxx;xx.&xxxx;1 odst. 2 tohoto xxxxxxxx.
X&xxxx;xxxxxx na xxxxxxxxx xxxxxxxxxx xxxxx xxx xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx hlediska xxxxxxxxxxx x&xxxx;xxxxxx, xxx xxxx xxx xxxx užití xxxxxxxxx xxxxx xxxxxxxx, xx xxxxxxx nevyžaduje xxxxxxxxxx údajů v plném xxxxxxx.
Xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx xxxxx xx požadované xxxxxxxx xxx xxxxxxxxx druhy x&xxxx;xxxxxxx na doplňkové xxxxx, xxxxx xxx xxxx xxxxxxxx xxx xxxxx většinové. Xxx xxxxxxxx xxxxxx doplňkových xxxxx xxxxxxxxxx pouze xxx menšinové xxxxx xx xxxxxxx xxxx xxxxxxx oddíly x&xxxx;xxxxxxxxxx xx kategorii/funkční skupině xxxxxxxxx látky (viz xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX).
6.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx dokumentace
Použije xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
6.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx analýzy
Oddíl II xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, xxxxx xxxx vázané xx xxxxxxxx xxxxxxxx, se xxxxxxx xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx látky xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
6.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx
6.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxx zvířata
|
6.3.1.1 |
Tolerance x&xxxx;xxxxxxxx xxxxx Xxxxx požadavky xxx jednotlivé xxxxxxxxx / xxxxxxx skupiny xxxxxxxxxxx látek. V zásadě xx xxxxxx xxxxxxxxx u menšinových xxxxx nepožadují, xxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxx xxxxxxx xxx xxxxxxxxxx (xxxxxxx xxxxxxxxxx 10) x&xxxx;xxxxxxxxxxx xxxxxxxxxxx xxxxx, který xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx podobný. Pokud xxx xxxxxxxxx xxxxxx xxxxx (xxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx) xxxxxxxx obdobné x&xxxx;xxxxxx xxxxxxx pro xxxxxxxxxx, xxxxxxxxxx xx xxxxx xxxxxx tolerance xxx xxxxxxxxx xxxxx, xxxxx xxxxxx z fyziologického xxxxxxxx xxxxxxx (xxxx. xxxx xxxx xxxxxxx). Xxxxx xx xxxxxxxx studie xxxxxxxxx, xxxx xxxxxx xxxxxx pro menšinové xxxxx (vyjma králíků) xxxx xxxxxxx 28&xxxx;xxx xxx xxxxxxx x&xxxx;xxxxx x&xxxx;42&xxxx;xxx xxx dospělá xxxxxxx. X&xxxx;xxxxxxx xxxxx xxxx xxxx xxxxxx: xxxxx králíků: 28 dní; xxxxxx králice: xxxxx xxxxxx (xx inseminace xx konce doby xxxxxxx). Xxxxx se xxxxxx vztahuje xx xxxxxx x&xxxx;xxxxxxxxx králíky, xxxxxxxx se za xxxxxxxxxx xxxxxx 49&xxxx;xxx (xxxxxxxx xxxxx xxxxx xx xxxxxxxx) x&xxxx;xxxx xxxxxxxxx králice až xx xxxxxxx. Xxx xxxx (xxxx než xxxxxxxxxx) se xxxxxxxx 90xxxxx období. |
6.3.2 Studie týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro xxxxxxx xxxx xxxxxxxxxxxx
|
6.3.2.1 |
Xxxxxx xxxxxxxxxxx Xxxxx xxxxxxxxx pro xxxxxxxxxx kategorie x&xxxx;xxxxxxx xxxxxxx doplňkových látek. Studie xxxxxxxxxxx xx nepožadují, xx-xx doplňková xxxxx xxx xxxxxxxx pro xxxxx u druhu, který xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx, xx xxx se xxxxxxxx žádost x&xxxx;xxxxxxxx. Xxxxxxxx podobnost z fyziologického xxxxxxxx xxxxxxxxxx, považuje xx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xx xxxxxxxxxx porovnání xxxxxxxxxxxxx xxxxxxx xx xxxxxxx xxxxxx in xxxxx (xxxx. x&xxxx;xxxxxxxxxx pomocí xxxxxxx xxxxx). Xxxx-xx xxxxxxxxx xxxx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxx většinovému druhu, xx xxxxx xxxxxx xxxxx o metabolismu xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxx druhu. |
|
6.3.2.2 |
Studie xxxxxxx Xx-xx xxxxxxx nebo xxxxxxxxx podobnost xxxxxxxxxxx, xxxxxxxx xx pouze xxxxxxxxxxxx indikátorového xxxxxxx x&xxxx;xxxxxxxxxxxxx tkáních a produktech. Xx xxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxx xxxx bod 3.2.1.2 xxxxxxx&xxxx;XX. |
|
6.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx pro xxxxxxxxxxxx Xxxxx xxxxxxxxxxx xxxxxx reziduí (XXX) Xxxxxxxxx MLR lze xxxxxxx xx xxxxxxxxxxx, xx xx v poživatelných xxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx žádné xxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx. XXX xxx extrapolovat x&xxxx;xxxxx xxxx xxxxxx xxxxx:
XXX pro xxxx xxx extrapolovat, xxxxx xxxxxxxx MLR xxx xxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx. Xxxxx xxxx xxxxxxxx xxxxxxxxx XXX x&xxxx;xxxxx (xxxx xxxx), xxxxxx a kuřat (nebo xxxxxxx), xxxxx xxxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx, xx xxxxx xxxxxxxx xxxxxx XXX xxxxxx pro xxxx, xxxxxxxx a králíky, což xxxxxxx, že se xxxxxxxx xx xxxxxx xxxxxxxxxxx xx všechna xxxxxxx, která xxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx, x&xxxx;xxxxxxxx ryb. X&xxxx;xxxxxxx xx xxxxx Xxxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxxxx (XXXX)&xxxx;(10) xxx xxxxxxxxx XXX pro Xxxxxxxxxx x&xxxx;xxxxxxx xxxx, xxxxx xxx povoluje xxxxxxxxxxx x&xxxx;XXX xx xxxxx většinového druhu xx Salmonidae x&xxxx;xxxxxxx xxxx za xxxxxxxxxxx, xx xxxxxxx xxxxx xxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxx pro XXX xx xxxxx x&xxxx;xxxx, lze XXX xxxxxxxxxxxx na xxxxxxx xxxxxxx určená x&xxxx;xxxxxxxx xxxxxxxx. Xxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxx xxx monitorování xxxxxxx x&xxxx;xxxxxxxxxxxxx tkáních x&xxxx;xxxxxxxxxx xxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx potravin. |
6.3.3 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx uživatele/pracovníky
Použije xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
6.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx životní xxxxxxxxx
Xxxxxxxxx xxxxx xxx životní xxxxxxxxx xxx extrapolovat x&xxxx;xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx xxxx, xxxxx xx z fyziologického xxxxxxxx xxxxxxxxxxx. Pro xxxxxxxxx xxxxx, xxxxx mají xxx xxxxxxxxx u králíků, xx xxxxxxx celý xxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxx každou xxxxxxxxx / xxxxxxx skupinu xxxxxxxxxxx látek.
6.4 Oddíl IV: Studie xxxxxxxx se xxxxxxxxx xxxxxxxxx xxxxx
Xxxxx xxxxxxxxx xxxxx byla xxx xxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxx xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx, x&xxxx;xxxxx xx xxxx nebo xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx, xx xxxxx považovat za xxxxxxxx účinnosti xxxxxx x&xxxx;xxxxxxx mechanismu působení x&xxxx;xxxxxxxxxxx xxxxx. Xxxxx xxxxxxxx spojitost xxxxxxxxxx, xx nutno xxxxxxxx xxxxxxxx podle xxxxxxxx xxxxxxxx xxx xxxxx&xxxx;XX x&xxxx;xxxxxxx&xxxx;XX. X&xxxx;xxxxxxxxx případech xxxx být xxxxxx xxxxxxxxxx xxxxx xxxxxx xx xxxxxx xxxxxxxxxxx xxxx (např. kozy x&xxxx;xxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxx). X&xxxx;xxxxx studii (X&xxxx;≤ 0,1) nebo xxxxxx xxxxxxxxxxx (X&xxxx;≤ 0,05), xx-xx xx xxxxx, xx xxxx xxx xxxxxxxxx xxxxxxxxxx.
Xxxxxxxx-xx xx xxxxxxxxx xxxxxxxxx, xxxx xxxxxx xxxxxx xxxxxxxxx odpovídá srovnatelným xxxxxxxxxx fázím většinového xxxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxx xxxxxx xxxxxxx příslušná xxxxxxxxxx x&xxxx;xxxx&xxxx;4.4 přílohy II x&xxxx;xxxxxxx&xxxx;XX.
6.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx xxxxxxx&xxxx;XX xx xxxxxxx podle xxxxxxxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
7.&xxxx;&xxxx;&xxxx;XXXXXXX X&xxxx;XXXXXXXX CHOVU A OSTATNÍ XXXXXXX, XXXXX XXXXXX XXXXXX K PRODUKCI XXXXXXXX
Xxxxxxx x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxx nejsou xxxxxx k produkci xxxxxxxx, xxxx vymezena x&xxxx;xx.&xxxx;1 xxxx.&xxxx;1 tohoto nařízení.
7.1 Oddíl I: Shrnutí xxxxxxxxxxx
Xxxxxxx se celý xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
7.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx takto:
|
— |
pro xxxxxxxxx xxxxx, xxxxx jsou xxxxxx xx xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx xxxxx xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2., 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
7.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxx xxxxx
7.3.1&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro cílová xxxxxxx
Xxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx / xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx. Požaduje-li xx xxxxxx xxxxxxxxx, xxxx xxxx trvání činí xxxxxxx 28&xxxx;xxx.
Xxxxxx xxxxxxxxx xx xxxxxxxxxx, xxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxx rozpětí xxx bezpečnost u třech xxxxxxxxxxx druhů (xxxxxx xxxxxxxxxxxxxxx a přežvýkavých savců x&xxxx;xxxxxxx).
7.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx spotřebitele
Tento xxx xx xxxxxxx xxxxxxxxxx. Pozornost se xxxxxx xxxxxxxxxxx xxxxxxxx.
7.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.3 přílohy II.
7.3.4 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx
Xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx nepožaduje.
7.4 Oddíl IV: Xxxxxx xxxxxxxx xx xxxxxxxxx doplňkové xxxxx
Xxxxx xxxxxxxxx xxx jednotlivé xxxxxxxxx / funkční xxxxxxx xxxxxxxxxxx xxxxx.
Xxxxxxxx xxxxxxxxx xxxxx, pro xxx xx xxxxxxxx xxxxxx xx xxxxxxxxx, xxx xxxx předem xxxxxxxx xxx xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx podobný, nepožaduje xx xxxxx xxxxxxxxx xxxxxxxxx, xxxx-xx požadovaný xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxx. Xxxxx xxxxxxxxx xxxxx nebyla dosud xxxxxxxx xxxx xxxxxxxxxx xxxxxx či xxxxxxxxxxx xxxxxxxx xxxx jiné xxx v případě xxxxxxxxxxx xxxxxxxx, xx xxxxx xxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxx xxxxx&xxxx;XX v příloze II.
Doba xxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxx 28&xxxx;xxx.
7.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx oddíl xxxxxxx&xxxx;XX xx použije xxxxx xxxxxxxxxx čl. 7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) č. 1831/2003.
8. DOPLŇKOVÉ XXXXX, XXXXX XXX XXXX XXXXXXXX PRO XXXXX X&xxxx;XXXXXXXXXXX
8.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
8.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky xxx xxxxx xxxxxxxxx xxxxx; xxxxxx analýzy
Oddíl II xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, xxxxx jsou xxxxxx xx xxxxxxxx povolení, xx xxxxxxx celý xxxxx&xxxx;XX, |
|
— |
xxx jiné xxxxxxxxx xxxxx xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2., 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
8.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx týkající xx xxxxxxxxxxx doplňkových xxxxx
Xxxx xxx xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx údaji.
Pro xxxxxxxxx xxxxx, xxxxx jsou xxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx látky xxxx xxxxxxxxx x&xxxx;Xxxxxxxx xxxx xxxx xxxxxx potravin xxx xxxxxxxxxxx xxxxxxx, xxxxxx studie xxxxxxxx xx xxxxxxxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxx.
Xxxxxx xx xxxx&xxxx;3.1, 3.2 a 3.3 xxxxxxx&xxxx;XX xx zřetelem na xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxx, xxxxx xxxx používány x&xxxx;xxxxxxxxxxx. Xxxxxxxx xxxxx, xxxxx xxxx používány xxxxxx x&xxxx;xxxxxxxxxxx, xxx klasifikovat xxxx:
|
— |
x&xxxx;xxxxxxxxxxxxxxxx XXX (xxx xxxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxx xxx xxxxx x&xxxx;xxxxx nízkou xxxxxxxxx), |
|
— |
xx xxxxxxxxxx XXX xxxx UL nebo |
|
— |
s nestanovenou XXX (xxx látky, x&xxxx;xxxxx dostupné xxxxx xxxxxxxxxxx ke zjištění xxxxxx bezpečnosti). |
8.3.1 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro xxxxxx xxxxxxx
Xx-xx xxxxx xxxxx xxxxxxxxx xxxxx xxxxxxx jako v případě xxxxxxxx, xxx bezpečnost xxx xxxxxx xxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx údajů xx xxxxxxx in xxxx s přihlédnutím x&xxxx;xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx xxxxxxxx druhů. Xx-xx xxxxx užití x&xxxx;xxxxxxxx xxxxxxxx vyšší xxx xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxx, xxxx xxx podle xxxxxx látky xxxxx xxxxxx tolerance x&xxxx;xxxxxxxx xxxxxxx.
8.3.2&xxxx;&xxxx;&xxxx;Xxxxxx týkající se xxxxxxxxxxx používání doplňkové xxxxx xxx spotřebitele
Pokud xxxxx jako doplňková xxxxx xxxx k vyšší xxxxxxxx spotřebitele nebo x&xxxx;xxxxxx druhu xxxxxxxxxx xxx v případě užití x&xxxx;xxxxxxxxxxx, budou xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxx x&xxxx;xxxxx x&xxxx;xxxxxxxxx.
|
8.3.2.1 |
Xxx xxxxxxxxx xxxxx, xxx něž xxxx specifikována XXX Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx xx nepožaduje xxxxx xxxxxxx, xxx užití xxxxxxxxx xxxxx v krmivech xxxx k odlišnému druhu xxxxxxxxxx xxx při xxxxx x&xxxx;xxxxxxxxxxx. |
|
8.3.2.2 |
Xxxxxxxxx látky xx xxxxxxxxxx XXX xxxx XX Xxxxxxxxxx xxx xxxxxxxxxxxx xx xxxxx xxxxxxxx s přihlédnutím k doplňkové xxxxxxxx xxxxxxxxxxx z užití x&xxxx;xxxxxxxx nebo xxxxxxxx xxxxxxxx v souvislosti x&xxxx;xxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx. Xx xxx xxxxxxx xxxxxxxxxxx údajů o reziduích x&xxxx;xxxxxxxxxx. Xxxx-xx xxxxxxxx xxxxxx xxxxxxx, xxxxxxxxx je xxxxxx xx srovnání xxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx x&xxxx;xxxxxxxxxx skupiny x&xxxx;xxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxx. |
|
8.3.2.3 |
Xxxxxxxxxxxxx xxxxxxxx xxxxx, xxx xxx xxxxxx XXX stanovena Je xxxxx xxxxxxxxxxx xxxxx důvody, xxxx xxxxxx XXX xxxxxxxxx. Xxxxx xx xxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx látky v krmivech xx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx expozice u spotřebitele, xxxxxxxx xx xxxxx xxxxxxxxxxxxx hodnocení. Doplňkovou xxxxxxxx xxxxxxxxxxx z užití x&xxxx;xxxxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxx x&xxxx;xxxxxxxxx z literatury. Jsou-li xxxxxxxx xxxxxx xxxxxxx, xxxxxxxxx xx omezen xx xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx x&xxxx;xxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxx. |
8.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx se xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
Xxx xxxxxxxxxx xxxxxxxxxxx doplňkové xxxxx xxx uživatele xx xxxxxx x&xxxx;xxxxx xxxxxxxxxxxx xxxxxxxx stanovená xxx xxxxxxxxxx x&xxxx;xxxxxx xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx.
8.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx
Xxxxxxxx se xxx&xxxx;3.4 přílohy II.
8.4 Oddíl IV: Studie xxxxxxxx xx účinnosti xxxxxxxxx látky
Jestliže je xxxxxx xxxxxxxxxx pro xxxxxx stejná xxxx xxx xxxxx x&xxxx;xxxxxxxxxxx, xxxxxx xxx xxxxx xxxxx prokázání xxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx xxxxx xxxxxxxxx na xxxxxxxx xxxxxxx v oddíle IV xxxxxxx&xxxx;XX.
8.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx látky xx xxx
Xxxxx xxxxx přílohy II xx použije podle xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
9.&xxxx;&xxxx;&xxxx;XXXXX XXXXXXXX
Xxxxxxx xx xxxxx xxxxxx xxxxxxxxx údajů xxxxxxxxxxxx pro předchozí xxxxxxxx, xxxx dokumentace xxxxxxxxxx xxx xxxxxx xxxxx xx.&xxxx;13 xxxx.&xxxx;3 xxxxxxxx (XX) č. 1831/2003 xxxxxxxx xxxxx xxxx xxxxxxx požadavky.
Žádost o změnu xxxxxxxx zahrnutých ve xxxxxxxxxx povolení, xxxx. xxxxxxxxxxxx, xxxxxxxxxxxxxxx nebo xxxxxxxx xxx užití xxxxxxxxx xxxxx, musí xxxxxxxx, xx xxxxx xxxx xxxxx škodlivý xxxxxx pro cílový xxxx, xxxxxxxxxxxx, xxxxxxxxx xxxx životní xxxxxxxxx. Xx xxxxx xxxxxx xx xxxxx xxxxxxxxxx xxxxx považovat xx xxxxxxxx, xxxxx účinná xxxxx(x)&xxxx;xxxx xxxxxxx(x)&xxxx;x&xxxx;xxxxxxxx xxx xxxxx xxxx stejné, xxxx xxxxxxx xx x&xxxx;xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx xxxxx xxxx xxxxxx, xxxxx xx xxxxxxxxxx xxxxx. Pro xxxxxxxx xxxxxxxx je xxxxx podat zkrácenou xxxxxx, jelikož xxxxxxx xxxxxx xxxxx opakovat xxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx xxx xxxxxx druh, xxxxxxxxxxxx a životní xxxxxxxxx x&xxxx;xxxxxxxxx.
Xxxxxx xxxx xxxxxxxx xxxx xxxxxxxxx:
|
1. |
xxxxxxx se xxxx xxxxxxx&xxxx;X&xxxx;– xx xxxxxxxx údaje o požadované xxxxx; |
|
2. |
xxxxxxx xx xxxx xxxxx&xxxx;XX přílohy II; |
|
3. |
je xxxxx xxxxxxxxxx údaje, xxxxx xxxxxxxxx, xx chemické xxxx biologické vlastnosti xxxxxxxxx xxxxx xxxx x&xxxx;xxxxxx stejné jako x&xxxx;xxxxxxx xxxxxxxx; |
|
4. |
xxxxxxxxx je xxxxx předložit xxxxxx x&xxxx;xxxxxxxxxxxxxx, a to xx xxxxxxx specifikace, zveřejněné xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx. Není-li xxxxxxxxxxxxxx xxxx prokázána, je xxxxx xxxxxxxx xxxxx xxxxxxxx xxxxx s MLR; |
|
5. |
je xxxxx xxxxxxxxx xxxxx, xx xx xxxxxxxxxx xxxxxxxxx poznatků xxxxxxx xxxxxxxxx látka za xxxxxxxxxxx xxxxxxxx bezpečná xxx xxxxxx xxxxx, xxxxxxxxxxxx, pracovníky x&xxxx;xxxxxxx xxxxxxxxx; |
|
6. |
xx xxxxx předložit xxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx xxxxx xx trh, xxxx-xx xxxxxxxx xxxxxxxxx xx monitorování zahrnuty x&xxxx;xxxxxxxx; a |
|
7. |
je nutno xxxxxxxxx zvláštní xxxxx x&xxxx;xxxxxxxx žádosti x&xxxx;xxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx částmi xxxxxx&xxxx;XXX, XX a V přílohy II. |
10. OBNOVENÍ XXXXXXXX
Xxxxxxx o obnovení xxxxxxxx xxxxx článku 14 nařízení (XX) x.&xxxx;1831/2003 xxxxxxx xxxx požadavky:
10.1 Oddíl I: Shrnutí xxxxxxxxxxx
Xxxxxxx xx xxxx oddíl I přílohy II. Xxxxxxxx xx xxxxx xxxxxxxxx povolení Xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxx xx trh xxxx xxxxxxxx xxxxxxxx xxxxxxx. Xxxxxxxx xx aktualizovaná xxxxxxxxxxx xxxxx nejnovějších xxxxxxxxx x&xxxx;xxxxxxxx xx xxxxxx x&xxxx;xxxxxxxx všech xxxx oproti xxxxxxxxx xxxxxxxx nebo xxxxxxxxxx xxxxxxxx povolení. Xxxxxxx xxxx předložit shrnutí xxxxxxxxxxx, xxxxx xxxxxxxx xxxxxx xxxxxxx, x&xxxx;xxxxxxxx xxxx informace, xxxxx xx xxxxx xxxxxxxxxx xx xxxx udělení xxxxxxxxxxx povolení/obnovení xxxxxxxx x&xxxx;xxxxxxx xx identitu x&xxxx;xxxxxxxxxx.
10.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, charakteristika x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx takto:
|
— |
pro doplňkové xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX, |
|
— |
xxx jiné xxxxxxxxx xxxxx se xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
Xx nutno xxxxxxxxx xxxxxx, xxxxx prokazují, xx xx doplňková xxxxx významně xxxxxxxxx, xxxxx xxx x&xxxx;xxxxxxx, xxxxxxx nebo xxxxxxxx, xxxxxx povolené doplňkové xxxxx. Je nutno xxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx postupu.
10.3 Oddíl III: Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxxxx látek
Musí být xxxxxxxxx důkaz, xx xx současného xxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxx za xxxxxxxxxxx xxxxxxxx bezpečná xxx xxxxxx druh, xxxxxxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx. Xxxx být xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xx xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxx xx posledního xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxx informace:
|
— |
zprávy x&xxxx;xxxxxxxxxxx xxxxxxxx, včetně xxxxxxxxxx xxxx (xxxxx xxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx xxxxx, xxxxxxx xxxxxx xxxxxxx xxxxxx) u cílových xxxxxx, xxxxxxxxxxxx, xxxxxxxxx x&xxxx;x&xxxx;xxxxxxxx xxxxxxxxx. Xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx musí xxxxxx xxxxxx xxxxxx, počet xxxxxxxxxxx xxxx/xxxxxx, výsledek, xxxxxxxx pro xxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxxx, |
|
— |
xxxxxx x&xxxx;xxxxx neznámých xxxxxxxxxxx x&xxxx;xxxxxxxxx kontaminacích, |
|
— |
údaje x&xxxx;xxxxxxxxxxxx xxxxxxx, xx-xx xx xxxxx, |
|
— |
xxxxx z epidemiologických/epizootologických a/nebo xxxxxxxxxxxxxxx studií, |
|
— |
jakékoliv xxxxx xxxxxxxxx týkající xx xxxxxxxxxxx doplňkové xxxxx x&xxxx;xxxxx doplňkové xxxxx xxx zvířata, xxxxxxx x&xxxx;xxxxxxx xxxxxxxxx. |
Xxxxx nejsou xxxxxxxxxx xxxxx xxxxx xxxxxxxxx o některém x&xxxx;xxxxxx xxxxxxx, musí xx xxx xxxxxx xxxxxxxxxx.
Xxxxxx x&xxxx;xxxxxxxxxx programu xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx trh xx předloží, xx-xx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx.
Xxxxx xxxxx xxxxxxxxxx xx.&xxxx;14 odst. 2 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxx x&xxxx;xxxxxxxx xxxxxxxx xxxxxxxx xxxxx xx xxxxx xxxx doplnění podmínek xxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxx monitorování, xx xxxxx xxxxxxxxx xxxxxxxx xxxxx na xxxxxxx xxxxxx na xxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxxx&xxxx;XXX, IV x&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
11.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXX XXXXXXXXX XXXXXXXXXXX XXXXX, XXXXX JIŽ XXXX XXXXXXXX XXXXX XXXXXXXX 70/524/XXX
Xxxxxxxxxxx xxxxxxx, xxxxx se xxxx xxxxx xxx&xxxx;11, jsou xxxxxxxxx xxxxx, xxxxx xxx byly xxxxxxxx xxxxx směrnice 70/524/XXX x&xxxx;xxxx být přehodnoceny x&xxxx;xxxxxxx s čl. 10 xxxx.&xxxx;2 xxxxxxxx (ES) x.&xxxx;1831/2003 x&xxxx;xxxxx xxxxx xx xxxxxx xxxxxx:
|
— |
xxxxxxxxxxxx xxxxx, |
|
— |
xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx, |
|
— |
xxxxxxxxxx x&xxxx;xxxxxxxxxxxxx, xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxx, |
|
— |
xxxxxxx, xxxxxx xxxxxxxx, |
|
— |
xxxxxxxxxxx, |
|
— |
xxxxxxxx, xxxxxxxxxxx a chemicky přesně xxxxxxxxxx xxxxx se xxxxxxxxxxxx xxxxxxx, |
|
— |
xxxxxxx prvky, |
|
— |
pojiva, xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx; |
|
— |
xxxxxxxxxx xxxxxxxxx a |
|
— |
radionuklidní xxxxxx. |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxx doplňkových xxxxx xxxx xxx xxxxxxx xxxx x&xxxx;xxxxxx xxxxxxxxxxx xxxxx. Avšak xxxxxxxx x&xxxx;xxxxxx historii xxxxxx xxxxxxxxxx používání je xxxxx xxxxxx údaje x&xxxx;xxx xxxxxxxxxxxx xxxxxx xxxxx ustanovení xxxxxx xxxxxxxx, aby xxxx xxxxxxxxx, xx xx xxxxxxxxxxx podmínek xxxxxxxxx xxxxx zůstává bezpečná xxx xxxxxx druhy, xxxxxxxxxxxx, xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx.
11.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx oddíl I přílohy II.
11.2 Oddíl II: Xxxxxxxx, xxxxxxxxxxxxxxx a podmínky xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx látky, které xxxxxx xxxxxx na xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx xxxx xxxxxxxxx xxxxx, které xxxx xxxxxx na xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx oddíl II. |
11.3 Oddíl III: Xxxxxx xxxxxxxx se bezpečnosti xxxxxxxxxxx xxxxx
Xxxxx xxxx xxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxx xx bezpečnost xxx xxxxxx xxxxx, xxxxxxxxxxxx, xxxxxxxxx/xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx, xxxxxxxx xx xxxxxxx xxxxxx bezpečnosti xxxxxxxxxxxx pro předchozí xxxxxxxx x&xxxx;xxxxxxxx nové xxxxxxxxx, xxxxx xxxx xxxxxxx xx doby xxxxxxx předchozího povolení. Xxxxx nebylo formální xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxx xxxx xxxxxxxxx látky, xxx xxxxxx xxxxxx x&xxxx;xxxxx z vědecké xxxxxxxxxx, xxxxxxxx xxxx xxxxxxxxxx xxxxxx, které xx xx xxxxxxxxxx x&xxxx;xxxx xxxxxxx. V opačném xxxxxxx xx xxxxxxxx úplný xxxxxx xxxxxx xxxxxxxxxxx.
11.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx xxxxxxxxx doplňkové látky
Shodu x&xxxx;xxxxxxxxx xx xxxxxxxx xxxxx xx.&xxxx;5 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003 xx xxxxx xxxxxxxxx xxxxxxxx předložením xxxxxx xxxxxxxxx xxx xxxxxx, xxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxxx používání.
11.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx přílohy II xx použije podle xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
(1)&xxxx;&xxxx;Xxxxxxxx xxxxx je xxxxxxxx xxxxx, která xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxx xx této xxxxx xxxxxxxx. Může xxxxxxxxx rovněž látky, xxxxx xxxx xxxxxxxx x&xxxx;xxxxxx xxxxxxx koncentracích, xxx je xxxxxxx.
(2)&xxxx;&xxxx;Xxx xxxxx xxxxxx nařízení xx „xxxxxxxx xxxxxxxx“ xxxxxx proces, xxx xxxx je přirozené xxxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx xx základě xxxxxxxxx fermentace x/xxxx xxxxxxx doplňkových xxxxx x&xxxx;xxxxxxxxxx.
(3)&xxxx;&xxxx;Xxxxxxxxxxxxx číslo xxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxx xx XXXXXX, xxxxxxxxxxx systému XX pro xxxxxxxxxxx xxxxx, xxxxxxxx x&xxxx;xxxxxxxx Xxxxxx (ES) č. 1565/2000 xx xxx 18.&xxxx;xxxxxxxx 2000 (Úř. věst. L 180, 19.7.2000 x.&xxxx;8), kterým xx stanoví xxxxxxxx xxxxxxxx pro přijetí xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx parlamentu x&xxxx;Xxxx (XX) x.&xxxx;2232/96 (Xx.&xxxx;xxxx. X&xxxx;180, 19.7.2000 x.&xxxx;8).
(4)&xxxx;&xxxx;X.&xxxx;Xxxx Xxxxxx: xxxxx Xxxx Evropy používané xxx xxxxxxxxx definované xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx xx xxxxxx Xxxx Xxxxxx x.&xxxx;1 „Natural xxxxxxx xx xxxxxxxxxxx“, xx.&xxxx;X,&xxxx;Xxxxxxxxx&xxxx;2000 x&xxxx;xxxxxxxxxxxxx svazcích.
(5) Číslo XXX (x.&xxxx;XXX) Registrační xxxxx xxxxx Xxxxxxxx Xxxxxxxxx Service, jednoznačný xxxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxx používaný v seznamech xxxxxxxxxx xxxxx.
(6)&xxxx;&xxxx;Xxx xxxxx xxxxxx xxxxxx xxxxxxxx xx „xxxxxxxxxxxxx významnou xxxxxx“ rozumí xxxxx x&xxxx;xxxxxxxxxx xxxxxx xxxx xxxxxxxx xxxxxxx (TDI xxxx XXX), ADI, xxxx s omezením, pokud xxx o její xxxxxxxxx, xxxx xxxxxx xxxxxx, xxx je xxxxxxxxx xx xxxxxxxx Rady 88/388/XXX xxxxxxxx xx xxxxx určených k aromatizaci xxx použití x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxx materiálů xxx xxxxxx výrobu, nebo xxxxxxxxx látka.
(7) Stanoveno x&xxxx;xxxxxxx&xxxx;4 xxxxxx Rady Xxxxxx x.&xxxx;1 „Xxxxxxx sources xx xxxxxxxxxxx“, xx.&xxxx;X,&xxxx;Xxxxxxxxx, 2000.
(8)&xxxx;&xxxx;XXXXX (XXX/XXX, 1996, Xxxx xxxxxxxx xxxxxx 35, IPCS, XXX Xxxxxx) xxxxxxxxxxxx prahová xxxxxxx pro cílové xxxxx xx xxxx xxx xxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxx zvířete a příjmu xxxxxx.
(9)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 180, 19.7.2000, x.&xxxx;8.
(10)&xxxx;&xxxx;Xxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx reziduí xxx Salmonidae x&xxxx;xxxxxxx xxxx. Xxxxxxxx agentura xxx xxxxxx xxxxxxxxx. Xxxxxxxxxx Medicines Xxxxxxxxxx Xxxx. XXXX/XXXX/153x/97-XXXXX.
XXXXXXX XX
Xxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxx x xxxx x xxxxxxxxx xxxx xxxxxx xxxxxx xxxxxxxxx
1. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxxxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Minimální xxxx trvání xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx/xxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx (xxxxxx) |
Xxxxx xxxxxxx sající xxxxx xx prasnic |
Xx narození |
Xx xx 21–42 xxx |
Xx xx 6–11 xx |
14 xxx |
|
Xxxxxx (xxxxxxxxx) |
Mladá xxxxxxx xx xxxxxxxx období xxxx xxxxxxx x xxxxxxxxxx xxxx pro masnou xxxxxxxx |
Xx 21–42 xxx |
Xx xx 120 xxx |
Xx xx 35 xx |
42 dní |
|
Selata (xxxxxx a odstavená xxxxxx) |
Xxxxx xxxxxxx xx xxxxxxxx xxxxxxx x xxxxxxxxxx nebo xxx masnou produkci |
Xx xxxxxxxx |
Xx xx 120 xxx |
Xx xx 35 xx |
58 xxx |
|
Xxxxx prasat |
Prasata xx xxxxxxx xxxxxx x xxxxx xxxxxxxx xx xx xxx xxxxxx xx jatky |
Od 60–120 xxx |
Xx xx 120–250 dní (xxxx xxxxx xxxxxxxx zvyklostí) |
80–150 xx (xxxx xxxxx místních xxxxxxxxx) |
Xx xx xxxxxxx xxxxxxxxx, nejméně xxxx 70 xxx |
|
Xxxxxxxx xxxxxx x xxxxxxxxxx |
Xxxxxx xxxxxxx, xxxxx byly xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Od xxxxx xxxxxxxxxx |
|
|
Od xxxxxxxxxx xx xxxxx odstavu xxxxxxx xxxx (xxx xxxxx) |
|
Xxxxxxxx xxxxxx k reprodukci xxxxx |
Xxxxxx xxxxxxx, které xxxx nejméně jednou xxxxxxxxxxxx/xxxxxxxxxx |
|
|
|
Xxxxxxx xxx xxxxx xxxx xxxxxxx xx xxxxx doby odstavu |
2. Xxxxxxx. Xxxxxxxxx xxxxxx: drůbež
|
Kategorie |
Xxxxxxxx xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx dlouhodobých xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxx kuřat |
Kuřata určená xxx výkrm |
Xx xxxxxxxxx |
Xx xx 35 xxx |
Xx xx ~1 600 x (xx xx 2 xx) |
35 xxx |
|
Xxxxxx xxxxx x xxxxxx |
Xxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxx xxxxx xxxx pro xxxxxx xxxxx |
Xx vylíhnutí |
Xx xx ~16 xxxxx (xx xx 20 týdnů) |
— |
112 xxx (xxxxxx-xx xxxxx o účinnosti x xxxxxxxxx pro xxxxx xxxxx) |
|
Xxxxxxx |
Xxxxxxx ve xxxxxx xxxxxxx xxx xxxxxxxx xxxxx |
Xx 16–21 xxxxx |
Xx xx ~13 xxxxx (xx xx 18 měsíců) |
Xx 1 200 x (xxxx), 1 400 x (xxxxx) |
168 dní |
|
Xxxxx xxxx |
Xxxxx x xxxxxxx chovaní xx xxxxx |
Xx xxxxxxxxx |
Xx do ~14 xxxxx (xx xx 20 xxxxx) Až xx ~16 týdnů (až do 24 xxxxx) |
Xxxxxx: xx xx ~7 000 x (xx xx 10 000 g) Samci: xx xx ~12 000 x (xx xx 20 000 x) |
84 dní |
|
Krůty xxx xxxxx xxxxxxxxxx |
Xxxxx x xxxxxxx xxxxxxx pro xxxxx xxxxxxxxxx |
Xxxx xxxxxx |
Od 30 týdnů xx xx ~ 60 xxxxx |
Samice: od ~15 000 x Xxxxx: xx ~30 000 g |
Xxxxxxx xxxx xxxxxx |
|
Odchov xxxx |
Xxxxx xxxxx a krocani xxxxxx x xxxxxxx účelům |
Xx xxxxxxxxx |
Xx xx 30 xxxxx |
Samice: až xx ~15 000 x Xxxxx: xx do ~30 000 g |
Xxxx xxxxxx (xxxxxx-xx údaje x xxxxxxxxx k dispozici xxx xxxxx krůt) |
3. Tabulka. Xxxxxxxxx xxxxxx: xxxx (domácí xxxx, xxxxxx xxxxx xxxxxxx x xxxxx)
|
Xxxxxxxxx |
Definice xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx trvání xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Hmotnost |
|||
|
Xxxxxx xxxxx |
Xxxxxx xxxxxxx xxx xxxxxxxxxx nebo produkci xxxxxxxx xxxx |
Xx narození |
Až xx 4 xxxxxx |
Xx xx 60–80 xx (xx do 145 xx) |
56 xxx |
|
Xxxxx xxxxx |
Xxxxxx xxx xxxxxxxx xxxxxxxx masa |
Xx xxxxxxxx |
Xx xx 6 měsíců |
Xx xx 180 xx (až xx 250 xx) |
Xx xxxxxxx, nejméně xxxx 84 xxx |
|
Xxxxx xxxxx |
Skot xx xxxxxxx xxxxxx x xxxxx produkci do xxx xxxxxx na xxxxx |
Xx xxxxxxx xxxxxxx xxxxxxxxxxxx |
Xx xx 10–36 xxxxxx |
Xx xx 350–700 xx |
168 xxx |
|
Xxxxxxx pro xxxxxxxx mléka |
Samice skotu, xxxxx porodily nejméně xxxxx xxxx |
|
|
|
84 dní (xx xxxxx uvést celé xxxxxx xxxxxxx) |
|
Krávy x xxxxxxxxxx |
Xxxxxx xxxxx, xxxxx xxxx xxxxxxx jednou inseminovány/připuštěny |
Od xxxxx xxxxxxxxxx xx xxxxx xxxxxxx xxxxxxx |
|
|
Xxx xxxxx (xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
4. Xxxxxxx. Xxxxxxxxx zvířat: ovce
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (hmotnost/stáří) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx jehňat |
Jehňata xxxxxxx xxx xxxxxxx xxxxxxxxxx |
Od xxxxxxxx |
Xx do 3 xxxxxx |
15–20 kg |
56 xxx |
|
Xxxxx xxxxxx |
Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxx |
Od xxxxxxxx |
Xx xx 6 xxxxxx (xxxx xxxxxx) |
Xx do 55 xx |
Xx xxxxxxx xxxxxxxxx, xxxxxxx však 56 xxx |
|
Ovce xxxxxx x xxxxxxxx xxxxx |
Ovce, xxxxx xxxxxxxx nejméně xxxxx xxxxx |
|
|
|
84 xxx (xx xxxxx xxxxx xxxx xxxxxx laktace) |
|
Xxxxxxx x xxxxxxxxxx |
Xxxxxx xxxx, které byly xxxxxxx jednou xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx xxxxxxxxxx do xxxxx xxxxxxx xxxxxxx |
|
|
Dva xxxxx (xxxxx xx xxxxxxxx xxxxxxxxxxx parametry) |
5. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Přibližná xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx xxxxxx |
Mladé kozy xxxxxxx xxx budoucí xxxxxxxxxx |
Xx narození |
Až do 3 xxxxxx |
15–20 xx |
Xxxxxxx 56 dní |
|
Xxxxx xxxxxx |
Xxxxx xxxx chované xxx xxxxxxxx kozího masa |
Od xxxxxxxx |
Xx xx 6 xxxxxx |
|
Nejméně 56 xxx |
|
Xxxx xxxxxx x xxxxxxxx xxxxx |
Xxxx xxxxxxx x xxxxxx xxxxxxxx |
|
|
|
84 xxx (je xxxxx xxxxx celé xxxxxx xxxxxxx) |
|
Xxxx k reprodukci |
Xxxxxx xxxx, xxxxx byly nejméně xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Od xxxxx xxxxxxxxxx xx konce xxxxxxx xxxxxxx |
|
|
Dva xxxxx (xxxxx se xxxxxxxx xxxxxxxxxxx parametry) |
6. Xxxxxxx. Xxxxxxxxx xxxxxx: ryby
|
Xxxxxxxxx |
Definice xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx trvání (xxxxxxxx/xxxxx) |
Xxxxxxxxx doba xxxxxx xxxxxxxxxxxx xxxxxx účinností |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxx x xxxxxx |
|
|
|
200–300 x |
90 xxx nebo xx xxxx, kdy xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx |
|
Xxxxx x xxxxxx |
Hejno matečných xxx |
Xxxxx xxxxx xx xxxxxxxx xxxx xxxxx |
|
|
90 dní |
7. Xxxxxxx. Xxxxxxxxx xxxxxx: králíci
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx zvířat |
Xxxxxxxxx xxxx xxxxxx (hmotnost/stáří) |
Xxxxxxxxx xxxx xxxxxx dlouhodobých xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx x xxxxxxxxx xxxxxxx |
|
Počínaje xx xxxxxxx xxxxx xx narození |
|
|
56 xxx |
|
Xxxxx xxxxxxx |
Králíci xxxxxxx pro masnou xxxxxxxx |
Xx odstavu |
Xx do 8–11 xxxxx |
|
42 xxx |
|
Xxxxxx xxxxxxx (xxx xxxxxxxxxx) |
Xxxxxxx, xxxxx byly xxxxxxx jednou xxxxxxxxxxxx/xxxxxxxxxx |
Od xxxxxxxxxx xx konce xxxxxxx odstavu |
|
|
Dva xxxxx (xxxxx se požadují xxxxxxxxxxx parametry) |
|
Chovné xxxxxxx xxxxxx k produkci xxxxxxx xxxxxxx |
Xxxxxxx, xxxxx byly xxxxxxx xxxxxx xxxxxxxxxxxx |
Xx xxxxx inseminace |
|
|
Xxxxxxx 2 xxxxx xxxx xxxxxxx xx xxxxx doby xxxxxxx (xxxx. xxx xxxxxxx mikroorganismů) |
8. Xxxxxxx. Xxxxxxxxx zvířat: xxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx zvířat |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxx |
Xxxxxxx xxxxxxxxx |
|
|
|
56 xxx |


