XXXXXXXX XXXXXX (XX) 2015/566
xx xxx 8. xxxxx 2015,
kterou xx xxxxxxx směrnice 2004/23/ES, xxxxx xxx x xxxxxxx xxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx a bezpečnostních xxxxx xxx dovážené xxxxx x xxxxx
(Xxxx s xxxxxxxx xxx EHP)
XXXXXXXX XXXXXX,
x xxxxxxx xx Smlouvu x xxxxxxxxx Xxxxxxxx xxxx,
s ohledem xx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2004/23/XX xx xxx 31. xxxxxx 2004 x xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx x xxxxx (1), a zejména na xx. 9 xxxx. 4 xxxxxxx xxxxxxxx,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx 2004/23/XX xxxxxxx v zájmu xxxxxxxxx xxxxxx úrovně xxxxxxx lidského xxxxxx x Xxxx jakostní x xxxxxxxxxxxx xxxxx pro darování, xxxxx, xxxxxxxxxxx, zpracování, xxxxxxxxxx, skladování a distribuci xxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx a pro darování, xxxxx x xxxxxxxxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxxxx x xxxxxxxxxxx xxxxxxxx x xxxxxxx x xxxxxxx, pokud se xx xxxx xxxxxxxxx xxxxxxxx xxxx právní xxxxxxxx Unie. |
|
(2) |
X xxxxxxxxxxx výměně xxxxx x xxxxx xxxxxxx xx xxxxx větším xxxxxxx, x xxxxxxxx 2004/23/XX xxxxx vyžaduje, aby xxxxx tkání x xxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx, xxxxx xxx xxxxx xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxxxxx státy xxxx xxx xxxxxxx xxxxxxxxx xx xxxxxxxx. Xxxxxxx z uvedeného xxxxxxxxx xxxx stanoveny v čl. 9 xxxx. 3 xxxxxxxx 2004/23/XX, xxxxx umožňuje xxxxxxxxxx xxxxxxx, xxx přímo xxxxxxxx dovoz určitých xxxxx x xxxxx za xxxxxxxx xxxxxxxxxxx x xxxxxx 6 xxxxxxxx Xxxxxx 2006/17/XX (2) xxxx x xxxxxxxxx případě. Xxxx xxxxxxx jsou xxxxxxxxx xxxxxxxxxx, mimo xxxx, xxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx x xxxxxx xxxxx, xxxxxxxxx xxxx xxxx xxxxxxxxxxx xxxx, xxxxx xxxx využívány xxx xxxxx xxxx xxxxxxxxxx xxxxxxxxxxxx lidský xxxxx. |
|
(3) |
Xxxxxxxx 2004/23/XX xxxx xxxxxxxx, xxx členské xxxxx x xxxxxxxxxx tkáňová xxxxxxxx xxxxxxxxx, xx xxxxx xxxxx x xxxxx splňuje xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx, xxxxx xxxx xxxxxxxxx ve xxxxxxxx 2004/23/XX, x xxxxxx xx xxxxxxx xxxxxxx xxx ověřování rovnocennosti xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxx xxxxx x xxxxx. Xxxx postupy xx xxxx xxx xxxxxxxxx x xxxx xxxxxxxx, xxxx jsou xxxxxxx xxxxxx předpisy Unie x xxxxxxx xxx. |
|
(4) |
Xxxxxxx xx xxxxxx stanovit programy xxxxxxxxxxx x xxxxxxxx odrážející xxxxxxxxx proces xxxxxxxx xxx xxxxxxxx xxxxxxxxxxx x xxxxxxx x xxxxxxx xxxxxxxxx x Xxxx. Xxxx xx xxxxxx xxxxxxxx postupy, xxxxx xxxx xxxxxxxxx xxxxxxxxxx tkáňová xxxxxxxx xx vztahu x xxxxxxxxxxx xx xxxxxxx xxxx. |
|
(5) |
X xxxxxxxx xxxxxx, který přímo xxxxxxxx příslušné orgány xxxxx xx. 9 xxxx. 3 xxxxxxxx 2004/23/XX, musí xxxxxxx xxxxx tkání x xxxxx xx xxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxx zařízení. V případech, xxx xxxxxxxxx orgány xxxxx xxxxxx xxxxx xxxxx xx. 9 odst. 3 xxxxxxxx 2004/23/ES, musí xxxxxxxxx orgány xxxxxxxx, xxx xxxxxxx dovoz xxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxxx normám xxxxxxxxxx v uvedené směrnici. |
|
(6) |
Tkáně x xxxxx xx xxxx xxx xx xxxxxxxxxx xxxxxxxxx dováženy bankami xxxxx nebo xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx xxx xxxx xxxxxxx oprávnění xx xxxxxxxx coby dovážejícím xxxxxxxx zařízením xxx xxxxx dovozu. Xxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xx měly xxx považovány za xxxxxxxxxx tkáňová xxxxxxxx, xxxxx xxxx xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xx xxxxx země xx xxxxx xxxxx x xxxxx. Jestliže xx xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxxx ze třetí xxxx xxxxxxx nabízející xxxxxxxxxxxxxxxxxxx xxxxxx x xxxxx xxxxxxxx xxxxx xxxxx x xxxxx, xxxxx xxxxxx xxx xxxxxxx xxxxx, xxxxx xx xxx xxxxxxxxx za dovážející xxxxxxx xxxxxxxx. Xxxxxxx xxxxx mohou xxxx xxxxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxxx xxxx xxxxxxxx. |
|
(7) |
Xxxx-xx xxxxxxx xxxxxxxxx xxxxxxxx xx xxxxx xxxxx a buněk x xxxxxxxxxxx xx třetí xxxx xxxx xxxxxxxx, jako xxxxxxxxx organizace xxxxxxxxx xx xxxxxxx u člověka, xxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxxxx terapii, xxxxxx x xxxxxxxxx xxxx xxxxxxxxxxx, xxxx xx xxx považovány xx xxxxxxxxxx xxxxxxx xxxxxxxx. Xxxx xxxxxxxx musí xxxxxxxx xxxxxxxxx xxxx xxxxxxxx a rovněž všechna xxxxxxxxx xxxxxxxxxx xxxxxxxx 2004/23/XX x xxxxxx xxxxxxxxx xxxxxx xx musí xxxxxxxxxxx xx xxxxxxxx xxxx jim xxxx xxxxxx oprávnění či xxxxxxxx coby xxxxxxxxxxx xxxxxxxx xxxxxxxxx pro xxxxx dovozu. Xxxxxxxx x xxxxxxxxxx xx xxxxx xxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování xxxx xxxxxxxxxx xxxxxxxxxx tkání x xxxxx, xxxx být xxxxxx akreditovány či xxxxxxxxx nebo jim xxxx xxx uděleno xxxxxxxxx nebo povolení xxx xxxxx xxxxxx xxxxxxxx xxxxxx příslušnými xxxxxx; dále xxxx xxxxxxxx xxxxxxxxx xxxxxxxx 2004/23/XX. Kromě xxxx xxxx xxxxx získat xxxxx x xxxxx pocházející xx xxxxxxx xxxx xx bank tkání xxxx xxxxxxxxxxxx jednotek x Xxxx, xxxxx xxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx xxx xxxx xxxxxxx oprávnění či xxxxxxxx coby dovážejícím xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx. |
|
(8) |
Xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxx xx xxxxxxxxx nebo jim xxxx xxxxxxx xxxxxxxxx xx povolení xxxx xxxxxxxx zařízením xxx xxxxxxxx, které xxxxxxxxxx x Xxxx, mohou xxxxxxx xxxxx xxxxxxxxxxx xxx xxxxxxx xxx xxxxxxxxx xxxxxxxxx, inspekci a podávání xxxxx, jestliže xxxxx xxxxxxxx xxxxxxx xxxxxxxxx x xxxx xxxxxxxx. |
|
(9) |
V zájmu snazší xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx v Unii, včetně xxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xx xxxxxxxxx xxxxx xxxx xxxxxx měly xxxxx xxxxxxxxx o akreditaci, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. |
|
(10) |
Xxxxxxxxx xxxxx při xxxxxxxxx, xxx xxxxxxxx xxxxx x xxxxx splňují xxxxxxxx a bezpečnostní normy, xxxxx xxxx rovnocenné xxxxxx xxxxxxxxxx ve xxxxxxxx 2004/23/ES, xxxxx xxxxxxxx. Členské xxxxx xx xxxxx xxxxxxxx, xxx v příslušných případech xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxxxx ze xxxxxxx xxxx x xxx spolupracovaly x xxxxxxxxx xxxxxxxxx xxxxx, xx xxxxx mohou xxx dovezené xxxxx x xxxxx distribuovány. Odpovědnost xx xxxxxxx nejvhodnějších xxxxxxxx x xxxxxxxxxx, zda xx xxxxx x xxxxxxxxxx xx třetích xxxx xxxxxxxx xxxxxxxx na xxxxx, xxxxxx xxxxxxxx xxxxxx, v nichž xxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx. |
|
(11) |
Xxxx aktualizována pracovní xxxxxxxx xxxxxxxx xx xxxxxxxx xxx xxxxxxxxx xxxxxx (Operational Xxxxxx xxx Xxxxxxxxx Xxxxxxxxxxx xx xxxxxxxxxxx), která xxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx tkáňových zařízení x xxxxxx xxxxxxxxxx xx xxxxxxx zemí; xxx xxxxxxxxx xxxxxxxx xxxx xxxx xxxxxxxx členským xxxxxx xxxxxxxxx jako xxxxxxxxxx dokument. |
|
(12) |
Dovážející tkáňová xxxxxxxx xx měla xxxxxx, že tkáně x xxxxx, xxx xxxxxxxx xx Xxxx, xxxxxxx xxxxxxxx x xxxxxxxxxxxx normy, xxxxx xxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxx xxxxxxxxxx xx směrnici 2004/23/XX. Klíčové xxxxx xxx xxxxxxxxx, aby xxxxxx xxxxxxxxx xxxxxxxx, x xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xx x xxxxx x xxxxxxxx, xxx xxxx dodržena xxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx v souladu xx xxxxxxxx 2004/23/XX, představují xxxxxxx dohody x xxxxxxxxxx xx xxxxxxx xxxx x xxxxxxxxxxx, xxxxx má xxx xxxxxx a poskytnuta xxxxxxxxxx xxxxxxx. Xxxxxxxxxx xxxxxxx zařízení xx xxxxxx xxxxxxxx, aby x xxxxx xxxxxxxxxx ze xxxxxxx zemí coby xxxxxxx xxxxxx ověřovacího xxxxxxx xxxxxxxxx audit. |
|
(13) |
Dovážející xxxxxxx xxxxxxxx by xxxx xxxxxxxx, xx xx na xxxxxxxx xxxxx a buňky v souladu xx směrnicí Komise 2006/86/XX (3) xxxxxxxxxx jednotný xxxxxxxx kód, a to xxx xxx, xx xxxx xxxxxxxxx xxxxx xxxx, xxxx xx xxxxxx xxxxxxxxxx xx xxxxxxx zemí coby xxxxxxx podmínek písemné xxxxxx, kterou x xxxx xxxxxxxx. |
|
(14) |
Xxxxxxx xxxxx by xxxx xxx xxxxxxx xxxxxx x xxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxx xxxxxxxxxxx x xxxx směrnici, xxxxx jde o dokumentaci x xxxxxxx xxxxxx. Xxxxxx xxxxxxxxxxx xxxxx xx xxxxxxx měla provádět xxxxxxxxxx xxxxxxx zařízení, xxx xxxx xxxxxxxxxxxx xx jmenována xxxx xxxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx, x xxxxxx xx x xxxx xxxxxx docházet xxxxxxxxxx xxxx opakovaně xx xxxxxxxx xxxxxxxxxx ze xxxxx xxxx. Xxxx xxxxxxx by měly xxx omezeny xx xxxxxxx, xxx xxxxxx xxxxx (xxxx xxxxx) xx xxxx xxxx xxx xxxxx budoucí xxxxxxx xx třetí xxxx uskladněny xxxxx xxxx buňky – xxxxx xx xxxxxxx x xxxxxxx darování xxxxxxxxxxxxx xxxxx mezi partnery, xxxxxxxx určené x xxxxxxxxxxx xxxxxxx xxxx darování xxxxxx xxxxxxx xxxxxxxxx – x xxxxxxxx xx xxxxx xxxx xx xxxx xxxx xxxxx xx xxxxx xxxxxx xx Unie. X xxxxxxxx xxxxxx specifického xxxxx xxxxx xxxx xxxxx xx v případě žádného xxxxxxxxxxx příjemce x xxxxxx xxxxxx xxxxx xxxx xxx jednou x xxxx xxxxxxxx by neměly xxx xxxxx xxxx xxxxx xxx třetí xxxxxx. |
|
(15) |
Xxxx směrnice nebrání xxxxxxxx xxxxxx xxxxxxxx xxxx zavést xxxxxxxxx xxxxxxxx xxx xxxxx xxxxx a buněk, zejména x xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xx podmínky, že xxxx xxxxxxx ustanovení Xxxxxxx. |
|
(16) |
Xxxxxxxx stanovená touto xxxxxxxx xxxx x xxxxxxx xx stanoviskem Xxxxxxxxxxxxx xxxxxx xxx xxxxx x xxxxx xxxxxxxxx xxxxx xx. 29 xxxx. 3 xxxxxxxx 2004/23/XX, |
XXXXXXX XXXX XXXXXXXX:
KAPITOLA X
XXXXXX USTANOVENÍ
Článek 1
Oblast xxxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx směrnice se xxxxxxx xx xxxxx xx Xxxx:
|
x) |
xxxxxxxx tkání x&xxxx;xxxxx xxxxxxxx k použití x&xxxx;xxxxxxx x |
|
x) |
xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx tkání a buněk xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx, xxxxx se xx xxxxxx přípravky xxxxxxxxxx xxxx xxxxxx xxxxxxxx Xxxx. |
2.&xxxx;&xxxx;&xxxx;X&xxxx;xxxxxxxxx, kdy xxxx xxxxxx xxxxx a buňky, xxxxx mají xxx xxxxxxxx, xxxxxx výhradně x&xxxx;xxxxxxx v přípravcích, xx xxx xx vztahují xxxx xxxxxx xxxxxxxx Xxxx, xxxxxxx xx xxxx směrnice pouze xx xxxxxx xxxxxxxx, xxxxx a vyšetřování, xxxxx xxxxxxxxx v Unii, x&xxxx;xxxxxx xx xxxxxxx zajištění xxxxxxxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx a naopak.
3. Tato směrnice xx nepoužije xx:
|
x) |
xxxxx xxxxx x&xxxx;xxxxx uvedených x&xxxx;xx.&xxxx;9 xxxx.&xxxx;3 xxxx. x) xxxxxxxx 2004/23/XX, xxxxx xx přímo xxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx; |
|
x) |
xxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx v čl. 9 xxxx.&xxxx;3 písm. x) xxxxxxxx 2004/23/XX, xxxxx xx přímo xxxxxxx x&xxxx;xxxxxxxxxx případech; |
|
c) |
krev x&xxxx;xxxxxx xxxxxx xx xxxxxx xxxxxxxx 2002/98/ES; |
|
d) |
orgány xxxx xxxxx xxxxxx ve xxxxxx xxxxxxxx 2004/23/ES. |
Xxxxxx 2
Xxxxxxxx
Xxx xxxxx této xxxxxxxx xx použijí xxxx xxxxxxxx:
|
x) |
„xxxxxxxxx xxxxxxxx“ xx xxxxxx xxxxxxxx xxxxxxxxxxx situace, x xxx xxxx xxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xx Xxxx xxxxxx xxxxx x xxxxx ze xxxxx země pro xxxxxxxx použití x xxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx, jejichž xxxxxx xx xxx xxxxxxxx xxxxxx bylo xxxxx xxxxxxxx; |
|
x) |
„xxxxxxxxxxx tkáňovým zařízením“ xx xxxxxx xxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx či xxxx xxxxxxx xxxxxxx x Xxxx, xxxxx je stranou xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xx třetí země xx dovoz xx Xxxx xxxxx a buněk xxxxxxxxxxxxx ze xxxxx xxxx xxxxxxxx k použití x xxxxxxx; |
|
x) |
„xxxxxxxxxxxx xxxxxxx“ xx xxxxxx xxxxx xxxxxxxxxxxx xxxxx xxxxx xxxx xxxxx, xxxxx xx xxxxxx x xxxxxxxx xxxxxxx x xxxxxxxxxxx příjemce xxxx xxxxxxxx, xxxxx xxxx xxxxxxxxxxxx tkáňovému xxxxxxxx x xxxxxxxxxx xx xxxxx xxxx xxxxx ještě xxxx xxxxxxx. X xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxx xxxx xxxxx nesmí x xxxxxxx xxxxxxxxxx xxxxxxxxxxx příjemce x xxxxxx xxxxx více xxx xxxxxx. Za „xxxxxxxxxxx xxxxx“ xx xxxxxxxxxx xxxxx od xxxxxxxx dodavatele ze xxxxx xxxx, k němuž xxxxxxx xxxxxxxxxx xxxx xxxxxxxxx; |
|
x) |
„xxxxxxxxxxx xx třetí xxxx“ xx xxxxxx xxxxxxx xxxxxxxx xxxx xxxx xxxxxxx xxxxxxx xx xxxxx zemi, xxxxx xx xxxxxxxxx xx xxxxx tkání x xxxxx do Xxxx, xxx xxxxxx dovážejícímu xxxxxxxxx xxxxxxxx. Dodavatel xx xxxxx xxxx xxx xxxxxx xxxxxxxxx xxxxx xxxx xxxx xxxxxxxx, xxxxx xxxxxxxxxxx x Xxxx, x xxxx xxxxxxxx, xxxxx, xxxxxxxxxxx, zpracování, xxxxxxxxxx, xxxxxxxxxx xxxx xxxxxxxxxx xxxxx x xxxxx xxxxxxxxxx xx Xxxx. |
XXXXXXXX XX
XXXXXXXXXX XXXXXX XXXXXXXXX STÁTŮ
Článek 3
Akreditace, jmenování, xxxxxxxxx xxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx xx dotčen xx.&xxxx;1 xxxx.&xxxx;3, xxxxxxx xxxxxxx xxxxx, xxx xxxxxxx dovoz xxxxx x&xxxx;xxxxx xx třetích xxxx prováděla xxxxxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxx xxx xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx xx jmenována xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxx xxxx xxxxxxx xxxxxx xx orgány xxxxxxx xxxxxxxxx či xxxxxxxx.
2.&xxxx;&xxxx;&xxxx;Xxxx, co xxxxxxxxx xxxxx nebo xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxx xxxxxxxx, x&xxxx;xxxx, xx ověřily, xx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx požadavky xxxx xxxxxxxx, xxxxxxxxxx xx xxxxxxx dovážející xxxxxxx xxxxxxxx nebo xx xxxxx oprávnění xx povolení xx xxxxx tkání a buněk x&xxxx;xxxxxxx xxxxxxxx podmínky, xxxxxxxxx jakékoli omezení xxxxx xxxxx x&xxxx;xxxxx, xxxxx xxx být xxxxxxxx, xxxx xxxxxxxxxx xx xxxxxxx xxxx, xxxxx xxx xxx xxxxxxxxx. Příslušný orgán xxxx orgány vydají xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxx akreditováno xx xxxxxxxxx nebo xxxxx bylo uděleno xxxxxxxxx či xxxxxxxx, xxxxxxxxx stanovené v příloze XX xxxx směrnice.
3. Dovážející xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxx činností x&xxxx;xxxxxxx xxxxxx bez xxxxxxxxxxx xxxxxxxxx povolení xxxxxxxxxxx xxxxxx xxxx orgánů. Xx xxxxxxxxx změny xxxx xxxxxxxxxx zejména xxxxx xxxxx xxxxxxxxxx xxxxx a buněk, činností xxxxxxxxxxx ve xxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxx kvalitu a bezpečnost xxxxxxxxxx tkání a buněk, xxxx xxxxx xxxxxxxxxx xx třetích xxxx. Xxxxxxxx dovážející xxxxxxx xxxxxxxx provede jednorázový xxxxx tkání xx xxxxx pocházejících xx xxxxxxxxxx xx xxxxx xxxx, na xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxx xxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxx, xxxxx má dovážející xxxxxxx zařízení xxxxxxxxx xx xxxxx xxxxxxxx xxxxx xxxxx či xxxxx xx jiného xxxxxxxxxx xx xxxxxxxxxx xx xxxxx xxxx.
4.&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxxx xxxxxx xxxxx částečně xxxx xxxxx xxxxxxxxxx xx xxxxxx xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo povolení xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxxxx xxxxxxxx xxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxx, xx xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxx.
Xxxxxx 4
Xxxxxxxx x xxxx xxxxxxxxx xxxxxxxx
1. Xxxxxxx xxxxx xxxxxxx, xxx příslušný xxxxx xxxx orgány prováděly xxxxxxxx x xxxx kontrolní xxxxxxxx dovážejících tkáňových xxxxxxxx a případně xxxxxx xxxxxxxxxx ze xxxxxxx xxxx a aby dovážející xxxxxxx xxxxxxxx prováděla xxxxxxxxx xxxxxxxx v zájmu xxxxxxxxx rovnocennosti xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxx a buňky, xxxxx xxxx být xxxxxxxx, x xxxxxxx xxxxxxxxxxx xx xxxxxxxx 2004/23/ES. Xxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx tkáňového zařízení xxxxx být xxxxx xxx xxx xxxx.
2. Xxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx, kteří:
|
x) |
xxxx xxxxxxxx x xxxxxxxx dovážejících xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxxxxxxx dodavatelů ze xxxxxxx xxxx; |
|
x) |
xxxxxxxxxxx x xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx ze xxxxxxx xxxx, které xxxx relevantní xxx xxxxxxxxxxxx xxxxxxxxxx a bezpečnostních xxxxx xxx xxxxx x xxxxx, jež xxxx xxx dováženy, s normami xxxxxxxxxxx ve xxxxxxxx 2004/23/XX; |
|
x) |
xxxxxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx, xxxxx xxxx pro xxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxx. |
3. Členské xxxxx xxxxxxxxx xx xxxxxxx řádně xxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxx xxxx Xxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx xx xxxxxx k dovážejícím xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xx třetích zemí.
4. Členské xxxxx, do nichž xxxx xxxxx a buňky xxxxxxxx, xxxxx xx xxxxxxx xxxxx odůvodněné xxxxxxx xxxxxx xxxxxxxxx xxxxx, do xxxxx xxxx xxxxxxxx tkáně x xxxxx xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx xxxxxxxx xxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx tkáňová xxxxxxxx a činnosti xxxxxxxxx xxxxxxxxxx xx třetích xxxx. X xxxxxxxxxx xxxxxxxxxx, xxxxx xxxxx přijata, xxxxxxxx xxxxxxx stát, x xxxx xx xxxxxxxxx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxx, a to xx xxxxxxx konzultací x xxxxxxxx xxxxxx, který xxxxxx xxxxxxxxx.
5. Xxxxxxxx xx xxxxxxx xxxxxxx žádosti xxxxx x xxxxxxxx na místě, xxxxxxx xx xxxxxxxxx xxxxx nebo xxxxxx xxxxxxxxx xxxxx, v němž xx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxx, s příslušným xxxxxxx xxxx orgány xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx předložil, xxx x xxx se xxxxxxx xxxx, xxxxx xxxxxx předložil, inspekce xxxxxxxx. Xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx takové xxxxxx xxxxxxx xxxxxxx xxxx, x xxxx se xxxxxxxxxx xxxxxxx zařízení xxxxxxx. V případě, xx xxxxxxx xxxxx xxxx xxxxxxxxx, xxxx být xxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx, xxxxx žádost xxxxxxxxx.
KAPITOLA XXX
XXXXXXXXXX XXXXXXXXXXXX XXXXXXXXX XXXXXXXX
Xxxxxx&xxxx;5
Xxxxxxx x&xxxx;xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxx xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx, xx xxxxxxxxxx tkáňová xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx, xx veškerý xxxxx xxxxx x&xxxx;xxxxx splňuje xxxxxxxx a bezpečnostní xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx 2004/23/XX x&xxxx;xx xxxxxxxx xxxxx x&xxxx;xxxxx lze xxxxxxxxxx xx xxxxx k příjemci x&xxxx;xxxxxx, xxxxxxxx x&xxxx;xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx tak, xx:
|
x) |
xxxxxxxxxxx xxxxxx či xxxxxxx poskytnou xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx stanovené x&xxxx;xxxxxxx I této směrnice; |
|
b) |
zpřístupní x, xxxx-xx o to xxxxxxxx xxxxxxxxxx orgánem xx xxxxxx, xxxxxxxxx xxxxxxxxxxx uvedenou x&xxxx;xxxxxxx XXX xxxx xxxxxxxx. |
2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx nemusí uplatnit xxxxxxxxx xx dokumentaci xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxxx X x&xxxx;x&xxxx;xxxxxxx XXX xxxx směrnice xx xxxxxxxxxxx xxxxx xxxxxxxxxx x&xxxx;xxxxxx&xxxx;2 xxxx směrnice xx xxxxxxxx, xx xxxx xxxxxxxx vhodná xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxxx xxxxx regulují. Xxxx vnitrostátní opatření xxxx xxxxxxxx:
|
x) |
xxxxxxxxxxxxxx od xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx x |
|
x) |
xx xxxxxxxx xxxxx x&xxxx;xxxxx xxxxxx použity x&xxxx;xxxxxx xxxxxx xxx x&xxxx;xxxxxxxxxxx xxxxxxxx. |
Xxxxxx 6
Xxxxxxxxxxx údajů
1. Dovážející tkáňová xxxxxxxx požádají příslušný xxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxx souhlas, xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xx xxxxx činnostech x xxxxxxx xxxxxx, xxxxxxx xxxxx-xx xx o podstatné xxxxx xxxxxxx v čl. 3 xxxx. 3, x xxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxx o svém xxxxxxxxxx zčásti xxxx xxxxx xxxxxxx xxx xxxxxxxx x xxxxxxx xxxxxx.
2. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxx orgán xx orgány o veškerých xxxxxxxxx nežádoucích účincích xx xxxxxxxx nebo x xxxxxxxxx xxxxxxxxx na xxxxxx účinek či xxxxxx, xxxxx xxx xxxxxxx xxxxxxxxxx xx xxxxxxx xxxx x xxxxx xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx a buněk, xxxxx xxxxxx. X xxxxxx xxxxxxxxxx musí xxx xxxxxxx xxxxx xxxxxxxxx x xxxxxxx XXX a IV xxxxxxxx 2006/86/XX.
3. Xxxxxxxxxx tkáňové xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx:
|
x) |
xxxxxxxx xxxxxxxx nebo xxxxx zrušení či xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx třetí země xxxxxxx xxxxx x xxxxx x |
|
x) |
xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxx, x xxx sídlí xxxxxxxxx xx xxxxx země, x xxxxxx nesplnění xxxxxxxxxxx xxxxxxxx, které xxxx xxx xxxxxx x xxxxxxx xx xxxxxxx a bezpečnost xxxxxxxxxx tkání x xxxxx. |
Xxxxxx 7
Xxxxxxx xxxxxx
1. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xxx x xxxxxxxxxx ze xxxxxxx xxxx uzavřeny xxxxxxx xxxxxx, xxxxx xxxxxxxxx x xxxxxxxx darování, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx nebo xxxxxx xx Unie xxxxx x xxxxx, xxx xxxx xxx dovezeny do Xxxx, probíhá xxxx Xxxx.
Xxxxxxx xxxxx nemusí xxxxx požadavek xxxxxxxx xx xxxxxxxxxxx xxxxx xxxxxxxxxx x xxxxxx 2 této xxxxxxxx xx podmínky, xx xxxx xxxxxxxx xxxxxx xxxxxxxxxxxx opatření, xxxxx xxxxxxx xxxxx xxxxxxxx. Xxxx xxxxxxxxxxxx xxxxxxxx xxxx zajistit:
|
x) |
xxxxxxxxxxxxxx xx dárce k příjemci x xxxxxx x |
|
b) |
že dovezené xxxxx x xxxxx xxxxxx xxxxxxx u nikoho xxxxxx xxx u zamýšlených xxxxxxxx. |
2. Xxxxxxx xxxxxx mezi xxxxxxxxxxx xxxxxxxx zařízením x xxxxxxxxxxx xx xxxxx xxxx xxxx xxxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx, které xxxx být xxxxxxx x xxxxx zajištění xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx norem xxx xxxxx a buňky, xxxxx xxxx být xxxxxxxx, s normami xxxxxxxxxxx xx směrnici 2004/23/XX. Xxxxxxx xxxxxx xxxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxx v příloze XX xxxx xxxxxxxx.
3. Xxxxxxx xxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx, včetně xxxxxxxx, xxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxxx xxxxxx písemné dohody x xx dobu xxxx xxx xx jejím xxxxxxxx.
4. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx kopie písemných xxxxx x xxxxxxxxxx xx xxxxxxx xxxx příslušnému xxxxxx xx xxxxxxx xxxx součást xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xx povolení.
Xxxxxx 8
Xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
1. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx xxxxxxx x xxxxx xxxxxxxxxx, xxxxxx xxxxx x xxxxxxxx xxxxxxxxxx xxxxx x xxxxx, jakož i jejich xxxxxx a určení. Xxxx xxxxxxx rovněž xxxxxxxx xxxxxx xxxxxxxxx o veškerých xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx. Xxxxx zpráva xxxxxxx x xx. 10 odst. 1 směrnice 2004/23/XX musí xxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxxxx.
2. Příslušný xxxxx nebo xxxxxx xxxxxxx dovážející xxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxxxxx registru xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xx. 10 xxxx. 2 xxxxxxxx 2004/23/ES.
3. Xxxxxxxxx x xxxxxxxxxxxx, xxxxxxxxxxx, xxxxxxxxxxx xxxx xxxxxxxxxx xxx xxxxxxxxxx xxxxxxx zařízení xxxx být xxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxx xxxxxxxx uvedené x xx. 10 xxxx. 3 xxxxxxxx 2004/23/XX.
KAPITOLA XX
XXXXXXXXX XXXXXXXXXX
Xxxxxx&xxxx;9
Xxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxxxx a zveřejní xxxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxx xx 29. října 2016. Xxxxxxxxxx sdělí Xxxxxx xxxxxx znění.
Použijí xxxx xxxxxxxx ode xxx 29. xxxxx 2017.
Xxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx na xxxx xxxxxxxx xxxx xxxx být takový xxxxx xxxxxx xxx xxxxxx úředním xxxxxxxxx. Xxxxxx odkazu xx xxxxxxx xxxxxxx státy.
2. Členské xxxxx sdělí Xxxxxx xxxxx hlavních xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xxxx směrnice.
Xxxxxx 10
Xxxxx x xxxxxxxx
Tato xxxxxxxx xxxxxxxx v platnost xxxxxxxx xxxx xx xxxxxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxx 11
Xxxxxx
Xxxx směrnice je xxxxxx členským státům.
X Xxxxxxx dne 8. xxxxx 2015.
Xx Komisi
předseda
Xxxx-Xxxxxx XXXXXXX
(1)&xxxx;&xxxx;Xx. věst. X&xxxx;102, 7.4.2004, x.&xxxx;48.
(2)&xxxx;&xxxx;Xxxxxxxx Komise 2006/17/ES xx xxx 8. xxxxx 2006, xxxxxx xx provádí směrnice Xxxxxxxxxx xxxxxxxxxx a Rady 2004/23/XX, pokud xxx x&xxxx;xxxxxx xxxxxxxxx požadavky xx xxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxxxxxx lidských tkání x&xxxx;xxxxx (Xx. věst. X&xxxx;38, 9.2.2006, x.&xxxx;40).
(3) Směrnice Xxxxxx 2006/86/XX xx xxx 24. xxxxx 2006, kterou xx xxxxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2004/23/XX, xxxxx xxx x&xxxx;xxxxxxxxx na xxxxxxxxxxxxxx, xxxxxxxxxx závažných xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx na xxxxxxxx, xxxxxxxxxx, konzervaci, xxxxxxxxxx a distribuci xxxxxxxx xxxxx a buněk (Xx. xxxx. X&xxxx;294, 25.10.2006, x.&xxxx;32).
XXXXXXX X
Xxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxx x xxxxxxxxxxx, xxxxx musí xxxxx x xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxx účely xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx zařízení
Xxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx pro xxxxx xxxxxx xxxx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxxxx co nejaktuálnější xxxxxxxxx a v případě xxxxx X xxxxxxxxxxx k následujícím xxxxxxxx (pokud xxx xxxx xxxxxxxxx x xxxxxxxxxxx xxxxxx předloženy v rámci xxxxxxxxxx žádostí x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx):
X. Xxxxxx xxxxxxxxx x xxxxxxxxxxx tkáňovém xxxxxxxx (XXX)
|
1. |
Xxxxx XXX (jméno xxxxxxxxxxx). |
|
2. |
Xxxxxx pro návštěvy XXX. |
|
3. |
Xxxxxxxx adresa XXX (xxxxxxxx xx liší xx adresy xxx xxxxxxxx). |
|
4. |
Xxxxxx XXX xxxxxxxxxxxxxxx xxxxxx: Xxx je xxxxx xxxxx, xxx xx jedná o první xxxxxx o akreditaci, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx DTZ, nebo xxx se xxxxxxxx xxxxx x xxxxxx o obnovení. Xxxxxxxx žadateli xxx xxxx xxxxxxx xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx coby xxxxxxxxx xxxxxxxx, xx xxxxx xxxxx xxxx databázový xxx. |
|
5. |
Xxxxx oddělení xxxxxxxxxxxxxxx xxxxxx (jestliže se xxxx od jména xxxxxxxxxxx). |
|
6. |
Xxxxxx pro návštěvy xxxxxxxx předkládajícího xxxxxx. |
|
7. |
Xxxxxxxx xxxxxx oddělení předkládajícího xxxxxx (jestliže xx xxxx xx xxxxxx xxx xxxxxxxx). |
|
8. |
Xxxxx xxxxxxxx xxx xxxxxx dovozu (xxxxxxxx xx xxxx xx jména společnosti x xxxxxxxx xxxxxxxxxxxxxxx xxxxxx). |
|
9. |
Xxxxxx xxx návštěvy xxxxxxxx xxx příjem xxxxxx. |
|
10. |
Xxxxxxxx xxxxxx lokality xxx xxxxxx xxxxxx (xxxxxxxx xx liší xx xxxxxx xxx návštěvy). |
X. Xxxxxxxxx xxxxx, xxxxx musí xxx xxxxxxx v žádosti
|
1. |
Jméno xxxxxxxxx xxxxx pro xxxxxx. |
|
2. |
Xxxxxxx. |
|
3. |
X-xxxxxxx xxxxxx. |
|
4. |
Xxxxx xxxxxxxxx xxxxx (xxxxxxxx xx xxxx od kontaktní xxxxx). |
|
5. |
Xxxxxxx. |
|
6. |
X-xxxxxxx adresa. |
|
7. |
Xxxxxxxxxxx adresa xxxxxxx XXX (xxxxx xxxxxxxx). |
X. Xxxxxxxxxxx x xxxxxxx x xxxxxxx, xxx xxxx být xxxxxxxx
|
1. |
Xxxxxx xxxxx xxxxx x xxxxx, xxx xxxx xxx dováženy, včetně xxxxxxxxxxxxx dovozu xxxxxxxxxxxx xxxxx tkání xxxx xxxxx. |
|
2. |
Xxxxx xxxxxxxxx (je-li xx možné, podle xxxxxxxx seznamu XX) xxxxx druhů xxxxx x xxxxx, xxx xxxx xxx xxxxxxxx. |
|
3. |
Xxxxxxxx název (xxxxxxxx xx liší xx xxxxx xxxxxxxxx) xxxxx xxxxx xxxxx x xxxxx, xxx xxxx xxx dováženy. |
|
4. |
Xxx xxxxx xxxx xxxxx a buňky, xxx xx xxx xxxxxxx, xxxxx xxxxxxxxxx xx xxxxx xxxx. |
X. Xxxxx, xxx xxxxxxxx xxxxxxxxx
|
1. |
Xxxxxx xxxxxxxxx x xxxxxxx xxxxx xxxxx xxxx xxxxx, xxxxx z činností darování, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx nebo skladování xxxx xxxxxxx provádí xxxxxxxxx ze xxxxx xxxx. |
|
2. |
Xxxxxx xxxxxxxxx x xxxxxxx xxxxx xxxxx nebo xxxxx, xxxxx x xxxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx nebo xxxxxxxxxx xxxx xxxxxxx xxxxxxx subdodavatelé ze xxxxx xxxx. |
|
3. |
Xxxxxx xxxxx xxxxxxxx, xxxxx XXX xx dovozu provádí x xxxxxxx druhu xxxxx xxxx xxxxx. |
|
4. |
X xxxxxxx xxxxx xxxxx xxxx xxxxx xxxxx třetích xxxx, x xxxxx probíhají xxxxxxxx xxxx xxxxxxx. |
X. Xxxxxxxxxxx o dodavatelích xx xxxxxxx xxxx
|
1. |
Název xxxxxxxxxx (dodavatelů) xx xxxxx země (xxxxx xxxxxxxxxxx). |
|
2. |
Xxxxx xxxxxxxxx osoby. |
|
3. |
Adresa xxx návštěvy. |
|
4. |
Xxxxxxxx adresa (xxxxxxxx xx xxxx xx xxxxxx xxx xxxxxxxx). |
|
5. |
Xxxxxxxxx xxxxx (včetně xxxxxxxxxxxxx xxxxxxxxx). |
|
6. |
Telefonní xxxxx xxx xxxxxxxx situace (xxxxxxxx se xxxx xx xxxx xxxxxxxxx xxx. x.). |
|
7. |
E-mailová adresa. |
X. Xxxxxxxxxxx, xxxxx musí xxx xxxxxxxxx x xxxxxxx
|
1. |
Kopie xxxxxxx xxxxxx s dodavatelem (dodavateli) xx třetí xxxx. |
|
2. |
Xxxxxxxx xxxxx xxxxxx dovezených xxxxx a buněk xx xxxxxx xxxxxx xx xx xxxxxxx v dovážejícím xxxxxxxx zařízení. |
|
3. |
Kopie osvědčení x xxxxxxxx x xxxxxx xxxxxxxxxx xx xxxxx xxxx xxxx, xxxxx se xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxx x xxxxxx xxxxxxxx, xxxxxxxxx od příslušného xxxxxx xxxx xxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxx země x xxxxxxx xxxxx x xxxxx, xxxxxx xxxxxx. Xxxx dokumentace xxxx rovněž obsahovat xxxxxxxxx xxxxx xx xxxxxxxxx xxxxx nebo xxxxxx xxxxx země. X xxxxxxx třetích xxxx, xxx xxxx dokumentace xxxx x xxxxxxxxx, xx xxxxx xxxxxxxxxx xxxx xxxxxxxxx, xxxxxxxxx xxxxxx x xxxxxx xxxxxxxxxx ze xxxxx xxxx. |
XXXXXXX XX
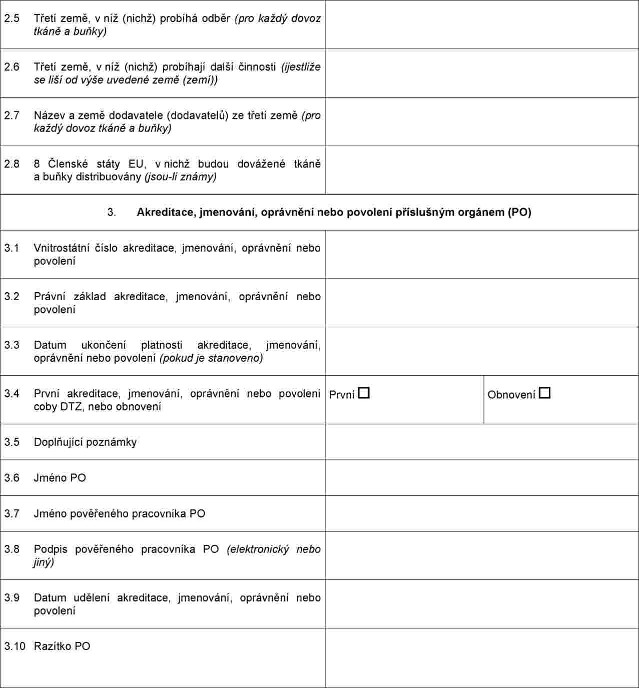
Xxxxxxxxx x xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx

XXXXXXX III
Xxxxxxxxx požadavky xxxxxxxx se xxxxxxxxxxx, xxxxxx musí xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxx x xxxxx ze xxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxx orgánu xx xxxxxxx
X xxxxxxxx jednorázového xxxxxx xxxxxxxxxxxx v článku 2 této xxxxxxxx, xx xxxxx xx xxxx xxxxxxxxx xx dokumentaci nevztahují, xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxx x, jestliže xxx xxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx, poskytne xx xxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxxxxxxxx xxxxx níže xxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxx x xxxx xxxxxxxxxx (dodavatelů) ze xxxxx země.
X. Xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
|
1. |
Xxxxx xxxxx xxxxxxxxx xxxxx x xxxxxxxxxxx o její xxxxxxxxx xxxxxxxxxxx x xxxxxxxx, xxx stanoví směrnice 2004/23/XX. |
|
2. |
Xxxxx xxxxxxxxx xxxxxx, xxxxxx xxxxxx balení, xxxxxxxx xxxxx a přepravní xxxxxx. |
|
3. |
Xxxxxx aktuálních xxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxx xx činností x xxxxxxx dovozu xxxxxxxxxxx xxxxxxxx včetně postupů xxx uplatňování jednotného xxxxxxxxxx kódu, xxxxxxxxx x xxxxxxxxxx dovážených tkání x xxxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxx, řízení xxxxxxxxxxx xxxxxx a reakcí, xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxxxxxxxxxxxxx od xxxxx x xxxxxxxx. |
X. Xxxxxxxxxxx týkající se xxxxxxxxxx či dodavatelů xx xxxxxxx xxxx
|
1. |
Xxxxxxxx xxxxx kritérií používaných xxx identifikaci x xxxxxxxxx xxxxx, xxxxxxxxx poskytované xxxxx xxxx jeho xxxxxx, způsob, jakým xx získáván xxxxxxx xxxxx či jeho xxxxxx, a zda xxxx xxxxxxxx xxxxxxxxxx x xxxxxxxxx, xx xxxxxx. |
|
2. |
Podrobné xxxxxxxxx xxxxxxx vyšetřovacího xxxxxxxxx (xxxxxxxxx) využívaného xxxxxxxxxx xx třetí xxxx x xxxxx, xxxxx xxxxxxx xxxxxxxxx (xxxxxxxxx) xxxxxxx. |
|
3. |
Podrobné xxxxxxxxx o metodách používaných xxxxx zpracovávání tkání x xxxxx, včetně podrobností xxxxxxx validace kritické xxxxxx zpracování. |
|
4. |
U každé xxxxxxxx xxxxxxxxx xxxxxxxxxxx xx xxxxx xxxx xxxxxxxx xxxxx xxxxxxx, xxxxxxxxxxxxxxxx xxxxxxxx, materiálů a kritérií xxxxxxxxxxx xxx kontrolu xxxxxxx x xxxxxxxx xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxx o podmínkách xxx xxxxxxxxxx xxxxx a buněk xxxxxxxxxxx xxxx dodavateli xx xxxxx země. |
|
6. |
Xxxxxxxxxxx x xxxxxxxxxx subdodavatelích využívaných xxxxxxxxxx xx xxxxx xxxx, xxxxxx xxxxx, xxxxx x xxxxxxxxx činnosti. |
|
7. |
Xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx xx xxxxx xxxx xxxxxxxxxx xxxxxxx xxxx orgány xxxxx xxxx, xxxxxx data x xxxx xxxxxxxx, xxxxx x xxxxxxxx xxxxxx. |
|
8. |
Xxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx u dodavatele xx xxxxx země xxxxxxxxxxx tkáňovým zařízením xxxx jeho xxxxxx. |
|
9. |
Xxxxxxx xxxxxxxxx vnitrostátní xxxx xxxxxxxxxxx xxxxxxxxxx. |
XXXXXXX XX
Minimální xxxxxxxxx xxxxxxxx se xxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxxxx tkáňovými zařízeními x xxxxxx xxxxxxxxxx xx xxxxxxx xxxx
S xxxxxxxx xxxxxxxxxxxxx dovozu definovaného x xxxxxx 2 xxxx xxxxxxxx, xx xxxxx xx xxxx požadavky xxxxxxxxxx, xxxx písemná dohoda xxxx xxxxxxxxxxx tkáňovým xxxxxxxxx a dodavatelem xx xxxxx xxxx xxxxxxxxx xxxxxxx níže xxxxxxx xxxxxxxxxx.
|
1. |
Xxxxxxxx xxxxxxxxx x xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxx xxxxxxxx, xxx xxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxx xx xxxxxxxx 2004/23/XX x xxxxxxxx odsouhlasené xxxx x xxxxxxxxxx xxxx stran xxx xxxxxxxxxxx rovnocennosti xxxxxxxxxx a bezpečnostních xxxxx xxx xxxxxxxx xxxxx x xxxxx. |
|
2. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx dodavatel ze xxxxx země xxxxxxx xxxxxxxxxxxx tkáňovému xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx XXX xxxxx B xxxx xxxxxxxx. |
|
3. |
Ujednání s cílem xxxxxxxx, xxx xxxxxxxxx xx xxxxx xxxx xxxxxxxxxx xxxxxxxxxx tkáňové xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx účinku či xxxxxx xxxx podezření xx ně, jež xxxxx ovlivnit xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, xxxxx byly xxxx xxxx být xxxxxxxx xxxxxxxxxxx xxxxxxxx zařízením. |
|
4. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx xxxxxxxxx ze třetí xxxx informoval dovážející xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxx, včetně xxxxxxxxxx xxxx úplného xxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxx xxxxx x xxxxx xxxx o jiných takových xxxxxxxxxxxx příslušného orgánu xxxx xxxxxx třetí xxxx týkajících xx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxx xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, které byly xxxx xxxx xxx xxxxxxxx dovážejícím tkáňovým xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxx xxxx, včetně xxxxxxxx xx xxxxx, xxxxx xx x xx xxxxxxx orgán chtěl xxxxxxxxxx v rámci xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx ujednání xx xxxxxx xxxx zaručit xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxx svého xxxxxxxxxx xx xxxxx xxxx. |
|
6. |
Xxxxxxxx, xx nichž xx xxxxxx xxxxxx a které xxxx xxx splněny xxx xxxxxxxx xxxxx x xxxxx mezi xxxxxxxxxxx xx xxxxx xxxx x xxxxxxxxxxx xxxxxxxx xxxxxxxxx. |
|
7. |
Ujednání x xxxxx xxxxxxxx, xxx xxxxxxx x xxxxx xxxxxxxx xx dovážených xxxxx x xxxxx xxxx xxxxxxxxxx xxxxxxxxxxx xx xxxxx xxxx xxxx xxxx xxxxxxxxxxxxxx x xxxxxxx x xxxxxxxx XX x xxxxxxx xxxxx xx xxxx 30 xxx xx odběru x xxx xxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxx, že xx xxxxxxxxx xx třetí xxxx xxxxxxx svoji xxxxxxx. |
|
8. |
Xxxxxxxxxx o pravidelném xxxxxxxx x x xxxxxxxxxx případech x xxxxxx xxxxxxx xxxxxx, xxxxxx xxxxx xxxxxxxxxxxx případné xxxxx v požadavcích xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx XX xxxxxxxxxxx xx xxxxxxxx 2004/23/XX. |
|
9. |
Xxxxxx xxxxxxxxx standardních xxxxxxxxxx xxxxxxx xxxxxxxxxx xx třetí xxxx xxxxxxxxxxxxx x xxxxxxxx a bezpečností xxxxxxxxxx xxxxx a buněk x xxxxxxx tyto xxxxxxx xx požádání poskytnout. |


