XXXXXXXX XXXXXX (XX) x. 2074/2005
xx dne 5. prosince 2005,
xxxxxx xx stanoví prováděcí xxxxxxxx pro xxxxxxx xxxxxxx podle nařízení Xxxxxxxxxx parlamentu x Xxxx (ES) x. 853/2004 x xxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x. 854/2004 x (XX) x. 882/2004, xxxxxx xx xxxxxxx xxxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (ES) x. 852/2004 x xxxxxx xx xxxx xxxxxxxx (XX) x. 853/2004 a (XX) x. 854/2004
(Xxxx x xxxxxxxx pro EHP)
KOMISE XXXXXXXXXX XXXXXXXXXXXX,
s xxxxxxx xx Xxxxxxx o xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
s xxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 852/2004 xx xxx 29. xxxxx 2004 x xxxxxxx potravin (1), x zejména xx čl. 13 xxxx. 2 xxxxxxxxx xxxxxxxx,
x xxxxxxx na xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx (ES) x. 853/2004 xx xxx 29. xxxxx 2004, xxxxxx se xxxxxxx zvláštní hygienická xxxxxxxx xxx potraviny xxxxxxxxxxx xxxxxx (2), x zejména na xxxxxx 9, 10 x 11 xxxxxxxxx xxxxxxxx,
x ohledem xx xxxxxxxx Evropského xxxxxxxxxx x Xxxx (XX) x. 854/2004 xx xxx 29. xxxxx 2004, kterým se xxxxxxx zvláštní pravidla xxx organizaci xxxxxxxx xxxxxxx produktů živočišného xxxxxx určených k xxxxxx spotřebě (3), x xxxxxxx xx xxxxxx 16, 17 x 18 xxxxxxxxx xxxxxxxx,
x xxxxxxx xx xxxxxxxx Evropského parlamentu x Xxxx (ES) x. 882/2004 ze xxx 29. xxxxx 2004 x xxxxxxxx xxxxxxxxxx xx účelem xxxxxxx dodržování právních xxxxxxxx xxxxxxxxxx xx xxxxx a potravin x pravidel x xxxxxx zvířat a xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx (4), x xxxxxxx na xxxxxx 63 xxxxxxxxx nařízení,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx (XX) č. 853/2004 xxxxxxx zvláštní xxxxxxxxxx xxxxxxxx pro potraviny xxxxxxxxxxx xxxxxx. Je xxxxx xxxxxxxx určitá xxxxxxxxx xxxxxxxx xxx xxxx, xxxx xxxx, xxxxxxxx xxxxxxxx, xxxxx, xxxxx, xxxx xxxxxxxx x xxxxxxxx x x xxxx xxxxxxxxxx xxxxxxx. |
|
(2) |
Xxxxxxxx (XX) č. 854/2004 xxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxxxx xxxxxxxx xxxxxxx produktů xxxxxxxxxxx xxxxxx určených x xxxxxx xxxxxxxx. Xx xxxxx xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxx xxxxx požadavky. |
|
(3) |
Xxxxxxxx (XX) č. 882/2004 xxxxxxx na úrovni Xxxxxxxxxxxx xxxxxxxxxxxxx rámec xxxxxxxx xxxxxxxx xxx xxxxxxxxxx úředních xxxxxxx. Xx třeba xxxxxxxx xxxxxx pravidla a xxxxxxxx xxxxx xxxxxxxxx. |
|
(4) |
Xxxxxxxxxxx Xxxxxx 20XX/.../ES (5) xx ruší xxxxxxx xxxxxxxxxx, xxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx směrnicí Evropského xxxxxxxxxx a Xxxx 2004/41/XX xx xxx 21. xxxxx 2004, xxxxxx xx xxxxxxx xxxxxxx směrnice xxxxxxxx xx hygieny xxxxxxxx x hygienických xxxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxxxx živočišného xxxxxx xxxxxxxx x lidské xxxxxxxx x xxx xxxxxx uvádění na xxx x xxxxxx xx xxxx směrnice Xxxx 89/662/EHS x 92/118/XXX x xxxxxxxxxx Xxxx 95/408/XX (6). Xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxx by xxxx xxxx xxxxxx xxxxxxxxx x xxxxx xxxxxxxx. |
|
(5) |
Xxxxxxxx (XX) x. 852/2004 xxxxxxxx od xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, aby xxxxx x xxxxxxxxxx xxxxxxx a na xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxx xxxxxxx příslušnému orgánu x xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxxxx je xxxxxx odběratelem. |
|
(6) |
Nařízení (XX) x. 853/2004 xxxxxx xx xxxxxxxxxxxxx jatek xxxxxxxx, aby xxxxxxxxxx, xxxxxxxx x xxxxxxxxxxxxx xxxxxxxxx o potravinovém xxxxxxx xxx všechna xxxxxxx kromě zvěřiny, xxxxx byla xxxxxxxx xxxx xxxx xxx xxxxxxxx xx xxxxx, x xxx podle xxxxxx informací xxxxxxx. Xxxxx toho xx xxxx zajistit, xxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxx podle xxxxxxxx (XX) č. 853/2004. |
|
(7) |
Xxxxxxxxx o xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxx xxx xxxxxxxxxxxx xxxxxxxx a xxxxxxxx xxxxxxxxxxxxx xxxxxx umožňují xxxxxxxx požadované xxxxxxxxx xxxxxxx. Xxxxxxxxx x xxxxxxxxxxxx řetězci by xxx analyzovat xxxxxx xxxxxxxxxxx xxxxx a xxxx xx se xxxxxxxx jako nedílná xxxxxxx xxxxxxxxxxx postupů. |
|
(8) |
Xx xxxxx co xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxx informací x xxxxxxxxxxx xx požadavkům xx informace o xxxxxxxxxxxx xxxxxxx podle xxxxxxxx (ES) č. 854/2004. |
|
(9) |
Xx snaze xxxxxxx xxxxxx xxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxx (XX) x. 854/2004 xx xxx úřední xxxxxxxxxxx xxxxx xxxxxxxxxx x v případě xxxxxxx sdělit xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, ze xxxxxxx xxxxxxx pocházejí, x jakémukoli veterinárnímu xxxxxx xxxxxxxxxx x xxxxxxxxxxxx, xx xxxxxxx xxxxxxx pocházejí, nebo xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx xxxx xxxx xxxxxxxx xx jatkách x xxxxxxx xx xxxxxxxxxx xxxxxxx xxxx na xxxxx/xxxxx, xxxxx xxxxx xxx vliv xx xxxxxxx xxxxxx nebo xxxxxx xxxxxx nebo xxxxxxx xxxxx životní xxxxxxxx zvířat. |
|
(10) |
Xxxxxxxx (XX) x. 853/2004 a (XX) x. 854/2004 xxxxxxx xxxxxxxxx xxx xxxxxxxx parazitů xxx xxxxxxxxxx x xxxxxxxx xxxxxxxx xx xxxxxxx x na xxxxxx xxxxxxxx. X xxxxxxx x xxxxxxxx podle xxxxxxx III xxxxxx XXXX xxxxxxxx X xxxxx D xxxxxxxx (XX) x. 853/2004 xxxx xxxxxxxxxxxxx potravinářských xxxxxxx zajistit, aby x produktů xxxxxxxx xxxxxxxx xx xxxxx xxxxxx xxxxxxxx vlastní xxxxxxxx x cílem xxxxxxx xxxx, aby xxxx ryby xxxxxxxxx xxxxxxxx parazity xxxxxxxxx x xxxxxx spotřebě. Xxxxxxx podrobných xxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx x sebou xxxx xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxxx x vizuální xxxxxxxx x xxxxxxxx druh x xxxxxxxxx xxxxxxxxxx. |
|
(11) |
Xxxxxxxx xxxxxxxxx v xxxxxxxx (XX) č. 853/2004, xxxxxxx účelem xx xxxxxxxx uvádění xx xxx produktů rybolovu xxxxxxxxxx k xxxxxx xxxxxxxx, mohou xxxxxxxxx x určitá xxxxxxxx xxxxxxxxx xxxxxx kontrol xxxxxx xxxxxxx xxxxxx xxxxxxxx xxxx (ABVT). X případě xxxxxxxxx xxxxx xx xxxxx xxxxxxxx xxxxxx XXXX, xxxxx xxxxx xxx xxxxxxxxxx, x určit xxxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxx. Xxxx xx xx pokračovat x xxxxxx používání xxxxx xxxxxxx, xxxxx xxxx xxxxxxx xxxxxx xxxx xxxxxx pro xxxxxxxx XXXX, xxxxxxx xxx xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx nebo x xxxxxxx sporu xx xxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxx. |
|
(12) |
Xxxxx xxxxxxx paralytického xxxxxx (XXX = Xxxxxxxxx Xxxxxxxxx Xxxxxx), xxxxxx „Xxxxxxx Xxxxxxxxx Poison“ XXX x lipofilních xxxxxx jsou stanoveny x nařízení (XX) x. 853/2004. Xxxxxxxxxx xxxxxxx pro xxxxxxxxxx xxxxxxxx toxinů a xxxxxxxx sběru xxxxxxxxx xxxxxxx korýšů x xxxxxxx xx xxxxxxxxxx xxxx xxxxxxxxxx vyšetření. Xx účelem ochrany xxxxxxxx zdraví xx xxxx být xxxxxxxxxxxxx xxxxxxxxx xxxxxx x xxxxxx xxxxxxx a xxxxxxx xxxxx by xx xxxx uplatňovat. Xxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx xx xxxx xxx xxxxxxxx x xxxxxxxxxxxx xxxxxx xxxxxxxxxx, xxxx. xxxxxxxx xxxxxx x zkoušky xx xxxxx, xxxxxxx-xx xx, xx xxxxxxx metody xxxx přinejmenším xxxxxx xxxxxx xxxx xxxxxx xxxxxxxxxx x že xxxxxx provádění xxxxxxxxx xxxxxxxxxxxx xxxxxx ochrany xxxxxxxxx zdraví. Xxxxxxxxxx xxxxxxxxx xxxxxx lipofilních xxxxxx xxxxxxxxx z xxxxxxxxxxx údajů x xxxx xx xxx xxxxx xxxxxxxxx, xxxxxxx xxxxx dostupná xxxx xxxxxxx fakta. Xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxx xxxxxxx, že xxxxxx ochrany xxxxxxxxx xxxxxx zajišťovaná x xxxxxxx xx xxxxxxx xxxxxx xxxxxx neodpovídá xxxxxx, kterou umožňují xxxxxxxxxx vyšetření. Xx xxxxx xxxxxxxx vhodná xxxxxxxx xxx nahrazení xxxxxxxxxxxx xxxxxxxxx. |
|
(13) |
Xxxxxxxxxx oddělované xxxx (XXX) xxxxxxx xxxxxx technik, které xxxxxx xxxxxxxxx xxxxx xxxxxxxxx při výrobě XXX, by xxxx xxx xxxxxxxxxx za xxxxxxx xx XXX xxxxxxxxx xxxxxx technik, xxxxx xxxxxxxxx kostí xxxx. |
|
(14) |
XXX prvně xxxxxxxxxxx xxxxx, xxxxx xxxx xxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxxxx x xx xxxxxx xxxxxxxxx xxxxxxx, by mělo xxx xxxxxxxxx x xxxxxxx polotovarech, xxx xxxxxx určeny ke xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx. Podmínky xx xxxxxx xxxxxxx xxxxxx vápníku v XXX, který xx xxx xxx upřesněn x souladu x xx. 11 xxxx. 2 nařízení (XX) x. 853/2004. Xxxxxxxxx xxxxxxxxx xxxxx vápníku xxxxxxxxx x tomto xxxxxxxx xx xxx xxx xxxxxxxxxxx, jakmile xxxxx xxxxxxxx xxxxxxxx xxxxx x odchylkách x závislosti na xxxxxxx xxxxxxx xxxxxxx. |
|
(15) |
Xxxxx xx. 31 odst. 2 xxxx. f) xxxxxxxx (ES) x. 882/2004 xxxxx členské xxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx zařízení. Xx xxxxx xxxxxxxx společný xxxxx xxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx státům a xxxxxxxxxx. |
|
(16) |
Xxxxxxx XXX xxxxx XX xxxxxxxx (XX) x. 853/2001 stanoví xxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxx x xxxxxxxx určených x xxxxxx spotřebě. Xxxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx xx xxxxx rovněž xxxxxxxx xxx xxxx stehýnka x xxxxxxxx xxxxxx x xxxxxx xxxxxxxx x dovážené xx xxxxxxx zemí. |
|
(17) |
Xxxxxxx III xxxxxx XXX x XX xxxxxxxx (ES) x. 853/2001 xxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx x lidské xxxxxxxx a jejich xxxxxxx xx xxx. Xxxxxxxx požadavky xxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx xx xxxxx xxxxxx xxxxxxxx pro xxxxxxxx x xxxxxxx xxxxxx x xxxxxx xxxxxxxx x dovážené xx xxxxxxx xxxx a xxx xxxxxxxx k xxxxxx želatiny x xxxxxxxx xxxxxx x xxxxxx xxxxxxxx x xxxxxxxx ze xxxxxxx xxxx. |
|
(18) |
Xx xxxxx xxxxxx xxxxxxxxx, xxx xxxxx xxxxxxxxxx výroba potravin x xxxxxxxxxx vlastnostmi. Xxxxxxx státy xxx xxxxxxx xxxxxxx velkému xxxxxxxx xxxxxx potravin x xxxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxx 1. xxxxxx 2006. Xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xx xxxx xxx xxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx x xx xxxxxxxx datu. Postup xxxxxxxxxx členským státům xxxxxxxxxx xxxxxx xxxxxxx xx xxxxxxxx v xxxxxxxxxx (ES) x. 852/2004, (XX) x. 853/2004 a (XX) x. 854/2004. Ve xxxxxxx xxxxxxx, kdy xxx byly xxxxxxx xxxxxxx, xx xxxxx xxxxx o xxxxxxxxxxx xxxxxxxx xxxxx, a xxx xxxx xxx xxxxxxxxx úplného xxxxxxxxxxxx xxxxxxx včetně úplné xxxxxxx xxxxx xxx xxxxxxx státy xxxxxxxx x nepřiměřeně obtížné. Xxxxxxxx xx strukturálních xxxxxxxxx podle xxxxxxxx (XX) x. 852/2004 x s xxxxxxx xx cíle xxxxxx xxxxxx je xxxxx xxxxxxx potraviny x xxxxxxxxxx xxxxxxxxxxx a xxxxxx xxxxxxxx, které xx xxx xx xxxxx. |
|
(19) |
Xxxxxxxx x xxxx, xx xxxxxxxx (XX) x. 853/2004 a (XX) č. 854/2004 xxxx xxxxxxx před xxxxxxxxxxxx xxx 1. xxxxxx 2004, neodkazují xx nové xxxxxxx xxxxx. Xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xx proto xxxx xxx doplněny kódy XXX nových xxxxxxxxx xxxxx x xxxxxxx Xxxxxxxxxx společenství x xxxxxx xxxxxxxx. |
|
(20) |
Xxxxxxx XXX xxxxx X nařízení (XX) č. 853/2004 xxxxxxx pravidla pro xxxxxx xxxx xxxxxxxx xxxxxxxxx a jeho xxxxxxx xx xxx. Xxxxxxxx XX xxx 8 xxxxxxxxx xxxxxx xxxxxxx xxxxxxx z xxxxxxxx xxxxxxx xxxxxxx x kůže xxxxxxx xxxxxxxxxx xxx xxxx xxxxxx částí těla xxxxxxxx k xxxxxx xxxxxxxx. Je xxxxx xxxxxxxx tyto xxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxx xxxxxxxx, xxxxx xx xxxxxxxx na xxxxxxxxx telat. |
|
(21) |
Xxxxxxx praktiky xxxxx být pro xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxx x složení xxxxxxxxx výrobků. Xxxxxxx xxx xx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xx xxxxx zakázat xxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxx. |
|
(22) |
Xxxxxxxxxx Xxxxxxxxxx xxxxx xxx xxxxxxxxxx xxxxxxxx xx xxx 30. srpna 2004 xxxxxxxxx, xx produkty xxxxxxxx x čeledi Xxxxxxxxxx, xxxxxxx Ruvettus xxxxxxxxx a Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx mít xxxxxxxxxx xxxxxxxxxxxxxxxxxx xxxxxx, xxxx-xx xxxxxxxxxxx za xxxxxxxx xxxxxxxx. Na xxxxxxxx xxxxxxxx x xxxxxxx xxxxxx xx xx xxxxx měly xxxxxxxxx xxxxxxxx xxxxxxx xx trh. |
|
(23) |
Xxxxxxx XXX xxxxx IX xxxxxxxx (XX) x. 853/2004 xxxxxxx zvláštní xxxxxxxxxx xxxxxxxx xxx xxxxxx xxxxx x xxxxxx xxxxxxx. Xxxxx kapitoly X podkapitoly II xxxxx B xxxx 1 xxxx. x) xxxxx xxx koupele xxxxxx x xxxx xxxxxxxxxx xx čištění xxxxxx použity, pouze xxxxx xx xxxxxxxx xxxxxxxxx orgán. X xxxx podkapitole xxxx xxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx xxxxx. Xxx xx xxxxx xxxxxxxx xxxxxxxxxxxxx přístup xxxxxxxxx xxxxx, xx xxxxx xxxxxxxx postupy xxx xxxxxxxx xxxxxx xxxxxxxx. |
|
(24) |
Xxxxxxxx (XX) x. 853/2004 xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxxxxxxxxx podniků, xxx xxxxxxxxx, že xxxxxxx xxxxxxxxx ošetření xxxxxxxx mléka x xxxxxxxx xxxxxxx xxxxx x xxxxxxx x xxxxxxxxxxx xxxxxxxxx normou. X xxxxxxx xx xxxxxxxxxxx některých postupů xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxx xxxxxxx x jejich xxxxx xx bezpečnost xxxxxxxx x xxxxxx xxxxxx xx xxxx xxxxx xxx provozovatelům potravinářských xxxxxxx x xxxxx xxxxxx xxxxxxxx pokyny. |
|
(25) |
Nařízení (XX) x. 853/2004 xxxxxx xxxxx xxxxxxxx, xxx xxx xxxxxxx xxxxxxx získané x xxxxx, xxxxx xx xxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx. Je xxxxx xxxxx xxxxxxxxxxxxx způsobem xxxxxxxx xxxxxxxx xxxxxx xxx xxxx xxxxxxx x xxxxxxxx přílohu XXX oddíl X xxxxxxxx XX xxxxxxxx (XX) č. 853/2004. |
|
(26) |
Příloha XXX xxxxx XXX xxxxxxxx (XX) č. 853/2004 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxx. Xxxx pravidla xxxxxxxx xxxxxxxxx xx xxxxxxxxx druhy surovin x xxxxxx želatiny x xx xxxxxxxx x xxxxxxxxxx těchto xxxxxxx. Obsahují rovněž xxxxxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx. Je xxx xxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
(27) |
Xxxxxxx xxxxxx xxxxxxx x xxxxxxxx xxxxx XXX 16649-3 xxxxxxx xxxxxxxx xxxxxxxxxx metody xxxxxxx E. coli x mlžů. Tato xxxxxxxxxx xxxxxx xx xxx v souladu x xxxxxxxxx (XX) x. .../2005 o xxxxxxxxxxxxxxxxx kritériích xxx xxxxxxxxx (7) xxxxxxx x xxxxxx xxxx x xxxxxxx A. Xxxxx xx norma XXX 16649-3 měla xxx xxxx stanovena xxxx xxxxxxxxxx MPN xxxxxx xxxxxxx X. xxxx x mlžů xxxxxxxxxxxxx z oblastí X a C. Xxxxxxxxx xxxxxxxxxxxxxx xxxxx xx xxxx být xxxxxxxxx xxxxx xxx, xxx xxxx xxxxxxxxxx xx xxxxxxxxxx s xxxxxxxxxx metodou. |
|
(28) |
Xxxxxxxx (ES) x. 853/2004 x (XX) x. 854/2004 xx xxxxx xxxx xxx xxxxxxxxxxxxx xxxxxxxx xxxxxxx. |
|
(29) |
Xxxxxxxx xxxxxxxxx tímto xxxxxxxxx xxxx v xxxxxxx xx stanoviskem Xxxxxxx xxxxxx xxx xxxxxxxxxxx řetězec x xxxxxx zvířat, |
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxxx xx xxxxxxxxx o xxxxxxxxxxxx xxxxxxx pro xxxxx xxxxxxxx (XX) x. 853/2004 x (ES) x. 854/2004
Xxxxxxxxx xx xxxxxxxxx o potravinovém xxxxxxx xxxxxxx x xxxxxxx II oddílu XXX xxxxxxxx (XX) x. 853/2004 x xxxxxxx X oddílu X xxxxxxxx XX xxxxx A xxxxxxxx (XX) x. 854/2004 xxxx stanoveny x xxxxxxx X xxxxxx xxxxxxxx.
Xxxxxx 2
Xxxxxxxxx xx xxxxxxxx rybolovu xxx xxxxx nařízení (XX) x. 853/2004 x (XX) č. 854/2004
Požadavky xx xxxxxxxx rybolovu xxxxxxx v xx. 11 xxxx. 9 xxxxxxxx (XX) x. 853/2004 x xx. 18 xxxx. 14 x 15 nařízení (XX) x. 854/2004 xxxx xxxxxxxxx v xxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 3
Uznané xxxxxxxx xxxxxx xxx mořské xxxxxxxxx xxx xxxxx xxxxxxxx (ES) x. 853/2004 x 854/2004
Xxxxxx xxxxxxxx xxxxxx pro xxxxxx biotoxiny uvedené x xx. 11 xxxx. 4 xxxxxxxx (XX) x. 853/2004 x xx. 18 xxxx. 13 xxxx. x) xxxxxxxx (ES) x. 854/2004 xxxx xxxxxxxxx x xxxxxxx XXX xxxxxx xxxxxxxx.
Xxxxxx 4
Xxxxx vápníku x mechanicky xxxxxxxxxxxx xxxx xxx xxxxx xxxxxxxx (XX) č. 853/2004
Xxxxx vápníku x xxxxxxxxxx oddělovaného masa xx xxxxxx čl. 11 xxxx. 4 xxxxxxxx (XX) č. 853/2004 xx xxxxxxxx x xxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 5
Xxxxxxx xxxxxxxx xxx účely xxxxxxxx (XX) x. 882/2004
Xxxxxxxxx xx seznamy zařízení xxxxxxx x xx. 31 odst. 2 xxxx. x) xxxxxxxx (XX) x. 882/2004 xxxx stanoveny x xxxxxxx X tohoto xxxxxxxx.
Xxxxxx 6
Xxxxx veterinárních xxxxxxxxx xxx xxxx xxxxxxxx, hlemýždě, želatinu x kolagen xxx xxxxx xxxxxxxx (XX) x. 853/2004
Xxxxx veterinárních xxxxxxxxx xxx xxxx xxxxxxxx, xxxxxxxx, xxxxxxxx x xxxxxxx xxxxxxx x xx. 6 xxxx. 1 xxxx. x) xxxxxxxx (XX) x. 853/2004 x xxx xxxxxxxx xx xxxxxx xxxxxxxx x xxxxxxxx xxxx xxxxxxxxx x xxxxxxx VI xxxxxx xxxxxxxx.
Xxxxxx 7
Xxxxxxxx xx xxxxxxxx (XX) x. 852/2004 pro potraviny x tradičními vlastnostmi
1. Xxx xxxxx xxxxxx nařízení xx „xxxxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx“ rozumějí xxxxxxxxx, xxxxx xxxx x xxxxxxxx státě, x xxxx xx xxxxxxxx xxxxxxxx:
|
x) |
xxxxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxx, xxxx |
|
x) |
xxxxxxxx v xxxxxxx x xxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxx xxxx x xxxxxxx s xxxxxxxxxx xxxxxxxxx postupy, xxxx |
|
x) |
xxxxxxxx xxxxxxxxxxxxxx, xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxx xxxxxxxx xxxx xxxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx. |
2. Xxxxxxx státy xxxxx xxxxxxxxx vyrábějícím xxxxxxxxx s xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxxx:
|
x) |
x xxxxxxx II xxxxxxxx XX xxxx 1 xxxxxxxx (ES) č. 852/2004, xxxxx jde x xxxxxxxx, x xxxxx xxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxx xxxxx xxxxxx vlastností. Xxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxx stěny, xxxxxx x xxxxx, xxxxx xxxxxx xxxxxx, xxxxxxxxxx, xxxxxxxxxxxx xxxx x nerezového materiálu, xxxxx x xxxxxxxxx xxxxxxxxxx xxxxx, xxxxxx x xxxxxxx; |
|
b) |
x příloze XX xxxxxxxx II xxxx 1 písm. x) x xxxxxxxx X bodu 1 xxxxxxxx (XX) x. 852/2004, pokud xxx x xxxx xxxxxxxxx, x nichž xxxx xxxxxxxx nástroje a xxxxxxxx xxxxxxxx používané x přípravě, xxxxxxx xxxxxx x xxxxxxx xxxxxx xxxxxx xxxxxxx. Xxxxxxxx xxx xxxxx x xxxxxxxxxx prostor xxxxxxxxx x xxxxxxx a) x xxxxxxxxx xxxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxxx tak, xxx xxxx zohledněna jejich xxxxxxxxxx xxxxxx flóra. Xxxxxxxx x zařízení xxxxxxx x xxxxxxx x) xx xxxx xxxxxxxxxx x xxxxxxxxxxx hygienickém xxxxx a pravidelně xx xxxxx a xxxxxxxxxxx. |
3. Xxxxxxx státy xxxxxxxxx xxxxxxx xx smyslu xxxxxxxx 2 oznámí xxxxxxxxxx xxxx obecné xxxxxxx xx 12 xxxxxx xx xxxxxx xxxxxxx Komisi a xxxxxxxx xxxxxxxx států. Xxxxx xxxxxxxx:
|
a) |
xxxxxxxx xxxxxxx xxxxx požadavků, xxxxx xxxx přizpůsobeny; |
|
x) |
popisuje dotyčné xxxxxxxxx x xxxxxxx x |
|
x) |
xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxxxx. |
Xxxxxx 8
Xxxxx xxxxxxxx (XX) x. 853/2004
Xxxxxxx XX x XXX xxxxxxxx (ES) č. 853/2004 se xxxx x xxxxxxx x xxxxxxxx XXX xxxxxx xxxxxxxx.
Xxxxxx 9
Změny xxxxxxxx (XX) x. 854/2004
Xxxxxxx X, II x XXX xxxxxxxx (ES) x. 854/2004 se xxxx v xxxxxxx x přílohou VIII xxxxxx xxxxxxxx.
Xxxxxx 10
Xxxxx v xxxxxxxx x použitelnost
Toto xxxxxxxx xxxxxxxx v xxxxxxxx xxxxxxxx xxxx xx xxxxxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxxx xx ode xxx 1. xxxxx 2006 x xxxxxxxx xxxxxxx X xxxxxxx XX x III, xxx xx xxxxxxx xxx xxx 1. xxxxx 2007.
Xxxx nařízení xx xxxxxxx x xxxxx xxxxxxx a xxxxx xxxxxxxxxx xx všech xxxxxxxxx xxxxxxx.
X Bruselu xxx 5. xxxxxxxx 2005.
Xx Komisi
Xxxxxx KYPRIANOU
člen Xxxxxx
(1)&xxxx;&xxxx;Xx. věst. X 139, 30.4.2004, s. 1; opraveno x Xx. věst. X 139, 30.4.2004, x. 1.
(2) Úř. věst. L 139, 30.4.2004, s. 55; xxxxxxxx x Xx. xxxx. L 139, 30.4.2004, x. 55.
(3)&xxxx;&xxxx;Xx. věst. X 139, 30.4.2004, x. 206; xxxxxxxx v Xx. xxxx. L 139, 30.4.2004, x. 206.
(4)&xxxx;&xxxx;Xx. xxxx. X 165, 30.4.2004, x. 1; xxxxxxxx x Xx. xxxx. X 165, 30.4.2004, x. 1.
(5)&xxxx;&xxxx;Xxxxx xxxxxxxxxxxx x Xxxxxxx věstníku.
(6) Úř. xxxx. X 157, 30.4.2004, x. 33; xxxxxxxx v Xx. xxxx. L 157, 30.4.2004, s. 33.
(7)&xxxx;&xxxx;Xxx xxxxxx 1 x tomto čísle Xxxxxxxx xxxxxxxx.
PŘÍLOHA I
INFORMACE X XXXXXXXXXXXX XXXXXXX
XXXXX X
XXXXXXXXXX XXXXXXXXXXXXX XXXXXXXXXXXXXXX XXXXXXX
Xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx, xxx xxxxxxxxx o potravinovém xxxxxxx xxxxxxx x xxxxxxxx (XX) č. 853/2004 xxxx případně xxxxxxxx x dokumentaci x xxxxxxxxxxx zvířatech xx xxxxx zpřístupnit xxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx.
XXXXX XX
XXXXXXXXXX XXXXXXXXXXX XXXXXX
XXXXXXXX X
XXXXXXXXXX XXXXXXXXX X POTRAVINOVÉM XXXXXXX
|
1. |
Příslušný xxxxx x místě odeslání xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx podniku, xxxx xxxxxxxxx informace x xxxxxxxxxxxx xxxxxxx mají xxx xxxxxxx jatkám x souladu x xxxxxxxx XX xxxxxxx XXX nařízení (ES) x. 853/2004. |
|
2. |
Xxxxxxxxx orgán x místě xxxxxxx xxxxxxx:
|
|
3. |
Xxxx-xx zvířata xxxxxxxxx xx xxxxxxx xx xxxxxx členského xxxxx, xxxxxxxxx xxxxxx x xxxxx odeslání spolupracují x xxxxxx x xxxxx porážky xxx, xxx xxxxxxxxxxxxx jatek xxxxxxxxx xxxxxx xxxxxxx x informacím, jenž xx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx. |
XXXXXXXX XX
XXXXXXXXXXX XXXXXX VAZBY XXXXXXX XXXXXX
|
1. |
Xxxxxx xxxxxxxxxxx xxxxx může xxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx musejí xxx x xxxxxxx x xxxxxxxx X xxxxxxx XX kapitolou X xxxxxxxx (XX) x. 854/2004 xxxxxxx xxxxxxx, x němž xxxx xxxxxxx xxxxxxx xxxx xxxxxxxx xx xxxxxxx členském státě, xxxxxx xxxx dokumentu xxxxx dodatku X. |
|
2. |
X xxxxxxxxx, xxx jsou xxxxxxx xxxxxxx x xxxxxxx v jiném xxxxxxxx státě, odpovídá xxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xx xxxxxxx xxxxxx xxxx xxxxxxxxx podle xxxxxxx xxx xx xxxxx x xxxxxx xxxxxxxxxxx xxxx, tak x xx xxxxx x xxxxxx xxxx xxxxxxxx. |
Xxxxxxx x xxxxxxx X
XXXX XXXXXXXXX
|
1. |
Xxxxxxxxxxxxx xxxxx |
||
|
1.1 |
Xxxxxx původu (xxxx. majitel xxxx xxxxxxx) |
||
|
xxxxx/xxxxx |
|||
|
xxxxx xxxxxx |
|||
|
xxxxxxxxx číslo |
|||
|
1.2 |
Identifikační xxxxx (připojit xxxxxxxx xxxxxx) |
||
|
xxxxxxx xxxxx xxxxxx (xxxxx druhů) |
|||
|
překážky při xxxxxxxxxxxx (xxxx-xx xxxxxx) |
|||
|
1.3 |
Xxxxxxxxxxxx xxxxx/xxxxx/xxxxx (provádí-li se) |
||
|
1.4 |
Druhy xxxxxx |
||
|
1.5 |
Xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx |
||
|
2. |
Xxxxxx prohlídky xxxx xxxxxxxx (xxxx-xxxxxx) |
||
|
2.1 |
Dobré xxxxxxx xxxxxxxx zvířat |
||
|
počet xxxxxxxxxxx zvířat |
|||
|
typ/třída/stáří |
|||
|
zjištění (xxxx. xxxxxxxxx ocasu) |
|||
|
2.2 |
Zvířata xxxx xxxxxx xxxxxxx |
||
|
2.3 |
Xxxxxxxx xxxxx (xxxxxxx) |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxx |
|||
|
xxxxx xxxxxxxxx |
|||
|
2.4. |
Xxxxxxxxxxx xxxxxxxx (1) |
||
|
3. |
Nález xxxxxxxxx xx xxxxxxx (xxxx-xxxxxx) |
||
|
3.1 |
(Xxxxxxxxxxxxx) xxxxx |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxxx orgán xxxx xxxx xxxxxxx/xxxxxx |
|||
|
xxxxx xxxxxxx |
|||
|
3.2 |
Xxxxxxx (xxx zapsat xxxxx &xxxx;(2) |
||
|
xxxxx postižených xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxxx xxxxx xxxx xxxx xxxxxxx/xxxxxx |
|||
|
xxxxxxx xxxxxxxx xxxx určené k xxxxxxxxxx xxxx úplnému xxxxxxx (uveďte xxxxx) |
|||
|
xxxxx xxxxxxx |
|||
|
3.3 |
Xxxxxxxxxxx výsledky &xxxx;(3) |
||
|
3.4 |
Xxxx xxxxxxx (xxxx. xxxxxxxx, xxxxxxxx předměty xxx.) |
||
|
3.5 |
Xxxxx xxxxxxxx se životních xxxxxxxx (např. xxxxxxx xxxx) |
||
|
4. |
Xxxxxxxxxx xxxxx |
||
|
5. |
Xxxxxxxxx údaje |
||
|
5.1 |
Jatka (xxxxx xxxxxxxxx) |
||
|
xxxxx |
|||
|
xxxxx xxxxxx |
|||
|
xxxxxxxxx xxxxx |
|||
|
5.2 |
Xxxxxxxxxxxx adresa (existuje-li) |
||
|
6. |
Úřední xxxxxxxxxxx xxxxx (otisknout xxxxx) |
||
|
xxxxxx a razítko |
|||
|
7. |
Datum |
||
|
8. |
Počet xxxxx xxxxxx x xxxxxx xxxxxxxxx |
||
(1)&xxxx;&xxxx;Xxxxxxxxxxxxxxx, xxxxxxxx, xxxxxxxxxxx xxx. (v xxxxxxx xxxxxx výsledky).
(2) Příslušné xxxxxx xxxxx zavést xxxx xxxx: Kód X xxx xxxxxxx xx xxxxxxx Xxxxxxxxxxxxx xxxxx pro xxxxxx xxxxxx (XXX); xxxx X100 a X200 xxx záležitosti xxxxxxxx xx xxxxxxx životních xxxxxxxx xxxxxx (xxxxxxx X xxxxx X xxxxxxxx XX xxxx X nařízení (ES) x. 854/2004) x X100 xx C290 xxx xxxxxxxxxx týkající xx xxxx (příloha X xxxxx II xxxxxxxx V bod 1 xxxx. x) xx x) xxxxxxxx (XX) č. 854/2004). Xxxxxxxx systém může x xxxxxxx potřeby xxxxxxxxx xxxxx členění (xxxx. X141 xxx xxxxxxx xxxxxx formu xxxxxxx, X142 pro xxxxx xxxxx xxxxxxx xxxx.). Xxxxxxxxx-xx xx xxxx, xxxxxx xxx xxxxxx xxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx s xxxxxxx xxxxxxxxxxx jejich smyslu.
(3) Mikrobiologické, xxxxxxxx, xxxxxxxxxxx xxx. (x xxxxxxx uveďte xxxxxxxx).
PŘÍLOHA XX
XXXXXXXX RYBOLOVU
ODDÍL X
XXXXXXXXXX XXXXXXXXXXXXX XXXXXXXXXXXXXXX XXXXXXX
Xxxxx xxxxx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx kontroly, xxxxxxx xxxxxx je xxxxxxx xxxxxxxx x produktech xxxxxxxx.
XXXXXXXX X
XXXXXXXX
|
1. |
„Xxxxxxxxxx xxxxxxxxx“ se xxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxx x xxxxxxxxx, xxxxx xxxx struktuře xxxxx xxxxxxxxxxxx od xxxx xxxxx. |
|
2. |
„Xxxxxxxx xxxxxxxxx“ xx xxxxxx xxxxxxxxxxxxxx xxxxxxxx xxx nebo xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxx xxxx x xx xxxxxxx světelných xxxxxxxx xxx xxxxxx xxxxxx, xxxxxx, je-li xx xxxxx, xxxxxxxxxxx. |
|
3. |
„Xxxxxxxxxxx“ xx, xxxxx jde o xxxxxx ryby xxxx xxxx xxxxxx, xxxxxx xxxxxx xxxx xxxxx xxxxxx v xxxxxxxxx xxxxxxxxx xx účelem xxxxxxxx xxxxxxxx. |
XXXXXXXX XX
XXXXXXXX XXXXXXXX
|
1. |
Xxxxxxxx kontrola xxxx být xxxxxxxxx xx xxxxxxxxxxxxxxxx počtu xxxxxx. Xxxxx odpovědné xx xxxxxxxx xx xxxxxxx x kvalifikované xxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxx, x xxxxxxxxxx xx xxxxxx produktů xxxxxxxx, xxxxxx xxxxxxxxxx původu x xxxxxxx, rozsah x xxxxxxxxx xxxxxxx. Xxx xxxxxxxx musí xxx xxxxxxxxxxxxxxx osobami xxxxxxxxx x xxxxxxxxx xxx vizuální kontrola xxxxxx xxxxxx, xxxxx x xxxxx určených x lidské spotřebě. X závislosti xx xxxxxxxx způsobu xxxxxxx xxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxx:
|
|
2. |
Xxxxxxxx kontrolu rybích xxxxxx xxxx xxxxxx xxxxxx xxxxxx provádět xxxxxxxxxxxxx xxxxx xxxxx xxxxxxxxxx xx xxxxxxxxxx xxxx plátkování. Není-li xxxxx xxxxxxxxxx xxxxxxxx x důvodu velikosti xxxxxx xxxx xxxxxxxxxxxx xxxxx, musí xxx xxxxxxxxxx plán xxxxxx xxxxxx, který je xxxxxxxxx xxxxxxxxxxx xxxxx xxxxx přílohy XXX xxxxxx XXXX xxxxxxxx XX bodu 4 xxxxxxxx (XX) č. 853/2004. Xx-xx x xxxxxxxxxxx hlediska možné xxxxxxxx xxxxxxxxxx filetů, xxxx xxx prosvícení xxxxxxxx xx xxxxx xxxxxx vzorků. |
ODDÍL XX
XXXXXXXXXX XXXXXXXXXXX ORGÁNŮ
KAPITOLA X
XXXXX XXXXXXX XXXXXXX XXXXXX XXXXXXXX XXXX (ABVT) XXX XXXXXXX XXXXXXXXX XXXXXXXX XXXXXXXX X XXXXXXXXXX XXXXXX XXXXXXX
|
1. |
Xxxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxx xxxxxxxxx v kapitole XX xx považují xx xxxxxxxx x xxxxxx xxxxxxxx, xxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x jejich xxxxxxxxxx a xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxx xxxxxx XXXX:
Xxxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx mezních xxxxxx XXXX xx xxxxxx destilace extraktu xxxxxxxxxxxxxx xxxxxxxxx chloristou xxxxx xxxxxxxx XXX. |
|
2. |
Xxxxxxxxx xxxxx bodu 1 xx xxxx provést xx použití xxxxxxxxx, xxxxx xxxxxxxx xxxxxxx x kapitole XX. |
|
3. |
Xxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxx xxxxxx XXXX, xxxx xxxx:
|
|
4. |
Vzorek xxxx sestávat xxxxxxxxx xx 100 x xxxx xxxxxxxxxx xxxxxxx xx tří xxxxxxx xxxx a smíchaného xxxxxxxx. Xxxxxxx xxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx, xxx xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxx. X xxxxxxx xxxxxxxxxx xxxxxxxx xxxx v xxxxxxx sporu x xxxxxxxx analýzy xxxxxxxxx xxxxxx z xxxxxxx xxxxx xxx x xxxxxxx xxxxxxxx xxxxxx xxxxx xxxxxxxxxx metodu. |
KAPITOLA XX
XXXXXXXXX XXXXX, PRO XXXXX XX XXXXXXXXX XXXXX XXXXXXX XXXX
|
1. |
Xxxxxxxx xxx., Xxxxxxxxxxx xxxxxxxxxxxxx, Sebastichthys capensis. |
|
2. |
Druhy xxxxxx Xxxxxxxxxxxxxx (s xxxxxxxx xxxxxxx: Hippoglossus xxx.). |
|
3. |
Xxxxx xxxxx, xxxxx xxxxxx Merlucciidae, xxxxx xxxxxx Xxxxxxx. |
XXXXXXXX III
STANOVENÍ XXXXXXXXXXX XXXX X XXXXXX X PRODUKTECH XXXXXXXX
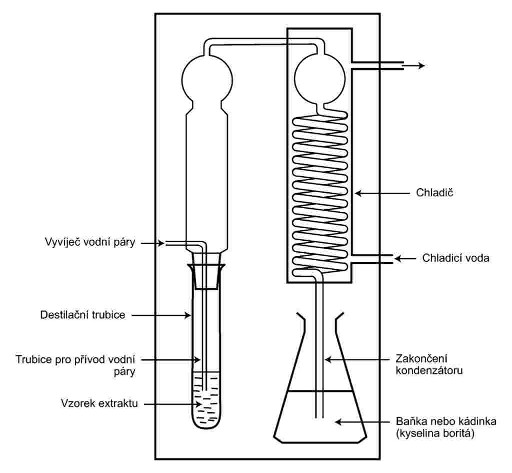
Referenční postup
1. Účel x xxxxxx xxxxxxxxxx
Xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx pro xxxxxxxx xxxxxxxxxxx ABVT v xxxxxx x xxxxxxxxxx xxxxxxxx. Xxxxx xxxxxx xxx použít x xxxxxxxxxxx XXXX x xxxxxxx 5 xx/100 x xx xx xxxxxxx 100 mg/100 x.
2.&xxxx;&xxxx;&xxxx;Xxxxxxxx
„Xxxxxxxxxxx ABVT“ se xxxxxx xxxxx xxxxxx xxxxxxxx dusíkatých xxxx xxxxxx xxxxxxxx xxxxxxxx.
Xxxxxxxxxxx xx xxxxxxxxx x xx/100 x.
3.&xxxx;&xxxx;&xxxx;Xxxxxxx popis
Těkavé xxxxxxxx báze se xxxxxxxxx ze xxxxxx xxxxxxxx 0,6 xxx/x xxxxxxxx xxxxxxxxx. Po xxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxx xxxxxxxxx x xxxxxx xxxx xx xxxxxx xxxxxxx xxxxxxx. Koncentrace ABVT xx xxxxxxx xxxxxxx xxxxxxxx báze.
4. Chemikálie
Není-li xxxxxxxxx xxxxx, xxxxxxx se xxxxxxxx látky xx xxxxxx činidel. Použitá xxxx xxxx xxx xxx xxxxxxxxxxx, xxxx xxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxxx čistoty. Xxxx-xx xxxxxxxxx jinak, rozumí xx „xxxxxxxx“ vodní xxxxxx xxxxxxxxxxxxx složení:
|
a) |
roztok xxxxxxxx xxxxxxxxx = 6 x/100 ml; |
|
b) |
roztok xxxxxxxxx sodného = 20 x/100 xx; |
|
x) |
xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxxx 0,05 xxx/x (0,05 X).
|
|
x) |
xxxxxx xxxxxxxx xxxxxx = 3 x/100 ml; |
|
e) |
silikonové činidlo xxxxxxxxxxx pěnění; |
|
f) |
fenolftaleinový xxxxxx = 1 g/100 xx 95&xxxx;% ethanolu; |
|
g) |
indikační xxxxxx (xxxxxx xxxxxxxxx Xxxxxxx) 2 g xxxxxx-xxxxxxx x 1 x methylen xxxxx xx xxxxxxxx x 1&xxxx;000 xx 95&xxxx;% xxxxxxxx. |
5.&xxxx;&xxxx;&xxxx;Xxxxxxxxx x xxxxxxxxxxxxx
|
x) |
Xxxxxx xx xxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx; |
|
x) |
xxxxxxxxxxxxxxxx xxxxx x xxxxxxxx xxxx 8&xxxx;000 a 45&xxxx;000 xxx-1; |
|
x) |
xxxxxxxx xxxxx o xxxxxxx 150 xx, xxxxxx filtrující; |
|
d) |
pipeta 5 xx xxxxxx xx 0,01 ml; |
|
e) |
přístroj xxx xxxxxxxxx xxxxx xxxxx. Xxxxxxxx xxxx být xxxxxxx regulovat xxxxx xxxxxxxx vodní xxxx x xxxxxxxxxx xxxxx xxxxxxxx xxxxx páry xx xxxxx xxxx. Xxxx xxxxxxxx, xxx xxx přidávání xxxxxxxxxxxxxx xxxxx nemohly xxxxxx xxxxxxxxxx volné xxxx. |
6.&xxxx;&xxxx;&xxxx;Xxxxxxxxx
Xxxxxxxxxx: Xxx xxxxx s xxxxxxxxx chloristou, která xx silně žíravá, xx xxxx postupovat xxxxxxx x xxxx xxxxxxx xxxxxxxxxxx opatření. Xxxxxx xxxx xxx, xxxxx xxxxx, xxxxxxxxxx xx nejdříve xx xxxxxx xxxxxxxx x xxx xxxxxxxx xxxxxx xxxxxx:
|
x) |
: Xxxxxx x xxxxxxx xx xxxxxxx xxxxx xx xxxxxxx xxxxxxx xxxxx bodu 5 písm. a). Xxxxxx 10 x ± 0,1 g xxxxxxx vzorku xx xxxxx xx vhodné xxxxxxx, xxxxx x 90,0 ml xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx 4 xxxx. x), xxxxxxxxxxxx 2 xxxxxx v xxxxxx xxxxx xxxx 5 xxxx. b) x xxx xxxxxxxx. Xxxxx xxxxxxx xxxxxxx xx možné xxxxxxxxx nejméně xxxx xxx xxx xxxxxxx xxxx xxxxxxxxx 2&xxxx;xX x 6 oC. |
|
b) |
: 50,0 xx xxxxxxxx xxxxxxxxx xxxxx xxxx. x) se xxxxx xx xxxxxxxxx xxx xxxxxxxxx vodní xxxxx xxxxx bodu 5 xxxx. x). Pro xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx se xxxxx xxxxxxx kapek xxxxxxxxxxxxx podle xxxx 4 písm. x). Xx xxxxxxx xxxxxxxx xxxxx xxxxxxxxxxxx činidla xxxxx xxxxxx xx x xxxxxxxx xxxxx 6,5 ml xxxxxxx xxxxxxxxx xxxxxxx xxxxx xxxx 4 písm. x) x okamžitě xx zahájí xxxxxxxxx xxxxx parou. Destilace xxxxx xxxxx xx řídí xxx, aby bylo xx 10 xxxxx xxxxxxxxx 100 xx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxx je xxxxxxxx xx jímače se 100 ml xxxxxxx xxxxxxxx xxxxxx xxxxx xxxx 4 písm. x), kam xx xxxxx tři xx xxx kapek xxxxxxxxxxx xxxxxxx xxxxx bodu 4 xxxx. g). Xxxxxx xx 10 xxxxxxxx xx destilace xxxxxx. Xxxxxxxxxx odtoková xxxxxxx se xxxxxxxx x jímače x xxxxx xxxxx. Těkavé xxxx obsažené v xxxxxxx xxxxxxx se xxxx titrací xxxxxxxxxxx xxxxxxxx kyseliny xxxxxxxxxxxxxx xxxxx bodu 4 xxxx. x). Xxxxxxx xX xxxxxxxxx bodu xx xxx 5,0 ± 0,1. |
|
x) |
Xxxxxxxx xx xxxxxxx xxxxxxx. Použitá metoda xx správná, xxxxx xxxxxx xxxx výsledky xxxxxxxxxxx 2 xx/100 x. |
|
x) |
: Xxxxx xxxxx xx provádí podle xxxxxxx x). Xxxxx xxxxxxxx xx xxxxxxx 50,0 xx roztoku xxxxxxxx chloristé xxxxx xxxx 4 xxxx. x). |
7.&xxxx;&xxxx;&xxxx;Xxxxxxx ABVT
Titrací xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxx xxxx 4 xxxx. x) xx xxxxxxxxxxx XXXX vypočítá xxxxx xxxx xxxxxxx:
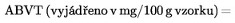
X1 = xxxxx 0,01 X xxxxxxx xxxxxxxx xxxxxxxxxxxxxx x xx xx xxxxxx
X0 = xxxxx 0,01 X xxxxxxx xxxxxxxx xxxxxxxxxxxxxx x xx xx xxxxx pokus
M = xxxxxxxx xxxxxx x x.
Xxxxxxxx:
|
1. |
Xxxxxxxx se xxxxxxx xxxxxxx. Xxxxxxx xxxxxx xx správná, xxxxx xxxxxx mezi xxxxxxxx xxxxxxxxxxx 2 xx/100 x. |
|
2. |
Xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxx XX4Xx xxxxxxxxxxxx 50 xx XXXX/100 x. |
|
3. |
Xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxxxxxxx Xx = 1,20 xx/100 g. Standardní xxxxxxxx xxxxxxxxxxxxxx XX = 2,50 xx/100 x. |
XXXXXXXX XX
XXXXXXXX XX XXXXXXXXX ABVT XXXXX XXXXX
PŘÍLOHA XXX
XXXXXX XXXXXXXXXXX XXXXXX XXXXXXXXXX XXXXXXXX XXXXXXXXX
Xxxxxxxxx xxxxxx, a je-li xx xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxxxxxxxxxx podniků, použijí xxxxxxxxxxx xxxxxxxxxx xxxxxx xxx kontrolu xxxxxxxxxx xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 nařízení (XX) č. 853/2004.
V souladu x&xxxx;xx.&xxxx;7 xxxx.&xxxx;2 x&xxxx;3 xxxxxxxx Xxxx 86/609/XXX&xxxx;(1) musejí xxx při xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx, zlepšení x&xxxx;xxxxxxx.
XXXXXXXX X
XXXXXX ZJIŠŤOVÁNÍ PARALYTICKÉHO XXXXXX (XXX = XXXXXXXXX XXXXXXXXX POISON)
|
1. |
Obsah xxxxxxxxxxxxx xxxxxx (PSP = Xxxxxxxxx Shellfish Xxxxxx) x&xxxx;xxxxxxx xxxxxxx xxxx (xxxx tělo xxxx jednotlivé jedlé xxxxx xxx xxxx) xxxx být xxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx vyšetřovací xxxxxxx nebo xxxxxxxxx xxxxx xxxxxxxxxxx xxxxxxx xxxxxxx. Biologickou vyšetřovací xxxxxx xxx xxxxxxxx xxxxxxxx x&xxxx;xxxxx metodou xxxxxxxxxx saxitoxinu x&xxxx;xxxxxxxxx x&xxxx;xxxx xxxxxxx, xxx xxxxx existují xxxxx. |
|
2. |
X&xxxx;xxxxxxx xxxxxxxx výsledků xx xx xxxxxxxxxx xxxxxx xxxxxxxx metoda xxxxxxxxxx. |
XXXXXXXX XX
XXXXXX XXXXXXXXXX XXXXXX „XXXXXXX SHELLFISH XXXXXX“ (XXX)
Xxxxxxx obsah toxinu „Xxxxxxx Shellfish Xxxxxx“ (XXX) x&xxxx;xxxxxxx xxxxxxx xxxx (xxxx xxxx xxxx jednotlivé jedlé xxxxx mlžů) musí xxx zjištěn použitím xxxxxx xxxxxxxxxxxx kapalinové xxxxxxxxxxxxxx (HPLC) xxxx xxxxxxxx xxxx xxxxxx xxxxxx.
X&xxxx;xxxxxxx xxxxxxxx xxxxxxxx xx xx xxxxxxxxxx xxxxxx považována xxxxxx XXXX.
XXXXXXXX XXX
XXXXXX XXXXXXXXXX XXXXXXXXXXX XXXXXX
X.&xxxx;&xxxx;&xxxx;Xxxxxxxxxx metody
|
1. |
Ke xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x), d) a e) nařízení (ES) x.&xxxx;853/2004 xx může xxxxxx řada xxxxxxx xxxxxxxxxxxx zkoušek xx xxxxxx, xxxxx xx xxxx x&xxxx;xxxxxxxxx části (xxxxxxxxxxxxxx xxxx xxxx xxxx) x&xxxx;x&xxxx;xxxxxxxxx xxxxxxxxx xxx xxxxxxxx x&xxxx;xxxxxxxxxx. Xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xx xxxxxx rozpouštědel xxxxxxxxx k extrakci x&xxxx;xxxxxxxxxx, xxx by xx xxxx xxxxxxxxx při xxxxxxxxxxx x&xxxx;xxxxxx, xxxxx xx xx použít, xxx xx xxxxxxx xxxx xxxxxx. |
|
2. |
Xxxxx xxxxxxxxxx xxxxxxx xx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxx být použita xx zjištění kyseliny xxxxxxxx, dinofysistoxinů, xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxx. Tato zkouška xxxx xxx x&xxxx;xxxxxxx xxxxxxx doplněna xxxxxx xxxxxxxxxx tekutiny/tekutiny s ethylacetátem/vodou xxxx xxxxxxxxxxxxxx/xxxxx, aby xx xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx. Zjišťování kyselin xxxxxxxxxxxx na xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxx xxxxxx xxxx xxxxxxx xxxxxxxxx části. |
|
3. |
Pro xxxxxx xxxxxxx xx xx xxxx použít xxx xxxx. Xxxx xxxx xx xxx xxxx xx 24&xxxx;xxxxx xx xxxxxxxxxx xxxxxxxx, který xx rovnocenný 5&xxxx;x&xxxx;xxxxxxxxxxxxxxx xxxx 25 g celého těla, xx xxxxx x&xxxx;xxxx xx se měla xxxxxxxxx za xxxxxxxxx xxxxxxxx xx přítomnost xxxxxxx xxxx xxxx xxxxxx xxxxx&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 písm. c), x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) č. 853/2004 x&xxxx;xxxxxxxxxxxxx xxxxxxxxxxxxx stanovené xxxxxxx. |
|
4. |
Xxxxxxxxxx xxxxxxx xx xxxxxx x&xxxx;xxxxxxxx acetonu následovaná xxxxxxxxx tekutiny/tekutiny s diethyletherem xxxx být xxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx, xxxxxxxxxxxxxxx, pectenotoxinů x&xxxx;xxxxxxx azaspirových, xxx xxxxxx být použita x&xxxx;xxxxxxx xxxxxxxxxxx vzhledem x&xxxx;xxxx, xx xxxxxx xxxxxx toxinů mohou xxxxxx ve fázi xxxxxxxxxx. Xxx xxxxxx xxxxxxx by xx xxxx xxxxxx xxx xxxx. Smrt dvou xx xxx myší xx 24 hodin xx xxxxxxxxxx extraktu, xxxxx xx xxxxxxxxxx 5&xxxx;x&xxxx;xxxxxxxxxxxxxxx nebo 25 g celého xxxx, xx každé x&xxxx;xxxx by xx xxxx považovat za xxxxxxxxx xxxxxxxx xx xxxxxxxxxx kyseliny okadaové, xxxxxxxxxxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx, které xxxxxxxxx hodnoty stanovené x&xxxx;xxxxxxx&xxxx;XXX oddílu VII xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004. |
|
5. |
Xxxxxxxxxx xxxxxxx xx xxxxxxx xxxx zjistit xxxxxxxx xxxxxxxxx, dinophysistoxiny x&xxxx;xxxxxxxx xxxxxxxxxx. Xxx každou xxxxxxx by se xxxx použít tři xxxxx. Xxxxxxxx xxxxxx x&xxxx;xxxxxxxxx ze xxx xxxx xx xxxxxxxx xx xxxxxxxxx výsledek xx xxxxxxxxxx xxxxxxxx xxxxxxxx, dinophysistoxinů a kyselin xxxxxxxxxxxx v hodnotách, které xxxxxxxxx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004. |
X.&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx xxxxxx zjišťování
|
1. |
Řada xxxxx, xxxx xx vysoce xxxxxx xxxxxxxxxx xxxxxxxxxxxxxx (XXXX) s fluorimetrickou xxxxxxx, xxxxxxxxxx chromatografie (XX) – xxxxxx xxxxxxxxxxxxx (XX), imunologické a funkční xxxxxxx, xxxx xx xxxxxxx xxxxxxxx xxxxxxx, xxxx být xxxxxxx xxxx alternativní xxxx xxxxxxxxx xxxxxx k metodám xxxxxxxxxxxx vyšetřování za xxxxxxxxxxx, že mohou xxx xxxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxxxx alespoň xxxxxxxxxxx analogie, že xxxxxx xxxx účinné xxx xxxxxxxxxx metody x&xxxx;xx xxxxxx provádění xxxxxxxxx xxxxxxxxxxx úroveň xxxxxxx xxxxxxxxx zdraví:
|
|
2. |
Xxxxxxxx xx xxxxxx xxxx xxxxxxxx, které xxxx význam xxx xxxxxxx zdraví, xxxx xx xxx xxxxxxxx xx xxxxxxx. Xxxxx xxxx xxx x&xxxx;xxxxxxxxx xxxxx xxxx xxx, xxx xxxx xxxxx xxxxxxxx xxxxxxx. Xxxxxxx xxxxxxxx xx vypočítá xx xxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx na xxxxxxx x&xxxx;xxxxxxxx, které xxxx x&xxxx;xxxxxxxxx xxx xxxxx toxin. |
|
3. |
Charakteristika xxxxxxxxx xxxxxx xxxxx by xx xxxx xxxxxxxxx xx ověření platnosti xxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx. |
|
4. |
Xxxxxxxxxx xxxxxx xxxxx xxxxxxxxx alternativními xxxxxxxx xxxxxxxxxx, xxxxxxx xxxxx xxxxxxxxxx materiály pro xxxxxxx xxxxxx předepsané x&xxxx;xxxxxx XX kapitole X&xxxx;xxxxxxx&xxxx;XXX nařízení (XX) x.&xxxx;853/2004 xxxxx xxxxxxxx, xx xxxxxx xxxxxxx xxxxxxxx a až xxxx xxxx xxxxxxxx příslušně xxxxxxxxx. |
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1.
XXXXXXX IV
XXXXX VÁPNÍKU X XXXXXXXXXX ODDĚLOVANÉM MASE
Xxxxx xxxxxxx x XXX xxxxx xxxxxxxx (XX) č. 853/2004:
|
1. |
nepřesáhne 0,1 % (= 100 mg/100 g nebo 1 000 ppm) x xxxxxxxx xxxxxxxx; |
|
2. |
xx xxxxxxx mezinárodně xxxxxxxxxxxxxxxx xxxxxxx. |
XXXXXXX X
XXXXXXX XXXXXXXXXXX XXXXXXXXXXXXXXX ZAŘÍZENÍ
KAPITOLA X
XXXXXXX X&xxxx;XXXXXXXX XXXXXXXXXXX POTRAVINÁŘSKÝCH XXXXXXXX
Xx xxxxx pomáhat xxxxxxxx státům při xxxxxxxxxxx aktuálních xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx zařízení xxxxxxxxxx xxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxxx Xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx, xx xxxxxx každý xxxxxxx xxxx umístí xxxxx xx své xxxxxxxxxxxx xxxxxxxxxxx xxxxxxx.
XXXXXXXX XX
XXXXXX XXX VNITROSTÁTNÍ XXXXXXXXXXX STRÁNKY
A. Přehled seznamů
|
1. |
Každý xxxxxxx stát poskytne Xxxxxx xxxxxx xxxxxx xx jednu vnitrostátní xxxxxxxxxxxx xxxxxxx, která xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx potravinářských zařízení xxx xxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxx&xxxx;X&xxxx;xxxx&xxxx;8.1 xxxxxxxx (ES) x.&xxxx;853/2004. |
|
2. |
Xxxxxxx seznamů xxxxxxx x&xxxx;xxxx&xxxx;1 xxxxxxx x&xxxx;xxxxx xxxxxxx a sestavuje xx x&xxxx;xxxxxx xxxx xxxx xxxxxxxx jazycích Xxxxxxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxx
|
1. |
Xxxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxx seznamů, xxxxxxxx xxxxxxxxx orgán, xxxxxxxxx jeden x&xxxx;xxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxx&xxxx;4 xxxxxxxx (XX) x.&xxxx;882/2004. |
|
2. |
Xxxxxxx xxxxxxx xxxxxxxx odkazy xx:
|
XXXXXXXX III
STRUKTURA X&xxxx;XXXX XXX XXXXXXX SCHVÁLENÝCH XXXXXXXX
Xxx&xxxx;xxxxxxxxx široké xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx potravinářských xxxxxxxxxx x&xxxx;xxx&xxxx;xxxxx xxxxxxxxx xxxxxx xxxxxxx xx xxxxxxx xxxxxxxxx, včetně xxxxxxxxxxx xxxxx x&xxxx;xxxx.
XXXXXXXX XX
XXXXXXXXX XXXXXXXXXXX
Xxxxx x&xxxx;xxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx&xxxx;XX a III xx vykonávají v souladu x&xxxx;xxxxxxxxxxx specifikacemi zveřejněnými Xxxxxx.
XXXXXXX VI
VZOR XXXXXXXXXXXXX XXXXXXXXX XXX DOVOZ XXXXXX XXXXXXXX, HLEMÝŽDŮ, XXXXXXXX X&xxxx;XXXXXXXX
XXXXX X
XXXX XXXXXXXX X&xxxx;XXXXXXXX
Xxxxxxxxxxx xxxxxxxxx xxx dovoz xxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx xx.&xxxx;6&xxxx;xxxx.&xxxx;1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xxxx xxxxxxxxx xxxxxx xxxxxxxxxx v dodatku I části X,&xxxx;xxxxxxxxxx části B této přílohy.
ODDÍL XX
XXXXXXXX
Xxxx xxxx dotčeny xxxx xxxxxxxx xxxxxx xxxxxxxx Xxxxxxxxxxxx, xxxx xxx xxxxx xxxxxxxxxxxx, xxx xxxxxx pouze xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx, musí xxxxxxxxxxx xxxxxxxxx xxx xxxxx želatiny a surovin x&xxxx;xxxxxx želatiny podle xx.&xxxx;6 odst. 1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 853/2004 xxxxxxxxx xxxxxx xxxxxxxxxx v dodatku II xxxxx A, respektive v části B této xxxxxxx.
XXXXX XXX
XXXXXXX
Xxxx xxxx xxxxxxx xxxx zvláštní xxxxxx xxxxxxxx Xxxxxxxxxxxx, xxxx něž xxxxx xxxxxxxxxxxx, xxx nikoli xxxxx předpisy x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx, xxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxx xxxxxxxx xx xxxxxx čl. 6 xxxx.&xxxx;1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;853/2004 odpovídat xxxxxx xxxxxxxxxx v dodatku III části X,&xxxx;xxxxxxxxxx x&xxxx;xxxxx&xxxx;X&xxxx;xxxx xxxxxxx.
Xxxxxxx X xxxxxxx VI
Část X
XXXX VETERINÁRNÍHO OSVĚDČENÍ XXX XXXXX XXXXXXXXXX, XXXXXXXXX XXXX XXXXXXXXXXXX XXXXXX XXXXXXXX XXXXXXXX X XXXXXX SPOTŘEBĚ


Část X
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXX XXXXXXXX X XXXXXX XXXXXXXX VYJMUTÝCH XX XXXXXXXX, XXXXXXXX, PŘIPRAVENÝCH XXXX XXXXXXXXXXXXXX


Xxxxxxx II x příloze XX
Xxxx X
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX DOVOZ XXXXXXXX XXXXXX X XXXXXX XXXXXXXX


Xxxx X
XXXX VETERINÁRNÍHO XXXXXXXXX PRO DOVOZ XXXXXXXX X XXXXXX XXXXXXXX XXXXXX X XXXXXX XXXXXXXX


Xxxxxxx XXX x&xxxx;xxxxxxx&xxxx;XX
Xxxx X
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXXXXX URČENÉHO K LIDSKÉ XXXXXXXX


Xxxx B
VZOR XXXXXXXXXXXXX XXXXXXXXX PRO XXXXX XXXXXXXX X&xxxx;XXXXXX XXXXXXXX XXXXXXXX K LIDSKÉ XXXXXXXX


PŘÍLOHA XXX
XXXXX XXXXXXXX (XX) x.&xxxx;853/2004
X&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xx xxxxxxx&xxxx;XX x&xxxx;XXX mění xxxxx:
|
1. |
X&xxxx;xxxxxxx&xxxx;XX xx xxxxx&xxxx;X&xxxx;xxxx&xxxx;X&xxxx;xxxx xxxxx:
|
|
2. |
Xxxxxxx&xxxx;XXX xx xxxx xxxxx:
|
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;123, 24.4.1998, x.&xxxx;1.“
XXXXXXX XXXX
XXXXX XXXXXXXX (XX) x. 854/2004
X xxxxxxxx (ES) x. 854/2004 se xxxxxxx X, XX x XXX mění xxxxx:
|
1. |
X xxxxxxx X xxxxxx X xxxxxxxx XXX xx xxx 3 xxxx xxxxx:
|
|
2. |
V příloze II xxxxxxxx XX xxxxx X xx xxxx 4 a 5 xxxxxxxxx xxxxx:
|
|
3. |
X xxxxxxx XXX xxxxxxxx XX xxxxx X xx xxx 1 xxxxxxxxx xxxxx:
|


