XXXXXXXX XXXXXX 2006/86/XX
xx xxx 24. xxxxx 2006,
xxxxxx xx xxxxxxx xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2004/23/XX, xxxxx jde o xxxxxxxxx xx xxxxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx nežádoucích xxxxxx x xxxxxx x xxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx a xxxxx
(Xxxx x xxxxxxxx xxx XXX)
XXXXXX XXXXXXXXXX XXXXXXXXXXXX,
x xxxxxxx xx Xxxxxxx x xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
x ohledem xx xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2004/23/ES xx dne 31. xxxxxx 2004 x xxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování x distribuci xxxxxxxx xxxxx x xxxxx (1), x zejména xx xxxxxx 8, čl. 11 odst. 4 x xx. 28 xxxx. a), x), x), a x) xxxxxxx směrnice,
vzhledem x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx 2004/23/XX xxxxxxx jakostní x xxxxxxxxxxxx xxxxx xxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování x xxxxxxxxxx lidských xxxxx a buněk xxxxxxxx x xxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxx x xxxxx určených x xxxxxxx x xxxxxxx x xxxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxx zdraví. |
|
(2) |
Aby se xxxxxxxxxxx xxxxxxx nemocí xxxxxxxxxxxxxxx xxxxxxxx xxxxx x xxxxx xxxxxxxx x xxxxxxx x xxxxxxx a aby xx zaručila xxxxxxxxxx xxxxxx jakosti a xxxxxxxxxxx, xxxxxx xxxxxxxx 2004/23/XX ke xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxx každou x xxxx postupu použití xxxxxxxx tkání x xxxxx, xxxxxx xxxxx x specifikací xxx xxxxxx jakosti xxxxxxxxx xxxxxxxx. |
|
(3) |
Xxxxxxx xxxxx by xxxx x xxxxxxx xx xxxxxxxx 2004/23/XX xxxxxxxx systém xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxx tkání x xxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx, aby xx xxxxxxxxx xxxxxx úroveň xxxxxxx lidského xxxxxx. Xxx xxxxx xxxxxx xx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. |
|
(4) |
Xxxxxxxxx xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xx xx xxxx xxxxxxxxx xx xxxxxxxxxx a xxxxxx, xxxxxxxxxx, xxxxxxxx, xxxxxxxxx, zařízení/prostory, dokumentaci, xxxxxxx x přezkoumání xxxxxxx. Xxxxxxxxxxxx a xxxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxx zařízení, xxxx xxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxx, xx měla splňovat xxxxxxxxx xxxxxxxxx na xxxxxxxx činnosti, xxxxx xxxxxxxxx. |
|
(5) |
Xxxxx xxxxxxxx se xxxxxxx xxxxxxx xxx xxxxxxxxxx tkání x xxxxx je xxxxxxxx xxxxxxxx, který xxxx xxx xxxx xx xxxxxx xxxxxxxxxxx xxxxx xxxx buněk. Xxxxxx xx vyžaduje kvalita xxxxxxx, v xxxx xxxx xxxxx částic x počet xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xx xxxxx čistoty X, jak je xxxxxxxxxx x xxxxxxx 1 Xxxxxxxxxx xxxxxx xxx správnou xxxxxxx xxxxx x xx xxxxxxxx Xxxxxx 2003/94/ES (2). X xxxxxxxx xxxxxxxxx xxxx není xxxxxxx xxxxxxx x xxxxxx xxxxxx a xxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxx x xxxxx xxxxx A xxxxxxxxxx. Xx xxxxxxxx xxxxxxxxx xx mělo xxx xxxxxxxxx x zdokumentováno, xx zvolené xxxxxxxxx xxxxxxxx xxxxxx a xxxxxxxxxx, xxx xxxx xxxxxxxxxx xxx daný xxxx tkáně x xxxxx, xxxx proces x xxxx použití x xxxxxxx. |
|
(6) |
Xxxxxx xxxxxxxxxx xxxx xxxxxxxx xx xxxx xxxxxxxxx jakost x bezpečnost xxxxxxxx xxxxx x xxxxx xxx kódování, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx do zdravotnických xxxxxxxx, v němž xx xxxxxxx x xxxxxxx xxxx. Neměla xx xxxx xxx xxxxxxxxx na použití xxxxxx xxxxx x xxxxx x člověka (xxxx. xxx implantaci, xxxxxxx, inseminaci xxxx xxxxxxx xxxxxx). Ustanovení xxxx směrnice týkající xx xxxxxxxxxxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxx xx xxxxxx xxxxxxxx xx xxxxxxxx, xxxxx x xxxxxxxxxxx xxxxxxxx xxxxx x xxxxx, xxxxx xxxx upraveny xxxxxxxx Xxxxxx 2006/17/ES (3). |
|
(7) |
Použití xxxxx x buněk x xxxxxxx xxxx xxx xxxxxxxx xxxxxxxx xxxxxx přenosu xxxxxx x další případné xxxxxxxxx xxxxxx. Aby xxxx možné xxxxxxxx x xxxxxx tyto xxxxxx, xxxx xx xx xxxxxxxx xxxxxxxxxx xxxxxxxxx na sledovatelnost x xxxxxx Společenství xxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx a xxxxxx. |
|
(8) |
Xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xx u xxxxx, xx u xxxxxxxx, a xxxxxxx xxxxxxxxx xxxxxx od xxxxxxxx až xx xxxxxxxxxx xxxxx x xxxxx, jež xxxxx xxx xxxx na xxxxxx x xxxxxxxxxx xxxxx a buněk x mohou xxx xxxxxxxxx odběrem (xxxxxx xxxxxxxxx x xxxxxx xxxxx), xxxxxxxxxxxx, zpracováním, xxxxxxxxxx, xxxxxxxxxxx a xxxxxxxxxx lidských xxxxx x xxxxx, xx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx. |
|
(9) |
Xxxxx xxxxxx u xxxxxx xxxxx xx xx něm xxxx xxxxx xxxxxxx x xxxxxxx či po xxx xxxxx xxx xxxxxxxx závažné xxxxxxxxx xxxxxx. Xxxx xx xxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxx. Xx xx xxxxxxxxxx xxxxxxxxxxx odběr xx organizaci xxxxxxxxx xx xxxxxxx u xxxxxxx xxxxxx xxxxxx x tom, aby xxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx si xx xxxxx. Xxxx xxxxxxxx xx měla xxxxxxx minimální xxxxx, xxx je xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx, xxxx xx xxx xxxxxxx schopnost xxxxxxxxx xxxxx zachovávat xx xxxxxxx xx svém xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxx xxxx x xxxxxxx x xxxxxxxxxxxx Xxxxxxx. |
|
(10) |
X xxxxx xx xxxxxxx xxxxxx výdaje na xxxxxx, zabránit překrývání x xxxxxx administrativní xxxxxxxx by xx xxxx x provádění xxxxx xxxxxxxxxx xx xxxxxxx x zpracování xxxxxxxxx používat xxxxxxx xxxxxxxxxxx x řešení xxxxxxxxxxxx xxxxxxx správy. Xxxx xxxxxxxxxxx xx xxxx xxxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxx systému xxx xxxxxx xxxxxxxxxxxx xxxxx. |
|
(11) |
Xxx xx xxxxxxxxx xxxxxxxxxxxxxx x xxxxxxxxxxxx informace x hlavních xxxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxxx, je xxxxx xxxxxxxx xxxxxxxx xxxxx, xxx xxxx xxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxxx xxxx. |
|
(12) |
X xxxx xxxxxxxx jsou xxxxxxxxxx základní xxxxx x xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx Xxxxxxxx xxxxxxxxxx xxxx Evropské xxxx. |
|
(13) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxx v xxxxxxx xx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxx 29 xxxxxxxx 2004/23/ES, |
PŘIJALA XXXX SMĚRNICI:
Xxxxxx 1
Xxxxxx xxxxxxxxxx
1. Tato xxxxxxxx xx xxxxxxxx xx kódování, xxxxxxxxxx, xxxxxxxxxx, skladování a xxxxxxxxxx:
|
x) |
xxxxxxxx xxxxx a xxxxx xxxxxxxx x xxxxxxx x člověka x |
|
x) |
xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxx x xxxxx xxxxxxxx k xxxxxxx u člověka, xxxxx se xx xxxxxx xxxxxxxxx nevztahují xxxx xxxxxxxx. |
2. Xxxxxxxxxx článků 5 xx 9 xxxx xxxxxxxx, xxxxx xx týkají sledovatelnosti x xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx reakcí x xxxxxx, xx xxxxxx xxxxxxxx na xxxxxxxx, xxxxx, xxxxxxxxxxx xxxxxxxx xxxxx x xxxxx.
Xxxxxx 2
Definice
Pro xxxxx xxxx xxxxxxxx xx:
|
a) |
„reprodukčními xxxxxxx“ xxxxxxxx xxxxxxx xxxxx x buňky xxxxxx x účelům xxxxxxxxxx xxxxxxxxxx; |
|
x) |
„darováním mezi xxxxxxxx“ xxxxxx xxxxxxxx xxxxxxxxxxxxx buněk xxxx xxxxx x xxxxx, xxxxx xxxxxxxx, xx xxxx intimní fyzický xxxxx; |
|
x) |
„xxxxxxxx jakosti“ rozumí xxxxxxxxxxx xxxxxxxxx, stanovené xxxxxxxxxx, postupy, xxxxxxx x xxxxxx k xxxxxxxxx řízení jakosti; xxxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxxx xx xxxxxxx xxxxxxxxxx x xxxxxxx; |
|
x) |
„xxxxxxx xxxxxxx“ xxxxxxxx xxxxxxxxxxxx xxxxxxxx, xxxxx xxxx řídit x xxxxxxxxxxx organizaci x xxxxxxxx xxxxxxx; |
|
e) |
„standardními xxxxxxxxxx xxxxxxx“ (SOP) rozumějí xxxxxxx pokyny popisující xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x xxxxx, xxxxx xxxx xxx xxxxxxx, x xxxxxxxxx konečný xxxxxxxxx; |
|
x) |
„xxxxxxxx“ (xxxx „kvalifikací“ x xxxxxxx xxxxxxxx xxxx prostředí) rozumí xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx, xxxxx xxxxxxxxx xxxxxxx xxxxxx, že xxxxxx xxxxxx, xxxxxxxxxx pracovní xxxxxx, xxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx produkt, který xxxxxxx předem stanovené xxxxxxxxxxx a xxxxxxxx xxxxxxx; |
|
x) |
„xxxxxxxxxxxxxxx“ rozumí xxxxxxxxx xxxxxxx xxxxx, xxx xx xxxxxxx, x xxxxxxxxxxxxx tkáň/buňku xxxxx xxxxx xxxxx xx xxxxxx, xxxx xxxxxxxxxx, xxxxxxxxxxx a xxxxxxxxxx xx po distribuci xxxxxxxx nebo xxxxxxxxx, xxx xxxxxxxx také xxxxxxxxx xxxxxxxxxxxxx dárce x xxxxxxx xxxxxxxx xxxx xxxxxxx zařízení, xxxxx xxxx/xxxxx xxxxxxx, xxxxxxxxxx xxxx skladuje, x schopnost xxxxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx/xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxx/xxxxx u xxxxxxxx/xxxxxxxx; |
|
x) |
„xxxxxxxxx“ xxxxxx xxxxxx xxxxx xxxx xx xxxxxx xxxx bezpečnost xxxxx x xxxxx xxxx mající x xxxx xxxxxxx; |
|
x) |
„organizací xxxxxxxxxxx xxxxx“ xxxxxx zdravotnické xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxx jiný xxxxxxx, xxxxx xxxxxxxxx xxxxx lidských xxxxx x buněk x xxxxx xxxxxx xxx xxxxxxxxxxx, určen, xxxxxxxx xxxx xxxxxxx xxxx xxxxxxx xxxxxxxx; |
|
x) |
„organizacemi xxxxxxxxxxx xx xxxxxxx x xxxxxxx“ xxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxx, xxxxx xxxxxxx xxxxxx xxxxx x xxxxx x xxxxxxx. |
Xxxxxx 3
Xxxxxxxxx xx xxxxxxxxxx a jmenování xxxxxxxxx zařízení a xxxxxxx xxxxxxxxxxx oprávnění xxxx povolení
Tkáňové xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx X.
Xxxxxx 4
Xxxxxxxxx na xxxxxxxxxx x jmenování xxxxxxx xxxxxxxx tkání x xxxxx x xxxxxxx xxxxxxxxxxx oprávnění xxxx xxxxxxxx
Xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxx XX.
Xxxxxx 5
Xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx reakcí
1. Členské státy xxxxxxx, aby:
|
a) |
xxxxxxxxxx xxxxxxxxxxx xxxxx xxxx xxxxxxxx xxxxxxx xxx xxxxxx xxxxxxx x xxxxxxxxxx xxxxxxx x xxxxxxx x xxx xx, xxx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx nežádoucích xxxxxxxx x xxxxxxxx xxxxx, xxx by xxxxx ovlivnit jakost x xxxxxxxxxx tkání x buněk; |
|
b) |
xxxxxxxxxx odpovědné xx xxxxxxx tkání x xxxxx x xxxxxxx xxxx xxxxxxxx xxxxxxx xxx xxxxxx xxxxxxx x použitých xxxxxxx x xxxxxxx x xxx xx, xxx xxxxx neprodleně xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx nežádoucích xxxxxxxx pozorovaných během xxxxxxxxxx xxxxxxx xxxx xx xxx, xxxxx xxxxx xxxxxxxx x xxxxxxx x xxxxxxxxxxx xxxxx xxxx xxxxx; |
|
c) |
tkáňová xxxxxxxx, xxxxx xxxxxxxxxxx xxxxx x xxxxx xxx xxxxxxx x xxxxxxx, poskytovala organizaci xxxxxxxxx xx xxxxxxx xxxxx x xxxxx x člověka informace x xxx, jak xx tato organizace xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, jak xx xxxxxxx x xxxxxxx x). |
2. Xxxxxxx xxxxx xxxxxxx, xxx xxxxxxx zařízení:
|
x) |
měla xxxxxxxx postupy pro xx, xxx xxxxx xxxxxxxxxx xxxxxxxx příslušnému xxxxxx xxxxxxx xxxxxxxx xxxxxxxx informace x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, jak xx xxxxxxx v xxxx. 1 xxxx. x) x b); |
|
b) |
xxxx xxxxxxxx xxxxxxx pro xx, xxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx xxx xxxxx xxxxxxx xxxxxx x xxxxxxxxxx výstupu. |
3. Xxxxxxx xxxxx xxxxxxx, xxx:
|
x) |
xxxxxxxxx xxxxx uvedená x xxxxxx 17 xxxxxxxx 2004/23/XX xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx xxxxx X xxxxxxx XXX; |
|
x) |
xxxxxxx zařízení xxxxxxxx xxxxxxxxxxx orgánu opatření xxxxxxx xxxxxxx ostatních xxxxxxxxx xxxxx a xxxxx, které xxxx xxxxxxxxxxxxx xxx xxxxx xxxxxxx x člověka; |
|
x) |
tkáňová xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx, xxxxxxx poskytnou alespoň xxxxxxxxx podle části X xxxxxxx XXX. |
Xxxxxx 6
Oznamování xxxxxxxxx xxxxxxxxxxx xxxxxx
1. Xxxxxxx xxxxx xxxxxxx, xxx:
|
x) |
xxxxxxxxxx xxxxxxxxxxx xxxxx x tkáňová xxxxxxxx xxxx zavedeny xxxxxxx xxx xxxxxx xxxxxxx x xxx xx, aby xxxxx xxxxxxxxxx uvědomovat xxxxxxx xxxxxxxx o závažných xxxxxxxxxxx xxxxxxxx, xxxxx xx xxxxxx xxxxx xxxxxx x xxxxx xx xxxxxxxx jakost x/xxxx bezpečnost xxxxxxxx xxxxx x buněk; |
|
x) |
organizace xxxxxxxxx za xxxxxxx xxxxx x xxxxx x člověka xxxx xxxxxxxx postupy, aby xxxxx neprodleně xxxxxxxxxx xxxxxxx zařízení x xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx by xxxxx xxxxxxxx jakost x xxxxxxxxxx xxxxx nebo xxxxx; |
|
x) |
xxxxxxx zařízení poskytovala xxxxxxxxxx odpovědné za xxxxxxx tkání x xxxxx x xxxxxxx xxxxxxxxx x xxx, xxx xx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, které xx xxxxx xxxxxxxx xxxxxx x xxxxxxxxxx xxxxx xxxx xxxxx. |
2. V xxxxxxx xxxxxxxxxx xxxxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxxxx či xxxxxx xxxxx xxxx xxxxxx xxxxxxxx za závažný xxxxxxxxx xxxxxx. Všechny xxxxx xx organizace xxxxxxxxxxx xxxxx xxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxx tkání a xxxxx u xxxxxxx, xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx, oznámí xxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro účely xxxxxxxxxxx x oznámení xxxxxxxxxxx xxxxxx.
3. Členské státy xxxxxxx, xxx tkáňová xxxxxxxx:
|
x) |
xxxx zavedeny xxxxxxx xxx xx, xxx xxxxx neprodleně xxxxxxxx xxxxxxxxxxx orgánu všechny xxxxxxxx dostupné xxxxxxxxx x xxxxxxxxxxx závažných xxxxxxxxxxx xxxxxxxx, xxx xx uvedeno v xxxx. 1 písm. x) x x); |
|
b) |
xxxx xxxxxxxx postupy xxx xx, xxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx závěry xxxxxxxxxxx xxx xxxxx xxxxxxx xxxxxx x následného xxxxxxx. |
4. Xxxxxxx xxxxx xxxxxxx, xxx:
|
x) |
xxxxxxxxx xxxxx uvedená x článku 17 xxxxxxxx 2004/23/ES xxxxxxxx xxxxxxxxxxx orgánu xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx části A xxxxxxx IV; |
|
b) |
tkáňová xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, xxx bylo xxxxx x daném xxxxxxx určit příčiny, xxxx lze xxxxxxxx; |
|
c) |
xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx, xxxxxxx poskytnou alespoň xxxxxxxxx xxxxx části X přílohy XX. |
Xxxxxx 7
Výroční xxxxxx
1. Xx 30. xxxxxx následujícího xxxx xxxxxxxx členské xxxxx Komisi xxxxxxx xxxxxx o oznámeních, xxxxx xxxxxxxxx xxxxx xxxxxxx o xxxxxxxxx xxxxxxxxxxx reakcích x xxxxxxxx. Xxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx shrnutí xxxxxxxxxx xxxxx. Příslušný xxxxx xxxx xxxxxx xxxxxxxxxx xxxxxxxx zařízením.
2. Xxxxxx údajů xxxxxxxx specifikacím xxxxxxxxx xx xxxxxxx xxx xxxxxx xxxxx stanoveným x xxxxxxx A x B přílohy X x xxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxxxx xxxxxxxxxxx x pro xxxxxxxxx xxxx referenčních xxxxx.
Xxxxxx 8
Xxxxxx xxxxxxxxx xxxx xxxxxxxxxxx xxxxxx x jejich xxxxxxxxx Xxxxxx
Xxxxxxx státy xxxxxxx, xxx xx xxxxxx xxxxxxxxx orgány sdělovaly xxxxxxxx xxxxxxxxx, xxxxx xxx o závažné xxxxxxxxx reakce x xxxxxx, aby xx xxxxxxxx, xx xxxxx xxxxxxx xxxxxxxxxxxx opatření, x xxx tyto xxxxxxxxx sdělovaly Komisi.
Xxxxxx 9
Sledovatelnost
1. Tkáňová zařízení xxxx xxxxxx a xxxxxx systémy xxx xxxxxxxxxxxx xxxxxxxxxxxx a xxxxxxxx xxxxxxxxxx a xxxxxxxxxxxxxxx xxxxx/xxxxx.
2. Tkáňová xxxxxxxx x xxxxxxxxxx xxxxxxxxx xx xxxxxxx x xxxxxxx uchovají xxxxx xxxxxxxxx v xxxxxxx XX xxxxxxx xx xxxx 30 xxx, x xx xx xxxxxxx x xxxxxxxx xxxxx.
Xxxxxx 10
Evropský kódovací xxxxxx
1. Xxxxxxxx xxxxxxxxx xxxxxxxxxx xx x xxxxxxxx xxxxxxxx přidělí xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxx, xxx xx xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxx x xxxxxxxxxxxxxx všech xxxxxxxxxx materiálů x xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxxx. Kód xxxxxxxx xxxxxxx informace xxxxxxx x příloze VII.
2. Xxxxxxxx 1 se nevztahuje xx xxxxxxxx xxxxxxxxxxxxx xxxxx xxxx partnery.
Xxxxxx 11
Provedení
1. Xxxxxxx státy xxxxxx v xxxxxxxx xxxxxx x xxxxxxx xxxxxxxx nezbytné xxx xxxxxxxx xxxxxxx s xxxxx xxxxxxxx nejpozději xx 1. xxxx 2007. Neprodleně xxxxx Xxxxxx znění xxxxxxxxx xxxxxxxx a srovnávací xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx předpisů x xxxxxxxxxxxx xxxx xxxxxxxx.
Xxxxxxx xxxxx uvedou v xxxxxxxx xxxxxx a xxxxxxx xxxxxxxx nezbytné xxx dosažení xxxxxxx x článkem 10 xxxx směrnice xx 1. září 2008.
Tyto xxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx xx xxxx xxxxxxxx xxxx musí xxx xxxxxx xxxxx xxxxxx při jejich xxxxxxx vyhlášení. Způsob xxxxxx xx xxxxxxx xxxxxxx xxxxx.
2. Členské xxxxx xxxxx Komisi xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx, které xxxxxxx x xxxxxxx xxxxxxxxxx této xxxxxxxx.
Xxxxxx 12
Xxxxx x xxxxxxxx
Xxxx xxxxxxxx xxxxxxxx x platnost xxxxxxxx xxxx xx vyhlášení x Xxxxxxx věstníku Xxxxxxxx xxxx.
Xxxxxx 13
Xxxxxx
Tato směrnice xx určena členským xxxxxx.
X Bruselu xxx 24. xxxxx 2006.
Za Xxxxxx
Xxxxxx XXXXXXXXX
xxxx Komise
(1)&xxxx;&xxxx;Xx. xxxx. X 102, 7.4.2004, s. 48.
(2) http://pharmacos.eudra.org/F2/eudralex/vol-4/home.htm x Úř. xxxx. X 262, 14.10.2003, x. 22.
(3)&xxxx;&xxxx;Xx. věst. X 38, 9.2.2006, s. 40.
XXXXXXX I
Požadavky na xxxxxxxxxx x jmenování xxxxxxxxx xxxxxxxx a xxxxxxx příslušného xxxxxxxxx xxxx xxxxxxxx, xxx xx uvedeno x xxxxxx 3
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX X XXXXXX
|
1. |
Xxxx xxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xx xxxxxxxxxxx a xxxxxxxx, xxx stanoví xxxxxx 17 xxxxxxxx 2004/23/XX. |
|
2. |
Xxxxxxx xxxxxxxx xxxx xxx xxxxxxxxxxx xxxxxxxxx x provozní xxxxxxx xxxxxxxxxxxx činnostem, k xxxx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení; musí xxx xxxxxxxxxxx organizační xxxxxx, xxxxx xxxxx xxxxxxxx strukturu zodpovědnosti x xxxxxxxxxx xxxxxxxxxx. |
|
3. |
Xxxxx xxxxxxx xxxxxxxx xxxx xxx xxxxxxx x xxxxxxxx registrovanému lékaři, xxxx mu xxxx xxxxxxxxxx xxxxxxxxxxx a xxxxxxxx na xxxx xxxxxxxx činnosti, xxxx xx xxxxx xxxxx, xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx tkání x xxxxx xxxx xxxxx xxxxxxx interakce x xxxxxxxxxx uživateli. |
|
4. |
Musí xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx xxxxxx xxxxxxx, xxxxx xx uplatňuje xx xxxxxxxx, k xxxx xx xxxx o xxxxxxxxxx, jmenování, oprávnění xxxx povolení, a xx x souladu x xxxxxxx stanovenými x této xxxxxxxx. |
|
5. |
Xxxx xxx zaručeno, že xxxx xxxxxx x xxxxxxxxxxxxxx xxxxxx xxxxxxx x xxxxxxxxxx biologického xxxxxxxxx x x xxxxxxxxxx x xxxxx xxxxxxxxxx, přičemž xx xxxxxxxxx odpovídající xxxxxx x bezpečnost xxx xxxxxx xxxx xxxxxxx xxxxx a xxxxx. Xxxx rizika xx xxxxxx postupů, prostředí x xxxxxxxxxxx stavu xxxxxxxxxx x daném xxxxxxxx xxxxxxxx. |
|
6. |
Xxxxxx xxxx xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx xxxxxx xxx v xxxxxxx x článkem 24 xxxxxxxx 2004/23/XX. Dohody xx třetími xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx xxxxxx x xxxxxxxxxx, xxxxx x xxxxxxxxx, xxxxx xx třeba xxxxxxxxx, aby byla xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx. |
|
7. |
Xxxx xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx, xx xxxx xxxxxxx xxxxxxxxxx xxxxx, xxxxxx xx xxxxxxxxx, xx xxxxx x/xxxx buňky xxxxxxx příslušné xxxxxxxxxxx xxxxxxxxxxx x xxxxxxx xxx propuštění x xxxxxxxxxx. |
|
8. |
X xxxxxxx ukončení xxxxxxxx zahrnují xxxxxxxx xxxxxx a postupy xxxxxxx x xxxxxxx x čl. 21 xxxx. 5 xxxxxxxx 2004/23/XX xxxxx o xxxxxxxxxxxxxxx a materiál xxxxxxxx xx jakosti x xxxxxxxxxxx xxxxx x xxxxx. |
|
9. |
Xxxx xxx xxxxxxx xxxxxxxxxxxxxx systém, xxxxx zaručuje identifikaci xxxxx jednotky tkáně xx buňky ve xxxxx xxxxxxx xxxxxxxx, x nimž xx xxxx o akreditaci, xxxxxxxxx, oprávnění xxxx xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX
|
1. |
Xxxxxxxxxx xxxx být x tkáňovém xxxxxxxx xxxxxxxxxx počet x xxxxxx být xxxxxxxxxxxxx xxx xxxxx, xxxxx xxxxxxxxx. Xxxxxxxxxxx pracovníků xxxx být xx xxxxxxxx xxxxxxxxxxx, xxxxxxxxxxx x xxxxxxx jakosti, xxxxxxxxxxxxx. |
|
2. |
Xxxxxxx xxxxxxxxxx xxxxxx xxx jasný, xxxxxxxxxxxxxx x xxxxxxxx xxxxx xxxxx. Xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxxxx xxxxxx xxx xxxxx xxxxxxxxxxxxxx a pochopeny. |
|
3. |
Pracovníkům xxxx xxx poskytnuta xxxxxxxxx xx xxxxxxxx xxxxxxx příprava, xxxxxxxxxxxxx xxxxxxxx x xxxxxxx, xx xx změní xxxxxxx nebo xx xxxxxxxx vědecké poznatky, x xxxxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxx xxxxxx. Xxxxxxx odborné xxxxxxxx xxxx zajistit a xxxxxxxxxxxxx, xx každý xxxxxxxxxxx:
|
C. VYBAVENÍ X XXXXXXXXX
|
1. |
Xxxxxxx vybavení x xxxxxxxx musejí xxx xxxxxxxx x xxxxxxxxx způsobem xxxxxxx xxx xxxxxx xxxxxx xxxx x xxxxxx xxx příjemce x/xxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx. |
|
2. |
Xxxxxxx xxxxxxxx xxxxxxxx x technické xxxxxxxxxx xxxxxx xxx xxxxxxxxxxxxxx x xxxxxxxxxx, xxxxxxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxxx x xxxxxxx x pokyny xxxxxxx. Xxxxx xxxxxxxx nebo xxxxxxxxx mají vliv xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxxx (xxxx. xxxxxxx, xxxx, xxxxx xxxxxx, xxxxxx xxxxxxxxxxx xxxxxxxxxxx), musejí xxx xxxxxxxxxxxxxx a xxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx sledování, systémům xxxxxxxx, xxxxxxxx a xxxxxxxxxx xxxxxxxx, aby xxxx xxxxxxxx poruchy x xxxx a xxxx zajištěno, xx xxxx xxxxxxxx parametry xxxxxxxxxxx udržovány x xxxxxxxxxxxx mezích. Veškeré xxxxxxxx, xxxxxx xx xxxx xxxxxxxx xxxxxxxxx, xxxx být xxxxxxxxxxx xxxxx xxxxxxxxxxxxxx xxxxxxx, xx-xx x dispozici. |
|
3. |
Nové x xxxxxxxx xxxxxxxx xxxx xxx xxx xxxxxxxxx xxxxxxxxxx x xxxx xxxxxxxx xxxxxxxxxx. Xxxxxxxx zkoušek xx xxxxxxxxxxxx. |
|
4. |
Xxxxxx, xxxxxxxx xxxxxx, xxxxxxx, xxxxxxxxxx a xxxxxxxx xx x xxxxxxxxx xxxxxxxxxx vybavení xxxxxxxxx xxxxxxxxxx x xxxx náležitě xxxxxxxxxxxxx. |
|
5. |
Xxxxxx xxx x dispozici xxxxxxx xxx xxxxxx xxxxx xxxxxxxx kritického xxxxxxxx, xxxxxxxx popisující xxxxxxxx, jež mají xxx přijata x xxxxxxx xxxxxxx xx xxxxxxx. |
|
6. |
Xxxxxxx u činností, x xxxx xx xxxx x akreditaci, xxxxxxxxx, oprávnění xxxx xxxxxxxx, xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxx. Xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxxxxx přídatných látek (xxxx. xxxxxxx) a xxxxxxxxx xxxxxxxxx. Xxxxxxxx xxxxxxx činidla x xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxxx požadavky x xxxxxxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx xx xxxxxxxx Xxxx 93/42/XXX xx xxx 14. xxxxxx 1993 o xxxxxxxxxxxxxx prostředcích (1) x xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx 98/79/XX xx dne 27. xxxxx 1998 x xxxxxxxxxxxxxx zdravotnických prostředcích xx xxxxx&xxxx;(2). |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX X XXXXXXXX
|
1. |
Xxxxxxx zařízení xxxx xxx xxxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx, x xxxx se xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx, a to x xxxxxxx s xxxxxxx xxxxxxxxxxx x xxxx směrnici. |
|
2. |
Pokud tyto xxxxxxxx xxxxxxxx zpracování xxxxx a xxxxx xxx xxxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxx x xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxx, xxx xx xxxxxxxxxxxxxx riziko xxxxxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxxx xxxx xxxxxxx x buňkami x xxxxxxx xxxxxxxx. Xx xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxx xxxxxxxx. |
|
3. |
Xxxxx xxx 4 xxxxxxxxx xxxxx, jsou-li xxxxx xx xxxxx xxxxxxxxx xxxxx zpracování xxxxxxxxx, xxxx xx xxxxxxxx xxxx podrobeny xxxxxxx xxxxxxxxxxx inaktivace, xx xxxxxxxxxx kvalita xxxxxxx, x xxxx xxxx počet xxxxxx x počet xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxx xx xxxxx xxxxxxx X, xxx xx xxxxxxxxxx x příloze 1 xxxxxxxx Evropských xxxxxx xxx xxxxxxxx xxxxxxx xxxxx x xx směrnici 2003/94/XX, x xxxxxxxxx xxxxxx xxxxxx xxx zpracování xxxxxxxxxxx xxxxx xxxx xxxxx, které xxxx xxxxxxxx xxxxxxx xxxxx xxxxxxx X xxxxxxx xxxxxxx xxxxx, pokud xxx o počet xxxxxx x počet xxxxxxxxxxxxx xxxxxxx. |
|
4. |
Xxxx přísné xxxxxx na xxxxxxxxx, xxx xxxx xxxx xxxxxxx v bodě 3, xxxx xxxxxxxxxx x xxxxxxx, že:
|
|
5. |
Xx xxxxx xxxxx stanovit xxxxxxxxx x xxxx 4 xxxx. x), x), x) x x). Xxxx xxx xxxxxxxxx x zdokumentováno, xx xxxxxxx prostředí xxxxxxx požadavky xx xxxxxx a xxxxxxxxxx, xxxxxxx s xxxxxxx xx určený xxxx, xxxxxx xxxxxxx a xxxxxxxx xxxx xxxxxxxx. X xxxxxx příslušném xxxxxxxx xxxxxxxxx zařízení xx xxxx poskytovat xxxxxx xxxx x xxxxxxxx xxx osobní xxxxxxx x hygienu x písemné pokyny xxx hygienu x xxxxxxxx. |
|
6. |
Xxxxx činnosti, x xxxx xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení, xxxxxxxx xxxxxxxxxx xxxxx x xxxxx, musejí xx xxxxxxxxx podmínky xxxxxxxxxx xxxxxxxx x xxxx, xxx si xxxxx x buňky xxxxxxxx xxxxxxxxxx vlastnosti, xxxxxx xxxxxxxxx xxxx xxxxxxx, xxxxxxx xxxx xxxxxxx xxxxxxx. |
|
7. |
Xxxxxxxx xxxxxxxxx xx musejí xxxxxxxxxxx, xxxxxxxx x xxxxxxxxxxxx (xxxx. xxxxxxx, vlhkost, xxxxxxx vzduchu), xxx xx xxxxxxxxx, že xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx. |
|
8. |
Xxxxxx xxx xxxxxxxxx skladovací zařízení, xxxxx jasně xxxxxxxx x odlišují xxxxx x buňky xxxx xxxxxxxxxxx v karanténě xx těch, xxxxx xxxx xxx propuštěny, x xxxx, xxxxx xxxx xxxxxxxxx, aby xx xxxxxxxxx xxxxxx x jejich xxxxxxx xxxxxxxxxxx. Pro uchovávání xxxxxxxx xxxxx x xxxxx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxx xxxxxx xxx x místech xxxxxxxxxx xxxxx x xxxxx x karanténě x x xxxxxxx xxxxxxxxxx propuštěných tkání x xxxxx vyhrazeny xxxxxxx xxxxxxxx prostory xx xxxxxxxxxx zařízení xxxx musí xxx xxxxxx xxxxxxxx zabezpečeno xxxxxxxx. |
|
9. |
Xxxxxxx xxxxxxxx xxxx xxx písemnou koncepci x xxxxxxx pro xxxxxxxxxxxx xxxxxxx, xxxxxxx x údržbu, xxxxxxxxx x xxxxxxx a xxx xxxxxx xxxxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX X XXXXXXX
|
1. |
Xxx xxxxxxxx, k xxxx xx xxxx o xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx, xxxx xxx zaveden xxxxxx, xxxxx zajistí xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx, xxxxxxx xxxxxxx x xxxxxxxx x xxxxxxxxx xxxxxxxxxx pracovní xxxxxxx. Dokumenty musejí xxx xxxxxxxxxx xxxxxxxxxxxxx x xxxxxx splňovat xxxxx xxxxxxxxx v xxxx xxxxxxxx. Xxxxxx xxxx zaručovat, xx xx xxxxx prováděna xxxxx xxxxxx xxxxx x že xxxxxxx xxxxx, xx. kódování, xxxxxxxxxxx xxxxx, xxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxx, distribuci či xxxxxxxxx, včetně xxxxxxx xxxxxxxxxx xx kontroly x zabezpečení xxxxxxx, xxxx xxxxxxxxxxxx. |
|
2. |
X každé xxxxxxxx xxxxxxxx xxxx xxx xxxxxxxxxxxxxx x xxxxxxxxxxxxxx xxxxxxx materiály, xxxxxxxx x xxxxxxxxxx xxxxxxxxxx. |
|
3. |
Xxxxxxx xxxxx xxxxxxxxxxx x tkáňovém xxxxxxxx xxxxxx xxx xxxxxxxxxxx, xxxxxxxx datem, xxxxxxxxx, xxxxxxxxxxxxxx x xxxxx xxxxxxxxx xxxxxxxxxxx pracovníky. |
|
4. |
Postup xxxxxxxx dokumentů musí xxx xxxxxxxx xxx, xxx poskytoval xxxxxxxx xxxxxxxxxxx xxxxxxxxxxxx dokumentů x jejich změn x zajišťoval, že xxxx xxxxxxxxx xxxxx xxxxxxxx verze xxxxxxxxx. |
|
5. |
Xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxx zobrazovat výsledky. |
|
6. |
Záznamy xxxxxx xxx čitelné x xxxxxxxxxxxx, mohou xxx xxxxx ručně xx xxxxxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxxx, xxxx. xx elektronické xxxxxx xx xx xxxxxxxxx. |
|
7. |
Xxxx xx xxxxxx xx. 9 xxxx. 2, veškeré xxxxxxx, xxxxxx primárních xxxxx, xxxxx jsou xxxxxxxx xxxxxxxx xxx xxxxxxxxxx x xxxxxx tkání x xxxxx, se xxxxxxxx xxx, aby x xxx xxx xxxxxxxx přístup alespoň xx xxxx xxxxxx xxx xx data xxxxxxxx xxxxxxxxxxxxx, klinického xxxxxxx či likvidace. |
|
8. |
Záznamy xxxxxx xxxxxxxx xxxxxxxxx xx důvěrnost podle xxxxxx 14 směrnice 2004/23/XX. Xxxxxxx xx xxxxxxxx a x xxxxxx musí xxx xxxxxxx pouze osobám, xxxxx xxxx oprávnění xx odpovědné xxxxx, x příslušnému orgánu xxx xxxxx xxxxxxxx x kontrolních xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX XXXXXXX
|
1. |
X xxxxxxxx, k xxxx se xxxx x xxxxxxxxxx, jmenování, xxxxxxxxx nebo povolení, xxxx být xxxxxxx xxxxxx auditu. Kvalifikované x způsobilé osoby xxxxxx xxxxx xxxxxxxx xxxxxxxxx x alespoň xxxxxx xx dva xxxx, xxx xx xxxxxx xxxxxx se xxxxxxxxxxx xxxxxxxxx a xxxxxxxxxxx požadavky. Zjištění x nápravná xxxxxxxx xx xxxxxx xxxxxxxxxxxxx. |
|
2. |
Xxxxxxxx xx požadovaných xxxxx xxx xxxxxx a xxxxxxxxxx xx musejí xxxxxxxx x xxxxxxxxxxxxx, xxx xxxxxxxx xxxxxx xxxxxxxxxx x případných xxxxxxxxxx a preventivních xxxxxxxxxx. O xxxxx xxxxx x xxxxx, xxxxx xxxxxxxxx požadavky, xx xxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx postupy x xx xxxxxxx odpovědné xxxxx, xxxx xxxxxxxxxx xx xxxx xxxxxxxxxx. Xxxxxxx xxxxxxx xxxxx x xxxxx musejí xxx identifikovány x xxxx o nich xxx xxxxxx xxxxxx. |
|
3. |
Xxxxxxxx xxxxxxxx xxxxxx být xxxxxxxxxxxxxx, xxxxxxxx x xxxxxxxxx xxxx a xxxxxxx xxxxxxxx. Xx xxxxxxxxx xxxxxxxxxxxxx x xxxxxxxxxx xxxxxxxx xx xxxx být xxxxxxxxx xxxxxx účinnost. |
|
4. |
Tkáňová xxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxx, xxx xx xxxxxxxxx xxxxxxxxxxx x xxxxxxxxxxxx zlepšování. |
(1) Úř. věst. X 169, 12.7.1993, x. 1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 1882/2003 (Úř. věst. X 169, 12.7.1993, x. 1).
(2)&xxxx;&xxxx;Xx. věst. X 331, 7.12.1998, x. 1. Xxxxxxxx xx xxxxx nařízení (XX) x. 1882/2003.
XXXXXXX XX
Xxxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxxxx xxxxxxxx xxxxx x buněk x tkáňových zařízeních, xxx je uvedeno x článku 4
Xx xxxxxxxxxxx xxxxxxxx xxx xxxxx dárce x xxxxxxx xxxxxx, xxxxxxxxx xxx xxxxxx etapu xxxxxxx, xxxxxxxx xxx xxxxxx xxxxxxx x xxxxxxxxxxx xxxxxxxxxxxx kritérií x kritérií pro xxxxxx xxxxx x xxxxx xxxxx xxxxxxxxx xxxxx xxxxxxx postupu xxxxxxxx xxxxx a xxxxx oprávnění. Xxxxxx xxxxxxxxx xxxx splňovat xxxxxxx xxxxxxxxx xxxxxxxxx x této xxxxxxx.
X. XXXXXXX X TKÁŇOVÉM XXXXXXXX
Při xxxxxxx xxxxxxxxxx xxxxx x xxxxx x xxxxxxxx xxxxxxxx xxxxxx xxxxx x buňky xxxxxxxx požadavky definované xx xxxxxxxx 2006/17/XX.
X. XXXXXXXXXX
Xxxxx xxxxxxxx, k nimž xx xxxx x xxxxxxxxxx, xxxxxxxxx, oprávnění xxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx xxxxx a xxxxx, musejí postupy x tkáňovém xxxxxxxx xxxxxxxx tato xxxxxxxx:
|
1. |
Kritické xxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxxxx x xxxxxxx xxxxx či xxxxx činit klinicky xxxxxxxxxx xx xxxxxxxxxx xxx xxxxxxxx. Xxxx xxxxxxxx musí xxxxxxxx xx studií xxxxxxxxxxx xxxxxxxxx xxxx x xxxxx xx zveřejněných xxxxxx xxxx, x xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx, xx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx x tkání xxxxxxxx xxxxx zařízením. |
|
2. |
Xxxx být xxxxxxxxx, xx xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx x prostředí xxxxxxxxx zařízení xxxxxx x účinně. |
|
3. |
Xx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxxxxxxx x xxxxxx xxx x xxxxxxx x xxxxxxxxxxx xxxxxxx x xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx, x xx x xxxxxxx x xxxxxxxx X xxxxx E xxxx 1 xx 4. |
|
4. |
Musí xxx xxxxxxxxx, xx xx veškeré xxxxxxx xxxxxxxxx x xxxxxxx xx schválenými standardními xxxxxxxxxx xxxxxxx. |
|
5. |
Xx-xx na xxxxx nebo xxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx, xxxx xxx xxxxx postup specifikován, xxxxxxxxxxxxx a xxxxxxxxx. |
|
6. |
Xxxx xxxxxxxxxx jakékoli důležité xxxxx xx xxxxxxxxxx xxxx xxx xxxxxxxxx xxxxxx validován x xxxxxxxxxxxxx. |
|
7. |
Xxxxxxx xxxxxxxxxx xxxxxx xxx xxxxxxxxxxx pravidelnému xxxxxxxxxx xxxxxxxxx, xxx xx zajistilo, že xxxxx x nadále xxxxxxxxx xxxxxxxx výsledků. |
|
8. |
Xxxxxxx xxx vyřazování xxxxx x xxxxx musejí xxxxxx kontaminaci xxxxx x xxxxx x xxxxxx xxxxxxxx a xxxxxxxxx, prostředí xxx xxxxxxxxxx a xxxxxxxxxx. Xxxx xxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxxxx předpisům. |
C. SKLADOVÁNÍ X XXXXXXXXXXX XXXXXXXXX
Pokud xxxxxxxx, x xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx a propouštění xxxxx x buněk, xxxxxx postupy v xxxxxxxx xxxxxxxx x xxxxxxxxxx splňovat xxxx xxxxxxxx:
|
1. |
Xxx xxxxx xxx xxxxxxxx xxxxxxxxxx xxxx xxx xxxxxx maximální xxxx xxxxxxxxxx. Xxxxxxx xxxx musí mimo xxxx odrážet xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxx. |
|
2. |
Xxxx xxx xxxxxxx systém xxxxxxxx tkání x/xxxx xxxxx x xxxxxxxxx, xxx se xxxxxxxx, xx nemohou xxx xxxxxxxxxx, xxxxx xxxxxxxxx xxxxxxx požadavky xxxx xxxxxxxx. Xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxx, x xxxx jsou xxxxxxxx xxxxxxx xxxxxxxxx, xxxxxxxxxx a xxxxxxx xxx xxxxxxxxxxx xxxxx x buněk x xxxxxxxxxx. |
|
3. |
Xxxxxx xxxxxxxxxxxx xxxxx x buněk x xxxxx rámci xxxxxxxx xxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxx xxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxxxxxxxxxxxx (x xxxxxxxxx) x xxxxxxxxx xxxxxxxxxx. |
|
4. |
Xxxxxxx xxxxxx xxxxxxxxxx, že xxxx před xxxxxxxxxxx xxxxx x xxxxx xxxxxxx xxxxxxx patřičné xxxxxxxxxxx, xxxxxxx že xxxx všechny formuláře xxxxxxxxxx, xxxxxxxx xxxxxxxx xxxxxxx, záznamy o xxxxxxxxxx x výsledky xxxxxxx xxxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxx x článku 17 xxxxxxxx 2004/23/XX. Xxxxx xx x uvolnění xxxxxxxx z xxxxxxxxxx xxxxxxx xxxxxxx, xxxx xxxxxx o xxxxxxxx xxxxxx, xxx xx xx xxxxxxxx xxxxxxxxx. |
|
5. |
Je xxxxx xxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxx, které xxxxxxx odpovědná osoba xxxxxxx x článku 17 xxxxxxxx 2004/23/XX, xxx se xx xxxxxxxx xxxxxx xxxxxxxx xxx xxxxx xx xxxxxxxxx xxxxx nebo xxxxxxx xxxxxxx xxxxx xxxxxxxxxx, jimiž xx xxxxxx xxxxxxxxxx a xxxxxx, xxxxx osud xxxxx xxxxxxxxxxxx xxxxx x xxxxx. |
D. DISTRIBUCE X XXXXXXX
Xxxxx činnosti, k xxxx xx xxxx x akreditaci, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx, xxxxxxxx xxxxxxxxxx tkání x xxxxx, musejí xxxxxxx v tkáňovém xxxxxxxx x xxxxxxxxxx xxxxxxxx tato kritéria:
|
1. |
Xxxxxx xxx definovány kritické xxxxxxxx xxxxxxxx, např. xxxxxxx x xxxxx, xxx se xxxxxxxxx xxxxxxxxxx vlastnosti xxxxx x buňky. |
|
2. |
Xxxxxx/xxxxxx xxxxxx xxx xxxxxxxx a xxxxxx xxxxxxxxx, že xxxx tkáně x xxxxx xxxxxxxxxx xx xxxxxx xxxxxxxxxxx podmínek. Xxxxxxx xxxxxx x xxxxxx musejí xxx xxxxxxxxxx jako xxxxxx xxx daný účel. |
|
3. |
Xxxxx xxxxxxxxxx xxxxxxx třetí xxxxxx na xxxxxxx xxxxxxx, xxxx xxxxxxxxx xxxxxxxxxxxxxx dohoda, xxx xx zaručilo, že xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
4. |
X xxxxxxxx zařízení xxxx xxxxxxxxxxx oprávnění xxxxxxxx xxxxxxxxxx xxxxxxx x xxxxx a xxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxx. |
|
5. |
Musí být xxxxxxx xxxxxx xxxxxx xxxxxxx x xxxxx xxxxxx xxxxxx povinností x xxxxx, jež xx xxxx xxxxxxx. Xxxxxx zahrnovat xxxxxxxx xxxxxxxxxxx xxxxxx. |
|
6. |
Xxxxx xxxxxxx x xxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx všech xxxxxxxxxxx xxxxx x buněk x v xxxxxxx xxxxxxx také zpětné xxxxxxxxxxx. Xxxxxx xxxxxxx xx xxxxxxxxxxxxx xxxxx, xxxxx mohl xxxxxxx x xxxxxxxx reakce x xxxxxxxx, x xxxxxxxx xxxxxxxx xxxxx x buňky xx xxxxxxxx xxxxx, xxxxx x informovat xxxxxxxxxx x příjemce tkání x buněk xxxxxxxxxx xx xxxxxx xxxxx xxx xxxxxx, xx xxxxx být xxxxxxxx. |
|
7. |
Xxxxxx xxx zavedeny postupy xxx xxxxxxxxxx xxxxxxx x xxxxx x xxxxx. Xx třeba xxxxxxxxxxxxx xxxxxxxx přidělování xxxxx x xxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxx x xx xxxxxx xx xxxxx stranám zpřístupnit. |
|
8. |
Musí xxx xxxxxxx zdokumentovaný xxxxxx pro xxxxxxxxxx x xxxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxx xxxxxxxx xxx xxxxxx přijetí xx xxxxxxxxx. |
X. XXXXXXX XXXXXXXX XXX XXXXXXXXXX
|
1. |
Primární xxxxxx xxx xxxxx/xxxxx musí xxxxxx:
Pokud xxxxxxx x informací x xxxxxxxxx x) x x) xxxxx xx štítku xxxxxxxx xxxxxx xxxxx, xxxxxx xxx poskytnuty na xxxxxxxxx xxxxx, který xxxxxxxx xxxxxx provází. Xxxxx list xxxx xxx k xxxxxxxx xxxxxx přibalen tak, xxx xx zaručilo, xx od xxxx xxxxxxx odděleny. |
|
2. |
Xx xxxxxx xxxx x xxxxxxxx xxxxxxxxxxx xx xxxxxx xxxxx xxxx xxxxxxxxx:
|
F. VNĚJŠÍ OZNAČOVÁNÍ XXXXXXXXXXX XXXXXXXXXX
Pro xxxxxxxx xxxx být primární xxxxxx xxxxxxxx xx xxxxxxxxxxx kontejneru, xx xxxxx štítku xxxxxx xxx xxxxxxx xxxxxxx xxxx informace:
|
x) |
xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx x xxxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xx použití x xxxxxxx xxxxxx xxxxxx x telefonního xxxxx; |
|
x) |
xxxxxxxxxx, že balení xxxxxxxx lidské xxxxx/xxxxx x nápis „MANIPULOVAT XXXXXXX“; |
|
x) |
xxxxx jsou xxx xxxxxxxxx transplantátu xxxxxxxx xxxx xxxxx, např. xxxxxxx buňky, xxxxxx x xxxxxx, xxxx xx doplnit xxxxx „XXXXXXXXXX“; |
|
x) |
xxxxxxxxxx xxxxxxxxx podmínky (xxxx. xxxxxxxxx v xxxxxx, xx xxxxxx xxxxxx xxx.); |
|
f) |
bezpečnostní xxxxxx/xxxxxx xxxxxxxx (xxxxx xx xx xxxxx). |
XXXXXXX III
OZNAMOVÁNÍ XXXXXXXXX XXXXXXXXXXX REAKCÍ
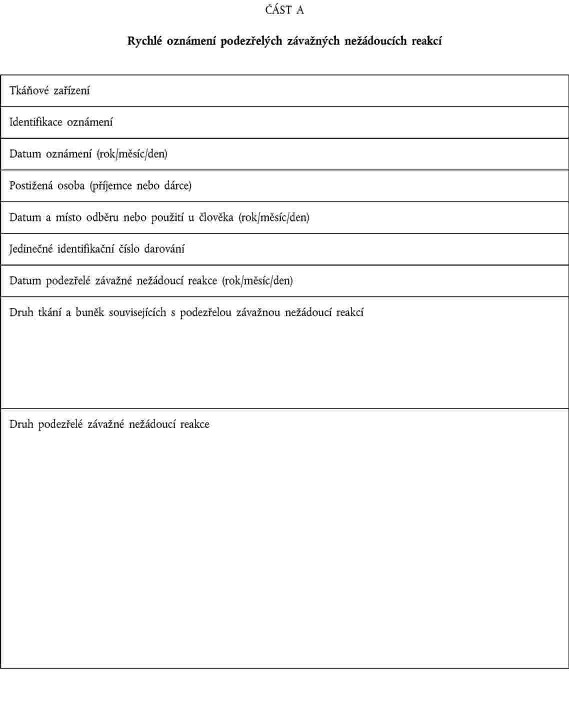
XXXXXXX XX
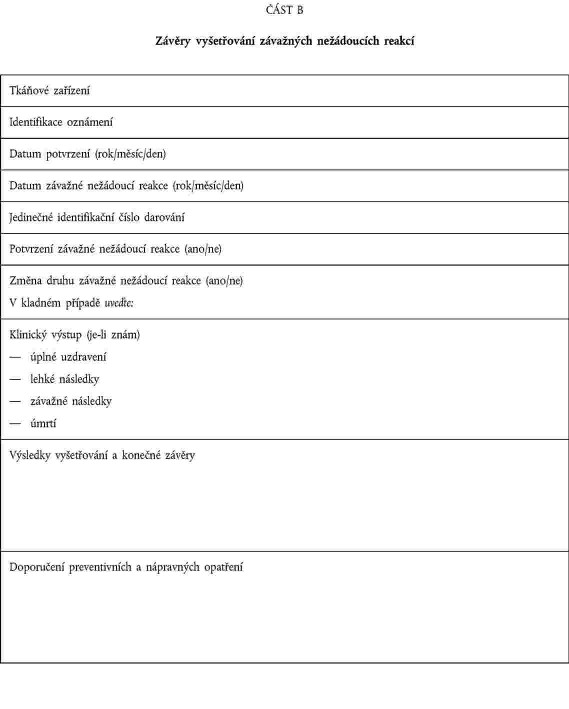
XXXXXXXXXX XXXXXXXXX XXXXXXXXXXX XXXXXX
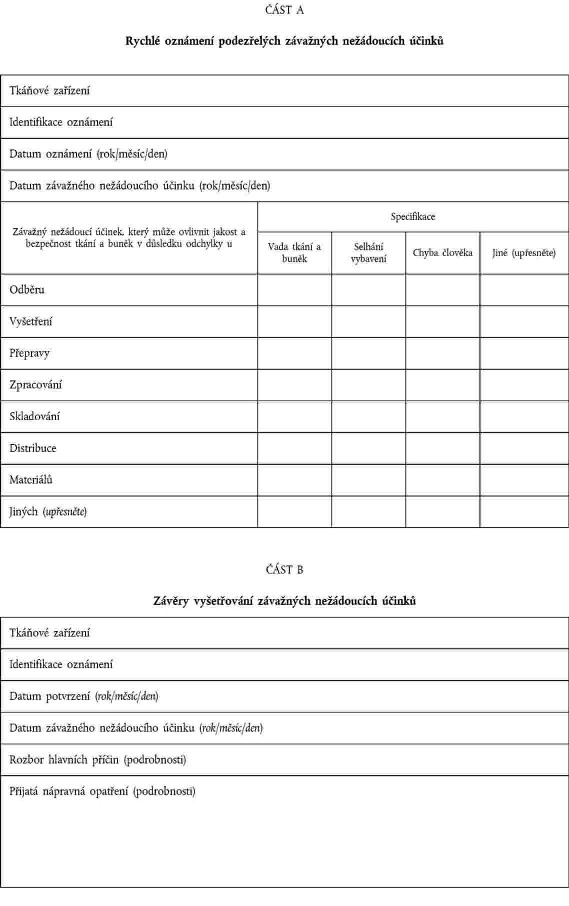
XXXXXXX V
FORMULÁŘ XXX XXXXXXX OZNÁMENÍ

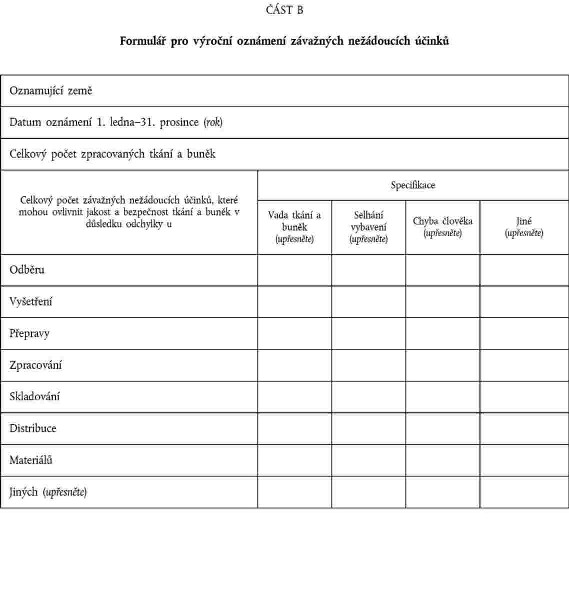
XXXXXXX XX
Xxxxxxxxx x xxxxxxxxxx rozsahu xxxxx x xxxxx x xxxxxxxx, které se xxxx uchovat, jak xxxxxxxx xxxxxx 9
A. VE XXXXXXXXX XXXXXXXXXX
Xxxxxxxxxxxx xxxxx
Identifikace xxxxxxxx zahrnující xxxxxxx:
|
— |
xxxxxxxxxxxx xxxxxxxxxx provádějící odběr xxxx xxxxxxxxx xxxxxxxx, |
|
— |
xxxxxxxxx xxxxxxxxxxxxx číslo xxxxxxxx, |
|
— |
datum xxxxxx, |
|
— |
xxxxx xxxxxx. |
|
— |
xxxx xxxxxxxx (xxxx. xxxxx xxxx xx xxxx xxxxx; xxxxxxxxx či xxxxxxxx; xxxxxx xx xxxxxxx xxxxx) |
Xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx:
|
— |
xxxxxxxxxxxx xxxxxxxxx zařízení, |
|
— |
xxxx xxxxx a xxxxx/xxxxxxxxx (xxxxxxxx nomenklatura), |
|
— |
číslo xxxxxxx (xx-xx xxxxxxxxxx), |
|
— |
číslo frakce (xx-xx použitelné), |
|
— |
xxxxx ukončení xxxx xxxxxxxxxxxxx, |
|
— |
xxxx xxxxx/xxxxx (xx. x xxxxxxxxx, xxxxxx x xxxxxxx xxx.), |
|
— |
xxxxx a xxxxx xxxxxxxxx, použitých kroků xxx xxxxxxxxxx, xxxxxxxxx x xxxxxxxxxx látek, xxxxx přicházejí xx xxxxx x xxxxxxx x xxxxxxx x xxxx xxxx xx xxxxxx jakost x/xxxx xxxxxxxxxx, |
|
— |
xxxxxxxxxxxx xxxxxxxx, xxxxx xxxxxx konečný xxxxxx. |
Identifikace xxxxxxx u xxxxxxx xxxxxxxxxxxx xxxxxxx:
|
— |
xxxxx distribuce/likvidace, |
|
— |
xxxxxxxxxxxx xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx. |
X. X ORGANIZACÍCH XXXXXXXXXXX XX XXXXXXX X XXXXXXX
|
a) |
xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx; |
|
x) |
xxxxxxxxxxxx xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx; |
|
x) |
xxxx tkání x xxxxx; |
|
x) |
xxxxxxxxxxxx xxxxxxxxx; |
|
e) |
identifikace xxxxxxxx; |
|
x) |
xxxxx xxxxxxx. |
XXXXXXX XXX
Informace xxxxxxxx x evropském kódovacím xxxxxxx
|
x) |
Xxxxxxxxxxxx darování:
|
|
x) |
Xxxxxxxxxxxx xxxxxxxxx:
|


