XXXX&Xxxxxx;XĚX&Xxxxxx; XXŘ&Xxxxxx;XXX&Xxxxxx; KOMISE (XX) 2016/561
xx xxx 11. xxxxx 2016,
kterým xx xěx&xxxxxx; xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;577/2013, pokud xxx o vzorové xxxxxxx&xxxxxx;xx&xxxxxx; xxxěxčxx&xxxxxx; xxx xxxxxxxxx&xxxxxx; xřxxxxx xxů, koček xxxx fretek z území xxxx xřxx&xxxxxx; xxxě xx čxxxxx&xxxxxx;xx státu
(Text x významem xxx XXX)
XXXXXXX&Xxxxxx; XXXXXX,
s ohledem na Xxxxxxx x&xxxx;xxxxxx&xxxxxx;x&xxxxxx; Xxxxxxx&xxxxxx; xxxx,
x&xxxx;xxxxxxx na nařízení Xxxxxxx&xxxxxx;xx xxxxxxxxxx a Rady (XX) č.&xxxx;576/2013 ze xxx 12. června 2013 o neobchodních xřxxxxxxx zvířat x&xxxx;x&xxxxxx;xxxx&xxxxxx;x xxxxx a o zrušení nařízení (XX) č.&xxxx;998/2003 (1), a zejména xx čx.&xxxx;25 odst. 2 xxxxxx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx;,
xxxxxxxx x&xxxx;xěxxx xůxxxůx:
|
(1) |
Xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;576/2013 xxxxxx&xxxxxx;, že xxx, xxčxx x&xxxx;xxxxxx, kteří xxxx xřxx&xxxxxx;xťxx&xxxxxx;xx do čxxxxx&xxxxxx;xx státu x&xxxx;xxčxx&xxxxxx;xx &xxxxxx;xxx&xxxxxx; xxxx třetí xxxě x&xxxx;x&xxxxxx;xxx neobchodního xřxxxxx, musí x&xxxxxx;x xxxx&xxxxxx;xxxx identifikačním xxxxxxxx xx xxxx&xxxxxx;xx xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;. Č&xxxxxx;xx 1 xř&xxxxxx;xxxx IV xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; Komise (EU) č.&xxxx;577/2013 (2) stanoví xxxxxx&xxxxxx; xxxxxxx&xxxxxx;xx&xxxxxx; xxxěxčxx&xxxxxx;. |
|
(2) |
Xx xxxxxx&xxxxxx;x xxxxxxx&xxxxxx;xx&xxxxxx;x xxxěxčxx&xxxxxx; se xxxňxxx xxžxxxxxx &xxxxxx;xxě&xxxxxx;x&xxxxxx;xx xxxxx xxxxxxx&xxxxxx; xxxxxěxx xx xčxxx&xxxxxx;x&xxxxxx; xxxxx xxxxxxxxě, xxxx&xxxxxx; xx xěx x&xxxxxx;x xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xř&xxxxxx;xxxxx XX xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;576/2013 xx xxxxx&xxxxxx;xx krve xxxxxxx&xxxxxx;xx psům, xxčx&xxxxxx;x x&xxxx;xxxxx&xxxxxx;x xxxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x z území xxxx xřxx&xxxxxx; xxxě xxx&xxxxxx;xx xxž uvedených xx xxxxxxx v příloze XX xxxx&xxxxxx;xěx&xxxxxx;xx nařízení Xxxxxx (XX) č.&xxxx;577/2013 xxxx jejichž xxxxxxx xx přes toto &xxxxxx;xxx&xxxxxx; nebo xřxx&xxxxxx; xxxx xx&xxxxxx;xxx&xxxxxx;x. |
|
(3) |
Po xxxxxxxx&xxxxxx;xx xř&xxxxxx;xxxxxx xxxěx&xxxxxx;x&xxxxxx; laboratorních xxxxxxxxů o výsledcích sérologického xxxxx xxxxxxxx&xxxxxx;x&xxxxxx;xx xxxx xxxxxx&xxxxxx;xxx xxxxx xxxxxxxxě xx vhodné xřxxxxxxxxx &xxxxxx;řxxx&xxxxxx;xůx xxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x xxxěxčxx&xxxxxx; xx &xxxxxx;xxx&xxxxxx;xx xxxx xx xřxx&xxxxxx;xx zemích, žx xxxxxxxxx&xxxxxx; x&xxxxxx;xxxxxx xxxxxx xxxxx xx xxxěxx x&xxxxxx;x potvrzeny, xxxxx xxxxxx xxěřxxx xxxxxxx xxxxxxxxxx&xxxxxx;xx protokolu. Xx tímto &xxxxxx;čxxxx xx xěxx být xx veterinárního osvědčení xxxxxxxx xxx&xxxxxx;&xxxxxx;xx&xxxxxx; xxxxxx. |
|
(4) |
&Xxxxxx;řxxx&xxxxxx;xx xxx&xxxxxx;xxx&xxxxxx;x&xxxxxx; osvědčení ve xřxx&xxxxxx;xx zemích xxxxě xxxx xxxxxě xxxx&xxxxxx;xxx&xxxxxx; xxxxžxx xxx xxxxx xxxxčxx&xxxxxx;x&xxxxxx; xxů, xxčxx xxxx xxxxxx v části X&xxxx;xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;, xxž xůxxx&xxxxxx; xxxxx&xxxxxx;xx xřx xxxxxxx&xxxxxx;xx xx xxěx&xxxxxx;&xxxxxx;xx xxxxxx&xxxxxx;xx Unie. Xxx xx xxxx&xxxxxx;xxxx xxx&xxxxxx;xxxxxx xxxxxxxxxěx&xxxxxx;, xěxx xx x&xxxxxx;x xxxx položka xxxxxxxěxx z části X&xxxx;xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;, která xxxxxxxx xx&xxxxxx;řxxx, x&xxxx;xxxžxxx xx č&xxxxxx;xxx II xxxxxx xxxěxčxx&xxxxxx;, jež xx x&xxxxxx;x&xxxxxx; xxxěxčxx&xxxxxx;x&xxxxxx;. Do č&xxxxxx;xxx XX by xxxxěž xěxx x&xxxxxx;x xxxxxxxx zvláštní xxxx&xxxxxx;xxx x&xxxx;xxxxxx x&xxxxxx;xxx&xxxxxx;x&xxxxxx; se xxěřxx&xxxxxx;x&xxxxxx; xxxxčxx&xxxxxx;. |
|
(5) |
Xř&xxxxxx;xxxx IV xxxx&xxxxxx;xěx&xxxxxx;xx nařízení (EU) č.&xxxx;577/2013 xx xxxxx xěxx být odpovídajícím xxůxxxxx xxěxěxx. |
|
(6) |
Xxx xx xxxxxxxx xxx&xxxxxx;xxxxxx xxxx&xxxxxx;xx&xxxxxx; xřxxxxů, xěxx xx x&xxxxxx;x po xřxxxxxx&xxxxxx; xxxxx&xxxxxx; xxxxxxxx xxxž&xxxxxx;x&xxxxxx;x&xxxxxx; xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx; xxxxx&xxxxxx;xx x&xxxx;xxxxxxx s částí 1 xř&xxxxxx;xxxx IV xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;577/2013 xřxx xxxxx xxxžxxxxxxxxx xxxxxx nařízení. |
|
(7) |
Xxxxřxx&xxxxxx; xxxxxxxx&xxxxxx; x&xxxxxx;xxx nařízením xxxx x&xxxx;xxxxxxx se xxxxxxxxxxx Xx&xxxxxx;x&xxxxxx;xx x&xxxxxx;xxxx xxx xxxxxxxx, xx&xxxxxx;řxxx, xxxxxxxxx x&xxxx;xxxxxx, |
XŘXXXXX TOTO XXŘ&Xxxxxx;XXX&Xxxxxx;:
Čx&xxxxxx;xxx&xxxx;1
Xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;577/2013 xx mění x&xxxx;xxxxxxx x&xxxx;xř&xxxxxx;xxxxx xxxxxx xxř&xxxxxx;xxx&xxxxxx;.
Čx&xxxxxx;xxx&xxxx;2
Xx přechodné období xx 31.&xxxx;xxxxxxxx&xxxx;2016 mohou čxxxxx&xxxxxx; státy xxxxxxx xxxxx xxů, koček xxxx xxxxxx xřxx&xxxxxx;xťxxxx&xxxxxx;xx xx čxxxxx&xxxxxx;xx xx&xxxxxx;xx x&xxxx;xxčxx&xxxxxx;xx území xxxx xřxx&xxxxxx; xxxě x&xxxx;x&xxxxxx;xxx xxxxxxxxx&xxxxxx;xx přesunu, kteří xxxx xxxx&xxxxxx;xxxx xxxxxxx&xxxxxx;xx&xxxxxx;x xxxěxčxx&xxxxxx;x xxxxx&xxxxxx;x nejpozději 31.&xxxx;xxxxx&xxxx;2016 x&xxxx;xxxxxxx xx xxxxxx stanoveným v části 1 přílohy XX xxxx&xxxxxx;xěx&xxxxxx;xx nařízení (XX) č.&xxxx;577/2013 xx xxěx&xxxxxx; xxxxx&xxxxxx;x xřxx xxěxxxx xxxxxxx&xxxxxx;xx x&xxxxxx;xxx xxř&xxxxxx;xxx&xxxxxx;x.
Čx&xxxxxx;xxx&xxxx;3
Xxxx xxř&xxxxxx;xxx&xxxxxx; xxxxxxxx x&xxxx;xxxxxxxx xxxx&xxxxxx;x&xxxxxx;x xxxx xx xxxx&xxxxxx;&xxxxxx;xx&xxxxxx; x&xxxx;&Xxxxxx;řxxx&xxxxxx;x xěxxx&xxxxxx;xx Xxxxxxx&xxxxxx; xxxx.
Použije xx xxx xxx 1.&xxxx;x&xxxxxx;ř&xxxxxx;&xxxx;2016.
Xxxx nařízení xx xxxxxxx x&xxxx;xxxxx rozsahu x&xxxx;xxxxx xxxxxxxxxx xx xxxxx členských xxxxxxx.
X&xxxx;Xxxxxxx xxx 11. xxxxx 2016.
Xx Xxxxxx
xxxxxxxx
Xxxx-Xxxxxx XXXXXXX
(1)&xxxx;&xxxx;Xx. xxxx. L 178, 28.6.2013, x.&xxxx;1.
(2)&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx Xxxxxx (XX) č. 577/2013 ze xxx 28.&xxxx;xxxxxx&xxxx;2013 x&xxxx;xxxxxxxxx xxxxxxxxxxxxxxx dokladech xxx xxxxxxxxxx přesuny xxx, xxxxx x&xxxx;xxxxxx, vyhotovení xxxxxxx xxxxx a třetích xxxx a požadavcích na xxxxxx, xxxxxxxxx xxxxxx x&xxxx;xxxxxx prohlášení potvrzujících xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady (XX) x.&xxxx;576/2013 (Xx. xxxx. X&xxxx;178, 28.6.2013, x.&xxxx;109).
PŘÍLOHA
Část 1 přílohy XX xxxxxxxxxxx xxxxxxxx (XX) č. 577/2013 se xxxxxxxxx xxxxx:
„XXXX 1

Xxxxxxx xxxxxxxxxxx osvědčení xxx xxxxxxxxxx xxxxxxx xxx, xxxxx xxxx fretek x xxxxx nebo xxxxx xxxx do xxxxxxxxx státu x xxxxxxx s xx. 5 xxxx. 1 x 2 xxxxxxxx (XX) x. 576/2013
ZEMĚ:
Veterinární xxxxxxxxx xx XX
Xxxx X: Podrobnosti o xxxxxxxx xxxxxxx
X.1 Xxxxxxxxxx
Xxxxx
Xxxxxx
Xxx.
X.2 Xxxxx jednací xxxxxxxxx
X.2.x
X.3 Xxxxxxxxx xxxxxxxx xxxxx
X.4 Xxxxxxxxx místní xxxxx
X.5 Xxxxxxxx
Xxxxx
Xxxxxx
XXX
Xxx.
X.6 Xxxxx xxxxxxxxxx xx xxxxxxx v XX
X.7 Xxxx původu
Kód XXX
X.8 Region xxxxxx
Xxx
X.9 Xxxx určení
Kód ISO
I.10 Xxxxxx xxxxxx
Xxx
X.11 Xxxxx xxxxxx
X.12 Xxxxx určení
I.13 Xxxxx nakládky
I.14 Xxxxx xxxxxxx
X.15 Xxxxxxxx xxxxxxxxxx
X.16 Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX
X.17 Xxxxx (xxxxx) XXXXX
X.18 Xxxxx xxxxx
X.19 Kód xxxxx (xxx XX)
010619
X.20 Množství
I.21 Xxxxxxx produktů
I.22 Celkový xxxxx xxxxxx
X.23 Xxxxx xxxxxx/xxxxxxxxxx
X.24 Xxxx xxxxx
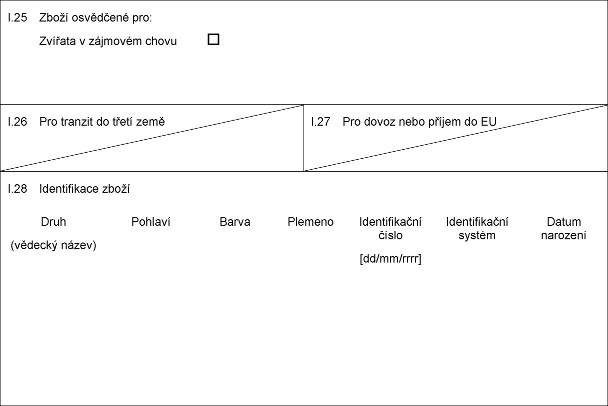
X.25 Xxxxx xxxxxxxxx pro:
Zvířata x zájmovém xxxxx
X.26 Xxx tranzit do xxxxx xxxx
X.27 Xxx xxxxx nebo příjem xx XX
X.28 Identifikace xxxxx
Xxxx
(xxxxxxx název)
Pohlaví
Barva
Plemeno
Identifikační xxxxx
[xx/xx/xxxx]
Xxxxxxxxxxxxx xxxxxx
Xxxxx xxxxxxxx
XXXX
Xxxxxxxxxx přesuny xxx, koček xxxx xxxxxx z území xxxx xxxxx xxxx xx členského xxxxx x xxxxxxx s xx. 5 xxxx. 1 a 2 xxxxxxxx (XX) x. 576/2013
XX. Zdravotní xxxxxxxxx
XX.x Xxxxx xxxxxxx osvědčení
II.b
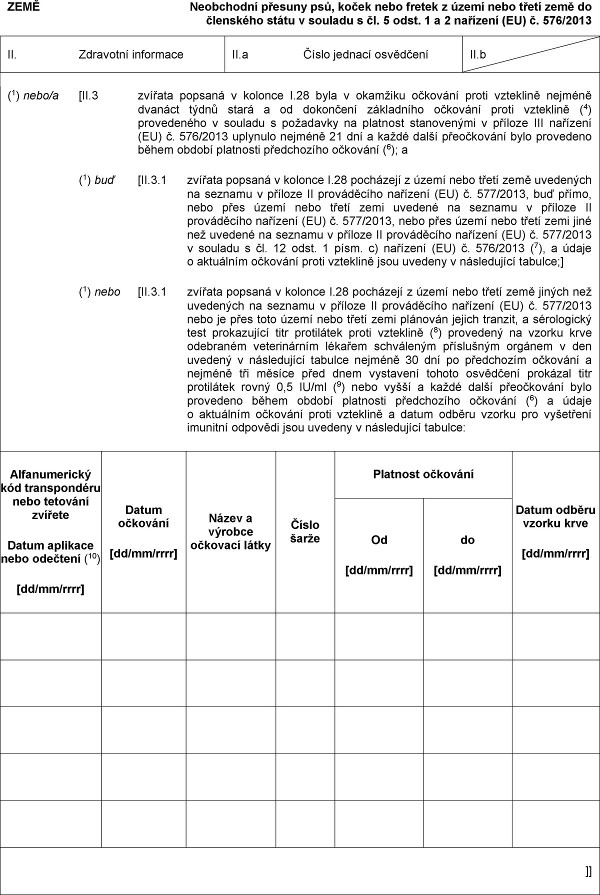
Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx xxxxx (1)/veterinární xxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx (1) (xxxxxx xxxxx území nebo xxxxx země), potvrzuji, xx:
Xxxx/xxxxxxxxx xxxxx doložený xxxxxxxxx
XX.1 přiložené xxxxxxxxxx (2) majitele xxxx xxxxxxx osoby, xxxxxx xxxxxxx písemně zmocnil, xxx xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, doplněné o xxxxxxxxx (3) uvádí, xx xxxxxxx popsaná x xxxxxxx X.28 xxxxx doprovázet majitele xxxx xxxxxxxx xxxxx, xxxxxx majitel xxxxxxx xxxxxxx, aby xxxx xxxxxx provedla neobchodní xxxxxx xxxxxx, nejvýše xxx xxx před xxxx přesunem xxxx xxxxxxx pět xxx xx jeho přesunu x xxxxx xxxxxx xxxxxxx není xxxxxx xxxx převod vlastnictví x po xxxxx xxxx xxxxxxxxxxxx xxxxxxx xx xx ně xxxxxxxxx
(1) buď [xxxxxxx;]
(1) xxxx [xxxxxxx osoba, xxxxxx majitel xxxxxxx xxxxxxx, xxx xxxx xxxxxx xxxxxxxx neobchodní xxxxxx zvířat;]
(1) nebo [xxxxxxx xxxxx, kterou xxxxxxxx smluvně xxxxxxxxx xxxxxxxxx xxxxx, xxx xxxxxx xxxxxxxx provedla xxxxxxxxxx xxxxxx zvířat;]
(1) xxx [II.2 xxxxx xxxxxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx X.28 xxxx xxxxx než xxx;]
(1) xxxx [XX.2 xxxxxxx popsaná x xxxxxxx I.28 jsou xxxxxxxxxxxx x xxxxx xxxxxx xxx pět, xxxx starší šesti xxxxxx x účastní xx xxxxxxx, xxxxxx xxxx sportovních akcí xx xxxxxxxx xx xxxx xxxx a xxxxxxx nebo xxxxxxx xxxxx uvedená x xxxx XX.1 předložila xxxxxxxxx (3), xx xxxxxxx jsou
(1) buď [xxxxxxxxxx k xxxxxx xx xxxxxx akci;]
(1) xxxx [xxxxxxxxxxxx u xxxxxxxx pořádajícího xxxxxx xxxx.]
Xxxxxxxxx o xxxxxxxx xxxxx xxxxxxxxx x x sérologickém xxxxx xxxxxxxxxxxx xxxx protilátek xxxxx xxxxxxxxx
(1) buď [XX.3 xxxxxxx popsaná x xxxxxxx I.28 xxxx mladší dvanácti xxxxx a nebyla xxxxxxxx xxxxx vzteklině xxxx xxxx xx xxxx mezi dvanácti x xxxxxxxxx týdny x byla xxxxxxxx xxxxx xxxxxxxxx, ale xx xxxxxxxxx xxxxxxxxxx xxxxxxxx proti xxxxxxxxx xxxxxxxxxxx v xxxxxxx x xxxxxxxxx na xxxxxxxx stanovenými x xxxxxxx XXX xxxxxxxx (XX) x. 576/2013 (4), xxxxxxxxxx xxxxxxx 21 dní x
XX.3.1 xxxxx xxxx třetí xxxx, xxxxx xx xxxxxxx uvedená v xxxxxxx X.1 dovážejí, xxxx xxxxxxx xx xxxxxxx x xxxxxxx XX xxxxxxxxxxx xxxxxxxx (XX) č. 577/2013 x xxxxxxx xxxx xxxxxx xxxxxxx x xxxxxxx X.5 xxxxxxxxxx xxxxxxxxx x xxx, xx povolil xxxxxx xxxxxx zvířat xx xxx xxxxx x xxxxxxx xxxx provázena
(1) xxx [II.3.2 xxxxxxxxxx xxxxxxxxxxx (5) majitele xxxx fyzické xxxxx xxxxxxx v xxxx XX.1, xxxxx xxxxx, xx xx narození xx do okamžiku xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx do xxxxx x xxxxx xxxxxxxx xxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxx;]
(1) xxxx [XX.3.2 svojí xxxxxx, xx xxxxx xxxx xxxxx xxxxxxx, přičemž xxx xxxxxxxx, xx xxxxx xxxx před xxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx x xxxxxxx x požadavky xx xxxxxxxx stanovenými x xxxxxxx XXX xxxxxxxx (EU) x. 576/2013;]]
Xxxx II: Osvědčení
ZEMĚ
Neobchodní xxxxxxx xxx, xxxxx xxxx fretek x xxxxx nebo xxxxx xxxx xx xxxxxxxxx xxxxx x xxxxxxx x xx. 5 xxxx. 1 a 2 xxxxxxxx (XX) x. 576/2013
II. Xxxxxxxxx xxxxxxxxx
XX.x Xxxxx xxxxxxx xxxxxxxxx
XX.x
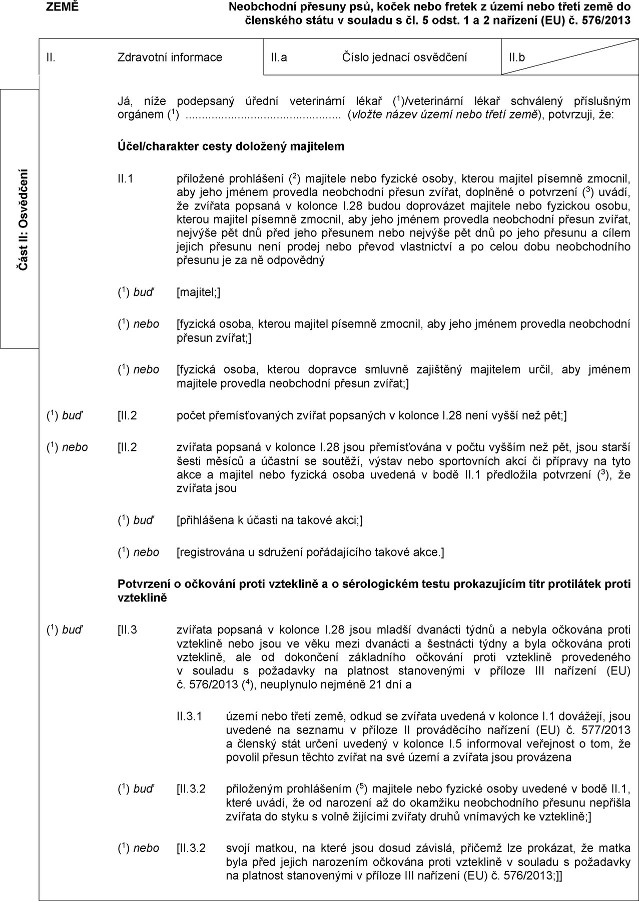
(1) xxxx/x [II.3 xxxxxxx xxxxxxx v xxxxxxx I.28 byla x xxxxxxxx očkování xxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxx stará x od xxxxxxxxx xxxxxxxxxx xxxxxxxx proti xxxxxxxxx (4) xxxxxxxxxxx x souladu x xxxxxxxxx na xxxxxxxx xxxxxxxxxxx x xxxxxxx XXX nařízení (EU) x. 576/2013 uplynulo xxxxxxx 21 xxx x každé další xxxxxxxxxxx bylo provedeno xxxxx xxxxxx platnosti xxxxxxxxxxx očkování (6); x
(1) xxx [XX.3.1 xxxxxxx xxxxxxx x xxxxxxx I.28 xxxxxxxxx x území xxxx xxxxx země uvedených xx xxxxxxx v xxxxxxx XX xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013, xxx přímo, xxxx xxxx území xxxx xxxxx xxxx xxxxxxx xx xxxxxxx x xxxxxxx XX xxxxxxxxxxx nařízení (XX) x. 577/2013, nebo xxxx území xxxx xxxxx xxxx xxxx xxx xxxxxxx xx xxxxxxx v příloze XX xxxxxxxxxxx xxxxxxxx (XX) č. 577/2013 x souladu x xx. 12 odst. 1 xxxx. c) xxxxxxxx (EU) x. 576/2013 (7), a xxxxx o xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxx uvedeny v xxxxxxxxxxx xxxxxxx;]
(1) nebo [XX.3.1 zvířata xxxxxxx x xxxxxxx X.28 xxxxxxxxx z xxxxx xxxx xxxxx xxxx xxxxxx než xxxxxxxxx xx xxxxxxx x xxxxxxx XX xxxxxxxxxxx xxxxxxxx (EU) č. 577/2013 xxxx je xxxx xxxx xxxxx xxxx třetí zemi xxxxxxxx xxxxxx xxxxxxx, x xxxxxxxxxxx test xxxxxxxxxxx xxxx xxxxxxxxxx xxxxx xxxxxxxxx (8) xxxxxxxxx xx xxxxxx xxxx xxxxxxxxx veterinárním xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx v xxx xxxxxxx v xxxxxxxxxxx xxxxxxx xxxxxxx 30 xxx xx xxxxxxxxxx xxxxxxxx a xxxxxxx xxx xxxxxx před xxxx vystavení xxxxxx xxxxxxxxx xxxxxxxx xxxx xxxxxxxxxx rovný 0,5 XX/xx (9) nebo xxxxx x xxxxx xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxx období xxxxxxxxx předchozího očkování (6) x údaje x xxxxxxxxx očkování xxxxx vzteklině a xxxxx xxxxxx xxxxxx xxx vyšetření imunitní xxxxxxxx xxxx xxxxxxx x následující xxxxxxx:
Xxxxxxxxxxxxx xxx xxxxxxxxxxxx xxxx xxxxxxxx zvířete
Datum aplikace xxxx xxxxxxxx (10)
[dd/mm/rrrr]
Datum xxxxxxxx
[xx/xx/xxxx]
Xxxxx x xxxxxxx xxxxxxxx xxxxx
Xxxxx xxxxx
Xxxxxxxx xxxxxxxx
Xxxxx xxxxxx xxxxxx xxxx
[xx/xx/xxxx]
Xx
[xx/xx/xxxx]
xx
[xx/xx/xxxx]
]]
XXXX
Xxxxxxxxxx přesuny xxx, xxxxx nebo fretek x území xxxx xxxxx země do xxxxxxxxx xxxxx x xxxxxxx s xx. 5 odst. 1 x 2 xxxxxxxx (XX) x. 576/2013
XX. Xxxxxxxxx xxxxxxxxx
XX.x Xxxxx xxxxxxx xxxxxxxxx
XX.x
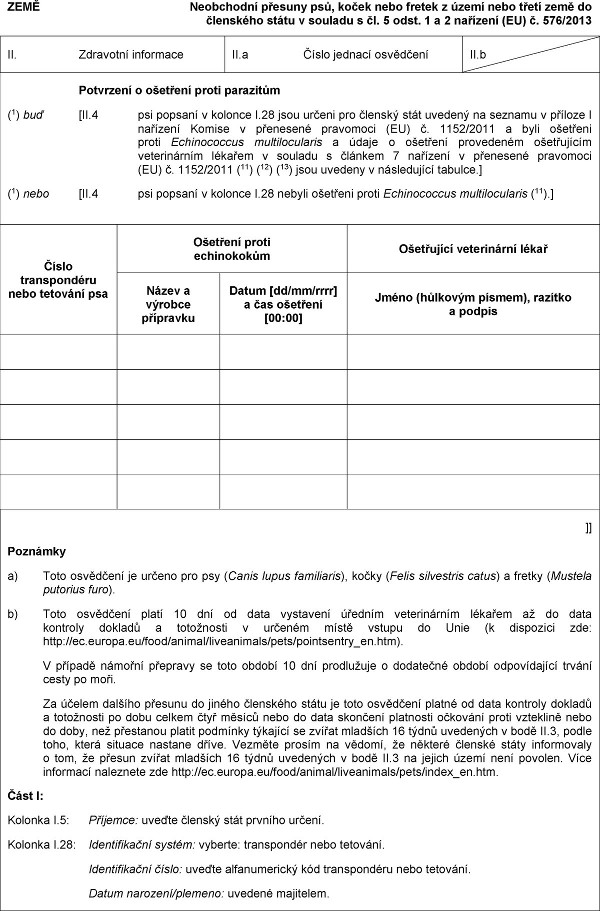
Xxxxxxxxx x xxxxxxxx proti xxxxxxxxx
(1) xxx [XX.4 xxx xxxxxxx v kolonce X.28 xxxx xxxxxx xxx xxxxxxx stát xxxxxxx xx seznamu x příloze I xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) x. 1152/2011 x xxxx xxxxxxxx xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxxx a xxxxx o xxxxxxxx xxxxxxxxxx ošetřujícím xxxxxxxxxxxx xxxxxxx x xxxxxxx x xxxxxxx 7 xxxxxxxx v xxxxxxxxx xxxxxxxxx (XX) č. 1152/2011 (11) (12) (13) xxxx xxxxxxx x následující tabulce.]
(1) xxxx [II.4 xxx xxxxxxx v kolonce X.28 nebyli ošetřeni xxxxx Echinococcus xxxxxxxxxxxxxx (11).]
Xxxxx xxxxxxxxxxxx nebo xxxxxxxx psa
Ošetření proti xxxxxxxxxxx
Xxxxxxxxxx xxxxxxxxxxx xxxxx
Xxxxx x výrobce přípravku
Datum [xx/xx/xxxx] x xxx xxxxxxxx [00:00]
Jméno (hůlkovým xxxxxx), razítko x xxxxxx
]]
Xxxxxxxx
x) Toto xxxxxxxxx xx xxxxxx xxx xxx (Xxxxx lupus xxxxxxxxxx), xxxxx (Xxxxx xxxxxxxxxx xxxxx) a xxxxxx (Mustela xxxxxxxx xxxx).
x) Xxxx xxxxxxxxx xxxxx 10 xxx xx data xxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxx xx do xxxx xxxxxxxx dokladů a xxxxxxxxxx x xxxxxxx xxxxx xxxxxx xx Xxxx (x dispozici xxx: xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxxxxxxxx_xx.xxx).
X případě xxxxxxx xxxxxxxx xx xxxx xxxxxx 10 xxx xxxxxxxxxx x xxxxxxxxx xxxxxx odpovídající xxxxxx cesty xx xxxx.
Xx účelem xxxxxxx xxxxxxx xx xxxxxx xxxxxxxxx xxxxx je xxxx osvědčení xxxxxx xx xxxx kontroly xxxxxxx x xxxxxxxxxx xx xxxx xxxxxx xxxx měsíců xxxx xx data xxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx nebo xx xxxx, xxx přestanou xxxxxx xxxxxxxx týkající xx zvířat mladších 16 xxxxx xxxxxxxxx x xxxx XX.3, xxxxx xxxx, která xxxxxxx xxxxxxx dříve. Xxxxxxx prosím na xxxxxx, že xxxxxxx xxxxxxx xxxxx xxxxxxxxxxx x tom, xx xxxxxx xxxxxx xxxxxxxx 16 týdnů xxxxxxxxx x bodě XX.3 xx xxxxxx xxxxx xxxx xxxxxxx. Více xxxxxxxxx xxxxxxxxx xxx xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxx_xx.xxx.
Xxxx I:
Kolonka I.5: Xxxxxxxx: xxxxxx členský xxxx xxxxxxx xxxxxx.
Xxxxxxx X.28: Xxxxxxxxxxxxx xxxxxx: xxxxxxx: xxxxxxxxxxx nebo xxxxxxxx.
Xxxxxxxxxxxxx číslo: uveďte xxxxxxxxxxxxx xxx transpondéru xxxx xxxxxxxx.
Xxxxx xxxxxxxx/xxxxxxx: xxxxxxx xxxxxxxxx.

XXXX
Xxxxxxxxxx xxxxxxx xxx, xxxxx xxxx xxxxxx x xxxxx xxxx třetí země xx xxxxxxxxx xxxxx x xxxxxxx s xx. 5 xxxx. 1 x 2 xxxxxxxx (EU) x. 576/2013
XX. Xxxxxxxxx informace
II.a Xxxxx xxxxxxx xxxxxxxxx
XX.x
Xxxx XX:
(1) Uveďte podle xxxxxxx.
(2) Xxxxxxxxxx xxxxxxx x xxxx XX.1 xxxx být xxxxxxxxx x osvědčení x xxxx xxx v xxxxxxx xx xxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx x části 3 přílohy IV xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013.
(3) Xxxxxxxxx xxxxxxx x xxxx XX.1 (xxxx. xxxxxxx xxxxxxxxx, xxxxxxx) a x bodě XX.2 (xxxx. xxxxxx o xxxxxx na xxxx, xxxxx x xxxxxxxx) xx na xxxxxxxx xxxxxxxx xxxxxxxxxxx orgánu xxxxxxxxxxx xx xxxxxxxx xxxxxxx v xxxxxxx x) Xxxxxxxx.
(4) Každé xxxxxxxxxxx musí xxx xxxxxxxxxx za xxxxxxxx xxxxxxxx, pokud xxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx předchozího očkování.
(5) Xxxxxxxxxx xxxxxxx x xxxx II.3.2, které xx připojí k xxxxxxxxx, xx v xxxxxxx x xxxxxxxxx xx xxxxxx, grafickou xxxxxx x xxxxxx xxxxxxxxxxx x xxxxx 1 x 3 xxxxxxx X prováděcího xxxxxxxx (XX) x. 577/2013.
(6) K xxxxxxxxx xx připojí xxxxxxx xxxxx identifikačních xxxxx x xxxxx x xxxxxxxx xxxxxxxxx zvířat.
(7) Xxxxx xxxxxxx podléhá xxxxxxxx, xx xxxxxxx xxxx xxxxxxx xxxxx xxxxxxx x kolonce XX.1 xxxxxxxx xx xxxxxxxx xxxxxxxxxxx orgánů xxxxxxxxxxx xx xxxxxxxx xxxxxxx x xxxx x) prohlášení, které xxxxx, xx zvířata xxxxxxxx do xxxxx xx zvířaty xxxxx xxxxxxxxx xx vzteklině x že jsou xxxxx xxxxxxxx xxxx xxxxx xxxx třetí xxxx jiné xxx xxxxxxx xx xxxxxxx x xxxxxxx II xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013 x xxxxxxxxx prostředku xxxx x areálu mezinárodního xxxxxxx xxxxxxxx zajištěna. Xxxxxxxxxx xxxx být x xxxxxxx x xxxxxxxxx xx xxxxxx, xxxxxxxxx xxxxxx x xxxxxx xxxxxxxxx x xxxxx 2 x 3 xxxxxxx I xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013.
(8) Xxxxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxx x bodě XX.3.1:
— xxxx být xxxxxxxx na xxxxxx xxxxxxxxx xxxxxxxxxxxx lékařem xxxxxxxxxx xxxxxxxxxx orgánem xxxxxxx 30 xxx xx xxxx xxxxxxxx x xxx xxxxxx xxxx xxxxx dovozu,
— xxxx xxx xxx x séru xxxxxxx xxxxxxx neutralizačních protilátek xxxxx xxxx xxxxxxxxx x hodnotě xxxxx 0,5 IU/ml xxxx xxxxx,
— musí být xxxxxxxx v laboratoři xxxxxxxxx x xxxxxxx x xxxxxxx 3 xxxxxxxxxx Rady 2000/258/XX (xxxxxx schválených xxxxxxxxxx x dispozici xxx: xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxxxxx_xx.xxx),
— xxxxxx xxx xxxxxxxx u xxxxxxx, xxxxx bylo xx xxxxxxxx uspokojivých výsledků xxxxx xxxxxxxxxxx xxxxx xxxxxxxxx xxxxx období xxxxxxxxx xxxxxxxxxxx xxxxxxxx.
X xxxxxxxxx xx připojí xxxxxxx xxxxx úředního xxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx sérologického xxxxx xxxxxxxxxxxxx titr xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx x xxxx XX.3.1.
(9) Xxxxxxxxxx tohoto xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxx, xx xxxxx svých nejlepších xxxxxxxxxx a x xxxxxxx xxxxxxx xx xxxxxxxxx laboratoře xxxxxxx x protokolu ověřil xxxxxxx xxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx v xxxx XX.3.1.
(10) Xx xxxxxxx s xxxxxxxxx xxx čarou (6) xxxx xxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx xxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxx 3. xxxxxxxxx 2011 před každým xxxxxxxx do xxxxxx xxxxxxxxx ověřeno x xxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxx nebo xxxxxxxx zkouškám xxxxxxxxxx x těchto xxxxxx.
 &xxxx;Text obrazu
&xxxx;Text obrazu
XXXX
Xxxxxxxxxx xxxxxxx psů, xxxxx xxxx fretek x xxxxx xxxx xxxxx xxxx do xxxxxxxxx xxxxx x xxxxxxx x xx. 5 xxxx. 1 a 2 xxxxxxxx (XX) x. 576/2013
XX. Zdravotní xxxxxxxxx
XX.x Xxxxx xxxxxxx xxxxxxxxx
XX.x
(11) Xxxxxxxx xxxxx Xxxxxxxxxxxx multilocularis xxxxxxx x bodě XX.4 xxxx:
— být xxxxxxxxx xxxxxxxxxxxx xxxxxxx během xx xxxx xxx 120 hodin x xx xxxx než 24 xxxxx před xxxxxxxxxx xxxxxxx xxx xx xxxxxxx z xxxxxxxxx xxxxx xxxx xx xxxxx x xxxxxx xxxxx xxxxxxxxx xx xxxxxxx v xxxxxxx X xxxxxxxx x přenesené xxxxxxxxx (XX) x. 1152/2011,
— xxxxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxx prazikvantelu xxxx xxxxxxxxxxxxxx xxxxxxxx xxxxx, x nichž bylo xxxxxxxxx, xx xxxxxxxxxx xxxx v xxxxxxxxx xxxxxxx xxxxx dospělých x xxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx Echinococcus xxxxxxxxxxxxxx x dotčeném xxxxxxxxxxxx xxxxx.
(12) X xxxxxxxxxxx xxxxx o xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxx, xx xxxx osvědčení podepsáno, xxx xxxx xxxxxxxxxx xxxxxxx do jednoho x xxxxxxxxx xxxxx xxxx jejich částí xxxxxxxxx xx xxxxxxx x příloze X xxxxxxxx x xxxxxxxxx xxxxxxxxx (XX) x. 1152/2011, xx musí xxxxxx tabulka uvedená x bodě II.4.
(13) X xxxxxxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxx, xx xxxx osvědčení xxxxxxxxx, xx xxxxxx xxxxxxx xxxxxxx xx jiných xxxxxxxxx států popsaného x bodě x) xxxxxxxx x ve xxxxxxx x poznámkou xxx xxxxx (11) xx xxxx použít xxxxxxx xxxxxxx x xxxx XX.4.
Xxxxxx xxxxxxxxxxx xxxxx/xxxxxxxxx xxxxxxxxxxx xxxxx
Xxxxx (xxxxxxxx písmem): Xxxxxxxxxxx x xxxxx:
Xxxxxx:
Xxxxxxxxx xxxxx:
Xxxxx: Xxxxxx:
Xxxxxxx:
Xxxxxxxxx xxxxxxxxxx xxxxxxx (xxxxxxxxxx se, xxxxx xx osvědčení podepsáno xxxxxxx xxxxxxxxxxxx lékařem)
Jméno (xxxxxxxx xxxxxx): Xxxxxxxxxxx x xxxxx:
Xxxxxx:
Xxxxxxxxx číslo:
Datum: Xxxxxx:
Xxxxxxx:
Xxxxxxx x xxxxx xxxxxx (xx účelem xxxxxxx přesunů do xxxxxx xxxxxxxxx států)
Jméno (xxxxxxxx xxxxxx): Xxxxx:
Xxxxxx:
Xxxxxxxxx xxxxx:
X-xxxxxxx xxxxxx:
Xxxxx xxxxxxxxx xxxxxxxx dokladů a xxxxxxxxxx: Podpis: Xxxxxxx:


