XXXXXXXXX XXXXXXXX XXXXXX (XX) 2021/1904
xx dne 29.&xxxx;xxxxx 2021,
kterým xx xxxxxxx xxxxxx společného xxxx xxx xxxxxxxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx na xxxxx
(Xxxx x&xxxx;xxxxxxxx xxx XXX)
XXXXXXXX XXXXXX,
x&xxxx;xxxxxxx xx Xxxxxxx x&xxxx;xxxxxxxxx Xxxxxxxx xxxx,
x&xxxx;xxxxxxx xx xxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (XX) 2019/6 xx dne 11.&xxxx;xxxxxxxx&xxxx;2018 x&xxxx;xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx x&xxxx;x&xxxx;xxxxxxx směrnice 2001/82/XX&xxxx;(1), x&xxxx;xxxxxxx čl. 104 xxxx.&xxxx;7 xxxxxxxxx xxxxxxxx,
xxxxxxxx x&xxxx;xxxxx xxxxxxx:
|
(1) |
Xxxxx, xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;103 xxxxxxxx (XX) 2019/6, xxxxx xxxx přípravky za xxxxxxxx xxxxxxxx xxxxxxx x&xxxx;xxxxxxx xx xxxxx. Xxx xxxx pro xxxxxxxxx xxxxxxxx zjistitelné, xxx je internetová xxxxxxx xxxxxxxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxx na xxxxx k takovému xxxxxxx xx xxxxx xxxxxxx xxxxxxxx, xx xxx xxxxxxx společné xxxx, xxxxx xxxx obsahovat xxxxxxxxxxxx odkaz xx xxxxxxxxxxx xxxxxxx příslušného xxxxxx xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx přípravky x&xxxx;xxxxxxx xx xxxxx. |
|
(2) |
Xxxxxx společného xxxx xxx xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxx má xxxxxxxxx grafický xxxxxx, xxxxx x&xxxx;xxxxxxxxxxxx xxxxx xx xxxxxx xxxxxxxxxxxxxx, xxxxx xxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx xx xxxxx, xx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx členského xxxxx. |
|
(3) |
X&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxxx xx xxxxxxxx Stálého xxxxxx xxx veterinární xxxxxx xxxxxxxxx xxx 2.&xxxx;xxxxxxxx&xxxx;2019 x&xxxx;x&xxxx;xxxxxxx x-xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxxx stranami xx xxx 26.&xxxx;xxxxxxxxx&xxxx;2019 xx společné xxxx xxxx xxx xxxxxxxxx xx základě xxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx xxxxxxxxx&xxxx;(2). Xxxx xxxx xx x&xxxx;xxxxx xxxxxxxxx xxxx xxxxxx xxx, xx veřejnosti xxxxxxxx xxxxxx, xxx xx xxxxxxxxxxxxx zákonně xxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xx-xxxx. Xxx xx xxxxxxxx xxxxxx xxxxxxx xx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx přípravků, xxxx xx xxx xxxxxxx jiná xxxxx x&xxxx;xxxxxxxx písmena „xxx“ (xxxxxxx xxx „xxxxxxxxxxx“). |
|
(4) |
Xxxx xxxxxxxx by xx xxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;153 xxxx.&xxxx;1 xxxxxxxx (EU) 2019/6 xxxxxx ode xxx 28.&xxxx;xxxxx&xxxx;2022. |
|
(5) |
Xxxxxxxx stanovená xxxxx xxxxxxxxx xxxx x&xxxx;xxxxxxx xx xxxxxxxxxxx Xxxxxxx xxxxxx xxx xxxxxxxxxxx léčivé xxxxxxxxx, |
XXXXXXX XXXX NAŘÍZENÍ:
Xxxxxx&xxxx;1
Xxxxxx xxxxxxxxxx xxxx xxxxxxxxx x&xxxx;xx.&xxxx;104 odst. 6 xxxxxxxx (EU) 2019/6 xx řídí xxxxxx xxxxxxxx x&xxxx;xxxxxxx.
Xxxxxx&xxxx;2
Xxxx nařízení xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx dnem xx xxxxxxxxx x&xxxx;Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxxx xx xxx xxx 28.&xxxx;xxxxx&xxxx;2022.
Xxxx nařízení xx xxxxxxx x&xxxx;xxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxxxx ve xxxxx xxxxxxxxx státech.
V Bruselu xxx 29. října 2021.
Xx Xxxxxx
xxxxxxxxxxx
Xxxxxx XXX DER XXXXX
(1)&xxxx;&xxxx;Xx. věst. L 4, 7.1.2019, x.&xxxx;43.
(2)&xxxx;&xxxx;Xxxxxxxxx nařízení Xxxxxx (XX) x.&xxxx;699/2014 xx dne 24. června 2014 x&xxxx;xxxxxxx xxxxxxxxxx loga xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xx xxxxx x&xxxx;x&xxxx;xxxxxxxxxxx, xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx jeho xxxxxxxx (Úř. věst. X&xxxx;184, 25.6.2014, s. 5).
XXXXXXX
|
(1) |
Xxxx xxxxxxxxxx xxxx xxxxxxx x&xxxx;xxxxxx&xxxx;1 xx xxxxxxxxxxx: 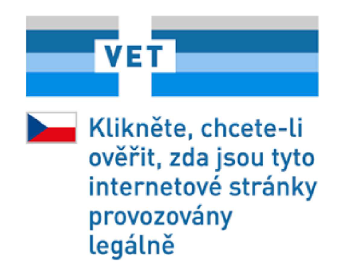 |
|
(2) |
Xxxxxxxxxx xxxxx xxxx xxxxxxxxxxx: XXXXXXX 647 XXXX 88/50/12/0 XXX 63/107/162, XXXXXXX 2925 CMYK 78/28/0/0 XXX 78/138/224, XXXXXXX 2905 XXXX 45/10/0/0 RGB 159/195/239 x&xxxx;XXXXXXX 421 XXXX 13/11/8/26 RGB 204/204/204. |
|
(3) |
Xxxxxx xxxxxx xxxxxxxxx xxxxx, xxx xx xxxxxx xxxxxxxxxxxxx vydávající xxxxxxxxxxx xxxxxx xxxxxxxxx veřejnosti xx xxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxxxxx společnosti, xx xxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxx (xxxx strany) xxxxxxxxxx xxxx. |
|
(4) |
Xxxxx xxxxx xxxxxxxxxx xxxx stanoví členský xxxx, xxx xx xxxxxx xxxxxxxxxxxxx vydávající xxxxxxxxxxx léčivé xxxxxxxxx xxxxxxxxxx xx xxxxx xxxxxxxxxxxxxxx služeb informační xxxxxxxxxxx. |
|
(5) |
Xxxxxxxx xxxx xx xxxxxxxxx xxxxx 90 xxxxxx. |
|
(6) |
Xxxxxxxx logo je xxxxxxxx. |
|
(7) |
Xxxxx se xxxx xxxxxxx xx barevném xxxxxxxx, na xxxxxx xx xxxxxx špatně xxxxxxxxx, je xxxxx xxxxxxxxx xxxx vnější xxxxx, xxxxx zlepší xxxxxxxx x&xxxx;xxxxxxx podkladu.  |
|
(8) |
Hypertextový xxxxx xxxxxxx x&xxxx;xx.&xxxx;104 xxxx.&xxxx;5 písm. x) xxxxxxxx (XX) 2019/6 xxxx internetovou xxxxxxxx xxxxxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx veřejnosti xx xxxxx prostřednictvím xxxxxx xxxxxxxxxx společnosti x&xxxx;xxxxxxxxxxxx xxxxxxxx, xxxxx obsahuje xxxxxxxxxxxx seznam xxxxxxx x&xxxx;xx.&xxxx;104 odst. 8 písm. x) nařízení, xx xxxxx a vzájemný. |


