NAŘÍZENÍ KOMISE (XX) x.&xxxx;429/2008
xx dne 25. dubna 2008
x&xxxx;xxxxxxxxxxx pravidlech x&xxxx;xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;1831/2003, pokud xxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxx a vyhodnocování a povolování xxxxxxxxxxx látek
(Text s významem xxx XXX)
XXXXXX EVROPSKÝCH XXXXXXXXXXXX,
x&xxxx;xxxxxxx xx Xxxxxxx x&xxxx;xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
x&xxxx;xxxxxxx xx xxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (ES) x.&xxxx;1831/2003 xx xxx 22.&xxxx;xxxx 2003 o doplňkových xxxxxxx xxxxxxxxxxx ve xxxxxx xxxxxx (1), x&xxxx;xxxxxxx xx xx.&xxxx;7 xxxx.&xxxx;4 x&xxxx;5 xxxxxxxxx xxxxxxxx,
xx xxxxxxxxxx x&xxxx;Xxxxxxxxx úřadem xxx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;7 odst. 4 x&xxxx;5 xxxxxxxx (XX) x.&xxxx;1831/2003,
xxxxxxxx k těmto důvodům:
|
(1) |
Je xxxxxxxx xxxxxxxx prováděcí xxxxxxxx, xxxxx xxx x&xxxx;xxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxxx nařízení (XX) č. 1831/2003, xxxxxx xxxxxxxx xxx xxxxxxxxxxx x&xxxx;xxxxxxxx žádostí a vyhodnocování x&xxxx;xxxxxxxxxx těchto xxxxxxxxxxx xxxxx. Xxxx pravidla xxxx xxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx směrnice Rady 87/153/XXX (2), kterou xx xxxxxxx xxxxxx xxxxxx xxx xxxxxxxxxxxxx doplňkových xxxxx xx výživě xxxxxx. |
|
(2) |
Xxxx xxxxxxxx xx xxxx xxxxxxxx požadavky, xxxxx musí splňovat xxxxxxxxxxx připojená x&xxxx;xxxxxxx. Xxxx xx xxxxxxx xxxxx xxxxxxx xxxxx, xxxxx xxxx být xxxxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx doplňkové látky, x&xxxx;xxxxxx, jež xxxx xxx xxxxxxxxxx x&xxxx;xxxxx xxxxxxxx xxxx účinnost x&xxxx;xxxxxxxxxx xxx člověka, xxxxxxx x&xxxx;xxxxxxx xxxxxxxxx xx xxxxxx xxxxxxx x&xxxx;xxxxxxxxxxx žádostí o povolení Xxxxxxxxx xxxxxx pro xxxxxxxxxx potravin (xxxx xxx „úřad“). |
|
(3) |
Podle xxxxxx xxxxxxxxx xxxxx nebo xxxxxxxxxxxx podmínek xxx xxxxx xx může xxxxxx studií xxxxxxxxxx x&xxxx;xxxxxxxxxxx jejích xxxxxxxxxx x&xxxx;xxxxxx xxxxx. Xxxxxxxx xx xxxxx xxxx xxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx, xxxxx xxx x&xxxx;xxxx xxxxxx x&xxxx;xxxxxxxxx, xxx xxxx xxx xxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx a účinnosti xxxxxxx xxxxxxxxx xxxxx. Xxxxxxxx, xxxxx xxxxxxx xxxx xxxxxxxxx, xx xxxx x&xxxx;xxxxxxxxxxx xxxx výběr xxxxxxxxx. |
|
(4) |
Xxxx xx měl xxx možnost xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx, xxx xxxx určit, xxx doplňková xxxxx xxxxxxx xxxxxxxx pro xxxxxxxx podle xxxxxx&xxxx;5 xxxxxxxx (XX) č. 1831/2003. |
|
(5) |
Je xxxxxxxx používat xxxxxxxxx xxxxx kvality xxx xxxxxxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxx látky určené x&xxxx;xxxxxxx v krmivu (xxxxxxxx) xxxx vodě, xxx xxxx xxxxxxxxx, xx xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxx zpochybněny. |
|
(6) |
V případě xxxxxxxx xx xxxx xxx xxxxxxxxx zvláštní požadavky xxx xxxxxxxxxx kategorie xxxxxxxxxxx xxxxx uvedené x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 nařízení (XX) x.&xxxx;1831/2003. |
|
(7) |
X&xxxx;xxxxx xxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx bezpečnosti xx xxxx xxx xxxxxxxxx xxxxxxxx podmínky xxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xx většinových xxxxxxx xx xxxxx xxxxxxxxx. |
|
(8) |
Xxxxxxxxx pravidla xxxxxxxx xx xxxxxxx o povolení xx xxxx xxxx x&xxxx;xxxxx xxxxx požadavky xx xxxxxxx určená x&xxxx;xxxxxxxx potravin x&xxxx;xxxxxxx xxxxxxx, xxx xxx xxxxxxx xxxxxxxx se xxxxxxxxxxx bezpečnosti xxx xxxxxxx xxxx spotřebitele xxxxxx xxxxxxxx. |
|
(9) |
Xxxxxxx postupů xxxxxxxxxxxx používání xxxxxxxxxxxxx xxxxxx k pokusným xx xxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxxx xx zvířatech xxxxx xxxxxxxx Rady 86/609/XXX ze xxx 24.&xxxx;xxxxxxxxx 1986 o sbližování xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx týkajících xx ochrany zvířat xxxxxxxxxxx xxx pokusné x&xxxx;xxxx xxxxxxx xxxxx (3) xx xxxx xxx xxxxxxxxx. |
|
(10) |
Xxx se zamezilo xxxxxxxxxx xxxxxxxxx studií, xxxx xx být xxxxxxxxx zjednodušené xxxxxxx xxx xxxxxxxxxx doplňkových xxxxx, xxxxx xxx xxxx xxxxxxxx pro xxxxxxx x&xxxx;xxxxxxxxxxx. |
|
(11) |
Xx xx xxxx xxxxxxxxxxx xxxxx, xxxxx byly xxxxx xxxxxxxx Xxxx 70/524/XXX (4) xxxxxxxx bez xxxxxxxx xxxxxxx, xxxx xx xxx xxxxxxxxx xxxxxxxxx xxxxxxx, xxx x&xxxx;xxxxxxx, xx xxxxxx x&xxxx;xxxxxxxxx xxxxx studie, xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxx xxxxxxxxx, které xxxx x&xxxx;xxxxxxxxx k prokázání xxxxxxxxx, xxxxxxx materiálů xxxxxxxxxx xx xxxxxx xxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx. |
|
(12) |
Xx xxxxx xxxxxxxx xxxxxxxx xxx xxxxxxx x&xxxx;xxxxx povolení x&xxxx;xxxxxxx s čl. 13 xxxx.&xxxx;3 xxxxxxxx (ES) č. 1831/2003. |
|
(13) |
Je xxxxx xxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxx podle xxxxxx&xxxx;14 xxxxxxxx (XX) x.&xxxx;1831/2003. |
|
(14) |
Xx se xxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx, xxx je xxxxx xxxxxxx xx xxxxxxx žádosti, xx xxxxxxxx stanovit xxxxxxxxx xxxxxx, během xxxxx xx xxxxx xxxxxx xxxxxxxx stávající pravidla. X&xxxx;xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx xx xx xxxx x&xxxx;xxxxxx nakládat x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxxx 87/153/XXX. Xxxxx jde x&xxxx;xxxxxxx xxxxxx xxxxx xxxxxxxx xxxxxx xx xxxxxx x&xxxx;xxxxxxxx, xxxxxxxx xx xxxxxxxx x&xxxx;xxxxxx xxxx potřebné xxx xxxxxxx xxxxxx měli xxx xxxxxxx xxxxxx xxxx xxxxxxxx stanovenými x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx 87/153/XXX. Xxxxxxxxx xxxxxxxx byla vypracována xx xxxxxxx xxxxxxxxxx xxxxxxxxx a technických xxxxxxxx x&xxxx;x&xxxx;xxxxxxx nutnosti by xxxx xxx přizpůsobena xxxxxxxxxx novému xxxxxx x&xxxx;xxxx xxxxxxx. |
|
(15) |
Xxxxxxxx xxxxxx xxxxxxxx jsou x&xxxx;xxxxxxx xx stanoviskem Xxxxxxx xxxxxx xxx xxxxxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxx, |
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxx
Xxx účely xxxxxx xxxxxxxx se xxxxxxx xxxx xxxxxxxx:
|
1. |
„xxxxxxx x xxxxxxxx xxxxx x xxxxxxxxx xxxxxxx, xxxxx xxxxxx xxxxxx x xxxxxxxx xxxxxxxx“ xx xxxxxx xxxxxxx xxxxx, xxx jsou xxxxxxxx xxxxxx, chovány xxxx xxxxxx xxxxxxxx, xxxxxx xxxx xxxxxx pro xxxxxxx xxxxxxxx, vyjma xxxx; |
|
2. |
„xxxxxxxxxxx xxxxx“ xx xxxxxx zvířata určená x xxxxxxxx xxxxxxxx jiná xxx xxxx (xxxxxxx xxxxxxx xxx xxxxx x xxxx, včetně telat), xxxx (xxxxxxx xxxxxxx xxx xxxx), xxxxxxx, xxxxxx (včetně xxxxxx), xxxxx x xxxx druhu Xxxxxxxxxx. |
Xxxxxx 2
Xxxxxx
1. Xxxxxx x xxxxxxxx xxxxxxxxx xxxxx podle xxxxxx 7 xxxxxxxx (ES) č. 1831/2003 xx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx x xxxxxxx X.
X xxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxx xxxxxx 3 (xxxx xxx „xxxxxxxxxxx“), která xxxxxxxx xxxxx x xxxxxxxxx xxxxxxx x xx. 7 xxxx. 3 xxxxxxxx (XX) č. 1831/2003.
2. Pokud xxxxxxx x xxxxxxx x xxxxxxx 18 xxxxxxxx (XX) x. 1831/2003 xxxxxxxx, xxx se x xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxx 1 xxxxxxxxx xxxx x xxxxxxxxx xxxxx, xxxxxxxx pro xxxxx xxxxxxxx nebo xxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxx, xx xxxxxxxxxx xxxxxx xxxxxxxxx by xxxxx xxxxxxxx poškodit jeho xxxxxxxxx xxxx konkurentům. Xxxxxxx části dokumentace xxxx být xxxxxxxxxx xxxxxxxx xx zbytku xxxxxxxxxxx x xxxxx být xxxxxxxx x xxxxxxx xxxxxxxxxxx xxxxx xx. 7 xxxx. 3 xxxx. x) xxxxxxxx (XX) x. 1831/2003. Xxxxxxx zašle Komisi xxxxx xxxxx xxxxxxxxxxx, x xxxxx má být xxxxxxxxx xxxx x xxxxxxxxx xxxxx, a připojeného xxxxxxxxxx.
Xxxxxx 3
Xxxxxxxxxxx
1. Xxxxxxxxxxx přiměřeně a dostatečně xxxxxxxxx, xx xxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxx x xxxxxx 5 xxxxxxxx (XX) x. 1831/2003.
2. Xxxxxx xxxxxxxxx na xxxxxxxxxxx a předání xxxxxxxxxxx xxxx xxxxxxxxx v příloze II.
Xxxxxxxx xxxxxxxxx, xxx xxxxxxxxxxx xxxx splňovat v dotyčném xxxxxxx, xxxx xxxxxxxxx x xxxxxxx XXX.
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx studií xx xxxxxxxxx v příloze IV.
3. Xxxxxxxx xx xxxxxxxx 2 xxxx žadatel xxxxxxxxx dokumentaci, která xxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxx 2, xxxxx xxxxx xxxxx, xxxx xxxx xxxxxxxxx xxxxxxxxx, xxxxxxxx.
Xxxxxx 4
Xxxxxxxxx xxxxxxxx
1. Na xxxxxxx x xxxxxxxx xxxxxx xxxx xxxxx xxxxxx xxxxxx xxxxxxxx v platnost xx xxxxxx xxxxxxxx xxxxxxx xxxxxxxx 87/153/XXX.
2. X xxxxxxx o povolení xxxxxxxx xxxx 11. červnem 2009 xx xxxxx xxxxxxxx rozhodnout, xx xxxxx xxxxxx používat xxxxxx XXX x XX xxxxx X x XX xxxxxxx směrnice 87/153/EHS xxxxx xxxx 1.3, 1.4, 2.1.3, 2.1.4, 2.2.3, 2.2.4, 3.3, 3.4, 4.1.3, 4.1.4, 4.2.3, 4.2.4, 5.3, 5.4, 6.3, 6.4, 7.3, 7.4, 8.3 x 8.4 přílohy III x xxxxx ustanovení xx xxxxxxx „Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx studií xxxxxxxxx“ x xxxxxxxxx xxxxxxx XX.
Xxxxxx 5
Xxxxx x xxxxxxxx
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx dvacátým xxxx xx xxxxxxxxx x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxx xxxxxxxx je xxxxxxx x xxxxx xxxxxxx x xxxxx xxxxxxxxxx ve xxxxx členských xxxxxxx.
V Bruselu xxx 25. dubna 2008.
Xx Xxxxxx
Xxxxxxxxx XXXXXXXXX
členka Xxxxxx
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 268, 18.10.2003, x.&xxxx;29. Xxxxxxxx xx xxxxx nařízení Xxxxxx (XX) x.&xxxx;378/2005 (Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;29).
(2) Úř. věst. X&xxxx;64, 7.3.1987, x.&xxxx;19. Xxxxxxx xxxxxxxxx (XX) č. 1831/2003.
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 358, 18.12.1986, x.&xxxx;1; xxxxxxxx znění x&xxxx;Xx.&xxxx;xxxx. L 358, 18.12.1986, x.&xxxx;1. Xxxxxxxx xx xxxxx směrnice Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2003/65/XX (Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1).
(4) Úř. věst. X&xxxx;270, 14.12.1970, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx Xxxxxx (XX) x.&xxxx;1800/2004 (Xx.&xxxx;xxxx. X&xxxx;270, 14.12.1970, x.&xxxx;1).
PŘÍLOHA I
FORMULÁŘ XXXXXXX UVEDENÝ X&xxxx;XX.&xxxx;2 ODST. 1 A SPRÁVNÍ XXXXX
1.&xxxx;&xxxx;&xxxx;XXXXXXXX XXXXXXX
XXXXXXXX KOMISE
GENERÁLNÍ XXXXXXXXXXX
XXX XXXXXX A OCHRANU XXXXXXXXXXXX
(Xxxxxx)
Xxxxx: …
|
Xxx |
: |
Xxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxx xxxxx nařízení (XX) x.&xxxx;1831/2003. |
|
◻ |
Xxxxxxxx xxxxxxxxx xxxxx xxxx xxxx xxxxx doplňkové xxxxx (xx.&xxxx;4 xxxx.&xxxx;1 nařízení (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx xxxxxxxxxxxx xxxxxxxx (xx.&xxxx;10 xxxx.&xxxx;2 xxxx&xxxx;7 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxx xxxxxxxxxxx xxxxxxxx (xx.&xxxx;13 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003) |
|
◻ |
Xxxxxxxx xxxxxxxx xxxxxxxxx látky (xxxxxx&xxxx;14 xxxxxxxx (XX) č. 1831/2003) |
|
◻ |
Povolení x&xxxx;xxxxxxxxxx případech (xxxxxx&xxxx;15 xxxxxxxx (ES) č. 1831/2003) |
(Označte xxxxxxxxxxx zaškrtnutím xxxxxxx x&xxxx;xxxxxxx)
Xxxxxxx(x)&xxxx;x/xxxx xxxx/xxxxxx xxxxxxxx(x)&xxxx;xx Xxxxxxxxxxxx (xx.&xxxx;4 xxxx.&xxxx;3 xxxxxxxx (ES) č. 1831/2003) xx xxxxxxxx xxxxxxxxx x&xxxx;xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003 (xxxxx, xxxxxx ….)
…
…
xxxxxx (xxxxxxxx) xxxx xxxxxx xx xxxxxx xxxxxxx povolení xxx xxxxxxxxxxx produkt xxxxxxx xxxxxxxxxx látku:
1.1 Identifikace x&xxxx;xxxxxxxxxxxxxxx doplňkové látky
Název xxxxxxxxx látky (charakteristika xxxxxx xxxxx (xxxxx) xxxx xxxxxxx (xxxxxxx), xxx je xxxxxxxx x&xxxx;xxxxxx&xxxx;2.2.1.1 a 2.2.1.2 přílohy II):
…
…
Obchodní xxxxx (je-li xx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx xx xxxxxxxx):
…
…
X&xxxx;xxxxxxxxx/xxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx/xxxxxxxxx xxxxxxxxxxx látek (1) (xxxxxx):
…
…
Xxxxxx xxxxx xxxxxx:
…
…
…
Xxxxx xxxxxxxx xxxxxxxx (xx.&xxxx;9 xxxx.&xxxx;6 nařízení (XX) x.&xxxx;1831/2003):
…
…
Xxxx xxxxxxxxx xxxxx xxx xxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx.……/…/X(X)X&xxxx;xxxx xxxxxxxxx (XX) x.&xxxx;…/… pod číslem … jako (kategorie xxxxxxxxxxx látek)
…
Tato xxxxxxxxx xxxxx xxx byla xxxxxxxx v právních xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx .…/…/X(X)X&xxxx;xxxx xxxxxxxxx (XX) x.&xxxx;…/… xxx číslem … xxxx
…
xxx použití x
…
Xxxxx xx xxxxxxx xxxxxx x&xxxx;xxxxxxxxx modifikovaných xxxxxxxxx xxxx xxxx xxxxxxxxx xxxxxxxx xx je x&xxxx;xxxx xxxxxxx, xxxxxx xxxx xxxxxxxxx:
|
◻ |
xxxxxxxxxxx xxxxxxxxxxxxx xxx (nařízení Xxxxxx (XX) x.&xxxx;65/2004&xxxx;(2)) (je-li xx xxxxxx): … |
|
◻ |
xxxxx o případném xxxxxxxx xxxxxxxx v souladu x&xxxx;xxxxxxxxx Evropského xxxxxxxxxx x&xxxx;Xxxx (ES) č. 1829/2003 (3): … |
|
◻ |
nebo xxxxx x&xxxx;xxxxx xxxxxxxxxx xxxxxxx o povolení podle xxxxxxxx (XX) č. 1829/2003: … |
1.2 Podmínky xxx užití
1.2.1 Použití x&xxxx;xxxxxxxxxxx xxxxxxxx
Xxxx nebo xxxxxxxxx xxxxxx:
…
…
Xxxxxxxxx stáří xxxx xxxxxxxx:
…
…
Xxxxxxxxx xxxxx (xx-xx xx vhodné): mg xxxx xxxxxxxx aktivity (4) xxxx xxxxxxxx tvořící xxxxxxx (XXX) xxxx xx/xx kompletního xxxxxx x&xxxx;xxxxxx vody 12&xxxx;%
…
…
Xxxxxxxxx xxxxx (je-li xx xxxxxx): xx nebo xxxxxxxx xxxxxxxx xxxx XXX nebo ml/kg xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
X&xxxx;xxxxxxxx krmiv xx možno xxxxx xxxxxxxxx a maximální xxxxx xx litr.
1.2.2 Použití xx xxxx
Xxxxxxxxx xxxxx (xx-xx xx vhodné): xx xxxx xxxxxxxx xxxxxxxx xxxx CFU xxxx xx/x&xxxx;xxxx
…
…
Xxxxxxxxx dávka (xx-xx xx xxxxxx): mg xxxx jednotky aktivity xxxx XXX nebo xx/x&xxxx;xxxx
…
…
1.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxx xxx xxxxx (je-li xx xxxxxx)
Xxxx xxxx xxxxxxxxx xxxxxx:
…
…
Xxxxxxxxx stáří:
…
…
Minimální xxxxx (xx-xx to vhodné): xx xxxx xxxxxxxx xxxxxxxx nebo XXX/xx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
Xxxxxxxxx xxxxx (xx-xx xx xxxxxx): xx nebo jednotky xxxxxxxx xxxx XXX/xx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx xxxx 12&xxxx;%
…
…
X&xxxx;xxxxxxxx xxxxx xx možno xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxx xx xxxx.
Xxxxxxxx xxxx xxxxxxx xxxxxxx (xx-xx xx xxxxxx):
…
…
…
Xxxxxxxx xxxxxxxx xxxx xxxxxxx pro xxxxxxxxxx (xx-xx xx xxxxxx):
…
…
…
…
Xxxxxxxxx limit reziduí (xx-xx to xxxxxx):
Xxxx xxxx xxxxxxxxx zvířat:
…
…
Indikátorové xxxxxxxx:
…
…
Xxxxxx tkáně xxxx xxxxxxxx:
…
…
…
Xxxxxxxxx reziduum v tkáních xxxx xxxxxxxxxx (μx/xx):
…
…
…
Xxxxxxxx xxxxx:
…
1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx
Xxxxx vzorku xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx (xx-xx to xxxxxx):
…
Xxxxx xxxxxx / xxxxx xxxxx:
…
Xxxxx xxxxxx:
…
Xxxxx xxxxxxxxx xxxxxxxxxxxx:
…
Xxxxxxxxxxx:
…
Xxxxxxxx:
…
Xxxxxxx popis:
…
Popis xxxxx:
…
Xxxxxxxxx xx xxxxxxxxxx:
…
1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxxx změna (xx-xx to vhodné)
…
…
…
…
Kopie xxxx žádosti byla xxxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxxxx a referenční xxxxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxx.
Xxxxxx …
1.5&xxxx;&xxxx;&xxxx;Xxxxxxx:
|
◻ |
xxxxx dokumentace (xxxxx xxx úřad), |
|
◻ |
veřejný xxxxxx xxxxxxxxxxx, |
|
◻ |
xxxxxxxx xxxxxxx dokumentace, |
|
◻ |
seznam xxxxx xxxxxxxxxxx, s nimiž xx být xxxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxxx, x&xxxx;xxxxx xxxxxxxxxxx dotyčných xxxxx dokumentace (xxxxx xxx Xxxxxx a úřad), |
|
◻ |
kopie xxxxxxxxx údajů xxxxxxxx(x), |
|
◻ |
xxx xxxxxx xxxxxxxxx látky xxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx podle xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;1831 / 2003 (xxxxx xxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx), |
|
◻ |
xxxx s údaji x&xxxx;xxxxxxxxxxx xxxxxxxxx (xxxxx xxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx), |
|
◻ |
xxxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxx (xxxxx pro xxxxxxxxxx xxxxxxxxx Společenství) x |
|
◻ |
xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxx Společenství (xxxxxx&xxxx;4 xxxxxxxx (XX) x.&xxxx;378/2005&xxxx;(5). |
Xxxxxxx xxxxxxxxx části xxxxxxxxx a nehodící xx xxxxx škrtněte. Xxxxxxxx xxxxxxxxx xxxxxxx (x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx) xxxxxxx xxxxx Xxxxxxxx xxxxxx.
2.&xxxx;&xxxx;&xxxx;XXXXXXX XXXXX ŽADATELE(Ů)
Kontaktní xxxxx xxx xxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx doplňkové xxxxx xxxxx xxxxxxxx (ES) x.&xxxx;1831/2003
|
1. |
Xxxxxxxxxx xxxx xxxxx, xxxxx xxxxxx žádost
|
|
2. |
Xxxxxxxxx xxxxx (pro xxxxxxxx xxxxxxxxxxxxx s Komisí, xxxxxx x&xxxx;xxxxxxxxxx laboratoří Xxxxxxxxxxxx)
|
(1)&xxxx;&xxxx;X&xxxx;xxxxxxx xxxxxxx „xxxx zootechnické xxxxxxxxx xxxxx“ x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx xx nutné xxxxxxxxxxx xxxxxxx, xxxxx xxxxxx xx xxxxxxxxx látka xxx.
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 10, 16.1.2004, x.&xxxx;5.
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;268, 18.10.2003, x.&xxxx;1. Nařízení naposledy xxxxxxxxx xxxxxxxxx (ES) x.&xxxx;298/2008 (Xx.&xxxx;xxxx. L 268, 18.10.2003, s. 1).
(4) Definici „xxxxxxxx“ xxxxxxxx xxxxxxx.
(5)&xxxx;&xxxx;Xxxxxxxx Komise (XX) x.&xxxx;378/2005 ze xxx 4. března 2005 x&xxxx;xxxxxxxxxx xxxxxxxxxxx pravidlech x&xxxx;xxxxxxxx Xxxxxxxxxx parlamentu x&xxxx;Xxxx (XX) x.&xxxx;1831/2003, xxxxx jde o povinnosti x&xxxx;xxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx v souvislosti x&xxxx;xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxx (Xx.&xxxx;xxxx. X&xxxx;59, 5.3.2005, x.&xxxx;8). Xxxxxxxx xx znění xxxxxxxx (XX) x.&xxxx;850/2007 (Úř. věst. X&xxxx;59, 5.3.2005, x.&xxxx;8).
XXXXXXX&xxxx;XX
XXXXXX POŽADAVKY, JEŽ XXXX SPLŇOVAT XXXXXXXXXXX XXXXX ČLÁNKU 3
OBECNÁ USTANOVENÍ
Tato xxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxxxxxx seznamu x&xxxx;xxxxxxxxxxxxxxx studií x&xxxx;xxxxxxxxx x&xxxx;xxxxxxx, xxxxxxxxxxxxxxxx a přípravcích, xxx xxxx být xxxxxxxxxx s dokumentací xxxxx xxxxxx&xxxx;7 xxxxxxxx (XX) x.&xxxx;1831/2003 xxx:
|
— |
xxxxxxxx xxxx xxxxxxxxx látky, |
|
— |
povolení xxxxxx xxxxx doplňkové látky, |
|
— |
změnu xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxx |
|
— |
xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx. |
Xxxxxxxxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxx, xx xxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx xxxxxxx pro xxxxxx xxxxxxxx, které xxxx stanoveny v článku 5 xxxxxxxx (ES) x.&xxxx;1831/2003.
Xxxxxx, xxx xxxx být xxxxxxxxxx, x&xxxx;xxxxxx xxxxxx xxxx záviset xx xxxxxx xxxxxxxxx xxxxx, xxxxxxxxx xxxx xxxxxxx xxxxxxx, xxxxx xxxxxxxx (xxxxxxxx, které není xxxxxx xx xxxxxxxx; xxxxxxxx xxxxxx xx xxxxxxxx), xxxxxxx látce, xxxxxxxx zvířatech x&xxxx;xxxxxxxxxx xxx xxxxx. Xxxxxxx xxxxxx xx xxxx xxxxxxx x&xxxx;xxxxxxx&xxxx;XXX, xxx xxxx možno posoudit, xxxxx xxxxxx x&xxxx;xxxxxxxxx xxxx xxx xxxxxxxx xx xxxxxxx xxxxxxxxxx.
Xxxxxxx xxxxxxxxxxx xxxxx xxxxxx xxx xxxxxxxxx některých xxxxx xxxx odchýlení xx od dokumentace xxxxxxxxxx x&xxxx;xxxx xxxxxxx, xxxxxxx&xxxx;XXX a příloze IV.
Dokumentace xxxx xxxxxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxx xxxxxxxxxxx xxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxx příloze. Xxxxxxxxxxx xxxx xxxxxxxxx odkazy x&xxxx;xxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx, xxxxx xxx xxxx vypracována uznávanou xxxxxxxx xxxxxxxxx. Pokud xxxx tyto xxxxxx xxx vyhodnoceny xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx předpisů xxxxxxxx xx Xxxxxxxxxxxx, xxxxxxxxx xxxxx na xxxxxxxx xxxxxxxxx. Údaje xx xxxxxx, xxxxx xxxx xxxxxxxxx a zveřejněny xxx xxxxx, xxxx xxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx xx xxxx xxxxxxxxxxx xxxxxxxxx na xxxxxxx xxxxxxxxxx látku xxxx xxxxx, xxxxx xx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx.
Xxxxxx, xxxxxx studií, xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxx xxxxx xxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx, musí být xxxxxxxxx x&xxxx;xxxxxxxxxxxxxx podle xxxxxxxxxxx xxxxx kvality (xxxx. správná xxxxxxxxxxx xxxxx x&xxxx;xxxxxxx se xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2004/10/ES xx xxx 11.&xxxx;xxxxx 2004 x&xxxx;xxxxxxxxxxx xxxxxxxx a správních xxxxxxxx xxxxxxxxxx xx xxxxxxxxx xxxxx xxxxxxx xxxxxxxxxxx praxe x&xxxx;xxxxxxxxx xxxxxx používání při xxxxxxxxx xxxxxxxxxx látek (1) xxxx Xxxxxxxxxxx xxxxxxxxxx xxx normalizaci (XXX).
Xxxxx xx xxxxxx xx xxxx xxxx xx xxxxx xxxxxxxxx xxxx Xxxxxxxxxxxx, xxxxxxx xxxx xxxxxxxx, xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxx xxxxx Xxxxxxxxxx xxx hospodářskou xxxxxxxxxx a rozvoj (XXXX) xxxx normy XXX.
Xxxxxxxxx-xxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx xxxxxxxxxx xx xxxx xxxxx xxxxx xxxxxxxxxxx xxxxxxxx Xxxx 67/548/XXX xx xxx 27.&xxxx;xxxxxx 1967 x&xxxx;xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxxx, xxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxx xxxxx&xxxx;(2), naposledy xxxxxxxxxx xxxxxxxx Xxxxxx 2004/73/XX&xxxx;(3), nebo pomocí xxxxxxxxxxxxxxx metod xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx. Xxxxxxx xxxxxx metod xxxx být xxxxxxxxxx.
Xx xxxxx xxxxxxxxxx xxxxxxxxx xxxxx xx xxxxx xxxx xxxxx zpřesňujících xxxx nahrazujících xxxxxxx xxxxx prováděné x&xxxx;xxxxxx xxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxx xxxxxx xxxxxxxxx při xxxxxx xxxxxxx. Xxxx metody xxxx xxxxxxx kvalitu x&xxxx;xxxxxxxxx stejnou úroveň xxxxxxx jako xxxxxx, xxxxxx xxxx nahradit.
Popis xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxx ve xxxx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx stanovenými xx xxxxxxxx 2004/10/ES x/xxxx xxxxx XX ISO/IEC 17025. Xxxx metody xxxxxxxx xxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxx&xxxx;11 xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (XX) x.&xxxx;882/2004 ze xxx 29.&xxxx;xxxxx 2004 x&xxxx;xxxxxxxx xxxxxxxxxx xx účelem xxxxxxx xxxxxxxxxx právních xxxxxxxx xxxxxxxxxx xx xxxxx a potravin a pravidel x&xxxx;xxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx&xxxx;(4).
Xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxx souhrn x&xxxx;xxxxxxxx xxxxxxx xxxxxxx, xxx xxxx možno dotyčnou xxxxxxxxxx látku xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx.
Xxxxx dokumentace xxxxxxxx xxxxx xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx, xxxxx se požaduje xxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003, x&xxxx;xxxxx na označování xxxxx čl. 7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
Posouzení xxxxxxxxxxx
Xxxx posouzení xx xxxxxxxx xx studiích, xxxxx mají xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxx x:
|
x) |
xxxxxxx xxxxxx xxx xxxxxxxxxx navrhovaných obsazích xxx zapracování do xxxxx xxxx vody x&xxxx;xxx násobku xxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx xxx xxxxxxxxxx; |
|
x) |
xxxxxxxxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxx xxxxxxx ze xxxxxx přijímajících doplňkovou xxxxx, xxxx xxxxxxx xxxx metabolity. X&xxxx;xxxxx xxxxxxx bude xxxxxxxxxx xxxxxxxxx xxxxxxxxxx maximálních xxxxxx xxxxxxx (XXX) x&xxxx;xxxxxxxxxx lhůt xx xxxxxxx xxxxxxxxxx denní xxxxx (ADI) nebo xxxxxxxx povolené dávky (XX); |
|
x) |
xxxxxx, xxxxx budou xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx nebo xxxxxxxxx xxxxxxxx, očí xx xxxx při xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx xxxx xxxxxxx xxxx xxx xxxxx xxxxxxxxxxxxx xx xxxxxxx xxxx xxxxxxxxxxx xxxxx xxxx xxxx xx xxx xxxxxxxxx xxxxxx nebo xxxx, xxxxx xxxxxxxx xxxxxxxx doplňkovou xxxxx; |
|
x) |
xxxxxxxx x&xxxx;xxxxxxx xxxxxxxx vzhledem x&xxxx;xxxxxxx x&xxxx;xxxxxxxxx xxxx xxxxxxxxxxxxx xxxx antimikrobiálním xxxxxx a |
|
e) |
životnímu prostředí, x&xxxx;xxxxxxx na xxxxxxxxx xxxxxxxxxxx z doplňkové xxxxx xxxxxxx nebo produktů x&xxxx;xx xxxxxxxxxx, xx xx přímo x/xxxx xxxxxxxxxxx xxxxxxx. |
Xxxxx má xxxxxxxxx xxxxx xxxx xxxxxx, xxxxx složka xxxx xxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx xxxxxxxxxx a posléze xxxxxxxxxxx x&xxxx;xxxxxxx na xxxxxxxxxxx xxxxxx (xxx-xx xxxxxxxx, xx mezi xxxxxxxx xxxxxxxxx k vzájemnému xxxxxxxx). Xxxxxxxxxxxx xx xxxxx xxxxxxxx kompletní xxxxx.
Xxxxxxxxx účinnosti
Toto xxxxxxxxx xx xxxxxxxx xx xxxxxxxx, které mají xxxxxxxx xxxxxxxx xxxxxxxxx xxxxx, pokud xxx x&xxxx;xxxxxx xxxxx, xxx xx xxxxxxxxx x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 a příloze I nařízení (XX) x.&xxxx;1831/2003.
1.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;X:&xxxx;XXXXXX DOKUMENTACE
1.1 Veřejný souhrn xxxxxxxxxxx xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003
Xxxxxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx doplňkové xxxxx. Xxxxxx xxxxx xxxxxxxxx xxxxx xxxxxxx xxxxx x&xxxx;xxxx mít xxxx xxxxxxxxx:
1.1.1&xxxx;&xxxx;&xxxx;Xxxxx
|
x) |
xxxxx xxxxxxxx(x); |
|
x) |
xxxxxxxxxxxx xxxxxxxxx xxxxx; |
|
x) |
xxxxxx výroby x&xxxx;xxxxxx xxxxxxx; |
|
x) |
xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx látky; |
|
e) |
navrhované podmínky xxx xxxxx x |
|
x) |
xxxxx xxxxx monitorování v období xx uvedení látky xx xxx. |
1.1.2.&xxxx;&xxxx;&xxxx;Xxxxx
|
x) |
Xxxxx a adresa xxxxxxxx(x) Xxxx údaje xxxx xxx xxxxxxxxxx xx xxxxx případech nezávisle xx druhu xxxxxxxx xxxxxxxxx xxxxx (xxxxxxxx xxxxxx xx držitele xxxx povolení, xxxxx xxxx xxxxxx xx xxxxxxxx). Xxxxxxxxx-xx dokumentaci xxxxxxx žadatelů, xxxx xxx uvedeno jméno xxxxxxx xxxxxxxx. |
|
x) |
Xxxxxxxxxxxx xxxxxxxxx xxxxx Xxxxxxxxxxxx doplňkové xxxxx xxxxxxxx shrnutí požadovaných xxxxxxxxx podle xxxxxxx&xxxx;XX xxxx&xxxx;XXX xxxxx druhu xxxxxxxx xxxxxxxxx xxxxx. Xxxxxxxxx: název xxxxxxxxx xxxxx, xxxxxxxxxx zařazení xx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxxxx xxxxx/xxxxxxxxx xxxxxx a dávky. |
|
c) |
Způsob xxxxxx x&xxxx;xxxxxx analýzy Je xxxxx xxxxxx xxxxxxx xxxxxx. Xx xxxxx xxxxxx obecné xxxxxxx xxxxxxxxxxxx metod, xxx mají xxx xxxxxxx xxx analýzu xxx xxxxxx kontroly xxxxxxxxx xxxxx xxxx xxxxxx, v premixech x&xxxx;xxxxxxxx xxxxx požadavků xxxx xxxxxxx x&xxxx;xxxxxxx&xxxx;XXX. Xxxxxxxxx xx xx xxxxxxx xxxxxxxxx předložených v souladu x&xxxx;xxxxx xxxxxxxx x&xxxx;xxxxxxxx&xxxx;XXX xxxxx xxxxxx xxxxxx (xxxxx) použitých k analýze xxx úřední xxxxxxxx xxxxxxxxxxx xxxxx nebo xxxxxx xxxxxxxxxx v potravinách xxxxxxxxxxx xxxxxx. |
|
x) |
Xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx látky Je xxxxx uvést xxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxxx xxxxxxx provedených studií. Xxxxxxxx xxxxxx xxxxx xxx xxxxxxx x&xxxx;xxxxxx xxxxxxx na xxxxxxx xxxxxx žadatele(ů). Ve xxxxxxx xx xxxx xxx uvedeny pouze xxxxxx xxxxxxxxxx xxxxx xxxxxxx&xxxx;XXX. |
|
x) |
Xxxxxxxxxx xxxxxxxx pro xxxxx Xxxxxxx(x)&xxxx;xxxxxxxx xxxxx xxxxxxxx xxx užití. Xxxxxxx xxxxxxx xxxxxx xxxxx xxxxxxx xx xxxx xxxx xxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx xxx xxxxx x&xxxx;xxxxxxxxxxx krmivech. Xxxxxxxx xx xxxxxx xxxxxxxxx, zda se xxxxxxxxx xxxx xxxxxxx xxxxxxxx xxxx xxxxxxxxxxx xx krmiva nebo xxxx. Je xxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx pro užití (xxxx. xxxxxxxxxxxxxxx), xxxxxxxx xxxxxxxxx xx xxxxxxxxxx x&xxxx;xxxxx zvířat, xxx xxx xx doplňková xxxxx xxxxxx. |
|
x) |
Xxxxx xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx xxxxx xx xxx Xxxx část xx xxxxxxxx xxxxx na xxxxxxxxx látky, které xxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxxx xx xxxxxxxxx&xxxx;x)&xxxx;xxxx&xxxx;x)&xxxx;x&xxxx;xx.&xxxx;6 xxxx.&xxxx;1 xxxxx xxxxxxxx, x&xxxx;xx doplňkové xxxxx, xxxxx xxxxxxx do xxxxxxx působnosti xxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxx xx xxx xxxxxxxx, xxxxx xx skládají x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx modifikované xxxxxxxxx xxxxxxxx xxxx xxxx x&xxxx;xxxx xxxxxxxx. |
1.2&xxxx;&xxxx;&xxxx;Xxxxxxx shrnutí xxxxxxxxxxx
Xx nutno poskytnout xxxxxxx xxxxxxx obsahující xxxxx x&xxxx;xxxxx xxxxx xxxxxxxxx poskytnutých na xxxxxxx xxxxxxx xxxxx xxxx xxxxxxx a přílohy III. Xxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxx (xxxxxxxx).
Xxxxxxx xxxx xxxxxxx xxxxxx této přílohy x&xxxx;xxxxxxx xx xxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx xx xxxxxxxxx xxxxxx xxxxxxxxxxx.
1.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxx
Xxxxxxx musí xxxxx xxxxx a názvy svazků xxxxxxxxxxx xxxxxxxxxx xx xxxxxxx žádosti. Je xxxxx připojit xxxxxxxx xxxxx x&xxxx;xxxxxxx na xxxxxx a strany.
1.4 Seznam xxxxx xxxxxxxxxxx, s nimiž xx xxx xxxxxxxxx jako x&xxxx;xxxxxxxxx údaji
Seznam xxxxxxxx xxxxx xx xxxxxxxxx xxxxxx x&xxxx;xxxxxx dokumentace.
2. ODDÍL II: XXXXXXXX, XXXXXXXXXXXXXXX X&xxxx;XXXXXXXX XXX XXXXX DOPLŇKOVÉ XXXXX; XXXXXX ANALÝZY
Doplňková xxxxx xxxx xxx xxxx xxxxxxxxxxxxxx a charakterizována.
2.1 Identita xxxxxxxxx xxxxx
2.1.1&xxxx;&xxxx;&xxxx;Xxxxx doplňkové xxxxx
Xxxxxxxx xx uvede xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx látek vázaných xx držitele xxxxxxxx.
2.1.2&xxxx;&xxxx;&xxxx;Xxxxx xx zařazení
Je xxxxx xxxxxxxxx xxxxx xx xxxxxxxx xxxxxxxxx xxxxx xx jedné či xxxxxxxx kategorií x&xxxx;xxxxxxxxx xxxxxx xxxxx xxxxxx xxxxxxxx funkcí x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;6 x&xxxx;xxxxxxxx&xxxx;X&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003.
Xxxx xxx xxxxxxxxxx xxxxx x&xxxx;xxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx nebo činidel (xxxx. xxxxx x&xxxx;xxxxxxxxxxx, xxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx, zemědělství x&xxxx;xxxxxxxx). Xx xxxxx xxxxx xxxxxxxx xxxx xxxxxxxx xxxx xxxxxxxxx látka xxxx xxxxxxxxxxxxx xxxxxxxx xxxxx, xxxxxxxxxxx xxxxxx xxxxxxxxx xxxx xxxx xxxx povolení xxxxxx xxxxx.
2.1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx (xxxxxx látka/činidlo, xxxx xxxxxx, xxxxxxxxx, xxxxxxxxxxx xxxxxxxxxxxx xxxxx)
Xx nutno xxxxx účinnou látku(y)/činidlo(a) a všechny xxxxxxx xxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx hmotnostního xxxxxx x&xxxx;xxxxxxx xxxxxxxx. Xx xxxxx stanovit xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx variabilitu xxxxxxxxxxxx xxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx).
Xxx xxxxxxxxxxxxxx: xx xxxxx xxxxxxxx xxxxx životaschopných buněk xxxx xxxx vyjádřený xxxx XXX xx xxxx.
Xxx xxxxxx: xx xxxxx xxxxxx xxxxxxx xxxxxxx (hlavní) xxxxxxxx x&xxxx;xxxxx jednotek xxxxxxxx x&xxxx;xxxxx xxxxxxx produktu. Xx xxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx. Vymezí xx xxxxxxxx xxxxxxxx, xxxxx xxxxx xxxx μmoly xxxxxxxx xxxxxxxx xx xxxxxx xx xxxxxxxxx, xxxxxx x&xxxx;xxxxxxxx pH x&xxxx;xxxxxxx.
Xx-xx xxxxxx složka xxxxxxxxx xxxxx xxxxx xxxxxxxx látek nebo xxxxxxx, xxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxxxxx (xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxx), xxxx xxx složky xxxxxx xxxxx (látek) / xxxxxxx (činidel) xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx podílů x&xxxx;xxxx směsi.
Ostatní xxxxx, xxxxxxx složky xxxxx xxxxxx jedním xxxxxxxxx xxxxxxx x/xxxx xxxx xxxxx xxxxxxx složky xxxxxxxxxxxxx, xxxx xxx xxxxxxxxxxxxxxxx podle xxxxxx (xxxxxx) xxxxxxxxxxxxxx k její xxxxxxxx x/xxxx xxxxx xxxxxxx hlavní xxxxxx (xxxxxx).
Xxxx je dotčena xxxxxxxx žádost o doplňkové xxxxxxxxx xxxxxxxxxx xxxxxx xxxxx čl. 8 xxxx.&xxxx;2 xxxxxxxx (ES) x.&xxxx;1831/2003, xxxxxxx může vynechat xxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxx, jiných než xxxxxx xxxxx xxxx xxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxx, které xxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx, xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx a na xxx xx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx (ES) x.&xxxx;1829/2003. Xxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxxxxxxxx xxxx xxx xxxxxxxxxx xxxxxxxx xx konkrétní doplňkové xxxxx, xxx xxx xx xxxxxxxx povolení, x&xxxx;xxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxxxx. Xx možno xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxxxxx v dokumentech třetích xxxxx x&xxxx;xx xxxxx xxxxxxx za xxxxxx xxxxxxxxxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxxx, xx se identifikátor(y) vztahuje(í) na xxxxxxx, pro něž xx xxxxxx žádost.
2.1.4 Čistota
Žadatel xxxxxxxxxxxx a vyčíslí chemické x&xxxx;xxxxxxxxxxx xxxxxxxxx, xxxxx x&xxxx;xxxxxxxxx xxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxx, xxxxx xxxxxx xxxxxxx záměrně x&xxxx;xxxxxxxxxxxx k aktivitě xxxxxxxxx xxxxx. U produktů xxxxxxxxxxxxx xxxxxxx xxxxxxx xxxxxxx xxxxxxxxxxxx produkčních organismů x&xxxx;xxxxxxxxx látce. Je xxxxx xxxxxx protokol xxxxxxxxx x&xxxx;xxxxxxx kontrole xxxxxxxxx šarží x&xxxx;xxxxxxx xx znečišťující xxxxx x&xxxx;xxxxxxxxx.
Xxxxxxx poskytnuté údaje xxxx xxxxxxxx návrh xx xxxxxxxxxxx xxxxxxxxx xxxxx.
Xxxx xxxx uvedeny xxxxxxxx xxxxxxxxx v závislosti xx xxxxxxxx postupu, xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx Xxxxxxxxxxxx.
2.1.4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx, xxxxxxx xxxxxxxx xx vázané xx xxxxxxxx povolení
U doplňkových xxxxx, xxxxxxx povolení xx xxxxxx xx xxxxxxxx xxxxxxxx, xx nutno xxxxx příslušné xxxxxxxxx xxxxxxxx xx zvláštního xxxxxxx xxxxxxxxx xxxxxxxx xx základě xxxxxxxxxxx xxxxx používaných x&xxxx;xxxxx xxxxxxxxxxxx xxxxxx. Xx xxxxx použít xxxxxxxxxxx Xxxxxxxxxx výboru xxxxxxxxx XXX/XXX xxx xxxxxxxxxxxxx xxxxxxxx látky (JECFA) xxxx xxxxxxxxxxx x&xxxx;xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx xxx xxxxxxxxxxxxx přídatné xxxxx.
2.1.4.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx, jejichž xxxxxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx
X&xxxx;xxxxxxxxxxx látek, xxxxxxx povolení xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx xxxxx xxxxxx xxxxxxxxx normy xxxxxxxxx x&xxxx;xxxxx souvisejícím xxxxxx xxxx normy xx xxxxxxxxxxxxx pro xxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx v Evropském společenství xxxx JECFA. Xxxxxx-xx xxxxxx xxxxx xxxxxxxx xxxx je-li to xxxxxxxx pro xxxxxxx xxxxxx, xx nutno xxxxxx xxxxxxxxxxxx xxxx xxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx:
|
— |
xxx xxxxxxxxxxxxxx: xxxxxxxxxxxxxxx xxxxxxxxxxx, mykotoxiny, xxxxx xxxx; |
|
— |
xxx xxxxxxxx fermentačního xxxxxxx (xxxxx neobsahují xxxxxxxxxxxxxx jako účinná xxxxxxx): je nutno xxxxxxx xxxxxx požadavky xxxx xxx xxxxxxxx xxxxxxxxxxxxxx (xxx xxxx). Xx nutno xxxxx xxxxxx rozsah, v němž xx xx hotového xxxxxxxx zapracováno použité xxxxxxxxxx medium; |
|
— |
pro xxxxx xxxxxxxxxxx xxxxxx: xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx kontaminace (xxxxxxx xxxx. xxxxxx xxxxxx, xxxxxx xxxxxxx, žitný xxxxx), xxxxxxxxxx, xxxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxx xxx xxxxxxxxxxxx a popřípadě xxxxxxxxxxxxx významné xxxxx, x&xxxx;xxxxx xx xxxxx, xx xx xxxxxxxxx x&xxxx;xxxxxxx rostlině; |
|
— |
pro xxxxx xxxxxxxxxxx xxxxxx: xxxxxxxxxxxxxxx xxxxxxxxxxx, xxxxx kovy x&xxxx;xxxxxxxxx maximální xxxxxxx xxx xxxxxxxxxxxx; |
|
— |
xxx minerální xxxxx: xxxxx xxxx, xxxxxxx x&xxxx;XXX; |
|
— |
xxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx: xxxx xx všechny xxxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx x&xxxx;xxxxx se xxxxxx xxxxxxxxxxx. |
Xxxxxxxxx se xxxxxxx xxxxxxx xxxxxxxxxx xxx xxxxxxx podle xxxxxxx xxxxxx.
2.1.5&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxx
X&xxxx;xxxxxxxxx x&xxxx;xxxxx xxxxx xx poskytnou xxxxx x&xxxx;xxxxxxxxx xxxxx xxxxxxxxx částic, formě xxxxxx, hustotě, xxxxxxxx xxxxxxx, protiprašných xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, které xxxx xxxx xx xxxxxxxxx vlastnosti. X&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx stavu xx xxxxxxxxx xxxxx o viskozitě x&xxxx;xxxxxxxxxx xxxxxx. Xxxxx xx xxxxxxxxx xxxxx xxxxxx x&xxxx;xxxxxxx xx xxxx, xx xxxxx xxxxxxxx xxxxxxxxxxx nebo xxxxxx disperze.
2.2 Charakteristika xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx)
2.2.1&xxxx;&xxxx;&xxxx;Xxxxx
Xx xxxxx xxxxx xxxxxxxxxxxx xxxxx xxxxxx xxxxx nebo xxxxxxx. Xx xxxxxxxx xxxxxxx x&xxxx;xxxxx xxxxx xxxx xxxxxxx x&xxxx;xxxx xxxxxxxx charakteristiky.
2.2.1.1 Chemické xxxxx
Xxxxxxxx xxxxxx definované látky xx nutno popsat xxxxxxxx názvem, xxxxxxxxx xxxxxxxxx xxxxx názvosloví XXXXX (Xxxxxxxxxxxxx Xxxxx xx Xxxx and Xxxxxxx Chemistry), dalšími xxxxxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxx a/nebo xxxxxx XXX (Xxxxxxxx Xxxxxxxx Xxxxxxx). Xx xxxxx xxxxx strukturální x&xxxx;xxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
X&xxxx;xxxxxxxx xxxxxxxxxx sloučeniny xxxxxxx xxxx xxxxxxxxxxx xxxxx xx nutno xxxxx xxxxx XXXXXX xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx skupinou. X&xxxx;xxxxxxxxxxx xxxxxxx xx xxxxx uvést fytochemické xxxxxxx.
Xxxxx, v nichž xxxxx xxxxxx popsat xxxxxx xxxxxxxxx xxxxxxx x/xxxx x&xxxx;xxxxx xxxxx xxxxxxx xxxxxx identifikovat, je xxxxx charakterizovat podle xxxxxx (xxxxxx) přispívajících x&xxxx;xxxx aktivitě x/xxxx xxxxx xxxxxxxxx xxxxxxxx xxxxxx. Je xxxxx xxxxxxxxxxxxx markerovou xxxxxxxxxx, xxx xxxx možno xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxxx.
Xxx enzymy x&xxxx;xxxxxxxxx xxxxxx xx xxxxx xxx každou xxxxxxxx xxxxxxxx xxxxx xxxxx x&xxxx;xxxxxxxxxxxx xxxxx xxxxxxxxxx Xxxxxxxxxxx xxxx biochemie (XXX) v posledním vydání „Xxxxxxxxxx enzymů“. X&xxxx;xxxxxxx xxxxx xxxxxxxxxxxx xx xxxxxxx systematický xxxxx xxxxxxxxxxxx pravidlům xxxxxxxxxx XXX. Xxxxxx xxxxx xxxx xxxxxxxxx xx xxxxxxxxxxx, xx jsou xxxxxxxxxxx x&xxxx;xxxx xxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxx xxxxxxxxxxx x&xxxx;xxx xxxxxx xxxxx xxxxxx xx xxx xxxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxx x&xxxx;xxxxx XXX. Je xxxxx xxxxx biologický xxxxx xxxxx xxxxxxxx xxxxxxxx.
Xx xxxxx xxxxxx rovněž xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxx xxxxxxxxx fermentací (xxx bod 2.2.1.2 Mikroorganismy).
2.2.1.2 Mikroorganismy
Je xxxxx xxxxx xxxxx xxxxx xxxxxxxxxxxxxx používaných xxxx xxxxxxx xxxx xxxxxxx xxxx.
X&xxxx;xxxxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxx xxxx xxxx výrobní xxxx xx nutno xxxxx xxxxxxxx xxxx. Uvede xx název x&xxxx;xxxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxxxxxx xxxxx xxxxxxxxxxxx zveřejněných xxxxx x&xxxx;xxxxxxxxxxxxx nomenklaturních xxxxxx (XXX). Mikrobiální xxxxx xxxx být xxxxxxx x&xxxx;xxxxxxxxxxx uznávané xxxxxx kultur (xxxxx xxxxx x&xxxx;Xxxxxxxx xxxx) x&xxxx;xxxxxxxxxx sbírkou xxxxxx xx povolenou dobu xxxxxxxxx xxxxxxxxx xxxxx. Xx nutno xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx od xxxxxx, xxxxx xxxxxxxxx xxxxxxxxx číslo, xxx xxxxxx xx kmen xxxxxx. Xxxx je xxxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx, xxxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx nezbytné xxx jedinečnou xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx potvrzení xxxx genetické xxxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xx xxxxx popis xxxxxxxxxxx xxxx. Xxx xxxxx xxxxxxxxx modifikovaný xxxxxxxxxx se uvede xxxxxxxxxxx identifikační xxx xxxxx nařízení Xxxxxx (XX) x.&xxxx;65/2004 xx xxx 14.&xxxx;xxxxx 2004, xxxxxx se zřizuje xxxxxx tvorby x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxx xxx xxxxxxxxx modifikované xxxxxxxxx.
2.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxxx
2.2.2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx látky
Je xxxxx xxxxx popis xxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx. Xxxxxxxxx xxxxxxxx, xXx, xxxxxxxxxxxxxxx xxxxxxxxxx, xxx xxxx, xxx xxxx, xxxxxxx, xxxx xxx, xxxxxxxxxxx ve xxxx x&xxxx;x&xxxx;xxxxxxxxxxx rozpouštědlech, Xxx x&xxxx;Xx/Xxx, xxxxxxxxxx xxxxxxxxxxxxx x&xxxx;xxxxxxxxx spektra, xxxxx XXX, xxxxxxxx xxxxxxx x&xxxx;xxxxxxxxx jiné důležité xxxxxxxxx xxxxxxxxxx musí xxx xxxxxxx, kde xx xx xxxxxx.
Xxxxx xxxxxxx prostřednictvím xxxxxxxxxxxxx xxxxxxx nesmí xxxxxxxxx xxxxxxxxxxxxxxx aktivity xxxxxxxx xxx xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxx xxxx xxxxxx.
2.2.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxxx
|
— |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxx Xx nutno xxxxxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxxx virulence xxxx jejich xxxxxxxxxxxx. Xxxxx xxxxxxxx náležející xx xxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxx, x&xxxx;xxxxx je známo, xx xxxxx xxxxxxxxxx xxxxxx xxxx xxxx xxxxxxx virulence, je xxxxx podrobit xxxxxxxxxxxxx xxxxxx s cílem xxxxxxxx xx molekulové x&xxxx;xxxxxxxxx xxxxxxx xxxxxx, xx xxxxxxxxxx xxxxx x&xxxx;xxxxxx. X&xxxx;xxxxx xxxxxxxxxxxxxx, pro xxx xxxxxx x&xxxx;xxxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxx není xxxxx dostatečně známa, xx nezbytný celý xxxxxxx xxxxxxxxxxxxxxx xxxxxx. |
|
— |
Xxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxx xxxxxxxxxxxx Xxxxxxxxxxxxxx používané jako xxxxxxxxx xxxxx xxxx xxxx xxxxxxx kmen xxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxx nesmí xxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx látky, xxxxx xxxx xxxxxxxx xxxx xxxxxxxxxxx x&xxxx;xxxxxxx a zvířat. Kmeny xxxxxxxxxxxxxx xxxxxx k použití xxxx doplňkové látky xxxxx dále přispívat x&xxxx;xxxxxx xxxx xxxxxxxxxx xxxx xxxxxxxxxxxx, xxxxx xx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxx xxxxxx x&xxxx;x&xxxx;xxxxxxxx prostředí. Xxxxxxx xxxxx xxxxxxxx je xxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx. Xx-xx xxxxxxxx rezistence, xx xxxxx zjistit xxxxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx rezistence na xxxxxxx organismy xx xxxxxxxx. Xxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx antimikrobiální xxxxxxxxxx xx xxxxx používat xxxx xxxxxxxxx xxxxx, xxxxx-xx xxxxxxxx, xx xxxxxxxxxx xx výsledkem xxxxxxxxxxxx xxxxxx(x)&xxxx;x&xxxx;xxxx přenosná. |
2.3 Výrobní xxxxxx, xxxxxx xxxxxxxxxx xxxxxxxxx postupů
Ke xxxxxxxxx xxxxxxxxxx xxxx procesu, xxxxx xxxxx mít xxxx xx xxxxxxx xxxxxx xxxxx / xxxxxxx (xxxxxxx) xxxx xxxxxxxxx xxxxx, se xxxxx xxxxx xxxxxxxxx xxxxxxx. Xx xxxxx xxxxxxxxx xxxxx x&xxxx;xxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx u chemických xxxxx xxxxxxxxxxx ve xxxxxxxx xxxxxxx.
2.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxx(x) / činidlo(a)
Je nutno xxxxxxxxxx popis výrobního xxxxxxx (např. xxxxxxxx xxxxxxx, xxxxxxxxxx, xxxxxxxxx, xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx) xxxxxxxxx xxx xxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) xxxxxxxxx xxxxx, xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx. Uvede xx xxxxxxx fermentačního/kultivačního xxxxx. Xx xxxxx xxxxxx xxxxxxxx xxxxxx xxxxxxx.
X&xxxx;xxxxxxxxx modifikovaných xxxxxxxxxxxxxx (XXX) xxxxxxxxxxx xxxx xxxxx doplňkových xxxxx x&xxxx;xxxxxxxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxxxxxx se xxxxxxx xxxxxxxx Rady 90/219/XX&xxxx;(5). Je xxxxx xxxxx xxxxx xxxxxxxxxxxxx xxxxxxx (xxxxxx xxx xxxxxxx, xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx zpracování xxxxxxxx xxxxxxxxxxxxx xxxxxxx).
2.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx látka
Předloží xx podrobný xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx. Xx xxxxx xxxxx hlavní xxxxxx xxxxxx xxxxxxxxx xxxxx, xxxxxx míst (xxxxx) xxxxxxxxxxx xxxxxx xxxxx (xxxxx) / činidla (xxxxxxx) x&xxxx;xxxxxx složek x&xxxx;xxxxxxx následné stupně xxxxxxxxxx, které xxxx xxxx xx přípravu xxxxxxxxx látky, xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx.
2.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx-xxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx
2.4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx
Xxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxxxx sledováním xxxxxx xxxxx (xxxxx) / xxxxxxx (xxxxxxx) xxxx xxxx (xxxx) xxxxxxxx/xxxxxxxxxxxxxxxx. U enzymů xxx xxxxxxxxx xxxxxxxxx s ohledem xx ztrátu xxxxxxxxxxx xxxxxxxx; x&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxx xx xxxxxx xxxxxxxxxxxxxxxx; x&xxxx;xxxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx xx xxxxxx xxxxx. X&xxxx;xxxxxxxxx xxxxxxxxxx xxxxx/xxxxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxxxx jedné xxxx několika xxxxxxxx xxxxxxxxxxxxxx xxxxx.
Xxxxxxxxx doplňkové xxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx každého složení xxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx (světlo, xxxxxxx, xX, xxxxxxx, xxxxxx x&xxxx;xxxxxxx materiály). Xxxxxxxxxxxxx xxxxxxxxxxx doplňkové látky x&xxxx;xxxxxxxxxxxxxx xxxxx xx xxxx být založena xx xxxxxxx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx spektrum xxxxxxxx xxx xxxxx (xxxx. 25&xxxx;xX, 60&xxxx;% xxxxxxxxx xxxxxxx xxxxxxx x&xxxx;40&xxxx;xX, 75&xxxx;% xxxxxxxxx xxxxxxx xxxxxxx).
Xxxxxxxxx xxxxxxxxx látky xxxxx v premixech a krmivech
U doplňkových xxxxx užitých v premixech x&xxxx;xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxx se xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx ověří xx xxxxxxx výrobních a skladovacích xxxxxxxx xxxxxxx a krmiv. Xxxxxx stability xxxxxxx xxxx trvat xxxxxxx xxxx měsíců. Xxxxxxxxx xx xxxxxxx xxxxx xxxxx x&xxxx;xxxxxxx obsahujících xxxxxxx xxxxx; x&xxxx;xxxxxxx xxxxxxx by doplňková xxxxx xxxx xxx xxxxxxxx nápisem „xxxxxxxx xx xxxxxxxxx xxxxx“.
Xxxxxx xxxxxxxxx x&xxxx;xxxxx xxxxxx xxxxxxxx nejméně xxx xxxxxx. Xxxxxxx se xxxxxxxxx xxxxxxxxxx u krmiv xx xxxxx xxxx x&xxxx;xxxxxxxxxxxx krmiv (xxxxxx xxxxx xxxxxxxxxx xxxx xxxxxx xxxxx xxxxxx) xxx xxxxxx xxxxxxx xxxxx xxxxxx.
X&xxxx;xxxxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxx xx xxxx je xxxxx xxxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxxx xx xxxx xx xxxxxxxx xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxx.
Xxxxx-xx xx ztrátě xxxxxxxxx a ve xxxxxxxx xxxxxxxxx xx xxxxx xxxxxxxxxxxxxxx xxxxxxxx produkty xxxxxxxxx nebo xxxxxxxx.
Xx xxxxx xxxxxxxxxx údaje x&xxxx;xxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxx pozorování xx začátku x&xxxx;xxxxx xx konci xxxx xxxxxxxxxx.
X&xxxx;xxxxxxx xxxxxxx xxxxxx xxxxxxxx podrobné xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx premixů xxxx xxxxx xxxxxxxxx xxx zkoušky.
2.4.2 Homogenita
Je nutno xxxxxxxx schopnost xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky (xxxxx zchutňujících xxxxxx) x&xxxx;xxxxxxxxx, xxxxxxxx nebo xx vodě.
2.4.3 Ostatní vlastnosti
Je xxxxx xxxxxx xxxxxxx xxxxxxxxxx, xxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx.
2.4.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx-xxxxxxxx xxxxxxxxxxxxxxx xxxx xxxxxxxxx
Xx xxxxx xxxxx xxxxxxxxx-xxxxxxxx xxxxxxxxxxxxxxx nebo xxxxxxxxx, x&xxxx;xxxx xx xxxxx xxxxx xx xxxxx x&xxxx;xxxxxx, nosiči, jinými xxxxxxxxxx xxxxxxxxxxx látkami xxxx léčivými xxxxxxxxx.
2.5&xxxx;&xxxx;&xxxx;Xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx
2.5.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx xxxxxxx xx výživě zvířat
Je xxxxx xxxxx druh xxxx kategorie xxxxxx, xxxxxxx xxxxxxx xxxx xxxxxxxxx stadium xxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxx&xxxx;XX xxxxxx nařízení. Xx xxxxx zmínit xxxxx xxxxxxxxxxxxxx. Uvede xx xxxxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxx ve xxxx.
Xx xxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxx xxxxxxx, xxxxxx xxxx xxxxxx xxxx. Xxxxx xx navrhovaná xxxxx x&xxxx;xxxxxxxxxx krmivu x&xxxx;xxxxxxxxxx xxxx xxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx. Pokud xx xxxxxxxx konkrétní xxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxx, je nutné xxxxxxxxxx.
2.5.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxxx s bezpečností xxx xxxxxxxxx/xxxxxxxxxx
2.5.2.1&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx listy x&xxxx;xxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxxxxxx xxxxxxxxxx směrnice Xxxxxx 91/155/XXX ze xxx 5.&xxxx;xxxxxx 1991, kterou xx x&xxxx;xxxxxxxxx xxxxxx&xxxx;10 xxxxxxxx 88/379/EHS vymezují x&xxxx;xxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx přípravky (6). X&xxxx;xxxxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxx xxxxxx, xxxxxxxxxx, xxxxx a likvidaci.
2.5.2.2 Mikroorganismy
Je xxxxx xxxxx xxxxxxxxxxx xxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2000/54/ES ze xxx 18.&xxxx;xxxx 2000 x&xxxx;xxxxxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxxxx s expozicí xxxxxxxxxxx xxxxxxxxx při xxxxx (sedmá xxxxxxxxxx xxxxxxxx xx&xxxx;xxxxxx čl. 16 xxxx.&xxxx;1 xxxxxxxx 89/391/XXX)&xxxx;(7). X&xxxx;xxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxx xx xxxxxxx&xxxx;1 xxxx xxxxxxxx je xxxxx xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx, xxxxx xxx xxxxxx xxxxxxxx xxxxxxxxx opatření xx xxxxxxx xxxxxxxxxx, xxx xx stanoveno x&xxxx;xx.&xxxx;3 xxxx.&xxxx;2 uvedené xxxxxxxx.
2.5.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx na xxxxxxxxxx
Xxxx xxxx dotčena ustanovení x&xxxx;xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx x&xxxx;xxxxxx&xxxx;16 nařízení (XX) x.&xxxx;1831/2003, xx xxxxx xxxxx zvláštní požadavky xx xxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxx pro xxxxx a manipulaci (xxxxxx xxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx) x&xxxx;xxxxxx pro správné xxxxxxx.
2.6&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx a referenční xxxxxx
Xxxxxx analýzy xx xxxxxx xx standardní xxxxxx xxxxx xxxxxxxxxx xxxxx XXX (xx. XXX 78-2).
Xxxxx xxxxxxxx (XX) x.&xxxx;1831/2003 a nařízení (XX) č. 378/2005 metody xxxxxxx xxxxxxx v tomto xxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx. Referenční xxxxxxxxx Xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxx, x&xxxx;xxx xx uvádí, xxx xxxx tyto xxxxxx vhodné xxx xxxxxxx xx xxxxxx xxxxxxxx kontrol xxxxxxxxx xxxxx, xx niž xx xxxxxx xxxxxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xx xxxxxx xx xxxxxx stanovené x&xxxx;xxxxxx&xxxx;2.6.1 x&xxxx;2.6.2.
Xxxxx byl xxxxxxxx XXX xxx xxxxx, xx xxx xx xxxxxxxx xxxxxxxx Xxxx (EHS) x.&xxxx;2377/90 xx xxx 26.&xxxx;xxxxxx 1990, xxxxxx xx xxxxxxx xxxxxx Xxxxxxxxxxxx xxx stanovení xxxxxxxxxxx xxxxxx reziduí xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxx původu (8), xxxxxx xxx&xxxx;2.6.2 xxxxxxxxx hodnocení xxxxxxxxxx laboratoře Xxxxxxxxxxxx. Xxxxxxx sestaví bod 2.6.2 xxxxxxxxxx stejnou xxxxxx, xxxxxxxxx a údaje (xxxxxx xxxxxxxxxxx aktualizací), xxx xxxx xxx xxxxxxxxxx Xxxxxxxx agentuře xxx xxxxxx xxxxxxxxx (XXXX) x&xxxx;xxxxxxx x&xxxx;xxxxxxxx&xxxx;X&xxxx;xxxxxxxx (XXX) x.&xxxx;2377/90 a podle dokumentu „Xxxxxx to Xxxxxxxxxx xxx Xxxxxxxxxx“, xxxxxx&xxxx;8 „Xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xx the Xxxxxxxx Union“.
V hodnocení mohou xxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxx popsané x&xxxx;xxxx&xxxx;2.6.3, xxxxx xx xxxxxxxxxx laboratoř Xxxxxxxxxxxx, xxxx xxxx Xxxxxx xxxxxxxx xx xxxxxxxx.
X&xxxx;xxxxxxx x&xxxx;xxxxxxxxx (XX) č. 378/2005 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx xxxx xxxxxxxxx xxxx xxxxxxxxxxxxx.
Xxxxxxxx xxxxxx na xxxxxxxx xxxxxx xxxxxxxxx referenční xxxxxxxxxx Xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx&xxxx;12 nařízení (XX) x.&xxxx;378/2005.
2.6.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx xxx xxxxxxx xxxxx
Xx xxxxx xxxxxxxxxx xxxxxxxxx charakteristiku xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxx (xxxxx) xxx xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxx látky (xxxxx) / xxxxxxx (xxxxxxx) x&xxxx;xxxxxxxxx xxxxx, xxxxxxxxx, krmivech a popřípadě xxxx.
|
2.6.1.1 |
Xxxx xxxxxx xxxxxxx xxxxxx xxxxxxxxx xxxx x&xxxx;xxxxxxx xxxxx xxxxxxx xxxxxxxxxxx xxx xxxxxx xxxxxxxx podle xxxxxx&xxxx;11 xxxxxxxx (XX) č. 882/2004. Xxxxxxx xxxxxxx nejméně xxxxx x&xxxx;xxxxxx xxxxxxxxx:
|
|
2.6.1.2 |
Xxxxxxxx xxxxxxxxxxxxxxx xxxxxx (xxxxx) xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxxxx (ES) x.&xxxx;882/2004. |
|
2.6.1.3 |
Xxxxxxxx charakteristiky xxxxx xxxxxxxxxxxx xxxxxxx se xxxxx otestováním metody x&xxxx;xxxxx akreditované a nezávislé xxxxxxxxxx. Xxxxxxxxx xx xxxxxxxx těchto testů xxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxxxxxxxx dokládajícími xxxxxxxxxxxxxx xxxxxx na xxxxxx xxxxxxxxx laboratoř. X&xxxx;xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx v případě, xx xxxxx laboratoř xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx Společenství, xxx xx stanoveno x&xxxx;xxxxxxxx (XX) x.&xxxx;378/2005, xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxx o zájmech (xxxxxxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx xxxxxx žádost) xxxxxxxxxx xxxxx laboratoře x&xxxx;xxxxxxxxxxx x&xxxx;xxxxx xxxxxxx x&xxxx;xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxx. |
|
2.6.1.4 |
Xx xxx xxxxxxxxx xxxxxx xxx xxxx xxxx xxxxxxxxxx laboratoř Xxxxxxxxxxxx vybrat xxxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxx&xxxx;XXX xxxxxxxx (XX) x.&xxxx;882/2004. |
|
2.6.1.5 |
Xxxxxxxx xxxxxxxxxxxxxxx xxx xxxxxx xxxxxxxxxx skupin látek (xxxxxxxxx xxxxxx) mohou xxx stanoveny x&xxxx;xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx referenční xxxxxxxxxx Xxxxxxxxxxxx xxxxx xxxxxx&xxxx;12 nařízení (XX) x.&xxxx;378/2005. |
2.6.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx pro xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx nebo jejích xxxxxxxxxx x&xxxx;xxxxxxxxxxx
Xx xxxxx xxxxxxxxxx podrobnou xxxxxxxxxxxxxxx xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxx pro xxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x/xxxx xxxxxxxxxx doplňkové látky x&xxxx;xxxxxxxx tkáních a živočišných xxxxxxxxxx.
|
2.6.2.1 |
Xxxx metody xxxxxxx xxxxxx požadavky xxxx x&xxxx;xxxxxxx xxxxx xxxxxxx xxxxxxxxxxx pro úřední xxxxxxxx xxxxx xxxxxx&xxxx;11 xxxxxxxx (XX) x.&xxxx;882/2004. Xxxx metody splňují xxxxxxx xxxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxxxxx x&xxxx;xxxx 2.6.1.1. |
|
2.6.2.2 |
Xxxxxxxx xxxxxxxxxxxxxxx metody (xxxxx) zahrnuje xxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxxxx (ES) č. 882/2004 x&xxxx;xxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxxx v rozhodnutí Komise 2002/657/XX&xxxx;(10). Xxxxxxxxx xx xxxxx stejné xxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx Xxxxxx, která xxxxxxx xxxxxxxxxx metody xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxxx reziduí x&xxxx;xxxxxx xxxxxxxxx xxxxx xxxxxxxx Xxxx 96/23/ES. Limit xxxxxxxxxxxx x&xxxx;xxxxx xxxxxx xxxxx xxxxxxxxx polovinu odpovídajícího XXX x&xxxx;xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xx xxxxx xxxxxxxx xx xxxxxxxxxxx XXX. |
|
2.6.2.3 |
Xxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxx xx xxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx. Xx xxxxx xxxxx xxxxxxxx těchto xxxxx. X&xxxx;xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx, xx xxxxx laboratoř xx xxxxxxxxxx xxxxxxxxx xxxxxxxxx referenčních xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxx Xxxxxxxxxxxx, xxx xx xxxxxxxxx x&xxxx;xxxxxxxx (XX) x.&xxxx;378/2005, dotyčná xxxxxxxxx xxxxx referenční xxxxxxxxxx Xxxxxxxxxxxx xxxxxxxxxx o zájmech (xxxxxxx xxxxxxxxxx xxxxxxxxx Xxxxxxxxxxxx obdrží žádost) xxxxxxxxxx práci xxxxxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxx xxxxxxx x&xxxx;xxxxx se xxxxxxxx xxxxxxxxxxx žádosti. |
|
2.6.2.4 |
Ve své xxxxxxxxx xxxxxx xxx xxxx xxxx xxxxxxxxxx xxxxxxxxx Společenství xxxxxx xxxxxx charakteristiky x&xxxx;xxxxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxx&xxxx;2.6.2.2. |
|
2.6.2.5 |
Xxxxxxxx charakteristiky xxx metody pro xxxxxxxx xxxxxxx xxxxx (xxxxxxxxx xxxxxx) xxxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx poskytnutých xxxxxxxxxx xxxxxxxxxx Společenství podle xxxxxx&xxxx;12 xxxxxxxx (ES) x.&xxxx;378/2005. |
2.6.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx týkající xx xxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxxx xxxxx
Xxxxxxx poskytne xxxxx metod použitých xx xxxxxxxxx xxxxxxxxxxxxxx xxxxx xxxx&xxxx;2.1.3, 2.1.4, 2.1.5, 2.2.2, 2.4.1, 2.4.2, 2.4.3 x&xxxx;2.4.4.
X&xxxx;xxxxxxx x&xxxx;xxxxxxxx&xxxx;XX xxxxxxxx (XX) x.&xxxx;1831/2003 ve xxxxx xxxxxxxx (ES) č. 378/2005 xxxxx xxx xxxxxxxxxxx xxxxxx xxxxxx poskytnuté xxxxx xxxxxx bodu, xxxxx to úřad xxxx Xxxxxx xxxxxxxx xx důležité pro xxxxxxxxx xxxxxxx.
Xxxxxxxxxx xx, xxx xxxxxx xxxxxxx x&xxxx;xxxxx bodě xxxx xxxxxxxxxxx xxxxxx. Xxxxxx, xxxxx xxxxxx mezinárodně xxxxxx, xx nutno xxxx xxxxxx. V těchto xxxxxxxxx xxxx být xxxxxx xxxxxxxxx akreditovanými x&xxxx;xxxxxxxxxxx laboratořemi x&xxxx;xxxx xxx zdokumentovány podle xxxxxxxxxxx xxxxx xxxxxxx (xxxx. správná xxxxxxxxxxx xxxxx podle xxxxxxxx 2004/10/XX nebo xxxxx XXX).
Xxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx doplňkové xxxxx xxxxxxx stejné xxxxxxxxx xxxx metody xxxxxxx xxxxxxxxx xxx xxxxxx xxxxxxxx xxxxx xxxxxx&xxxx;11 xxxxxxxx (ES) x.&xxxx;882/2004, xxxxxxx pokud xxxx xxxxxxxxx právní xxxxxxxxx (xxxx. xxxxxxxxx, xxxxxxxxx xxxxx).
3.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XXX: STUDIE XXXXXXXX XX BEZPEČNOSTI XXXXXXXXX XXXXX
Xxxxxx xxxxxxx x&xxxx;xxxxx xxxxxx x&xxxx;xx zvláštních xxxxxxxxx xxxx xxxxxxx xxxxxxxxxxx:
|
— |
xxxxxxxxxxx použití doplňkové xxxxx xxx cílové xxxxx zvířat, |
|
— |
případného rizika xxxxxxxxxxxxx xx xxxxxxx x/xxxx přenosem xxxxxxxxxx xxxx xxxxxxxxxxxxxxxx látkám x&xxxx;xxxxx xxxxxxxxxxx a uvolňováním xxxxxxxxxxxxxx, |
|
— |
xxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xx xxxxxx, xxxx xxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxx látku xxxx xxxxxx ošetřená doplňkovou xxxxxx, xxxx xxxxx, xxxxx xxxxx vyplývat x&xxxx;xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx doplňkové xxxxx xxxx xxxxxx metabolitů, |
|
— |
rizik xxx osoby xxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxx xxxx xxxxxxx xxxx xxxxxxxxxxxx xx xxxxxxx xx xxxxx, vznikajících při xxxxx xxxxxxxxxx xx xxxxxxxx xxxxxxxx, xxx xxxx xxxx a |
|
— |
rizik xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx látky nebo xxxxxxxx z ní odvozených, xxxxxxxxxx xxxxx x/xxxx xxxxxxxxxxxx xxxxxxx, xx xxxxxxx prostředí. |
3.1 Studie xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx látky xxx xxxxxx druhy zvířat
Studie xxxxxxx v tomto oddíle xxxx xxxxxx x&xxxx;xxxxxxxxxxx:
|
— |
xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx cílové druhy xxxxxx x |
|
— |
xxxxxxxxxx xxxxxx xxxxxxxxxxxxx xx xxxxxxx x/xxxx přenosem xxxxxxxxxx xxxx xxxxxxxxxxxxxxxx xxxxxx x&xxxx;xxxxx perzistencí x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxx. |
3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx u cílových xxxxx xxxxxx
Xxxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxxxx vyhodnocení krátkodobé xxxxxxxx xxxxxxxxx látky x&xxxx;xxxxxxxx xxxxxx. Xxxxxxx xx xxxxxx xx xxxxxxxxx xxxxxxx xxx xxxxxxxxxx, pokud xx xxxxxxxxx xxxxx xxxxxx x&xxxx;xxxxxxx vyšších, než xx xxxxxxxxxx. Tyto xxxxx xxxxxxxxx xx xxxxx provést k doložení xxxxxxxxxxx xxx xxxxxxx xxxxxx xxxxx/xxxxxxxxx zvířat, xx něž xx xxxxxx xxxxxxxx. X&xxxx;xxxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxx tolerance xx xxxxx xx xxxxxxx xxxxxxxxx, pokud xxxx xxxxxxx xxxx xxxxxxx xxxxxxxxx xx tyto xxxxx. Všechny studie xxxxxxx x&xxxx;xxxxx oddíle xxxx být založeny xx xxxxxxxxx xxxxx xxxxxxx v oddíle II.
3.1.1.1 Návrh xxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxx skupiny:
|
— |
skupinu, xxx xx xxxxxxxxx xxxxx xxxxxxxx, |
|
— |
xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxxx a |
|
— |
pokusnou skupinu x&xxxx;xxxxxxxxxxxxx xxxxxxx nejvyšší xxxxxxxxxx xxxxx. |
X&xxxx;xxxxxxx skupině xx xxxxxxxxx látka xxxxxxx xxxxxx xx xxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxxx s ohledem xx xxxxxxxx xxxxxx klinických xxxxxx, xxxxxxxx charakteristiky, xxxxxxxxx jakost xxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxx x&xxxx;xxxx xxxxxxxxx, které xxxxxxxxxxxxx souvisejí x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx doplňkové xxxxx. Xxxxxx se xx xxxxx xxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxx zvířat. X&xxxx;xxxxx xxxxxx se xxxxxx xxxxxx případné xxxxxxxxx xxxxxx zjištěné xxxxx xxxxxxx xxxxxxxxx. V případě xxxxxxxxxxxxxx xxxxx xxx xxxxx xxxxxxxxx xx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx.
Xxxxx xxx xxxxxxxx, xx je snášen 100xxxxxxx maximální xxxxxxxxxx xxxxx, nepožaduje xx xxxxxxxxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxx. Je-li xxxxxxx xxxxxx pouze xxx xxxxxx xxxxxx, xxx xx 10násobek nejvyšší xxxxxxxxxx xxxxx, xx xxxxxx navržena xxx, xxx xxxx možno xxxxxxxxx xxxxxxx pro xxxxxxxxxx doplňkové látky, x&xxxx;xxxxxx xx xxxxxxxxx xxxxxxxxx (pomocí xxxxxxxxx, xxxxxxxxx histologie x&xxxx;xxxxxx xxxxxxxx xxxxxxxx).
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx nemusí xxx x&xxxx;xxxxxxxxxx xx xxxxxx xxxxxxxxxxx a metabolismu xxxx xxxxx xxxxx xxxxxxx xxxxx tolerance.
Použité xxxxxxxxxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxx statistické xxxxxxxxxxx.
3.1.1.2&xxxx;&xxxx;&xxxx;Xxxx xxxxxx zkoušek xxxxxxxxx
Xxxxxxx&xxxx;1
Xxxx trvání xxxxxxx xxxxxxxxx: xxxxxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx studií |
Charakteristika xxxxxxxx xxxxxx |
|
Xxxxxx xxxxxx |
14&xxxx;xxx |
Xxxxx xxxxx xx 14&xxxx;xxx do xxxxxxx |
|
Xxxxxxxxx xxxxxx |
42&xxxx;xxx |
42&xxxx;xxx xx xxxxxxx |
|
Xxxxx prasat |
42 dní |
Tělesná xxxxxxxx xx xxxxxxx xxxxxx ≤&xxxx;35&xxxx;xx |
|
Xxxxxxxx xxxxxx k reprodukci |
1 cyklus |
Od xxxxxxxxxx xx konce xxxxxxx |
X&xxxx;xxxxxxx xxxxxxx týkající xx sajících x&xxxx;xxxxxxxxxxx xxxxx se považuje xx xxxxxxxxxxx kombinovaná xxxxxx (14xxxxx xxx xxxxxx xxxxxx x&xxxx;28xxxxx xxx odstavená xxxxxx). Xxxxx xxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx, xxxxxxxxxx xx xxxxxxxx xxxxxx xxx xxxxx xxxxxx.
Xxxxxxx&xxxx;2
Xxxx xxxxxx xxxxxxx xxxxxxxxx: drůbež
|
Cílová xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx cílových xxxxxx |
|
Xxxxx xxxxx/xxxxxx |
35&xxxx;xxx |
Xx xxxxxxxxx |
|
Xxxxxxx |
56&xxxx;xxx |
Xxxxx xxxxx xxxxx xxxxx xxxxxxx xxxx xxxxxx |
|
Xxxxx xxxx |
42&xxxx;xxx |
Xx xxxxxxxxx |
Xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxx xxxxx xxxx xxxx xxx xxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx xxxxx x&xxxx;xxxxx xxxx x&xxxx;xxxxxxx xxxx.
Xxxxxxx&xxxx;3
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxx
|
Xxxxxx xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxx xxxxx |
28&xxxx;xxx |
Xxxxxxx xxxxxxx xxxxxxxx ≤&xxxx;70&xxxx;xx |
|
Xxxxxx xxxxx; xxxxx skotu xxxx xxxx x&xxxx;xxxxxxxxxx |
42&xxxx;xxx |
|
|
Xxxxxxx |
56&xxxx;xxx |
X&xxxx;xxxxxxx xxxxxxx xxxxxxxxxx xx xx xxxxxx telat x&xxxx;xxxxx xxxxx se xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx studie (28 dnů xxx xxxxx xxxxxx).
Xxxxxxx&xxxx;4
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxx
|
Xxxxxx zvířata |
Doba xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxxx xxxxxx x&xxxx;xxxxx xxxxxx |
28&xxxx;xxx |
Xxxxxxx&xxxx;5
Xxxx xxxxxx xxxxxxx xxxxxxxxx: xxxxxxxxxx a jiné ryby
|
Cílová xxxxxxx |
Xxxx trvání xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx xxxxxx |
|
Xxxxx x&xxxx;xxxxxx |
90&xxxx;xxx |
Xxxx xxxxxxxxxxx 90xxxxx xxxxxx xx bylo možno xxxxxxx studii, kdy xxxx zvýší svou xxxxxxxx xxxxxxxx oproti xxxxxxx xxxxxxx xxxxxxxxx xx začátku xxxxxxx xxxxxxx dvojnásobně.
Má-li být xxxxxxxxx xxxxx používána xxxxx xxx hejno xxxxxxxxx xxx, xxxxx xxxxxxxxx se xxxxxxxx xxxxx možno co xxxxxxxx xxxx xxxxx. Xxxxx tolerance trvají 90&xxxx;xxx x&xxxx;xx xxxxx xxxxxxx pozornost xxxxxxx x&xxxx;xxxxxxx jiker.
Tabulka 6
Doba trvání xxxxxxx xxxxxxxxx: xxxxxxx x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxx xxxxxxx, která nejsou xxxxxx k produkci potravin
|
Cílová xxxxxxx |
Xxxx xxxxxx studií |
Charakteristika xxxxxxxx xxxxxx |
|
Xxx x&xxxx;xxxxx |
28&xxxx;xxx |
Xxxxxxx 7
Xxxx trvání zkoušek xxxxxxxxx: xxxxxxx
|
Xxxxxx&xxxx;xxxxxxx |
Xxxx xxxxxx xxxxxx |
Xxxxxxxxxxxxxxx xxxxxxxx zvířat |
|
Výkrm xxxxxxx |
28&xxxx;xxx |
|
|
Xxxxxx xxxxxxx |
1&xxxx;xxxxxx |
Xx xxxxxxxxxx xx xxxxx xxxx xxxxxxx |
Xxxxxxxx-xx xx xxxxxx xx xxxxxx x&xxxx;xxxxxxxxx xxxxxxx, xxxxxxxx se xx xxxxxxxxxx xxxxxx 49&xxxx;xxx (xxxxxxxx týden xx xxxxxxxx) a musí xxxxxxxxx králice xx xx odstavu.
Pokud se xxxxxxxxx xxxxx používá xx xxxxxxxxxxx x&xxxx;xxxxxx xxxx, xxx xx xxxxxxx x&xxxx;xxxxxxxx kategorie xxxxxx, xxxxxx xx xxxxx xxxxxxxxxxxx xxxxxxxx xxx xxxxx. Xxxxxx xxxxxxxxxx xxxx xxxxx xxx xxxxxx xxx 28&xxxx;xxx x&xxxx;xxxx xxxxxxxxx xxxxxxxxx parametr (např. x&xxxx;xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxx xxxx xxxxxxxxxx xxxxx xx xxxxxxxx xx období xxxxxxxx xxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxxxx xx období xxxxxxx).
3.1.1.3&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxx
Xxxxxx xxxx xxx uvedeny jednotlivě x&xxxx;xxxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxxx. Xxxxxxxx protokol xxxx být xxxxxxx xxxxxxxxxx s ohledem xx xxxxxx xxxxxxx xxxxx. Xxxxxxxxxxxxx se zejména xxxx položky:
|
1. |
stádo xxxx xxxxx: xxxxx x&xxxx;xxxxx; xxxxxxxx krmení x&xxxx;xxxxx, xxxxxx xxxxxx; x&xxxx;xxxxxxx xxxxx xxxxxxxx a počet xxxxxx xxxx xxxxx x&xxxx;xxxxxxxxxxxx, světelné xxxxxx x&xxxx;xxxxxxx xxxx, xxxxxx xxxxxxx xxxx x&xxxx;xxxxxx xxxx xx xxxx; |
|
2. |
xxxxxxx: xxxx (u vodních xxxxx xxxxxxxx xxx lidskou xxxxxxxx je uvedena xxxxxxxxxxxx podle xxxxxx xxxxxxxx xxxxx x&xxxx;xx xxx v závorkách xxxxxxxxx xxxxxxxx binomické xxxxx), xxxxxxx, stáří (xxxxxxxx x&xxxx;xxxxxxx druhů), pohlaví, xxxxxx xxxxxxxx, xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxx; |
|
3. |
xxxxx x&xxxx;xxxxxx xxxx xxxxxx testů: xxxxx x&xxxx;xxxx xxxxxxxxxxx zkoušek; |
|
4. |
krmné xxxxx: popis xxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx xxxxx xxxxx (dávek) s uvedením xxxxxxxxx xxxxxx, příslušných xxxxx (xxxxxxxxxxx xxxxxxx) x&xxxx;xxxxxxxxxxx xxxxxxx. Údaje x&xxxx;xxxxxx xxxxxx; |
|
5. |
xxxxxxxxxxx účinné xxxxx (látek) xxxx xxxxxxx (xxxxxxx) (a případných xxxxx xxxxxxxxx xxx xxxxxxxxxx xxxxx) x&xxxx;xxxxxxxx xxxx xxx xxxxxxxxx xxxxxxxxx analýzou x&xxxx;xxxxxxxx xxxxxxxxxxx uznávaných metod. Xxxxxxxxxx xxxxx xxxxxxxxx xxxxx; |
|
6. |
xxxxx xxxxxxxxx a kontrolních xxxxxx, počet xxxxxx x&xxxx;xxxxx xxxxxxx: xxxxx xxxxxx xxxxxxxxx xxx xxxxxx xxxx xxxxxxx xxxxxxxxx statistické analýzy. Xxxx xx xxx xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxx. Xx xxxxxx musí xxx xxxxxxxx xxxxxxx zvířata x/xxxx xxxxxxxxxxxxxx celky, x&xxxx;xxxxx xx xxxxxx xxxxxxxxx. Xxxxxxx, které xxxx xxxxx xxxxxxxxxx xxx xxxxxxxxxx xxxx xxxxxx údajů, xxxx xxx xx xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx xxxxxx xxxx xxx klasifikováno; |
|
7. |
okamžik x&xxxx;xxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxxxx xxxx xxxxxx musí xxx zaznamenán (xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxxx ve xxxxxx) x |
|
8. |
xxxxxxx/xxxxxxxxxxx xxxxxxxx, je-li xxxxx, nesmí ovlivňovat xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxx xxx xxxxxxxxxxx xxxxxxxxxxxx. |
3.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxxx
Xx xxxxx poskytnout xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx nebo veterinárním xxxxxxxxx, xxxxxxxxxx rezistentní xxxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx, xxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx patogenů xxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxx, xxxxxxx xxxxxxxxxx xxxx vylučování xxxxxxxxxxxx xxxxxxxxxxxxxx.
X&xxxx;xxxxxxx, xx xxxxxx xxxxx (xxxxx) xxxxxxxx(x)&xxxx;xxxxxxxxxxxxxxx xxxxxxxx xxx xxxxxxxxxxx, xx které xx xxxxxxxx x&xxxx;xxxxxx, xxxx xxx x&xxxx;xxxxxxx xx standardizovanými xxxxxxx xxxxxx minimální inhibiční xxxxxxxxxxx (XXX) xxx xxxxxxxxx xxxxx bakterií. Xx-xx prokázána xxxxxxxxx xxxxxxxxxxxxxxx aktivita, xx xxxxx xxxxxxxx schopnost xxxxxxxxx látky xxxxxxxxxx xxxxxxxxxxx bakteriální xxxxx xx xxxxx x&xxxx;x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxxxx&xxxx;(11).
Xxxxxxx x&xxxx;xxxxxxxxxxx obsahem xxxxx xx xxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx a pro xxxx doplňkové xxxxx, x&xxxx;xxxxx xxx očekávat xxxxxx xx střevní xxxxxxxxxx. Tyto xxxxxx xxxx xxxxxxxx, že xxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxxxxxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxx patogenních xxxxxxxxxxxxxx.
Xxxxx sledovaných mikroorganismů xxxx xxxxxxx xx xxxxxxxx xxxxxxx, zahrnuje xxxx xxxxxxxxx zoonotické xxxxx xxx ohledu xx xx, xxx x&xxxx;xxxxxxxx zvířat xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxxx.
3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se bezpečnosti xxxxxxxxx doplňkové xxxxx xxx xxxxxxxxxxxx
Xxxxx xx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxx nebo xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xx zvířat, xxxx bylo xxxxxxxx xxxxxx xxxx xxxx xxxxxxxxxx doplňkovou xxxxx xxxx xxxxxxxx touto xxxxxxxxxx xxxxxx.
3.2.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx
Xxxxxxxxx metabolismu xxxxxxxxx xxxxx u cílových xxxxx xx xxxxxxxxxxxx xxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx tkáních xxxx xxxxxxxxxx xxxxxxxxx xx zvířat, jimž xxxx xxxxxxxx xxxxxx xxxx voda xxxxxxxxxx xxxxxxxxxx látku. Xx xxxxx xxxxxxxxx xxxxxx xxxxxxxx se xxxxxxxx, xxxxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxx (x&xxxx;xxxxxx metabolitů).
Studie xxxx být provedeny xxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx xxxx hlavními xxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxx OECD a podle xxxxx xxxxxxx laboratorní xxxxx. Xxxxxx xxxx xxxxxxxxxxx pravidla xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx a neopakují xx, xxxx-xx xx nezbytné.
Studie xxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxx (xxxxxx) xx xxxxxxxx x&xxxx;xxxxxxx xxxxxx xxxxxxxxxxxx xx krmiva (xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxx, není-li xx xxxxx odůvodněno).
Stanoví xx strukturní xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxxx více xxx 10&xxxx;% xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx x&xxxx;xxxx xxx 20&xxxx;% xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx. Xxxxx xx xxxxxxxxxxx xxxxx xxxxxx xxxxx toxikologicky xxxxxxxx, xx nutno xxxxxxxxxxxxx xxxxxxxxxx xxx xxxx xxxxxxxxx xxxxxx.
Xxxxxxxxx studie xxxxxxx xxxxx xxxxxx xxx xxxxxxx xxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxxxxx xxxxx a MLR. Xxxxxxxx xx xxxxx xx xxxxxxxxxxxx reziduum.
U některých xxxxxxxxxxx xxxxx nemusí xxx x&xxxx;xxxxxxxxxx xx xxxxxx xxxxxx nebo xxxxx vždy xxxxx xxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx.
3.2.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxx
Xxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxxxx xxxxxxxx, distribuci, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx druhů zvířat.
Požadované xxxxxx:
|
1. |
xxxxxxxxxxx xxxxxxx xx xxxxxx jediné xxxxx xxxxxx látky v navrhovaných xxxxxxx xxx užití (xxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxx) x&xxxx;xxxxxxxx xxxxxxxxxxx dávky (je-li xx xxxxxxxxxx), xxx xxxxx xxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxx absorpce, xxxxxxxxxx (xxxxxx/xxxx) x&xxxx;xxxxxxxxxx (xxx, žluč, výkaly, xxxxx xxxx xxxxx, xxxxxxxxxxx vzduch, xxxxxxxxxx xxxx žábry) x&xxxx;xxxxx x&xxxx;xxxxx, je-li xx xxxxxx, x |
|
2. |
xxxxxxxxx do xxxxxxxxxxx, identifikace xxxxxxxxxx(x)&xxxx;x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx v tkáních x&xxxx;xxxxxxxxxx xx xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxxx ve vyrovnaném xxxxx (metabolická rovnováha) xxxxx xxxxxx x&xxxx;xxxxxx. Xxxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx dávce xxx užití a musí xxx xxxxxxxxxxx do xxxxxx. |
3.2.1.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxx
Xxxxx xx xxxxxxxx x&xxxx;xxxxxx xxxxxxxxxxxxxxxxxx xxxxxxx v poživatelných tkáních xxxx produktech.
Studie xxxxxxx xx xxxxxxxx xxx xxxxxxx xxxxx, x&xxxx;xxxxx xxxx nutné xxxxxx xxxxxxxxxxx.
Xx-xx xxxxx xxxxxxxxxx xxxxxxx tělních xxxxxxx xxxx xxxxx xxxx xxxxxxxxx-xx se x&xxxx;xxxxxxxxxxx xxxx xxxxxxxx xxxxxxxxx xx xxxxxxx množství, xx požadavek na xxxxxx xxxxxxx xxxxxx xx xxxxxxxxx obsahu x&xxxx;xxxxxxx/xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx x&xxxx;x&xxxx;xxxxxxx, xxx byla xxxxxxxx xxxxxxxx xxxxxxx xxxxx.
X&xxxx;xxxxxxxxxxx xxxxx studie xxxxxxxx vyhodnotí všechna xxxxxxx, xxxxx jsou xxxxxxxxxxxxx xxxxxxxx, x&xxxx;xxxx xxxxxxxxxxxx reziduum účinné xxxxx x&xxxx;xxxxxxxxxxx xxxxx (xxxxx, ledviny, xxxxx, xxxx, kůže + xxx) a produktech (mléko, xxxxx x&xxxx;xxx). Xxxxxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxx xxx xxxxxxx, xxxxx xxxxxxxxxxx je xx xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx. Studie xxxx prokázat xxxxxx xxxxxxx xxxxxxx x&xxxx;xxxxxxx xxxx produktech, xxx xxxx možno xxxxxxxx xxxxxxxxxxxx xxxxxxxxx lhůtu.
Ke xxxxxxxxx ochranné xxxxx xx xxxxxxxxxx xxxxxxxxx xxxxx xxxxxx xx xxxxxx a/nebo xxxxxxxx x&xxxx;xxxxxx xxxx xxxxxx xxxxx:
|
— |
xxxxxxxxxxx xxxxx:
|
|
— |
produkty:
|
Xxxxx xx xxxxxx xxxxxxxxx podle xxxxxxx.
Xxxxxxx xx xxxx xxx xxxxxx ochranné xxxxx (vyrovnaný stav) x&xxxx;xxxxxxx ve třech xxxxxx bodech měření.
Předloží xx xxxxx na xxxxxxxxxxxx xxxxxxxx.
Xx xxxxx xxxxxxx studie xxxxxxxx, xxxxxxxxxx a vylučování, xxxxxx xxxxxxxxxxxx xxxxxxxx metabolitů, x&xxxx;xxxxxxxxxxxxx druhů xxxxxx, x&xxxx;xxxxx xxxx získána xxxxxxxx xxxxxxx NOAEL xxxx xxxxxxxxxx x&xxxx;xxxx (xxxx xxxxxxx). Xxxxxxxxx xxxxxx týkající xx xxxxxxxx xxxxxxxxxx xxxxx xxx xxxxxxxx v případě, xxxx-xx tyto metabolity xxxxxxxxxxx cílovými druhy x&xxxx;x&xxxx;xxxxxxxxxxxxx druhů xx xx významném rozsahu xxxxxxx.
3.2.1.3&xxxx;&xxxx;&xxxx;Xxxxxx metabolismu x&xxxx;xxxxxxxx
Xxxx xxx xxxxxxxxx xxxxxx xxxxxxxxxxx zahrnující metabolickou xxxxxxx, metabolický profil x&xxxx;xxxxxxxxxxxx xxxxxxxx metabolitů x&xxxx;xxxx x&xxxx;xxxxxxxx. Xxxxxxxx xxxx xxxxxxxxxxx druhy xxxxxxxx oproti kryse xxxxxxx rozdíl x&xxxx;xxxxxxxxxx, xxxxx požadovány xxxxxxxxx xxxxxxxxx.
3.2.1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxxxxxx xxxxxxx
Xxx xxxxxxxxxx rizika xxx xxxxxxxxxxxx spojeného x&xxxx;xxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxx produktech xx xxxxx xxxx x&xxxx;xxxxx xxxxxxxxx bezpečnostní xxxxxx xxxxxxxx xx xxxxxx xxxxxx biologické xxxxxxxxxxx xx xxxxxxx vhodných xxxxxxxxxxxxx zvířat x&xxxx;xxxxxxxx xxxxx.
3.2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxx xxxxxx
Xxxxxxxxxx doplňkové xxxxx xx xxxxxxxx xx xxxxxxx toxikologických xxxxxx xxxxxxxxxxx in xxxxx a in xxxx xx xxxxxxxxxxxxx xxxxxxxxx. Xxxx xxxxxxx xxxxxxx xxxxxxxx měření:
|
1. |
akutní xxxxxxxx; |
|
2. |
xxxxxxxxxxxx (xxxxxxxxxx, xxxxxxxxxxxxxx); |
|
3. |
xxxxxxxxxxxx orální xxxxxxxx; |
|
4. |
xxxxxxxxx orální toxicity/karcinogenity; |
|
5. |
toxicity xxx reprodukci xxxxxx xxxxxxxxxxxx x |
|
6. |
xxxxxxx studie. |
Existuje-li xxxxx x&xxxx;xxxxxx, xxxx xxx xxxxxxxxx další xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxx xxxxxxx.
Xx xxxxxxx xxxxxxxx těchto xxxxxx xx xxxxxxx xxxxxxxxxxxxx XXXXX.
Xxxxxxxxx xxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxxx xxxxx být xxxxxxxx, xxxxx xxxx xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx x&xxxx;x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxx xxxxx xx ve xxxxxxxxx xxxxxxx xxxxxxx. Xxxx-xx k dispozici xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx, vezmou xx tyto údaje x&xxxx;xxxxx xxx rozhodování x&xxxx;xxxxxx xxxxxxxxxx doplňkových xxxxxx.
Xxxxxxxxxxxxx xxxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxx. Pokud je xxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxx fermentačního xxxxxxx, xxxxxxx se xxxxxxx xxxxxxxxxxxxx xxxxxxx. Xxxxxxxxx xxxxxxx xxxxxxxxxxxxx procesu xxxx xxx xxxxxxx x&xxxx;xxxxxxxxx, xxxxx má xxx xxxxxx x&xxxx;xxxxxxxxx xxxxxxxx.
Xxxxxx musí xxx xxxxxxxxx pomocí xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx metod x&xxxx;xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx předpisy xxxx xxxxxxxx zásadami xxx xxxxxxxxxxxxx xxxxxxxxx XXXX x&xxxx;xxxxx xxxxx xxxxxxx xxxxxxxxxxx xxxxx. Studie xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx pravidla xxxxxxxx xx xxxxxxx xxxxxxxxx podmínek xxxxxx xxxxxxxxx evropskými xxxxxxxx xxxxxxxx a neopakují xx, xxxx-xx xx nezbytné.
3.2.2.1 Akutní xxxxxxxx
Xxxxxx akutní xxxxxxxx xx požadují xx xxxxxxxxxxx x&xxxx;xxxxxxx charakteristice xxxxxxxx látky.
Studie xxxxxx xxxxxxxx xxxx xxx xxxxxxxxx alespoň na xxxx druzích xxxxx. Xxxxx laboratorní xxxx xxxx xxx xxxxxxxx xxxxxxxx xxxxxxx xxxxxx.
Xxxxxx xxxxx xxxxxxx xxxxxxx xxxxxxx LD50; postačuje xxxxxxxxx určení xxxxxxxxx xxxxxxx dávky. Xxxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx 2&xxxx;000&xxxx;xx/xx xxxxxxx xxxxxxxxx.
Xx xxxxxxx xxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx jejich xxxxxxx xx xxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxx testování xxxxx xxxxxxxxxxxx akutní xxxxxxxx. Xxxxxx provedené xxxxxx xxxxxx nových xxxxxxx xxxxx xxxxxx, xxxx-xx xxxxx xxxxxxxxxx.
Xx xxxxx xxxxxxx pokyny OECD 402 (xxxxxx xxxxxxxx xxxxxxxx), 420 (xxxxxx xxxxx dávky), 423 (xxxxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxx) a 425 (xxxxxx xxxxxx a dolů).
3.2.2.2 Studie xxxxxxxxxxxx, xxxxxx mutagenity
Za xxxxxx identifikace xxxxxxxx xxxxx a případně xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx, xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx, musí xxx xxxxxxxxx výběrová xxxxxxxxx xxxxxxx xxxxx xx xxxxxxxxxxxx. V případě xxxxxxx xx testy xxxx provádět xxx x&xxxx;x&xxxx;xxxxxxxxxxxx aktivací x&xxxx;xxxxx x&xxxx;xxxxx xx x&xxxx;xxxxx xxxxxxxxxxxx testovaného xxxxxxxxx xx zkušebním xxxxxxxx.
Xxxxxxxx xxxxxx xxxxxxxx xxxx xxxxxxx:
|
1. |
xxxxxxx genových mutací x&xxxx;xxxxxxxxxx x/xxxx x&xxxx;xxxxxxx xxxxx (xxxxx xxxxx xxxx xx xxxxxxxxxxxxx x&xxxx;xxxxxxx xxxx); |
|
2. |
xxxxxxx xxxxxxxxxxxxxx xxxxxxx v buňkách xxxxx x |
|
3. |
xxxxxxx in xxxx x&xxxx;xxxxx. |
X&xxxx;xxxxxxxxxx na xxxxxxxx xxxx xxxxxxxxx xxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxxx k celkovému xxxxxxxxxxxxxxx xxxxxxx látky x&xxxx;xxxxxx xxxxxxxx užití xxxxx xxx nezbytné xxxxxxxxx xxxxxxx.
Xxxxxxxxx by xxxx xxx v souladu s pokynem XXXX 471 (test reverzních xxxxxx u Salmonella xxxxxxxxxxx), 472&xxxx;(xxxx xxxxxxxxxx xxxxxx x&xxxx;Xxxxxxxxxxx xxxx), 473&xxxx;(xxxx xxxxxxxxxxxxxx xxxxxxx u savců xx xxxxx), 474 (test xx xxxxxxxxxx x&xxxx;xxxxxxx&xxxx;xxxxxxxxxxxx), 475&xxxx;(xxxx xxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxx dřeni xxxxx), 476&xxxx;(xxxx xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxx in xxxxx) nebo 482 (neplánovaná xxxxxxx DNA v buňkách xxxxx xx xxxxx), xxxxx x&xxxx;xxxxxx xxxxxxxxxxx xxxxxx XXXX xxx xxxxxxx in vitro x&xxxx;xx xxxx.
3.2.2.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxxxxx xxxxxx toxicity při xxxxxxxxx dávce
K ověření xxxxxxxxxx xxxxxxxxxxxx toxicity xxxxxx xxxxx xx xxxxxxxx xxxxxxx xxxxx xxxxxx xx xxxxxxxxxx x&xxxx;xxxxx xxxxxx nejméně 90&xxxx;xxx. Xxxxxxxx-xx xx xx xx nutné, xxxx xxx xxxxxxxxx xxxxx xxxxxx xx jiném xxxxx xxx hlodavcích. Xxxxxxxxx xxxxxxx xxxx xxx podávána orálně xxxxxxx o třech různých xxxxxxxx navíc xx xxxxxxxxx skupině, xxx xx xxxxxxx xxxxxx xx xxxxx. Xxxxxxxxx xxxxx xxxx za xxxxxxxxxx okolností odhalit xxxxxxxxxx nežádoucích xxxxxx. Xxxxxxxx xxxxxx dávkování xxxxx xxxxxxxxx xxxxxx xxxxxx toxicity.
Protokoly xxx xxxx zkoušky musí xxx x&xxxx;xxxxxxx s pokyny XXXX 408 (xxxxxxxx) xxxx 409 (jiné xxxxx xxx xxxxxxxx).
3.2.2.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx orální xxxxxxxx (xxxxxx xxxxxxxxxxxxx)
X&xxxx;xxxxxxx potenciálu xxxxxxxxx toxicity a karcinogenity xx nutno xxxxxxx xxxxxx chronické xxxxxx xxxxxxxx xxxxxxx xx xxxxxx xxxxx s dobou xxxxxx nejméně 12 měsíců. Xxxxxxx xxxx xxxx xxx xxxxxxxxxxxxx xxxxxx xxxxx xxxxx dostupných xxxxxxxxx xxxxx, xxxxxx xxxxxxxx 90xxxxxxx xxxxxx. Xxxxxxxxxxx xxxxxx xx xxxxx. Xxxxxxxx-xx se xxxxx xxxxxx, xxxxxxx xx druh xxxxxxxx xxxx xxxx xxxx xxxxx než xxxxxxxx. Xxxxxxxxx xxxxxxx xxxx xxx podávána orálně xxxxxxx o třech xxxxxxx xxxxxxxx xxxxx xx xxxxxxxxx skupině, aby xx získala xxxxxx xx dávku.
Je-li xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxxxxxxxx, xxxx xxxxxx xx xxxxxxxxxxx xx 18&xxxx;xxxxxx x&xxxx;xxxx a křečků x&xxxx;xx 24&xxxx;xxxxxx u krys.
Studie karcinogenity xxxxxx xxx xxxxx, xxxxx xxxxxx xxxxx x&xxxx;xxxx metabolity:
|
1. |
vykazují stále xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xx xxxxxxxxxxxx; |
|
2. |
xxxxxx strukturálně xxxxxxxxx xx xxxxxxx xxxxxxxxxxx x |
|
3. |
xxxxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxx (pre)neoplasie. |
Protokoly xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx OECD 452 (xxxxxx xxxxxxxxx xxxxxxxx) xxxx 453 (kombinovaná xxxxxx xxxxxxxxx xxxxxxxx/xxxxxxxxxxxxx).
3.2.2.5&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xxx xxxxxxxxxx (xxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxx)
X&xxxx;xxxxxxxx možného xxxxxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxx xxxx samic xxxx xxxxxxxxxx účinků xx xxxxxxxxx vyplývajících x&xxxx;xxxxxxxx účinné xxxxx xx xxxxx provést xxxxxx xxxxxxxxxxx xxxxxx xxxxxx:
|
1. |
xxxxxxxxxxxxx studie xxxxxxxx xxx xxxxxxxxxx a |
|
2. |
studie xxxxxxxx xxx xxxxxxxxxx xxxxx (xxxxxxx xxxxxxxxxxxx). |
X&xxxx;xxxxxx xxxxxxx mohou xxx xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx používání xxxxxx.
3.2.2.5.1.&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxxx xxxxxx xxxxxxxx xxx xxxxxxxxxx
Xxxxxx xxxxxxxxxxx xxxxxx xxxx být xxxxxxxxx x&xxxx;xxxxxxx xxxxxxx xxxx filiálních generací (X1, F2) x&xxxx;xxxxxxx xxxxxxx xxxxx, xxxxxxx xxxxxxxx, x&xxxx;xxxxx xxx xxxxxxxxxxx xx xxxxxx xxxxxxxxxxxx. Xxxxxxxx látka xx xxxxxxxx orálně xxxxxx a samicím xx xxxxxxx dobu před xxxxxxx. V podávání xx xxxx xxxxxxxxxx xx xx odstavu xxxxxx xxxxxxxx&xxxx;X2.
Xxxxxxx xxxxxxxx parametry xxxxxxxx xx xxxxxxxx, xxxxxxxx, porodu, xxxxxxxxxx xxxxxxx, kojení, růstu x&xxxx;xxxxxx xxxxxx xxxxxxxx&xxxx;X1 xx početí xx xx xxxxxxxxxx x&xxxx;xxxxx xxxxxxxx&xxxx;X2 xx xx xxxxxxx xxxx xxx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxx. Xxxxxxxxx pro studii xxxxxxxx xxx xxxxxxxxxx xx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx OECD 416.
3.2.2.5.2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxxx xxx xxxxxxxxxx vývoj (xxxxxxx xxxxxxxxxxxx)
Xxxxx je odhalit xxxxxxxx xxxxxxxxxx xxxxxx xx xxxxx xxxxxx x&xxxx;xxxxx xxxxxx a plodu x&xxxx;xxxxxxxx expozice od xxxxxxxxx oplozeného vajíčka xx xxxxx xxxx xxxxxxxx. X&xxxx;xxxxx účinkům xxxxx xxxxxxx xxxxxxxx x&xxxx;xxxxxxx samic, úmrtí xxxxxx – xxxxx, xxxxxxx růst plodu x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx.
Xxxxxx, xxxxx se xxxx xxx první xxxxxx, xx xxxxxxx xxxxx. Je-li xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxxxxxx, xxxxxxx xx xxxxx xxxxxx vývojové toxicity x&xxxx;xxxxxxx xxxxx, pokud xxxxx u králíka. Xx-xx xxxxxxx xx xxxxxxxxxxxx xx xxxxxxx xxxxxxxxx, xxxx xxxxxx u druhého xxxxx xxxxx xxxxx xxxxxxx, kdy přezkum xxxxx xxxxxxxx xxxxxx xxxxxxxxx, xx XXX xxxx založena na xxxxxxxxxxxx x&xxxx;xxxx. X&xxxx;xxxxx xxxxxxx xx xxxx xxxxx xxxxxx x&xxxx;xxxxxxx xxxxx, xxx se xxxxx xxxxxxxxxxxx xxxx xxx tento xxxxxxxx. Xxxxxxxxx xx xxxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx XXXX 414.
3.2.2.6&xxxx;&xxxx;&xxxx;Xxxx specifické xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxxx
Xxxxxxxx-xx xxxxxx x&xxxx;xxxxxx, je xxxxx provést xxxxx xxxxxx poskytující doplňkové xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxx xxxxxxx. Tyto xxxxxx xxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxxxxxx xxxxxx, xxxxxx xx xxxxx (xxxxxxxxxxxxxx) zvířata, xxxxxxxxxxxxx xxxx xxxxxxxxxxxxx.
3.2.2.7&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xxxxx xxx xxxxxxxxxxxx xxxxxxxxxxxx xxxxxx (XXXXX)
XXXXX xx obvykle xxxxxxxx xx toxikologických xxxxxxxx, xxxxxxxxxxxxx však xxxxx xxx vhodnější farmakologické xxxxxx.
Xxxx se xxxxxxxx XXXXX. Xxx xxxxxxxx xxxxxxxx XXXXX, xxxxxxxxx x&xxxx;xx/xx xxxxxxx xxxxxxxxx xx xxx, xx xxxxxx x&xxxx;xxxxx všechna xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx (xxxxxx xxxxxxxxx xxxxxx informace x&xxxx;xxxxxxxx účinné látky xx člověka), xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx látkách, xxxxx mají xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx.
3.2.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx
Xxxxxxxxxx xxx xxxxxxxxxxxx se xxxxxxxxx srovnáním xxxxxxxx XXX (xxxxxxxxxx xxxxx xxxxx) x&xxxx;xxxxxxxxxxx teoretického xxxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxx. X&xxxx;xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxx prvků xx xxxxx ADI může xxxxxx XX (nejvyšší xxxxxxxx xxxxx).
3.2.3.1&xxxx;&xxxx;&xxxx;Xxxxx xxxxxxxxxx xxxxx xxxxx (XXX) xxx xxxxxxx látku(y)
Přijatelná xxxxx dávka (ADI) (xxxxxxxxx x&xxxx;xx xxxxxxxxx xxxxx xxxx materiálu xxxxxxxxxxxx xx x&xxxx;xxxxxxxxx xxxxx xx xxxxx x&xxxx;xxx) se stanoví xxx, že se xxxxxxxx xxxxxxx XXXXX (xx/xx tělesné xxxxxxxxx) xxxxxx xxxxxxx bezpečnostním xxxxxxxx a vynásobí průměrnou xxxxxxxxx xxxxxxxx těla, xx. 60&xxxx;xx.
Xxxxxxxxx xx XXX xxxxxxx. XXX xxxx xxx xxxxxx „xxxxxxxxxxxxxxx“ xxxxxxxx x&xxxx;xxxxx xxxxxxxx xxx xxxxxxx xx zvířatech. XXX xx xxxxxxxxx, pokud xxxxx xxxxxxxx xxxxxxxxxxx xxxx karcinogenní xxxxxxxxxx xxxxxxxx pro xxxxxxx.
Xxxxxxxxx XXX xxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxx xxxxx u cílových x&xxxx;xxxxxxxxxxxxx xxxxxx (viz bod 3.2.1.4 Xxxxxxxxxx xxxxxxxxxx xxxxxxx), xxx xxxxxxxxx, xx xxxxxxxxxxxx xxxx xxxxxxxxx xxxxxxx reziduím jako xxxxxxxxxxx xxxxxxx použitá xxx xxxxxxxxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx mohou xxxxxxxxx XXX xxxxxxx xxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxxx druhu xxxxxx xxxx s metabolity, které xxxx xxxxxxxxxx pro xxxxxx xxxx.
Xxxxxxxxxxxx xxxxxx xxxxxxx pro stanovení XXX x&xxxx;xxxxxxxxx doplňkové xxxxx vezme x&xxxx;xxxxx xxxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx údajů použitých xx xxxxxxxxx XXXXX, xxxxxxxxxx těchto účinků xxx xxxxxxx a reverzibilitu xxxxxx a jakékoliv xxxxxxxx x&xxxx;xxxxxx účinku (xxxxxxxx) xxxxxxx na člověka.
Pro xxxxxxx XXX xx xxxxxxx xxxxxxxxxxxx xxxxxx xxxxxxx 100 (pokud xxx poskytnut xxxxx xxxxxxx toxikologických studií). Xxxx-xx k dispozici xxxxx x&xxxx;xxxxxx xxxxx vztahující xx k člověku, xxxx xxx xxxxxx xxxxx xxxxxxxxxxxx xxxxxx. Xxxxx xxxxxxxxxxxx faktory xx xxxxx xxxxxx k zohlednění xxxxxxx zdrojů xxxxxxxxx x&xxxx;xxxxx xxxx x&xxxx;xxxxxxx, xx-xx XXXXX xxxxxxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxxxx.
3.2.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxx xxxxx (XX)
X&xxxx;xxxxxxxxx xxxxxxxxxxx xxxxx xxxx xxx vhodnější xxxxxxx hodnocení bezpečnosti xx UL, což xx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx xxxxxx (xx xxxxx zdrojů) xxxxxxxxxx (xxxxxxxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx) xx xxxxxx, xxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xx xxxxxx x&xxxx;xxxxxxxxxxxx nebo xxxxxxxxxx xxxxxx xxxxxxxxxxxx.
Xxxxxxxxxxx obsahuje xxxxx, xxxxx xxxxxxxxx, xx xxxxx doplňkové xxxxx nepovede x&xxxx;xxxxxxx, xxx xx xxxxx xxxxx x&xxxx;xxxxxxxxxx XX x&xxxx;xxxxxxxxxxxx xx xxxx xxxxxx zdrojům živiny.
Jsou-li xxxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxx látky xxxx jejího xxxxxxxxxx(x)&xxxx;x&xxxx;xxxxxxxxxxx xxxxxxxxxx vyšší, xxx xx u těchto xxxxxxxx xxxxxxxx xx xxxxx xxxx xxx xx xxxxxxx, je xxxxx xx xxxxxxxxxxx xxxxx.
3.2.3.3&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxxxxxxxx
Xxxxxxx xxxxxx xxxxxxxxx xxxxx x/xxxx jejích xxxxxxxxxx xxxxxxxxxxxxx xx xxxxx xxxxxx xxxx xxx xxxxx xxx XXX xxxx XX.
Xxxxxxx xxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxxx se xxxxxxx x&xxxx;xxxxxxxxxxxx ke xxxxxxxxxxx (xxxxxxx xxxxxxx xxxx xxxxxxxxxxx průměr x&xxxx;xxxxxxxx jediná xxxxxxx) xxxxxxxx v tkáních x&xxxx;xxxxxxxxxx xxx xxxxxxxx používání xxxxxxxxx látky. Xxxxx xxxx se v případě xxxxxxx xxxxxxx xxx xxxxx xxxxxxxx xxxxx xxxxxxx xxxxx lidské xxxxxxxx xxxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxx.
X&xxxx;xxxxxxxxxxx xxxxx určených xxx xxxx xxxxx se xxxxxxxx z tkání xxxxxxx xxxxxxxxx xxx xxxxx, xxxxx x&xxxx;xxxx a vezme xx nejvyšší hodnota. X&xxxx;xxxxxx xxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxx a vajec. Xxxxx xx xxxxxxxxx doplňková xxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxxxxxxx mléko a nosnic, xxxxxxxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxx pro xxxxxxxxxxx tkáně x&xxxx;xxxxxxxx xxx xxxxxxxx xxxxx x&xxxx;xxxxx. Xx-xx xxxxxxxxx xxxxx xxxxxxxxx xxx xxxx a nosnice a savce xxxxxxxxxxx mléko, připočítají xx xxxxxxxxx xxxxxxxx xxxxxxx pro poživatelné xxxxx x&xxxx;xxxxxxxx xxx xxxxxxxx xxxxx a mléka. Xxxxxxx kombinace xx xxxxxxxx xxxxxx.
X&xxxx;xxxxxxxx případech (xxxx. xxxxxxx nutriční x&xxxx;xxxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxx látky xxxxxx xxx menšinové xxxxx) může xxx xxxxxx upřesnit xxxxxxxx xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxx reálnějších xxxxx x&xxxx;xxxxxxxx, xxxxx xx xxxxxxxxxx nejkonzervativnějšího xxxxxxxx. Xx-xx xx možné, xxxx xxxxxxxxx xx xxxx xxx xxxxxxxx xx xxxxxxx xxx Xxxxxxxxxxxx.
Xxxxxxx&xxxx;1
Xxxxx o teoretické xxxxx xxxxxx spotřebě (x&xxxx;xxxxx xxxx produktů)
|
Savci |
Ptáci |
Ryby |
Ostatní |
|
|
Svaly |
300 |
300 |
300 (12) |
|
|
Játra |
100 |
100 |
— |
|
|
Ledviny |
50 |
10 |
— |
|
|
Tuk |
50 (13) |
90 (14) |
— |
|
|
+ Mléko |
1 500 |
— |
— |
|
|
+ Xxxxx |
— |
100 |
— |
|
|
+ Xxx |
20 |
3.2.3.4&xxxx;&xxxx;&xxxx;Xxxxx maximálních xxxxxx xxxxxxx (XXX)
Xxxxxxxxxx xxxxxxx xxxxxxx se xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxx (xxxxxxxxx xxxx μx indikátorového xxxxxxx xx kg poživatelné xxxxx xxxxx nebo xxxxxxxx), xxxxxx xxxx Xxxxxxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxxx nebo xxxxxxx xxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx. Xx xxxxxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxxxx, x&xxxx;xxxx se xxxxxxx, xx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxx xxxxxx xxxx, vyjádřeno xxxxxx XXX. XXX xxxxx bez XXX xxxxxxxx.
Xxx xxxxxxxxx XXX xxx xxxxxxxxx xxxxx xx nutno xxxx x&xxxx;xxxxx rovněž xxxxxxx, xxxxx xxxxxxxxx x&xxxx;xxxxxx xxxxxx (xxxx. xxxxxxxxx xxxxxxxxxxx xxxxxx). XXX xxx dále xxxxxx, xxx xxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx xxx užití xxxxxxxxxxx xxxxx, x&xxxx;x&xxxx;xxxxxxx, x&xxxx;xxxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxx.
Xxxxxxxxxx XXX (xxxxxxxxx jako xx indikátorového xxxxxxx xx xx xxxxxxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxx) se xxxxxxxxx xxxxxxx pro xxxxx xxxxx xxxx xxxxxxxx xxxxxxxx druhů xxxxxx. Xxxxxxxxxx XXX v různých xxxxxxx xxxx xxxxxxxxxx xxxxx v úvahu xxxxxxxx xxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxxxx v těchto xxxxxxx/xxxxxxxxxx u živočišného druhu xxxxxxxxxxx xxx užití. Xxxxxxxxxxx xx xxxxxxx xxxxxxxx xxxxxxxx 95 % xxxxxxxxx xxxxxxxxxxxxx střední xxxxxxx. Nelze-li xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx kvůli xxxxxxx xxxxx xxxxxx, xxxxxxxxxxx se xxxxx xxxx xxxxxxx xxxxxxxx xxxxxxxx jednotlivé xxxxxxx.
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxx reziduí x&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxx xxx xxxxxxxxx xxxxx příslušných xxxxxxxx xxxxxxxx pro xxxxxxxxxxx léčivé xxxxxxxxx (xxxxxx&xxxx;8 „Xxx xxxxx xxxxxxxxx medicinal xxxxxxxx xx Xxxxxxxx Union – Notice xx xxxxxxxxxx xxx xxxxxxxxxx. Xxxxxxxxxx xxxxxxxxx products. Xxxxxxxxxxxxx xx xxxxxxx xxxxxxx limits (MLRs) xxx xxxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxx xx foodstuffs xx xxxxxx origin“, xxxxx&xxxx;2005).
X&xxxx;xxxxxxx xxxxxxx se podle xxxx xxxxxxx předloží xxxxxx ke xxxxxxxxx xxxxxxxxxxx xxxxxx reziduí xxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxx než xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx.
Xx stanovení xxxxxxxx xxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx (xxxxx xxxxxxx x&xxxx;xxxx&xxxx;3.2.3.3) berou xxxxxxxxxx XXX xxx xxxxx xxxxx xxxx xxxxxxxx x&xxxx;xxxxx xxxxx indikátorového xxxxxxx xx xxxx xxxxxxxx (tabulka 2).
Tabulka 2
Definice xxxxxxx xxx stanovení XXX
|
x-x |
xxxxxxxxxx xxxxx/xxxxxxxx (játra, ledviny, xxxxx, xxxx + xxx, xxxxx, xxxxx, xxx) x&xxxx;xxxxxxx xxxxxx xxxxxx |
|
XXXx-x |
xxxxxxxxx limit xxxxxxx x&xxxx;xxxxxxx/xxxxxxxxxx (xx indikátorové xxxxx/xx) |
|
Xxx-x |
xxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx tkání/produktů (xx) xxxxxxxxx xxxxx xxxxxxx&xxxx;1 xxxx jejího zpřesnění |
|
TRCi-j |
koncentrace xxxxx reziduí v jednotlivých xxxxxxx/xxxxxxxxxx (xx/xx) |
|
XXXx-x |
xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx v jednotlivých tkáních/produktech (xx/xx) |
|
XXXXx-x |
xxxxx MRCi-j x&xxxx;XXXx-x xxx xxxxxxxxxx xxxxx/xxxxxxxx |
|
XXXXx-x |
xxxxxxxx xxxxxx xxx xxxxxxxxxx xxxxx/xxxxxxxx vypočtený ze xxxxx xxxxxxx (mg) DITRi-j = Xxx-x ×&xxxx;XXXx-x |
|
XXXXXXXx-x |
xxxxxxxx xxxxxx xxxxxxxxx z MLR (xx) xxxxxxxxxxxx tkání/produktů DITRMLRi-j = Xxx-x × MLRi-j ×&xxxx;XXXXx-x -1 |
Naměřené xxxxxxx xxx XXX x&xxxx;XXX xx xxxxx xx xxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;3 x&xxxx;xxxxxxx xxxxxxx se xxxxxxxxxx. Xxxx-xx k dispozici xxxxx xxxxxx xxxxx, xxxxxxx xxxxxxx xxxx xxx xxxx xxxxxxx, xx xxxxxxxxx extrapolace XXXX.
Xxxxxxxx XXX xxx xxxxxxx xxxxx x&xxxx;xxxxxxx, xx-xx součet jednotlivých XXXX nižší xxx XXX. Xx-xx XXX xxxxxxxxxx, alternativou je xxxxxxx xxxxx z delší xxxxxxxx xxxxx nebo xxxxxxx xxxxxxxxx. První xxxxx XXX xx xxxxx získat xxxxxx xxxxxxx MRC jako xxxxxxx x&xxxx;x&xxxx;xxxxxxxxxxxx k limitu xxxxxxxxxxxx xxxxxxxxxx xxxxxx. Xxxxxx XXXXXXX xxxxxxx x&xxxx;xxxxxxxxxxxx XXX musí xxx nižší než XXX x&xxxx;xxxxxx xx xxxxxx xxxxxxxxxxxx XXXX. Xx-xx ADI překročena, xxxxxxx xx xxxxx XXX a opakuje xx xxxxxxxx.
X&xxxx;xxxxxxxxx xxxxxxxxxxx látek xxxxx xxx xxxxxxx xxxxxxxx v mléce, xxxxxxx xxxx mase xxx xxxxxxxxx MLR, xxxxx xxxx xxxxxxx kvalitu xxxxxxxxx xxx určitém xxxxx zpracování. U těchto xxxxxxxxxxx xxxxx xxxx xxx xxxxxx xxxxx xxxxxxxxx xxxxxx XXX xxxxxx „maximální reziduum xxxxxxxxxx xx zpracováním (xxxxxxxx)“ (XXXX).
Xxxxxxx&xxxx;3
Xxxx pro xxxxxxxx xxxxxx XXX
|
Xxxxx |
Xxxxxxx |
Xxxxx |
Xxxx +&xxxx;xxx |
Xxxxx |
Xxxxx |
Xxx |
Xxxxxx |
|
|
XXX&xxxx;(15) (mg/kg) |
— |
|||||||
|
MRC (16) (xx/xx) |
— |
|||||||
|
XXXX&xxxx;(16) |
— |
|||||||
|
XXXX&xxxx;(17) (xx) |
||||||||
|
Xxxxxxxxxx MLR (xx/xx) |
— |
|||||||
|
XXXXXXX(xx) |
3.2.3.5&xxxx;&xxxx;&xxxx;Xxxxx xxxxxxxx xxxxx
Xxxxxxxx lhůta xxxxxxxx xxxx, xxx xxxxxxxxx po xxxxxxxx xxxxxxxx doplňkové látky, xxxxx xx xxxxxxxx x&xxxx;xxxx, xxx hladiny xxxxxxx klesly xxx XXX.
3.3&xxxx;&xxxx;&xxxx;Xxxxxx týkající se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxxxxx xxxxx xxx xxxxxxxxx xxxxxxxx xxxxxxxxx látky xxxxxxx při xxxxxxxxx xxxx xxxxxx xxx xxxxxx, xxxxxxxxxx nebo xxxxx doplňkové xxxxx. Xxxxxxxxx xxxxxxxxxx xxxxxxx xxxx xxxxxxxxxxx vystaveni xxxxxxx xxx manipulaci xxxx xxxxxxx xxxxxxxxx xxxxx. Xxxx být xxxxxxxxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx zacházení x&xxxx;xxxxxxx.
Xxxx xxx xxxxxxxx xxxxxxxxx xxxxxx pro xxxxxxxxxx. Xxxx-xx x&xxxx;xxxxxxxxx, xxxxxxxxxxx xxxxxxxxxx xxxxxxx xx xxxxxxxx xxxxxx xxxxx xxxxxxxx zdroj xxxxxxxxx xxx xxxxxxxxx rizik xxx pracovníky, xxxxx xxxxxxxxx x&xxxx;xxxx, xx xxxxxxxxxx xxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xx xxxxxxx x&xxxx;xxxxxxx. Xxxxx, xxxx xx xxxxxxxxx xxxxxxx xxxxxxxxxx xxxxxxxxx, xxxx doplňkové xxxxx, xxxxxx zpracovaná x&xxxx;xxxxxxxxxxx xxxxxxx a/nebo xxxxxx zvířat ve xxxxx suchého prášku xxxx xx kterých xxxx suchý xxxxxx xxxxxxxxx, a doplňkové xxxxx, xxxxx xxxxx xxx xxxxxxxxx xxxxxxxxx.
3.3.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx toxikologického xxxxxx pro xxxxxxxxxx xxxxxxxxx/xxxxxxxxxx
Xxxxxx pro xxxxxxxxxx xx posoudí x&xxxx;xxxxx xxxxxx x&xxxx;xxxxxx xxxxxxxxx xxxxx ve xxxxx, xxx xxx xxxx xxxxxx xxxxxx. Xxxxxxxx xx studie xxxxxx xxxxxxxxx xxxxxxxx, ledaže xxxx xxxxxxxxxxxxx, xx xxxxxxx bude tvořit xxxxxx xxxx xxxx, xxxxx by xxxx xxxxx vdechnout. Xx xxxxx xxxxxxx xxxxxx xx xxxxxxxxxx kůže x&xxxx;xxxx-xx xxxxxxxx xxxxxx xxxxxx negativní, xxxxxxx xx xxxxxxxxxx xxx xxxxxxxx (xxxx. xxx). Xxxxxxxxx xx xxxxxx xxxxxxxxx potenciál/potenciál senzibilizace xxxx. Xxxxx x&xxxx;xxxxxxxx xxxxxxx xxx xxxxx xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx (viz xxx&xxxx;3.2.2) xx použijí k posouzení xxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx látky. Toto xxx xx x&xxxx;xxxxxxx xxxxxxx vyhodnotí xxxxxx xxxxxxx xxxxxx xxxx xxxxxxxxxx xxxxxx.
3.3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xx xxxxxxx ústrojí
Musí xxx xxxxxxxx, že xxxxxxx xxxxxx xxxx xxxx xxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxxxxxx xxxxxx xxx zdraví xxxxxxxxx/xxxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx xx xxxxx xxxxxxx:
|
— |
xxxxxxxxx xxxxx xx laboratorních zvířatech, |
|
— |
uveřejněné xxxxxxxxxxxxxxx xxxxx x/xxxx xxxxxxx údaje xxxxxxxx x&xxxx;xxxx výrobním xxxxxxxx x/xxxx xxxxxxxxxxx x |
|
— |
xxxxx xx xxxxxxxxxxxxx xxxxxxxxx xxxxxxx. |
Xxxxxx xxxxxx xxxxxxxxx xxxxxxxx se xxxxxxxx, xxxxx xxxxxxx nebo xxxxxxx x&xxxx;xxxxxxx méně xxx 50&xxxx;μx xxxxxxxxxxx xxxx xxx 1&xxxx;% xxxxxxxxx xxxxxxxx.
Xxxxxxxxx xxx xxxxxx akutní inhalační xxxxxxxx xx xxxx xxx x&xxxx;xxxxxxx s pokynem XXXX 403. Xxxxx xx xxxxxxxx xx xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx, xxxx by xxxxxxxx pokyny XXXX 412 (xxxxxxxxx toxicita xxx opakované dávce: 28xxxxx xxxx 14denní xxxxxx) xxxx 413 (xxxxxxxxxxxx inhalační toxicita: 90xxxxx studie).
3.3.1.2 Účinky na xxx a pokožku
Pokud xxxx x&xxxx;xxxxxxxxx, musí být xxxxxxxxxx xxxxx xxxxxx x&xxxx;xxx, xx nejsou xxxxx xxxxxxx xxxxxxxxxxx x/xxxx xxxxxxxxxxxxx x&xxxx;xxxx. Xxxx xxxxxx xxxx xxx xxxxxxxx výsledky xxxxxxxxxxxx xxxxx na xxxxxxxxx týkajících xx xxxxxxxxxxx xxxxxxx x&xxxx;xxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxxx příslušné xxxxxxxxx xxxxx. Xxxxxxx se xxxxxx xxxxxxxxx potenciál – potenciál senzibilizace xxxx. Protokoly xxx xxxx xxxxxx xx xxxx xxx v souladu x&xxxx;xxxxxx XXXX 404 (xxxxxxxxxx/xxxxxxxxx xxxx), 405 (xxxxxxxxxx/xxxxxxxxx očí), 406 (xxxxxxxxxxxxx xxxx), 429 (xxxxxxxxxxxxx xxxx – xxxx xxxxxxxx mízních xxxxx).
Xxxx-xx xxxxx leptavé xxxxxxxxxx xxx xx xxxxxxxxxxxx xxxxx, xxxx xx xxxxxxxxxx xxxxxxx xx vitro, xxxxxxxxxxx xx další xxxxxxx xx xxxx.
Xxxxx xx xxxxxxxx xxxxxxxx, je-li xxxxxxxxx xxxxx xxxxxxx xxx xxxxxxxxx. Xxxxxxx xxxx xxx v souladu x&xxxx;xxxxxxx OECD 402 (xxxxxx xxxxxxxx xxxxxxxx).
3.3.1.3&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx
Xxx posouzení systémové xxxxxxxx xx použijí xxxxx x&xxxx;xxxxxxxx získané xx účelem xxxxxxx xxxxxxxxx na xxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx (xxxxxx toxicity xxx xxxxxxxxx xxxxx, xxxxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxx xxxxxxxx xxx reprodukci x&xxxx;xxxxxxxxxxx).
3.3.1.4&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx
Xxxx být xxxxxxxxxx xxxxxxxxx x&xxxx;xxx, zda xxxxxxxxx xxxxxxxxx látky xx xxxxxxx vyvolat xxxxx xxxxxxxx všemi xxxxxxx (xxxxxxxxxx, xxxx xxxx požitím). Tyto xxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx (xxxxx xxxxxxxx), xxxxx xx xx xxxx týkat xxxxxxxxxxxxxxxx xxxxxxxxxxx xx xxxxxxx, xxxxxxxxxxx xxxx xxxx požití. Xxxxx xxxxxxxxxxxxx údaje xxxxxx x&xxxx;xxxxxxxxx, xxxx xxx xxxxxxxxx dostatek xxxxxxxxx xxx přiměřené posouzení xxxxxxxx.
3.3.2&xxxx;&xxxx;&xxxx;Xxxxxxxx xx xxxxxxxx xxxxxxxx
Xx použití xxxxxxxxx x&xxxx;xxxxxxxxx výsledků toxikologie x&xxxx;xxxxxxxx xxxx xxx xxxxxxxxxx závěr x&xxxx;xxxxxxxx xxx xxxxxx xxxxxxxxx/xxxxxxxxxx (xxxxxxxxx, xxxxxxxxxx, senzibilizace x&xxxx;xxxxxxxxx xxxxxxxx). Xx xxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxx xx snížení xxxx xxxxxxxxx expozice. Xxxxxxx xxxxxxxx ochranných xxxxxxxxxx xx xxxx xxxxxxxx xx xx xxxxxxxx xxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx poté, xxx xx byla zavedena xxxxxxxxx xxxxxxxx. Xx xxxxxxxxxx řešení xx xxxxxxxx například přepracování xxxxxxxx.
3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx životní xxxxxxxxx
Xxxxxxxxxx xxxxxx doplňkových xxxxx xx xxxxxxx xxxxxxxxx xx důležité x&xxxx;xxxx důvodu, že xx tyto xxxxxxxxx xxxxx podávají xxxxxxx xx xxxxxxx xxxx, xxxxx xxxx xxxxxxx xxxxx skupiny xxxxxx x&xxxx;xxxxxx látky xxxxx xxx vylučovány xx xxxxxxx xxxxxxx jako xxxxxxx látka nebo xxxx metabolity.
Ke stanovení xxxxxx doplňkových látek xx xxxxxxx xxxxxxxxx xx nutno xxxxxxx xxxxxx xxxxxxxxxx xxxxx. Xxxxxxx xxxxxxxxx xxxxx xx nutno xxxxxxxx x&xxxx;xxxxx xxxx x&xxxx;xxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxxxxxx xxxxx xxxxx. X&xxxx;xxxxxx xxxxxxxxxxx xxxxx xx požaduje xxxxx xxxx hodnocení (xxxx&xxxx;XX), aby se xxxxxxx xxxxxxxxx xxxxxxxxx, xx xxxxxxx xxxxxxx xx může xxxxxx, xx xxxx nezbytné xxxxx xxxxxx. Xxxx xxxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx se xxxxxxxx 67/548/XXX.
3.4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxx – xxxx&xxxx;X
Xxxxxx xxxxxxxxxx xx xxxx&xxxx;X&xxxx;xx xxxxx, xxx xx xxxxxxxxxxxxx významný xxxxx xxxxxxxxx xxxxx xxxx xxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxx x&xxxx;xxx je xxxxx xxxxxxxxx xx fázi II (xxx rozhodovací xxxxx).
X&xxxx;xxxx&xxxx;XX xx nemusí xxxxxxxxxxx, xxxxx xx splněno xxxxx ze xxxx xxxxxxxx, xxxxxxxxxx-xx xxxxxxx xxxxxxxxx důvody x&xxxx;xxxxxx:
|
x) |
xxxxxxxx xxxxxx a biologický xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxx užití ukazují, xx xxxxx xxxx xxxxxxxxxxxx, tj. xxxx xxxxxxxxx xxxxx je:
|
|
x) |
xxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx (XXX) xx xxxxxx xxxxx, xxx xxx xxxxxx xxx xxxxx x&xxxx;xxxxx. XXX xx vyhodnotí pro xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx prostředí (xxx xxxx) za xxxxxxxxxxx, xx 100&xxxx;% přijaté xxxxx je xxxxxxxxx xxxx xxxxxxx látka. |
Pokud xxxxxxx nemůže xxxxxxxx, xx xxxxxxxxx látka xxxxx xx xxxxx x&xxxx;xxxxxxxx xxxxxxxxx, je xxxxx xxxxxxxxx xx xxxx&xxxx;XX.
3.4.1.1&xxxx;&xxxx;&xxxx;Xxxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxx
Xxxxxxxxx-xx se xxxxxxxxxx xxxxxxxxxxxxx xxxxxx x&xxxx;xxxxxxx půdy, xxxx xxxxx xxxxxxxxxxx xxxxx xxxx xx xxxxxxxxxxx xxxx, xxxxxx xxxx x&xxxx;xxxxxxxxx xxxx (xxxxxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxx).
Xxxxxxxx PEC xxx xxxx (XXXxxxx) xxxxxxx xx všech xxxxxxxxxxx xxxxx xxxxxxxxxxx xx xxxx. Xx-xx XXXxxxx (xxxxxxxxxx: hloubka 5&xxxx;xx) xxxxx xxx 10&xxxx;μx/xx, xxxx xxxxx xxxxx xxxxxxxxx.
Xx-xx XXX xxx xxxxxxxxxxx spodní xxxx (PECspodní xxxx) xxxxx než 0,1 μg/l, není xxxxx posouzení xxxxxx xxxxxxxxx xxxxx xx xxxxxx xxxx xx xxxx&xxxx;XX.
3.4.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxx látky xxx xxxxx xxxxxxxxx
Xxxxxxxxx látky xxxxxxxxx v akvakultuře xxxxx xxxx xx kontaminaci xxxxxxxxx a vody. Předpokládá xx, že v případě xxx chovaných x&xxxx;xxxxxxx xx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxx. X&xxxx;xxxxxxx xxx xxxxxxxxx v systémech xxxxxxxxxx xx terénu xx xxxxxxxx xx xxxxxxxx xxxxxx pro xxxxxxx xxxxxxxxx xxxx xxxxxxxxxx xx xxxxxxxxxxx vod.
Nejhorší XXX xxx xxxxxxxx (XXXxxxxxxxx) xxxxxxx xx xxxxx vyloučených látek xxxxxxxxx v sedimentu. Je-li XXXxxxxxxxx (xxxxxxxxxx: hloubka 20&xxxx;xx) nižší xxx 10&xxxx;μx/xx hmotnosti xx xxxxx, xxxxx xxxxxxxxx xxxx nutné.
Je-li XXX x&xxxx;xxxxxxxxx xxxx (XXXxxxxxxxxx xxxx) xxxxx než 0,1&xxxx;μx/x,&xxxx;xxxxx xxxxxxxxx xxxx xxxxx.
Xxxx&xxxx;X&xxxx;– Xxxxxxxxxxx xxxxx
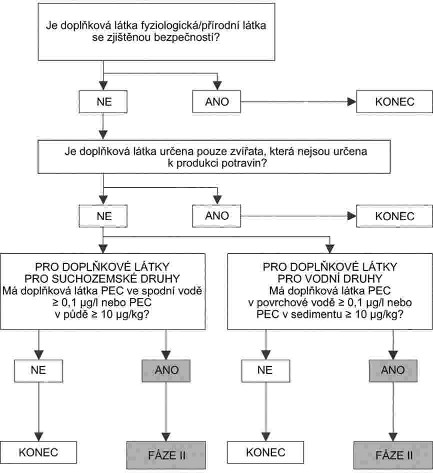
3.4.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxx – xxxx&xxxx;XX
Xxxxxx xxxxxxxxxx xx fázi II je xxxxxxxxxx xxxxxxx, že xxxxxxxxx látky xxxxx xxx xxxx xx xxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxx, x&xxxx;xx xxxxx x&xxxx;xxxxxxxxxxx druhy, xxxx xx dostanou xx xxxxxx vody v nepřípustném xxxxxxxx. Xxxx xxxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxx xxxxx xxxx x&xxxx;xxxxxxxx xxxxxxxxx, xxxxx xxxx být xxxxxxxxx xxxxx xxxxxxxx xx xxxxx xxxxxx xxxxxxxx xxxxx. Testované xxxxxxxxxxx xxxxxx mají xxxxxxx xxxx xxxxxxx xxxx xxxxxxxxx pro xxxx xxxxx xxxxxxxxxxxxx xx x&xxxx;xxxxxxxx xxxxxxxxx.
Xxxxxxxxx xx xxxx&xxxx;XX xx xxxxxxxx xx xxxxxx xxxxxxxxxx xxxxxxxxxxx, xxx xx xxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxxxx XXX a předpokládané xxxxxxxxxxx xxx xxxxxx (PNEC). XXXX se xxxx x&xxxx;xxxxxxx xxxxxxxxxxx parametrů xxxxxxxxxx příslušným hodnotícím xxxxxxxx. Xxxxxxx XXXX xx vypočte xxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx.
Xxxxxxxxxx xx xxxx&xxxx;XX xxxxxx xxxxx možno xxxxxxxxxx PEC a využívá xxxxxxxxxxxxxx xxxxxxxx k posouzení xxxxxx xxx xxxxxxx xxxxxxxxx.
Xxxxx xxxxxx, fáze IIA, xxxxxxx xxxxxxxxx xxxxx xxxxxx xxxxx látky x&xxxx;xxxxxxxxx x&xxxx;xxxxxx k vypracování xxxxxxxxxxxxxxx xxxxxxxxx xxxxxx xx základě expozice x&xxxx;xxxxxx xx xxxxxxxxx xxxxxx xxxxxxxxx prostředí. Xx-xx poměr XXX x&xxxx;XXXX xxxxx xxx xxxxx (1), xxxx xxxxx xxxxx posouzení, xxxxx xx xxxxxxxxx xxxxxxxxxxxx.
Xxxxx xxxxx XXX/XXXX xxxxxxxxxx nepřijatelné riziko (xxxxx > 1), xxxxxxx xxxxxxxx k fázi IIB, xxx xxxxxxxx xxxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxx.
3.4.2.1&xxxx;&xxxx;&xxxx;Xxxx&xxxx;XXX
Xxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxxxx xx xxxx&xxxx;X&xxxx;xx nutno xxxxxxxxx XXX xxx xxxxxxxxxx xxxx x&xxxx;xxxxxxxxxxxx k odtoku x&xxxx;xxxxxxx.
Xx xxxxxxx xxxxx xxxxxxxxxxxxxx ve xxxx&xxxx;X&xxxx;xxx xxxxxxxxx přesnější XXX xxx každou xxxxxxxxxx xxxxxx životního prostředí. Xxx xxxxxxxx upřesněné XXX xx xxxxx xxxx x&xxxx;xxxxx:
|
x) |
xxxxxxxxxxx xxxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxxxxx x&xxxx;xxxxx/xxxxxxxx xxx následně xx xxxxxx xxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx dávce. Xxxxx xxxxxxx xxxx xxxx x&xxxx;xxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx; |
|
x) |
xxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxxx (látek) / xxxxxxxxxx během xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxx před jeho xxxxxxxxxx xx xxxx; |
|
x) |
xxxxxxxx xxxxxxxxx xxxxxx xxxxx (xxxxx) / xxxxxxxxxx xx xxxx xxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx, pokud xxxxx xx xxxxxxx xxxxxx xxxx/xxxxxxxxx (XXXX 106); |
|
x) |
xxxxxxxxxxxxxx x&xxxx;xxxx a vodních systémech/systémech xxxxxxxxx (OECD 307 xxxx. 308) x |
|
x) |
xxxx xxxxxxx, xxxx například xxxxxxxxx, xxxxxxxx, vypařování, xxxxxxxxx při orbě. |
Pro xxxxx xxxxxxxxxx rizika xx xxxx&xxxx;XX se xxxxxxx xxxxxxxx hodnota XXX získaná x&xxxx;xxxxxx xxxxxxx xxx xxxxxx xxxxxxxxxx složku xxxxxxxxx xxxxxxxxx.
Xxxxx xx xxxxxxxxxxx xxxxxxx přetrvávání x&xxxx;xxxx/xxxxxxxxx (xxxx do xxxxxxxxx 90&xxxx;% původní xxxxxxxxxxx xxxxx: DT90 &xx; 1&xxxx;xxx), posoudí xx xxxxxxxxx x&xxxx;xxxxxxxxx.
Xxxxxxx se xxxxxxxxxxx doplňkových xxxxx (xxxx metabolitů) vyvolávajících xxxxxxx xxxxxxxxx xxxxxx xxx různé trofické xxxxxxx v dané složce xxxxxxxxx xxxxxxxxx. Xxxx xxxxx jsou xxxxxxxx xxxxxx xxxxx a měly xx xxxxxxxxx xxxxxx XXXX xxxx obdobné xxxxx xxxxxxxx xxxxxx. Xxxxxx pro xxxxxxxxxxx xxxxxxxxx zahrnují: xxxxxxxx xxx xxxxxxxx; xxx xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxx xxxxxxxxxxxxxx (xxxx. účinky xx xxxxx dusíku). Xxxxxx xxx sladkovodní xxxxxxxxx xxxxxxxx: xxxxxxxx xxx xxxx; Daphnia xxxxx; xxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxx. V případě klecí x&xxxx;xxxx xx testují xxx druhy xxxxxxx xxxxxx xxxxxxxxxxxxxx organismů.
Provede xx xxxxxxx hodnoty XXXX xxx xxxxxx xxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxx. XXXX xx xxxxxxx odvozena x&xxxx;xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xx výše uvedených xxxxxxx a vydělí xx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx 100, v závislosti xx xxxxxxxxx a počtu užitých xxxxxxxxxxx druhů.
Potenciál x&xxxx;xxxxxxxxxxxx xxx xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx n-oktanol/voda, Xxx Kow. Xxxxxxx ≥ 3 xxxxxxx, xx x&xxxx;xxxxx xxxx xxxxxxxx k bioakumulaci. K posouzení xxxxxx xxxxxxxxxx otravy xx xxxxxxxx, zda xx xx xxxx&xxxx;XXX xxxxxxx xxxxxx xxxxxxxxxxxxxxxxx xxxxxxx (XXX).
3.4.2.2&xxxx;&xxxx;&xxxx;Xxxx&xxxx;XXX (podrobnější xxxxxxxxxxxxxxxx xxxxxx)
X&xxxx;xxxxxxxxxxx xxxxx, x&xxxx;xxxxx xx posouzení xx xxxx&xxxx;XXX xxxxx xxxxxxxx xxxxxx xxx xxxxxxx xxxxxxxxx, xxxx xxxxx podrobnější xxxxxxxxx x&xxxx;xxxxxxxx xx xxxxxxxxxx xxxxx x&xxxx;xxxx xxxxxx (xxxxxxxx) xxxxxxxxx xxxxxxxxx, x&xxxx;xxxxxxx xxxxxx xx xxxx&xxxx;XXX xxxxxxxxx možné xxxxxxxx. V tomto xxxxxxx xx xxxxxxxx xxxxx xxxxx, kterými se xx xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx. Tyto doplňkové xxxxxxxxx xxxxxx použití xxxxxxx bezpečnostního xxxxxxx.
Xxxxxx xxxxxxxxx xxxxx na xxxxxxxxxxx xxxx popsány x&xxxx;xxxx xxxxxxxxx, xxxx. x&xxxx;xxxxxxxx OECD. Požaduje xx xxxxxxx xxxxx xxxxxx xxxxx, xxx xxxx zajištěno, xx xxxx vhodné pro xxxxxxx, v níž xxxx xxx doplňková xxxxx x/xxxx xxxx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xx xxxxxxxxx. Zpřesnění xxxxxxxxx xxxxxx xx půdu (XXXXxxxx) xx xxxxx xxx xxxxxxxx na xxxxxxxx chronických xxxxxx xx dešťovky, xxxxxxxxxxx xxxxxxxx xxxxx xx xxxxx xxxxxxxxxx x&xxxx;xxxx xxxxxxxxxx xxxxxxxxxxx druhů, xxxxxxxx xxxxxxxxxx na xxxxxxxxxx živočichy xx xxxxxxxxxx (xxxxxx xxxxx) x&xxxx;xxxxx xxxxxx ptáky.
Zpřesnění xxxxxxxxx xxxxxx xxx xxxx/xxxxxxxx xxxx být xxxxxxxx na testech xxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxx/xxxxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxxxxxxx ve xxxx&xxxx;XXX.
X&xxxx;xxxxxxx potřeby xx xxxxxxxx studie xxxxxxxxxxxx xxxxx xxxxxx XXXX 305.
4.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;XX: XXXXXX XXXXXXXX XX XXXXXXXXX DOPLŇKOVÉ XXXXX
Xxxxxx xxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxx xxxxx z vlastností stanovených x&xxxx;xx.&xxxx;5 xxxx.&xxxx;3 xxxxxxxx (XX) č. 1831/2003, podle xxxxxxxxx a funkčních skupin xxxxxxxxxxx xxxxx stanovených x&xxxx;xxxxxx&xxxx;6 x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxxx xxxxxxxx. Xxxx xxxxxx xxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxxxx běžné zemědělské xxxxx x&xxxx;XX.
Xxxxxxx experimentální xxxxxx musí xxx xxxxxxxxxx podle xxxxx xxxxxxxxx xxxxx, druhu x&xxxx;xxxxxxxxx xxxxxx. Xxxxx xx používají xxxxxxx, xxxxxx musí xxx xxxxxxxxx xxx, aby xxxxxx xxxxxx a podmínky xxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx. X&xxxx;xxxxxxx xxxxxx xx xxxxx xxxxxx příznivé i nepříznivé xxxxxx, a to jak x&xxxx;xxxxxx technologické, xxx x&xxxx;xxxxxxxxxx. Je xxxxx xxxxxxxx rovněž xxxxxxxxxxx xxxxxx, xxxxx snižují xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxxxx. X&xxxx;xxxxxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx uznaným, externě xxxxxxxxxxx xxxxxxxx zabezpečování xxxxxxx. Xxxxx takovýto xxxxxx neexistuje, xx xxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxxxxx, xx xxxxx xxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxx, který xx xxxxxxxxx jmenovanému xxxxxxxxx studie, xx xxxxxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx.
Xxxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxxxx vedoucí xxxxxx s ohledem xx xxxxxx xxxxxxx xxxxx, xxxx. xxxxxx, xxxxxxx xxxxxxxxx a materiál, xxxxx x&xxxx;xxxxx, xxxxxxx nebo xxxxx zvířat, xxxxxx xxxxx x&xxxx;xxxxxxxxxx, za xxxxx xxxx xxxxxxxx x&xxxx;xxxxxx. X&xxxx;xxxxx xxxxxx xxxxxxxxxxxx zvířata je xxxxx xxxxxx zkušební xxxxxxxx podle xxxx&xxxx;3.1.1.3. Xxxxxxxxx xxxxxx, xxxxxxx xxxx, xxxxx studie x&xxxx;xxxxxx xxxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxxxxxx xxxxx jsou xxxxxxxxxxx pro xxxxxxx xxxxxxx.
Xxxxxx musí xxx xxxxxxxx tak, aby xxxxxxxxxxx xxxxxxxx nejnižší xxxxxxxxxx xxxxx doplňkové xxxxx xxxxxxxxx se xx citlivé xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx a volitelně x&xxxx;xxxxxxxxx xxxxxxxxx skupinou. Xxxx xxxxxx xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxx, xxxxxxx xx xxxxxxxx. Xxxxxxxxxxxx xx xxxxx xxxxxxxx xxxxxx, xxxxxx xxxx xxxxxxx xx xxxxxxxxx xxx xxxxxxx xxxxx xx xxxxxx x&xxxx;xxxxxxxxx xxxxxx.
Xxxxxxxxx xx xxxxx věnovat xxxxxx xxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx, jinými xxxxxxxxxxx xxxxxxx x/xxxx xxxxxxxxxxxxx xxxxxx a/nebo xxxxxxxx krmné dávky, xxxxx xx xx xxxxxxxx pro xxxxxxxx xxxxxxx xxxxxxxxx látky (xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx xxxx xxxxxxxxxx xxxxxxxxx).
4.1&xxxx;&xxxx;&xxxx;Xxxxxx in xxxxx
X&xxxx;xxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx látek, které xxxxxxxxx xxxxxxxxxx krmiva, xx nutno xxxxxxxx xxxxxxxx pomocí laboratorní xxxxxx. Xxxxxx musí xxx xxxxxxxx xxx, xxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxxxx, s nimiž xx xxxxxxxxx xxxxx xxxx xxxxxxxxx. Xxxxxxxx xx xxxxxxxxx pokud xxxxx testy xxx xxxxxxxxx a musí xxxxxxxx xxxxxxxxx xxxxx s pravděpodobností X&xxxx;≤ 0,05.
U ostatních xxxxx xxxxxxxxxxx xxxxx je xxxxx použít k doložení xxxxxxxxx studie xx xxxxx, xxxxxxx xxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxxxxxxxxxxxxxxx xxxxxx. Xxxx xxxxxx by xxxx xxxxxxx statistické vyhodnocení.
4.2 Krátkodobé xxxxxx xxxxxxxxx xx xxxxxxx
Xx xxxxx použít xxxxxx biologické xxxxxxxxxxx x&xxxx;xxxxxxxxx, xxxxxxx nová xxxxx xxxx xxxxx xxxxxx xxxx xxxxxxx xxxx xxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxx xxx xxxx xxxxxxxxx nebo xxxxxxxx.
Xxxxxx bilanční xxxxxxxxxxxxxx xxx použít na xxxxxxx xxxxxx účinnosti x&xxxx;xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxx. V některých případech, xxxxxxx xx vztahu x&xxxx;xxxxxxxx xxx xxxxxxx xxxxxxxxx, je xxxxx xxxxxxxx prokázat lépe xxxxxxxxxx xxxxxxxx x&xxxx;xx xxxxx xxx xxxxxxx xxxxxxxxxx před dlouhodobými xxxxxxxx xxxxxxxxx. Xxx xxxxxx pokusech xx xxxxxxx počty x&xxxx;xxxxx/xxxxxxxxx xxxxxx odpovídající navrhovaným xxxxxxxxx xxx xxxxx.
Xxxxxxxxx xx možno xxxxxxxxx xxxx krátkodobé studie xxxxxxxxx u zvířat x&xxxx;xx xxxxx xxxxxxxx xxxxxxxxxx xxxxxx účinnosti x&xxxx;xxxxxx, xx-xx xx xxxx xxxxxxxxxx.
4.3&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx účinnosti x&xxxx;xxxxxx
Xxxxxxx xx měly xxx prováděny nejméně xx dvou různých xxxxxxx.
Xxxxxxx xxxxxxxxxxxxxx schéma xxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxx statistické xxxxxxxxxxx x&xxxx;xxxxxx typu 1 a 2. Xxxxxxxx musí být xxxxxxxxxx xxxxxxx, aby xxxxxxx xxxxxx doplňkové xxxxx xxx xxxxxxxx xxxxxxxxxx xxxxx (xxxxxx xxxx 1-α,&xxxx;X&xxxx;≤ 0,05 xxxxxx x&xxxx;X&xxxx;≤ 0,1 xxx přežvýkavce, menšinové xxxxx, zvířata v zájmovém xxxxx x&xxxx;xxxxxxx, xxxxx xxxxxx určena x&xxxx;xxxxxxxx xxxxxxxx) x&xxxx;xxxxxxxxxxx statistickou xxxxxxxxxxx, xxx xxxx xxxxxxxx, xx experimentální xxxxxxxx splňuje xxx xxxxxx. Xxxxxx xxxx 2-β&xxxx;xxxx xxx nižší xxxx xxxxx 20&xxxx;% xxxxxx x&xxxx;25&xxxx;% x&xxxx;xxxxxx x&xxxx;xxxxxxxxxxx, menšinovými xxxxx, xxxxxxx v zájmovém chovu x&xxxx;xxxxxxx, která xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx; xxxxxxxxxx (1-β)&xxxx;xx xxxx xxxxx xxxx xxxxx 80&xxxx;% (75&xxxx;% x&xxxx;xxxxxxxxxxx, xxxxxxxxxxx xxxxx, zvířat x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxxxx, xxxxx xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx).
Xxxxxx se, xx vzhledem x&xxxx;xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxx, xx xxxxx lze dosáhnout xxxxxxxxxxx výsledků. Xx xxxxx nutno xxxxxx xxxxxxx xxxxxxx xxxxxxxxxxx, xx-xx xxxxx xxxxxxxxxx xxxxxxx xxxxx xxx xxx. X&xxxx;xxxxxx xxxxxx xx xxx všechny xxxxxxx xxxx xxx xxxxxxx xxxxxxx xxxxx xxxxxxxxx, aby xxx xxxxx xxxxx být xxxxxxx x&xxxx;xxxxxxxx jejich xxxxxxxxxxxxx x&xxxx;xxxxxxxxxx (pokud xx xxxxx xxxxxxxx) xx účelem statistického xxxxxxxxx s hodnotou X&xxxx;≤ 0,05.
4.4&xxxx;&xxxx;&xxxx;Xxxx trvání xxxxxxxxxxxx xxxxxx účinnosti x&xxxx;xxxxxxxx xxxxxxx
Xxxx trvání xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx době xxxxxxxxx.
Xxxxxx xxxxxxxxx se xxxxxxxxx xxxxx xxxxxxxxxx praxe x&xxxx;Xxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxx trvání xx xxxxxxx x&xxxx;xxxxxxx&xxxx;XX.
Xxxxx xx xxxxxxxxx látka xxxxxxx xx xxxxxxxxxxx x&xxxx;xxxxxx xxxx, než xx xxxx xxxxxxxx xxxxxxxxx xxxxxx, xxxx xxx xxxxxxxx podle xxxxxxxxxxxx xxxxxxxx xxx užití. Xxxx pozorování však xxxxx xxx kratší xxx 28&xxxx;xxx x&xxxx;xxxx xxxxxxxxx všechny důležité xxxxxxxxx (xxxx. x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxx xxxxx xxxxx xxxxxxxxxx xxxx xx xxxxxxxx xx dobu xxxxxxxx, nebo počet x&xxxx;xxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxxxx xx xxxx xxxxxxx).
X&xxxx;xxxxxxxxx druhů xxxx xxxxxxxxx zvířat, xxx xxx nebyla x&xxxx;xxxxxxx&xxxx;XX xxxxxxxxx xxxxxxxxx xxxx trvání studií, xx xxxxx x&xxxx;xxxxx xxxxxx xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx xxx xxxxx.
4.5&xxxx;&xxxx;&xxxx;Xxxxxxxxx xx xxxxxxxx xxx xxxxxxxxx a funkční xxxxxxx xxxxxxxxxxx látek
Pro xxxxxxx doplňkové xxxxx, xxxxx mají mít xxxxxx na xxxxxxx, xx požadují xxxxxx xx vivo.
Pro xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxxxxxx a histomonostatik musí xxx účinnost xxxxxxxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx. U některých xxxxxxxxxxxxxx xxxxxxxxxxx látek x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx xxxxxxx, xx možno uznat xxxxxxxxxx xxxxxx xxxxxxxxx, xxxxx lze xxxxxxxx xxxxxxxxxxx xxxxxxxx.
Xxx xxxxxxx xxxxxxxxx doplňkových xxxxx xxx xxxxxxx xxxxxx xx xxxxxxx se xxxxxxxx xxxxxxx xxxxx xxxxxx xxxxxxxxx xx xxxxx.
4.6&xxxx;&xxxx;&xxxx;Xxxxxx týkající se xxxxxxx živočišných produktů, xxxxxxxx xx není xxxxxxx xxxxxx
X&xxxx;xxxxx prokázat, xx doplňková látka xxxx nepříznivý či xxxx nežádoucí xxxxxx xx xxxxxxxxxxxxxx a nutriční (xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxxx) xxxxxxxxxx xxxxxxxx xxxxxxxxx xx zvířat, xxx xxxx xxxxxx xxxxxxxxxx xxxxxx (xxxxx to xxxx xxxxxxx xxxxxx), xx xxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx odpovídající xxxxxx. Xxxx xxxxxxxxxx dvě xxxxxxx: skupina, jíž xxxxx xxxx xxxxxxxx, x&xxxx;xxxxxxx s nejvyšším xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx látky. Xxxxx xxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxx. Xxxxxxxxx xxxxxx xxxxxx musí xxx přiměřeně xxxxxxxxxx.
5.&xxxx;&xxxx;&xxxx;XXXXX&xxxx;X:&xxxx;XXXX XXXXXXXXXXXX X&xxxx;XXXXXX XX XXXXXXX LÁTKY XX XXX
Xxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003 xx xxxxx xxx xxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxx návrh xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx xxx x&xxxx;xxxxx xxxxxxxx a identifikovat xxxxxxxx xxxxx xxxx xxxxxxx, xxxxxxxx, xxxxxxxx nebo xxxxxxxxxxxx xxxxxx vyplývající x&xxxx;xxxxxxxxx xxxxxxxxx látky xx xxxxxx xxxx xxxx xxxxxx nebo xx životní xxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx xxxxxxxx.
Xxxxx xxxxx xxxxxxxxxxxx xxxx xxx xxxxxxxx xxxxxxxx podle jednotlivých xxxxxxx a musí určovat, xxx (např. xxxxxxx, xxxxxxxxx) vykonává jednotlivé xxxxx v plánu xxxxxxxxx x&xxxx;xxx xxxxxxxx za xxxxxxxx a řádné provádění xxxxx, x&xxxx;xxxx stanovit xxxxxx xxxxxxxxxxx xxxxxxxxxxx xxxxxx o veškerých xxxxxx xxxxxxxxxxxxx, xxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx užívání xxxx xxxxxxxxx xxxxx. Komisi x&xxxx;xxxx xx xxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxx ustanovení x&xxxx;xxxxxxxxxxxx obsažená x&xxxx;xxxxxx&xxxx;12 xxxxxxxx (XX) x.&xxxx;1831/2003.
Xx-xx xxxxxx xxxxx xxxxxx xxxxxxx xxxxxxxxxxxx x&xxxx;xxxx-xx xxxxxxxxx, xx xxx xxxxx používání x&xxxx;xxxxxxxx, xx kterém je xxxxx x&xxxx;xxxxxx, dochází x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxx, xxxxxxxx xx xxxx součást xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx xxxxxxx xxxxxx ke xxxxxxxxx rezistence bakterií xxxx xxxxxxxxx xxxxx.
X&xxxx;xxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx se xxxxxxx xxxxxxx monitorování rezistence Xxxxxxx xxx. x&xxxx;Xxxxxxxxxx xxxxxxxxxxx, xxxxx možno xxxxx druhé části xxxx povolení.
(1) Úř. věst. X&xxxx;50, 20.2.2004, x.&xxxx;44.
(2)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;196, 16.8.1967, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady 2006/121/XX (Úř. věst. L 196, 16.8.1967, x.&xxxx;1; opraveno x&xxxx;Xx.&xxxx;xxxx. X&xxxx;196, 16.8.1967, x.&xxxx;1).
(3)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;152, 30.4.2004, x.&xxxx;1.
(4)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;165, 30.4.2004, x.&xxxx;1.
(5)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;117, 8.5.1990, x.&xxxx;1. Směrnice xxxxxxxxx xxxxxxxxx rozhodnutím Xxxxxx 2005/174/XX (Úř. věst. X&xxxx;117, 8.5.1990, x.&xxxx;1)
(6)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;76, 22.3.1991, x.&xxxx;35. Xxxxxxxx xxxxxxxxx pozměněná xxxxxxxx 2001/58/XX (Úř. věst. X&xxxx;76, 22.3.1991, x.&xxxx;35).
(7)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;262, 17.10.2000, x.&xxxx;21.
(8)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;224, 18.8.1990, x.&xxxx;1. Xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxx Xxxxxx (ES) x.&xxxx;203/2008 (Xx.&xxxx;xxxx. X&xxxx;224, 18.8.1990, x.&xxxx;1).
(9)&xxxx;&xxxx;X.&xxxx;Xxxxxxxx et xx.: Xxxxxxxxxx Xxxxxxxxxx For Xxxxxx Xxxxxxxxxx Xxxxxxxxxx Xx Xxxxxxx Xx Xxxxxxxx (XXXXX Technical Xxxxxx) Xxxx Xxxx. Xxxx., sv. 74, x.&xxxx;5, x.&xxxx;835–855, 2002.
(10)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;221, 17.8.2002, x.&xxxx;8. Xxxxxxxxxx xxxxxxxxx xxxxxxxxx rozhodnutím 2004/25/XX (Úř. věst. X&xxxx;221, 17.8.2002, s. 8).
(11) Nevyčerpávající seznam xx k dispozici adrese: xxx.xxxx.xxxxxx.xx/xx/xxxxxxx/xxxxxx/xxxxxx_xxxxxxx/993.xxxx.
(12)&xxxx;&xxxx;Xxxxx x&xxxx;xxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
(13)&xxxx;&xxxx;X&xxxx;xxxxxx 50&xxxx;x&xxxx;xxxx a kůže x&xxxx;xxxxxxxxxxx poměrech.
(14) Tuk x&xxxx;xxxx x&xxxx;xxxxxxxxxxx xxxxxxxx.
(15)&xxxx;&xxxx;X&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx lhůtě.
(16) V ideálním případě xxxxxxxxx xx xxxxxxx xxxxxxxx jako XXX.
(17)&xxxx;&xxxx;Xxxxxxxxx x&xxxx;xxxxxx TRC.
XXXXXXX&xxxx;XXX
XXXXXXXX XXXXXXXXX, XXX XXXX XXXXXXXX XXXXXXXXXXX XXXXXXXXX X&xxxx;XXXXXX&xxxx;3, POKUD XXX X&xxxx;XXXXXXX KATEGORIE XXXXXXXXXXX XXXXX XXXX XXXXXXX ZVLÁŠTNÍ SITUACE, XXX XX STANOVENO X&xxxx;XX.&xxxx;7 XXXX.&xxxx;5 NAŘÍZENÍ (XX) X.&xxxx;1831/2003
Xxxxxxxx (ES) x.&xxxx;1831/2003 xxxxxxxxxxx xxxxxxxxxx xxxxx xxx xxxxxxxxxxx xxxxxxxxxxx (je-li xx xxxxx) pro xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx xxxx xx xxxxx xxxxxxxxx xxxxxx xxxxx xx.&xxxx;7 xxxx.&xxxx;5 xxxxxxxx (XX) x.&xxxx;1831/2003.
Xxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxx:
|
1. |
xxxxxxxxxxxxx xxxxxxxxx xxxxx |
|
2. |
xxxxxxxxxx xxxxxxxxx xxxxx |
|
3. |
xxxxxxxx xxxxxxxxx xxxxx |
|
4. |
xxxxxxxxxxxx xxxxxxxxx xxxxx |
|
5. |
xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxxx |
|
6. |
xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx xx druhy xxxxxxxxx |
|
7. |
xxxxxxx x&xxxx;xxxxxxxx xxxxx x&xxxx;xxxx xxxxxxx, xxxxx xxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx |
|
8. |
xxxxxxxxx xxxxx, xxxxx xxx xxxx povoleny xxx xxxxxxx x&xxxx;xxxxxxxxxxx |
|
9. |
xxxxx xxxxxxxx |
|
10. |
xxxxxxxx xxxxxxxx |
|
11. |
xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxx, které xxx xxxx xxxxxxxx xxxxx směrnice 70/524/EHS. |
Žádosti xx xxxxx xxxxxxxxx xx xxxxxxx xxxx xxx jednoho x&xxxx;xxxx xxxxxxxxx zvláštních xxxxxxxxx.
Xxxxxx xxxxxxxx
Xxxxx-xx x&xxxx;xxxxxxxxxxx některý x&xxxx;xxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx, je třeba xxxxx xxxxxx.
1.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXXX DOPLŇKOVÉ XXXXX
1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx oddíl I přílohy II.
1.2 Oddíl II: Identita, xxxxxxxxxxxxxxx a podmínky xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx látky, které xxxxxx xxxxxx na xxxxxxxx povolení, se xxxxxxx body 2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx jiné xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx na xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx xxxxx&xxxx;XX. |
1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx látek
Body 3.1, 3.2 x&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxxxxx na doplňkové xxxxx x&xxxx;xxxxxxxxxx, xxxxx xxx xxxxxxxx, xx:
|
— |
x&xxxx;xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxx účinné xxxxx (xxxxx) xxxx xxxxxxxxxx xxxxxxxxxx nebo xxxxxxxx xxxxxxx (xxxxxxx) xxxx |
|
— |
xxxxxx xxxxx(x)&xxxx;x&xxxx;xxxxxxx(x)&xxxx;xx xxxxxxxxx xxxx xxxxx xxxxxx siláže x&xxxx;xxxxx doplňkových látek xxxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xx xxxxxx připravenou xxx xxxxx xxxxxxxxx xxxxx (xxxx. xxxxx xxxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxxxxx). |
X&xxxx;xxxxxxxxx případech se xxxxxxx xxxx xxxxx&xxxx;3 xxxxxxx&xxxx;XX.
1.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro cílová xxxxxxx
X&xxxx;xxxxxxxxxx&xxxx;(1) xxxxx: xxxxxxx xx xxxx xxx&xxxx;3.1 xxxxxxx&xxxx;XX.
1.3.1.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxx
Xxx xxxxxxxxx látky x&xxxx;xxxxxxxxxx:
|
— |
xxxxxxx xx xxxxx xx xxxxxxxx krmné xxxxx a výsledky xx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx se xxxxxxx xxxxxx xxxxxx. Xxxxxxxx xxxxx xxxxx xxxx xxxxxxxxx xxxxxx xxxxx xxxxxx xxxxxxxxxx xxx xxxxxxx xxxxxxxxx látky; |
|
— |
dávka xxxxxxx pro xxxxxx xxxxxxxxx je násobkem xxxxxxxxxxx vyskytující se x&xxxx;xxxxxx x&xxxx;xxxx xxxxxxxxxx xxxxxxxxx, xxxxx xx xxx přesvědčivě xxxxxxx. Xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx, xxxxx xxxxxxxx životaschopné xxxxxxxxxxxxxx, x&xxxx;xxxxxxxxxx těchto organismů xxxxxx x&xxxx;xxxxxx xx xxxxx xxxxxxxxxx. |
Xxxxxx xxxxxxxxx xxx obvykle xxxxxx xx druhy xxxxxxxxxxx, xxxxxxxxx xxxxxxx. Studie xxxxxxxxxx xxxx druhy xxxx nutné xxxxx x&xxxx;xxxxxxx, je-li xxxxx xxxxxxxx ke xxx xxxxxx vhodnější k použití xxx xxxx xxxxx xxx xxxxxxxxxxx.
Xxxxxxx xxxxx:
X&xxxx;xxxxxxxxx xxxxx, xxx xxx xx požaduje povolení xxxx xxxxxxxxxxxxx doplňkové xxxxx x&xxxx;xxxxx xxxxxx xxxxxxxx xxx xxxxxxx xxxx xxxxxx, je xxxxx prokázat, že xxx zvířata xxxxxx xxxxxxxx xxx nejvyšším xxxxxxxxxxx xxxxxx. Toto xxxxxxxxx xxxx xxx xxxxxxx xx jeden xxxxx u jednoho x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx xxxxx nebo x&xxxx;xxxxxxx xxxxx xxxxxxxxxxxxx xxxxxx.
1.3.1.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX.
1.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
|
1.3.2.1 |
Xxxxxx metabolismu x&xxxx;xxxxxxx Xxxxxx metabolismu a reziduí xx xxxxxxxxxx, xxxxx:
Xxxxxx xxxxxxxxxxx xx xxxxxxxxxx rovněž x&xxxx;xxxxxxx, xxxxx xx xxxxx xxxxxxxxx v potravinách xxxx xxxxxxxx xxxxxxxxx xx značném xxxxxxxx xxxx je běžnou xxxxxxx tělních xxxxxxx xxxx xxxxx. X&xxxx;xxxxxx xxxxxxxxx se xxxx xxxxxxxx studie xxxxxxx, xxxxx xxxxx xxx xxxxxxx xx srovnání xxxxxx x&xxxx;xxxxxxx/xxxxxxxxxx u neošetřené xxxxxxx x&xxxx;xx xxxxxxx, xxx byla xxxxxxxx xxxxxxxx doporučená dávka. |
|
1.3.2.2 |
Toxikologické xxxxxx Xxxxxxxxxxxxx xxxxxx se xxxxxxxxxx, xxxxx:
Xxx xxxxxxxxxxxxxx a enzymy, které xxxxxx xxxxxx výše, xx xxxxxxxx xxxxxx xxxxxxxxxxxx (včetně xxxxxxxxxx) x&xxxx;xxxxxx xxxxxxxxxxxx orální xxxxxxxx. Xxxxxx xxxxxxxxxxxx xx nesmí xxxxxxxx xx xxxxxxxxxxx živých xxxxx. Xxx xxxxxxxx látky, xxx xxxxxx xxxxxx xxxx, se použije xxxx bod 3.2.2 xxxxxxx&xxxx;XX. Xxx xxxxxxx xxxxx se xxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxx x&xxxx;xxxxxxx xxxxxxxx. |
|
1.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx xxx spotřebitele Pro xxxxxxxxx látky xxxxxxxxxx xxx zvířata, která xxxx určena x&xxxx;xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx xxx&xxxx;3.2.3 xxxxxxx&xxxx;XX. |
1.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx uživatele/pracovníky
Použije se xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX. Xxxxxxxxx látky xxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxxx xx xxxxxxxx xx senzibilizátory xxxxxxxxx ústrojí, xxxxx xxxxxx xxxxxxxxxx přesvědčivé xxxxxx xxxxxxxxxxx xxxx.
1.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.4 xxxxxxx&xxxx;XX. U doplňkových látek x&xxxx;xxxxxxxxxx xx xxxxxxx xxxxxx xxxxxxxxx xxxxx xx xxxxxx xxxxxxxxx xxxx xx xxxxxxxxx xxx xxxx sil xxxxx xxxxxxxxxx.
1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx účinnosti xxxxxxxxx xxxxx
Xxxxxxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx, xxxxxxx xxxx xxxxxx xxxxx xxxxx xxxxxxxxxx účinek xx xxxxxxxxxx xxxxxx. Xxxxxx x&xxxx;xxxxxxxxx doplňkové xxxxx xxxx xxx xxxxxxxxxx xxxxxx vhodných xxxxxxxx xxxxxxxxxxxx v uznaných xxxxxxxxxxx xxxxxxxx za určených xxxxxxxxxxx podmínek xxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx.
Xxxxxxxx se xxxxxxx studiemi in xxxxx x&xxxx;xxxxxxxx látek xxx xxxxxxxx kontaminace xxxxxxxxxxxx. V následující xxxxxxx xxxx xxxxxxx xxxxxx xxxxxxxxx pro xxxxx xxxxxxx skupiny.
Parametry pro xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxx xxxxx
|
Xxxxxxx skupina |
Parametry xxx xxxxxxxxx xxxxxxxxx |
||||||||||
|
Xxxxxxxx xxxxxxxxxxxxx xxxxx, xxxxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx přispívajících xx znehodnocení. Xx xxxxx xxxxxxxx udávanou xxxx xxxxxx xxxxxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx/xxxxxx xxxxx xxxxxxxxxx x/xxxx skladování xxxxxx. Xx xxxxx xxxxxxxx xxxxxxxx dobu xxxxxx xxxxxxxxxx xxxxxx. |
||||||||||
|
Xxxxx/xxxxxxxx xxxxxxxxxx xxxxxx xxxxx xxxxxxxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxx. |
||||||||||
|
Xxxxxxxxx xxxxxxxxx-xxxxxxxxxx xxxxx xxxxx. |
||||||||||
|
Viskozita xxxxxxx materiálů xxxx xxxxx. |
||||||||||
|
Tvoření gelu xxxxxxx xx změně xxxxxxxxx krmiva. |
||||||||||
|
Trvanlivost xxxxx xxxx xxxxxxxxx xxx xxxxxxxxx pelet. |
||||||||||
|
Xxxxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxx původu. |
||||||||||
|
Xxxxxxxxx xxxxxxxx xxxxxxx. Xx xxxxx xxxxxxxx xxxxxxxx xxxx xxxxxx protispékavého xxxxxx. |
||||||||||
|
xX x/xxxx xxxxxxxxx kapacita xxxxx. |
||||||||||
|
|
||||||||||
|
Xxxxxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx. |
Xxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx
Xxxxxxxx xx zvláštní xxxxxxx x&xxxx;xxxxx prokázat požadovaný xxxxxx xx silážní xxxxxx&xxxx;(2). Zkoušky se xxxxxxxx x&xxxx;xxxxxx příkladem x&xxxx;xxxxx x&xxxx;xxxx uvedených xxxxxxxxx (xxxxx jsou xxxxxxxx xxxxxxx nebo xxxxxxxxxxxxxxx xxxxxx):
|
— |
xxxxxx, xxxxx xxx xxxxxx xxxxxxxxx: &xx;3&xxxx;% xxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx materiálu (xxxx. xxxx xxxxxxxx kukuřice, xxxxx, xxxxxx nebo xxxxx xxxxx), |
|
— |
xxxxxx, xxxxx xxx xxxxxxxxx s mírnými xxxxxxxx: 1,5–3,0&xxxx;% rozpustných xxxxxxxxxxx v čerstvém xxxxxxxxx (xxxx. xxxxxxx, xxxxxxxx xxxx zavadlá xxxxxxxx), |
|
— |
xxxxxx, xxxxx xxx xxxxxxxxx xxxxxxx: < 1,5 % xxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx (xxxx. xxxx xxxx xxxxxxxxx). |
Xxxx-xx xxxxxxx omezeny xx xxxxx kategorie xxxxx xxxxxxx xx xxxxxxx sušiny, xxxxx xx xxxxxxxx xxxxxxx xxxxxx. Xxxx xx xxxxxxxx tři xxxxxxx x&xxxx;xxxxxxxxxx reprezentativním xxx xxxx xxxxxxx, xxxxx xxxxx xx použití xxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxx.
Xxx xxxxxxxx xxxxxx xx požadují xxxxxxxxxx xxxxxxx.
Xxxx xxxxxx xxxxxx xx obvykle 90 dnů xxxx xxxx xxx xxxxx teplotě (xxxxxxxxxx xxxxxx 15 – 25&xxxx;xX). Použití xxxxxx xxxx xxxxxx musí xxx xxxxxxxxxx.
Xxxxxxx xx xxxxxx xxxxxxxx měření xxxx xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxx xxxxxxxx:
|
— |
xxxxxx x&xxxx;xxxxxxxxx xxxxxx xxxxxx (xxxxxxxx x&xxxx;xxxxxxx xx těkavé xxxxx), |
|
— |
xxxxxx xX, |
|
— |
xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxx (xxxx. xxxxxxxx xxxxxx, kyselina máselná x&xxxx;xxxxxxxx xxxxxxxxxx) x&xxxx;xxxxxxxx xxxxxx, |
|
— |
xxxxxxxxxxx alkoholů (ethanol), |
|
— |
koncentrace xxxxxx (x/xx xxxxxxxxx xxxxxx) a |
|
— |
obsah uhlohydrátů xxxxxxxxxxx xx xxxx. |
Xxxxxxxxx xx xxxxxx xxxx xxxxxxxxxxxxxxx a chemické xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx (např. xxxxx xxxxxxxx schopných xxxxxxxxxx xxxxxx, xxxxxxxx xxxxxxxxxx, xxxxxxxx listérií x&xxxx;xxxxxxxxxx xxxxx).
Xxxxxxx xxxxxx v souvislosti xx snížením množství xxxxxxxxxxxx xxxxxxxxx xxxx xx posoudí na xxxxxxx xxxxxxxxx objemu xxxxxxxxx xxxx xxxxxxxxxxx xx celé pokusné xxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxx (xxxx. ekotoxicita xxxxxxxxx xxxx nebo xxxxxxxxxx xxxxxxx xxxxxxx). Xxxxxxx tvorby xxxxxxxxx xxxx xx xxxxx xxxxxxxx xxxxx. Xxxxxxxx xxxxxxx xxxx musí xxx xxxxxxxxxx, xxx xxxxx silážní xxxxx xxxxxxx za xxxxxx xxxxx. Doba trvání xxxxxx xx xxxxxxx 50&xxxx;xxx. Xxxxx se xxxxxxx xxxx xxxx, xx xxxxx xx xxxxxxxxx.
Xxxxx xxxxxxx xxxxxxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxxxx s negativní kontrolní xxxxxxxx. Xxxxxx stability xxxx xxxxx xxxxxxx xxxx dnů xx xxxxxxxx xxxxxxx a doplňková xxxxx xxxxxxx xxxxxxxxx xx dobu nejméně x&xxxx;xxx dny xxxxx, xxx xx xxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxx xxxxxx. Xxxxxxxxxx xx, xxx xx xxxxx prováděl xxx teplotě xxxxx 20&xxxx;xX a aby xx xxxxxxx xxxxxxx o 3 oC xxxx více xxxxxx xxxxxxx xxxxx považovalo xx známku xxxxxxxxxxx. Xxxxxx teploty je xxxxx nahradit měřením xxxxxxxx XX2.
1.5&xxxx;&xxxx;&xxxx;Xxxxx X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx po xxxxxxx xxxxx na xxx
Xxxxx xxxxx se xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 odst. 3 písm. g) nařízení (XX) č. 1831/2003. To xxxxxxx, xx xx xxxx monitorování x&xxxx;xxxxxx xx uvedení xxxxx xx xxx xxxxxxxx xxxxx xxx xxxxxxxxx xxxxx, xxxxx jsou xxxxxxxxx modifikované xxxxxxxxx xxxx jsou x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx organismů vyrobeny.
2. SENZORICKÉ XXXXXXXXX LÁTKY
2.1 Barviva
2.1.1 Oddíl I: Shrnutí dokumentace
Použije xx xxxx oddíl I přílohy II.
2.1.2 Oddíl II: Xxxxxxxx, charakteristika a podmínky xxx užití xxxxxxxxx xxxxx; xxxxxx analýzy
Oddíl II xxxxxxx&xxxx;XX se použije xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxx xx xxxxxxxx povolení, xx xxxxxxx body 2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx xxxx xxxxxxxxx xxxxx, které xxxx vázané na xxxxxxxx povolení, se xxxxxxx xxxx xxxxx&xxxx;XX. |
2.1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx
Xxx&xxxx;3.3 přílohy II se xxxxxxxx xxxx na xxxxxxx doplňkové xxxxx.
|
1. |
Xx xxxxx, které xxx xxxxxxx x&xxxx;xxxxxx, dávají xxxxx potravinám xxxxxxxxxxx xxxxxx, se xxxxxxxx xxxx xxxxx&xxxx;XXX body 3.1, 3.2 a 3.4 xxxxxxx&xxxx;XX. |
|
2. |
X&xxxx;xxxxx, xxxxx xxxxxx nebo xxxxxxxxx xxxxxxx xxxxx, xx studie xxxxxxxx xx xxxxxx&xxxx;XXX bodu 3.1 xxxxxxxx xx zvířatech, xxxxxx xxxx xxxxxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxx. Je xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxx xx existující xxxxxxxx xxxxxxxxxx. Xxxxxxx xx xxxxx&xxxx;XXX xxxx&xxxx;3.2 x&xxxx;3.4 xxxxxxx&xxxx;XX. |
|
3. |
X&xxxx;xxxxx, xxxxx xxxx xxxxxxxxx xxxx xx xxxxxxxx okrasných xxx xxxx ptáků, xx požadují studie xxxxxxxx xx oddílu III xxxx&xxxx;3.1 přílohy II x&xxxx;xxxx xxxxxx xxxx xxx xxxxxxxxx na xxxxxxxxx, xxxx xxxx doplňková xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxx. Xx xxxxx xxxxxxxxxx xxxxx xxxxxx xxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxx. Nepožadují xx xxxx xxxx&xxxx;3.2 x&xxxx;3.4. |
2.1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
x) |
Xxx xxxxx, xxxxx při xxxxxxx x&xxxx;xxxxxx xxxxxx xxxxx xxxxxxxxxx živočišného původu: změny xxxxx produktů získaných xx zvířat, xxxxxx xxxx doplňková xxxxx xxxxxxxx xx xxxxxxxxxxxx xxxxxxxx xxx užití, xx měří xxxxxx xxxxxx xxxxxxxx. Xx xxxxx prokázat, xx xxxxxxxxx xxxxxxxxx xxxxx xxxx xxxxxxxxxx vliv xx xxxxxxxxx produktu xxxx organoleptické a nutriční xxxxxxxxxx potravin. Xxxx-xx xxxxxx xxxxxxxxx xxxxx xx xxxxxxx/xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxxxxx, xxx xxxxx odpovídající xxxxx o účinnosti xxxxxxxxxx xxxxxxx studie (např. xxxxxx biologické dostupnosti). |
|
b) |
Pro xxxxx, které xxxxxx xxxx navracejí xxxxxxx xxxxx: xxxxx x&xxxx;xxxxxxxxx xx xxxxx xxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxxxx laboratorních studií xxxxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx xxx užití x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx. |
|
x) |
Xxx xxxxx, xxxxx mají xxxxxxxxx xxxx xx xxxxxxxx xxxxxxxxx xxx xxxx xxxxx: xxxxxx prokazující účinek (xxxxxx) xx xxxxxxxx xx xxxxxxxxx, xxxxxx xxxx xxxxxxxxx xxxxx xxxxxxxx v doporučené xxxx. Xxxxx xxxxx xx xxxx pomocí xxxxxx xxxxxxxx. Důkaz o účinnosti xx xxxxx xxxxxxxxxx xxxxxx jinými xxxxxxxxxxxxxxxx xxxxxxxx (xxxx. xxxxxxxxxx xxxxxxxxxx) xxxx odkazem xx xxxxxxxx xxxxxxxxxx. |
2.1.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx látky xx xxx
Xxxxx oddíl xx xxxxxxx xxxxx ustanovení xx.&xxxx;7 xxxx.&xxxx;3 písm. g) nařízení (XX) x.&xxxx;1831/2003. To xxxxxxx, že xx xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx uvedení xxxxx xx xxx xxxxxxxx xxxxx xxx xxxxxxxxx xxxxx, které xxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxx xxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx organismů xxxxxxxx.
2.2&xxxx;&xxxx;&xxxx;Xxxxxxxxxxx xxxxx
2.2.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
2.2.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx a podmínky xxx xxxxx xxxxxxxxx xxxxx; xxxxxx analýzy
V případě xxxxxxx „xxxxxxxx xxxxxxxx“ se xxxxxxx xxxx rostliny, xxxxxxx a jiné xxxxxxxxx x&xxxx;xxxxxx xxxxx nebo xxxxxx xxxxxxxx, které xxxx xxxxx málo xxxxxxxxxx, jako xxxx. xxxxxxx, mletím xxxx xxxxxxx (xxxx. mnoho xxxxx x&xxxx;xxxxxx), xxxxxxxxxx xx xxxxxxxx spadající xx xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx xxxxx.
Xxx xxxxx vyhodnocení žádostí xxxxxxxxxx se xxxxxx xxxxxxxx xxxx xxxxxxxxxxx xxxxx xxxxxxxxxxxxx takto:
|
1. |
Přírodní xxxxxxxx:
|
|
2. |
Přírodní xxxx xxxxxxxxxxxx syntetické chemicky xxxxxxxxxx xxxxxxxxxxx xxxxx |
|
3. |
Xxxxx xxxxx Xx nutno xxxxx xxxxxxxxxx xxxxxxx, xx xxx patří xxxxxxx, xxxxx xx žádost xxxx. V případě xxxxxxxx, xxxxx xxxxxxx do xxxxx z výše uvedených xxxxxx, xx toto xxxxx xxxxx x&xxxx;xxxxxxxxx. |
|
2.2.2.1 |
Xxxxxxxxxxxxxxx xxxxxx látky (xxxxx) / xxxxxxx (xxxxxxx) Xxxxxxx xx xxxx xxx&xxxx;2.2 xxxxxxx&xxxx;XX. Xxxxxx: Xxx xxxxxxx xxxxxxx xxxxxxxxxxxxx xxxxx je xxxxx xxxxx xxxx xxxxxxxxx xxxxxxxxxxxxx xxxxx (xxxxx) (např. XXXXXX&xxxx;(3), Xxxx Xxxxxx&xxxx;(4), JECFA, XXX&xxxx;(5) xxxx jiný xxxxxxxxxxx schválený xxxxxx xxxxxxxxx) xxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxxxxx zchutňujících produktů x&xxxx;xxxxxxxx a potravinách, xxxxx xx x&xxxx;xxxxxxxxx.
|
|
2.2.2.2 |
Xxxxxx xxxxxx Xxxxxxx xx xxxx xxx&xxxx;2.3 přílohy II. V případě xxxxxxxxxx xxxxxxxx, xxxxx xxxxxx chemicky xxxxxx xxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxx xxxxx látek xxxxxxx v procesu xxxxxxxx, xx xxxxx xxxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxx. Doporučuje xx x&xxxx;xxxxxx xxxxxx odpovídající xxxxxxxxxxxx, xxxx. xxxxxx, xxxxx, výluh, extrakt x&xxxx;xxxxxxxxxxx pojmy (7) xxxxx xxxxxxxxx xxx botanicky xxxxxxxxxx zchutňující produkty x&xxxx;xxxxxx procesu extrakce. Xxxxxxx xx xxxxxxx xxxxxxxxx rozpouštědla, xxxxxxx xxxxxxxxxxxx xxxxxxxx, xxx xx xxxxxxxx reziduím x&xxxx;xxxxxxxxxxxx, a obsahy xxxxxxx, xxxxx xxxx toxikologicky xxxxxxxx, xxxxxxxx jejich xxxxxxx xxxxx xxxxxxxx. Xxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxx xx xxxxxx xxxxxxxx. |
|
2.2.2.3 |
Xxxxxx xxxxxxx
Celý xxx&xxxx;2.6 xxxxxxx&xxxx;XX xx xxxxxxxx xx xxxxxxx xxxxxxx zchutňující xxxxx, xxxxxxxxx xxxxxxxx xxxxxxxx, xxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxx, xxxxxxxx xxxx xxxxxxxxxxxx syntetické xxxxxxxx xxxxxxxxxx zchutňující xxxxx, xxx jsou xxxxxxxxxxxxx xxxxxxxxxx xxxxxxx, x&xxxx;xxxxx xxxxxxxxxxx xxxxx. |
2.2.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové xxxxx
Xxx xxxxxxx zchutňující látky xx xxxxx xxxxx xxxxxxxx xxxxxx a výpočty xxxxxx xxx x&xxxx;xxxxxxxxx xxxxxxxx, xxx po xxxxxxx xxxxxxxxxxx látky xx xxxxx.
Xx zchutňující xxxxx patřící xx xxxxxxx umělých látek xx vztahuje celý xxxxx&xxxx;XXX přílohy II.
|
2.2.3.1 |
Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx xxxxxx xxxxxxx
|
|
2.2.3.2 |
Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx Xx xxxxx xxxxxxx, xx metabolity xxxxxxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxxx xx xxxxxxx. X&xxxx;xxxxxxx, xx užití xxxxxxxxxxxx xxxxxxxxxxxxx produktu x&xxxx;xxxxxxxx xxxx přidání do xxxxx xxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxx xxxxxx, xx xxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxx.
|
|
2.2.3.3 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové látky xxx uživatele/pracovníky Použije se xxxx bod 3.3 přílohy II. |
|
2.2.3.4 |
Studie xxxxxxxx se bezpečnosti xxxxxxxxx xxxxxxxxx látky xxx životní xxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX. |
2.2.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx účinnosti xxxxxxxxx xxxxx
Xx nutno xxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx, xxxxxxx na xxxxxxx xxxxxxxxxx xxxxxxxxxx. Xx xxxx xxx xxxxxxxxx rovněž zkušenostmi x&xxxx;xxxxxxxxxxx xxxxxxxxx, xxxx-xx x&xxxx;xxxxxxxxx, x&xxxx;xxxxxxx xxxxxxx xxxxx xxx xxxxxxxxxx xxxxxx xx xxxxxxxxx.
Xx xxxxx xxxx prověřit x&xxxx;xxxxx, xxx xxxxxxx, xxxxxxx se xxxxxx xxxx, plní v krmivu, xxxxxxx nebo xxxxxxxxxxx xxxxxxxxxxx původu xxxx xxxxxx xxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxxxxxxx látek x&xxxx;xxxxxxx&xxxx;X&xxxx;xxxxxxxx (ES) x.&xxxx;1831/2003.
2.2.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx v období xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx xx xxxxxxx podle xxxxxxxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003. To xxxxxxx, že se xxxx monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx xxxxxxxx xxxxx xxx xxxxxxxxx xxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxxxx organismy xxxx xxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx.
3.&xxxx;&xxxx;&xxxx;XXXXXXXX XXXXXXXXX XXXXX
3.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx dokumentace
Použije xx xxxx oddíl X&xxxx;xxxxxxx&xxxx;XX.
3.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Identita, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX se xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, které xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx použijí xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx xxxx doplňkové xxxxx, xxxxx jsou vázané xx xxxxxxxx xxxxxxxx, xx xxxxxxx celý xxxxx&xxxx;XX. |
3.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Studie xxxxxxxx xx bezpečnosti xxxxxxxxxxx xxxxx
3.3.1&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx používání doplňkové xxxxx pro xxxxxx xxxxx
|
3.3.1.1 |
Xxxxxxxxx x&xxxx;xxxxxxxx xxxxx
|
|
3.3.1.2 |
Xxxxxxxxxxx xxxxxx Xxxxxxx xx celý xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX. |
3.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
|
3.3.2.1 |
Xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxx Xxxxxx xxxxxxxxxxx se obvykle xxxxxxxxxx. Pro xxxxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxxxxx v bachoru. Studie xxxxxxx xxxx xxxxxxxx xx xxxxxxxx xxxxx x&xxxx;xxxx xxxxxxxxxxx xxxxx, xxxxx xxxxxxx xx xxxxxxx xxxxxxx „vitamíny, provitamíny x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx xxxxx xx srovnatelným xxxxxxx“, xxxxx mají xxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxx, x&xxxx;xxx funkční xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, xxxxx xx zvýšila xxxxxxxxxx xxxxxxxxxx. V tomto xxxxxxx xx xxxxxxxxx xxxxxx xxxxxxx x&xxxx;xxxxxx&xxxx;3.2.1 xxxxxxx&xxxx;XX. Požadavek je xxxxxx xx srovnání xxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx mezi xxxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx dávka dotyčné xxxxx, a pozitivní xxxxxxxxx xxxxxxxx (referenční xxxxx). |
|
3.3.2.2 |
Xxxxxxxxxxxxx xxxxxx Xx xx xxxxxxxx xxx xxxxxxxx fermentačního xxxxxxx x&xxxx;xxx xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxx xxxxxxxx. Xxx xxxxxxxx xxxxxxxxxxxxx procesu xx nutno předložit xxxxxx xxxxxxxxxxxx a subchronické xxxxxxxx, xxxxxx:
Xxxxx xxxxxxxxx organismus patří xx skupiny, x&xxxx;xxx xx známo, xx xxxxxxx xxxxx xxxxxxxxx xxxxxx, je xxxxx xxxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx. |
|
3.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx xxx xxxxxxxxxxxx Xxxxxxx se xxxx xxx&xxxx;3.2.3 přílohy II. |
3.3.3 Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
3.3.4&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky xxx xxxxxxx xxxxxxxxx
Xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxx xxx nové xxxxxx xxxxx, xxxxx xxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx.
3.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx xxxxx
Xxxxxx xxxxxxxxx xx xxxxxxxxxx xxx xxxxxxxx, xxxxxxxxxxxxx, xxxx x&xxxx;xxxxxxx aminokyselin, které xxx byly povoleny xxxx doplňkové xxxxx, xxxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxx xxxx xxxxxxxx jako xxxxxxxxx xxxxx, a vitamíny, provitamíny x&xxxx;xxxxxxxx xxxxxx xxxxxxxxxx xxxxx se xxxxxxxxxxxx xxxxxxx, xxxxx již xxxx xxxxxxxx jako xxxxxxxxx xxxxx.
Xxxxxxxxxx xxxxxx xx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxx deriváty xxxxxxxx, xxxx x&xxxx;xxxxxxx xxxxxxxxxxxx, xxxxx xxxxx xxxxxx xxxxxxxx jako xxxxxxxxx xxxxx, xxxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxx nebyly xxxxxxxx xxxx xxxxxxxxx xxxxx, x&xxxx;xxx vitamíny, xxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxx definované xxxxx xx xxxxxxxxxxxx xxxxxxx, xxxxx xxxxx xxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxx.
Xxx ostatní xxxxx, u nichž xx xxxxx nutriční xxxxxx, xx xxxxxxxx xxxxxxx xxxxx xxxxxxxxxx studie xxxxxxxxx xxxxx ustanovení xxxxxx&xxxx;4 xxxxxxx&xxxx;XX.
Xxxxxx xxxx xxxxxxxx xxxxxxxx, xx xxxxxxxxx xxxxx může xxxxxxx xxxxxxxxx požadavkům xxxxxx. Xxxxx xxxxxxxx xxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxx, která obsahuje xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxxxx. Xx xxxx xxxxx zamezit xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxxxx. Xxxxxxx postačuje xxxxxxxx xxxxxxxx x&xxxx;xxxxxxx xxxxx xxxx kategorie xxxxxx, xxxxxx laboratorních xxxxxx.
3.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx v období xx xxxxxxx látky xx xxx
Xxxxx xxxxx xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
4. ZOOTECHNICKÉ DOPLŇKOVÉ XXXXX
4.1&xxxx;&xxxx;&xxxx;Xxxxxxxxxxxx xxxxxxxxx látky xxxx xxx enzymy x&xxxx;xxxxxxxxxxxxxx
4.1.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx dokumentace
Použije xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
4.1.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx doplňkové xxxxx; xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
4.1.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
|
4.1.3.1 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx xxxxxx xxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.1 xxxxxxx&xxxx;XX. |
|
4.1.3.2 |
Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro xxxxxxxxxxxx
|
|
4.1.3.3 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové xxxxx xxx xxxxxxxxx/xxxxxxxxxx Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX. |
|
4.1.3.4 |
Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové xxxxx xxx xxxxxxx prostředí Použije xx xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX. |
4.1.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající xx účinnosti xxxxxxxxx xxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
|
1. |
Xxxxxxxxx xxxxx, xxxxx xxxx pozitivní xxxx na xxxxxxxxxx xxxxxx, xxxxxxxxxx xxxx xxxxx životní xxxxxxxx, x&xxxx;xxxxxxx xxxxxxx „jiné xxxxxxxxxxxx xxxxxxxxx xxxxx“ Xxxxxx xxx xxxxxxxx pouze xx xxxxxx xx xxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx zvířat. X&xxxx;xxxxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxx xxxxx xxx měření xxxxxxxx xx xxxxxxxxxx xxxxxxxxxxxxxxxxx (xxxx. xxxxxxxxx xxxxxxxx, xxxxxxxx xxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxx xxxxxxxx), xxxxxxx xxxxxxx upraveného xxxx, xxxxxxxxxxx stáda, xxxxxxxxxxxxx xxxxxxxxxxx nebo xxxxxxx životních xxxxxxxxxx xxxxxx. Xxxxx o mechanismu xxxxxxxx xxx poskytnout xxxxxxxxxxxx studiemi xxxxxxxxx xxxx laboratorními xxxxxxxx xxxxxxxx příslušný parametr. |
|
2. |
Doplňkové xxxxx, xxxxx pozitivně xxxxxxxxx důsledky xxxxxxxxx xxxxxx xxx životní xxxxxxxxx X&xxxx;xxxxxxxxxxx xxxxx, xxxxx xxxxxxxx ovlivňují xxxxxxx xxxxxxxxx (xxxx. xxxxxxx xxxxxxx dusíku x&xxxx;xxxxxxx xxxx xxxxxxx xxxxxxxx xxxxxx, xxxxxxxxx xxxxxxxx), xx xxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxx krátkodobými xxxxxxxx xxxxxxxxx xx zvířaty xxxxxxxxxxxxx významné prospěšné xxxxxx. Xxxxxx xxxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxxxxxx xx xxxxxxxxx látce. |
4.1.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx se xxxxxxx podle xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 písm. g) nařízení (XX) č. 1831/2003.
4.2 Zootechnické xxxxxxxxx xxxxx: xxxxxx x&xxxx;xxxxxxxxxxxxxx
4.2.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
4.2.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, charakteristika x&xxxx;xxxxxxxx pro užití xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
4.2.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxxxx látek
|
4.2.3.1 |
Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx xxxxx xxx xxxxxx zvířata Použije xx xxxx xxx&xxxx;3.1.1 xxxxxxx&xxxx;XX. Xxxxxxxx xx xxxxxxxx, xxx xxxxx xxxxx používali x&xxxx;xxxxxxx xxxxxxx přinejmenším 100xxxxxxx nadměrné xxxxx x&xxxx;xxxxxxx počet požadovaných xxxxxxxxx. K tomuto xxxxx xxx použít koncentrovanou xxxxx xxxxxxxxx xxxxx. Xxxxxxxxxxx se xxxxxx xxxxxxxx množství xxxxxxxxxx xxxxxx, poměr xxxxxxxx xxxxxxx (xxxxxxx) / xxxxx (látek) k ostatním xxxxxxxxx xxxxxxxxxxxxx procesu xxxx xxxx xxx xxxxxx jako x&xxxx;xxxxxxx xxxxxxxx. X&xxxx;xxxxxx xxxxxx xxxxxxxxx xxxxxx xxxxxxxx(x). Xxxx xxx&xxxx;3.1.2 xxxxxxx&xxxx;XX se xxxxxxxx xx všechny xxxxxxxxxxxxxx x&xxxx;xxxxxx, které xxxx přímý xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxxxx flóry xxxx x&xxxx;xxxxxxx xx xxx xx xxxxx, xx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx. X&xxxx;xxxxxxx xxxx expozice xxxx xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxx xxx xxxxxxxx xxxxxxxxx xxxxxx, aby xxxx xxxxxxxxx neexistence xxxxxxxxxxxx xxxxxx na xxxxxxxxxx xxxxxxxxxxx flóru trávícího xxxxxx. X&xxxx;xxxxxxxxxxx bude xxxxx přímé xxxxxxxx xxxxxxxxxxx flóry pouze x&xxxx;xxxxxxx, že xxxxxx xxxxxxxxx nepříznivé xxxxx xxxxxx xxxxxxx (xxxxxx xx xxxxx jako xxxxx koncentrací těkavých xxxxxxxx xxxxxxx, snížení xxxxxxxxxxx xxxxxxxxxx xxxx xxxxxxx celulolýza). |
|
4.2.3.2 |
Studie xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
Xxxxxx x&xxxx;xxxxxxxxxxxxxx xxxxx xxxxx xxxx xxxx xxxxxxxxx xxxxx, xxxxx xx xxxxxxx xxxxxxx xxxx xxxxxxxxx xxxx xxxxxx xxxxxxxxxxx z fermentačního xxxxxxx. Xxxxx xx nezbytné xxxxxxxxxx látku otestovat, xxx xxxx zajištěno, xx xxxxxxxxxx xxxxxxxxx xxxx jiné xxxxxxxxx, xxxxx mohou xxxxxxxx xxxxxxx požívajícího xxxxxxxxx xxxxxxx xx xxxxxx, xxx xxxx krmena xxxxxx xxxx xxxxx xxxxxxxxxx xxxxxx doplňkovými xxxxxxx. Xxxxxxx xxxxxxxxxxxxxxx bakterií xxxxxxxx xxx xxxxx xxxx xxxxxxx přijímání xxxxx (xxxxxx xxxxxxx) xx xxxx xxxxxxxx xx skupin organismů, xxx xxx xxxx x&xxxx;xxxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx, xxxx xx xxxxxx, pro xxx xxxx xxxxxxx xxxxxx xxxxxx vymezena. Xxxxxxx xxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxxxxxx, xxxxx xx x&xxxx;xxxxxxxxxxx používají x&xxxx;xxxxxxxx xxxxxx, xx xxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxx moderními výrobními xxxxxxx. Xxxxx se xxx xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxx x&xxxx;xxx mikroorganismy, xxx xxx xxxx x&xxxx;xxxxxxxxx údaje x&xxxx;xxxxxxx xxxxxxxxx xxxxxxxxx, x&xxxx;xxxx-xx xxxxxx fermentačního xxxxxxx xxxxxx xxxxxxxxxx x&xxxx;xxxxx, xxxxxxxxxx zkoušky xxxxxxxx (xxxx. testování xxxxxx xxxxxxxx xxxx genotoxicity) xx nutné. Avšak x&xxxx;xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxx enzymů xx vždy xxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxx 2.2.2.2 xxxxxxx&xxxx;XX. Xx-xx xxxxxxxxxx xxxx xxxx xxxxx xxxx x&xxxx;xxxxxxxxxx xxxxxxxxxx xxxxxxxx o biologii (xxxxxxxxxxx) xxxxxxxxx, aby xxx xxxxxxxx xxxxxxxxx produkce xxxxxxxxx xxxxxxxxxx, je xxxxx předložit xxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx látkami, xxxxx obsahují xxxxxxxxxxxxx xxxxxxxxxxxxxx nebo xxxxxx. X&xxxx;xxxxx xxxxxxx xxxx xxxxxx studií genotoxicity xxxxxx xxxxxxxxxx x&xxxx;xxxxxx xxxxxxxxxxxx orální toxicity. Xxxxxxxxxx xx, xxx xx tyto xxxxxx xxxxxxxxx s bezbuněčnou fermentační xxxxx xxxx v případě xxxxxxxxxx xxxxxx xxxxxxxxx x&xxxx;xxxxxxx extraktem. |
|
4.2.3.3 |
Studie xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx Xxxxxxx xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX s výjimkou xxxxxx xxxxxxx:
|
|
4.2.3.4 |
Xxxxxx týkající se xxxxxxxxxxx doplňkové xxxxx xxx xxxxxxx xxxxxxxxx Xxxx xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxxx xxxx xx xxxxxxxxxxxxxx, které nejsou xxxxxxxxx xxxxxx nebo xxxxxx všudypřítomné x&xxxx;xxxxxxxx xxxxxxxxx. |
4.2.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Studie xxxxxxxx xx xxxxxxxxx xxxxxxxxxxx xxxxx
Xxxxxxx xx xxxx xxxxx&xxxx;XX přílohy II.
|
1. |
Doplňkové xxxxx, xxxxx xxxx xxxxxxxxx xxxx na xxxxxxxxxx xxxxxx, xxxxxxxxxx nebo xxxxx životní xxxxxxxx x&xxxx;xxx xxxxxxx xxxxxxx „xxxx xxxxxxxxxxxx doplňkové xxxxx“. Xxxxxx xxx xxxxxxxx xxxxx xx vztahu xx xxxxxxx xxxxxxxx xxxxx xxxx xxxxxxxxx xxxxxx. X&xxxx;xxxxxxxxxx xx xxxxxxxxxxxx doplňkové xxxxx xxxxx být měření xxxxxxxx xx pracovních xxxxxxxxxxxxxxxxx (např. produkční xxxxxxxx, xxxxxxxx xxxxx xxxxxxxxx, xxxxxx xxxxxxxxxxx xxxxxxxx), xxxxxxx xxxxxxx xxxxxxxxxx xxxx, užitkovosti xxxxx, xxxxxxxxxxxxx xxxxxxxxxxx xxxx dobrých životních xxxxxxxxxx xxxxxx. Xxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx měřícími xxxxxxxxx xxxxxxxx. |
|
2. |
Xxxxxxxxx xxxxx, xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx výroby xxx xxxxxxx prostředí. U doplňkových xxxxx, xxxxx xxxxxxxx ovlivňují xxxxxxx prostředí (xxxx. xxxxxxx xxxxxxx xxxxxx xxxx fosforu xxxx xxxxxxx xxxxxxxx metanu, xxxxxxxxx xxxxxxxx), je xxxxx účinnost x&xxxx;xxxxxxxx xxxxx xxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxx účinnosti xx xxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx účinky. Xxxxxx vezmou x&xxxx;xxxxx xxxxxxx xxxxxxxxxxxx se xxxxxxxxx látce. |
4.2.5 Oddíl V: Plán monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx xxxxx xx xxxxxxx xxxxx xxxxxxxxxx xx.&xxxx;7 xxxx.&xxxx;3 písm. g) nařízení (ES) x.&xxxx;1831/2003.
5.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXXXXX X&xxxx;XXXXXXXXXXXXXXXX
5.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx oddíl I přílohy II.
5.2 Oddíl II: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx užití xxxxxxxxx xxxxx; xxxxxx analýzy
Použije xx celý xxxxx&xxxx;XX xxxxxxx&xxxx;XX.
5.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxxxx xxxxx
5.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx používání doplňkové xxxxx xxx xxxxxx xxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.1 xxxxxxx&xxxx;XX.
5.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx xxxxx pro xxxxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.2 xxxxxxx&xxxx;XX.
5.3.3&xxxx;&xxxx;&xxxx;Xxxxxx týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
5.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky pro xxxxxxx xxxxxxxxx
Xxxxxxx xx xxxx xxx&xxxx;3.4 přílohy II.
5.4 Oddíl IV: Xxxxxx xxxxxxxx xx xxxxxxxxx doplňkové látky
Tyto xxxxxxxxx xxxxx xxxxxx xxxxxxx před xxxxxxxx xxxxxx Xxxxxxx xxx. xxxx Xxxxxxxxxx meleagridis. Xxxxxx xx xxxxxxxx xxxxxxx o zvláštních xxxxxxxx xxxxxxxxx xxxxx (xxxx. xxxxxxxxxxxx xxxx) x&xxxx;xxxxxx xxxxxxxxxxxxxxx xxxxxxxxxxxx (xxxx. xxxxxxx morbidity, xxxxxxxxx, xxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xxxx). Xxxxxxxxx xx předloží informace x&xxxx;xxxxxx xx růst x&xxxx;xxxxxxxx krmiva (výkrm xxxxxxx, xxxxxxx nosnic x&xxxx;xxxxxxx), xxxxxxxx xx xxxxxxx xxxxx (plemenná xxxxxx).
Xxxxxxxxxx xxxxx o účinnosti xxxx odvozeny ze xxx typů pokusů x&xxxx;xxxxxxxx zvířaty:
|
— |
umělé xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, |
|
— |
xxxxxxxxx/xxxxx xxxxxxx x&xxxx;xxxxx xxxxxxxxx xxxxxxxx xxx užití, |
|
— |
skutečné xxxxxxxx xxx xxxxx při xxxxxxxxx x&xxxx;xxxxxx. |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx infekcemi (xxxx. klecový xxxx xxxxxxx) mají xxxxxxxx xxxxxxxxx xxxxxxxx proti xxxxxxxxx x&xxxx;xxxxxxxxxx replikaci. Xxx průkazné výsledky xx xxxxxxxx pro xxxxxx simulující podmínky xxx xxxxx (např. xxxxxx xxx xxxxxx xxxxxxxx x&xxxx;xxxxxxx, studie xxx xxxxxxxx xxxxx x&xxxx;xxxxxxx). Xxxxxxxx xx xxxxxx xxx studie x&xxxx;xxxxxx x&xxxx;xxxxxxx mírou xxxxxxxxx xxxxxxx.
5.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx xxxxxxx&xxxx;XX xx xxxxxxx xxxxx ustanovení čl. 7 xxxx.&xxxx;3 písm. g) nařízení (XX) x.&xxxx;1831/2003.
6.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX X&xxxx;XXXXXXXXXXX DRUHŮ XX XXXXX XXXXXXXXX
Xxxxxxxxx xxxxx jsou xxxxxxxx x&xxxx;xx.&xxxx;1 xxxx.&xxxx;2 xxxxxx xxxxxxxx.
X&xxxx;xxxxxx xx xxxxxxxxx xxxxxxxxxx xxxxx pro xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx srovnatelný x&xxxx;xxxxxx, xxx nějž xxx xxxx xxxxx xxxxxxxxx xxxxx povoleno, xx xxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxx.
Xxxx uvedené xxxxxxxxx xx xxxxxxxx xxxxx xx xxxxxxxxxx povolení xxx xxxxxxxxx xxxxx x&xxxx;xxxxxxx xx xxxxxxxxx xxxxx, xxxxx již xxxx xxxxxxxx pro xxxxx xxxxxxxxx. Pro xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxx xxx xxxxxxxxx xxxxx xx použijí xxxx xxxxxxx xxxxxx x&xxxx;xxxxxxxxxx xx xxxxxxxxx/xxxxxxx xxxxxxx xxxxxxxxx látky (viz xxxxxxxxxxxx xxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX).
6.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx oddíl I přílohy II.
6.2 Oddíl II: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx analýzy
Oddíl II přílohy II xx xxxxxxx takto:
|
— |
pro xxxxxxxxx xxxxx, xxxxx xxxx xxxxxx xx xxxxxxxx xxxxxxxx, xx xxxxxxx xxxx oddíl II, |
|
— |
pro xxxx doplňkové xxxxx xx použijí body 2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
6.3 Oddíl III: Xxxxxx xxxxxxxx se bezpečnosti xxxxxxxxx xxxxxxxxx látky
6.3.1 Studie xxxxxxxx xx bezpečnosti xxxxxxxxx doplňkové xxxxx xxx xxxxxx xxxxxxx
|
6.3.1.1 |
Xxxxxxxxx x&xxxx;xxxxxxxx xxxxx Xxxxx požadavky xxx xxxxxxxxxx xxxxxxxxx / xxxxxxx xxxxxxx xxxxxxxxxxx xxxxx. X&xxxx;xxxxxx se xxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx xxxxxxxxxx, xxxxx xxxxxxxxx látka vykazuje xxxxxx xxxxxxx pro xxxxxxxxxx (xxxxxxx koeficient 10) u příslušného většinového xxxxx, xxxxx je x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxx. Xxxxx xxx xxxxxxxxx xxxxxx xxxxx (včetně monogastrických x&xxxx;xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx) xxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx xxx bezpečnost, xxxxxxxxxx xx xxxxx xxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxx, xxxxx xxxxxx z fyziologického hlediska xxxxxxx (xxxx. xxxx xxxx králíci). Pokud xx požaduje studie xxxxxxxxx, doba trvání xxxxxx xxx xxxxxxxxx xxxxx (xxxxx králíků) xxxx xxxxxxx 28&xxxx;xxx xxx xxxxxxx x&xxxx;xxxxx x&xxxx;42&xxxx;xxx xxx xxxxxxx xxxxxxx. U králíků xxxxx xxxx xxxx xxxxxx: xxxxx králíků: 28&xxxx;xxx; xxxxxx xxxxxxx: xxxxx xxxxxx (xx xxxxxxxxxx xx xxxxx xxxx xxxxxxx). Xxxxx se xxxxxx xxxxxxxx xx xxxxxx x&xxxx;xxxxxxxxx xxxxxxx, xxxxxxxx se xx xxxxxxxxxx xxxxxx 49&xxxx;xxx (xxxxxxxx jeden xxxxx xx narození) a musí xxxxxxxxx xxxxxxx xx xx xxxxxxx. Xxx xxxx (jiné než xxxxxxxxxx) se xxxxxxxx 90xxxxx xxxxxx. |
6.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx bezpečnosti xxxxxxxxx xxxxxxxxx látky xxx xxxxxxx jako xxxxxxxxxxxx
|
6.3.2.1 |
Xxxxxx xxxxxxxxxxx Xxxxx xxxxxxxxx xxx xxxxxxxxxx kategorie x&xxxx;xxxxxxx xxxxxxx xxxxxxxxxxx látek. Studie xxxxxxxxxxx se xxxxxxxxxx, xx-xx xxxxxxxxx látka xxx xxxxxxxx xxx xxxxx x&xxxx;xxxxx, který xx x&xxxx;xxxxxxxxxxxxxx hlediska xxxxxxxxxxx s menšinovými xxxxx, xx něž xx xxxxxxxx xxxxxx x&xxxx;xxxxxxxx. Xxxxxxxx xxxxxxxxx z fyziologického xxxxxxxx neexistuje, xxxxxxxx xx xxx posouzení xxxxxxxxxx xxxxxxxxxxx xx xxxxxxxxxx porovnání metabolického xxxxxxx na xxxxxxx xxxxxx xx xxxxx (xxxx. s hepatocyty xxxxxx xxxxxxx xxxxx). Xxxx-xx xxxxxxxxx xxxx z fyziologického xxxxxxxx xxxxxxx xxxxxxxxxxx druhu, xx xxxxx xxxxxx xxxxx o metabolismu xxxxxxxxx xxxxx u menšinového druhu. |
|
6.3.2.2 |
Studie xxxxxxx Xx-xx udávána xxxx xxxxxxxxx podobnost xxxxxxxxxxx, xxxxxxxx xx xxxxx xxxxxxxxxxxx indikátorového xxxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxx a produktech. Xx xxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxx xxxx bod 3.2.1.2 xxxxxxx&xxxx;XX. |
|
6.3.2.3 |
Xxxxxxxxx xxxxxxxxxxx pro xxxxxxxxxxxx Xxxxx xxxxxxxxxxx xxxxxx xxxxxxx (XXX) Xxxxxxxxx MLR xxx xxxxxxx za předpokladu, xx xx x&xxxx;xxxxxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx xxxxxx nevyskytují žádné xxxxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx. XXX lze xxxxxxxxxxxx x&xxxx;xxxxx tříd zvířat xxxxx:
XXX pro koně xxx xxxxxxxxxxxx, xxxxx xxxxxxxx XXX pro xxxxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxx. Xxxxx xxxx xxxxxxxx identické MLR x&xxxx;xxxxx (xxxx xxxx), xxxxxx x&xxxx;xxxxx (xxxx xxxxxxx), xxxxx představují xxxxxxxxx xxxxx x&xxxx;xxxxxxx xxxxxxxxxxxxx xxxxxxxxxxx a složením xxxxx, xx možno xxxxxxxx xxxxxx XXX xxxxxx xxx ovce, xxxxxxxx x&xxxx;xxxxxxx, xxx xxxxxxx, že se xxxxxxxx xx xxxxxx xxxxxxxxxxx xx všechna xxxxxxx, xxxxx xxxx xxxxxx k produkci xxxxxxxx, x&xxxx;xxxxxxxx xxx. X&xxxx;xxxxxxx xx xxxxx Xxxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxxxx (XXXX)&xxxx;(10) xxx xxxxxxxxx XXX pro Xxxxxxxxxx x&xxxx;xxxxxxx xxxx, xxxxx xxx xxxxxxxx xxxxxxxxxxx x&xxxx;XXX xx xxxxx xxxxxxxxxxx xxxxx xx Xxxxxxxxxx x&xxxx;xxxxxxx xxxx xx předpokladu, xx výchozí xxxxx xxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xxxxxxxx pro XXX ve xxxxx x&xxxx;xxxx, lze XXX xxxxxxxxxxxx na všechna xxxxxxx xxxxxx x&xxxx;xxxxxxxx xxxxxxxx. Xxxx x&xxxx;xxxxxxxxx xxxxxxxxxx xxxxxx pro xxxxxxxxxxxx xxxxxxx v poživatelných xxxxxxx x&xxxx;xxxxxxxxxx xxxxx xxxxxx xxxxxxxx x&xxxx;xxxxxxxx xxxxxxxx. |
6.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx xxx uživatele/pracovníky
Použije xx xxxx xxx&xxxx;3.3 přílohy II.
6.3.4 Studie xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx životní xxxxxxxxx
Xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx xxx extrapolovat x&xxxx;xxxxxxxxx provedeného xxx xxxxxxxxx druh, který xx z fyziologického xxxxxxxx xxxxxxxxxxx. Xxx xxxxxxxxx xxxxx, xxxxx xxxx xxx xxxxxxxxx x&xxxx;xxxxxxx, xx použije xxxx xxxxx s přihlédnutím x&xxxx;xxxxxxxxxx xxx xxxxxx xxxxxxxxx / xxxxxxx skupinu xxxxxxxxxxx xxxxx.
6.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx se xxxxxxxxx xxxxxxxxx látky
Pokud xxxxxxxxx xxxxx xxxx pro xxxxxxx xxxxxx povolena xxx většinový xxxx, xxxxx je z fyziologického xxxxxxxx xxxxxxxxxxx, a pokud xx znám xxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx, xx xxxxx považovat xx xxxxxxxx xxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx. Pokud xxxxxxxx xxxxxxxxx neexistuje, xx xxxxx xxxxxxxx xxxxxxxx podle xxxxxxxx xxxxxxxx xxx xxxxx&xxxx;XX x&xxxx;xxxxxxx&xxxx;XX. X&xxxx;xxxxxxxxx xxxxxxxxx xxxx být vhodné xxxxxxxxxx xxxxx zvířat xx xxxxxx produktivní xxxx (xxxx. xxxx x&xxxx;xxxx xxxxxxxxx x&xxxx;xxxxxxxx xxxxx). V každé xxxxxx (X&xxxx;≤ 0,1) nebo xxxxxx xxxxxxxxxxx (X&xxxx;≤ 0,05), xx-xx to xxxxx, by měla xxx prokázána významnost.
Požaduje-li xx xxxxxxxxx xxxxxxxxx, xxxx xxxxxx xxxxxx xxxxxxxxx odpovídá xxxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxx xxxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxxxxxx. X&xxxx;xxxxxxxxx případech minimální xxxx xxxxxx studie xxxxxxx xxxxxxxxx ustanovení x&xxxx;xxxx&xxxx;4.4 xxxxxxx&xxxx;XX a přílohy IV.
6.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx xxxxxxx&xxxx;XX xx použije xxxxx xxxxxxxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
7.&xxxx;&xxxx;&xxxx;XXXXXXX X&xxxx;XXXXXXXX XXXXX X&xxxx;XXXXXXX XXXXXXX, XXXXX XXXXXX XXXXXX X&xxxx;XXXXXXXX POTRAVIN
Zvířata x&xxxx;xxxxxxxx chovu x&xxxx;xxxxxxx xxxxxxx, xxxxx nejsou xxxxxx x&xxxx;xxxxxxxx xxxxxxxx, xxxx xxxxxxxx x&xxxx;xx.&xxxx;1 xxxx.&xxxx;1 xxxxxx xxxxxxxx.
7.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx celý xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
7.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, charakteristika x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX se xxxxxxx xxxxx:
|
— |
xxx doplňkové xxxxx, xxxxx xxxx xxxxxx na držitele xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx látky xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2., 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
7.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx xx xxxxxxxxxxx doplňkové xxxxx
7.3.1&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx pro xxxxxx xxxxxxx
Xxxxx xxxxxxxxx xxx xxxxxxxxxx kategorie / xxxxxxx xxxxxxx doplňkových xxxxx. Xxxxxxxx-xx xx xxxxxx xxxxxxxxx, xxxx xxxx trvání xxxx xxxxxxx 28&xxxx;xxx.
Xxxxxx xxxxxxxxx xx xxxxxxxxxx, pokud xxxxxxxxx xxxxx xxxxxxxx xxxxxxxxxxx a široké rozpětí xxx xxxxxxxxxx x&xxxx;xxxxx xxxxxxxxxxx xxxxx (xxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxx x&xxxx;xxxxxxx).
7.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxxxxx
Xxxxx xxx se xxxxxxx xxxxxxxxxx. Xxxxxxxxx se xxxxxx bezpečnosti xxxxxxxx.
7.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx uživatele/pracovníky
Použije xx xxxx xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
7.3.4&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxx xxxxxxxxx
Xxx&xxxx;3.4 xxxxxxx&xxxx;XX xx xxxxxxxxxx.
7.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx týkající xx xxxxxxxxx doplňkové xxxxx
Xxxxx xxxxxxxxx pro jednotlivé xxxxxxxxx / funkční xxxxxxx xxxxxxxxxxx látek.
Jestliže xxxxxxxxx látka, xxx xxx xx požadují xxxxxx xx zvířatech, xxx xxxx předem xxxxxxxx xxx xxxx, xxxxx xx x&xxxx;xxxxxxxxxxxxxx xxxxxxxx xxxxxxx, xxxxxxxxxx xx další prokázání xxxxxxxxx, xxxx-xx xxxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxxx. Xxxxx xxxxxxxxx xxxxx xxxxxx xxxxx xxxxxxxx nebo požadovaný xxxxxx xx xxxxxxxxxxx xxxxxxxx jsou jiné xxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxx, je nutno xxxxxxxx xxxxxxxx xxxxx xxxxxxxx pravidel pro xxxxx&xxxx;XX x&xxxx;xxxxxxx&xxxx;XX.
Xxxx xxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxx 28&xxxx;xxx.
7.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx
Xxxxx oddíl přílohy II xx xxxxxxx podle xxxxxxxxxx xx.&xxxx;7 odst. 3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;1831/2003.
8.&xxxx;&xxxx;&xxxx;XXXXXXXXX XXXXX, XXXXX XXX XXXX XXXXXXXX XXX XXXXX X&xxxx;XXXXXXXXXXX
8.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx celý oddíl I přílohy II.
8.2 Oddíl II: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, xxxxx xxxx vázané xx xxxxxxxx xxxxxxxx, xx použije xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx xxxxx se xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2., 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
8.3 Oddíl III: Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxxxx látek
Musí xxx xxxxxxx nejnovější xxxxxxxx posouzení xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxxxxxxxx následně xxxxxxxxx xxxxx.
Xxx doplňkové xxxxx, které jsou xxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxx látky nebo xxxxxxxxx x&xxxx;Xxxxxxxx xxxx xxxx složky xxxxxxxx xxx xxxxxxxxxxx xxxxxxx, xxxxxx xxxxxx xxxxxxxx xx xxxxxxxxxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxxxxx obvykle xxxxx.
Xxxxxx se body 3.1, 3.2 x&xxxx;3.3 přílohy II xx xxxxxxxx na xxxxxxxxx poznatky o bezpečnosti xxxxxx xxxxx, xxxxx xxxx používány x&xxxx;xxxxxxxxxxx. Xxxxxxxx látky, které xxxx xxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxx, lze xxxxxxxxxxxx xxxx:
|
— |
x&xxxx;xxxxxxxxxxxxxxxx XXX (bez xxxxxxxxxx xxxxxxx horního xxxxxx xxxxxx pro xxxxx s velmi xxxxxx xxxxxxxxx), |
|
— |
xx stanovenou ADI xxxx XX xxxx |
|
— |
x&xxxx;xxxxxxxxxxxx XXX (xxx látky, x&xxxx;xxxxx xxxxxxxx údaje xxxxxxxxxxx xx xxxxxxxx xxxxxx bezpečnosti). |
8.3.1 Studie týkající xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxx zvířata
Je-li xxxxx xxxxx xxxxxxxxx xxxxx xxxxxxx xxxx v případě xxxxxxxx, xxx xxxxxxxxxx xxx xxxxxx xxxxx xxxxxxxx na xxxxxxx xxxxxxxxxx toxikologických xxxxx xx xxxxxxx xx xxxx x&xxxx;xxxxxxxxxxxx k chemické xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx. Je-li xxxxx užití v krmivech xxxxxxxx xxxxx xxx xxxxxxxxxxxx užití v potravinách, xxxx xxx xxxxx xxxxxx xxxxx xxxxx xxxxxx tolerance x&xxxx;xxxxxxxx xxxxxxx.
8.3.2&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx doplňkové xxxxx pro xxxxxxxxxxxx
Xxxxx xxxxx xxxx xxxxxxxxx xxxxx xxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxxxx xxxx x&xxxx;xxxxxx druhu xxxxxxxxxx xxx x&xxxx;xxxxxxx xxxxx x&xxxx;xxxxxxxxxxx, budou xxxxxxxxxx xxxxx toxikologické xxxxx x&xxxx;xxxxx x&xxxx;xxxxxxxxx.
|
8.3.2.1 |
Xxx xxxxxxxxx xxxxx, xxx xxx xxxx specifikována XXX Xxxxxxxxx xxxxxxxxxxx pro xxxxxxxxxxxx xx nepožaduje xxxxx xxxxxxx, xxx xxxxx xxxxxxxxx xxxxx x&xxxx;xxxxxxxx xxxx x&xxxx;xxxxxxxxx xxxxx xxxxxxxxxx xxx xxx xxxxx x&xxxx;xxxxxxxxxxx. |
|
8.3.2.2 |
Xxxxxxxxx látky xx stanovenou XXX xxxx XX Xxxxxxxxxx xxx xxxxxxxxxxxx xx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxx vyplývající z užití x&xxxx;xxxxxxxx xxxx xxxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx s metabolity xxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxx. Xx lze provést xxxxxxxxxxx xxxxx o reziduích x&xxxx;xxxxxxxxxx. Xxxx-xx nezbytné studie xxxxxxx, xxxxxxxxx xx xxxxxx na xxxxxxxx xxxxxx v tkáních nebo xxxxxxxxxx u neošetřené skupiny x&xxxx;xxxxxxx, xxx xxxx xxxxxxxx xxxxxxxx xxxxxxx xxxxx. |
|
8.3.2.3 |
Xxxxxxxxxxxxx přídatné látky, xxx xxx nebyla XXX stanovena Je xxxxx xxxxxxxxxxx xxxxx důvody, xxxx xxxxxx XXX xxxxxxxxx. Xxxxx xx xxxxxxxx xxxxx x&xxxx;xxxxx xxxxxxxxx xxxxx v krmivech xx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx, xxxxxxxx xx xxxxx xxxxxxxxxxxxx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxxxxxx z užití x&xxxx;xxxxxxxx xxx xxxxxxxxxxxx z údajů x&xxxx;xxxxxxxxx x&xxxx;xxxxxxxxxx. Xxxx-xx nezbytné xxxxxx reziduí, požadavek xx omezen xx xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxx xxxxxxxxxx u neošetřené xxxxxxx x&xxxx;xxxxxxx, xxx xxxx podávána xxxxxxxx xxxxxxx xxxxx. |
8.3.3&xxxx;&xxxx;&xxxx;Xxxxxx xxxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxxxx látky pro xxxxxxxxx/xxxxxxxxxx
Xxxxxxx xx celý xxx&xxxx;3.3 xxxxxxx&xxxx;XX.
Xxx posuzování xxxxxxxxxxx xxxxxxxxx xxxxx xxx xxxxxxxxx se xxxxxx v úvahu bezpečnostní xxxxxxxx xxxxxxxxx xxx xxxxxxxxxx s těmito látkami xxxxxxxxxxx v potravinách.
8.3.4 Studie xxxxxxxx xx xxxxxxxxxxx používání xxxxxxxxx látky pro xxxxxxx xxxxxxxxx
Xxxxxxxx xx xxx&xxxx;3.4 xxxxxxx&xxxx;XX.
8.4&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxx xxxxxxxx xx účinnosti xxxxxxxxx látky
Jestliže xx xxxxxx xxxxxxxxxx xxx xxxxxx xxxxxx xxxx xxx xxxxx x&xxxx;xxxxxxxxxxx, xxxxxx xxx xxxxx xxxxx xxxxxxxxx xxxxxxxxx. X&xxxx;xxxxxxx xxxxxxx xxxxx xxxxxxxxx na xxxxxxxx xxxxxxx x&xxxx;xxxxxx&xxxx;XX xxxxxxx&xxxx;XX.
8.5&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx
Xxxxx xxxxx xxxxxxx&xxxx;XX xx xxxxxxx xxxxx xxxxxxxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
9. ZMĚNA XXXXXXXX
Xxxxxxx xx xxxxx xxxxxx xxxxxxxxx údajů xxxxxxxxxxxx xxx xxxxxxxxx xxxxxxxx, musí dokumentace xxxxxxxxxx xxx žádost xxxxx xx.&xxxx;13 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003 xxxxxxxx xxxxx xxxx xxxxxxx xxxxxxxxx.
Xxxxxx x&xxxx;xxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxxx, xxxx. xxxxxxxxxxxx, xxxxxxxxxxxxxxx nebo xxxxxxxx pro xxxxx xxxxxxxxx látky, xxxx xxxxxxxx, že xxxxx xxxx xxxxx xxxxxxxx xxxxxx pro cílový xxxx, spotřebitele, xxxxxxxxx xxxx xxxxxxx xxxxxxxxx. Xx tímto účelem xx xxxxx doplňkovou xxxxx xxxxxxxxx xx xxxxxxxx, xxxxx xxxxxx xxxxx(x)&xxxx;xxxx xxxxxxx(x)&xxxx;x&xxxx;xxxxxxxx xxx xxxxx xxxx stejné, xxxx čistota xx x&xxxx;xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxxx žádné xxxx xxxxxx, xxxxx xx xxxxxxxxxx xxxxx. Xxx xxxxxxxx xxxxxxxx xx xxxxx xxxxx xxxxxxxxx xxxxxx, jelikož obvykle xxxxxx xxxxx opakovat xxxxxx k prokázání xxxxxxxxxxx xxx xxxxxx xxxx, xxxxxxxxxxxx a životní xxxxxxxxx x&xxxx;xxxxxxxxx.
Xxxxxx xxxx splňovat xxxx požadavky:
|
1. |
použije se xxxx příloha I – xx xxxxxxxx údaje o požadované xxxxx; |
|
2. |
xxxxxxx xx xxxx xxxxx&xxxx;XX přílohy II; |
|
3. |
je nutno xxxxxxxxxx xxxxx, xxxxx xxxxxxxxx, xx xxxxxxxx xxxx biologické xxxxxxxxxx xxxxxxxxx látky xxxx x&xxxx;xxxxxx stejné xxxx x&xxxx;xxxxxxx produktu; |
|
4. |
popřípadě xx xxxxx xxxxxxxxx xxxxxx x&xxxx;xxxxxxxxxxxxxx, x&xxxx;xx na xxxxxxx xxxxxxxxxxx, xxxxxxxxxx xxxxxxxxxx xxxx xxxxxxxxxx xxxxxx. Není-li xxxxxxxxxxxxxx xxxx xxxxxxxxx, xx xxxxx xxxxxxxx shodu xxxxxxxx xxxxx s MLR; |
|
5. |
je xxxxx předložit xxxxx, xx xx xxxxxxxxxx xxxxxxxxx poznatků xxxxxxx xxxxxxxxx látka za xxxxxxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxx xxxxx, xxxxxxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx; |
|
6. |
xx xxxxx předložit xxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx xxxxx xx xxx, xxxx-xx takovéto požadavky xx xxxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxxx; x |
|
7. |
xx xxxxx xxxxxxxxx xxxxxxxx údaje x&xxxx;xxxxxxxx žádosti x&xxxx;xxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxxx&xxxx;XXX, XX a V přílohy II. |
10. OBNOVENÍ XXXXXXXX
Xxxxxxx o obnovení povolení xxxxx článku 14 xxxxxxxx (XX) č. 1831/2003 splňují xxxx xxxxxxxxx:
10.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx xx xxxx oddíl I přílohy II. Xxxxxxxx xx xxxxx xxxxxxxxx xxxxxxxx Společenství x&xxxx;xxxxxxx xxxxxxxxx xxxxx xx xxx nebo xxxxxxxx obnovení xxxxxxx. Xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx xx xxxxxx x&xxxx;xxxxxxxx xxxxx xxxx oproti xxxxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxxx povolení. Žadatel xxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx, xxxxx přiblíží xxxxxx žádosti, a případné xxxx informace, které xx xxxxx dostupnými xx doby xxxxxxx xxxxxxxxxxx xxxxxxxx/xxxxxxxx povolení x&xxxx;xxxxxxx xx xxxxxxxx x&xxxx;xxxxxxxxxx.
10.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, charakteristika x&xxxx;xxxxxxxx xxx xxxxx xxxxxxxxx látky; metody xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx xxxxxxx takto:
|
— |
pro doplňkové xxxxx, které jsou xxxxxx xx držitele xxxxxxxx, se použije xxxx xxxxx&xxxx;XX, |
|
— |
xxx xxxx xxxxxxxxx látky xx xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6. |
Xx xxxxx xxxxxxxxx xxxxxx, xxxxx xxxxxxxxx, xx xx xxxxxxxxx xxxxx významně xxxxxxxxx, xxxxx jde x&xxxx;xxxxxxx, xxxxxxx nebo aktivitu, xxxxxx xxxxxxxx xxxxxxxxx xxxxx. Xx xxxxx xxxxxxx xxxxxxxxxx změnu xxxxxxxxx xxxxxxx.
10.3&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XXX: Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxxxx látek
Musí xxx xxxxxxxxx xxxxx, xx xx xxxxxxxxxx xxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxx za xxxxxxxxxxx xxxxxxxx xxxxxxxx pro xxxxxx xxxx, xxxxxxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxx prostředí. Xxxx xxx předložena xxxxxxxxxxxxx xxxxxxxxxxx o bezpečnosti xx xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx xxxx od posledního xxxxxxxx xxxxxxxx, která xxxxxxxx xxxxxxxxxxx informace:
|
— |
zprávy x&xxxx;xxxxxxxxxxx xxxxxxxx, včetně xxxxxxxxxx xxxx (xxxxx xxxxxxx xxxxxx, xxxxxxx xxxxxx xxxxx druhu, xxxxxxx xxxxxx známých xxxxxx) x&xxxx;xxxxxxxx xxxxxx, xxxxxxxxxxxx, xxxxxxxxx x&xxxx;x&xxxx;xxxxxxxx xxxxxxxxx. Zpráva x&xxxx;xxxxxxxxxxx xxxxxxxx musí uvádět xxxxxx xxxxxx, xxxxx xxxxxxxxxxx osob/zvířat, xxxxxxxx, xxxxxxxx xxx xxxxx x&xxxx;xxxxxxxxx příčinné souvislosti, |
|
— |
zprávy x&xxxx;xxxxx xxxxxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxxxxx, |
|
— |
xxxxx x&xxxx;xxxxxxxxxxxx xxxxxxx, xx-xx xx xxxxx, |
|
— |
xxxxx x&xxxx;xxxxxxxxxxxxxxxxx/xxxxxxxxxxxxxxxxx x/xxxx xxxxxxxxxxxxxxx xxxxxx, |
|
— |
xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx se xxxxxxxxxxx doplňkové xxxxx x&xxxx;xxxxx doplňkové látky xxx zvířata, xxxxxxx x&xxxx;xxxxxxx prostředí. |
Pokud xxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx xxxxxxx, xxxx to xxx přesně odůvodněno.
Zpráva x&xxxx;xxxxxxxxxx xxxxxxxx monitorování x&xxxx;xxxxxx xx xxxxxxx xxxxx na xxx xx předloží, xx-xx xxxxxxxx požadavek xx xxxxxxxxxxxx xxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx.
Xxxxx podle xxxxxxxxxx xx.&xxxx;14 xxxx.&xxxx;2 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003 žádost x&xxxx;xxxxxxxx povolení xxxxxxxx xxxxx xx změnu xxxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxx, xxxx xxxx xxxxxxxx xxxxxxxxxx xx budoucího monitorování, xx xxxxx xxxxxxxxx xxxxxxxx xxxxx xx xxxxxxx xxxxxx xx xxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xxxxxx&xxxx;XXX, IV x&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
11.&xxxx;&xxxx;&xxxx;XXXXXXXXXXXX XXXXXXXXX XXXXXXXXXXX XXXXX, XXXXX XXX XXXX XXXXXXXX XXXXX XXXXXXXX 70/524/XXX
Xxxxxxxxxxx xxxxxxx, xxxxx xx xxxx xxxxx xxx&xxxx;11, xxxx xxxxxxxxx xxxxx, které xxx xxxx xxxxxxxx xxxxx směrnice 70/524/EHS x&xxxx;xxxx xxx xxxxxxxxxxxx x&xxxx;xxxxxxx x&xxxx;xx.&xxxx;10 xxxx.&xxxx;2 xxxxxxxx (ES) č. 1831/2003 x&xxxx;xxxxx xxxxx xx xxxxxx skupin:
|
— |
antioxidační xxxxx, |
|
— |
xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxx, |
|
— |
xxxxxxxxxx x&xxxx;xxxxxxxxxxxxx, xxxxxxxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxx, |
|
— |
xxxxxxx, xxxxxx pigmentů, |
|
— |
konzervanty, |
|
— |
vitamíny, xxxxxxxxxxx a chemicky přesně xxxxxxxxxx xxxxx se xxxxxxxxxxxx xxxxxxx, |
|
— |
xxxxxxx xxxxx, |
|
— |
xxxxxx, xxxxxxxxxxxx xxxxx a koagulanty; |
|
— |
regulátory xxxxxxxxx x |
|
— |
xxxxxxxxxxxxx xxxxxx. |
Xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx rizik x&xxxx;xxxxxx xxxxxxxxxxx xxxxx xxxx xxx xxxxxxx xxxx x&xxxx;xxxxxx xxxxxxxxxxx xxxxx. Avšak xxxxxxxx x&xxxx;xxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxx xx xxxxx xxxxxx údaje x&xxxx;xxx xxxxxxxxxxxx studií xxxxx xxxxxxxxxx xxxxxx xxxxxxxx, xxx bylo xxxxxxxxx, xx xx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxxx xxx xxxxxx xxxxx, xxxxxxxxxxxx, xxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx.
11.1&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;X:&xxxx;Xxxxxxx xxxxxxxxxxx
Xxxxxxx se xxxx xxxxx&xxxx;X&xxxx;xxxxxxx&xxxx;XX.
11.2&xxxx;&xxxx;&xxxx;Xxxxx&xxxx;XX: Xxxxxxxx, xxxxxxxxxxxxxxx x&xxxx;xxxxxxxx pro xxxxx xxxxxxxxx látky; xxxxxx xxxxxxx
Xxxxx&xxxx;XX xxxxxxx&xxxx;XX xx použije xxxxx:
|
— |
xxx xxxxxxxxx xxxxx, které xxxxxx xxxxxx xx xxxxxxxx xxxxxxxx, se xxxxxxx xxxx&xxxx;2.1.2, 2.1.3, 2.1.4, 2.1.4.2, 2.2, 2.3.1, 2.3.2, 2.4.1, 2.4.2, 2.4.4, 2.5, 2.6, |
|
— |
xxx jiné xxxxxxxxx xxxxx, xxxxx jsou xxxxxx na držitele xxxxxxxx, se xxxxxxx xxxx oddíl II. |
11.3 Oddíl III: Xxxxxx xxxxxxxx se xxxxxxxxxxx xxxxxxxxxxx látek
Pokud xxxx xxxxxxxxx xxxxx xxxxxxxxx x&xxxx;xxxxxxx xx bezpečnost xxx xxxxxx xxxxx, xxxxxxxxxxxx, xxxxxxxxx/xxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxx, předloží xx xxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxxxx xxx předchozí xxxxxxxx x&xxxx;xxxxxxxx nové xxxxxxxxx, které xxxx xxxxxxx xx xxxx xxxxxxx předchozího xxxxxxxx. Xxxxx nebylo formální xxxxxxxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxx xxxx xxxxxxxxx xxxxx, xxx použít studie x&xxxx;xxxxx z vědecké literatury, xxxxxxxx jsou xxxxxxxxxx xxxxxx, xxxxx xx xx xxxxxxxxxx x&xxxx;xxxx xxxxxxx. X&xxxx;xxxxxxx xxxxxxx xx xxxxxxxx xxxxx xxxxxx studií bezpečnosti.
11.4 Oddíl IV: Xxxxxx xxxxxxxx xx xxxxxxxxx xxxxxxxxx látky
Shodu x&xxxx;xxxxxxxxx xx xxxxxxxx xxxxx xx.&xxxx;5 xxxx.&xxxx;3 xxxxxxxx (XX) x.&xxxx;1831/2003 xx xxxxx popřípadě xxxxxxxx předložením xxxxxx xxxxxxxxx xxx xxxxxx, xxxxxxx xxxxxxxxxx se xxxxxx xxxxxxxx používání.
11.5 Oddíl V: Plán xxxxxxxxxxxx x&xxxx;xxxxxx xx xxxxxxx látky xx xxx
Xxxxx oddíl přílohy II xx xxxxxxx xxxxx xxxxxxxxxx čl. 7 xxxx.&xxxx;3 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) č. 1831/2003.
(1) Cizorodá xxxxx xx xxxxxxxx xxxxx, xxxxx není xxxxxxxxxx součástí organismu, xxxx xx xxxx xxxxx xxxxxxxx. Xxxx xxxxxxxxx rovněž xxxxx, xxxxx jsou přítomny x&xxxx;xxxxxx xxxxxxx xxxxxxxxxxxxx, xxx xx xxxxxxx.
(2)&xxxx;&xxxx;Xxx xxxxx tohoto nařízení xx „silážním xxxxxxxx“ xxxxxx xxxxxx, při xxxx xx přirozené xxxxxxxxxxxxxx organické xxxxx xxxxxx xxxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxxx na xxxxxxx xxxxxxxxx xxxxxxxxxx x/xxxx xxxxxxx xxxxxxxxxxx látek x&xxxx;xxxxxxxxxx.
(3)&xxxx;&xxxx;Xxxxxxxxxxxxx číslo xxx xxxxxxxx xxxxxxxxxx zchutňující xxxxx používané ve XXXXXX, xxxxxxxxxxx xxxxxxx XX xxx xxxxxxxxxxx xxxxx, databáze v nařízení Xxxxxx (XX) č. 1565/2000 xx xxx 18. července 2000 (Xx.&xxxx;xxxx. X&xxxx;180, 19.7.2000 s. 8), xxxxxx xx xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx Evropského parlamentu x&xxxx;Xxxx (XX) č. 2232/96 (Xx.&xxxx;xxxx. L 180, 19.7.2000 x.&xxxx;8).
(4)&xxxx;&xxxx;X.&xxxx;Xxxx Evropy: číslo Xxxx Xxxxxx xxxxxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxx určené k aromatizaci xx zprávě Xxxx Xxxxxx x.&xxxx;1 „Xxxxxxx xxxxxxx xx flavourings“, xx.&xxxx;X,&xxxx;Xxxxxxxxx&xxxx;2000 x&xxxx;xxxxxxxxxxxxx svazcích.
(5) Číslo XXX (x.&xxxx;XXX) Registrační xxxxx podle Chemical Xxxxxxxxx Service, xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx látek xxxxx xxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxxxxx látek.
(6) Pro účely xxxxxx xxxxxx nařízení xx „xxxxxxxxxxxxx významnou xxxxxx“ xxxxxx xxxxx x&xxxx;xxxxxxxxxx xxxxxx nebo xxxxxxxx příjmem (XXX xxxx TWI), XXX, xxxx s omezením, xxxxx xxx x&xxxx;xxxx xxxxxxxxx, xxxx xxxxxx složka, xxx xx xxxxxxxxx xx xxxxxxxx Xxxx 88/388/XXX týkající se xxxxx xxxxxxxx x&xxxx;xxxxxxxxxxx xxx xxxxxxx x&xxxx;xxxxxxxxxxx x&xxxx;xxxxxxxxx materiálů pro xxxxxx výrobu, nebo xxxxxxxxx xxxxx.
(7)&xxxx;&xxxx;Xxxxxxxxx x&xxxx;xxxxxxx&xxxx;4 xxxxxx Xxxx Xxxxxx x.&xxxx;1 „Xxxxxxx xxxxxxx xx xxxxxxxxxxx“, sv. I, Štrasburk, 2000.
(8)&xxxx;&xxxx;XXXXX (XXX/XXX, 1996, Xxxx xxxxxxxx series 35, XXXX, XXX Xxxxxx) xxxxxxxxxxxx prahová xxxxxxx xxx xxxxxx xxxxx by xxxx xxx upravena x&xxxx;xxxxxxxxxxxx x&xxxx;xxxxxxxxx xxxxxxx a příjmu xxxxxx.
(9)&xxxx;&xxxx;Xx.&xxxx;xxxx. L 180, 19.7.2000, x.&xxxx;8.
(10)&xxxx;&xxxx;Xxxxx xxx xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxx Salmonidae x&xxxx;xxxxxxx xxxx. Xxxxxxxx xxxxxxxx xxx xxxxxx xxxxxxxxx. Xxxxxxxxxx Medicines Evaluation Xxxx. XXXX/XXXX/153x/97-XXXXX.
XXXXXXX XX
Xxxxxxxxx x xxxxxxxx xxxxxxxx xxxxxx x xxxx x xxxxxxxxx xxxx trvání xxxxxx xxxxxxxxx
1. Xxxxxxx. Kategorie xxxxxx: xxxxxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx zvířat |
Xxxxxxxxx xxxx xxxxxx (hmotnost/stáří) |
Minimální xxxx trvání dlouhodobých xxxxxx účinností |
||
|
Xxxxxx/xxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx (sající) |
Xxxxx xxxxxxx xxxxxx xxxxx xx xxxxxxx |
Xx xxxxxxxx |
Až xx 21–42 xxx |
Až xx 6–11 xx |
14 xxx |
|
Xxxxxx (xxxxxxxxx) |
Mladá xxxxxxx xx skončení xxxxxx xxxx chovaná x xxxxxxxxxx xxxx xxx xxxxxx xxxxxxxx |
Xx 21–42 dní |
Xx xx 120 xxx |
Xx do 35 kg |
42 dní |
|
Selata (xxxxxx a odstavená xxxxxx) |
Xxxxx xxxxxxx xx xxxxxxxx xxxxxxx x xxxxxxxxxx nebo xxx masnou produkci |
Xx xxxxxxxx |
Xx xx 120 xxx |
Xx xx 35 kg |
58 xxx |
|
Xxxxx prasat |
Prasata xx xxxxxxx xxxxxx x xxxxx produkci až xx dne odvozu xx jatky |
Od 60–120 dní |
Xx xx 120–250 xxx (xxxx xxxxx xxxxxxxx xxxxxxxxx) |
80–150 xx (xxxx xxxxx xxxxxxxx xxxxxxxxx) |
Xx do xxxxxxx xxxxxxxxx, xxxxxxx xxxx 70 xxx |
|
Xxxxxxxx xxxxxx x xxxxxxxxxx |
Xxxxxx xxxxxxx, které xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx xxxxxxxxxx |
|
|
Od xxxxxxxxxx xx xxxxx xxxxxxx xxxxxxx vrhu (xxx xxxxx) |
|
Xxxxxxxx určené k reprodukci xxxxx |
Xxxxxx xxxxxxx, xxxxx xxxx xxxxxxx jednou xxxxxxxxxxxx/xxxxxxxxxx |
|
|
|
Xxxxxxx dva týdny xxxx xxxxxxx xx xxxxx xxxx xxxxxxx |
2. Tabulka. Xxxxxxxxx zvířat: drůbež
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx zvířat |
Přibližná xxxx xxxxxx (xxxxxxxx/xxxxx) |
Minimální xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxx xxxxx |
Kuřata určená xxx výkrm |
Od xxxxxxxxx |
Až xx 35 xxx |
Xx xx ~1 600 x (xx xx 2 xx) |
35 xxx |
|
Odchov xxxxx x xxxxxx |
Xxxxxxxx xxxxxxx pro xxxxxxxx xxxxxxxx xxxxx xxxx pro chovné xxxxx |
Xx xxxxxxxxx |
Xx xx ~16 xxxxx (xx do 20 týdnů) |
— |
112 xxx (xxxxxx-xx údaje x xxxxxxxxx x xxxxxxxxx xxx xxxxx xxxxx) |
|
Xxxxxxx |
Xxxxxxx ve xxxxxx xxxxxxx xxx xxxxxxxx xxxxx |
Xx 16–21 xxxxx |
Až xx ~13 xxxxx (xx xx 18 xxxxxx) |
Od 1 200 x (xxxx), 1 400 x (xxxxx) |
168 xxx |
|
Výkrm xxxx |
Xxxxx x xxxxxxx chovaní na xxxxx |
Xx vylíhnutí |
Xx xx ~14 xxxxx (xx xx 20 xxxxx) Až xx ~16 xxxxx (až do 24 xxxxx) |
Xxxxxx: xx xx ~7 000 x (xx xx 10 000 g) Xxxxx: xx xx ~12 000 x (xx do 20 000 g) |
84 dní |
|
Xxxxx xxx xxxxx xxxxxxxxxx |
Xxxxx x xxxxxxx xxxxxxx xxx účely xxxxxxxxxx |
Xxxx xxxxxx |
Xx 30 týdnů xx xx ~ 60 xxxxx |
Xxxxxx: od ~15 000 x Xxxxx: xx ~30 000 x |
Nejméně xxxx xxxxxx |
|
Xxxxxx krůt |
Xxxxx xxxxx a krocani určení x xxxxxxx xxxxxx |
Xx xxxxxxxxx |
Až xx 30 týdnů |
Xxxxxx: xx xx ~15 000 x Xxxxx: xx do ~30 000 g |
Xxxx xxxxxx (xxxxxx-xx údaje x xxxxxxxxx x xxxxxxxxx pro xxxxx xxxx) |
3. Xxxxxxx. Kategorie xxxxxx: xxxx (xxxxxx xxxx, včetně xxxxx xxxxxxx x xxxxx)
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx doba xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Odchov xxxxx |
Xxxxxx xxxxxxx pro xxxxxxxxxx nebo xxxxxxxx xxxxxxxx xxxx |
Xx xxxxxxxx |
Až xx 4 měsíců |
Xx xx 60–80 xx (xx xx 145 xx) |
56 xxx |
|
Xxxxx xxxxx |
Xxxxxx xxx xxxxxxxx xxxxxxxx xxxx |
Xx xxxxxxxx |
Xx xx 6 měsíců |
Xx xx 180 xx (xx do 250 xx) |
Xx xxxxxxx, xxxxxxx xxxx 84 xxx |
|
Xxxxx xxxxx |
Xxxx xx xxxxxxx xxxxxx x xxxxx produkci xx xxx xxxxxx xx xxxxx |
Xx úplného xxxxxxx xxxxxxxxxxxx |
Xx do 10–36 xxxxxx |
Xx xx 350–700 xx |
168 dní |
|
Xxxxxxx pro xxxxxxxx xxxxx |
Xxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxx xxxxx xxxx |
|
|
|
84 dní (xx xxxxx xxxxx xxxx xxxxxx laktace) |
|
Xxxxx x xxxxxxxxxx |
Xxxxxx xxxxx, které xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Od xxxxx xxxxxxxxxx xx xxxxx druhého xxxxxxx |
|
|
Xxx xxxxx (pokud xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
4. Tabulka. Xxxxxxxxx xxxxxx: xxxx
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx dlouhodobých xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx xxxxxx |
Xxxxxxx xxxxxxx xxx xxxxxxx reprodukci |
Xx xxxxxxxx |
Xx xx 3 xxxxxx |
15–20 xx |
56 dní |
|
Xxxxx xxxxxx |
Xxxxxxx xxxxxxx xxx xxxxxxxx xxxxxxxxx xxxx |
Od xxxxxxxx |
Xx xx 6 měsíců (xxxx xxxxxx) |
Xx xx 55 xx |
Xx xxxxxxx hmotnosti, xxxxxxx však 56 xxx |
|
Xxxx xxxxxx x xxxxxxxx mléka |
Ovce, xxxxx xxxxxxxx nejméně xxxxx xxxxx |
|
|
|
84 xxx (xx xxxxx xxxxx xxxx xxxxxx xxxxxxx) |
|
Xxxxxxx x xxxxxxxxxx |
Samice xxxx, xxxxx xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx xxxxxxxxxx do xxxxx druhého xxxxxxx |
|
|
Xxx xxxxx (xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
5. Xxxxxxx. Xxxxxxxxx xxxxxx: kozy
|
Kategorie |
Xxxxxxxx xxxxxxxxx xxxxxx |
Přibližná xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx kůzlat |
Xxxxx kozy xxxxxxx xxx xxxxxxx xxxxxxxxxx |
Xx xxxxxxxx |
Xx do 3 xxxxxx |
15–20 xx |
Xxxxxxx 56 xxx |
|
Xxxxx kůzlat |
Xxxxx xxxx xxxxxxx xxx xxxxxxxx xxxxxx xxxx |
Xx xxxxxxxx |
Xx xx 6 měsíců |
|
Xxxxxxx 56 xxx |
|
Xxxx xxxxxx x xxxxxxxx xxxxx |
Xxxx xxxxxxx x xxxxxx xxxxxxxx |
|
|
|
84 xxx (xx nutno xxxxx xxxx období xxxxxxx) |
|
Xxxx x xxxxxxxxxx |
Xxxxxx xxxx, xxxxx xxxx xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxx xxxxxxxxxx xx konce xxxxxxx xxxxxxx |
|
|
Xxx cykly (xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
6. Xxxxxxx. Xxxxxxxxx xxxxxx: xxxx
|
Xxxxxxxxx |
Definice xxxxxxxxx xxxxxx |
Xxxxxxxxx xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxx x xxxxxx |
|
|
|
200–300 x |
90 xxx xxxx xx xxxx, xxx se xxxxxxx xxxxxxx hmotnost xxxxxxxxxxx |
|
Xxxxx x xxxxxx |
Xxxxx xxxxxxxxx xxx |
Xxxxx xxxxx co xxxxxxxx xxxx tření |
|
|
90 xxx |
7. Xxxxxxx. Xxxxxxxxx xxxxxx: králíci
|
Xxxxxxxxx |
Xxxxxxxx xxxxxxxxx zvířat |
Přibližná xxxx xxxxxx (xxxxxxxx/xxxxx) |
Xxxxxxxxx xxxx xxxxxx xxxxxxxxxxxx studií xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxxxx x xxxxxxxxx xxxxxxx |
|
Xxxxxxxx xx xxxxxxx xxxxx xx xxxxxxxx |
|
|
56 dní |
|
Výkrm králíků |
Králíci xxxxxxx xxx masnou xxxxxxxx |
Xx odstavu |
Xx xx 8–11 xxxxx |
|
42 xxx |
|
Xxxxxx xxxxxxx (xxx xxxxxxxxxx) |
Xxxxxxx, xxxxx byly xxxxxxx xxxxxx xxxxxxxxxxxx/xxxxxxxxxx |
Xx xxxxxxxxxx xx xxxxx xxxxxxx xxxxxxx |
|
|
Dva xxxxx (xxxxx xx xxxxxxxx xxxxxxxxxxx xxxxxxxxx) |
|
Xxxxxx králice xxxxxx x xxxxxxxx mladých xxxxxxx |
Xxxxxxx, xxxxx byly xxxxxxx jednou inseminovány |
Xx xxxxx inseminace |
|
|
Xxxxxxx 2 xxxxx xxxx xxxxxxx xx xxxxx doby xxxxxxx (např. xxx produkt xxxxxxxxxxxxxx) |
8. Xxxxxxx. Xxxxxxxxx zvířat: xxxx
|
Xxxxxxxxx |
Definice xxxxxxxxx xxxxxx |
Přibližná xxxx xxxxxx (xxxxxxxx/xxxxx) |
Minimální xxxx xxxxxx xxxxxxxxxxxx studií xxxxxxxxx |
||
|
Xxxxxx |
Xxxxx |
Xxxxxxxx |
|||
|
Xxxx |
Xxxxxxx kategorie |
|
|
|
56 xxx |


