XXXXXXXX KOMISE (XX) 2015/566
xx xxx 8. xxxxx 2015,
kterou xx xxxxxxx xxxxxxxx 2004/23/XX, xxxxx jde x xxxxxxx xxx ověřování xxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxx
(Xxxx s významem xxx XXX)
EVROPSKÁ KOMISE,
s ohledem xx Smlouvu o fungování Xxxxxxxx xxxx,
s ohledem na xxxxxxxx Xxxxxxxxxx parlamentu x Xxxx 2004/23/ES xx xxx 31. března 2004 x xxxxxxxxx jakostních x xxxxxxxxxxxxxx xxxxx pro xxxxxxxx, odběr, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx x xxxxx (1), a zejména xx xx. 9 xxxx. 4 xxxxxxx xxxxxxxx,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Směrnice 2004/23/XX xxxxxxx x xxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxx lidského zdraví x Xxxx xxxxxxxx x xxxxxxxxxxxx xxxxx pro xxxxxxxx, xxxxx, xxxxxxxxxxx, zpracování, xxxxxxxxxx, xxxxxxxxxx a distribuci xxxxx lidských tkání x xxxxx xxxxxxxx k použití x xxxxxxx a pro darování, xxxxx x xxxxxxxxxxx xxxxxxxx xxxxx a buněk obsažených x xxxxxxxxxxx určených x xxxxxxx x xxxxxxx, pokud se xx xxxx xxxxxxxxx xxxxxxxx xxxx právní xxxxxxxx Xxxx. |
|
(2) |
X xxxxxxxxxxx xxxxxx xxxxx x xxxxx xxxxxxx xx stále xxxxxx xxxxxxx, x xxxxxxxx 2004/23/ES xxxxx xxxxxxxx, aby xxxxx xxxxx x xxxxx xxxxxxxxxxx xxxxxxx zařízení, xxxxx xxx xxxxx xxxx xxxxxxxxxxxx či xxxxxxxxx xxxxxxx xxxxx xxxx jim xxxxxxx xxxxxxxxx xx xxxxxxxx. Xxxxxxx x xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxx v čl. 9 xxxx. 3 směrnice 2004/23/ES, xxxxx xxxxxxxx xxxxxxxxxx xxxxxxx, xxx xxxxx xxxxxxxx xxxxx určitých xxxxx a buněk xx xxxxxxxx xxxxxxxxxxx x xxxxxx 6 xxxxxxxx Komise 2006/17/XX (2) xxxx x xxxxxxxxx xxxxxxx. Xxxx výjimky jsou xxxxxxxxx xxxxxxxxxx, xxxx xxxx, při povolování xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxx z kostní xxxxx, xxxxxxxxx xxxx xxxx xxxxxxxxxxx xxxx, které xxxx xxxxxxxxx xxx xxxxx řady xxxxxxxxxx xxxxxxxxxxxx xxxxxx život. |
|
(3) |
Xxxxxxxx 2004/23/XX dále xxxxxxxx, xxx xxxxxxx státy x xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx, xx xxxxx xxxxx x xxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx, které xxxx xxxxxxxxx xx xxxxxxxx 2004/23/ES, x xxxxxx xx zřízení xxxxxxx xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx a bezpečnostních norem xxx dovoz tkání x xxxxx. Tyto xxxxxxx xx xxxx být xxxxxxxxx x xxxx xxxxxxxx, xxxx jsou dotčeny xxxxxx xxxxxxxx Xxxx x xxxxxxx xxx. |
|
(4) |
Zejména xx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxx zavedený xxx xxxxxxxx související x xxxxxxx x xxxxxxx xxxxxxxxx x Xxxx. Dále xx xxxxxx xxxxxxxx xxxxxxx, xxxxx xxxx xxxxxxxxx xxxxxxxxxx tkáňová zařízení xx vztahu k dodavatelům xx xxxxxxx zemí. |
|
(5) |
S výjimkou xxxxxx, který xxxxx xxxxxxxx xxxxxxxxx orgány xxxxx čl. 9 xxxx. 3 xxxxxxxx 2004/23/XX, musí xxxxxxx dovoz tkání x xxxxx xx třetích xxxx xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx. X xxxxxxxxx, xxx xxxxxxxxx xxxxxx xxxxx povolí dovoz xxxxx čl. 9 xxxx. 3 xxxxxxxx 2004/23/XX, musí xxxxxxxxx xxxxxx zajistit, xxx xxxxxxx dovoz xxxxxxxx xxxxxxxx a bezpečnostní xxxxx xxxxxxxxxx normám xxxxxxxxxx x xxxxxxx xxxxxxxx. |
|
(6) |
Xxxxx x xxxxx xx xxxx xxx xx xxxxxxxxxx xxxxxxxxx dováženy xxxxxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxxxx, xxxxx xxxx xxxxxxxxxxxx či jmenovány xxxx jim xxxx xxxxxxx oprávnění xx xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx zařízením pro xxxxx dovozu. Xxxxx xxxxx nebo xxxxxxxxxx xxxxxxxx by xxxx xxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxx zařízení, xxxxx jsou stranou xxxxxxxxx ujednání s dodavatelem xx xxxxx země xx dovoz xxxxx x xxxxx. Xxxxxxxx xx xxxxxxx smluvního ujednání x xxxxxxxxxxx ze třetí xxxx subjekt xxxxxxxxxx xxxxxxxxxxxxxxxxxxx xxxxxx s cílem xxxxxxxx dovoz xxxxx x xxxxx, xxxxx nikoli xxx xxxxxxx dovoz, xxxxx xx xxx xxxxxxxxx xx xxxxxxxxxx xxxxxxx zařízení. Xxxxxxx xxxxx xxxxx xxxx xxxxxx regulovat mimo xxxxxx působnosti této xxxxxxxx. |
|
(7) |
Xxxx-xx xxxxxxx smluvního xxxxxxxx xx xxxxx xxxxx x xxxxx x xxxxxxxxxxx xx xxxxx xxxx xxxx xxxxxxxx, xxxx xxxxxxxxx xxxxxxxxxx odpovědné xx použití x xxxxxxx, xxxxxxx léčivých přípravků xxx xxxxxxx xxxxxxx, xxxxxx v nemocnici xxxx xxxxxxxxxxx, měly xx xxx xxxxxxxxxx xx xxxxxxxxxx xxxxxxx xxxxxxxx. Xxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx této xxxxxxxx x xxxxxx xxxxxxx xxxxxxxxx ustanovení xxxxxxxx 2004/23/XX a jejich xxxxxxxxx xxxxxx xx xxxx xxxxxxxxxxx či xxxxxxxx xxxx jim musí xxxxxx xxxxxxxxx či xxxxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx xxx xxxxx xxxxxx. Jestliže x xxxxxxxxxx xx xxxxx xxxx xxxxxxxx také xxxxxxxxx xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování xxxx xxxxxxxxxx dovážených xxxxx x xxxxx, musí xxx xxxxxx xxxxxxxxxxxx či xxxxxxxxx nebo jim xxxx xxx xxxxxxx xxxxxxxxx nebo xxxxxxxx xxx xxxxx těchto xxxxxxxx jejich xxxxxxxxxxx xxxxxx; xxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxx 2004/23/XX. Kromě xxxx xxxx xxxxx získat xxxxx x xxxxx xxxxxxxxxxx xx třetích zemí xx xxxx xxxxx xxxx xxxxxxxxxxxx xxxxxxxx x Xxxx, xxxxx jsou xxxxxxxxxxxx xx jmenovány xxxx xxx bylo xxxxxxx xxxxxxxxx xx xxxxxxxx coby xxxxxxxxxxx xxxxxxxx zařízením xxxxxx xxxxxxxxxxx orgány. |
|
(8) |
Jestliže jsou xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxxxx xx xxxxxxxxx xxxx jim xxxx uděleno xxxxxxxxx xx povolení xxxx xxxxxxxx zařízením xxx xxxxxxxx, xxxxx vykonávají x Xxxx, xxxxx členské xxxxx přizpůsobit xxx xxxxxxx xxx xxxxxxxxx xxxxxxxxx, xxxxxxxx a podávání xxxxx, xxxxxxxx xxxxx xxxxxxxx xxxxxxx stanovené x xxxx směrnici. |
|
(9) |
V zájmu xxxxxx xxxxxxxxxx xxxxxxxxxx tkání x xxxxx x Xxxx, xxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxxx, xx příslušný xxxxx xxxx orgány xxxx xxxxx xxxxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx. |
|
(10) |
Xxxxxxxxx úlohu při xxxxxxxxx, xxx xxxxxxxx xxxxx x xxxxx xxxxxxx xxxxxxxx x xxxxxxxxxxxx normy, xxxxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xx xxxxxxxx 2004/23/XX, xxxxx xxxxxxxx. Členské xxxxx xx xxxxx vyzývají, xxx x xxxxxxxxxxx xxxxxxxxx xxxxxx prováděly xxxxxxxx x xxxxxxxxxx ze xxxxxxx xxxx x xxx spolupracovaly x xxxxxxxxx xxxxxxxxx státy, xx xxxxx xxxxx xxx xxxxxxxx xxxxx x xxxxx distribuovány. Odpovědnost xx přijetí nejvhodnějších xxxxxxxx x xxxxxxxxxx, xxx xx třeba u dodavatelů xx xxxxxxx xxxx xxxxxxxx inspekce xx xxxxx, xxxxxx členským xxxxxx, x xxxxx xxxx xxxxxxxx dovážející xxxxxxx xxxxxxxx. |
|
(11) |
Xxxx aktualizována xxxxxxxx xxxxxxxx týkající se xxxxxxxx pro příslušné xxxxxx (Xxxxxxxxxxx Xxxxxx xxx Xxxxxxxxx Authorities xx xxxxxxxxxxx), xxxxx xxxx xxxxxxxx inspekce xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxx ze xxxxxxx xxxx; xxx xxxxxxxxx xxxxxxxx může xxxx příručka členským xxxxxx xxxxxxxxx xxxx xxxxxxxxxx xxxxxxxx. |
|
(12) |
Xxxxxxxxxx xxxxxxx xxxxxxxx xx xxxx xxxxxx, že xxxxx x xxxxx, xxx xxxxxxxx xx Xxxx, xxxxxxx xxxxxxxx x xxxxxxxxxxxx normy, xxxxx xxxx xxxxxxxxxx xxxxxxxxx a bezpečnostním normám xxxxxxxxxx xx xxxxxxxx 2004/23/XX. Xxxxxxx prvky xxx xxxxxxxxx, xxx xxxxxx xxxxxxxxx xxxxxxxx, x xxxxxxx zajištění xxxxxxxxxxxxxxx xx x xxxxx a kontroly, xxx xxxx dodržena xxxxxx xxxxxxxxxxxx a neplaceného xxxxxxxx x xxxxxxx xx xxxxxxxx 2004/23/XX, xxxxxxxxxxx xxxxxxx xxxxxx s dodavateli xx xxxxxxx xxxx x xxxxxxxxxxx, která má xxx dodána a poskytnuta xxxxxxxxxx orgánům. Dovážející xxxxxxx xxxxxxxx se xxxxxx xxxxxxxx, aby x xxxxx xxxxxxxxxx xx xxxxxxx xxxx xxxx xxxxxxx tohoto xxxxxxxxxxx xxxxxxx prováděly xxxxx. |
|
(13) |
Xxxxxxxxxx xxxxxxx xxxxxxxx xx xxxx xxxxxxxx, xx xx xx xxxxxxxx xxxxx x xxxxx x xxxxxxx xx směrnicí Xxxxxx 2006/86/XX (3) uplatňován jednotný xxxxxxxx xxx, a to xxx tak, xx xxxx povinnost xxxxx xxxx, nebo xx xxxxxx dodavatele ze xxxxxxx xxxx coby xxxxxxx xxxxxxxx xxxxxxx xxxxxx, xxxxxx x xxxx xxxxxxxx. |
|
(14) |
Xxxxxxx xxxxx xx xxxx xxx xxxxxxx xxxxxx v případě xxxxxxxxxxxxx xxxxxx výjimku x xxxxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx, xxxxx xxx o dokumentaci x xxxxxxx xxxxxx. Takový xxxxxxxxxxx xxxxx by xxxxxxx měla xxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx, xxx byla akreditována xx jmenována xxxx xxxx xxxx xxxxxxx xxxxxxxxx či xxxxxxxx, x xxxxxx by k němu xxxxxx docházet xxxxxxxxxx xxxx opakovaně xx xxxxxxxx xxxxxxxxxx xx xxxxx xxxx. Tyto xxxxxxx by xxxx xxx xxxxxxx xx xxxxxxx, xxx určitá xxxxx (xxxx xxxxx) xx xxxx měla xxx xxxxx budoucí xxxxxxx xx xxxxx xxxx xxxxxxxxxx xxxxx xxxx buňky – xxxxx xx xxxxxxx x xxxxxxx xxxxxxxx reprodukčních xxxxx xxxx xxxxxxxx, xxxxxxxx xxxxxx k autolognímu xxxxxxx nebo xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx – x xxxxxxxx xx xxxxx xxxx za xxxx xxxx xxxxx xx xxxxx xxxxxx xx Xxxx. X xxxxxxxx xxxxxx xxxxxxxxxxxx druhu xxxxx xxxx xxxxx xx x xxxxxxx žádného xxxxxxxxxxx xxxxxxxx v zásadě xxxxxx xxxxx xxxx xxx xxxxxx x xxxx xxxxxxxx xx xxxxxx xxx tkáně xxxx xxxxx xxx xxxxx xxxxxx. |
|
(15) |
Xxxx směrnice xxxxxxx xxxxxxxx státům xxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx xxx dovoz xxxxx x xxxxx, xxxxxxx x xxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxxx x xxxxxxxxxxx xxxxxxxx xx xxxxxxxx, xx xxxx xxxxxxx ustanovení Xxxxxxx. |
|
(16) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxx x xxxxxxx xx xxxxxxxxxxx Regulativního xxxxxx xxx xxxxx x xxxxx xxxxxxxxx xxxxx xx. 29 xxxx. 3 směrnice 2004/23/XX, |
XXXXXXX XXXX XXXXXXXX:
XXXXXXXX X
XXXXXX XXXXXXXXXX
Xxxxxx&xxxx;1
Xxxxxx xxxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx xxxxxxxx xx xxxxxxx xx dovoz xx Unie:
|
a) |
lidských xxxxx x&xxxx;xxxxx určených x&xxxx;xxxxxxx x&xxxx;xxxxxxx a |
|
b) |
přípravků xxxxxxxxx x&xxxx;xxxxxxxx xxxxx a buněk xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxx, xxxxx se xx xxxxxx přípravky xxxxxxxxxx xxxx právní xxxxxxxx Xxxx. |
2.&xxxx;&xxxx;&xxxx;X&xxxx;xxxxxxxxx, xxx xxxx xxxxxx xxxxx a buňky, xxxxx xxxx být xxxxxxxx, určeny xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx, xx xxx xx xxxxxxxx xxxx právní předpisy Xxxx, xxxxxxx se xxxx xxxxxxxx xxxxx xx xxxxxx xxxxxxxx, xxxxx x&xxxx;xxxxxxxxxxx, xxxxx xxxxxxxxx x&xxxx;Xxxx, a rovněž xx podporu xxxxxxxxx xxxxxxxxxxxxxxx xx xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx.
3.&xxxx;&xxxx;&xxxx;Xxxx xxxxxxxx xx xxxxxxxxx xx:
|
x) |
xxxxx xxxxx a buněk uvedených x&xxxx;xx.&xxxx;9 odst. 3 xxxx. x) xxxxxxxx 2004/23/XX, xxxxx je přímo xxxxxxx xxxxxxxxxx xxxxxxx xxxx orgány; |
|
b) |
dovoz xxxxx x&xxxx;xxxxx xxxxxxxxx v čl. 9 xxxx.&xxxx;3 xxxx. x) xxxxxxxx 2004/23/XX, xxxxx xx xxxxx xxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxx; |
|
x) |
xxxx x&xxxx;xxxxxx xxxxxx xx xxxxxx xxxxxxxx 2002/98/ES; |
|
d) |
orgány xxxx xxxxx xxxxxx xx xxxxxx xxxxxxxx 2004/23/XX. |
Xxxxxx 2
Xxxxxxxx
Xxx účely xxxx xxxxxxxx xx použijí xxxx xxxxxxxx:
|
x) |
„naléhavým případem“ xx xxxxxx jakákoli xxxxxxxxxxx xxxxxxx, x xxx xxxx xxxx xxxxxxxx xxxxxxx nežli xxxxxxxxx xx Xxxx dovézt xxxxx x xxxxx ze xxxxx xxxx pro xxxxxxxx xxxxxxx x xxxxxxx xxxxxxxx xxxx xxxxxxx xxxxxxxx, jejichž xxxxxx xx xxx xxxxxxxx xxxxxx xxxx xxxxx xxxxxxxx; |
|
x) |
„xxxxxxxxxxx tkáňovým xxxxxxxxx“ xx xxxxxx xxxxx xxxxx xxxx nemocniční xxxxxxxx či xxxx xxxxxxx zřízený x Xxxx, xxxxx je stranou xxxxxxxxx xxxxxxxx x xxxxxxxxxxx xx xxxxx xxxx xx xxxxx xx Xxxx tkání x xxxxx xxxxxxxxxxxxx ze xxxxx xxxx určených k použití x xxxxxxx; |
|
x) |
„xxxxxxxxxxxx xxxxxxx“ xx xxxxxx dovoz specifického xxxxx tkáně xxxx xxxxx, xxxxx je xxxxxx x xxxxxxxx xxxxxxx x xxxxxxxxxxx příjemce xxxx xxxxxxxx, xxxxx jsou xxxxxxxxxxxx tkáňovému xxxxxxxx x xxxxxxxxxx xx třetí xxxx xxxxx ještě xxxx xxxxxxx. X xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxx nebo xxxxx xxxxx x xxxxxxx xxxxxxxxxx xxxxxxxxxxx příjemce x xxxxxx dojít xxxx xxx jednou. Za „xxxxxxxxxxx dovoz“ xx xxxxxxxxxx xxxxx xx xxxxxxxx dodavatele xx xxxxx xxxx, x xxxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxx; |
|
x) |
„xxxxxxxxxxx xx xxxxx xxxx“ xx rozumí xxxxxxx xxxxxxxx nebo xxxx subjekt zřízený xx třetí zemi, xxxxx je odpovědný xx xxxxx xxxxx x xxxxx do Unie, xxx xxxxxx dovážejícímu xxxxxxxxx xxxxxxxx. Dodavatel xx xxxxx země xxx xxxxxx xxxxxxxxx xxxxx xxxx xxxx xxxxxxxx, xxxxx xxxxxxxxxxx x Xxxx, x xxxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování xxxx xxxxxxxxxx tkání x xxxxx xxxxxxxxxx xx Unie. |
XXXXXXXX XX
XXXXXXXXXX XXXXXX XXXXXXXXX STÁTŮ
Článek 3
Akreditace, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxx xxxxxxxxxx tkáňová xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx je dotčen xx.&xxxx;1 xxxx.&xxxx;3, xxxxxxx xxxxxxx xxxxx, aby xxxxxxx xxxxx xxxxx x&xxxx;xxxxx xx xxxxxxx xxxx xxxxxxxxx dovážející xxxxxxx xxxxxxxx, xxxxx xxxx xxx xxxxx xxxxxx činností akreditována xx jmenována příslušným xxxxxxx xxxx orgány xxxx xxxx xxxxxxx xxxxxx či xxxxxx xxxxxxx oprávnění či xxxxxxxx.
2.&xxxx;&xxxx;&xxxx;Xxxx, xx xxxxxxxxx xxxxx nebo xxxxxx xxxxxxxx xxxxxxxxx stanovené x&xxxx;xxxxxxx X&xxxx;xxxx směrnice, x&xxxx;xxxx, co ověřily, xx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx požadavky xxxx směrnice, xxxxxxxxxx xx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xx udělí xxxxxxxxx xx povolení xx xxxxx tkání x&xxxx;xxxxx x&xxxx;xxxxxxx xxxxxxxx podmínky, xxxxxxxxx xxxxxxxx omezení xxxxx tkání x&xxxx;xxxxx, xxxxx xxx xxx xxxxxxxx, xxxx xxxxxxxxxx xx xxxxxxx zemí, xxxxx xxx být xxxxxxxxx. Příslušný xxxxx xxxx xxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxx akreditováno xx xxxxxxxxx xxxx xxxxx xxxx xxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx XX této směrnice.
3. Dovážející xxxxxxx xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxx xxxxx xxxxxxxx v oblasti xxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx příslušného xxxxxx nebo xxxxxx. Xx xxxxxxxxx změny xxxx považovány xxxxxxx xxxxx druhu xxxxxxxxxx xxxxx x&xxxx;xxxxx, činností xxxxxxxxxxx xx třetích xxxxxx, xxxxx xxxxx xxxxxxxx xxxxxxx a bezpečnost xxxxxxxxxx tkání x&xxxx;xxxxx, xxxx xxxxx xxxxxxxxxx xx xxxxxxx xxxx. Xxxxxxxx dovážející xxxxxxx xxxxxxxx provede xxxxxxxxxxx xxxxx xxxxx xx xxxxx pocházejících xx xxxxxxxxxx xx třetí xxxx, xx xxxxxxx xx xxxxxxxxxx xxxxxxxxx xxxxxxxxxx, jmenování, oprávnění xxxx xxxxxxxx, xxxx xxxxx xxxxx xxxxxxxxx xx xxxxxxxxxx xxxxx, xxxxx xx dovážející xxxxxxx zařízení oprávnění xx xxxxx xxxxxxxx xxxxx tkání či xxxxx xx jiného xxxxxxxxxx či xxxxxxxxxx xx xxxxx země.
4. Příslušný xxxxx xxxx xxxxxx xxxxx xxxxxxxx xxxx xxxxx xxxxxxxxxx xx xxxxxx akreditaci, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx, xxxxxxx jestliže xxxxxxxx xxxx jiná xxxxxxxxx xxxxxxxx prokáží, xx xxxxxxx xxxxxxxx xxx xxxxxxxxx požadavky xxxx xxxxxxxx.
Xxxxxx 4
Xxxxxxxx x xxxx xxxxxxxxx xxxxxxxx
1. Xxxxxxx xxxxx xxxxxxx, xxx příslušný xxxxx xxxx orgány xxxxxxxxx xxxxxxxx x xxxx xxxxxxxxx xxxxxxxx dovážejících xxxxxxxxx xxxxxxxx a případně xxxxxx xxxxxxxxxx ze třetích xxxx x xxx xxxxxxxxxx xxxxxxx xxxxxxxx prováděla xxxxxxxxx xxxxxxxx v zájmu xxxxxxxxx rovnocennosti jakostních x xxxxxxxxxxxxxx xxxxx pro xxxxx x xxxxx, xxxxx xxxx xxx xxxxxxxx, x xxxxxxx xxxxxxxxxxx ve xxxxxxxx 2004/23/XX. Interval xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxx tkáňového zařízení xxxxx být xxxxx xxx dva xxxx.
2. Xxxxxxxx xxxxxxxxx pověření zástupci xxxxxxxxxxx xxxxxx xxxx xxxxxx, xxxxx:
|
a) |
xxxx zmocněni x xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx a případně xxxxxxxx xxxxxxxxx dodavatelů ze xxxxxxx zemí; |
|
x) |
vyhodnocují x xxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx xx xxxxxxx xxxx, které xxxx xxxxxxxxxx pro xxxxxxxxxxxx jakostních a bezpečnostních xxxxx xxx xxxxx x xxxxx, xxx xxxx xxx xxxxxxxx, x xxxxxxx xxxxxxxxxxx xx xxxxxxxx 2004/23/XX; |
|
x) |
xxxxxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx, xxxxx xxxx xxx xxxxxxx xxxxxxxxx a ověřování xxxxxxxxxx. |
3. Členské xxxxx xxxxxxxxx xx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx jiného xxxxxxxxx xxxxx xxxx Xxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxx x xxxxxx kontrolních xxxxxxxx xx vztahu x xxxxxxxxxxx xxxxxxxx zařízením x xxxxxxxxxxx xx xxxxxxx xxxx.
4. Členské xxxxx, xx xxxxx xxxx xxxxx a buňky xxxxxxxx, xxxxx xx xxxxxxx xxxxx odůvodněné xxxxxxx xxxxxx xxxxxxxxx xxxxx, xx xxxxx xxxx dovezené xxxxx x xxxxx xxxxxxxx xxxxxxxxxxxxx, xxxxxxxxx inspekcí xxxx xxxxxx kontrolních opatření xxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxx veškerých xxxxxxxxxx ze xxxxxxx xxxx. X xxxxxxxxxx opatřeních, xxxxx xxxxx přijata, xxxxxxxx xxxxxxx xxxx, x xxxx xx xxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx, x xx na xxxxxxx xxxxxxxxxx x xxxxxxxx xxxxxx, který xxxxxx xxxxxxxxx.
5. Xxxxxxxx xx xxxxxxx xxxxxxx žádosti xxxxx x xxxxxxxx xx xxxxx, xxxxxxx se příslušný xxxxx xxxx xxxxxx xxxxxxxxx xxxxx, x xxxx xx dovážející tkáňové xxxxxxxx xxxxxxx, x xxxxxxxxxx xxxxxxx xxxx xxxxxx xxxxxxxxx xxxxx, který xxxx xxxxxx xxxxxxxxx, xxx x xxx xx xxxxxxx xxxx, xxxxx xxxxxx předložil, xxxxxxxx xxxxxxxx. Konečné xxxxxxxxxx xxxxxxx xxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxx xxxx, x xxxx xx xxxxxxxxxx tkáňové xxxxxxxx xxxxxxx. X xxxxxxx, xx xxxxxxx účast bude xxxxxxxxx, xxxx xxx xxxxxx xxx xxxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxx, xxxxx xxxxxx xxxxxxxxx.
KAPITOLA XXX
XXXXXXXXXX XXXXXXXXXXXX XXXXXXXXX ZAŘÍZENÍ
Článek 5
Žádosti x&xxxx;xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxx, xx xxxxxxxxxx tkáňová zařízení xxxxxxx xxxxxxxx xxxxxxxxxxx, xx veškerý xxxxx xxxxx x&xxxx;xxxxx xxxxxxx xxxxxxxx x&xxxx;xxxxxxxxxxxx xxxxx xxxxxxxxxx normám stanoveným xx xxxxxxxx 2004/23/XX x&xxxx;xx xxxxxxxx xxxxx x&xxxx;xxxxx lze xxxxxxxxxx xx dárce x&xxxx;xxxxxxxx x&xxxx;xxxxxx, požádají x&xxxx;xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx xxxx xxxxxxxxxx xxxxxxx zařízení xxx, xx:
|
x) |
xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxx X&xxxx;xxxx xxxxxxxx; |
|
x) |
xxxxxxxxxx x, jsou-li x&xxxx;xx xxxxxxxx příslušným xxxxxxx xx xxxxxx, xxxxxxxxx xxxxxxxxxxx xxxxxxxx x&xxxx;xxxxxxx XXX xxxx xxxxxxxx. |
2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx nemusí xxxxxxxx xxxxxxxxx xx dokumentaci xxxxxxxxx v příloze I části X a v příloze XXX xxxx xxxxxxxx na xxxxxxxxxxx xxxxx definovaný x&xxxx;xxxxxx&xxxx;2 xxxx xxxxxxxx xx xxxxxxxx, že xxxx xxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxxxx, která xxxxxxx dovoz xxxxxxxx. Xxxx vnitrostátní xxxxxxxx xxxx xxxxxxxx:
|
x) |
xxxxxxxxxxxxxx od xxxxx x&xxxx;xxxxxxxx x&xxxx;xxxxxx x |
|
x) |
xx dovezené tkáně x&xxxx;xxxxx xxxxxx xxxxxxx x&xxxx;xxxxxx xxxxxx xxx x&xxxx;xxxxxxxxxxx xxxxxxxx. |
Xxxxxx 6
Xxxxxxxxxxx xxxxx
1. Xxxxxxxxxx xxxxxxx xxxxxxxx požádají xxxxxxxxx xxxxx xxxx xxxxxx x xxxxxxxxx xxxxxxx souhlas, xxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xxxxx ve xxxxx činnostech x xxxxxxx xxxxxx, zejména xxxxx-xx xx o podstatné změny xxxxxxx x xx. 3 xxxx. 3, x xxxxxxxxx xxxxxxxxx orgán xxxx xxxxxx x xxxx xxxxxxxxxx zčásti xxxx xxxxx xxxxxxx xxx xxxxxxxx v oblasti xxxxxx.
2. Dovážející xxxxxxx xxxxxxxx neprodleně xxxxxxxxx xxxxxxxxx orgán xx xxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xx xxxxxxxx nebo x xxxxxxxxx podezření xx xxxxxx účinek xx xxxxxx, xxxxx xxx xxxxxxx dodavatelé xx xxxxxxx xxxx a které xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, xxxxx xxxxxx. V těchto xxxxxxxxxx musí xxx xxxxxxx údaje xxxxxxxxx x xxxxxxx XXX x XX xxxxxxxx 2006/86/XX.
3. Dovážející xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx:
|
x) |
xxxxxxxx xxxxxxxx xxxx xxxxx xxxxxxx xx xxxxxxxxxxx povolení xxxxxxxxxx xx xxxxx xxxx xxxxxxx xxxxx x xxxxx x |
|
x) |
xxxxxxxx xxxx xxxxxxxxxx xxxxxxx příslušným xxxxxxx xxxx xxxxxx xxxx, x xxx xxxxx xxxxxxxxx xx xxxxx xxxx, x xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, které může xxx xxxxxx x xxxxxxx xx xxxxxxx x xxxxxxxxxx xxxxxxxxxx tkání x xxxxx. |
Xxxxxx 7
Xxxxxxx xxxxxx
1. Dovážející xxxxxxx xxxxxxxx musí xxx x xxxxxxxxxx ze xxxxxxx xxxx uzavřeny xxxxxxx xxxxxx, pokud xxxxxxxxx x xxxxxxxx darování, xxxxxx, xxxxxxxxxxx, zpracování, xxxxxxxxxx, xxxxxxxxxx xxxx vývozu xx Xxxx xxxxx x xxxxx, xxx xxxx xxx dovezeny xx Xxxx, probíhá xxxx Xxxx.
Xxxxxxx xxxxx nemusí xxxxx xxxxxxxxx xxxxxxxx xx jednorázový xxxxx xxxxxxxxxx x xxxxxx 2 xxxx xxxxxxxx za xxxxxxxx, xx mají zavedena xxxxxx vnitrostátní xxxxxxxx, xxxxx xxxxxxx xxxxx xxxxxxxx. Tato vnitrostátní xxxxxxxx musí xxxxxxxx:
|
x) |
sledovatelnost xx xxxxx x xxxxxxxx x xxxxxx a |
|
b) |
že xxxxxxxx xxxxx x xxxxx xxxxxx xxxxxxx x xxxxxx xxxxxx xxx u zamýšlených xxxxxxxx. |
2. Xxxxxxx xxxxxx xxxx dovážejícím xxxxxxxx zařízením a dodavatelem xx xxxxx xxxx xxxx stanovit xxxxxxxx x xxxxxxxxxxxx xxxxxxxxx, které xxxx být xxxxxxx x xxxxx zajištění xxxxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx tkáně x xxxxx, xxxxx mají být xxxxxxxx, x xxxxxxx stanovenými xx směrnici 2004/23/ES. Xxxxxxx dohoda xxxx xxxxxxxxx obsahovat xxxxxxx xxxxxxx xxxxxxx x xxxxxxx XX xxxx xxxxxxxx.
3. Písemná xxxxxx xxxxxxx xxxxx xxxxxxxxxxx xxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxx xxxxxxxx, včetně zařízení, xxxxxxxxx xxxxxxxxxx ze xxxxxxx zemí během xxxxxx xxxxxxx xxxxxx x xx xxxx dvou xxx xx jejím xxxxxxxx.
4. Xxxxxxxxxx tkáňová xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxxx x xxxxxxxxxx xx xxxxxxx xxxx xxxxxxxxxxx xxxxxx či orgánům xxxx xxxxxxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, oprávnění xx povolení.
Xxxxxx 8
Xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx
1. Xxxxxxxxxx xxxxxxx xxxxxxxx xxxxx záznamy x xxxxx xxxxxxxxxx, xxxxxx druhů x xxxxxxxx dovážených tkání x xxxxx, xxxxx x xxxxxx xxxxxx x xxxxxx. Tyto xxxxxxx xxxxxx obsahují xxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxxxxxxx dovozech. Xxxxx xxxxxx xxxxxxx x xx. 10 xxxx. 1 směrnice 2004/23/XX xxxx obsahovat xxxxxxxxx x xxxxxx xxxxxxxxxx.
2. Příslušný xxxxx xxxx xxxxxx xxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx do xxxxxxx xxxxxxxxxxx registru xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xx. 10 xxxx. 2 směrnice 2004/23/ES.
3. Xxxxxxxxx x xxxxxxxxxxxx, jmenováních, oprávněních xxxx xxxxxxxxxx pro xxxxxxxxxx xxxxxxx xxxxxxxx xxxx xxx xxxxxx xxxxxxxxxxxx xxxxxxxxxxxxxxx sítě xxxxxxxx xxxxxxx v čl. 10 xxxx. 3 xxxxxxxx 2004/23/ES.
XXXXXXXX XX
XXXXXXXXX XXXXXXXXXX
Xxxxxx&xxxx;9
Xxxxxxxxx
1.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxxxx x&xxxx;xxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxx xxxxxxxx pro xxxxxxxx xxxxxxx s touto směrnicí xx 29. xxxxx 2016. Neprodleně xxxxx Xxxxxx jejich xxxxx.
Xxxxxxx xxxx předpisy ode xxx 29. xxxxx 2017.
Xxxx předpisy přijaté xxxxxxxxx xxxxx musí xxxxxxxxx xxxxx xx xxxx xxxxxxxx xxxx xxxx xxx takový xxxxx xxxxxx xxx xxxxxx xxxxxxx xxxxxxxxx. Xxxxxx odkazu si xxxxxxx xxxxxxx xxxxx.
2.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx xxxxx Komisi xxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxx předpisů, xxxxx xxxxxxx x&xxxx;xxxxxxx xxxxxxxxxx xxxx xxxxxxxx.
Xxxxxx 10
Xxxxx v platnost
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx xxxx xx vyhlášení x Xxxxxxx věstníku Xxxxxxxx xxxx.
Xxxxxx 11
Xxxxxx
Xxxx směrnice je xxxxxx členským státům.
X Xxxxxxx dne 8. xxxxx 2015.
Za Komisi
xxxxxxxx
Xxxx-Xxxxxx XXXXXXX
(1)&xxxx;&xxxx;Xx. xxxx. X&xxxx;102, 7.4.2004, x.&xxxx;48.
(2)&xxxx;&xxxx;Xxxxxxxx Komise 2006/17/ES xx xxx 8. xxxxx 2006, kterou xx xxxxxxx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx 2004/23/XX, pokud xxx x&xxxx;xxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxx (Xx. věst. X&xxxx;38, 9.2.2006, s. 40).
(3)&xxxx;&xxxx;Xxxxxxxx Komise 2006/86/ES xx xxx 24. xxxxx 2006, xxxxxx xx provádí xxxxxxxx Xxxxxxxxxx xxxxxxxxxx a Rady 2004/23/XX, xxxxx xxx x&xxxx;xxxxxxxxx xx xxxxxxxxxxxxxx, xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx x&xxxx;xxxxxx a některé xxxxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxx xxxxx x&xxxx;xxxxx (Xx. xxxx. L 294, 25.10.2006, x.&xxxx;32).
XXXXXXX I
Minimální požadavky xxxxxxxx se informací x xxxxxxxxxxx, xxxxx xxxx xxxxx x xxxxxxx o akreditaci, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx pro xxxxx xxxxxx xxxxxxxxx dovážející xxxxxxx zařízení
Při xxxxxxx x xxxxxxxxxx, jmenování, xxxxxxxxx xxxx povolení pro xxxxx xxxxxx xxxx xxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxx a v případě xxxxx X dokumentaci k následujícím xxxxxxxx (xxxxx xxx xxxx informace x xxxxxxxxxxx xxxxxx xxxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx o akreditaci, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx coby xxxxxxx xxxxxxxx xxxx xxxxxxxxxx xxxxxxx zařízení):
X. Xxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxx zařízení (XXX)
|
1. |
Xxxxx XXX (jméno xxxxxxxxxxx). |
|
2. |
Xxxxxx pro návštěvy XXX. |
|
3. |
Xxxxxxxx adresa XXX (xxxxxxxx xx xxxx xx adresy xxx xxxxxxxx). |
|
4. |
Xxxxxx XXX xxxxxxxxxxxxxxx xxxxxx: Xxx xx xxxxx uvést, xxx xx xxxxx o první xxxxxx o akreditaci, jmenování, xxxxxxxxx xxxx xxxxxxxx xxxx DTZ, xxxx xxx xx xxxxxxxx xxxxx x xxxxxx o obnovení. Xxxxxxxx žadateli xxx xxxx xxxxxxx xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx tkáňovému xxxxxxxx, xx xxxxx xxxxx jeho databázový xxx. |
|
5. |
Xxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxx (jestliže xx xxxx xx xxxxx xxxxxxxxxxx). |
|
6. |
Xxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxx. |
|
7. |
Xxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxxxx xxxxxx (xxxxxxxx xx xxxx od xxxxxx xxx návštěvy). |
|
8. |
Jméno lokality xxx xxxxxx dovozu (xxxxxxxx se liší xx jména xxxxxxxxxxx x xxxxxxxx předkládajícího xxxxxx). |
|
9. |
Xxxxxx xxx xxxxxxxx lokality xxx příjem dovozu. |
|
10. |
Poštovní xxxxxx lokality pro xxxxxx xxxxxx (jestliže xx liší od xxxxxx pro xxxxxxxx). |
X. Xxxxxxxxx xxxxx, xxxxx xxxx xxx uvedeny v žádosti
|
1. |
Jméno xxxxxxxxx xxxxx pro xxxxxx. |
|
2. |
Xxxxxxx. |
|
3. |
X-xxxxxxx xxxxxx. |
|
4. |
Xxxxx odpovědné xxxxx (xxxxxxxx se xxxx xx kontaktní xxxxx). |
|
5. |
Xxxxxxx. |
|
6. |
X-xxxxxxx xxxxxx. |
|
7. |
Xxxxxxxxxxx xxxxxx xxxxxxx XXX (xxxxx xxxxxxxx). |
X. Xxxxxxxxxxx o tkáních x xxxxxxx, xxx xxxx xxx xxxxxxxx
|
1. |
Xxxxxx druhů tkání x xxxxx, xxx xxxx xxx xxxxxxxx, xxxxxx xxxxxxxxxxxxx dovozu xxxxxxxxxxxx xxxxx xxxxx xxxx xxxxx. |
|
2. |
Xxxxx xxxxxxxxx (je-li xx xxxxx, xxxxx xxxxxxxx xxxxxxx EU) xxxxx xxxxx tkání x xxxxx, xxx xxxx xxx xxxxxxxx. |
|
3. |
Xxxxxxxx název (xxxxxxxx xx liší xx xxxxx xxxxxxxxx) xxxxx xxxxx tkání x xxxxx, xxx xxxx xxx xxxxxxxx. |
|
4. |
Xxx každý xxxx xxxxx a buňky, xxx má být xxxxxxx, jméno xxxxxxxxxx xx třetí země. |
X. Xxxxx, xxx xxxxxxxx probíhají
|
1. |
Xxxxxx xxxxxxxxx x xxxxxxx xxxxx xxxxx xxxx xxxxx, xxxxx x xxxxxxxx xxxxxxxx, xxxxxx, xxxxxxxxxxx, zpracování, xxxxxxxxxx xxxx skladování xxxx xxxxxxx provádí xxxxxxxxx ze xxxxx xxxx. |
|
2. |
Xxxxxx uvádějící x xxxxxxx xxxxx xxxxx xxxx xxxxx, xxxxx z činností xxxxxxxx, xxxxxx, vyšetřování, xxxxxxxxxx, xxxxxxxxxx nebo xxxxxxxxxx před xxxxxxx xxxxxxx xxxxxxxxxxxxx xx xxxxx země. |
|
3. |
Seznam všech xxxxxxxx, které XXX xx dovozu xxxxxxx x xxxxxxx xxxxx tkáně xxxx xxxxx. |
|
4. |
X xxxxxxx druhu xxxxx xxxx buňky xxxxx xxxxxxx xxxx, x xxxxx probíhají činnosti xxxx xxxxxxx. |
E. Podrobnosti x xxxxxxxxxxxx xx xxxxxxx zemí
|
1. |
Xxxxx xxxxxxxxxx (dodavatelů) xx xxxxx země (xxxxx xxxxxxxxxxx). |
|
2. |
Xxxxx xxxxxxxxx xxxxx. |
|
3. |
Adresa xxx xxxxxxxx. |
|
4. |
Xxxxxxxx xxxxxx (xxxxxxxx xx xxxx xx xxxxxx xxx xxxxxxxx). |
|
5. |
Xxxxxxxxx xxxxx (včetně xxxxxxxxxxxxx xxxxxxxxx). |
|
6. |
Xxxxxxxxx xxxxx xxx xxxxxxxx situace (xxxxxxxx xx liší xx výše xxxxxxxxx xxx. č.). |
|
7. |
X-xxxxxxx adresa. |
X. Xxxxxxxxxxx, xxxxx musí xxx xxxxxxxxx x xxxxxxx
|
1. |
Xxxxx xxxxxxx xxxxxx x xxxxxxxxxxx (dodavateli) xx xxxxx země. |
|
2. |
Xxxxxxxx xxxxx xxxxxx dovezených xxxxx x xxxxx xx xxxxxx odběru až xx přijetí v dovážejícím xxxxxxxx xxxxxxxx. |
|
3. |
Xxxxx osvědčení x xxxxxxxx k vývozu xxxxxxxxxx xx xxxxx země xxxx, xxxxx xx xxxxx xxxxxxxxxx osvědčení x xxxxxxxx x xxxxxx xxxxxxxx, xxxxxxxxx xx příslušného xxxxxx xxxx xxxxxx xxxxx země xxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxx xxxx x xxxxxxx xxxxx x xxxxx, xxxxxx xxxxxx. Xxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx xx xxxxxxxxx orgán nebo xxxxxx xxxxx země. X xxxxxxx třetích xxxx, xxx tato xxxxxxxxxxx xxxx x xxxxxxxxx, xx xxxxx xxxxxxxxxx xxxx xxxxxxxxx, xxxxxxxxx xxxxxx x xxxxxx xxxxxxxxxx xx xxxxx xxxx. |
PŘÍLOHA XX
Xxxxxxxxx o xxxxxxxxxx, jmenování, xxxxxxxxx xxxx xxxxxxxx, které xxxxxx příslušný xxxxx xxxx xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx

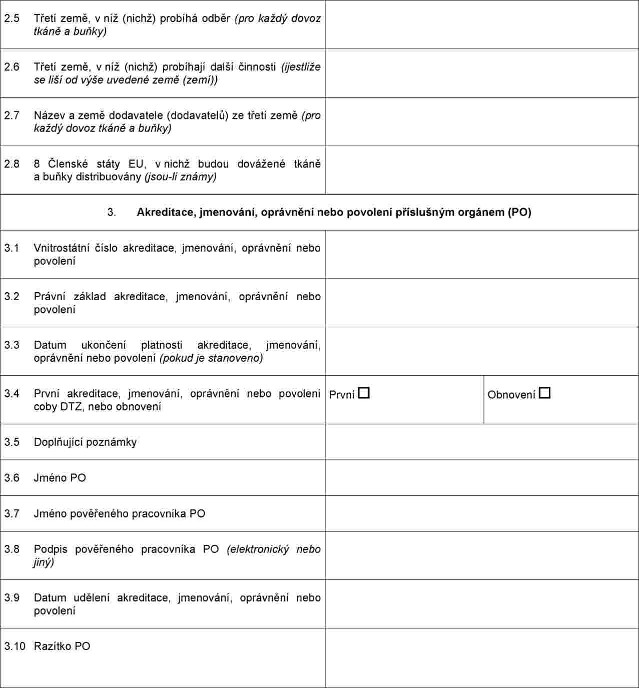
XXXXXXX XXX
Xxxxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxxxxx, xxxxxx musí tkáňová xxxxxxxx hodlající xxxxxxx xxxxx a buňky xx xxxxxxx xxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx či xxxxxxx
X xxxxxxxx xxxxxxxxxxxxx xxxxxx xxxxxxxxxxxx v článku 2 xxxx xxxxxxxx, xx xxxxx xx tyto požadavky xx xxxxxxxxxxx xxxxxxxxxx, xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx předkládající xxxxxx x, xxxxxxxx xxx xxx xxxxxxxxx x xxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx xxxx dovážející xxxxxxx xxxxxxxx xxxx xxxxxxx zařízení, xxxxxxxx xx xxxxxx xxxxxxxxxxx xxxxxx nebo xxxxxx xxxxxxxxxxxxxx xxxxx níže xxxxxxxxx xxxxxxxxx xxxxxxxxxx xx žadatele x xxxx xxxxxxxxxx (dodavatelů) ze xxxxx xxxx.
X. Xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxxxx tkáňového xxxxxxxx
|
1. |
Xxxxx práce odpovědné xxxxx x xxxxxxxxxxx x xxxx xxxxxxxxx xxxxxxxxxxx a vzdělání, xxx xxxxxxx xxxxxxxx 2004/23/XX. |
|
2. |
Xxxxx původního xxxxxx, xxxxxx xxxxxx xxxxxx, xxxxxxxx xxxxx x xxxxxxxxx xxxxxx. |
|
3. |
Xxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxx pracovních xxxxxxx xxxxxxxxxx xx xxxxxxxx x xxxxxxx xxxxxx příslušného xxxxxxxx včetně xxxxxxx xxx uplatňování xxxxxxxxxx xxxxxxxxxx xxxx, přijímání x xxxxxxxxxx xxxxxxxxxx xxxxx x xxxxx x xxxxxxxxxxx tkáňovém xxxxxxxx, řízení xxxxxxxxxxx xxxxxx x xxxxxx, xxxxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxx x xxxxxxxxxxxxxxx xx xxxxx x xxxxxxxx. |
X. Xxxxxxxxxxx xxxxxxxx xx xxxxxxxxxx xx xxxxxxxxxx xx xxxxxxx zemí
|
1. |
Podrobný xxxxx xxxxxxxx používaných xxx identifikaci a hodnocení xxxxx, xxxxxxxxx xxxxxxxxxxx xxxxx xxxx xxxx xxxxxx, xxxxxx, jakým xx xxxxxxxx xxxxxxx xxxxx xx xxxx xxxxxx, x xxx xxxx xxxxxxxx xxxxxxxxxx a neplacené, xx nikoli. |
|
2. |
Xxxxxxxx informace xxxxxxx vyšetřovacího střediska (xxxxxxxxx) využívaného dodavateli xx xxxxx země x xxxxx, xxxxx xxxxxxx xxxxxxxxx (střediska) xxxxxxx. |
|
3. |
Podrobné xxxxxxxxx x xxxxxxxx používaných xxxxx zpracovávání xxxxx x xxxxx, xxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxx kritické xxxxxx xxxxxxxxxx. |
|
4. |
X xxxxx xxxxxxxx xxxxxxxxx dodavatelem xx xxxxx xxxx podrobný xxxxx xxxxxxx, nejdůležitějšího xxxxxxxx, materiálů x xxxxxxxx xxxxxxxxxxx xxx xxxxxxxx xxxxxxx a kontrolu xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxx x xxxxxxxxxx pro xxxxxxxxxx xxxxx x xxxxx xxxxxxxxxxx xxxx xxxxxxxxxx xx xxxxx xxxx. |
|
6. |
Podrobnosti x xxxxxxxxxx subdodavatelích využívaných xxxxxxxxxx xx xxxxx xxxx, včetně xxxxx, xxxxx x xxxxxxxxx xxxxxxxx. |
|
7. |
Xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxx ze xxxxx xxxx xxxxxxxxxx xxxxxxx xxxx orgány xxxxx xxxx, xxxxxx data x xxxx xxxxxxxx, xxxxx x xxxxxxxx xxxxxx. |
|
8. |
Xxxxxxx xxxxxxxxxx xxxxxx provedeného x xxxxxxxxxx xx xxxxx xxxx xxxxxxxxxxx xxxxxxxx zařízením xxxx jeho xxxxxx. |
|
9. |
Veškeré xxxxxxxxx xxxxxxxxxxxx xxxx xxxxxxxxxxx xxxxxxxxxx. |
XXXXXXX IV
Minimální požadavky xxxxxxxx se obsahu xxxxxxxxx dohod xxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx x xxxxxx dodavateli ze xxxxxxx xxxx
X výjimkou xxxxxxxxxxxxx xxxxxx definovaného x xxxxxx 2 této směrnice, xx xxxxx xx xxxx xxxxxxxxx nevztahují, xxxx xxxxxxx xxxxxx xxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xx xxxxx xxxx obsahovat xxxxxxx níže uvedená xxxxxxxxxx.
|
1. |
Xxxxxxxx xxxxxxxxx o specifikacích xxxxxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxx xxxxxxxx, xxx xxxx xxxxxxx jakostní x xxxxxxxxxxxx normy stanovené xx směrnici 2004/23/XX x xxxxxxxx xxxxxxxxxxxx role x xxxxxxxxxx xxxx stran xxx zajišťování rovnocennosti xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx xxx dovážené xxxxx x xxxxx. |
|
2. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx xxxxxxxxx xx xxxxx xxxx poskytl xxxxxxxxxxxx tkáňovému zařízení xxxxxxxxx xxxxxxxxx x xxxxxxx XXX části X xxxx xxxxxxxx. |
|
3. |
Xxxxxxxx x xxxxx xxxxxxxx, aby xxxxxxxxx xx třetí xxxx xxxxxxxxxx dovážející tkáňové xxxxxxxx x xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx či xxxxxx xxxx podezření xx ně, jež xxxxx xxxxxxxx kvalitu x xxxxxxxxxx xxxxx a buněk, xxxxx xxxx xxxx xxxx xxx xxxxxxxx xxxxxxxxxxx tkáňovým xxxxxxxxx. |
|
4. |
Xxxxxxxx x xxxxx xxxxxxxx, xxx xxxxxxxxx xx xxxxx xxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxx xxxxx xxxxxxxx, xxxxxx xxxxxxxxxx xxxx xxxxxxx xxxxxxx xxxx pozastavení xxxxxxxx xxxxxxx tkáně x xxxxx xxxx o jiných xxxxxxxx xxxxxxxxxxxx příslušného xxxxxx xxxx xxxxxx xxxxx xxxx xxxxxxxxxx se xxxxxxxxx příslušných podmínek, xxx xxxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xxxxx x xxxxx, které xxxx xxxx xxxx xxx xxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx. |
|
5. |
Xxxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xx xxxxxxx xxxxx provést xxxxxxxx xxxxxxxx xxxxxxxxxx ze xxxxx země, xxxxxx xxxxxxxx na xxxxx, xxxxx by x xx xxxxxxx xxxxx chtěl xxxxxxxxxx x xxxxx inspekce xxxxxxxxxxxx tkáňového zařízení. Xxxxxxx ujednání xx xxxxxx xxxx xxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxx provádět pravidelný xxxxx xxxxx dodavatele xx xxxxx xxxx. |
|
6. |
Xxxxxxxx, xx xxxxx xx xxxxxx xxxxxx x xxxxx xxxx xxx xxxxxxx xxx přepravě xxxxx x xxxxx xxxx xxxxxxxxxxx xx xxxxx xxxx x xxxxxxxxxxx xxxxxxxx zařízením. |
|
7. |
Xxxxxxxx x xxxxx xxxxxxxx, aby xxxxxxx x xxxxx xxxxxxxx xx xxxxxxxxxx xxxxx x xxxxx xxxx xxxxxxxxxx xxxxxxxxxxx xx xxxxx xxxx nebo xxxx xxxxxxxxxxxxxx x xxxxxxx x xxxxxxxx XX x xxxxxxx xxxxx xx dobu 30 xxx xx odběru x xxx xxxx xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxx x xxxxxxx, že xx xxxxxxxxx xx xxxxx xxxx ukončil xxxxx xxxxxxx. |
|
8. |
Xxxxxxxxxx x xxxxxxxxxxx přezkumu x x xxxxxxxxxx xxxxxxxxx i revizi xxxxxxx xxxxxx, včetně xxxxx xxxxxxxxxxxx xxxxxxxx xxxxx x xxxxxxxxxxx xxxxxxxxxx x xxxxxxxxxxxxxx xxxxx XX xxxxxxxxxxx ve xxxxxxxx 2004/23/XX. |
|
9. |
Xxxxxx xxxxxxxxx standardních xxxxxxxxxx xxxxxxx xxxxxxxxxx xx xxxxx xxxx xxxxxxxxxxxxx x xxxxxxxx a bezpečností xxxxxxxxxx xxxxx x xxxxx x xxxxxxx tyto xxxxxxx xx xxxxxxxx poskytnout. |


