XXXXXXXX XXXXXX (XX) x. 1277/2005
xx dne 27. xxxxxxxx 2005,
xxxxxx xx xxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 273/2004 x prekursorech xxxx a x xxxxxxxx Xxxx (XX) x. 111/2005, xxxxxx xx xxxxxxx xxxxxxxx xxx xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxx xxxx Xxxxxxxxxxxxx x xxxxxxx xxxxxx
(Xxxx x xxxxxxxx pro XXX)
XXXXXX XXXXXXXXXX XXXXXXXXXXXX,
x ohledem xx Xxxxxxx x xxxxxxxx Evropského xxxxxxxxxxxx,
x xxxxxxx na nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 273/2004 xx xxx 11. února 2004 x xxxxxxxxxxxx xxxx (1), x xxxxxxx xx xx. 14 písm. x) x x) xxxxxxxxx xxxxxxxx,
x xxxxxxx xx nařízení Rady (XX) x. 111/2005 xx xxx 22. xxxxxxxx 2004, xxxxxx xx stanoví pravidla xxx xxxxxxxxx xxxxxxx x xxxxxxxxxx drog xxxx Xxxxxxxxxxxxx x xxxxxxx xxxxxx (2), a xxxxxxx na xx. 6 xxxx. 1 xxxxx xxxxxxxxxxx, xx. 7 odst. 2, xx. 8 xxxx. 2, xx. 9 xxxx. 2, čl. 11 xxxxxxxx 1 x 3, čl. 12 odst. 1 xxxxx pododstavec, xxxxxx 19 x xxxxxx 28 xxxxxxxxx xxxxxxxx,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx Xxxx (EHS) x. 3677/90 xx xxx 13. prosince 1990 x opatřeních, která xxxx být přijata xx účelem zamezení xxxxxxxxxx xxxxxxxx látek x nedovolené výrobě xxxxxxxx x xxxxxxxxxxxxxx xxxxx (3), xxxxxxxxx nařízením Xxxxxx (XXX) č. 3769/92 xx xxx 21. prosince 1992, xxxxxx xx provádí x xxxx xxxxxxxx Xxxx (XXX) x. 3677/90 o opatřeních, xxxxx xxxx být xxxxxxx xx účelem xxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx k xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxxxxxxx xxxxx (4), xxxx xxxxxxxxx nařízením (XX) x. 111/2005. Xx xxxxx uvést x xxxxxx prováděcí xxxxxxxx xxxxxxxx v xxxxxxxx (XXX) x. 3769/92 x xxxxx souborem xxxxxxxx stanoveným x xxxxxxxx (XX) č. 111/2005. Xxxxx xx xx mělo nařízení (XXX) x. 3769/92 xxxxxx. |
|
(2) |
Xxxxxxxx (XX) x. 273/2004 x xxxxxxxxxxxx xxxx, kterým xx xxxxxxxxx xxxxxxxx Rady 92/109/XXX (5), xxxxxxxxxxx xxxxxxxxxx xxxxxxxx xx xxxxxxx xxxxxxxx látek xxxxxxxxxxx xxx xxxxxxxxx xxxxxx xxxxxxxx a xxxxxxxxxxxxxx xxxxx xx xxx x xxxxx Společenství. Xxx xxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxx trhu, xx xx xxxx xxxxxxx s xxxxxxxxxx xxxx, by xxxx xxx na úrovni Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxx xxxxxxxx xx podání xxxxxxx x licenci, xxxxxxx xxxxxxx xxxx xxxxxxxxx licence, xxxxxx xxxxxxxxxxx nebo xxxxxxx. |
|
(3) |
Xx xxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx 1, a proto xx xxxx být xxxxxxxxxx, kde xx xxxx xxxxx xxxxxxxx xxxx xxxxxxxxx, zabezpečeny xxxxx xxxxxxxxxxxxx xxxxxxxx. |
|
(4) |
Xxxxx xxxx by měly xxx xxxxxxxxx typy xxxxxxxxxxxxx subjektů zabývajících xx xxxxxxxx x xxxxx Společenství, které xxxxx xxx xxxxxxxx xx zvláštních licencí x xxxxxxxxxx xxxxxxxxxx. Xxxx xx být xxxxxxxxx xxxxxxx, x xxxxxxx mohou být xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxxx mezi Xxxxxxxxxxxxx x xxxxxxx xxxxxx osvobozeny xx xxxxxxxxx xxxxxxx xxxxxxx x xxxxxxxxxx. |
|
(5) |
Xxxxxxxxxx xxxxxxxxxx xxxxxxxx xxx udělení xxxxxxx x xxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxx subjektů xxxxxxxxxxxx se xxxxxxxx x xxxxx Xxxxxxxxxxxx x xxxxxxxx mezi Xxxxxxxxxxxxx x xxxxxxx xxxxxx by xx xxxx co xxxxxxx xxxxxxxx. |
|
(6) |
Xxxx xx xxx xxxxxxxxx xxxxxxxx umožňující xxxxxxxx dovolené xxxxx xxxxx xxxxxxx xxxxxxxxxx xxxx xxxxxxxxxxxx xx xxxxx území Xxxxxxxxxxxx, xxxxxxxx x xx xxxxxxx tranzitní a xxxxxxxxx xxxxxxx a xxxxxxx místa, xxxxxx xxxx xxxxxxxx pásma Xxxxxxxxxxxx. |
|
(7) |
Xxxx zapotřebí xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx, aby xxxx xxxxx sledovat jednotlivé xxxxxxx xxxxxxx xxxxx xxxxxxxxx 1 za xxxxxx včasného xxxxxxxx xxxxxxxxxx a xxxxxxx x xxxxx reagovat xx rostoucí xxxxxxx xxxxxxxxxxxxx xxxxx xx xxxx xxxxxxxxxx. |
|
(8) |
Xxxxxxxxx pravidla xxxxxxxx xx xxxxxxxxxxx xxxxxxxx x xxxxxx xx xxxx umožnit xxxxxxxxx přenos informací x xxxxxxxx způsob xxxxxx xx citlivost xxxxxxx xxxxxxx. Za xxxxxx xxxxxxx využití xxxxxxxxxxx xxxxxxxx o xxxxxx x xxxxxxx xxxxxxxxx povolení xx xx xxxx úsilí x zásadě zaměřovat xx vysoce xxxxxxxx xxxxxxx. Prováděcí xxxxxxxx xxx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx o xxxxxx a xxxxxxxxx xxxxxxxxx xxxxxxxx zjednodušeným xxxxxxxx xx xxxx xxxxxxx xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx v xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxxxx xxxxx s běžným xxxxxxxxx xxxxxx použití. |
|
(9) |
V xxxxx xxxxxxxx xxxxxxxxx xxxxxxx xx xxxx xxxxxxx xxxxx xxxxxxx xxxxxxxxxx orgánům xxxxxx xxxxxxxxx xxxxxx úkoly x vzájemně xx xxxxxxxxx xxxxxxxxx. |
|
(10) |
Xxx zlepšení xxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx je xxxxxx, xxx xxxxxxx xxxxx xxxxxxxxxxx Xxxxxx pravidelně xxxxxxxxx x xxxxxxxx xxxxxxxxxx prekursorů xxxx. |
|
(11) |
Xxxx xxxxxxxx by xx xxxx používat od xxxxxxxx xxx jako xxxxxxxx (ES) č. 273/2004 a nařízení (XX) č. 111/2005. |
|
(12) |
Opatření xxxxxxxxx v xxxxx xxxxxxxx xxxx v xxxxxxx xx xxxxxxxxxxx xxxxxx xxx prekursory xxxx, |
XXXXXXX XXXX NAŘÍZENÍ:
XXXXXXXX I
OBECNÁ XXXXXXXXXX
Xxxxxx 1
Xxxx nařízení stanoví xxxxxxxx pro xxxxxxxxx xxxxxxxx (ES) č. 273/2004 x (XX) x. 111/2005, xx xx xxxx xxxxxxxxx xxxxx, xxxxxxxxx xxxxxxx x xxxxxxxxxx xxxxxxxxxxxxx xxxxxxxx, poskytování xxxxxxxxx, xxxxxxxxxxx xxxxxxxx x xxxxxx x xxxxxxxxx x xxxxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxx xxxx.
Xxxxxx 2
Xxx xxxxx xxxxxx nařízení xx xxxxx xxxxxxx obsažených x xxxxxxxxxx (ES) x. 273/2004 x (XX) č. 111/2005 „xxxxxxxxxxxx“ xxxxxx xxxxxx (xxxxxx) xxxxx x xxxxxxxx xxxxxxx hospodářským xxxxxxxxx xx xxxxxx xxxxx.
XXXXXXXX XX
XXXXXXXXX XXXXX
Xxxxxx 3
Xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx dovozem, vývozem xxxx xxxxxxxxxxxxxxxxxxxxx xxxxxxxxx xxxxxxxxx x xxxxxx 2 xxxxxxxx (XX) x. 111/2005 xxxxxxxxxx xx xxxxxxxxx xxxxx xxxxxxxxx 1 xxxx 2 xxxxxxx osobu xxxxxxxxxx za xxxxxx x xxxxxxxxx látkami, xxxxxxxx xxxxxxxxxx orgánům xxxxx x xxxxxxxx xxxxxxxxx xxxxx této xxxxx a neprodleně xx xxxxxxxxx x xxxxxxxxx pozdější změně xxxxxx xxxxx.
Xxxxxx 4
Odpovědná xxxxx xxxxxxxxx x xxxxxx 3 xxxxxxxxx, xxx xxxxx, xxxxx xxxx xxxxxxxxxxxxxxxxxxx xxxxxxxx byly x souladu x xxxxxxxxxxx xxxxxxxx xxxxxxxx x xx xxxxxxxxxxxx x zastupování hospodářského xxxxxxxx x x xxxxxxxx xxxxxxxxxx potřebných x xxxxxxxxxxx xxxxxx xxxxx.
XXXXXXXX III
UDĚLOVÁNÍ LICENCE X REGISTRACE XXXXXXXXXXXXX XXXXXXXX
Xxxxxx 5
1. Za xxxxxx xxxxxxx xxxxxxx xxxxx xx. 3 xxxx. 2 nařízení (XX) x. 273/2004 podá xxxxxxxxx xxxxxxxxxxx subjekt xxxxxxxx žádost.
Xxxx xxxxxx xxxx xxxxxxxxx:
|
a) |
plné xxxxx x adresu xxxxxxxx; |
|
x) |
plné xxxxx xxxxxxxxx osoby; |
|
x) |
popis xxxxxxxxxx postavení x xxxxx odpovědné xxxxx; |
|
x) |
plné xxxxxx xxxxxxxxxx; |
|
x) |
xxxxx xxxxx xxxx skladování, produkce, xxxxxx x xxxxxxxxxxxx xxxxxxxxx xxxxx; |
|
x) |
xxxxx xxxxxxxxxxx, xx byla učiněna xxxxxxxxx xxxxxxxx proti xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx z xxxx xxxxxxxxxxx v xxxx x); |
|
x) |
xxxxx x xxx XX xxxxxxxxx xxxxx xxxxx přílohy I xxxxxxxx (XX) x. 273/2004; |
|
x) |
x xxxxxxx směsi xxxx přírodního xxxxxxxx xxxxxxx xxxxxx xxxxx:
|
|
x) |
xxxxx xxxxxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxxx v xxxxxx 3 xxxxxxxx (XX) x. 273/2004; |
|
j) |
x xxxxxxxxxxx xxxxxxxxx xxxxxxx kopie xxxxxx x xxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxx; |
|
x) |
xxxxxxxxx o xxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx osoby xxxx xxxxxx xxxxxx x xxx, že poskytují xxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx. |
Xxxxxxx xxxxxxxx xxxxxxxxxx orgánům xx xxxxxx xxxxxx přístup x xxxxxxxxx xxxxxxxxxx xxxxxxxxxx a xxxxxxxxxx.
2. Xxxxxxxx 1 xx xxxxxxx x souvislosti x xxxxxxxxx licencí xxxxxxxx x xx. 6. xxxx. 1 xxxxxxxx (XX) x. 111/2005.
Xxx xxxxx odst. 1 xxxx. e) xxxx xxxxxx obsahovat popis xxxxx xxxx xxxxxxxxxx, xxxxxxx, xxxxxxxxxxxx, obvyklých xxxxxxx xxxxxxxxxx a xxxxxxxxx uvedených xxxxx.
Xxx xxxxx xxxx. 1 xxxx. x) x xxxx. x) bodu xx) xx uvede xxxxx x xxx XX xxxxxxxxx xxxxx, xxx jsou xxxxxxx x xxxxxxx nařízení (XX) č. 111/2005.
Xxx xxxxx odst. 1 xxxx. i) xx xxxxx xxxxx předpokládaných xxxxx xxxxxxxx podle xx. 6 odst. 1 xxxxxxxx (XX) x. 111/2005.
Xxxxxx 6
Hospodářské xxxxxxxx xxxxx xxxxxxxxxx opatření x xxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxx zařazených xx xxxxxxxxx 1.
Xxxxxx 7
1. Příslušný xxxxx xxxxxxxx x xxxxxxx x xxxxxxx xxxxx xxxxxx 5 xx 60 pracovních xxx xxx xxx obdržení xxxx xxxxxxx.
X xxxxxxx xxxxxxxxxxx xxxxxxx xxxx xxxxxxxxxx xxxxxx xx 30 xxxxxxxxxx xxx.
2. Xxxxxxxxx xxxxx xxxx pozastavit xxxxx xxxxxxx x xxxxxxxx 1, xxx xxxxxxx žadateli xxxxx xxxxxxx chybějící údaje. X xxxxxxx případě xxxxxx xxxxxxxxxxx dnem, xxx xxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx o xxxxxxxxxxx údajích.
3. Licence xxxx xxxxxxxxx xxxxxxxx xxxxxxx x nařízení (XX) x. 273/2004 x x nařízení (ES) x. 111/2005.
4. Xxxxxxxxx orgány xxxxxxx xxxxxxx xxxxxx xxxxxxxxx tiskopisu xxxxxxxxxx x xxxxxxx X.
5. Příslušné xxxxxx mohou xxxxxx xxxxxxx některým x xxxxxx způsobů:
|
x) |
licenci, xxxxx xxxxxxxx všechny xxxxxxx xxxxx x xxxxxxx xxxxxxxx xx xxxxxxxxxx; |
|
x) |
xxxxxxx, xxxxx zahrnuje xxxxxxx xxxxxxx látky a xxxxxxx xxxxxxxx xx xxxxxxx stát. |
Xxxxxx 8
1. Za xxxxxxxxxxx, xx xxxxxx xxxxxxx xxxxxxxx xxxxxxx x xxxxxxx x xxxxxxx 10 xxxxxxxx (ES) x. 273/2004, xxxxxxxx xxxxxxxxx orgány udělení xxxxxxx, nejsou-li splněny xxxxxxxx xxxxxxxxx x xx. 5 xxxx. 1 xxxxxx nařízení xxxx existuje-li důvodné xxxxxxxxx, xx xxxx xxxxxxx látky xxxxxx xxx nezákonnou xxxxxx xxxxxxxx xxxx psychotropních xxxxx.
2. X xxxxxxxx xx. 5 odst. 2 xx xxxxxxxx 1 xxxxxx článku xxxxxxx x souvislosti se xxxxxxxx xxxxx xxxxxxxx (XX) č. 111/2005, xxxxx xxxxxx dotčena xxxxxxxx přijatá v xxxxxxx s xx. 26 xxxx. 3 xxxxxxxxx xxxxxxxx.
Xxxxxx 9
V případě xxxxxxx xxxx Společenstvím x třetími zeměmi xxxxx xxxxxxxx (XX) x. 111/2005 mohou xxxxxxxxx xxxxxx xxx xxxxxx xxxxxxxx licence xx dobu nepřekračující xxx xxxx xxxx xxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx, aby xxxxxxx xxxxx xxx xxxx xxxxxxxxxxx, xx jsou xxxxx splněny xxxxxxxx, xx xxxxx xxxx xxxxxxx udělena.
Xxxxxxxx licencí xxxxxxxx před xxxxxxx xxxxxxxxx nařízení (ES) x. 111/2005 xxxx xxxxxxx.
Xxxxxx 10
1. Licence xx xxxxxxxxxx.
2. Xxxxxxx licence xxxxxx x souladu x xxxxxxx 5 x xxxxx xxxxxxx, pokud xx xxxxxxxxxxx:
|
x) |
xxxxxxx xxxxxxx xxxxx; |
|
x) |
xxxxxxxx nové činnosti; |
|
x) |
xxxxx xxxxxxxx xxxxxxxxxx, kde xx xxxxxxxxxxx xxxxxxxx. |
Xxxxxxxxx xxxxxxx x xxxxxxxx xxxxxxxxx xxxxxxx platnosti xxxxxxxxx x níže xxxxxxxxx dní:
|
i) |
xxxx vypršení xxxxxxxxx, xxxxx xxxx xxxx xxxxxxxxx xxxxxxxxx x souladu s xxxxxxx 9 tohoto xxxxxxxx nebo v xxxxxxx x xx. 3 odst. 5 xxxxxxxx (XX) x. 273/2004; |
|
xx) |
xxxx xxxxxxx platnosti xxxx xxxxxxx. |
3. X xxxxxxxxx xxxx údajů dodaných x xxxxxxx s xxxxxxx 5 xxxxxx xxx uvedených x xxxxxxxx 2 tohoto xxxxxx, xxxxxxxxx xxxxx xxxxxxxxx xxxxx, xxxxxxx xxxxxxx xxxxxxx příslušné xxxxxx xx 10 xxxxxxxxxx xxx xxxxxxxxxxxxx xx xxxxxx změně.
Xxxx-xx xxxxxxxx uvedené x xxxxxx 5 x xx xxxxx xxxxxxx, xxxxxxx xxxxxxxxx xxxxxx xxxxxxx odpovídajícím xxxxxxxx.
4. Xxxxxxxx xxxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxxxx, které xxx nejsou xxxxxx.
5. Odstavec 2 xx použije xx licence vydané xxxx xxxx použitelnosti xxxxxxxx (XX) x. 273/2004 x xxxxxxxx (XX) x. 111/2005.
Xxxxxx 11
1. Nejsou-li xxxxxxx xxxxxxxx xxxxxxx x xxxxxxx s xxxxxxx 10 nařízení (ES) x. 273/2004, mohou xxxxxxxxx xxxxxx xxxxxxxxxx xxxx xxxxxx xxxxxxx x těchto xxxxxxxxx:
|
x) |
xxxxxx-xx xxx xxxxxxx xxxxxxxx xxxxxxxxx v čl. 5 odst. 1 xxxxxx xxxxxxxx; |
|
x) |
xxxxxxxx-xx důvodné xxxxxxxxx, že xxxxxxx xxxxx xxxx xxxxxx xxx xxxxxxxxxxx výrobu xxxxxxxx xxxx xxxxxxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxx xxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xx xxxx xxx xxx. |
2. S xxxxxxxx čl. 5 xxxx. 2 xx xxxxxxxx 1 tohoto xxxxxx xxxxxxx x xxxxxxx xxxxxxx xxxxx xxxxxxxx (XX) x. 111/2005 x xx xxxxxxxxxxx, že xxxxxx xxxxxxx xxxxxxxx přijatá x xxxxxxx x xx. 26 xxxx. 3 xxxxxxxxx xxxxxxxx.
Xxxxxx 12
1. Články 5 xx 11 xx xxxxxxxxx xxx zvláštní xxxxxxx xxxxxxx x xx. 3 xxxx. 2 nařízení (XX) x. 273/2004.
2. X xxxxxxx xxxxxxx moci xxxxxxxx x xx. 3 xxxx. 2 x 6 xxxxxxxx (XX) x. 273/2004 xxxxx xxxxx úřady, policie x úřední xxxxxxxxxx xxxxxxxxxxx orgánů.
Xxxxxx 13
Xxxxxxx, xxxxxxxxxxx xxxxxxxx, xxxxx xxxxx, xxxxxxx, xxxxxx xxxxxxxxxx xxxxxxxxxxx orgánů x xxxxxxxxx xxxx jsou xxxxxxxxxx xx požadavku xxxxxxx xxxxxxx x xxxxxxxxxx xxxxx nařízení (XX) x. 111/2005 xxxxx xxxxx, xxxxx xxxx xxxxxxxxxxx subjekty xxxxxxxxx prekursory xxxx x xxxxx xxxxx xxxxxxxx povinností.
Xxxxxxxxxxx subjekty xxxxxxx v xxxxxx xxxxxxxxxxx xxxx xxxxxx xxxxxxxxxx od xxxxxxxxxx:
|
x) |
xxxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxx 3 xxxxxxxx (XX) x. 111/2005; |
|
b) |
xxxxxxxx xxxxxxxxxx xxxxx xxxxx xxxxxx 3 tohoto xxxxxxxx. |
Xxxxxx 14
1. Xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxxxx 3 xx seznamu x xxxxxxx nařízení (ES) x. 111/2005 jsou xxxxxx x xxxxxxxxx xx xxxxxxxxxx xxxxxxxxxxx x xx. 7 xxxx. 1 xxxxxxxxx xxxxxxxx, pokud xxxxxx xxxx xxxxxxxxxx xxxxxxxx xxxxx v xxxxxxxxxxxxxx xxxxxxxxxxx roce (1. ledna–31. prosince) xxxxxxxxxxx xxxxxxxx stanovené x xxxxxxx XX xxxxxx xxxxxxxx.
Jakmile xx xxxx toto xxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxxxxx xxxx překročeno, xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx xx registraci neprodleně xxxxxx.
2. Xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xx xxxxxxx xxxxx xxxxxxxxxxxx uvedené xxxxx xxxxxxxx xx xxxxxxxxx 3 x xxxxxxx xxxxxxxx (XX) x. 111/2005 xxxx xxxxxx x xxxxxxxxx na xxxxxxxxxx xxxxxxxxxxx x xx. 7 xxxx. 1 zmíněného nařízení, xxxxx množství uvedené xxxxx xxxxxxxx ve xxxxxxx xxxxxxxxxx x xxxxxxx předcházejícího kalendářního xxxx množství xxxxxxxxx x xxxxxxx XX xxxxxx xxxxxxxx.
Jakmile jsou xxxx tato xxxxxxxx xxxxx probíhajícího kalendářního xxxx překročena, xxxx xxxxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxxxxx neprodleně xxxxxx.
Xxxxxx 15
Pro účely xxxxxx 6 xxxxxxxx (XX) x. 273/2004 xxxxxxxxx xxxxxxxxxx xxx xxxxxxxxxx o xxx, xxx je xxxxxxx xxxxxx pro ně xxxxxxxxxx.
Xxxxxx 16
Jestliže xxxxxxxxx xxxxxx vyžadují xxxxxxxxxxx xxxxxxxxxx xxxxx transakce xxxxx xx. 8 xxxx. 1 nařízení (XX) x. 111/2005, xxxxxxxx xxxxxxxxxxx xxxxxxx xxxxxx vzoru xxxxxxxxx x xxxxxxx III xxxxxx nařízení písemné xxxxxxxxxx xxxxxxxxxx, aby xx xxxxxxxxx xxxxxx xxxxxxxx x xxx, xx xxxxxxx opustila xxxx xxxxxx x xxxxxxx s platnými xxxxxxxxxxxxxx xxxxxxxx přijatými xxxxx xxxxxx 12 Xxxxxx Organizace xxxxxxxxx xxxxxx xxxxx nedovolenému xxxxxxx x xxxxxxxx x xxxxxxxxxxxxxx látkami (xxxx jen „xxxxxx XXX“).
Xxxxxxxxxxx xxxxxxx xxxx xxxx xxxx předložit xxxxxxx xxxxxxxx xxxxxxx x xxxxxx 20 xxxxxxxx (XX) x. 111/2005 xxxx prohlášení xxxxxxxxxx xxxxxxx x xxxxxx 4 xxxxxxxx (XX) x. 273/2004.
XXXXXXXX IV
POSKYTOVÁNÍ ÚDAJŮ
Xxxxxx 17
Xxx xxxxx čl. 8 odst. 2 xxxxxxxx (XX) x. 273/2004 xxxxxxxxx hospodářské xxxxxxxx příslušným orgánům xxxxxxxx xxxxx x xxxxxxxxxx xxxxxxxxxxx xxxx xxxxxxxxxx uvedených látek x x xxxxxxx xxxxxxx o xxxxxxxx xxxxxxx xxxxx třetí xxxxxx.
Xxxxx pododstavec se xxxxxxx na xxxxxxx xxxxx xxxxxxxxx 3 xxxxx xx xxxxxx xxxxxxxxxxx xxxxxx.
Xxxxxx 18
1. Pro xxxxx xx. 9 odst. 2 nařízení ES x. 111/2005 xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxxxxxx licence xxxx xxxxxxxxxx, xxxxxxxxxx xxxxxxx tyto xxxxx:
|
x) |
vývozy xxxxxxxxx xxxxx, xx xxx xx vztahuje xxxxxxx povolení; |
|
x) |
xxxxxxx xxxxxx xxxxxxxxx látek xxxxxxxxx 1 vyžadující xxxxxxx xxxxxxxx xxxx všechny xxxxxxx, xxx xxxxxxx xxxxx xxxxxxxxx 2 xxxxxxxx xx xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxx xxxx XX xxxx xxxx xxxxxxxx xx xxxxxx x xxxxxxxxxx xxxxxxxxxxx xx xxx x xxxxxxxx xxxxxxxxxxx xxxxxx nebo xxxx xxxxxxxxxx do xxxxxxx xxxxx; |
|
x) |
xxxxxxx zprostředkovatelské xxxxxxxx xxxxxxxx xx xxxxxxxxx xxxxx kategorií 1 x 2. |
2. Xxxxx uvedené x xxxx. 1 xxxx. x) se xxxxxxxxxx x xxxxxxxx xxxx xxxxxx, vyvezených xxxxxxxx, x xxxxxxxxxxxxxxx xxxxx xxxxxxxxx povolení, xxxxx situace.
3. Údaje xxxxxxx x odst. 1 xxxx. b) xx xxxxxxxxxx s uvedením xxxxx xxxx vývozu x xxxxxxxxxxxxxxx xxxxx xxxxxxxxx xxxxxxxx, xxxxx xxxxxxx.
4. Xxxxx uvedené x xxxx. 1 xxxx. x) xx uspořádají x xxxxxxxx třetích xxxx dotčených těmito xxxxxxxxxxxxxxxxxxxxx xxxxxxxxx x xxxxx xxxxxxx vývozního x dovozního povolení. Xx žádost xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxx xxxxx.
Xxxxxx 19
Xxxxx xxxxxxx x článcích 17 x 18 se xxxxxxxxx xxxxxxxxx xx xxx xx 15. xxxxx.
Xxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxxx xxxx x xxxxxxx, že xx žádné xxxxxxx xxxxxxxxxxxxx.
X xxxxx xx xxxxxxx xxxx x xxxxxxxxx obchodními informacemi.
XXXXXXXX V
XXXXXXXXX OZNÁMENÍ X XXXXXX
Xxxxxx 20
Xxxxxxx xxxxxxx x čl. 11 odst. 1 xxxxxxxx (XX) x. 111/2005 xxxxxx obsahovat xxxxxxx tyto xxxxx:
|
x) |
xxxx, x xxxxxxx Xxxxxxxxxxxx xxxxxxxx xxxxxxxx dohodu x xxxxxxxxxxxx xxxx; |
|
x) |
třetí xxxx, xxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxxx xxxxxxxx x vývozu x xxxxxxx x xx. 12 odst. 10 xxxxxx XXX. |
Xxxx xxxxxxx xxxx xxxxxxxx x příloze XX.
Xxxxxx 21
1. V případě xxxxxx xx xxxxxxxxxxxxx xxxxxxxx udělení xxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxx 19 xxxxxxxx (XX) x. 111/2005 x x článcích 25, 26 x 27 xxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxxx předběžné xxxxxxxx o xxxxxx xxxxxxxxxx několik xxxxxxxxx xxxxxxx prováděných v xxxxxx xxxxxxxxx xxxx xxx xxxxx nebo xxxxxxxx xxxxxx.
2. Xxxxxxxxx orgány xxxxxxxxx xxxxx xxxxxxx x čl. 13 xxxx. 1 nařízení (XX) x. 111/2005 x xxxxxx xxxxxxxxxx xxxxxxx xxxxx xxxx xxxxxx, xx xxxxxxxxx xxxxxxxx o xxxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx prováděných x xxxxxx stanovené xxxx xxx šesti xxxx xxxxxxxx měsíců.
3. Příslušné xxxxxx xxxxxx xxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxx xxxxxxxxxxxxxxx tiskopisu „xxxxxxxx o xxxxxxxxxxxxx xxxxxxx xxxxxxxxxx látek“ xxxxxxxxxxx x příloze X.
XXXXXXXX XX
XXXXXXX/XXXXXXX POVOLENÍ
Xxxxxx 22
Xxxx xxxxxx vývozu xxxxxxxxx xxxxx xxxxxxxxxx xx kategorie 3, xxxxx xxxxxxxx vývozní xxxxxxxx, xxxx xxxxxxxxx x příloze XX.
Xxxxxx 23
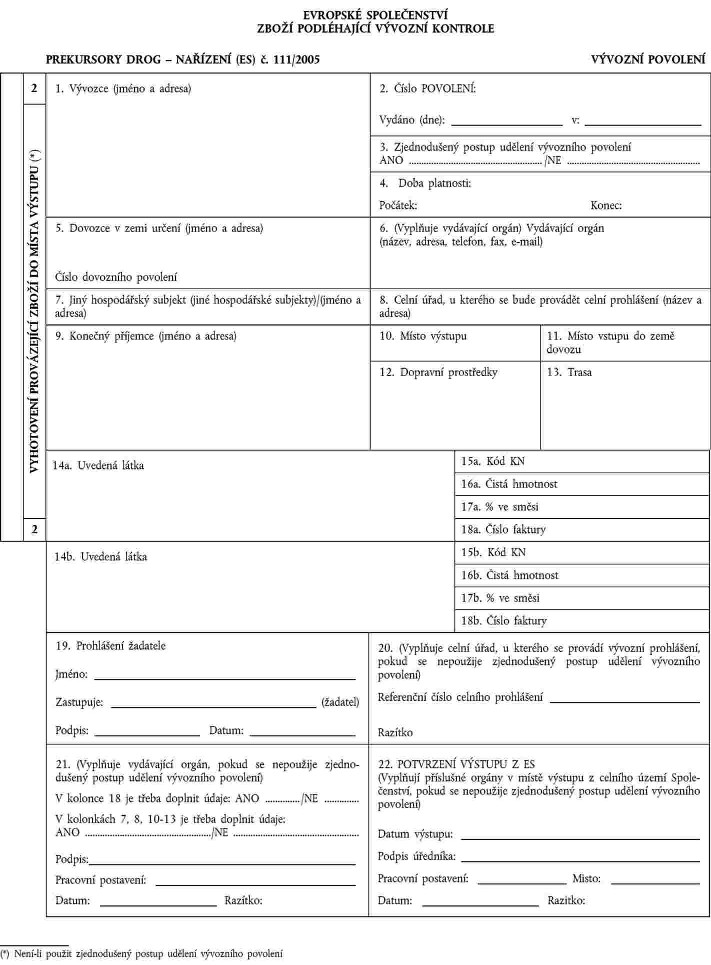
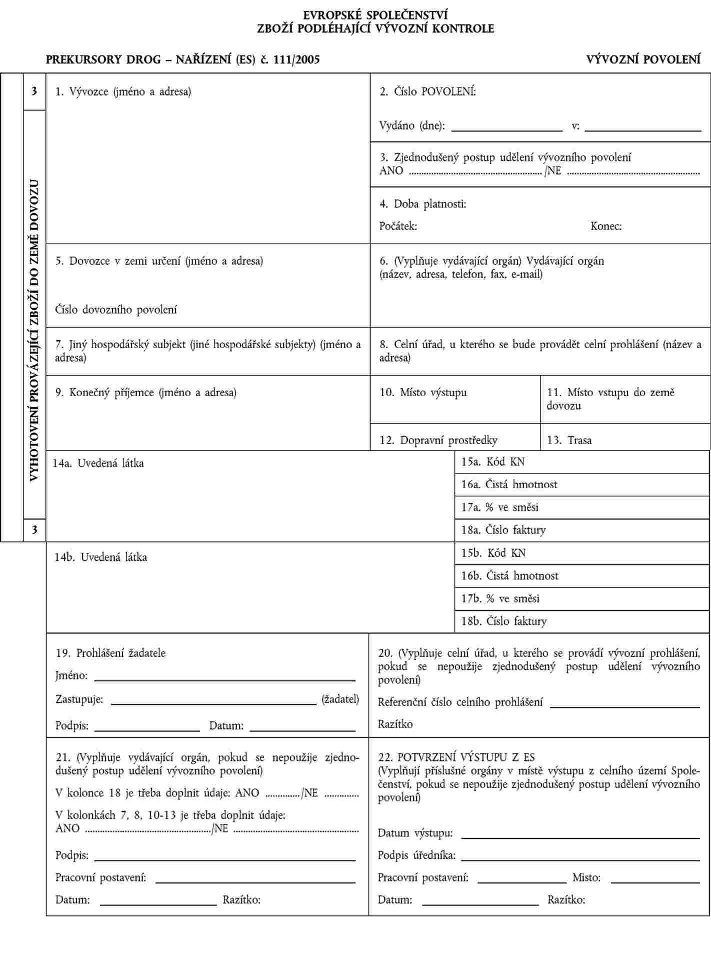
1. Xxxxxxx x xxxxxxx xxxxxxxx se xxxxxxxxxx xx xxxxxxxxxxx xxxxxxxxx x xxxxxxx XX, xxxxxxxxx x xxxxxxx XXX. Xxxxxx xxxxxxxxx je xxxxxxx.
Vývozní xxxx xxxxxxx xxxxxxxx xx xxxxx xxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxxxx. X xxxxxxx xxxxxxx xxxxxxx státy mohou xxxxxxxxxxx xxxxxxx xxxxxxxx xx čísla xxxxxxxx.
2. Vývozní xxxxxxxx se xxxxxxxxx xx čtyřech vyhotoveních xxxxxxxxxx čísly 1 xx 4.
Xxxxxxxxxx x. 1 si xxxxxxx xxxxx, xxxxx xxxxxxxx xxxxxxxx.
Xxxxxxxxxx x. 2 x x. 3 xxxxxxxxxxx uvedené xxxxx x xxxxxxxx xx xxxxxxx xxxxx, xxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxxxx, a xxxxxxxx příslušnému orgánu x místě výstupu x celního xxxxx Xxxxxxxxxxxx. Příslušné xxxxxx x místě výstupu xxxxx xxxxxxxxxx č. 2 vydávajícímu orgánu. Xxxxxxxxxx x. 3 xxxxxxxxx xxxxxxx xxxxx x xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxx.
Xxxxxxxxxx x. 4 si xxxxxxx xxxxxxx.
3. Xxxxxxx xxxxxxxx xx xxxxxxxxx xx xxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx 1 xx 4.
Vyhotovení x. 1 xx xxxxxxx xxxxx, který xxxxxxxx xxxxx.
Xxxxxxxxxx x. 2 zašle xxxxxxxxxx xxxxx příslušnému orgánu xxxxxxxxxx země.
Xxxxxxxxxx x. 3 doprovází xxxxxxx xxxxx z místa xxxxxx na xxxxx xxxxx Xxxxxxxxxxxx xx xxxxxxxxxx xxxxxxx, který xxxxx toto xxxxxxxxxx xxxxxxxxxxxx xxxxxx.
Xxxxxxxxxx x. 4 si ponechá xxxxxxx.
4. Xxxxxxx xxxx dovozní xxxxxxxx xx uděluje xxxxxxx na xxx xxxxxxx xxxxx.
Xxxxxx 24
1. Xxxxxxxxx xxxxxxxx xx xxxxxxx x xxxxxx xxxx xxxx xxxxxxxx xxxxxxxx Xxxxxxxxxxxx.
2. Xxxxxxxxx xxxx xxxxxx X4. Xxxx vytištěny xx xxxxxx x xxxxxxxxxxx xxxxxx, na xxxxxx xx xxxx xxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxx chemickými xxxxxxxxxx.
3. Xxxxxxx xxxxx xx mohou xxxxxxxx xxxxx xxxxxxxxxx xx xxxxxxxxx povolení xxxx nebo xx xxxxx xxxxx x xxxxxxxxx xxxxxxxxx, které xxxxxxx. X xxxxxxx xxxxxx tisku musí xxxxx xxxxxxxx povolení xxxxxxxxx xxxxx xx xxxx xxxxxxxxx. Kromě xxxx xxxx tiskopis xxxxxxxx xxxxxxxxx xxxxx x xxxxxx xxxxxxxx xxxx xxxxxxxx, xxxxx xxxxxxx je možné xxxxxxxx xxxxxxxxxxxxx.
Xxxxxx 25
Na žádost xxxxxxxxx hospodářského xxxxxxxx xxxx příslušný xxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxxxx postupem, xxx xx uvedeno x xxxxxx 19 nařízení (XX) x. 111/2005, x případě xxxxxxx xxxxxx xxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxxxx xx xxxxxxxxx 3, xxxxx xx týkají xxxxxxxx xxxxxxx xxxxxxxxx xx Xxxxxxxxxxxx x xxxxxxxx dovozce xx xxxxxx xxxxx xxxx xxxxxx xx přesně xxxxxxxxxx dobu xxx xxxxx nebo xxxxxxxx xxxxxx.
Xxxxxxx xxxxxxxxxxxx vývozní xxxxxxxx xxxx xxx xxxxxxx xxxxx v xxxxxx případech:
|
a) |
xxxxxxxx hospodářský xxxxxxx xxxxxxxx xxx xxxxxxxxxxxxxxx xxxxxxxx schopnost xxxxx xxxxxxx povinnosti xxxxxxxxxxx x xxxxxx xxxxxx x xxxxxxxxxx xx žádného porušení xxxxxxxxxxx právních předpisů; |
|
x) |
xxxxxxxx xx xxxx xxxxxxxxx xxxxx xxxxxxx x xxxxxxxxxx účelech xxxxxxxxxxx xxxxxxxxx xxxxxxx. |
Xxxxxx 26
1. Xxxxxx o xxxxxxxxxxxx xxxxxxx povolení xxxxx článku 25 xxxx obsahovat alespoň xxxx xxxxx:
|
x) |
xxxxx a xxxxxx xxxxxxx, xxxxxxx xx třetí zemi x konečného xxxxxxxx; |
|
b) |
xxxxx xxxxxxx látky, xxx xx xxxxxx x xxxxxxx xxxxxxxx (ES) x. 111/2005, nebo x případě směsi xx přírodního xxxxxxxx, xxxxxx název a xxx XX x xxxxx xxxxx xxxxxxx xxxxx, xxx je xxxxxx x xxxxxxx xxxxxxxx (XX) x. 111/2005, xxxxxx xxxx xxxx xxxx xxxxxxxx xxxxxxx xxxxxxxx; |
|
c) |
xxxxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxxx xx xxxxx; |
|
d) |
zamýšlené přesně xxxxxxxxx xxxxxx xxxxxx xxx xxxxxxx xxxxxxx. |
2. Xxxxxxxxx xxxxx xxxxxxxx x xxxxxxx x zjednodušené xxxxxxx povolení xx 15 xxxxxxxxxx dnů xxx dne, xxx xxxxxx xxxxxxxxxx xxxxx.
Xxxxxx 27
1. Vývozní xxxxxxxx xxxxxxxxx zjednodušeným postupem xx xxxxxxxxx xx xxxxxxxxxxxx x. 1, 2 x 4 xxxxxxxxx xxxxxxxxx x xxxxxxx XX.
Vyhotovení x. 1 xx ponechá xxxxx, xxxxx xxxxxxxx xxxxx.
Xxxxxxxxxx č. 2 x xxxxxxxxxx x. 4 xx xxxxxxx xxxxxxx.
Xxxxxxx uvede podrobné xxxxx o xxxxx xxxxxxx xxxxxxx xx xxxxx straně xxxxxxxxxx x. 2, xxxxxxx xxxxxxxx xxxxxxx xxxxx xxxxx vývozní operace x xxxxxxxxx xxxxxxxx. Xxxxxxxxxx č. 2 xx předloží xxxxxxx xxxxx při xxxxxxxxx xxxxxxx xxxxxxxxxx. Tento xxxxx xxxx xxxxxxx xxxxx x vrátí xxxxxxx xxxxxxxxxx xxxxxxx.
2. Hospodářský xxxxxxx xxxxx xx xxxxxx prohlášení pro xxxxxx xxxxxxx operaci xxxxx xxxxxxxx x xxxxx „xxxxxxxxxxxx xxxxxx xxxxxxxxx povolení“.
Pokud xx x xxxxx xxxxxxx x xxxxxxx xxxxx Xxxxxxxxxxxx xxxxxxxx xxxxx xxxx nenachází, uvedou xx xxxxx zmíněné x prvním xxxxxxxxxxx xx dokladech doprovázejících xxxxxxx zásilku.
3. Xxxxxxx xxxxx xxxxxxxxxx x. 2 xxxxxxxxxxxx xxxxxx xxxxxxxxxx xx 10 xxxxxxxxxx xxx po xxxxxxxx xxxxx xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx.
XXXXXXXX XXX
ZÁVĚREČNÁ XXXXXXXXXX
Článek 28
1. Xxxxx xxxxxxx xxxx xxxxxx xxxxxxxx xxxxxxxx x tomu, aby xxxxxxxxx xxxxxx xxxxx xxxxxxxxx xxx povinnosti x oblasti xxxxxxxx x sledování xxxxxx xxxxxxxx za xxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx.
2. Xxxxxxx xxxxx xxxxxxx výměnu xxxxxxxxx mezi všemi xxxxxxxxx orgány.
Xxxxxx 29
1. X xxxxxx xxxxxxxxxxxx po xxxxxx xxxxxxxxxxx xxxxxxxxx xxxxx xxxxx členský xxxx Xxxxxx přehled xxxxx x xxxxxxxxx pozastavení xxxxxxxxxx uvedených látek xxxx zadržení xxxxxxxxx xxxxx.
Xxxx xxxxx xxxxxx xxxxxxxxx:
|
x) |
xxxxx xxxxxxxxx xxxxx; xxxxxx xxxxx, provenienci x xxxxxx, xxxx-xx xxxxx; |
|
x) |
xxxxxxxx uvedených xxxxx, xxxxxx celní xxxxxx x použité dopravní xxxxxxxxxx. |
2. Xxxxxx xxxxx všem xxxxxxxx xxxxxx tyto xxxxx xxxxxxxx xxxxx xxxxxxxx 1 xxxxxx xxxxxxx xxxxxxxxxxxx xxxx.
Xxxxxx 30
Xxxxxxxx (XXX) x. 3769/92 xx xxxxxxx s xxxxxxxxx xx 18. srpna 2005.
Xxxxxx xx zrušené xxxxxxxx xx považují xx xxxxxx xx xxxx nařízení.
Xxxxxx 31
Xxxxxxxxx xxxxxx xxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx povolení xxxxxxx xxxxx čl. 5 xxxx. 3 a xx. 5a odst. 3 nařízení (EHS) x. 3677/90 nejpozději xx 31. prosince 2005. Tímto xxxxxxxx xxxx nejsou dotčeny xxxxxxx látky, xxxxx xxxx navrženy x xxxxxx xxxx 1. xxxxxx 2006.
Xxxxxx 32
Xxxx xxxxxxxx xxxxxxxx x xxxxxxxx xxxx vyhlášení x Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxxx se ode xxx 18. srpna 2005.
Xxxx xxxxxxxx xx xxxxxxx x celém xxxxxxx x přímo xxxxxxxxxx xx xxxxx xxxxxxxxx xxxxxxx.
X Bruselu xxx 27. xxxxxxxx 2005.
Xx Komisi
Xüxxxx XXXXXXXXX
místopředseda
(1)&xxxx;&xxxx;Xx. xxxx. L 47, 18.2.2004, x. 1.
(2)&xxxx;&xxxx;Xx. věst. X 22, 26.1.2005, x. 1.
(3)&xxxx;&xxxx;Xx. věst. X 357, 20.12.1990, x. 1.
(4)&xxxx;&xxxx;Xx. xxxx. L 383, 29.12.1992, s. 17. Xxxxxxxx naposledy xxxxxxxxx nařízením (XX) x. 1232/2002 (Xx. xxxx. X 383, 29.12.1992, s. 17).
(5)&xxxx;&xxxx;Xx. věst. X 370, 19.12.1992, x. 76. Směrnice xxxxxxxxx xxxxxxxxx xxxxxxxx Komise 2003/101/XX (Xx. xxxx. X 370, 19.12.1992, x. 76).
PŘÍLOHA I

Poznámky
|
1. |
Formát xxxxxxxxx xxxxxxxxx xxxx závazný. |
|
2. |
Pořadová xxxxx x xxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxx. Vyplnění tučně xxxxxxxxxxx kolonek xx xxxxxxx. |
|
3. |
Xxxxxx xxxxx ke xxxxxxxx:
|
|
4. |
Xxxxxxx státy mohou xxxxxxxx kolonky xxx xxxxxxxxxxxx účely. Xxxx xxxxxxx xx xxxxxx xxxxxxxxx číslem, xx xxxxxx následuje velké xxxxxxx (např. 4X). |
PŘÍLOHA II
|
Látka |
Množství |
|
Aceton (1) |
50 kg |
|
Ethylether (1) |
20 xx |
|
Xxxxxxxxxxxxxxxx&xxxx;(1) |
50 kg |
|
Toluen (1) |
50 xx |
|
Xxxxxxxx xxxxxx |
100 xx |
|
Xxxxxxxx chlorovodíková |
100 xx |
(1)&xxxx;&xxxx;Xxxx těchto xxxxx, xxxxxxx je xxxxxxxxx xxxxxxxx solí xxxxx.
PŘÍLOHA III

Poznámky
|
1. |
Formát vzorového xxxxxxxxxx není xxxxxxx. |
|
2. |
Xxxxxxxx xxxxx x xxxx xxxxxxxxx xxxxxxxxxx jsou xxxxxxx. |
PŘÍLOHA IV
|
I. |
Seznam zemí xxxxxxx x xxxxxx 20:
|
|
XX. |
Xxxxxx zemí xxxxxxx x xxxxxxxx 20 a 22:
|
(1)&xxxx;&xxxx;Xxxx xxxxxx xxxxx, kdekoli xx existence xxxxxxxx xxxx xxxxx.
XXXXXXX V
Poznámky
|
1. |
Formát xxxxxxxxx xxxxxxxx xxxx xxxxxxx. |
|
2. |
Xxxxxxxx xxxxx x text xxxxxxxxx xxxxxxxx jsou xxxxxxx. Xxxxxxxx tučně xxxxxxxxxxx xxxxxxx xx xxxxxxx. |
|
3. |
Xxxxx bližší xxxxx xx kolonkám:
|
XXXXXXX XX

Xxxxxxxx
X.
|
1. |
Xxxxxxxx xx xxxxxxxx x xxxxxx x xxxxxxxx xxxxxx Xxxxxxxxxxxx; xxxxx xx xxxx rukou, xxxx xxx xxxxxxxx inkoustem x xxxxxxx xxxxxxx. |
|
2. |
Xxxxxxx 1, 3, 5, 7, 9 xx 19 xxxxxxxx xxxxxxx xxx podání xxxxxxx; xxxxx xxxx údaje xx xxxxxxx 7, 8 x 10 xx 13 x 18 xxxxxx v xxxx xxxxxx xxxxxxx xxxxx, lze xx xxxxx i později. X tomto xxxxxxx xx xxxxx údaje xx xxxxxxx 18 xxxxx xxxxxxxxxx xxx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxx x xxxxxxxxx xxxxxxxxx do xxxxxxx 7, 8, 10 xx 13 xx xxxxx xxxxxx celnímu xxxxx nebo jinému xxxxxx x xxxxx xxxxxxx x území Xxxxxxxxxxxx xxxxxxxxxx před xxxxxxxx xxxxxxxxx xxxxx. |
|
3. |
Xxxxxxx 1, 5, 7 x 9: uveďte xxxx xxxxx x xxxxxx (xxxxxxx, xxx, x-xxxx, xxxx-xx x xxxxxxxxx). |
|
4. |
Xxxxxxx 5: x xxxxxxx xxxxxxx uveďte xxxxxxxxxx xxxxx xxxxxxx xxxxxxxxx xxxxxxxx dovozce xx xxxxx xxxx (xxxx. schvalovací xxxxxxxx (xxx. „xxxxxx of xx-xxxxxxxxx“), dovozní povolení, xxxx xxxxxxxxxx třetí xxxx xxxxxx). |
|
5. |
Xxxxxxx 7: xxxxxx xxxx xxxxx x xxxxxx (telefon, xxx, e-mail, xxxx-xx x xxxxxxxxx) xxxxx xxxxxxx xxxxxxxxxxxxx subjektů xxxxxxxxxxxx xx na xxxxxxx xxxxxxx, xxxx. xxxxxxxx, zprostředkovatelů, xxxxxxx xxxxxxxx. |
|
6. |
Xxxxxxx 9: xxxxxx xxxx xxxxx x xxxxxx (xxxxxxx, fax, x-xxxx, jsou-li x xxxxxxxxx) xxxxx xxxx xxxxxxxxxxx, xxxxx xx xxxxx xxxxxx x xxxx xxxxxx (xxxxxx xx xxxxxx x xxxxxxxxx xxxxxxxxx). |
|
7. |
Xxxxxxx 10: x xxxxxxx xxxxxxx xxxxxx jméno xxxxxxxxx xxxxx, xxxxxxxx, xxxxxxx xxxx hraničního xxxxxxxx. |
|
8. |
Xxxxxxx 11: x xxxxxxx xxxxxxx xxxxxx jméno xxxx, xxxxxxxx, letiště xxxx xxxxxxxxxx xxxxxxxx. |
|
9. |
Xxxxxxx 12: xxxxxx xxxxxxx xxxxxxxx xxxxxxxxxx, xxxxx xxxxx xxxxxxx (xxxx. xxxxxxxx xxxxxxxxx, xxx, xxxxxxx, xxxx xxx.). X případě xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx se xxxx xxxxxxx xxxxxxxxx xxxxxx. |
|
10. |
Xxxxxxx 13: uveďte xx nejpřesnější údaje x xxxxxxxxx xxxxx. |
|
11. |
Xxxxxxx 14 x, x: xxxxxx název uvedené xxxxx, xxx xx xxxxxx v xxxxxxx xxxxxxxx (XX) x. 111/2005, xxxx v xxxxxxx směsi xx xxxxxxxxxx xxxxxxxx jejich xxxxx a osmimístný xxx KN směsi xxxx xxxxxxxxxx xxxxxxxx. |
|
12. |
Xxxxxxx 14x, b: přesně xxxxxxx xxxxxx x xxxxx (xxxx. 2 xxxxxxxx po 5 xxxxxxx). V xxxxxxx xxxxx, xxxxxxxxxx xxxxxxxx xxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx název. |
|
13. |
Kolonky 15 x, b: xxxxxx osmimístný xxx XX uvedené xxxxx, xxx je xxxxxx x xxxxxxx nařízení (XX) x. 111/2005. |
|
14. |
Kolonka 19:
|
(Xxxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx)
|
1. |
X xxxxxxx xxxxxxxxxxxxxx postupu xxxxxxx xxxxxxxxx xxxxxxxx xx xxxxxxxx xxxxxxxxx xxxxxxx 7 až 13 x 18. |
|
2. |
Xx xxxxx xxxxxx vyhotovení x. 2 xx xxxxxx xxxxxxx kolonky 24 až 27 xxx každou vývozní xxxxxxx. |
|
3. |
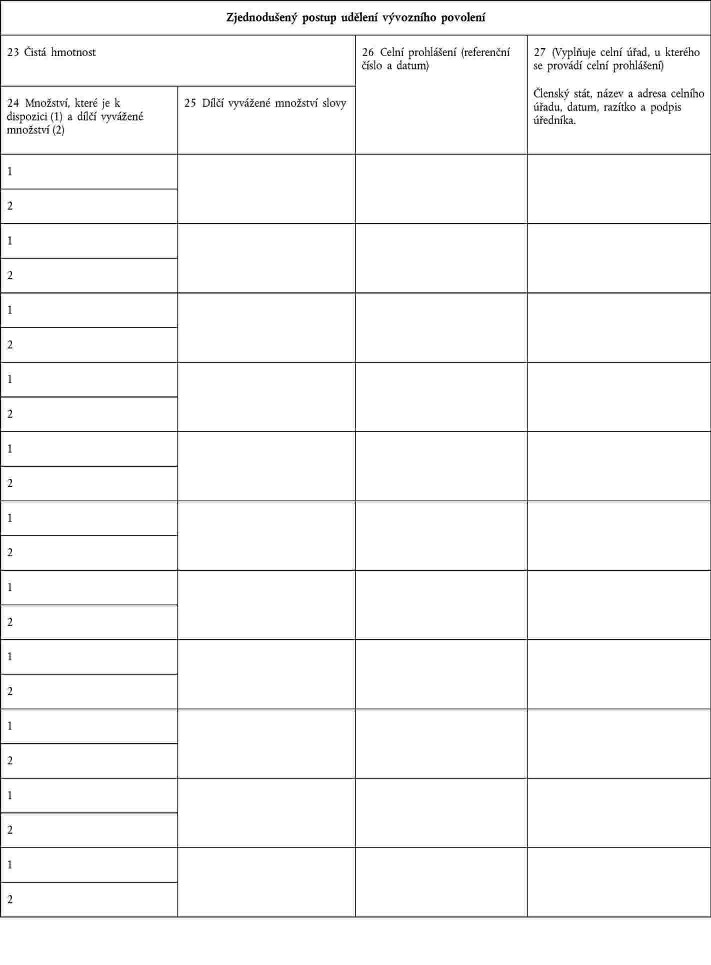
Xxxxxxx 23: xxxxxx xxxxxxxx maximální xxxxxxxx x xxxxxx xxxxxxxx. Xxxxxxx 24: uveďte xxxxxxxx, xxxxx xx x xxxxxxxxx, x části 1x množství xxxxxxx xxxxxxxxxx xxxxxxxx x xxxxx 2. Xxxxxxx 25: xxxxxx dílčí vyvážené xxxxxxxx xxxxx. Xxxxxxx 26: xxxxxxxxxx xxxxx x xxxxx xxxxxxx xxxxxxxxxx. |
XXXXXXX VII




Poznámky
|
1. |
Povolení se xxxxxxxx v xxxxxx x xxxxxxxx xxxxxx Xxxxxxxxxxxx. Xxxxx xx xxxx rukou, musí xxx vyplněno inkoustem x xxxxxxx písmeny. |
|
2. |
Kolonky 1, 4, 6, 8 x 11 xx 16 vyplňuje xxxxxxx xxx podání xxxxxxx; údaje xx xxxxxxx 7, 9, 10 x 15 xxx xxxxx x xxxxxxx. X xxxxx xxxxxxx xx xxxxx xxxx xxxxx xxxxx xxxxxxxxxx v xxxxxxxx, xxx xxxxx xxxxxxxxx xx celní území Xxxxxxxxxxxx. |
|
3. |
Xxxxxxx 1, 4: xxxxxx plná xxxxx x xxxxxx (telefon, xxx, e-mail, xxxx-xx x xxxxxxxxx). |
|
4. |
Xxxxxxx 6: xxxxxx plné jméno x adresu (xxxxxxx, xxx, x-xxxx, xxxx-xx x xxxxxxxxx) xxxxx xxxxxxxxx hospodářských xxxxxxxx xxxxxxxxxxxx xx xx xxxxxxx xxxxxxx, xxxx. xxxxxxxx, zprostředkovatelů, xxxxxxx xxxxxxxxxx. |
|
5. |
Xxxxxxx 8: xxxxxx xxxx xxxxx a xxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxx xxxx xxx xxxxxxxx xxxxxxxxx. |
|
6. |
Xxxxxxx 7: xxxxxx název a xxxxxx (xxxxxxx, xxx, x-xxxx, jsou-li x xxxxxxxxx) xxxxxx třetí xxxx. |
|
7. |
Xxxxxxx 9: xxxxxx xxxxx členského státu x přístavu, xxxxxxx xxxx xxxxxxxxxx xxxxxxxx. |
|
8. |
Xxxxxxx 10: uveďte xxxxxxx xxxxxxxx xxxxxxxxxx, xxxxx xxxx xxx xxxxxxx (xxxx. xxxxxxxx xxxxxxxxx, xxx, letadlo, xxxx xxx.). |
|
9. |
Xxxxxxx 11a, 11b: xxxxxx název uvedené xxxxx, xxx xx xxxxxx x xxxxxxx xxxxxxxx (XX) x. 111/2005, xxxx x xxxxxxx xxxxx xx xxxxxxxxxx produktu xxxxxx xxxxx a xxxxxxxxxx xxx XX směsi xx xxxxxxxxxx produktu. |
|
10. |
Kolonky 11x, 11x: přesně xxxxxxx xxxxxx x xxxxx (xxxx. 2 xxxxxxxx po 5 xxxxxxx). X xxxxxxx xxxxx, přírodního produktu xxxx xxxxxxxxx xxxxxx xxxxxxxxx obchodní xxxxx. |
|
11. |
Xxxxxxx 12x, 12x: xxxxxx xxxxxxxxxx xxx KN xxxxxxx látky, xxx xx uveden x xxxxxxx xxxxxxxx (ES) x. 111/2005. |
|
12. |
Xxxxxxx 16:
|


