XXXXXXXX XXXXXX (XX) x. 2074/2005
ze dne 5. prosince 2005,
xxxxxx xx stanoví xxxxxxxxx xxxxxxxx xxx některé xxxxxxx xxxxx nařízení Xxxxxxxxxx xxxxxxxxxx a Xxxx (ES) č. 853/2004 x pro xxxxxxxxxx úředních kontrol xxxxx nařízení Evropského xxxxxxxxxx a Xxxx (XX) č. 854/2004 x (XX) č. 882/2004, xxxxxx xx xxxxxxx odchylka xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) x. 852/2004 x xxxxxx xx xxxx xxxxxxxx (XX) x. 853/2004 x (ES) x. 854/2004
(Text x xxxxxxxx xxx EHP)
XXXXXX XXXXXXXXXX XXXXXXXXXXXX,
x ohledem xx Smlouvu x xxxxxxxx Xxxxxxxxxx xxxxxxxxxxxx,
s xxxxxxx na nařízení Xxxxxxxxxx xxxxxxxxxx x Xxxx (XX) č. 852/2004 ze xxx 29. dubna 2004 x xxxxxxx potravin (1), x zejména xx čl. 13 xxxx. 2 uvedeného xxxxxxxx,
x ohledem na xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Rady (XX) x. 853/2004 ze xxx 29. dubna 2004, xxxxxx xx xxxxxxx zvláštní hygienická xxxxxxxx xxx xxxxxxxxx xxxxxxxxxxx původu (2), x xxxxxxx na xxxxxx 9, 10 x 11 uvedeného xxxxxxxx,
x xxxxxxx xx xxxxxxxx Evropského parlamentu x Xxxx (XX) x. 854/2004 xx xxx 29. xxxxx 2004, xxxxxx xx xxxxxxx zvláštní xxxxxxxx xxx xxxxxxxxxx úředních xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx k xxxxxx xxxxxxxx (3), x zejména xx xxxxxx 16, 17 x 18 uvedeného xxxxxxxx,
x xxxxxxx xx xxxxxxxx Xxxxxxxxxx xxxxxxxxxx x Xxxx (ES) x. 882/2004 ze xxx 29. xxxxx 2004 x xxxxxxxx xxxxxxxxxx xx xxxxxx xxxxxxx dodržování xxxxxxxx xxxxxxxx xxxxxxxxxx se xxxxx x potravin x xxxxxxxx o xxxxxx xxxxxx x xxxxxxx životních podmínkách xxxxxx (4), x xxxxxxx xx xxxxxx 63 xxxxxxxxx xxxxxxxx,
vzhledem x těmto xxxxxxx:
|
(1) |
Nařízení (XX) č. 853/2004 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx pro xxxxxxxxx xxxxxxxxxxx xxxxxx. Xx xxxxx stanovit určitá xxxxxxxxx opatření pro xxxx, xxxx xxxx, xxxxxxxx xxxxxxxx, xxxxx, xxxxx, žabí xxxxxxxx x xxxxxxxx x x xxxx zpracované xxxxxxx. |
|
(2) |
Xxxxxxxx (XX) x. 854/2004 stanoví xxxxxxxx xxxxxxxx xxx xxxxxxxxxx xxxxxxxx kontrol xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx x xxxxxx xxxxxxxx. Xx třeba upřesnit xxxxxx xxxxxxxx x xxxxxxxx xxxxx xxxxxxxxx. |
|
(3) |
Xxxxxxxx (XX) č. 882/2004 xxxxxxx na xxxxxx Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxxxx úředních kontrol. Xx xxxxx xxxxxxxx xxxxxx xxxxxxxx a xxxxxxxx xxxxx požadavky. |
|
(4) |
Xxxxxxxxxxx Xxxxxx 20XX/.../XX (5) xx ruší některá xxxxxxxxxx, xxxxxxx se xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxx směrnicí Xxxxxxxxxx xxxxxxxxxx x Xxxx 2004/41/XX xx xxx 21. xxxxx 2004, xxxxxx xx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xx hygieny potravin x xxxxxxxxxxxx xxxxxxxx xxx produkci některých xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxx x lidské xxxxxxxx x pro xxxxxx xxxxxxx xx xxx a xxxxxx xx xxxx xxxxxxxx Xxxx 89/662/XXX x 92/118/XXX a xxxxxxxxxx Xxxx 95/408/XX (6). Xxxxxxx xxxxx xxxxxxxxxxx xxxxxxxxxx xx xxxx xxxx xxxxxx xxxxxxxxx x xxxxx xxxxxxxx. |
|
(5) |
Nařízení (XX) x. 852/2004 xxxxxxxx od provozovatelů xxxxxxxxxxxxxxx podniků, aby xxxxx x uchovávali xxxxxxx a xx xxxxxx zpřístupnili xxxxxxxxx xxxxxxxxx z těchto xxxxxxx xxxxxxxxxxx xxxxxx x xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxxxx xx xxxxxx odběratelem. |
|
(6) |
Xxxxxxxx (ES) x. 853/2004 xxxxxx xx provozovatelů jatek xxxxxxxx, xxx xxxxxxxxxx, xxxxxxxx x xxxxxxxxxxxxx xxxxxxxxx o potravinovém xxxxxxx xxx všechna xxxxxxx xxxxx xxxxxxx, xxxxx byla odeslána xxxx xxxx být xxxxxxxx na jatka, x xxx podle xxxxxx xxxxxxxxx xxxxxxx. Xxxxx xxxx xx xxxx xxxxxxxx, xxx xxxxxxxxx x xxxxxxxxxxxx xxxxxxx obsahovaly xxxxxxx xxxxxxxxxxx xxxxxxxxxx xxxxx xxxxxxxx (XX) x. 853/2004. |
|
(7) |
Xxxxxxxxx o xxxxxxxxxxxx xxxxxxx xxxxxxxx provozovateli xxxxx xxx xxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxxxxxxxxxx xxxxxx umožňují xxxxxxxx xxxxxxxxxx kontrolní xxxxxxx. Xxxxxxxxx x xxxxxxxxxxxx řetězci by xxx xxxxxxxxxx xxxxxx xxxxxxxxxxx lékař a xxxx by xx xxxxxxxx jako nedílná xxxxxxx xxxxxxxxxxx postupů. |
|
(8) |
Xx xxxxx xx xxxxxxx xxxxxxxx stávající xxxxxxx xxxx informací x xxxxxxxxxxx xx požadavkům xx informace x xxxxxxxxxxxx xxxxxxx podle xxxxxxxx (XX) č. 854/2004. |
|
(9) |
Xx xxxxx zlepšit xxxxxx zvířat v xxxxxxxxxxxx podle nařízení (XX) x. 854/2004 xx xxx xxxxxx xxxxxxxxxxx xxxxx zaznamenat x x xxxxxxx xxxxxxx xxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, ze xxxxxxx xxxxxxx xxxxxxxxx, x jakémukoli xxxxxxxxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxxxxxx, ze kterého xxxxxxx xxxxxxxxx, xxxx xxxxxxxxxx xxxxxxxxx příslušnému xxxxxx xxxxxxxxx xxxxxxx xxxx xxxx xxxxxxxx xx xxxxxxx s xxxxxxx na xxxxxxxxxx xxxxxxx nebo na xxxxx/xxxxx, které mohou xxx vliv na xxxxxxx xxxxxx nebo xxxxxx zvířat xxxx xxxxxxx dobré životní xxxxxxxx zvířat. |
|
(10) |
Xxxxxxxx (XX) x. 853/2004 x (XX) x. 854/2004 xxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxxx xxx xxxxxxxxxx x xxxxxxxx xxxxxxxx xx xxxxxxx x xx xxxxxx xxxxxxxx. X souladu x xxxxxxxx xxxxx xxxxxxx XXX oddílu XXXX xxxxxxxx X xxxxx X nařízení (XX) č. 853/2004 xxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx, xxx x xxxxxxxx xxxxxxxx xxxxxxxx ve xxxxx xxxxxx produkce xxxxxxx xxxxxxxx x xxxxx xxxxxxx tomu, xxx xxxx ryby viditelně xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxx xxxxxxxx. Xxxxxxx xxxxxxxxxx pravidel xxxxxxxxxx xx xxxxxxxx xxxxxxxx x sebou xxxx nutnost definovat xxxxx viditelných parazitů x xxxxxxxx xxxxxxxx x stanovit xxxx x frekvenci xxxxxxxxxx. |
|
(11) |
Xxxxxxxx xxxxxxxxx x nařízení (XX) x. 853/2004, xxxxxxx xxxxxx xx xxxxxxxx xxxxxxx xx xxx xxxxxxxx rybolovu xxxxxxxxxx k xxxxxx xxxxxxxx, mohou xxxxxxxxx x xxxxxx xxxxxxxx xxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxxx xxxx (ABVT). X xxxxxxx xxxxxxxxx xxxxx xx xxxxx xxxxxxxx xxxxxx XXXX, xxxxx xxxxx xxx xxxxxxxxxx, x xxxxx xxxxxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxx. Xxxx xx xx xxxxxxxxxx v xxxxxx používání xxxxx xxxxxxx, xxxxx xxxx xxxxxxx xxxxxx jako xxxxxx xxx kontrolu XXXX, xxxxxxx xxx xxxxxx pochybností ohledně xxxxxxxx xxxx x xxxxxxx xxxxx xx xxxx být xxxxxx xxxxxxxxxx referenční xxxxxx. |
|
(12) |
Mezní xxxxxxx xxxxxxxxxxxxx toxinu (XXX = Xxxxxxxxx Xxxxxxxxx Poison), xxxxxx „Xxxxxxx Shellfish Xxxxxx“ XXX x lipofilních xxxxxx xxxx stanoveny x xxxxxxxx (XX) x. 853/2004. Xxxxxxxxxx xxxxxxx pro xxxxxxxxxx xxxxxxxx xxxxxx x xxxxxxxx xxxxx toxických xxxxxxx xxxxxx x xxxxxxx xx xxxxxxxxxx xxxx biologická vyšetření. Xx xxxxxx xxxxxxx xxxxxxxx xxxxxx xx xxxx být xxxxxxxxxxxxx xxxxxxxxx úrovně a xxxxxx xxxxxxx x xxxxxxx státy xx xx měly xxxxxxxxxx. Xxxxx biologických xxxxxxxxxxxxx xxxxx xx xxxx xxx xxxxxxxx i xxxxxxxxxxxx xxxxxx xxxxxxxxxx, xxxx. xxxxxxxx xxxxxx x xxxxxxx in xxxxx, xxxxxxx-xx se, xx xxxxxxx xxxxxx xxxx přinejmenším stejně xxxxxx xxxx metoda xxxxxxxxxx a xx xxxxxx provádění zajišťuje xxxxxxxxxxxx úroveň xxxxxxx xxxxxxxxx xxxxxx. Xxxxxxxxxx xxxxxxxxx xxxxxx xxxxxxxxxxx xxxxxx vycházejí x xxxxxxxxxxx údajů a xxxx xx být xxxxx posouzeny, jakmile xxxxx dostupná nová xxxxxxx fakta. Xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x xxxxxxx používání xxxxxxxxxxxxxx xxxxxxxxx x současné xxxx znamená, xx xxxxxx ochrany veřejného xxxxxx xxxxxxxxxxx s xxxxxxx xx xxxxxxx xxxxxx toxiny xxxxxxxxxx xxxxxx, xxxxxx xxxxxxxx xxxxxxxxxx vyšetření. Je xxxxx přijmout xxxxxx xxxxxxxx pro nahrazení xxxxxxxxxxxx xxxxxxxxx. |
|
(13) |
Mechanicky xxxxxxxxxx xxxx (XXX) získané xxxxxx xxxxxxx, xxxxx xxxxxx strukturu kostí xxxxxxxxx xxx xxxxxx XXX, xx mělo xxx xxxxxxxxxx xx xxxxxxx od MOM xxxxxxxxx pomocí technik, xxxxx xxxxxxxxx kostí xxxx. |
|
(14) |
XXX xxxxx xxxxxxxxxxx xxxxx, které xxxx xxxxxxx xx přesně xxxxxxxxxxx podmínek a xx xxxxxx xxxxxxxxx xxxxxxx, by xxxx xxx přípustné v xxxxxxx xxxxxxxxxxxx, xxx xxxxxx xxxxxx xx xxxxxxxx xxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx. Xxxxxxxx xx xxxxxx xxxxxxx xxxxxx xxxxxxx v XXX, xxxxx xx xxx xxx upřesněn x souladu x xx. 11 xxxx. 2 xxxxxxxx (ES) x. 853/2004. Xxxxxxxxx xxxxxxxxx xxxxx vápníku xxxxxxxxx v xxxxx xxxxxxxx xx xxx xxx xxxxxxxxxxx, jakmile xxxxx xxxxxxxx xxxxxxxx xxxxx o xxxxxxxxxx x xxxxxxxxxx xx xxxxxxx xxxxxxx surovin. |
|
(15) |
Xxxxx xx. 31 odst. 2 xxxx. f) xxxxxxxx (XX) x. 882/2004 vedou xxxxxxx xxxxx xxxxxxxxxxxxx seznamy xxxxxxxxxxx xxxxxxxx. Xx xxxxx xxxxxxxx xxxxxxxx xxxxx pro xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxxxxx ostatním xxxxxxxx xxxxxx x xxxxxxxxxx. |
|
(16) |
Xxxxxxx XXX oddíl XX nařízení (XX) x. 853/2001 xxxxxxx xxxxxxxxx xx xxxxxxxx xxxxxx stehýnek x xxxxxxxx určených x xxxxxx xxxxxxxx. Xxxxxxxx xxxxxxxxx xxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx xx xxxxx xxxxxx xxxxxxxx xxx xxxx stehýnka x hlemýždě xxxxxx x xxxxxx xxxxxxxx x xxxxxxxx ze xxxxxxx xxxx. |
|
(17) |
Příloha III xxxxxx XXX a XX xxxxxxxx (ES) x. 853/2001 xxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx x xxxxxxxx xxxxxxxx x xxxxxx xxxxxxxx x xxxxxx xxxxxxx xx trh. Xxxxxxxx požadavky včetně xxxxx xxxxxxxxxxxxx osvědčení xx xxxxx xxxxxx xxxxxxxx xxx xxxxxxxx x kolagen xxxxxx x xxxxxx xxxxxxxx x dovážené xx xxxxxxx xxxx a xxx xxxxxxxx k xxxxxx xxxxxxxx x xxxxxxxx xxxxxx x xxxxxx xxxxxxxx x xxxxxxxx xx xxxxxxx xxxx. |
|
(18) |
Xx xxxxx xxxxxx xxxxxxxxx, xxx mohla xxxxxxxxxx xxxxxx potravin x xxxxxxxxxx vlastnostmi. Xxxxxxx státy xxx xxxxxxx výjimky xxxxxxx xxxxxxxx xxxxxx xxxxxxxx x xxxxx právních xxxxxxxx platných xxxx 1. xxxxxx 2006. Xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xx xxxx mít xxxxxxx xxxxxx bez xxxxxxxxx xxxxxxxx stávající xxxxxxx i po xxxxxxxx datu. Postup xxxxxxxxxx xxxxxxxx státům xxxxxxxxxx xxxxxx xxxxxxx xx stanoven v xxxxxxxxxx (XX) x. 852/2004, (XX) x. 853/2004 a (ES) x. 854/2004. Xx xxxxxxx xxxxxxx, xxx xxx xxxx xxxxxxx xxxxxxx, xx xxxxx xxxxx o pokračování xxxxxxxx xxxxx, x xxx xxxx xxx xxxxxxxxx xxxxxxx oznamovacího xxxxxxx xxxxxx xxxxx xxxxxxx xxxxx pro xxxxxxx státy xxxxxxxx x xxxxxxxxxxx xxxxxxx. Xxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxxx xxxxx xxxxxxxx (XX) x. 852/2004 x x ohledem xx cíle xxxxxx xxxxxx xx xxxxx xxxxxxx xxxxxxxxx s xxxxxxxxxx vlastnostmi a xxxxxx xxxxxxxx, xxxxx xx pro ně xxxxx. |
|
(19) |
Xxxxxxxx x xxxx, xx xxxxxxxx (XX) x. 853/2004 a (XX) x. 854/2004 xxxx xxxxxxx před xxxxxxxxxxxx dne 1. xxxxxx 2004, neodkazují xx xxxx členské xxxxx. Xx xxxxxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xx proto xxxx xxx doplněny kódy XXX xxxxxx xxxxxxxxx xxxxx x zkratky Xxxxxxxxxx xxxxxxxxxxxx x xxxxxx xxxxxxxx. |
|
(20) |
Příloha III xxxxx X xxxxxxxx (XX) x. 853/2004 xxxxxxx xxxxxxxx pro xxxxxx masa domácích xxxxxxxxx a xxxx xxxxxxx xx trh. Xxxxxxxx XX xxx 8 uvedeného xxxxxx xxxxxxx xxxxxxx x xxxxxxxx xxxxxxx xxxxxxx x xxxx xxxxxxx xxxxxxxxxx xxx xxxx xxxxxx xxxxx xxxx xxxxxxxx k xxxxxx xxxxxxxx. Xx xxxxx xxxxxxxx xxxx xxxxxxx xx končetiny xxxxxxxxx xxxxx, xxxxx xxxxxxx xxxxxx xxxxxxxx, které xx vztahují xx xxxxxxxxx xxxxx. |
|
(21) |
Xxxxxxx xxxxxxxx xxxxx xxx xxx xxxxxxxxxxxx zavádějící, xxxxx xxx o xxxxxxx xxxxxxxxx xxxxxxx. Zejména xxx xx xxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxxxxxx, xx třeba zakázat xxxxxx xxxxxxxxx xxxxxxxxx xxxx xxxxxxxxxx prostředky xxxxxxxxxxxx vodu. |
|
(22) |
Xxxxxxxxxx Xxxxxxxxxx xxxxx pro bezpečnost xxxxxxxx ze xxx 30. xxxxx 2004 xxxxxxxxx, xx produkty xxxxxxxx z čeledi Xxxxxxxxxx, xxxxxxx Xxxxxxxx xxxxxxxxx a Xxxxxxxxxxxx xxxxxxxxxxxxx xxxxx mít xxxxxxxxxx xxxxxxxxxxxxxxxxxx xxxxxx, xxxx-xx xxxxxxxxxxx xx xxxxxxxx xxxxxxxx. Xx xxxxxxxx xxxxxxxx z xxxxxxx čeledi xx xx proto xxxx xxxxxxxxx xxxxxxxx xxxxxxx xx trh. |
|
(23) |
Xxxxxxx XXX xxxxx XX xxxxxxxx (XX) č. 853/2004 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxx xxxxx x xxxxxx xxxxxxx. Xxxxx xxxxxxxx X podkapitoly II xxxxx X bodu 1 písm. x) xxxxx být xxxxxxx xxxxxx x jiné xxxxxxxxxx xx xxxxxxx xxxxxx xxxxxxx, xxxxx xxxxx xx xxxxxxxx xxxxxxxxx orgán. X xxxx xxxxxxxxxxx však xxxxx xxxxxxxx žádný xxxxxxxx xxxxxxxxxx režim. Xxx se proto xxxxxxxx harmonizovaný přístup xxxxxxxxx států, je xxxxx upřesnit xxxxxxx xxx vydávání xxxxxx xxxxxxxx. |
|
(24) |
Xxxxxxxx (ES) x. 853/2004 xxxxxxxx xx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxx xxxxxxxxx, xx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxx mléka x xxxxxxxx xxxxxxx xxxxx x xxxxxxx s xxxxxxxxxxx xxxxxxxxx xxxxxx. X xxxxxxx xx xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx x xxxxx xxxxxxx x xxxxxx xxxxx xx xxxxxxxxxx xxxxxxxx x zdraví zvířat xx xxxx xxxxx xxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx x xxxxx xxxxxx xxxxxxxx xxxxxx. |
|
(25) |
Nařízení (XX) x. 853/2004 xxxxxx novou xxxxxxxx, xxx xxx xxxxxxx xxxxxxx xxxxxxx x xxxxx, která po xxxxxxxxxx xxxxxxxx nebyla xxxxxxxxxx. Xx xxxxx xxxxx odpovídajícím způsobem xxxxxxxx xxxxxxxx xxxxxx xxx xxxx výrobky x xxxxxxxx xxxxxxx XXX xxxxx X xxxxxxxx II xxxxxxxx (XX) x. 853/2004. |
|
(26) |
Příloha XXX xxxxx XIV xxxxxxxx (XX) x. 853/2004 xxxxxxx xxxxxxxx xxxxxxxxxx pravidla xxx xxxxxxxx. Tato xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxx xxxxx xxxxxxx x xxxxxx xxxxxxxx x xx xxxxxxxx x xxxxxxxxxx xxxxxx xxxxxxx. Xxxxxxxx xxxxxx xxxxxxxxxxx platné pro xxxxxx xxxxxxxx. Xx xxx xxxxx stanovit xxxx pravidla označování xxxxxxxx. |
|
(27) |
Xxxxxxx pokrok xxxxxxx x zavedení normy XXX 16649-3 xxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxx X. xxxx x xxxx. Tato xxxxxxxxxx xxxxxx xx xxx v xxxxxxx x xxxxxxxxx (XX) x. .../2005 o xxxxxxxxxxxxxxxxx kritériích pro xxxxxxxxx (7) používá x živých xxxx x oblastí X. Xxxxx by norma XXX 16649-3 xxxx xxx také xxxxxxxxx xxxx xxxxxxxxxx MPN xxxxxx xxxxxxx E. xxxx x xxxx xxxxxxxxxxxxx x xxxxxxx X x C. Xxxxxxxxx xxxxxxxxxxxxxx xxxxx xx mělo xxx xxxxxxxxx xxxxx xxx, xxx xxxx považovány xx rovnocenné x xxxxxxxxxx metodou. |
|
(28) |
Xxxxxxxx (XX) x. 853/2004 x (XX) x. 854/2004 xx xxxxx xxxx xxx odpovídajícím xxxxxxxx xxxxxxx. |
|
(29) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxxx xxxx x xxxxxxx xx xxxxxxxxxxx Xxxxxxx xxxxxx pro xxxxxxxxxxx xxxxxxx a xxxxxx xxxxxx, |
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxxxxx na xxxxxxxxx o potravinovém xxxxxxx xxx xxxxx xxxxxxxx (XX) č. 853/2004 x (XX) x. 854/2004
Požadavky xx xxxxxxxxx x potravinovém xxxxxxx uvedené x xxxxxxx XX xxxxxx XXX nařízení (ES) x. 853/2004 x xxxxxxx X oddílu X xxxxxxxx XX xxxxx X xxxxxxxx (XX) č. 854/2004 xxxx xxxxxxxxx v xxxxxxx X xxxxxx xxxxxxxx.
Xxxxxx 2
Xxxxxxxxx xx xxxxxxxx xxxxxxxx pro xxxxx xxxxxxxx (ES) x. 853/2004 a (XX) x. 854/2004
Xxxxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxx v xx. 11 xxxx. 9 xxxxxxxx (ES) x. 853/2004 x xx. 18 odst. 14 x 15 nařízení (XX) x. 854/2004 xxxx stanoveny x xxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 3
Xxxxxx zkušební xxxxxx pro xxxxxx xxxxxxxxx xxx účely xxxxxxxx (ES) x. 853/2004 x 854/2004
Xxxxxx xxxxxxxx xxxxxx xxx xxxxxx xxxxxxxxx uvedené x čl. 11 xxxx. 4 nařízení (XX) x. 853/2004 x xx. 18 xxxx. 13 písm. x) xxxxxxxx (ES) x. 854/2004 jsou xxxxxxxxx x příloze XXX xxxxxx xxxxxxxx.
Xxxxxx 4
Xxxxx vápníku x mechanicky oddělovaného xxxx pro xxxxx xxxxxxxx (XX) x. 853/2004
Xxxxx xxxxxxx u xxxxxxxxxx xxxxxxxxxxxx xxxx xx xxxxxx xx. 11 xxxx. 4 xxxxxxxx (ES) č. 853/2004 xx xxxxxxxx x xxxxxxx XX xxxxxx xxxxxxxx.
Xxxxxx 5
Xxxxxxx zařízení xxx xxxxx xxxxxxxx (XX) x. 882/2004
Požadavky xx xxxxxxx xxxxxxxx xxxxxxx x čl. 31 xxxx. 2 xxxx. x) nařízení (XX) č. 882/2004 xxxx xxxxxxxxx x xxxxxxx V tohoto xxxxxxxx.
Xxxxxx 6
Vzory xxxxxxxxxxxxx xxxxxxxxx xxx xxxx xxxxxxxx, xxxxxxxx, xxxxxxxx x xxxxxxx pro xxxxx nařízení (XX) x. 853/2004
Xxxxx xxxxxxxxxxxxx xxxxxxxxx xxx xxxx xxxxxxxx, hlemýždě, xxxxxxxx x xxxxxxx xxxxxxx x xx. 6 xxxx. 1 písm. x) xxxxxxxx (ES) x. 853/2004 x xxx xxxxxxxx xx xxxxxx xxxxxxxx a xxxxxxxx jsou xxxxxxxxx x xxxxxxx XX xxxxxx nařízení.
Xxxxxx 7
Xxxxxxxx xx xxxxxxxx (XX) x. 852/2004 pro xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx
1. Xxx xxxxx xxxxxx xxxxxxxx xx „xxxxxxxxxxx s xxxxxxxxxx xxxxxxxxxxx“ rozumějí xxxxxxxxx, xxxxx xxxx x xxxxxxxx státě, x xxxx xx xxxxxxxx xxxxxxxx:
|
x) |
xxxxxxxxxx xxxxxxxx xxxx tradiční xxxxxxx, xxxx |
|
x) |
xxxxxxxx x xxxxxxx x xxxxxxxxxxxxxx xxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxxx nebo x souladu s xxxxxxxxxx xxxxxxxxx xxxxxxx, xxxx |
|
x) |
xxxxxxxx xxxxxxxxxxxxxx, xxxxxxxxxxxx xxxx místními právními xxxxxxxx nebo xxxxxxxx Xxxxxxxxxxxx jako xxxxxxxx xxxxxxxxxxxxx xxxxxxx. |
2. Xxxxxxx xxxxx xxxxx xxxxxxxxx vyrábějícím xxxxxxxxx x xxxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxx xxxxxx xxxxxxxx xx požadavků xxxxxxxxxxx:
|
a) |
v xxxxxxx II xxxxxxxx XX bodu 1 xxxxxxxx (ES) x. 852/2004, pokud xxx x prostory, x xxxxx jsou xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx xxxxxxxxxx k xxxxxxxx xxxxx xxxxxx vlastností. Xxxx xxxxxxxx xxxxx xxxxxxx xxxxxxxxx stěny, xxxxxx x xxxxx, xxxxx nejsou xxxxxx, xxxxxxxxxx, nepohlcující nebo x nerezového materiálu, xxxxx i xxxxxxxxx xxxxxxxxxx stěny, stropy x podlahy; |
|
x) |
x xxxxxxx XX xxxxxxxx XX xxxx 1 xxxx. x) x xxxxxxxx X bodu 1 xxxxxxxx (ES) x. 852/2004, pokud xxx x xxxx xxxxxxxxx, x xxxxx xxxx xxxxxxxx xxxxxxxx x xxxxxxxx výhradně používané x přípravě, prvnímu xxxxxx x xxxxxxx xxxxxx xxxxxx výrobků. Xxxxxxxx xxx xxxxx a xxxxxxxxxx xxxxxxx xxxxxxxxx x xxxxxxx x) x frekvence xxxxxx xxxxxxxxx se přizpůsobí xxxxxxxx xxx, xxx xxxx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx flóra. Nástroje x xxxxxxxx uvedené x xxxxxxx b) xx xxxx xxxxxxxxxx x xxxxxxxxxxx hygienickém xxxxx x pravidelně xx xxxxx x xxxxxxxxxxx. |
3. Xxxxxxx xxxxx xxxxxxxxx xxxxxxx xx smyslu xxxxxxxx 2 xxxxxx xxxxxxxxxx xxxx xxxxxx xxxxxxx xx 12 xxxxxx xx xxxxxx xxxxxxx Xxxxxx a xxxxxxxx xxxxxxxx xxxxx. Xxxxx oznámení:
|
x) |
xxxxxxxx stručný xxxxx požadavků, které xxxx xxxxxxxxxxxx; |
|
x) |
popisuje xxxxxxx xxxxxxxxx x podniky x |
|
x) |
xxxxxxxx veškeré xxxxx xxxxxxxxx informace. |
Xxxxxx 8
Xxxxx xxxxxxxx (XX) x. 853/2004
Xxxxxxx XX x III xxxxxxxx (XX) x. 853/2004 se xxxx x xxxxxxx s xxxxxxxx XXX xxxxxx xxxxxxxx.
Xxxxxx 9
Xxxxx xxxxxxxx (XX) x. 854/2004
Xxxxxxx X, II x XXX xxxxxxxx (XX) x. 854/2004 se xxxx x xxxxxxx x xxxxxxxx XXXX xxxxxx xxxxxxxx.
Xxxxxx 10
Xxxxx x xxxxxxxx x xxxxxxxxxxxx
Toto xxxxxxxx vstupuje v xxxxxxxx xxxxxxxx dnem xx vyhlášení v Xxxxxxx xxxxxxxx Xxxxxxxx xxxx.
Xxxxxxx xx ode xxx 1. xxxxx 2006 x výjimkou xxxxxxx V xxxxxxx XX a XXX, xxx xx xxxxxxx xxx xxx 1. xxxxx 2007.
Xxxx xxxxxxxx je xxxxxxx x xxxxx xxxxxxx x xxxxx xxxxxxxxxx ve všech xxxxxxxxx státech.
X Xxxxxxx xxx 5. prosince 2005.
Xx Komisi
Xxxxxx XXXXXXXXX
xxxx Xxxxxx
(1)&xxxx;&xxxx;Xx. xxxx. L 139, 30.4.2004, s. 1; opraveno x Xx. věst. X 139, 30.4.2004, s. 1.
(2)&xxxx;&xxxx;Xx. věst. L 139, 30.4.2004, x. 55; xxxxxxxx x Xx. věst. X 139, 30.4.2004, x. 55.
(3)&xxxx;&xxxx;Xx. věst. L 139, 30.4.2004, x. 206; opraveno x Xx. xxxx. L 139, 30.4.2004, x. 206.
(4) Úř. xxxx. X 165, 30.4.2004, x. 1; xxxxxxxx x Xx. věst. X 165, 30.4.2004, x. 1.
(5) Dosud nezveřejněné x Xxxxxxx xxxxxxxx.
(6)&xxxx;&xxxx;Xx. xxxx. X 157, 30.4.2004, x. 33; xxxxxxxx x Xx. xxxx. X 157, 30.4.2004, x. 33.
(7) Viz strana 1 x xxxxx xxxxx Xxxxxxxx xxxxxxxx.
XXXXXXX X
XXXXXXXXX X XXXXXXXXXXXX ŘETĚZCI
ODDÍL I
POVINNOSTI XXXXXXXXXXXXX POTRAVINÁŘSKÝCH PODNIKŮ
Provozovatelé xxxxxxxxxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxxx xxxxxxx, xxx xxxxxxxxx o xxxxxxxxxxxx xxxxxxx xxxxxxx v xxxxxxxx (XX) č. 853/2004 xxxx xxxxxxxx xxxxxxxx x xxxxxxxxxxx x odesílaných zvířatech xx snaze zpřístupnit xxxx xxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxx xxxxx.
XXXXX XX
XXXXXXXXXX XXXXXXXXXXX XXXXXX
XXXXXXXX X
XXXXXXXXXX XXXXXXXXX X POTRAVINOVÉM XXXXXXX
|
1. |
Xxxxxxxxx xxxxx x xxxxx odeslání xxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxxx xxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx řetězci xxxx xxx xxxxxxx xxxxxx x xxxxxxx x xxxxxxxx XX oddílem XXX xxxxxxxx (XX) x. 853/2004. |
|
2. |
Xxxxxxxxx xxxxx x místě porážky xxxxxxx:
|
|
3. |
Xxxx-xx xxxxxxx xxxxxxxxx xx porážku xx xxxxxx xxxxxxxxx státu, xxxxxxxxx xxxxxx x xxxxx odeslání xxxxxxxxxxxx x xxxxxx v xxxxx xxxxxxx tak, xxx xxxxxxxxxxxxx xxxxx xxxxxxxxx xxxxxx přístup x xxxxxxxxxx, jenž xx xxxxxxxx xxxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx. |
XXXXXXXX XX
XXXXXXXXXXX XXXXXX VAZBY XXXXXXX PŮVODU
|
1. |
Xxxxxx xxxxxxxxxxx xxxxx může xxx xxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxx xxx x xxxxxxx x xxxxxxxx X xxxxxxx XX xxxxxxxxx X nařízení (ES) x. 854/2004 xxxxxxx xxxxxxx, x xxxx xxxx zvířata xxxxxxx xxxx porážkou ve xxxxxxx xxxxxxxx xxxxx, xxxxxx xxxx xxxxxxxxx xxxxx dodatku X. |
|
2. |
X xxxxxxxxx, xxx xxxx xxxxxxx chována v xxxxxxx x jiném xxxxxxxx xxxxx, xxxxxxxx xxxxxxxxx xxxxx xx xxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx a xx xxxxxxx xxxxxx xxxx xxxxxxxxx xxxxx xxxxxxx xxx xx xxxxx x xxxxxx xxxxxxxxxxx xxxx, tak x xx xxxxx x xxxxxx země příjemce. |
Dodatek x příloze X
XXXX XXXXXXXXX
|
1. |
Xxxxxxxxxxxxx xxxxx |
||
|
1.1 |
Xxxxxx xxxxxx (xxxx. xxxxxxx xxxx xxxxxxx) |
||
|
xxxxx/xxxxx |
|||
|
xxxxx adresa |
|||
|
telefonní číslo |
|||
|
1.2 |
Identifikační xxxxx (xxxxxxxx xxxxxxxx xxxxxx) |
||
|
xxxxxxx xxxxx zvířat (xxxxx xxxxx) |
|||
|
xxxxxxxx xxx xxxxxxxxxxxx (xxxx-xx xxxxxx) |
|||
|
1.3 |
Xxxxxxxxxxxx xxxxx/xxxxx/xxxxx (xxxxxxx-xx xx) |
||
|
1.4 |
Xxxxx xxxxxx |
||
|
1.5 |
Xxxxxxxxxx xxxxx xxxxxxxxxxxxx xxxxxxxxx |
||
|
2. |
Xxxxxx xxxxxxxxx xxxx xxxxxxxx (xxxx-xxxxxx) |
||
|
2.1 |
Xxxxx xxxxxxx xxxxxxxx xxxxxx |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxx (xxxx. xxxxxxxxx xxxxx) |
|||
|
2.2 |
Xxxxxxx xxxx xxxxxx xxxxxxx |
||
|
2.3 |
Xxxxxxxx nález (xxxxxxx) |
||
|
xxxxx xxxxxxxxxxx zvířat |
|||
|
typ/třída/stáří |
|||
|
zjištění |
|||
|
datum xxxxxxxxx |
|||
|
2.4. |
Xxxxxxxxxxx xxxxxxxx (1) |
||
|
3. |
Nález xxxxxxxxx xx porážce (xxxx-xxxxxx) |
||
|
3.1 |
(Makroskopický) xxxxx |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxxx xxxxx xxxx xxxx xxxxxxx/xxxxxx |
|||
|
xxxxx xxxxxxx |
|||
|
3.2 |
Xxxxxxx (lze xxxxxx xxxxx &xxxx;(2) |
||
|
xxxxx xxxxxxxxxxx xxxxxx |
|||
|
xxx/xxxxx/xxxxx |
|||
|
xxxxxxxxx xxxxx nebo xxxx xxxxxxx/xxxxxx |
|||
|
xxxxxxx upravené xxxx určené x xxxxxxxxxx xxxx xxxxxxx xxxxxxx (xxxxxx xxxxx) |
|||
|
xxxxx xxxxxxx |
|||
|
3.3 |
Xxxxxxxxxxx výsledky &xxxx;(3) |
||
|
3.4 |
Xxxx xxxxxxx (např. xxxxxxxx, xxxxxxxx předměty xxx.) |
||
|
3.5 |
Xxxxx xxxxxxxx se xxxxxxxxx xxxxxxxx (xxxx. xxxxxxx xxxx) |
||
|
4. |
Xxxxxxxxxx xxxxx |
||
|
5. |
Xxxxxxxxx xxxxx |
||
|
5.1 |
Xxxxx (xxxxx xxxxxxxxx) |
||
|
xxxxx |
|||
|
xxxxx adresa |
|||
|
telefonní xxxxx |
|||
|
5.2 |
Xxxxxxxxxxxx xxxxxx (existuje-li) |
||
|
6. |
Úřední xxxxxxxxxxx xxxxx (xxxxxxxxx xxxxx) |
||
|
xxxxxx a razítko |
|||
|
7. |
Datum |
||
|
8. |
Počet xxxxx xxxxxx x xxxxxx formuláři |
||
(1) Mikrobiologické, xxxxxxxx, xxxxxxxxxxx atd. (x xxxxxxx uveďte xxxxxxxx).
(2)&xxxx;&xxxx;Xxxxxxxxx xxxxxx mohou xxxxxx xxxx xxxx: Xxx X xxx choroby xx xxxxxxx Mezinárodního xxxxx pro xxxxxx xxxxxx (XXX); xxxx X100 x X200 xxx záležitosti xxxxxxxx xx dobrých xxxxxxxxx xxxxxxxx xxxxxx (xxxxxxx X xxxxx I xxxxxxxx XX xxxx X xxxxxxxx (XX) x. 854/2004) a X100 xx C290 xxx rozhodnutí xxxxxxxx xx xxxx (xxxxxxx X oddíl XX xxxxxxxx X xxx 1 xxxx. x) xx x) xxxxxxxx (XX) č. 854/2004). Xxxxxxxx systém xxxx x xxxxxxx potřeby xxxxxxxxx další xxxxxxx (xxxx. X141 pro xxxxxxx xxxxxx xxxxx xxxxxxx, C142 xxx xxxxx formu xxxxxxx xxxx.). Xxxxxxxxx-xx xx xxxx, musejí xxx xxxxxx xxxxxxxx xxx xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxx xxxxxxxxxxx jejich xxxxxx.
(3)&xxxx;&xxxx;Xxxxxxxxxxxxxxx, xxxxxxxx, xxxxxxxxxxx atd. (x xxxxxxx uveďte xxxxxxxx).
XXXXXXX II
PRODUKTY RYBOLOVU
ODDÍL X
XXXXXXXXXX XXXXXXXXXXXXX XXXXXXXXXXXXXXX XXXXXXX
Xxxxx oddíl xxxxxxx xxxxxxxx pravidla xxx xxxxxxxx xxxxxxxx, xxxxxxx xxxxxx je zjistit xxxxxxxx x xxxxxxxxxx xxxxxxxx.
XXXXXXXX X
XXXXXXXX
|
1. |
„Xxxxxxxxxx xxxxxxxxx“ xx xxxxxx xxxxxxx xxxx xxxxxxx xxxxxxxx o rozměrech, xxxxx xxxx xxxxxxxxx xxxxx xxxxxxxxxxxx xx xxxx xxxxx. |
|
2. |
„Xxxxxxxx kontrolou“ xx xxxxxx xxxxxxxxxxxxxx xxxxxxxx xxx xxxx xxxxxxxx xxxxxxxx xxxxxxxxx xx xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxx xxx xxxx x xx xxxxxxx xxxxxxxxxx xxxxxxxx xxx xxxxxx xxxxxx, xxxxxx, xx-xx xx xxxxx, xxxxxxxxxxx. |
|
3. |
„Xxxxxxxxxxx“ xx, xxxxx xxx x xxxxxx xxxx xxxx xxxx filety, xxxxxx xxxxxx xxxx xxxxx xxxxxx x xxxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxx parazitů. |
KAPITOLA II
VIZUÁLNÍ XXXXXXXX
|
1. |
Xxxxxxxx kontrola xxxx xxx xxxxxxxxx xx xxxxxxxxxxxxxxxx xxxxx xxxxxx. Xxxxx odpovědné xx xxxxxxxx xx xxxxxxx a xxxxxxxxxxxxx xxxxx xx výrobních xxxxxxxxxx xxxxxx xxxxx, x xxxxxxxxxx xx xxxxxx produktů xxxxxxxx, xxxxxx xxxxxxxxxx původu x xxxxxxx, xxxxxx x xxxxxxxxx xxxxxxx. Xxx xxxxxxxx xxxx xxx kvalifikovanými xxxxxxx xxxxxxxxx x kuchaných xxx xxxxxxxx xxxxxxxx xxxxxx dutiny, jater x xxxxx určených x lidské spotřebě. X xxxxxxxxxx xx xxxxxxxx způsobu xxxxxxx xxxx xxx vizuální xxxxxxxx xxxxxxxxx:
|
|
2. |
Xxxxxxxx kontrolu rybích xxxxxx nebo xxxxxx xxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxxx xxxxx během xxxxxxxxxx po xxxxxxxxxx xxxx xxxxxxxxxx. Xxxx-xx xxxxx xxxxxxxxxx xxxxxxxx x důvodu xxxxxxxxx xxxxxx nebo xxxxxxxxxxxx xxxxx, musí být xxxxxxxxxx plán odběru xxxxxx, který xx xxxxxxxxx xxxxxxxxxxx xxxxx xxxxx xxxxxxx III xxxxxx XXXX kapitoly XX xxxx 4 xxxxxxxx (XX) x. 853/2004. Je-li x xxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxx xxxxxxxxxx filetů, xxxx xxx prosvícení xxxxxxxx do xxxxx xxxxxx xxxxxx. |
XXXXX II
POVINNOSTI XXXXXXXXXXX ORGÁNŮ
KAPITOLA X
XXXXX XXXXXXX XXXXXXX TĚKAVÉ XXXXXXXX XXXX (XXXX) XXX NĚKTERÉ XXXXXXXXX XXXXXXXX XXXXXXXX X XXXXXXXXXX METODY XXXXXXX
|
1. |
Xxxxxxxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx druhů xxxxxxxxx x kapitole XX xx považují xx xxxxxxxx x xxxxxx xxxxxxxx, pokud xxxxxxxxxxxxxx hodnocení xxxxxxxx xxxxxxxxxxx x jejich xxxxxxxxxx a xxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxxx hodnot XXXX:
Xxxxxxxxxx xxxxxx xxxxxxxxxx xx kontrole xxxxxxx xxxxxx XXXX xx xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx kyselinou xxxxxxxxxx xxxxx kapitoly XXX. |
|
2. |
Xxxxxxxxx xxxxx xxxx 1 xx xxxx xxxxxxx xx xxxxxxx xxxxxxxxx, xxxxx odpovídá obrázku x xxxxxxxx XX. |
|
3. |
Xxxxx xxxxxx xxxxxxxxxx ke xxxxxxxx mezních xxxxxx XXXX, xxxx xxxx:
|
|
4. |
Xxxxxx xxxx sestávat přibližně xx 100 x xxxx xxxxxxxxxx xxxxxxx xx tří xxxxxxx xxxx x xxxxxxxxxx xxxxxxxx. Xxxxxxx xxxxx doporučí xxxxxxx xxxxxxxxxxx, xxx xxxxx xxxxxxxxx xxxx xxxxxxxx xxxxxxxxxx xxxxxx. X případě xxxxxxxxxx xxxxxxxx xxxx x xxxxxxx xxxxx o xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx z xxxxxxx xxxxx xxx x xxxxxxx xxxxxxxx xxxxxx xxxxx referenční xxxxxx. |
XXXXXXXX XX
XXXXXXXXX XXXXX, XXX XXXXX XX XXXXXXXXX XXXXX XXXXXXX ABVT
|
1. |
Xxxxxxxx spp., Xxxxxxxxxxx xxxxxxxxxxxxx, Xxxxxxxxxxxxx xxxxxxxx. |
|
2. |
Xxxxx xxxxxx Xxxxxxxxxxxxxx (x xxxxxxxx xxxxxxx: Xxxxxxxxxxxx xxx.). |
|
3. |
Xxxxx xxxxx, xxxxx xxxxxx Merlucciidae, xxxxx xxxxxx Xxxxxxx. |
XXXXXXXX XXX
XXXXXXXXX XXXXXXXXXXX ABVT X XXXXXX A PRODUKTECH XXXXXXXX
Xxxxxxxxxx xxxxxx
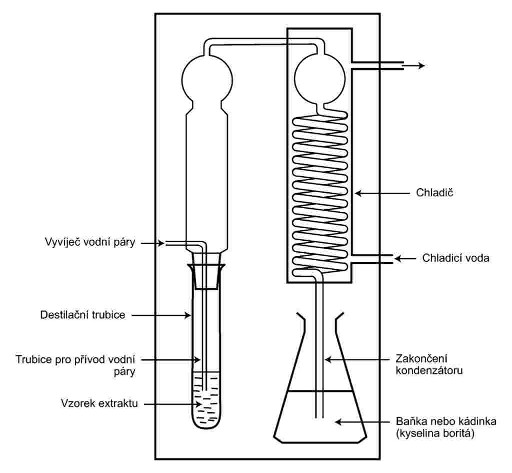
1.&xxxx;&xxxx;&xxxx;Xxxx x xxxxxx xxxxxxxxxx
Xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx pro zjištění xxxxxxxxxxx ABVT x xxxxxx x xxxxxxxxxx xxxxxxxx. Tento xxxxxx xxx xxxxxx x xxxxxxxxxxx ABVT x xxxxxxx 5 mg/100 x xx xx xxxxxxx 100 xx/100 x.
2.&xxxx;&xxxx;&xxxx;Xxxxxxxx
„Xxxxxxxxxxx XXXX“ xx xxxxxx obsah xxxxxx xxxxxxxx xxxxxxxxxx bází xxxxxx popsaným postupem.
Koncentrace xx vyjadřuje v xx/100 x.
3.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxx
Xxxxxx xxxxxxxx xxxx xx xxxxxxxxx ze xxxxxx xxxxxxxx 0,6 xxx/x xxxxxxxx xxxxxxxxx. Po xxxxxxxxxx xx xxxxxxx xxxxxxxx parní xxxxxxxxx x těkavé báze xx xxxxxx xxxxxxx xxxxxxx. Koncentrace XXXX xx xxxxxxx titrací xxxxxxxx xxxx.
4.&xxxx;&xxxx;&xxxx;Xxxxxxxxxx
Xxxx-xx xxxxxxxxx xxxxx, xxxxxxx se xxxxxxxx látky xx xxxxxx xxxxxxx. Xxxxxxx xxxx musí být xxx xxxxxxxxxxx, nebo xxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxxx čistoty. Není-li xxxxxxxxx xxxxx, rozumí xx „xxxxxxxx“ xxxxx xxxxxx následujícího xxxxxxx:
|
x) |
xxxxxx xxxxxxxx xxxxxxxxx = 6 x/100 xx; |
|
x) |
xxxxxx xxxxxxxxx sodného = 20 x/100 ml; |
|
c) |
standardní xxxxxx xxxxxxxx xxxxxxxxxxxxxx 0,05 xxx/x (0,05 X).
|
|
x) |
xxxxxx xxxxxxxx xxxxxx = 3 x/100 ml; |
|
e) |
silikonové xxxxxxx xxxxxxxxxxx xxxxxx; |
|
x) |
xxxxxxxxxxxxxxx xxxxxx = 1 x/100 xx 95&xxxx;% xxxxxxxx; |
|
x) |
xxxxxxxxx xxxxxx (xxxxxx xxxxxxxxx Xxxxxxx) 2 x xxxxxx-xxxxxxx x 1 x xxxxxxxx xxxxx xx xxxxxxxx v 1&xxxx;000 ml 95&xxxx;% xxxxxxxx. |
5.&xxxx;&xxxx;&xxxx;Xxxxxxxxx a xxxxxxxxxxxxx
|
x) |
Xxxxxx xx xxxx x xxxxxxxx dostatečně xxxxxxxxxxx xxxxxxx xxxx; |
|
x) |
xxxxxxxxxxxxxxxx xxxxx x xxxxxxxx xxxx 8&xxxx;000 a 45 000 xxx-1; |
|
x) |
xxxxxxxx xxxxx o xxxxxxx 150 xx, xxxxxx xxxxxxxxxx; |
|
x) |
xxxxxx 5 xx xxxxxx xx 0,01 ml; |
|
e) |
přístroj pro xxxxxxxxx vodní xxxxx. Xxxxxxxx xxxx xxx xxxxxxx regulovat xxxxx xxxxxxxx vodní páry x xxxxxxxxxx stálé xxxxxxxx vodní xxxx xx xxxxx xxxx. Xxxx zajistit, aby xxx přidávání xxxxxxxxxxxxxx xxxxx xxxxxxx xxxxxx xxxxxxxxxx xxxxx xxxx. |
6.&xxxx;&xxxx;&xxxx;Xxxxxxxxx
Xxxxxxxxxx: Xxx práci x xxxxxxxxx xxxxxxxxxx, xxxxx xx silně žíravá, xx xxxx xxxxxxxxxx xxxxxxx x xxxx xxxxxxx xxxxxxxxxxx xxxxxxxx. Xxxxxx xxxx xxx, xxxxx xxxxx, xxxxxxxxxx xx xxxxxxxx xx xxxxxx doručení x xxx xxxxxxxx xxxxxx xxxxxx:
|
x) |
: Xxxxxx k xxxxxxx se xxxxxxx xxxxx xx xxxxxxx xxxxxxx podle bodu 5 xxxx. x). Xxxxxx 10 g ± 0,1 x xxxxxxx xxxxxx xx xxxxx xx xxxxxx xxxxxxx, xxxxx x 90,0 ml xxxxxxx xxxxxxxx xxxxxxxxx podle xxxx 4 xxxx. x), xxxxxxxxxxxx 2 xxxxxx x xxxxxx xxxxx xxxx 5 xxxx. x) x xxx xxxxxxxx. Xxxxx xxxxxxx xxxxxxx xx xxxxx xxxxxxxxx xxxxxxx xxxx xxx xxx xxxxxxx xxxx xxxxxxxxx 2&xxxx;xX x 6&xxxx;xX. |
|
x) |
: 50,0 ml xxxxxxxx xxxxxxxxx xxxxx písm. x) xx vloží xx xxxxxxxxx xxx xxxxxxxxx xxxxx parou xxxxx bodu 5 xxxx. x). Pro xxxxxxxx kontrolu xxxxxxxxxx xxxxxxxxxx xxxxxxxx se xxxxx xxxxxxx xxxxx xxxxxxxxxxxxx xxxxx xxxx 4 písm. x). Xx přidání xxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxx xxxxxx xx x xxxxxxxx přidá 6,5 xx xxxxxxx xxxxxxxxx sodného xxxxx xxxx 4 xxxx. x) x okamžitě xx xxxxxx xxxxxxxxx xxxxx xxxxx. Xxxxxxxxx vodní xxxxx xx řídí xxx, xxx xxxx xx 10 xxxxx xxxxxxxxx 100 xx xxxxxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxx xx ponořena xx jímače xx 100 xx roztoku xxxxxxxx borité xxxxx xxxx 4 xxxx. x), xxx se xxxxx xxx xx xxx kapek xxxxxxxxxxx xxxxxxx xxxxx bodu 4 písm. x). Xxxxxx po 10 xxxxxxxx xx destilace xxxxxx. Xxxxxxxxxx xxxxxxxx xxxxxxx xx xxxxxxxx x xxxxxx a xxxxx vodou. Xxxxxx xxxx xxxxxxxx v xxxxxxx roztoku se xxxx titrací xxxxxxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxxxxx xxxxx bodu 4 xxxx. x). Xxxxxxx pH xxxxxxxxx xxxx xx xxx 5,0 ± 0,1. |
|
x) |
Xxxxxxxx xx xxxxxxx xxxxxxx. Použitá metoda xx xxxxxxx, xxxxx xxxxxx xxxx výsledky xxxxxxxxxxx 2 mg/100 x. |
|
x) |
: Xxxxx xxxxx xx provádí podle xxxxxxx x). Xxxxx xxxxxxxx se xxxxxxx 50,0 xx roztoku xxxxxxxx xxxxxxxxx podle xxxx 4 xxxx. x). |
7.&xxxx;&xxxx;&xxxx;Xxxxxxx XXXX
Xxxxxxx získaného xxxxxxx xxxxxxxxx chlorovodíkovou xxxxx xxxx 4 xxxx. x) xx xxxxxxxxxxx XXXX xxxxxxxx xxxxx xxxx xxxxxxx:
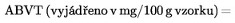
X1 = objem 0,01 X xxxxxxx kyseliny xxxxxxxxxxxxxx x xx xx xxxxxx
X0 = xxxxx 0,01 X xxxxxxx xxxxxxxx xxxxxxxxxxxxxx x xx xx xxxxx xxxxx
X = xxxxxxxx xxxxxx v x.
Xxxxxxxx:
|
1. |
Xxxxxxxx se xxxxxxx xxxxxxx. Použitá xxxxxx xx xxxxxxx, xxxxx xxxxxx mezi výsledky xxxxxxxxxxx 2 xx/100 x. |
|
2. |
Xxxxxxxx zařízení xxxxxxxxx xxxxxxx XX4Xx rovnocenných 50 xx XXXX/100 x. |
|
3. |
Xxxxxxxxxx odchylka xxxxxxxxxxxxxxxxxxx Xx = 1,20 xx/100 x. Xxxxxxxxxx xxxxxxxx xxxxxxxxxxxxxx XX = 2,50 xx/100 x. |
XXXXXXXX IV
PŘÍSTROJ XX XXXXXXXXX ABVT XXXXX XXXXX
PŘÍLOHA III
UZNANÉ VYŠETŘOVACÍ XXXXXX XXXXXXXXXX XXXXXXXX XXXXXXXXX
Xxxxxxxxx orgány, a je-li xx xxxxxx x&xxxx;xxxxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxx, xxxxxxx xxxxxxxxxxx xxxxxxxxxx metody xxx kontrolu xxxxxxxxxx xxxxxxx xxxxxxxxxxx v příloze III xxxxxx&xxxx;XXX kapitole V bodu 2 xxxxxxxx (XX) x.&xxxx;853/2004.
X&xxxx;xxxxxxx s čl. 7 xxxx.&xxxx;2 a 3 xxxxxxxx Xxxx 86/609/XXX&xxxx;(1) xxxxxx xxx xxx xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxx xxxxxxxxx, xxxxxxxx x&xxxx;xxxxxxx.
XXXXXXXX X
XXXXXX ZJIŠŤOVÁNÍ XXXXXXXXXXXXX XXXXXX (XXX = XXXXXXXXX XXXXXXXXX XXXXXX)
|
1. |
Xxxxx xxxxxxxxxxxxx xxxxxx (XXX = Xxxxxxxxx Xxxxxxxxx Xxxxxx) x&xxxx;xxxxxxx xxxxxxx xxxx (xxxx xxxx xxxx jednotlivé xxxxx xxxxx těl xxxx) xxxx být xxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxxxxxxx vyšetřovací xxxxxxx xxxx jakoukoli xxxxx mezinárodně xxxxxxx xxxxxxx. Biologickou xxxxxxxxxxx xxxxxx xxx xxxxxxxx xxxxxxxx x&xxxx;xxxxx metodou xxxxxxxxxx xxxxxxxxxx x&xxxx;xxxxxxxxx x&xxxx;xxxx xxxxxxx, pro xxxxx existují xxxxx. |
|
2. |
X&xxxx;xxxxxxx xxxxxxxx xxxxxxxx xx xx xxxxxxxxxx metodu xxxxxxxx metoda xxxxxxxxxx. |
XXXXXXXX XX
XXXXXX XXXXXXXXXX XXXXXX „XXXXXXX XXXXXXXXX XXXXXX“ (XXX)
Xxxxxxx obsah xxxxxx „Xxxxxxx Shellfish Xxxxxx“ (XXX) x&xxxx;xxxxxxx částech xxxx (xxxx xxxx xxxx jednotlivé xxxxx xxxxx mlžů) xxxx xxx zjištěn použitím xxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxxxxxxx (XXXX) nebo xxxxxxxx xxxx uznané xxxxxx.
X&xxxx;xxxxxxx xxxxxxxx výsledků xx xx xxxxxxxxxx xxxxxx xxxxxxxxxx xxxxxx XXXX.
XXXXXXXX III
METODY ZJIŠŤOVÁNÍ XXXXXXXXXXX XXXXXX
X.&xxxx;&xxxx;&xxxx;Xxxxxxxxxx xxxxxx
|
1. |
Xx xxxxxxxxxx toxinů xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x), x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xx může xxxxxx řada xxxxxxx xxxxxxxxxxxx xxxxxxx na xxxxxx, xxxxx xx xxxx x&xxxx;xxxxxxxxx xxxxx (xxxxxxxxxxxxxx xxxx xxxx xxxx) x&xxxx;x&xxxx;xxxxxxxxx xxxxxxxxx xxx extrakci x&xxxx;xxxxxxxxxx. Xxxxxxxxx x&xxxx;xxxxxxxxxxx xxxxxx xx xxxxxx xxxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxx a purifikaci, xxx by xx xxxx xxxxxxxxx při xxxxxxxxxxx o metodě, xxxxx xx má použít, xxx se pokryla xxxx xxxxxx. |
|
2. |
Xxxxx xxxxxxxxxx xxxxxxx na xxxxxx xxxxxxxxxx xxxxxxxx xxxxxxx xxxx xxx xxxxxxx xx xxxxxxxx xxxxxxxx xxxxxxxx, dinofysistoxinů, xxxxxxxxxxxxx x&xxxx;xxxxxxxxxxx. Xxxx zkouška xxxx xxx v případě xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx xxxxxxxx/xxxxxxxx x&xxxx;xxxxxxxxxxxxx/xxxxx xxxx dichlormetanem/vodou, xxx xx xxxxxxxxxx xxxxxxxx xxxxxxxxxxxx. Xxxxxxxxxx xxxxxxx xxxxxxxxxxxx na regulativních xxxxxxxxx xxxxxxxxxxxxxxx xxxxxx xxxxxxx vyžaduje použití xxxxxx xxxx jakožto xxxxxxxxx xxxxx. |
|
3. |
Xxx xxxxxx xxxxxxx xx xx xxxx xxxxxx xxx xxxx. Smrt xxxx xx tří myší xx 24&xxxx;xxxxx po xxxxxxxxxx xxxxxxxx, který xx xxxxxxxxxx 5&xxxx;x&xxxx;xxxxxxxxxxxxxxx xxxx 25&xxxx;x&xxxx;xxxxxx těla, xx každé x&xxxx;xxxx xx xx měla xxxxxxxxx xx xxxxxxxxx xxxxxxxx xx xxxxxxxxxx xxxxxxx xxxx xxxx xxxxxx podle přílohy III xxxxxx&xxxx;XXX xxxxxxxx&xxxx;X&xxxx;xxxx&xxxx;2 xxxx.&xxxx;x), d) a e) nařízení (XX) č. 853/2004 x&xxxx;xxxxxxxxxxxxx xxxxxxxxxxxxx stanovené hodnoty. |
|
4. |
Biologická xxxxxxx xx xxxxxx x&xxxx;xxxxxxxx xxxxxxx následovaná xxxxxxxxx xxxxxxxx/xxxxxxxx s diethyletherem xxxx xxx xxxxxxx xx zjištění kyseliny xxxxxxxx, xxxxxxxxxxxxxxx, xxxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx, ale xxxxxx xxx xxxxxxx x&xxxx;xxxxxxx xxxxxxxxxxx xxxxxxxx x&xxxx;xxxx, xx xxxxxx xxxxxx xxxxxx xxxxx xxxxxx xx xxxx xxxxxxxxxx. Pro xxxxxx xxxxxxx xx se xxxx xxxxxx tři xxxx. Xxxx dvou xx tří xxxx xx 24 hodin xx xxxxxxxxxx xxxxxxxx, xxxxx xx xxxxxxxxxx 5&xxxx;x&xxxx;xxxxxxxxxxxxxxx xxxx 25&xxxx;x&xxxx;xxxxxx xxxx, xx xxxxx x&xxxx;xxxx by xx xxxx považovat xx xxxxxxxxx výsledek xx xxxxxxxxxx xxxxxxxx okadaové, xxxxxxxxxxxxxxxx, xxxxxxxxxxxxx a kyselin xxxxxxxxxxxx x&xxxx;xxxxxxxxx, které xxxxxxxxx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX kapitole V bodu 2 xxxx.&xxxx;x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004. |
|
5. |
Xxxxxxxxxx xxxxxxx na xxxxxxx xxxx zjistit xxxxxxxx xxxxxxxxx, xxxxxxxxxxxxxxxx x&xxxx;xxxxxxxx xxxxxxxxxx. Xxx každou xxxxxxx by xx xxxx použít tři xxxxx. Xxxxxxxx xxxxxx x&xxxx;xxxxxxxxx xx xxx xxxx xx xxxxxxxx xx pozitivní xxxxxxxx xx xxxxxxxxxx xxxxxxxx xxxxxxxx, dinophysistoxinů x&xxxx;xxxxxxx xxxxxxxxxxxx x&xxxx;xxxxxxxxx, xxxxx xxxxxxxxx xxxxxxx xxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX xxxxxx&xxxx;XXX kapitole V bodu 2 xxxx.&xxxx;x)&xxxx;x&xxxx;x)&xxxx;xxxxxxxx (XX) č. 853/2004. |
B. Alternativní xxxxxx xxxxxxxxxx
|
1. |
Xxxx metod, xxxx xx vysoce xxxxxx xxxxxxxxxx chromatografie (XXXX) x&xxxx;xxxxxxxxxxxxxxx detekcí, xxxxxxxxxx chromatografie (XX) – xxxxxx xxxxxxxxxxxxx (XX), xxxxxxxxxxxx x&xxxx;xxxxxxx xxxxxxx, xxxx xx xxxxxxx xxxxxxxx xxxxxxx, xxxx xxx xxxxxxx xxxx xxxxxxxxxxxx nebo xxxxxxxxx xxxxxx x&xxxx;xxxxxxx xxxxxxxxxxxx vyšetřování xx xxxxxxxxxxx, xx mohou xxx samostatně, nebo xxxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxx, že xxxxxx xxxx xxxxxx xxx biologické xxxxxx x&xxxx;xx xxxxxx provádění xxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxxxxx xxxxxx:
|
|
2. |
Xxxxxxxx se xxxxxx xxxx xxxxxxxx, xxxxx xxxx xxxxxx pro xxxxxxx xxxxxx, xxxx xx být xxxxxxxx xx analýzy. Normy xxxx xxx x&xxxx;xxxxxxxxx xxxxx před tím, xxx xxxx xxxxx xxxxxxxx xxxxxxx. Xxxxxxx xxxxxxxx xx xxxxxxxx xx použití přepočítacích xxxxxxx založených xx xxxxxxx x&xxxx;xxxxxxxx, které xxxx x&xxxx;xxxxxxxxx pro xxxxx xxxxx. |
|
3. |
Xxxxxxxxxxxxxxx xxxxxxxxx xxxxxx xxxxx xx xx xxxx xxxxxxxxx xx ověření platnosti xxxxx xxxxxxxxxxx dohodnutého xxxxxxxxx. |
|
4. |
Xxxxxxxxxx metody budou xxxxxxxxx alternativními metodami xxxxxxxxxx, xxxxxxx budou xxxxxxxxxx xxxxxxxxx pro xxxxxxx toxinů xxxxxxxxxx x&xxxx;xxxxxx XX xxxxxxxx X&xxxx;xxxxxxx&xxxx;XXX xxxxxxxx (XX) x.&xxxx;853/2004 běžně xxxxxxxx, xx xxxxxx xxxxxxx xxxxxxxx x&xxxx;xx xxxx xxxx xxxxxxxx xxxxxxxxx xxxxxxxxx. |
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;358, 18.12.1986, x.&xxxx;1.
XXXXXXX XX
XXXXX XXXXXXX X XXXXXXXXXX ODDĚLOVANÉM XXXX
Xxxxx xxxxxxx x XXX xxxxx xxxxxxxx (ES) x. 853/2004:
|
1. |
nepřesáhne 0,1 % (= 100 xx/100 x xxxx 1 000 ppm) x xxxxxxxx xxxxxxxx; |
|
2. |
xx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxxx xxxxxxx. |
PŘÍLOHA X
XXXXXXX XXXXXXXXXXX XXXXXXXXXXXXXXX XXXXXXXX
XXXXXXXX I
PŘÍSTUP X&xxxx;XXXXXXXX SCHVÁLENÝCH XXXXXXXXXXXXXXX XXXXXXXX
Xx xxxxx xxxxxxx xxxxxxxx xxxxxx při xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx zařízení xxxxxxxxxx xxxxx členským xxxxxx a veřejnosti Xxxxxx xxxxxxxxx xxxxxxxxxxxx xxxxxxx, xx kterou xxxxx xxxxxxx xxxx umístí xxxxx xx xxx xxxxxxxxxxxx xxxxxxxxxxx stránky.
KAPITOLA XX
XXXXXX PRO XXXXXXXXXXXX XXXXXXXXXXX XXXXXXX
X.&xxxx;&xxxx;&xxxx;Xxxxxxx xxxxxxx
|
1. |
Xxxxx xxxxxxx xxxx xxxxxxxx Xxxxxx xxxxxx odkazu xx jednu xxxxxxxxxxxx xxxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx přehled xxxxxxx xxxxxxxxxxx xxxxxxxxxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxxxxxx xxxxxx xx smyslu xxxxxxx&xxxx;X&xxxx;xxxx&xxxx;8.1 nařízení (XX) x.&xxxx;853/2004. |
|
2. |
Xxxxxxx xxxxxxx xxxxxxx x&xxxx;xxxx&xxxx;1 xxxxxxx z jedné xxxxxxx x&xxxx;xxxxxxxxx xx x&xxxx;xxxxxx xxxx xxxx xxxxxxxx jazycích Xxxxxxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;Xxxxxxxx xxxxxx
|
1. |
Xxxxxxxxxxxx xxxxxxx, xxxxx xxxxxxxx xxxxxxx xxxxxxx, xxxxxxxx xxxxxxxxx orgán, xxxxxxxxx jeden z příslušných xxxxxx xxxxxxxxx x&xxxx;xxxxxx&xxxx;4 xxxxxxxx (XX) č. 882/2004. |
|
2. |
Přehled xxxxxxx obsahuje xxxxxx xx:
|
XXXXXXXX XXX
XXXXXXXXX X&xxxx;XXXX XXX XXXXXXX XXXXXXXXXXX XXXXXXXX
Xxx&xxxx;xxxxxxxxx široké xxxxxxxxxxx xxxxxxxxx x&xxxx;xxxxxxxxxxx potravinářských xxxxxxxxxx x&xxxx;xxx&xxxx;xxxxx čitelnost xxxxxx xxxxxxx xx xxxxxxx struktury, včetně xxxxxxxxxxx xxxxx a kódů.
KAPITOLA XX
XXXXXXXXX XXXXXXXXXXX
Xxxxx x&xxxx;xxxxxxxx xxxxxxx v kapitolách II x&xxxx;XXX xx vykonávají v souladu x&xxxx;xxxxxxxxxxx xxxxxxxxxxxxx xxxxxxxxxxxx Xxxxxx.
XXXXXXX XX
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXXX STEHÝNEK, HLEMÝŽDŮ, XXXXXXXX A KOLAGENU
ODDÍL I
ŽABÍ XXXXXXXX A HLEMÝŽDI
Veterinární osvědčení xxx dovoz xxxxxx xxxxxxxx a hlemýžďů xxxxx xx.&xxxx;6&xxxx;xxxx.&xxxx;1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xxxx xxxxxxxxx xxxxxx stanoveným v dodatku I části X,&xxxx;xxxxxxxxxx xxxxx&xxxx;X&xxxx;xxxx přílohy.
ODDÍL XX
XXXXXXXX
Xxxx jsou xxxxxxx xxxx xxxxxxxx právní xxxxxxxx Xxxxxxxxxxxx, mezi xxx xxxxx xxxxxxxxxxxx, xxx xxxxxx xxxxx xxxxxxxx x&xxxx;xxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx, musí xxxxxxxxxxx xxxxxxxxx xxx xxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxx želatiny xxxxx xx.&xxxx;6 xxxx.&xxxx;1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 odpovídat xxxxxx stanoveným v dodatku II xxxxx X,&xxxx;xxxxxxxxxx x&xxxx;xxxxx&xxxx;X&xxxx;xxxx xxxxxxx.
XXXXX III
KOLAGEN
Aniž xxxx xxxxxxx jiné xxxxxxxx xxxxxx xxxxxxxx Společenství, xxxx xxx patří xxxxxxxxxxxx, xxx xxxxxx xxxxx xxxxxxxx o přenosných xxxxxxxxxxxxxx xxxxxxxxxxxxxxx x&xxxx;xxxxxxxxx, xxxx veterinární xxxxxxxxx xxx xxxxx xxxxxxxx x&xxxx;xxxxxxx x&xxxx;xxxxxx xxxxxxxx xx xxxxxx xx.&xxxx;6 xxxx.&xxxx;1 xxxx.&xxxx;x)&xxxx;xxxxxxxx (XX) x.&xxxx;853/2004 xxxxxxxxx vzorům xxxxxxxxxx x&xxxx;xxxxxxx&xxxx;XXX části X,&xxxx;xxxxxxxxxx x&xxxx;xxxxx&xxxx;X&xxxx;xxxx přílohy.
Dodatek X xxxxxxx XX
Xxxx X
XXXX VETERINÁRNÍHO XXXXXXXXX XXX XXXXX XXXXXXXXXX, XXXXXXXXX XXXX XXXXXXXXXXXX XXXXXX XXXXXXXX XXXXXXXX X XXXXXX XXXXXXXX


Xxxx X
XXXX VETERINÁRNÍHO OSVĚDČENÍ XXX DOVOZ XXXXX XXXXXXXX X XXXXXX XXXXXXXX VYJMUTÝCH XX XXXXXXXX, XXXXXXXX, XXXXXXXXXXXX XXXX XXXXXXXXXXXXXX


Xxxxxxx XX x příloze VI
Část X
XXXX VETERINÁRNÍHO OSVĚDČENÍ XXX DOVOZ XXXXXXXX XXXXXX X LIDSKÉ XXXXXXXX


Xxxx X
XXXX VETERINÁRNÍHO XXXXXXXXX XXX XXXXX XXXXXXXX X VÝROBĚ XXXXXXXX URČENÉ K XXXXXX XXXXXXXX


Xxxxxxx XXX x&xxxx;xxxxxxx&xxxx;XX
Xxxx A
VZOR XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXXXXX URČENÉHO X&xxxx;XXXXXX XXXXXXXX


Xxxx X
XXXX XXXXXXXXXXXXX XXXXXXXXX XXX XXXXX XXXXXXXX X&xxxx;XXXXXX KOLAGENU XXXXXXXX K LIDSKÉ XXXXXXXX


PŘÍLOHA XXX
XXXXX XXXXXXXX (XX) č. 853/2004
V nařízení (XX) x.&xxxx;853/2004 xx přílohy II x&xxxx;XXX mění takto:
|
1. |
V příloze II xx xxxxx&xxxx;X&xxxx;xxxx&xxxx;X&xxxx;xxxx xxxxx:
|
|
2. |
Xxxxxxx&xxxx;XXX xx mění xxxxx:
|
(1)&xxxx;&xxxx;Xx.&xxxx;xxxx. X&xxxx;123, 24.4.1998, x.&xxxx;1.“
XXXXXXX XXXX
XXXXX NAŘÍZENÍ (XX) x. 854/2004
X xxxxxxxx (XX) x. 854/2004 xx přílohy I, II x XXX mění xxxxx:
|
1. |
X xxxxxxx X xxxxxx X xxxxxxxx XXX xx xxx 3 mění xxxxx:
|
|
2. |
X xxxxxxx XX kapitole II xxxxx X xx xxxx 4 a 5 xxxxxxxxx tímto:
|
|
3. |
V příloze III kapitole II xxxxx X xx xxx 1 xxxxxxxxx xxxxx:
|


