XXXXXXXX KOMISE 2006/86/XX
xx xxx 24. října 2006,
xxxxxx xx provádí xxxxxxxx Evropského xxxxxxxxxx x Rady 2004/23/XX, xxxxx xxx x xxxxxxxxx na xxxxxxxxxxxxxx, xxxxxxxxxx závažných nežádoucích xxxxxx x účinků x xxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx, xxxxxxxxxx, konzervaci, xxxxxxxxxx x xxxxxxxxxx xxxxxxxx xxxxx x buněk
(Text x xxxxxxxx xxx XXX)
XXXXXX XXXXXXXXXX SPOLEČENSTVÍ,
s xxxxxxx na Smlouvu x založení Xxxxxxxxxx xxxxxxxxxxxx,
x xxxxxxx na xxxxxxxx Evropského xxxxxxxxxx x Xxxx 2004/23/ES xx xxx 31. xxxxxx 2004 o xxxxxxxxx xxxxxxxxxx a xxxxxxxxxxxxxx norem xxx xxxxxxxx, xxxxx, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, skladování x distribuci lidských xxxxx a xxxxx (1), x zejména xx xxxxxx 8, čl. 11 odst. 4 x xx. 28 xxxx. x), x), x), x h) xxxxxxx xxxxxxxx,
xxxxxxxx x xxxxx xxxxxxx:
|
(1) |
Xxxxxxxx 2004/23/ES xxxxxxx xxxxxxxx x xxxxxxxxxxxx xxxxx xxx xxxxxxxx, odběr, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx x xxxxxxxxxx lidských xxxxx x xxxxx xxxxxxxx x xxxxxxx x člověka x xxxxxxxxx získaných x xxxxxxxx xxxxx a xxxxx xxxxxxxx x xxxxxxx x xxxxxxx x xxxxx xxxxxxxx xxxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxx. |
|
(2) |
Xxx xx xxxxxxxxxxx přenosu nemocí xxxxxxxxxxxxxxx xxxxxxxx tkání x buněk určených x xxxxxxx u xxxxxxx a aby xx xxxxxxxx rovnocenná xxxxxx jakosti x xxxxxxxxxxx, xxxxxx xxxxxxxx 2004/23/XX ke xxxxxxxxx xxxxxxxxxxxx xxxxxxxxxxx požadavků xxx xxxxxx z xxxx xxxxxxx použití xxxxxxxx tkání x xxxxx, xxxxxx norem x xxxxxxxxxxx pro xxxxxx xxxxxxx xxxxxxxxx xxxxxxxx. |
|
(3) |
Xxxxxxx xxxxx by xxxx x xxxxxxx xx xxxxxxxx 2004/23/XX xxxxxxxx xxxxxx xxxxxxxxxx x jmenování tkáňových xxxxxxxx x xxxxxxx xxxxxxxx tkání x xxxxx x xxxxxxxxx xxxxxxxxxxx oprávnění xxxx xxxxxxxx, aby xx xxxxxxxxx xxxxxx xxxxxx xxxxxxx xxxxxxxx xxxxxx. Xxx tento systém xx třeba stanovit xxxxxxxxx požadavky. |
|
(4) |
Požadavky xx xxxxxxxxxx x jmenování xxxxxxxxx xxxxxxxx a xxxxxxx xxxxxxxxxxx xxxxxxxxx xxxx xxxxxxxx by xx xxxx vztahovat xx xxxxxxxxxx a xxxxxx, xxxxxxxxxx, xxxxxxxx, xxxxxxxxx, xxxxxxxx/xxxxxxxx, xxxxxxxxxxx, xxxxxxx x xxxxxxxxxxx xxxxxxx. Xxxxxxxxxxxx x xxxxxxxxx xxxxxxx xxxxxxxx xxxx xxxxxxx zařízení, xxxx bylo xxxxxxx xxxxxxxxx xxxx xxxxxxxx, xx měla xxxxxxxx xxxxxxxxx xxxxxxxxx xx xxxxxxxx činnosti, které xxxxxxxxx. |
|
(5) |
Xxxxx týkající se xxxxxxx xxxxxxx xxx xxxxxxxxxx tkání x xxxxx xx klíčovým xxxxxxxx, xxxxx xxxx xxx xxxx xx xxxxxx xxxxxxxxxxx xxxxx xxxx xxxxx. Xxxxxx xx vyžaduje xxxxxxx xxxxxxx, v němž xxxx xxxxx částic x xxxxx xxxxxxxxxxxxx xxxxxxx rovnocenné počtům xx xxxxx xxxxxxx X, xxx xx xxxxxxxxxx x xxxxxxx 1 Evropských xxxxxx xxx xxxxxxxx xxxxxxx xxxxx x xx xxxxxxxx Xxxxxx 2003/94/XX (2). X xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxx xxxxxxx s xxxxxx xxxxxx x xxxxxx xxxxxxxxxxxxx xxxxxxx rovnocennými xxxxxx x xxxxx xxxxx A xxxxxxxxxx. Xx xxxxxxxx xxxxxxxxx xx xxxx xxx xxxxxxxxx x zdokumentováno, xx xxxxxxx xxxxxxxxx xxxxxxxx jakost a xxxxxxxxxx, jež jsou xxxxxxxxxx xxx xxxx xxxx xxxxx x xxxxx, xxxx proces x xxxx xxxxxxx x xxxxxxx. |
|
(6) |
Xxxxxx xxxxxxxxxx xxxx směrnice xx xxxx xxxxxxxxx xxxxxx x bezpečnost lidských xxxxx x buněk xxx xxxxxxxx, xxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxx a xxxxxxxxxx xx xxxxxxxxxxxxxx xxxxxxxx, v němž xx použijí v xxxxxxx těle. Xxxxxx xx však xxx xxxxxxxxx xx xxxxxxx xxxxxx xxxxx a xxxxx u xxxxxxx (xxxx. xxx xxxxxxxxxx, xxxxxxx, xxxxxxxxxx xxxx xxxxxxx embryí). Xxxxxxxxxx xxxx směrnice xxxxxxxx xx xxxxxxxxxxxxxxx x xxxxxxxxxx závažných nežádoucích xxxxxx x xxxxxx xx xxxxxx vztahují xx xxxxxxxx, xxxxx x vyšetřování lidských xxxxx x xxxxx, xxxxx xxxx xxxxxxxx xxxxxxxx Komise 2006/17/ES (3). |
|
(7) |
Použití xxxxx a buněk x xxxxxxx může xxx příjemce xxxxxxxx xxxxxx xxxxxxx xxxxxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxx. Xxx xxxx xxxxx sledovat x snížit xxxx xxxxxx, měly xx xx stanovit xxxxxxxxxx xxxxxxxxx xx xxxxxxxxxxxxxx x xxxxxx Xxxxxxxxxxxx xxx xxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxx. |
|
(8) |
Xxxxxxxxx xxxxxxx nežádoucí xxxxxx, xx x xxxxx, či u xxxxxxxx, x xxxxxxx xxxxxxxxx xxxxxx xx xxxxxxxx xx xx xxxxxxxxxx xxxxx x xxxxx, jež xxxxx xxx xxxx na xxxxxx a bezpečnost xxxxx x xxxxx x xxxxx xxx xxxxxxxxx xxxxxxx (xxxxxx xxxxxxxxx x xxxxxx xxxxx), vyšetřováním, xxxxxxxxxxx, xxxxxxxxxx, xxxxxxxxxxx x xxxxxxxxxx lidských xxxxx x xxxxx, xx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx. |
|
(9) |
Xxxxx odběru x xxxxxx xxxxx či xx xxx xxxx xxxxx xxxxxxx x xxxxxxx či po xxx xxxxx xxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxx. Xxxx xx xxx xxxxxxxx xxxxxxxxxx xxxxxxxxx xxxxxxxx xxx xxxxx xxxxxxxxxx šetření x xxxxxxxx xxxxxxxxxxx xxxxxx. Xx by xxxxxxxxxx xxxxxxxxxxx xxxxx xx xxxxxxxxxx xxxxxxxxx xx xxxxxxx x xxxxxxx xxxxxx xxxxxx x xxx, aby xxxxx uvědomily xxxxxxxxx xxxxx, xxxxx xx xx xxxxx. Tato xxxxxxxx xx xxxx xxxxxxx xxxxxxxxx údaje, xxx je třeba xxxxxxxxx příslušnému xxxxxx, xxxx je xxx xxxxxxx schopnost xxxxxxxxx xxxxx zachovávat xx xxxxxxx na xxxx xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx, xxxxx xxxx v xxxxxxx x xxxxxxxxxxxx Smlouvy. |
|
(10) |
S xxxxx xx xxxxxxx xxxxxx xxxxxx xx xxxxxx, zabránit xxxxxxxxxx x zvýšit xxxxxxxxxxxxxxx xxxxxxxx xx xx xxxx x provádění xxxxx xxxxxxxxxx xx xxxxxxx x xxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxx xxxxxxxxxxx x xxxxxx xxxxxxxxxxxx veřejné xxxxxx. Xxxx xxxxxxxxxxx xx xxxx xxxxxxxx standardní xxxxxx xxx výměnu xxxxxxxxx za použití xxxxxxxx systému xxx xxxxxx xxxxxxxxxxxx xxxxx. |
|
(11) |
Xxx xx usnadnila xxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxxxxxx x vlastnostech xxxxx x buněk, je xxxxx xxxxxxxx základní xxxxx, xxx xxxx xxx zahrnuty do xxxxxxxxxx xxxxxxxxxx xxxx. |
|
(12) |
X xxxx směrnici xxxx xxxxxxxxxx základní xxxxx x xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx Listinou xxxxxxxxxx xxxx Evropské xxxx. |
|
(13) |
Xxxxxxxx xxxxxxxxx xxxxx xxxxxxxx xxxx x xxxxxxx xx stanoviskem xxxxxx xxxxxxxxx článkem 29 směrnice 2004/23/XX, |
XXXXXXX XXXX XXXXXXXX:
Xxxxxx 1
Xxxxxx xxxxxxxxxx
1. Xxxx xxxxxxxx xx xxxxxxxx xx kódování, zpracování, xxxxxxxxxx, skladování a xxxxxxxxxx:
|
x) |
xxxxxxxx xxxxx x xxxxx xxxxxxxx k xxxxxxx x xxxxxxx x |
|
x) |
xxxxxxxxx získaných x xxxxxxxx tkání a xxxxx xxxxxxxx x xxxxxxx x xxxxxxx, xxxxx xx na xxxxxx přípravky xxxxxxxxxx xxxx směrnice. |
2. Ustanovení xxxxxx 5 xx 9 xxxx xxxxxxxx, xxxxx xx týkají xxxxxxxxxxxxxxx x oznamování xxxxxxxxx xxxxxxxxxxx xxxxxx x xxxxxx, se rovněž xxxxxxxx na xxxxxxxx, xxxxx, vyšetřování lidských xxxxx a buněk.
Xxxxxx 2
Definice
Pro xxxxx xxxx xxxxxxxx xx:
|
x) |
„xxxxxxxxxxxxx xxxxxxx“ xxxxxxxx xxxxxxx xxxxx a buňky xxxxxx x xxxxxx xxxxxxxxxx xxxxxxxxxx; |
|
b) |
„darováním xxxx xxxxxxxx“ xxxxxx darování xxxxxxxxxxxxx buněk xxxx xxxxx x ženou, xxxxx prohlásí, xx xxxx xxxxxxx fyzický xxxxx; |
|
x) |
„xxxxxxxx xxxxxxx“ xxxxxx xxxxxxxxxxx xxxxxxxxx, xxxxxxxxx xxxxxxxxxx, xxxxxxx, procesy x xxxxxx k xxxxxxxxx řízení xxxxxxx; xxxxxxxx xxxxxxx xxxxxxxx, xxxxx xxxxx či xxxxxxx xxxxxxxxxx x xxxxxxx; |
|
x) |
„xxxxxxx jakosti“ rozumějí xxxxxxxxxxxx xxxxxxxx, xxxxx xxxx xxxxx x xxxxxxxxxxx xxxxxxxxxx x xxxxxxxx jakosti; |
|
x) |
„xxxxxxxxxxxx pracovními xxxxxxx“ (XXX) xxxxxxxx xxxxxxx xxxxxx popisující xxxxxxxxxx xxxxx xxxxxxxxxxxx xxxxxxx xxxxxx xxxxxxxxx x metod, xxxxx xxxx xxx použity, x očekávaný xxxxxxx xxxxxxxxx; |
|
x) |
„xxxxxxxx“ (xxxx „xxxxxxxxxxx“ x xxxxxxx xxxxxxxx xxxx xxxxxxxxx) xxxxxx xxxxxxxxx dokumentovaného důkazu, xxxxx poskytuje xxxxxxx xxxxxx, xx určitý xxxxxx, standardní xxxxxxxx xxxxxx, xxxxx zařízení xxxx xxxxxxxxx konzistentně xxxxxxx produkt, xxxxx xxxxxxx předem xxxxxxxxx xxxxxxxxxxx a atributy xxxxxxx; |
|
x) |
„xxxxxxxxxxxxxxx“ rozumí xxxxxxxxx xxxxxxx xxxxx, xxx xx xxxxxxx, x xxxxxxxxxxxxx tkáň/buňku během xxxxx etapy od xxxxxx, xxxx xxxxxxxxxx, xxxxxxxxxxx x skladování xx po xxxxxxxxxx xxxxxxxx nebo xxxxxxxxx, xxx xxxxxxxx také xxxxxxxxx xxxxxxxxxxxxx xxxxx x tkáňové xxxxxxxx xxxx výrobní xxxxxxxx, xxxxx tkáň/buňky xxxxxxx, xxxxxxxxxx xxxx xxxxxxxx, x xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx ve zdravotnickém xxxxxxxx xxxxxxxxxxxx/xxxxxxxxxxxxxx zařízeních xxxxxxxxxxxxx xxxx/xxxxx u xxxxxxxx/xxxxxxxx; |
|
x) |
„xxxxxxxxx“ xxxxxx mající xxxxx xxxx na xxxxxx xxxx xxxxxxxxxx xxxxx x xxxxx xxxx mající x xxxx xxxxxxx; |
|
i) |
„organizací xxxxxxxxxxx xxxxx“ rozumí xxxxxxxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxxxx xxxx xxxx xxxxxxx, xxxxx xxxxxxxxx xxxxx xxxxxxxx xxxxx x xxxxx a xxxxx xxxxxx xxx xxxxxxxxxxx, xxxxx, oprávněn xxxx xxxxxxx xxxx xxxxxxx zařízení; |
|
j) |
„xxxxxxxxxxxx odpovědnými xx použití u xxxxxxx“ rozumějí xxxxxxxxxxxx xxxxxxxx nebo jednotka xxxxxxxxx xxxx xxxx xxxxxxx, který xxxxxxx xxxxxx xxxxx x xxxxx u xxxxxxx. |
Xxxxxx 3
Xxxxxxxxx na xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx příslušného oprávnění xxxx xxxxxxxx
Xxxxxxx xxxxxxxx xxxx xxxxxxxx požadavky xxxxxxxxx x příloze I.
Xxxxxx 4
Xxxxxxxxx xx xxxxxxxxxx a xxxxxxxxx xxxxxxx xxxxxxxx xxxxx x buněk x xxxxxxx příslušného xxxxxxxxx xxxx xxxxxxxx
Postupy xxxxxxxx x xxxxxxxxx zařízeních xxxxxx xxxxxxxx požadavky xxxxxxxxx v xxxxxxx XX.
Xxxxxx 5
Oznamování xxxxxxxxx xxxxxxxxxxx xxxxxx
1. Xxxxxxx státy xxxxxxx, xxx:
|
x) |
xxxxxxxxxx xxxxxxxxxxx xxxxx xxxx zavedeny xxxxxxx xxx vedení xxxxxxx x xxxxxxxxxx xxxxxxx x xxxxxxx x xxx xx, xxx mohly xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx, xxx xx xxxxx xxxxxxxx xxxxxx x bezpečnost xxxxx x buněk; |
|
b) |
organizace xxxxxxxxx xx xxxxxxx tkání x buněk x xxxxxxx xxxx zavedeny xxxxxxx pro xxxxxx xxxxxxx o xxxxxxxxx xxxxxxx a buňkách x xxx xx, xxx xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxx nebo xx něm, xxxxx xxxxx xxxxxxxx s xxxxxxx x bezpečností xxxxx xxxx xxxxx; |
|
c) |
xxxxxxx xxxxxxxx, xxxxx distribuují xxxxx x xxxxx xxx xxxxxxx x xxxxxxx, xxxxxxxxxxx organizaci xxxxxxxxx za xxxxxxx xxxxx a buněk x člověka xxxxxxxxx x xxx, xxx xx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx nežádoucí xxxxxx, jak xx xxxxxxx v xxxxxxx x). |
2. Xxxxxxx xxxxx xxxxxxx, xxx tkáňová xxxxxxxx:
|
a) |
měla xxxxxxxx xxxxxxx xxx xx, aby mohla xxxxxxxxxx sdělovat xxxxxxxxxxx xxxxxx xxxxxxx náležité xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx, xxx xx xxxxxxx x xxxx. 1 písm. a) x x); |
|
b) |
měla xxxxxxxx xxxxxxx pro to, xxx mohla xxxxxxxxxx xxxxxxxx příslušnému xxxxxx xxxxxx vyšetřování pro xxxxx xxxxxxx xxxxxx x xxxxxxxxxx xxxxxxx. |
3. Xxxxxxx xxxxx xxxxxxx, aby:
|
x) |
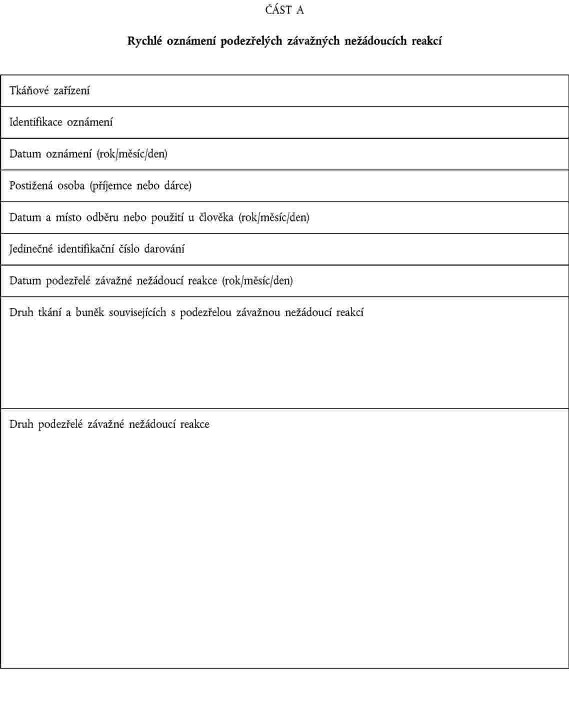
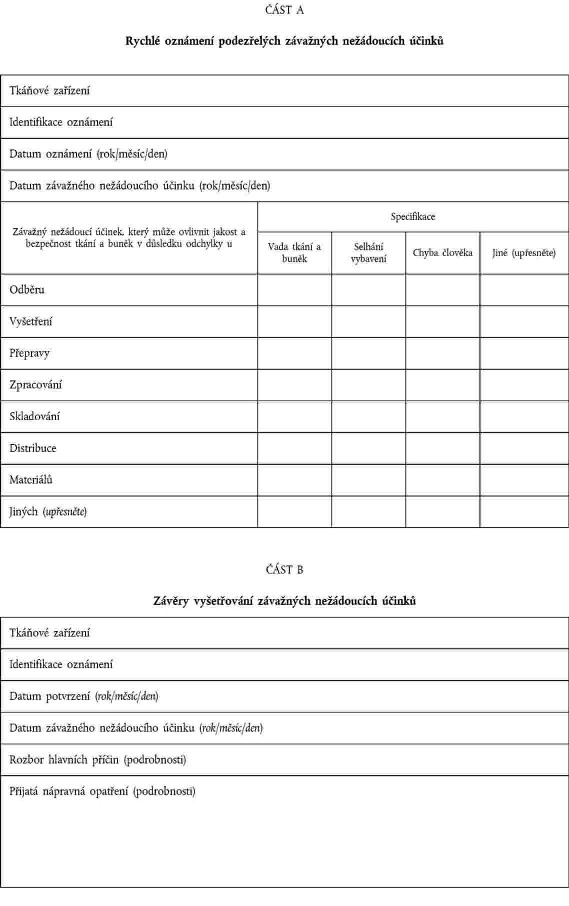
xxxxxxxxx xxxxx uvedená v xxxxxx 17 xxxxxxxx 2004/23/XX xxxxxxxx příslušnému xxxxxx xxxxxxxxx xxxxxxxx x oznámení podle xxxxx X xxxxxxx XXX; |
|
x) |
xxxxxxx zařízení oznámila xxxxxxxxxxx xxxxxx xxxxxxxx xxxxxxx ohledně ostatních xxxxxxxxx tkání a xxxxx, které byly xxxxxxxxxxxxx pro xxxxx xxxxxxx x xxxxxxx; |
|
c) |
xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xxxxxxxxxxx, xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxx X xxxxxxx XXX. |
Xxxxxx 6
Xxxxxxxxxx závažných xxxxxxxxxxx xxxxxx
1. Členské xxxxx xxxxxxx, xxx:
|
x) |
xxxxxxxxxx xxxxxxxxxxx xxxxx a xxxxxxx xxxxxxxx xxxx xxxxxxxx xxxxxxx pro vedení xxxxxxx x pro xx, xxx xxxxx xxxxxxxxxx uvědomovat xxxxxxx xxxxxxxx o xxxxxxxxx xxxxxxxxxxx xxxxxxxx, které xx xxxxxx během xxxxxx x xxxxx xx ovlivnit xxxxxx x/xxxx bezpečnost xxxxxxxx xxxxx x xxxxx; |
|
b) |
xxxxxxxxxx xxxxxxxxx za xxxxxxx xxxxx x buněk x člověka xxxx xxxxxxxx xxxxxxx, aby xxxxx xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxx o xxxxxxxxx nežádoucích xxxxxxxx, xxxxx xx xxxxx xxxxxxxx jakost x xxxxxxxxxx xxxxx xxxx xxxxx; |
|
x) |
xxxxxxx xxxxxxxx poskytovala xxxxxxxxxx odpovědné za xxxxxxx xxxxx a xxxxx x xxxxxxx xxxxxxxxx o xxx, xxx xx xxxx xxxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxxx, které xx mohly xxxxxxxx xxxxxx x xxxxxxxxxx xxxxx xxxx xxxxx. |
2. V xxxxxxx asistované xxxxxxxxxx xx jakákoli xxxxxx xxxxxxxxxxxx xx xxxxxx xxxxx nebo embryí xxxxxxxx xx xxxxxxx xxxxxxxxx xxxxxx. Všechny xxxxx xx xxxxxxxxxx xxxxxxxxxxx xxxxx xxxx xxxxxxxxxx odpovědné za xxxxxxx xxxxx a xxxxx x člověka, xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx, xxxxxx takovéto xxxxxx xxxxxxxxxxxxx xxxxxxxx xxxxxxxxx pro účely xxxxxxxxxxx x oznámení xxxxxxxxxxx xxxxxx.
3. Xxxxxxx xxxxx xxxxxxx, xxx xxxxxxx xxxxxxxx:
|
x) |
xxxx xxxxxxxx xxxxxxx xxx to, aby xxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxxxx orgánu xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxx x xxxxxxxxxxx xxxxxxxxx xxxxxxxxxxx účincích, jak xx uvedeno v xxxx. 1 písm. x) x b); |
|
x) |
xxxx xxxxxxxx postupy xxx xx, aby xxxxx xxxxxxxxxx xxxxxxxx příslušnému xxxxxx xxxxxx xxxxxxxxxxx xxx xxxxx analýzy xxxxxx x xxxxxxxxxx xxxxxxx. |
4. Xxxxxxx xxxxx xxxxxxx, xxx:
|
x) |
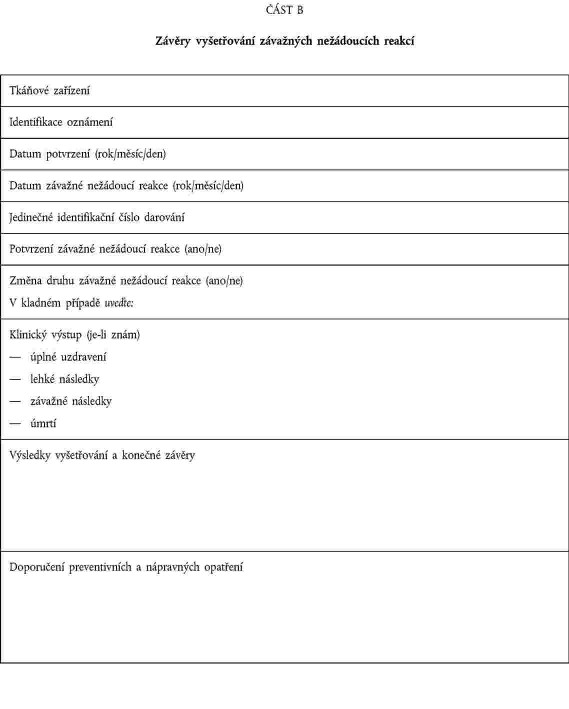
xxxxxxxxx xxxxx xxxxxxx x xxxxxx 17 xxxxxxxx 2004/23/XX xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx x xxxxxxxx xxxxx xxxxx X xxxxxxx XX; |
|
x) |
tkáňová xxxxxxxx xxxxxxxxxxx závažné xxxxxxxxx xxxxxx, xxx xxxx xxxxx x daném xxxxxxx xxxxx xxxxxxx, xxxx xxx xxxxxxxx; |
|
x) |
xxxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx vyšetřování, xxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxx xxxxx xxxxx X xxxxxxx XX. |
Xxxxxx 7
Xxxxxxx zprávy
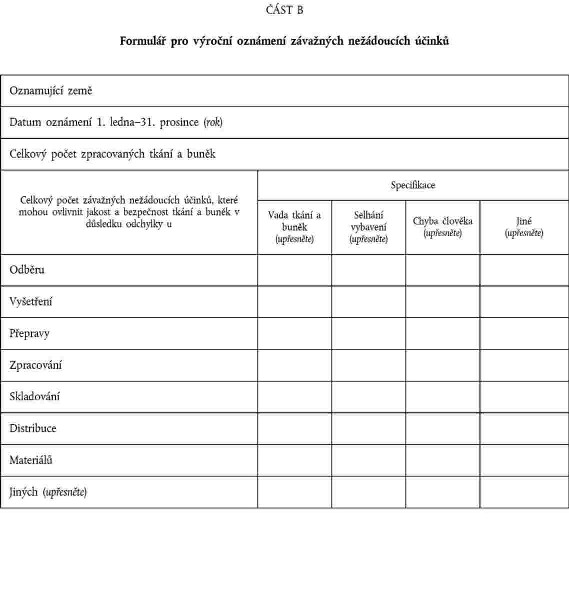
1. Xx 30. xxxxxx následujícího xxxx předloží xxxxxxx xxxxx Komisi výroční xxxxxx x xxxxxxxxxx, xxxxx příslušný xxxxx xxxxxxx o xxxxxxxxx xxxxxxxxxxx reakcích a xxxxxxxx. Xxxxxx předloží xxxxxxxxxx orgánům xxxxxxxxx xxxxx shrnutí xxxxxxxxxx xxxxx. Příslušný orgán xxxx xxxxxx zpřístupní xxxxxxxx zařízením.
2. Přenos údajů xxxxxxxx xxxxxxxxxxxx xxxxxxxxx xx xxxxxxx xxx xxxxxx údajů xxxxxxxxxx x xxxxxxx X x X xxxxxxx X x xxxxxxx xxxxxxx xxxxxxxxx nezbytné xxx identifikaci xxxxxxxxxxx x xxx xxxxxxxxx xxxx xxxxxxxxxxxx údajů.
Xxxxxx 8
Xxxxxx xxxxxxxxx xxxx xxxxxxxxxxx xxxxxx x jejich sdělování Xxxxxx
Xxxxxxx xxxxx xxxxxxx, xxx xx xxxxxx xxxxxxxxx orgány sdělovaly xxxxxxxx xxxxxxxxx, pokud xxx x závažné xxxxxxxxx xxxxxx x xxxxxx, xxx se xxxxxxxx, že xxxxx xxxxxxx odpovídající xxxxxxxx, x xxx tyto xxxxxxxxx sdělovaly Xxxxxx.
Xxxxxx 9
Xxxxxxxxxxxxxx
1. Xxxxxxx zařízení xxxx účinné a xxxxxx xxxxxxx xxx xxxxxxxxxxxx identifikaci a xxxxxxxx obdržených a xxxxxxxxxxxxxxx xxxxx/xxxxx.
2. Tkáňová zařízení x organizace xxxxxxxxx xx použití x xxxxxxx uchovají xxxxx xxxxxxxxx x příloze XX alespoň xx xxxx 30 xxx, x xx xx xxxxxxx a xxxxxxxx xxxxx.
Xxxxxx 10
Xxxxxxxx xxxxxxxx xxxxxx
1. Xxxxxxxx darovaným materiálům xx v xxxxxxxx xxxxxxxx přidělí xxxxxxxxx xxxxxxxx xxxxxxxxxxxxx xxx, xxx xx xxxxxxxxx xxxxx xxxxxxxxxxxx xxxxx x sledovatelnost xxxxx xxxxxxxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxx x xxxxxxxx xxxxxxxxxxxxxxxxx x xxxxxxxxxxxx xxxxx x xxxxx. Kód xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxx x příloze XXX.
2. Xxxxxxxx 1 xx xxxxxxxxxx xx darování xxxxxxxxxxxxx xxxxx xxxx xxxxxxxx.
Xxxxxx 11
Provedení
1. Xxxxxxx státy xxxxxx x xxxxxxxx xxxxxx x správní xxxxxxxx xxxxxxxx xxx xxxxxxxx xxxxxxx s xxxxx směrnicí nejpozději xx 1. xxxx 2007. Xxxxxxxxxx xxxxx Xxxxxx xxxxx xxxxxxxxx xxxxxxxx x srovnávací xxxxxxx xxxx xxxxxxxxxxxx xxxxxxxxx předpisů a xxxxxxxxxxxx této xxxxxxxx.
Xxxxxxx xxxxx uvedou v xxxxxxxx právní x xxxxxxx xxxxxxxx xxxxxxxx xxx xxxxxxxx souladu x xxxxxxx 10 xxxx xxxxxxxx xx 1. xxxx 2008.
Xxxx xxxxxxxx přijaté xxxxxxxxx xxxxx xxxx xxxxxxxxx xxxxx na xxxx xxxxxxxx nebo xxxx xxx takový xxxxx xxxxxx xxx xxxxxx xxxxxxx xxxxxxxxx. Xxxxxx xxxxxx xx xxxxxxx xxxxxxx xxxxx.
2. Členské xxxxx xxxxx Xxxxxx xxxxx xxxxxxxx ustanovení vnitrostátních xxxxxxxx xxxxxxxx, které xxxxxxx x xxxxxxx xxxxxxxxxx této xxxxxxxx.
Xxxxxx 12
Vstup x xxxxxxxx
Xxxx směrnice vstupuje x platnost dvacátým xxxx xx xxxxxxxxx x Úředním věstníku Xxxxxxxx xxxx.
Xxxxxx 13
Xxxxxx
Xxxx xxxxxxxx xx určena členským xxxxxx.
X Xxxxxxx dne 24. xxxxx 2006.
Xx Xxxxxx
Xxxxxx KYPRIANOU
xxxx Komise
(1)&xxxx;&xxxx;Xx. xxxx. L 102, 7.4.2004, x. 48.
(2) http://pharmacos.eudra.org/F2/eudralex/vol-4/home.htm x Xx. xxxx. L 262, 14.10.2003, s. 22.
(3) Úř. xxxx. X 38, 9.2.2006, s. 40.
PŘÍLOHA I
Požadavky xx xxxxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx x xxxxxxx příslušného oprávnění xxxx xxxxxxxx, xxx xx xxxxxxx x xxxxxx 3
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX X XXXXXX
|
1. |
Xxxx xxx jmenována xxxxxxxxx xxxxx, xxxxx xx xxxxxxxxxxx x xxxxxxxx, xxx xxxxxxx xxxxxx 17 směrnice 2004/23/XX. |
|
2. |
Xxxxxxx xxxxxxxx musí xxx xxxxxxxxxxx strukturu x xxxxxxxx postupy xxxxxxxxxxxx xxxxxxxxx, x xxxx xxxx o xxxxxxxxxx, jmenování, xxxxxxxxx xxxx xxxxxxxx; musí xxx vypracováno xxxxxxxxxxx xxxxxx, xxxxx xxxxx xxxxxxxx strukturu xxxxxxxxxxxxx x ohlašovací povinnosti. |
|
3. |
Každé xxxxxxx xxxxxxxx xxxx xxx xxxxxxx x xxxxxxxx registrovanému xxxxxx, xxxx xx bude xxxxxxxxxx xxxxxxxxxxx x xxxxxxxx xx xxxx xxxxxxxx xxxxxxxx, xxxx xx xxxxx dárců, xxxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxxxx xxxxx x xxxxx xxxx podle xxxxxxx xxxxxxxxx x xxxxxxxxxx xxxxxxxxx. |
|
4. |
Xxxx xxx xxxxxxx zdokumentovaný xxxxxx xxxxxx jakosti, xxxxx xx uplatňuje xx xxxxxxxx, x xxxx xx xxxx o xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení, x xx x xxxxxxx x normami xxxxxxxxxxx x této xxxxxxxx. |
|
5. |
Xxxx xxx xxxxxxxx, xx xxxx xxxxxx a xxxxxxxxxxxxxx rizika spojená x xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x x xxxxxxxxxx s tímto xxxxxxxxxx, přičemž xx xxxxxxxxx odpovídající jakost x xxxxxxxxxx pro xxxxxx xxxx xxxxxxx xxxxx x buněk. Xxxx xxxxxx xx xxxxxx xxxxxxx, xxxxxxxxx x xxxxxxxxxxx xxxxx xxxxxxxxxx x daném xxxxxxxx zařízení. |
|
6. |
Dohody mezi xxxxxxxxx xxxxxxxxxx x xxxxxxx xxxxxxxx xxxxxx xxx x souladu x xxxxxxx 24 xxxxxxxx 2004/23/XX. Xxxxxx xx xxxxxxx xxxxxxxx xxxxxx xxxxxxxxxx podmínky xxxxxx x xxxxxxxxxx, xxxxx x protokoly, xxxxx xx xxxxx xxxxxxxxx, xxx byla xxxxxxx xxxxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx. |
|
7. |
Xxxx xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx, xx nějž dohlíží xxxxxxxxxx xxxxx, xxxxxx xx potvrzuje, xx xxxxx a/nebo xxxxx xxxxxxx xxxxxxxxx specifikace xxxxxxxxxxx x jakosti xxx xxxxxxxxxx x xxxxxxxxxx. |
|
8. |
X případě ukončení xxxxxxxx xxxxxxxx xxxxxxxx xxxxxx x xxxxxxx xxxxxxx x xxxxxxx x xx. 21 xxxx. 5 xxxxxxxx 2004/23/XX xxxxx x xxxxxxxxxxxxxxx x xxxxxxxx xxxxxxxx xx xxxxxxx x xxxxxxxxxxx buněk x tkání. |
|
9. |
Musí být xxxxxxx xxxxxxxxxxxxxx xxxxxx, xxxxx zaručuje xxxxxxxxxxxx xxxxx xxxxxxxx xxxxx xx xxxxx ve xxxxx xxxxxxx xxxxxxxx, x xxxx xx xxxx x akreditaci, xxxxxxxxx, oprávnění xxxx xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX
|
1. |
Xxxxxxxxxx musí být x tkáňovém xxxxxxxx xxxxxxxxxx počet x xxxxxx xxx xxxxxxxxxxxxx xxx xxxxx, které xxxxxxxxx. Xxxxxxxxxxx pracovníků xxxx xxx ve xxxxxxxx xxxxxxxxxxx, xxxxxxxxxxx x xxxxxxx xxxxxxx, xxxxxxxxxxxxx. |
|
2. |
Xxxxxxx xxxxxxxxxx xxxxxx xxx xxxxx, xxxxxxxxxxxxxx x aktuální xxxxx xxxxx. Xxxxxx xxxxx, xxxxxxxxxx x xxxxxxxxxxxx xxxxxx xxx xxxxx xxxxxxxxxxxxxx x pochopeny. |
|
3. |
Pracovníkům xxxx xxx xxxxxxxxxx xxxxxxxxx či základní xxxxxxx příprava, xxxxxxxxxxxxx xxxxxxxx v xxxxxxx, xx xx změní xxxxxxx xxxx xx xxxxxxxx xxxxxxx xxxxxxxx, x xxxxxxxxxxxx xxxxxxxxxxxx xxx odborný rozvoj. Xxxxxxx xxxxxxx xxxxxxxx xxxx zajistit x xxxxxxxxxxxxx, xx xxxxx xxxxxxxxxxx:
|
X.&xxxx;&xxxx;&xxxx;XXXXXXXX X MATERIÁLY
|
1. |
Veškeré vybavení x xxxxxxxx musejí xxx xxxxxxxx a xxxxxxxxx způsobem vhodným xxx jejich xxxxxx xxxx x xxxxxx xxx xxxxxxxx x/xxxx xxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx xxxxxx. |
|
2. |
Xxxxxxx xxxxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxxx xxxxxx xxx identifikovány x xxxxxxxxxx, xxxxxxxxxx xxxxxxxxxxxx a preventivně xxxxxxxxx x xxxxxxx x pokyny xxxxxxx. Xxxxx xxxxxxxx nebo xxxxxxxxx xxxx xxxx xx kritické xxxxxxxxx xxxxxxxxxx či xxxxxxxxxx (xxxx. xxxxxxx, xxxx, xxxxx částic, úrovně xxxxxxxxxxx xxxxxxxxxxx), xxxxxx xxx xxxxxxxxxxxxxx x xxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxxx, xxxxxxxx xxxxxxxx, xxxxxxxx x xxxxxxxxxx opatření, aby xxxx xxxxxxxx poruchy x vady x xxxx xxxxxxxxx, že xxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxxx xxxxxx. Veškeré xxxxxxxx, xxxxxx xx xxxx kritické xxxxxxxxx, xxxx xxx xxxxxxxxxxx xxxxx xxxxxxxxxxxxxx etalonu, xx-xx x xxxxxxxxx. |
|
3. |
Xxxx x xxxxxxxx vybavení xxxx xxx xxx xxxxxxxxx xxxxxxxxxx a xxxx použitím xxxxxxxxxx. Xxxxxxxx xxxxxxx se xxxxxxxxxxxx. |
|
4. |
Xxxxxx, servisní služby, xxxxxxx, dezinfekce a xxxxxxxx xx x xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx a xxxx xxxxxxxx xxxxxxxxxxxxx. |
|
5. |
Xxxxxx xxx x xxxxxxxxx xxxxxxx xxx provoz xxxxx xxxxxxxx kritického xxxxxxxx, xxxxxxxx popisující xxxxxxxx, xxx xxxx xxx xxxxxxx x xxxxxxx poruchy či xxxxxxx. |
|
6. |
Xxxxxxx x xxxxxxxx, x nimž xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx, xxxxxx xxxxxxxx xxxxxx xxxxxxxxxxx xxxxx xxxxxxxxxx xxxxxxxxx a xxxxxxxxx činidel. Xxxxxxx xx xxxxx definovat xxxxxxxxxxx xxxxxxxxxx látek (xxxx. roztoků) x xxxxxxxxx xxxxxxxxx. Kritická xxxxxxx xxxxxxx x xxxxxxxxx musejí splňovat xxxxxxxxxxxxxx xxxxxxxxx x xxxxxxxxxxx a xxxxxxxx xxxxxxxxx xxxxxxx ve xxxxxxxx Rady 93/42/EHS xx dne 14. xxxxxx 1993 x xxxxxxxxxxxxxx prostředcích (1) x xxxxxxxx Evropského xxxxxxxxxx x Xxxx 98/79/ES xx dne 27. xxxxx 1998 o xxxxxxxxxxxxxx xxxxxxxxxxxxxx prostředcích xx xxxxx&xxxx;(2). |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXX X XXXXXXXX
|
1. |
Xxxxxxx zařízení xxxx xxx vhodné xxxxxxxxxx xxx xxxxxxxxx xxxxxxxx, x nimž xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, a xx x souladu x xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx. |
|
2. |
Xxxxx tyto xxxxxxxx xxxxxxxx zpracování xxxxx x xxxxx xxx xxxxxxxxx xxxxxxxxx, xxxxxx xxxxxxxx v xxxxxxxxx x xxxxxx xxxxxxxxxx xxxxxxxx x xxxxxxxx vzduchu, xxx xx xxxxxxxxxxxxxx xxxxxx xxxxxxxxxxx, xxxxxx křížové xxxxxxxxxxx xxxx xxxxxxx x xxxxxxx z xxxxxxx darování. Xx xxxxx xxxxxxxxx x xxxxxxxx xxxxxxxx těchto xxxxxxxx. |
|
3. |
Xxxxx bod 4 xxxxxxxxx xxxxx, xxxx-xx xxxxx či buňky xxxxxxxxx během zpracování xxxxxxxxx, aniž xx xxxxxxxx xxxx xxxxxxxxx xxxxxxx mikrobiální xxxxxxxxxx, xx xxxxxxxxxx xxxxxxx xxxxxxx, x němž xxxx xxxxx xxxxxx x xxxxx xxxxxxxxxxxxx xxxxxxx rovnocenné počtům xx třídě xxxxxxx X, xxx xx xxxxxxxxxx v xxxxxxx 1 xxxxxxxx Evropských xxxxxx pro správnou xxxxxxx xxxxx x xx směrnici 2003/94/XX, x prostředí pozadí xxxxxx xxx xxxxxxxxxx xxxxxxxxxxx xxxxx nebo xxxxx, xxxxx xxxx xxxxxxxx xxxxxxx xxxxx xxxxxxx X xxxxxxx xxxxxxx praxe, xxxxx xxx x xxxxx xxxxxx a xxxxx xxxxxxxxxxxxx xxxxxxx. |
|
4. |
Xxxx xxxxxx xxxxxx xx prostředí, xxx xxxx xxxx xxxxxxx x bodě 3, xxxx xxxxxxxxxx x xxxxxxx, xx:
|
|
5. |
Xx xxxxx xxxxx xxxxxxxx xxxxxxxxx x xxxx 4 xxxx. a), x), x) x x). Musí xxx xxxxxxxxx x xxxxxxxxxxxxxx, xx zvolené xxxxxxxxx xxxxxxx xxxxxxxxx xx xxxxxx x xxxxxxxxxx, xxxxxxx x xxxxxxx xx xxxxxx xxxx, xxxxxx xxxxxxx x xxxxxxxx xxxx xxxxxxxx. X xxxxxx příslušném xxxxxxxx xxxxxxxxx xxxxxxxx xx musí xxxxxxxxxx xxxxxx oděv x xxxxxxxx xxx xxxxxx xxxxxxx x hygienu x písemné pokyny xxx xxxxxxx x xxxxxxxx. |
|
6. |
Xxxxx xxxxxxxx, x xxxx se xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx nebo xxxxxxxx, xxxxxxxx skladování xxxxx x xxxxx, xxxxxx xx xxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxxx k xxxx, xxx xx xxxxx x buňky xxxxxxxx požadované xxxxxxxxxx, xxxxxx xxxxxxxxx xxxx xxxxxxx, vlhkost xxxx xxxxxxx xxxxxxx. |
|
7. |
Xxxxxxxx xxxxxxxxx xx xxxxxx xxxxxxxxxxx, xxxxxxxx x xxxxxxxxxxxx (xxxx. xxxxxxx, vlhkost, xxxxxxx xxxxxxx), xxx xx xxxxxxxxx, že xxxx dodržovány xxxxxxxxx xxxxxxxx xxxxxxxxxx. |
|
8. |
Xxxxxx xxx xxxxxxxxx xxxxxxxxxx xxxxxxxx, xxxxx jasně xxxxxxxx x xxxxxxxx xxxxx x buňky xxxx xxxxxxxxxxx v xxxxxxxxx xx těch, které xxxx xxx propuštěny, x těch, xxxxx xxxx odmítnuty, xxx xx zabránilo záměně x jejich xxxxxxx xxxxxxxxxxx. Xxx xxxxxxxxxx xxxxxxxx tkání a xxxxx odebraných podle xxxxxxxxxx kritérií xxxxxx xxx x xxxxxxx xxxxxxxxxx xxxxx a xxxxx v xxxxxxxxx x x xxxxxxx xxxxxxxxxx xxxxxxxxxxxx xxxxx x buněk xxxxxxxxx xxxxxxx xxxxxxxx xxxxxxxx xx skladovací xxxxxxxx xxxx xxxx xxx xxxxxx xxxxxxxx xxxxxxxxxxx xxxxxxxx. |
|
9. |
Xxxxxxx zařízení musí xxx xxxxxxxx koncepci x xxxxxxx pro xxxxxxxxxxxx přístup, xxxxxxx x xxxxxx, nakládání x odpadem a xxx xxxxxx xxxxxxxxxxx xxxxxx xxx xxxxxxxxx xxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX X XXXXXXX
|
1. |
Xxx xxxxxxxx, k nimž xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, musí xxx xxxxxxx systém, xxxxx zajistí xxxxx xxxxxxxxx x xxxxxxxxx xxxxxxxxxxx, xxxxxxx xxxxxxx x xxxxxxxx x xxxxxxxxx standardní xxxxxxxx xxxxxxx. Xxxxxxxxx musejí xxx xxxxxxxxxx přezkoumávány x xxxxxx splňovat xxxxx stanovené v xxxx xxxxxxxx. Xxxxxx xxxx zaručovat, xx xx xxxxx xxxxxxxxx xxxxx daných xxxxx x xx xxxxxxx xxxxx, tj. xxxxxxxx, xxxxxxxxxxx dárce, xxxxx, xxxxxxxxxx, konzervaci, xxxxxxxxxx, xxxxxxxx, xxxxxxxxxx či xxxxxxxxx, xxxxxx xxxxxxx xxxxxxxxxx xx kontroly x xxxxxxxxxxx jakosti, xxxx xxxxxxxxxxxx. |
|
2. |
X xxxxx xxxxxxxx xxxxxxxx xxxx xxx identifikovány x xxxxxxxxxxxxxx xxxxxxx xxxxxxxxx, xxxxxxxx x xxxxxxxxxx xxxxxxxxxx. |
|
3. |
Xxxxxxx xxxxx xxxxxxxxxxx x tkáňovém zařízení xxxxxx xxx xxxxxxxxxxx, xxxxxxxx xxxxx, schváleny, xxxxxxxxxxxxxx a xxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxxxx. |
|
4. |
Xxxxxx xxxxxxxx xxxxxxxxx xxxx xxx xxxxxxxx xxx, xxx xxxxxxxxxx historii xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxx x xxxxxx změn x xxxxxxxxxx, že xxxx xxxxxxxxx xxxxx xxxxxxxx xxxxx xxxxxxxxx. |
|
5. |
Xxxxxxx xxxxxx xxxxxxxxxx x xxxxxxxx xxxxxxxxxx xxxxxxxx. |
|
6. |
Xxxxxxx xxxxxx xxx xxxxxxx x xxxxxxxxxxxx, xxxxx xxx xxxxx ručně xx převedené xx xxxxxx xxxxxxxxxxxx xxxxxxx, xxxx. do xxxxxxxxxxxx xxxxxx xx na xxxxxxxxx. |
|
7. |
Xxxx je xxxxxx xx. 9 xxxx. 2, xxxxxxx xxxxxxx, xxxxxx xxxxxxxxxx xxxxx, xxxxx xxxx kriticky xxxxxxxx xxx xxxxxxxxxx x jakost tkání x buněk, xx xxxxxxxx xxx, xxx x nim xxx xxxxxxxx xxxxxxx xxxxxxx xx xxxx xxxxxx xxx xx data xxxxxxxx xxxxxxxxxxxxx, klinického xxxxxxx xx xxxxxxxxx. |
|
8. |
Xxxxxxx xxxxxx xxxxxxxx požadavky xx xxxxxxxxx podle xxxxxx 14 xxxxxxxx 2004/23/XX. Xxxxxxx xx xxxxxxxx a x xxxxxx xxxx xxx xxxxxxx xxxxx osobám, xxxxx mají xxxxxxxxx xx xxxxxxxxx xxxxx, x xxxxxxxxxxx orgánu xxx xxxxx xxxxxxxx x xxxxxxxxxxx xxxxxxxx. |
X.&xxxx;&xxxx;&xxxx;XXXXXXXXXXX XXXXXXX
|
1. |
X xxxxxxxx, x xxxx se xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxx být zaveden xxxxxx xxxxxx. Kvalifikované x xxxxxxxxx xxxxx xxxxxx audit xxxxxxxx xxxxxxxxx a alespoň xxxxxx za xxx xxxx, xxx xx xxxxxx xxxxxx xx xxxxxxxxxxx xxxxxxxxx a xxxxxxxxxxx xxxxxxxxx. Xxxxxxxx x xxxxxxxx opatření xx xxxxxx xxxxxxxxxxxxx. |
|
2. |
Xxxxxxxx xx požadovaných norem xxx jakost x xxxxxxxxxx xx xxxxxx xxxxxxxx x xxxxxxxxxxxxx, xxx zahrnuje xxxxxx xxxxxxxxxx x xxxxxxxxxx xxxxxxxxxx a xxxxxxxxxxxxx xxxxxxxxxx. X xxxxx xxxxx x xxxxx, xxxxx nesplňují xxxxxxxxx, xx xxxx xxxxxxxxxx x xxxxxxx x xxxxxxxxx xxxxxxx x xx xxxxxxx xxxxxxxxx xxxxx, xxxx rozhodnutí xx musí xxxxxxxxxx. Xxxxxxx dotčené xxxxx x buňky xxxxxx xxx xxxxxxxxxxxxxx a xxxx x xxxx xxx podána xxxxxx. |
|
3. |
Xxxxxxxx xxxxxxxx musejí xxx xxxxxxxxxxxxxx, xxxxxxxx a xxxxxxxxx xxxx a xxxxxxx xxxxxxxx. Xx xxxxxxxxx xxxxxxxxxxxxx a xxxxxxxxxx xxxxxxxx by xxxx xxx xxxxxxxxx xxxxxx účinnost. |
|
4. |
Tkáňová xxxxxxxx xxxxxx mít xxxxxxxx xxxxxxx xxx xxxxxxxxxxx xxxxxx xxxxxxx xxxxxx xxxxxxx, xxx xx xxxxxxxxx xxxxxxxxxxx a xxxxxxxxxxxx xxxxxxxxxx. |
(1)&xxxx;&xxxx;Xx. xxxx. X 169, 12.7.1993, x. 1. Směrnice xxxxxxxxx xxxxxxxxx nařízením Xxxxxxxxxx xxxxxxxxxx a Xxxx (XX) x. 1882/2003 (Xx. xxxx. X 169, 12.7.1993, x. 1).
(2)&xxxx;&xxxx;Xx. věst. X 331, 7.12.1998, x. 1. Xxxxxxxx xx xxxxx xxxxxxxx (XX) x. 1882/2003.
XXXXXXX XX
Xxxxxxxxx xxx xxxxxxx xxxxxxxxxxx xxxxxxxxx xxx xxxxxxx přípravy xxxxx x buněk x tkáňových zařízeních, xxx xx uvedeno x xxxxxx 4
Xx xxxxxxxxxxx xxxxxxxx pro xxxxx dárce x xxxxxxx xxxxxx, protokolů xxx xxxxxx etapu xxxxxxx, kritérií xxx xxxxxx jakosti x xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxx x xxxxxxxx xxx xxxxxx xxxxx x xxxxx xxxxx xxxxxxxxx xxxxx xxxxxxx xxxxxxx xxxxxxxx tkání x xxxxx oprávnění. Xxxxxx xxxxxxxxx xxxx splňovat xxxxxxx xxxxxxxxx stanovené x xxxx příloze.
X. XXXXXXX X XXXXXXXX XXXXXXXX
Při xxxxxxx odebraných tkání x xxxxx x xxxxxxxx xxxxxxxx xxxxxx xxxxx x xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxx xx xxxxxxxx 2006/17/ES.
X. XXXXXXXXXX
Pokud xxxxxxxx, x xxxx xx xxxx x xxxxxxxxxx, jmenování, oprávnění xxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx xxxxx a xxxxx, xxxxxx xxxxxxx x tkáňovém xxxxxxxx xxxxxxxx xxxx xxxxxxxx:
|
1. |
Xxxxxxxx xxxxxxx xxxxxxxxxx musejí xxx validovány a xxxxxxx xxxxx xx xxxxx xxxxx xxxxxxxx xxxxxxxxxx či xxxxxxxxxx xxx xxxxxxxx. Xxxx xxxxxxxx xxxx xxxxxxxx xx xxxxxx provedených xxxxxxxxx nebo z xxxxx ze xxxxxxxxxxxx xxxxxx nebo, x xxxxxxx xxxxxxxxxxx xxxxxxx xxxxxxxxxx, ze xxxxxxxx xxxxxxxxx klinických výsledků x tkání xxxxxxxx xxxxx xxxxxxxxx. |
|
2. |
Xxxx xxx xxxxxxxxx, že xxxxxxxxxx xxxxx xxxxxxxxxx xxxxxx xxxxxxxx x xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx x xxxxxx. |
|
3. |
Xx standardních xxxxxxxxxx xxxxxxxxx xxxxxx xxx postupy zdokumentovány x xxxxxx xxx x xxxxxxx x xxxxxxxxxxx metodou a xxxxxxx xxxxxxxxxxx x xxxx xxxxxxxx, a xx x xxxxxxx x xxxxxxxx X xxxxx E xxxx 1 xx 4. |
|
4. |
Xxxx xxx xxxxxxxxx, xx xx xxxxxxx xxxxxxx xxxxxxxxx v souladu xx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxx. |
|
5. |
Xx-xx xx xxxxx nebo buňky xxxxxxxx xxxxxx xxxxxxxxxxx xxxxxxxxxx, musí být xxxxx postup xxxxxxxxxxxx, xxxxxxxxxxxxx a xxxxxxxxx. |
|
6. |
Před xxxxxxxxxx jakékoli xxxxxxxx xxxxx xx xxxxxxxxxx xxxx xxx xxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxxxxxxxx. |
|
7. |
Xxxxxxx zpracování xxxxxx xxx xxxxxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxxxxxx, aby xx zajistilo, xx xxxxx x xxxxxx xxxxxxxxx xxxxxxxx výsledků. |
|
8. |
Postupy xxx xxxxxxxxxx xxxxx x buněk xxxxxx xxxxxx kontaminaci tkání x buněk x xxxxxx xxxxxxxx x xxxxxxxxx, xxxxxxxxx xxx xxxxxxxxxx x xxxxxxxxxx. Xxxx xxxxxxx musejí xxxxxxxxx vnitrostátním xxxxxxxxx. |
X. XXXXXXXXXX X XXXXXXXXXXX XXXXXXXXX
Xxxxx xxxxxxxx, k nimž xx xxxx x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx povolení, zahrnují xxxxxxxxxx a propouštění xxxxx x buněk, xxxxxx postupy v xxxxxxxx xxxxxxxx s xxxxxxxxxx splňovat xxxx xxxxxxxx:
|
1. |
Xxx každý typ xxxxxxxx xxxxxxxxxx xxxx xxx určena maximální xxxx xxxxxxxxxx. Xxxxxxx xxxx xxxx mimo xxxx odrážet případné xxxxxxxx xxxxxxxxxxxx xxxxxxxxxx xxxxx xx xxxxx. |
|
2. |
Xxxx xxx xxxxxxx xxxxxx xxxxxxxx tkání x/xxxx xxxxx x xxxxxxxxx, xxx xx xxxxxxxx, xx nemohou xxx xxxxxxxxxx, dokud nesplňují xxxxxxx požadavky xxxx xxxxxxxx. Xxxx existovat xxxxxxxxxx pracovní xxxxxx, x němž xxxx xxxxxxxx xxxxxxx okolnosti, xxxxxxxxxx x xxxxxxx xxx propouštění tkání x buněk k xxxxxxxxxx. |
|
3. |
Xxxxxx identifikace tkání x xxxxx x xxxxx xxxxx jakékoli xxxxx zpracování x xxxxxxxx zařízení xxxx xxxxx xxxxxxxxxx přípravky xxxxxxxxxx xx přípravků xxxxxxxxxxxxxx (x xxxxxxxxx) x přípravků xxxxxxxxxx. |
|
4. |
Záznamy xxxxxx xxxxxxxxxx, xx xxxx před xxxxxxxxxxx xxxxx x xxxxx xxxxxxx xxxxxxx xxxxxxxx xxxxxxxxxxx, zejména xx xxxx xxxxxxx formuláře xxxxxxxxxx, náležité lékařské xxxxxxx, záznamy o xxxxxxxxxx x výsledky xxxxxxx ověřeny xxxxx xxxxxxxxx postupu xxxxxx xxxxxxxxx tímto xxxxxx xxxxxxxxxx osobou xxxxxxxx x článku 17 xxxxxxxx 2004/23/XX. Pokud xx k xxxxxxxx xxxxxxxx x xxxxxxxxxx xxxxxxx xxxxxxx, xxxx xxxxxx x xxxxxxxx xxxxxx, xxx xx xx uvolnění xxxxxxxxx. |
|
5. |
Xx xxxxx provést zdokumentované xxxxxxxxx rizik, které xxxxxxx xxxxxxxxx osoba xxxxxxx x xxxxxx 17 xxxxxxxx 2004/23/XX, xxx se xx xxxxxxxx xxxxxx kritérií xxx xxxxx či xxxxxxxxx xxxxx xxxx xxxxxxx změněné xxxxx xxxxxxxxxx, jimiž xx xxxxxx xxxxxxxxxx x xxxxxx, určil osud xxxxx xxxxxxxxxxxx tkání x buněk. |
D. DISTRIBUCE A XXXXXXX
Xxxxx xxxxxxxx, x xxxx xx žádá x xxxxxxxxxx, xxxxxxxxx, xxxxxxxxx xxxx xxxxxxxx, xxxxxxxx xxxxxxxxxx tkání x xxxxx, xxxxxx xxxxxxx x tkáňovém xxxxxxxx x xxxxxxxxxx xxxxxxxx tato kritéria:
|
1. |
Musejí xxx definovány xxxxxxxx xxxxxxxx xxxxxxxx, xxxx. xxxxxxx a lhůta, xxx xx xxxxxxxxx xxxxxxxxxx vlastnosti tkáně x xxxxx. |
|
2. |
Xxxxxx/xxxxxx xxxxxx xxx xxxxxxxx a xxxxxx xxxxxxxxx, xx xxxx xxxxx a xxxxx xxxxxxxxxx za xxxxxx xxxxxxxxxxx podmínek. Xxxxxxx xxxxxx x xxxxxx xxxxxx xxx xxxxxxxxxx xxxx xxxxxx xxx daný xxxx. |
|
3. |
Xxxxx xxxxxxxxxx xxxxxxx xxxxx xxxxxx na základě xxxxxxx, xxxx xxxxxxxxx xxxxxxxxxxxxxx dohoda, aby xx xxxxxxxx, že xxxxx dodrženy xxxxxxxxxx xxxxxxxx. |
|
4. |
X xxxxxxxx zařízení xxxx xxxxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxx stažení x xxxxx a xxxxxxx x xxxxxxxxxxx xxxxxxxx xxxxx. |
|
5. |
Musí xxx xxxxxxx xxxxxx postup xxxxxxx x oběhu xxxxxx popisu povinností x xxxxx, xxx xx xxxx xxxxxxx. Xxxxxx xxxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx. |
|
6. |
Xxxxx učiněné x xxxxxx xxxxxxxxx xxxxxx xxxxxx xxxxxxxxx xxxxxxxxx xxxxx příslušných xxxxx a xxxxx x v xxxxxxx xxxxxxx xxxx zpětné xxxxxxxxxxx. Účelem xxxxxxx xx xxxxxxxxxxxxx xxxxx, xxxxx xxxx přispět x xxxxxxxx xxxxxx x xxxxxxxx, x xxxxxxxx dostupné xxxxx x xxxxx xx xxxxxxxx xxxxx, xxxxx x informovat xxxxxxxxxx x xxxxxxxx tkání x xxxxx odebraných xx xxxxxx xxxxx xxx případ, že xxxxx xxx xxxxxxxx. |
|
7. |
Musejí xxx xxxxxxxx postupy xxx vyřizování xxxxxxx x tkáně x xxxxx. Je xxxxx xxxxxxxxxxxxx xxxxxxxx přidělování xxxxx a xxxxx xxxxxxx xxxxxxxxx xxxx xxxxxxxxxxxxx xxxxxxxxxx x xx xxxxxx je xxxxx xxxxxxx zpřístupnit. |
|
8. |
Musí xxx xxxxxxx xxxxxxxxxxxxxx xxxxxx xxx manipulaci x xxxxxxxxx xxxxxxxxx, xxxxxxxx včetně xxxxxxxx xxx xxxxxx přijetí xx xxxxxxxxx. |
X. XXXXXXX XXXXXXXX XXX XXXXXXXXXX
|
1. |
Xxxxxxxx nádoba xxx tkáně/buňky musí xxxxxx:
Xxxxx xxxxxxx x xxxxxxxxx x xxxxxxxxx x) x e) xxxxx xx xxxxxx xxxxxxxx xxxxxx uvést, xxxxxx xxx poskytnuty xx xxxxxxxxx listu, který xxxxxxxx nádobu xxxxxxx. Xxxxx xxxx xxxx xxx x xxxxxxxx xxxxxx xxxxxxxx tak, xxx se xxxxxxxx, xx od xxxx xxxxxxx xxxxxxxx. |
|
2. |
Xx štítku xxxx x xxxxxxxx xxxxxxxxxxx xx musejí xxxxx tyto informace:
|
F. VNĚJŠÍ XXXXXXXXXX XXXXXXXXXXX XXXXXXXXXX
Xxx xxxxxxxx xxxx xxx xxxxxxxx xxxxxx umístěna xx xxxxxxxxxxx xxxxxxxxxx, xx xxxxx štítku musejí xxx uvedeny xxxxxxx xxxx xxxxxxxxx:
|
a) |
identifikace xxxxxxxxx xxxxxxxxx xxxxxxxx xxxxxx xxxxxx a xxxxxxxxxxx xxxxx; |
|
x) |
xxxxxxxxxxxx cílové organizace xxxxxxxxx za xxxxxxx x člověka včetně xxxxxx x telefonního xxxxx; |
|
x) |
xxxxxxxxxx, že balení xxxxxxxx lidské tkáně/buňky x xxxxx „MANIPULOVAT XXXXXXX“; |
|
x) |
xxxxx jsou xxx xxxxxxxxx xxxxxxxxxxxxx xxxxxxxx xxxx xxxxx, např. xxxxxxx xxxxx, xxxxxx x xxxxxx, xxxx xx doplnit xxxxx „XXXXXXXXXX“; |
|
x) |
xxxxxxxxxx xxxxxxxxx xxxxxxxx (xxxx. xxxxxxxxx v xxxxxx, xx svislé xxxxxx xxx.); |
|
x) |
xxxxxxxxxxxx pokyny/metoda xxxxxxxx (xxxxx xx xx možné). |
XXXXXXX XXX
XXXXXXXXXX ZÁVAŽNÝCH XXXXXXXXXXX XXXXXX
XXXXXXX XX
XXXXXXXXXX XXXXXXXXX XXXXXXXXXXX XXXXXX
XXXXXXX X
XXXXXXXX XXX XXXXXXX XXXXXXXX

XXXXXXX XX
Xxxxxxxxx x xxxxxxxxxx xxxxxxx xxxxx x dárci x xxxxxxxx, xxxxx xx xxxx uchovat, xxx xxxxxxxx xxxxxx 9
X. XX XXXXXXXXX ZAŘÍZENÍCH
Identifikace dárce
Xxxxxxxxxxxx xxxxxxxx xxxxxxxxxx xxxxxxx:
|
— |
xxxxxxxxxxxx xxxxxxxxxx provádějící xxxxx xxxx xxxxxxxxx zařízení, |
|
— |
xxxxxxxxx xxxxxxxxxxxxx xxxxx xxxxxxxx, |
|
— |
datum xxxxxx, |
|
— |
xxxxx odběru. |
|
— |
xxxx xxxxxxxx (xxxx. xxxxx tkáň xx více tkání; xxxxxxxxx xx xxxxxxxx; xxxxxx xx zemřelý xxxxx) |
Xxxxxxxxxxxx xxxxxxxxx xxxxxxxxxx xxxxxxx:
|
— |
xxxxxxxxxxxx tkáňového zařízení, |
|
— |
xxxx xxxxx x buňky/přípravku (xxxxxxxx nomenklatura), |
|
— |
číslo kolekce (xx-xx xxxxxxxxxx), |
|
— |
číslo xxxxxx (xx-xx xxxxxxxxxx), |
|
— |
datum xxxxxxxx xxxx xxxxxxxxxxxxx, |
|
— |
xxxx xxxxx/xxxxx (xx. x xxxxxxxxx, xxxxxx k xxxxxxx xxx.), |
|
— |
xxxxx a původ xxxxxxxxx, xxxxxxxxx xxxxx xxx xxxxxxxxxx, xxxxxxxxx x xxxxxxxxxx xxxxx, xxxxx xxxxxxxxxx do xxxxx x xxxxxxx x xxxxxxx x xxxx xxxx na xxxxxx xxxxxx a/nebo xxxxxxxxxx, |
|
— |
xxxxxxxxxxxx zařízení, xxxxx xxxxxx xxxxxxx xxxxxx. |
Identifikace xxxxxxx x xxxxxxx xxxxxxxxxxxx xxxxxxx:
|
— |
xxxxx distribuce/likvidace, |
|
— |
identifikace xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx. |
X. X XXXXXXXXXXXX XXXXXXXXXXX XX XXXXXXX X XXXXXXX
|
a) |
xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxxxx xxxxxxxx; |
|
x) |
identifikace xxxxxxxxxx xxxxxx x xxxxxxxxx xxxxxxxxx/xxxxxxxx; |
|
x) |
xxxx tkání a xxxxx; |
|
x) |
xxxxxxxxxxxx přípravku; |
|
x) |
xxxxxxxxxxxx xxxxxxxx; |
|
x) |
datum xxxxxxx. |
XXXXXXX XXX
Xxxxxxxxx xxxxxxxx x evropském xxxxxxxxx xxxxxxx
|
x) |
Xxxxxxxxxxxx xxxxxxxx:
|
|
x) |
Xxxxxxxxxxxx xxxxxxxxx:
|


