Věstník MŽP ČR, částka 1/2017
Certifikovaná metodika
(Nmet)
Ověřená metodika pasivního vzorkování pro sledování polybromovaných difenyletherů a jiných hydrofobních kontaminantů ve vodním prostředí
Masarykova univerzita, Přírodovědecká fakulta,
Centrum pro výzkum toxických látek v prostředí RECETOX
Metodika je výsledkem řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA.
Řešitelský tým projektu:
doc. Ing. Branislav Vrana, Ph.D.
prof. RNDr. Jana Klánová, Ph.D.
doc. RNDr. Pavel Čupr, Ph.D.
RNDr. Roman Prokeš, Ph.D.
RNDr. Jana Borůvková, Ph.D.
Ing. Jitka Bečanová, Ph.D.
Foppe Smedes
doc. Mgr. Klára Hilscherová, Ph.D.
Mgr. Jiří Novák, Ph.D.
Mgr. RNDr. Michal Bittner, Ph.D.
Mgr. Ondřej Sáňka, Ph.D.
Ing. Šimon Vojta, Ph.D.
RNDr. Ondřej Mikeš, Ph.D.
Mgr. Anežka Nečasová
Mgr. Katarína Bányiová
Ing. Kateřina Šebková, Ph.D.
Mgr. Jakub Urík
Ing. Barbora Feixová
Všichni výše uvedení členové týmu jsou z Centra pro výzkum toxických látek v prostředí RECETOX, Přírodovědecké fakulty MU - tedy z řešitelského pracoviště projektu.
Citace: Vrana B. a kol.: Ověřená metodika pasivního vzorkování pro sledování polybromovaných difenyletherů a jiných hydrofobních kontaminantů ve vodním prostředí - certifikovaná metodika (Nmet). Masarykova univerzita, RECETOX. RECETOX REPORT No. 597. Listopad 2016.
5 Princip pasivního vzorkování
7 Pasivní vzorkování hydrofóbních organických látek - rozdělovací pasivní vzorkovače
7.1 Dostupné příručky pro použití rozdělovacích pasivních vzorkovačů
7.2 Výběr odběrového místa
7.3 Pasivní vzorkovač na bázi elastomeru ze silikonové pryže
7.4 Příprava vzorkovačů
7.4.1 Příprava vzorkovačů
7.4.2 Přídavek PRC do vzorkovačů
7.4.3 Potřebné množství vzorků
7.4.4 Uskladnění vzorkovačů
7.5 Statické pasivní vzorkování v terénu
7.5.1 Instalace pasivních vzorkovačů v terénu
7.5.2 Vyjímání vzorkovačů
7.6 Dynamické pasivní vzorkování v terénu
7.6.1 Vzorkovací zařízení
7.6.2 Obsluha dynamického vzorkovacího zařízení
7.6.3 Montáž vzorkovače do vzorkovacího zařízení - začátek odběru
7.6.4 Demontáž vzorkovače - konec odběru
7.7 Odeslání vzorků k analýze
7.8 Laboratorní zpracování vzorků
7.8.1 Extrakce vzorkovačů
7.8.2 Extrakce za studena
7.8.3 Redukce objemu rozpouštědla
7.8.4 Čištění extraktu pro stanovení BDE a HBCD
7.8.5 Čištění extraktu pro stanovení nových bromovaných zhášečů hoření (NBFR)
7.9 Instrumentální analýza
7.9.1 Instrumentální analýza BDE a NBFR
7.9.2 Instrumentální analýza HBCD
7.10 Interpretace výsledků měření
7.10.1 Výpočet vzorkovací rychlosti RS
7.10.2 Výpočet koncentrace ve vodní fázi
7.11 Kalibrační parametry vzorkovače
7.11.1 Rozdělovací koeficient vzorkovač-voda (KPW)
7.11.2 Difúzní koeficienty zhášečů hoření v silikonovém elastomeru
7.12 Zajištění a řízení kvality (QA/QC)
7.12.1 Činidlo pro slepé stanovení (reagent blank)
7.12.2 Laboratorní kontrola
7.12.3 Terénní kontrola
7.12.4 Provozní referenční látka (performance reference compound; PRC)
7.12.5 Zařízení pro určení výtěžnosti (recovery spike)
7.12.6 Použití kontrolních a slepých vzorků
7.12.7 Řízení kvality v přípravě vzorků na toxikologickou analýzu
7.13 Reportování
8 Popis novosti a uplatnění metodiky
10 Protokol o odběru vzorků (vzor)
11 Protokol o provozu dynamického vzorkovacího zařízení po dobu expozice vzorkovače (vzor)
12.1 Organizace dat pro výpočet vzorkovacích rychlostí RS (list RS kalkulace Altesil MW)
12.2 Výpočet koncentrace látky ve vodní fázi (Data Cw)
13.1 Princip metody
13.2 Stanovení Kpw
14 Stanovení difúzních koeficientů bromovaných zhášečů silikonové pryži AlteSil (Dp)
14.1 Princip metody
14.2 Stanovení difúzních koeficientů
2 Seznam zkratek a symbolů
|
A |
plocha vzorkovače, kterou difunduje analyt |
|
APV |
adsorpční pasivní vzorkovač |
|
BDE |
bromované difenylethery |
|
Cfree |
koncentrace volně rozpuštěné látky |
|
D |
difúzní koeficient |
|
DCM |
dichlormethan |
|
DEQ |
stupeň dosažení rovnováhy v systému vzorkovač-voda pro sledovanou látku |
|
GC-MS |
plynová chromatografie s hmotnostní spektrometrií |
|
HBCD |
hexabromcyklododekan |
|
HRGC |
plynová chromatografie s vysokým rozlíšením |
|
HRMS |
hmotnostní spektrometrie s vysokým rozlíšením |
|
ChA |
chemická aktivita látky |
|
ji |
difúzní tok látky i-tou fázou |
|
ke |
eliminační rychlostní konstanta prvního řádu |
|
ki |
koeficient přestupu látky i-tou fází |
|
Kmw |
rozdělovací koeficient membrána-voda |
|
Kow |
rozdělovací koeficient oktanol-voda |
|
Kpw |
rozdělovací koeficient vzorkovač-voda nebo polymer-voda |
|
LDPE |
polyetylen s nízkou hustotou |
|
LOD |
mez detekce metody |
|
LOQ |
mez stanovení metody |
|
mp |
hmotnost sorpční fáze (polymeru) vzorkovače |
|
NBFR |
nové bromované zhášeče hoření |
|
NEK |
norma environmentální kvality |
|
PAH |
polycyklické aromatické uhlovodíky |
|
PCB |
polychlorované bifenyly |
|
PDMS |
polydimethylsiloxan |
|
POPs |
persistentní organické látky |
|
PRC |
provozní referenční látky (performance reference compounds) |
|
Q |
průtok vody v systému; objem vody vyměnený za jednotku času |
|
R |
univerzální plynová konstanta |
|
Re |
Reynoldsovo číslo |
|
RPV |
rozdělovací pasivní vzorkovač |
|
RS |
vzorkovací rychlost látky |
|
Sc |
Schmidtovo číslo |
|
Sh |
Sherwoodovo číslo |
|
SPE |
extrakce na tuhé fázi |
|
SPME |
mikroextrakce na tuhé fázi |
|
Sw |
rozpustnost látky ve vodě |
|
TWA |
time-weighted average; časově vážená průměrná koncentráce |
|
VRS |
Vodní Rámcová Směrnice 2000/60/ES |
|
WBL |
mezní difúzní vrstva vody (water boundary layer) |
Klíčová slova
Bromované zhášeče hoření, Pasivní vzorkovací zařízení, odběr vzorků v povrchových vodách, hydrofobní znečišťující látky, volně rozpuštěná koncentrace, silikonová pryž
Terminologie
V metodice je dále použita terminologie definována v ČSN EN ISO 5667-23 Jakost vod - Odběr vzorků - Část 23: Návod pro pasivní odběr vzorků v povrchových vodách [1].
3 Cíl metodiky
Metodika popisuje zařízení/metodu pro účinné pasivní vzorkování polybromovaných difenyletherů a dalších hydrofobních organických látek (hexabromcyklododekan, nové bromované zhášeče hoření) z vodního prostředí, které umožňuje kvantifikaci volně rozpuštěné koncentrace těchto látek ve vodním sloupci, v útvarech povrchových vod na koncentrační úrovni nižší než 1 pg l-1.
Pasivní vzorkování je monitorovací nástroj, kterého lze vhodně využít pro sledování organických látek ve vodě a dalších složkách životního prostředí. Je navržen tak, aby poskytnul informaci o volně rozpuštěných koncentracích sledovaných látek. Ty jsou v mnoha případech nejvhodnějším parametrem, umožňujícím vysvětlení expozice vodních organismů toxickými látkami. Další výhodou je, zároveň umožňuje přímé srovnání naměřených koncentrací ve vodě s koncentracemi naměřenými pasivním vzorkováním v různých jiných složkách vodního prostředí (např. v sedimentech nebo tkáních vodních živočichů) na základě porovnání chemické aktivity sledovaných látek v těchto složkách prostředí. Časově integrační povaha odběru vzorků v kombinaci s použitím vzorkovacího media (polymeru) s dobře definovanými a konstantními vlastnostmi umožňuje, aby se minimalizovala variabilita monitorovacích dat v důsledku vzorkování. Lze kvantitativně stanovit mnohem nižší koncentrace látek, než je možné získat tradičními bodovými odběry vzorků vody. Zároveň poskytuje data s nižší inherentní variabilitou (variabilita pocházející ze samotného způsobu odběru vzorků) než je tomu např. při použití monitorování chemických látek v biotě. Pasivní vzorkování je vhodným nástrojem k monitorování stopových organických znečišťujících látek za účelem hodnocení jejich časových a prostorových trendů v povrchových vodách.
4 Popis metodiky
Součástí metodiky je
-
návrh polymerního materiálu na bázi elastomeru ze silikonové pryže, vhodného pro konstrukci pasivního vzorkovače
-
kalibrační parametry pasivního vzorkovače - rozdělovací koeficienty BDE a dalších hydrofobních látek (HBCD, nové bromované zhášeče hoření, dechlorany Plus) v systému polymer-voda, difúzní koeficienty BDE a dalších hydrofobních látek v polymerním materiálu vzorkovače
-
návrh zařízení pro pasivní vzorkování BDE a dalších hydrofobních látek v terénu z útvarů povrchových vod. Pro dosažení nízkých mezí stanovení BDE a dalších hydrofobních látek ve vodě, dosahuje zařízení vzorkovacích rychlostí až 50 l den-1
-
metodický postup extrakce a úpravy vzorku pasivního vzorkovače před analýzou BDE a dalších hydrofobních látek plynovou nebo kapalinovou chromatografií ve spojení s hmotnostní spektrometrií
-
metodický postup interpretace dat - algoritmus výpočtu koncentrace BDE a dalších hydrofobních látek ve vodě z dat získaných z pasivního vzorkování
Metoda se zabývá principy pasivního vzorkování, přípravou vzorkovačů, jejich nasazením v terénu, laboratorním zpracováním, doporučenými postupy chemické analýzy a výpočtem koncentrací sledovaných látek ve vodním prostředí. Je diskutována i problematika zajištění kvality procesu vzorkování a následného zpracování vzorků v laboratoři. Praktické využití metody je doplněno kalibračními parametry pasivního vzorkovače na bázi silikonové pryže AlteSil, které byly stanoveny pro BDE a další bromované zhášeče hoření v rámci řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA. Metodika je doplněna řadou praktických příkladů použití s cílem zjednodušit uživateli interpretaci dat z pasivního vzorkování. Její součástí je uživatelská pomůcka v prostředí MS Excel pro výpočet koncentrací látek ve vodní fázi z množství sledované látky ve vzorkovači.
Metodika specifikuje postupy pro stanovení časově vážených průměrných koncentrací a rovnovážných koncentrací rozpuštěných podílů BDE a jiných hydrofobních kontaminantů (HBCD, nových bromovaných zhášečů hoření). Lze ji zároveň využít i k monitorování dalších látek, např. polycyklických aromatických uhlovodíků, polychlorovaných bifenylů, organochlorovaných pesticidů ve vodním prostředí s použitím pasivního odběru vzorků s následnou analýzou.
Metoda je ověřena pro aplikaci v povrchové a technologicky vyčištěné komunální odpadní vodě. Je možné ji použít i k pasívnímu odběru pitné a podzemní vody. Povrchově aktivní látky, emulgátory, vyšší koncentrace polárních rozpouštědel mohou ovlivnit akumulaci sledovaných látek do vzorkovače. Přítomnost druhé fáze ve vodě (např. ropné látky, emulgované tuky a vosky) může rušivě působit na proces odběru vzorků. Metoda nebyla ověřena pro použití v nečištěné komunální a průmyslové odpadní vodě. Vzhledem k uvolňování stopových koncentrací provozních referenčních látek (viz kapitola 7.4.2) ze vzorkovače do vzorkované vody metoda není vhodná pro odběr z pitné vody, která je přímo určena ke konzumaci.
Tato metodika má pomoci uživatelům pasivního vzorkování, kteří chtějí realizovat pasivní odběr vzorků bromovaných zhášečů hoření nebo jiných hydrofobních kontaminantů vodního prostředí ve svém výzkumu nebo při monitorování znečišťujících látek. Je určena pro uživatele pasivních vzorkovačů, zejména pro firmy a instituce zabývající se kvalitou a znečištěním vodního ekosystému. V podmínkách ČR jsou to zejména státní podniky Povodí, Český hydrometeorologický ústav a společnosti zodpovědné za kvalitu pitné vody.
5 Princip pasivního vzorkování
Pasivní vzorkování je založeno na použití in situ zařízení, které akumuluje kontaminanty z vody. Přestup kontaminantu z prostředí do vzorkovače je samovolný difúzní proces, který je způsoben rozdílem chemických aktivit monitorované látky mezi vzorkovaným médiem a sorpční fází vzorkovače (Obrázek 1).
Akumulace látky ve vzorkovači probíhá až do ustálení termodynamické rovnováhy (resp. ustáleného stavu v otevřených dynamických systémech, jakými jsou např. řeky) mezi vzorkovačem a vodou, nebo dokud se proces vzorkování nepřeruší. Doba expozice vzorkovačů je obvykle několik dní až týdnů. Akumulované kontaminanty se následně extrahují a v extraktu se stanoví jejich koncentrace. Pokud jsou vzorkovače kalibrované, je možné z množství látky ve vzorkovači vypočítat koncentraci látky rozpuštěné ve vzorkováném médiu, např. ve vodě. Pasivní vzorkování je často integrační, tj získaný vzorek reprezentuje koncentraci látky ve vzorkováném médiu za určité časové období. Velmi důležitým aspektem pasivního vzorkování je možnost vyjádřit množství látky ve vzorkovači v rovnováze se vzorkovaným médiem formou chemické aktivity, která je mírou hnací síly pro samovolný přestup látky mezi různými složkami životního prostředí [2].
V počáteční fázi expozice vzorkovače se látky z vody akumulují do vzorkovače rychlostí, která je přímo úměrná jejich koncentraci ve vodní fázi (lineární fáze vzorkování; Obrázek 2). V této lineární fázi odběru získaný vzorek reprezentuje časově vážený průměr koncentrace látky ve vzorkovaném médiu (vodě) a vzorkování se označuje jako časově integrativní. Po delší době expozice vzorkovače je dosaženo distribuční rovnováhy látky mezi vzorkovačem a vzorkovaným mediem. Tato fáze odběru se nazývá rovnovážné pasivní vzorkování. Díky vysoké sorpční kapacitě (Kpw×mp) a integračnímu charakteru pasivních vzorkovačů je možné monitorovat látky, které se nacházejí rozpuštěné ve vodě v extrémně nízkých koncentracích (řádově pg l-1).
Konvenční metody vzorkování vody, založené na bodových odběrech, neumožňují stanovení takto nízkých koncentrací, ačkoli normy environmentální kvality (NEK), určené Vodní rámcovou směrnicí [3- 5] vyžadují monitorovat některé znečišťující látky ve vodě metodami, které mají mez stanovení na úrovni ng l-1 i níže. V odborné literatuře je dostupných několik přehledových prací, které popisují design, kalibrační postupy, pracovní charakteristiky a příklady aplikace různých pasivních vzorkovačů na monitorování znečišťujících látek ve vodním prostředí [6-18]. Booij a kol. [19] sumarizovali potenciál využití různých pasivních vzorkovačů pro monitorování látek regulovaných Vodní rámcovou směrnicí [3] a i jinými směrnicemi a úmluvami (OSPAR [20]; U.S. Clean Water Act atd.). Vrana a kol. [15] vypracovali pro asociaci laboratoří NORMAN poziční dokument, který uvádí přehled použitelnosti pasivního vzorkování pro monitorování emergentních (dosud neregulovaných) znečišťujících látek ve vodním prostředí. Další aktuální poziční dokument asociace NORMAN o pasivním vzorkování byl publikován mezinárodní skupinou expertů, na základě diskusí na specializovaném workshopu, který se konal v listopadu 2014 v Lyonu [21]. Dokument identifikuje konkrétní aktivity, které je nutné vykonat, aby pasivní vzorkování mohlo být v budoucnu využíváno v rutinním monitoringu vodního prostředí za účelem posouzení rizik, managementu kontaminantů a k hodnocení jejich trendů v životním prostředí. Užitečným zdrojem informací o principech a aplikacích pasivního vzorkování ve vodním prostředí je i specializovaná monografie, věnovaná jedné z nejznámějších vzorkovacích technik, tzv. semipermeabilním membránám (SPMD) [22], a také přehledová monografie o pasivních vzorkovacích technikách pro monitorování životního prostředí [23].
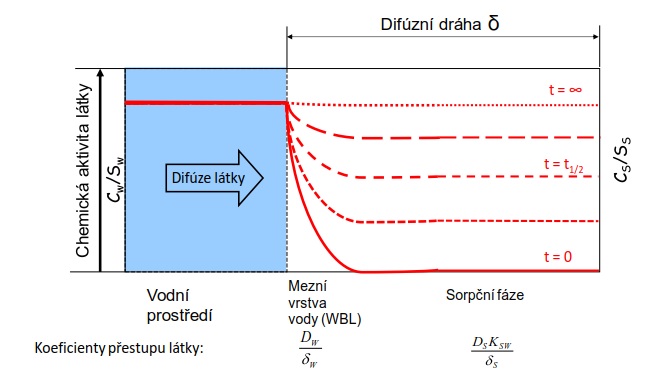
Obrázek 1. Funkční princip pasivního vzorkovače, který ukazuje koncentrační profil látky po dobu difúze a akumulace z vodního prostředí do sorbentu (sorpční fáze) v čase t. Vysoká afinita látky k sorpční fázi je hnací silou difúze molekul sledované látky do vzorkovače, dokud nedojde k vyrovnání chemické aktivity látky v obou médiích, tj. k ustálení termodynamické rovnováhy.
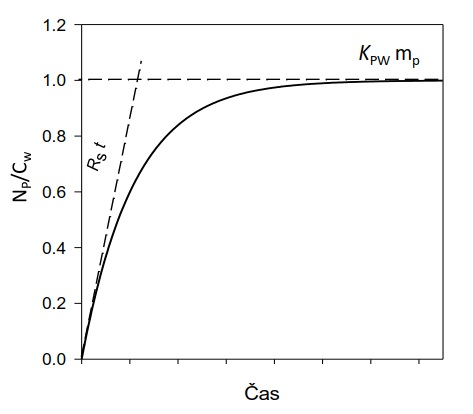
Obrázek 2 Efektivní objem vody extrahovaný vzorkovačem (Np/Cw) jako funkce času. Pro dlouhé expoziční doby je extrahovaný objem omezen sorpční kapacitou vzorkovače (KPW×mp) a pro krátké expoziční časy součinem vzorkovací rychlosti a doby expozice. Přibližné modely, které platí pro lineární část akumulace (krátká doba expozice) a rovnovážné vzorkování (dlouhá doba expozice) jsou znázorněny čárkovanými čarami. Upravené podle [24].
6 Sledované sloučeniny
Tabulka 1 Cílové sloučeniny: Bromované zhášeče hoření
|
Látka |
Zkratka [25] |
CAS |
Vzorec |
|
α-Hexabromcyklododekan |
aHBCD (α-HBCD) |
134237-50-6 |
C12H18Br6 |
|
β-Hexabromcyklododekan |
bHBCD (β-HBCD) |
134237-51-7 |
C12H18Br6 |
|
γ-Hexabromcyclododekan |
gHBCD (γ-HBCD) |
134237-52-8 |
C12H18Br6 |
|
2,4,4'-tribromdifenyl ether |
BDE 28 |
41318-75-6 |
C12H7Br3O |
|
2,2',4,4'-tetrabromdifenyl ether |
BDE 47 |
5436-43-1 |
C12H6Br4O |
|
2,2',4,4',5-pentabromdifenyl ether |
BDE 99 |
60348-60-9 |
C12H5Br5O |
|
2,2',4,4',6-pentabromdifenyl ether |
BDE 100 |
189084-64-8 |
C12H5Br5O |
|
2,2',4,4',5,5'-hexabromdifenyl ether |
BDE 153 |
68631-49-2 |
C12H4Br6O |
|
2,2',4,4',5,6'-hexabromdifenyl ether |
BDE 154 |
207122-15-4 |
C12H4Br6O |
|
Allyl 2,4,6-tribromfenyl ether |
ATE (TBP-AE) |
3278-89-5 |
C9H7Br3O |
|
2,3,5,6-Tetrabrom-p-xylen |
pTBX (TBX) |
23488-38-2 |
C8H6Br4 |
|
2-Bromoallyl-2,4,6-tribromfenyl ether |
BATE (TBP-BAE) |
3728-89-5 |
C6H7Br3O |
|
1,2,3,4,5-Pentabrombenzen |
PBBZ |
608-90-2 |
C6HBr5 |
|
3,4,5,6-Tetrabrom-2-chlortoluen |
TBCT |
39569-21-6 |
C7H3Br4Cl |
|
Pentabromtoluen |
PBT |
87-83-2 |
C7H3Br5 |
|
Pentabromethylbenzen |
PBEB |
85-22-3 |
C8H5Br5 |
|
2,3-Dibrompropyl-2,4,6-tribromfenyl ether |
DPTE (TBP-DBPE) |
35109-60-5 |
C9H7Br5O |
|
Hexabrombenzen |
HBBZ (HBB) |
87-82-1 |
C6Br6 |
|
Pentabromobenzyl akrylát |
PBBA |
59947-55-1 |
C10H5Br5O2 |
|
2-Ethylhexyl-2,3,4,5-tetrabrombenzoát |
EHTBB (EH-TBB, TBB) |
183658-27-7 |
C15H19Br4O2 |
|
1,2-Bis(2,4,6-tribromfenoxy)ethan |
BTBPE |
37853-59-1 |
C14H8Br6O2 |
|
Bis(2-ethyl-1-hexyl)tetrabromoftalát |
BEHTBP (BEH-TEBP, TBPH) |
26040-51-7 |
C24H34Br4O4 |
|
1syn-Dechloran Plus |
s-DP (s-DDC-CO) |
13560-89-9 |
C18H12Cl12 |
|
1anti-Dechloran Plus |
a-DP (a-DDC-CO) |
13560-89-9 |
C18H12Cl12 |
|
1Dechloran Plus Mono adukt |
DPMA |
||
|
α-Tetrabromoethylcyklohexan |
aTBECH (α-DBE-DBCH) |
3322-93-8 |
C8H12Br4 |
|
β-Tetrabromoethylcyklohexan |
bTBECH (β-DBE-DBCH) |
3322-93-8 |
C8H12Br4 |
|
α-1,2,5,6-Tetrabromocyklooktan |
aTBCO (α-TBCO) |
3194-57-8 |
C6H2Br4O |
|
β-1,2,5,6-Tetrabromocyklooktan |
bTBCO (β-TBCO) |
3194-57-8 |
C6H2Br4O |
|
Hexachlorocyclopentenyl-dibromcyklooktan |
HCDBCO (DBHCTD) |
51936-55-1 |
C13H12Br2Cl6 |
1) Tyto látky nepatří mezi bromované zhášeče hoření, byly ale měřeny stejnou analytickou metodou a zahrnuty do studie.
Tabulka 2 Bromované a jiné zhášeče hoření: fyzikálně chemické vlastnosti
|
Zkratka |
CAS |
M (g/mol) |
log KOW |
Rozpustnost ve vodě (25°C) (mg l-1) |
|
aHBCD (α-HBCD) |
134237-50-6 |
641,70 |
5,071) |
0,04881) |
|
bHBCD (β-HBCD) |
134237-51-7 |
641,70 |
5,121) |
0,01471) |
|
gHBCD (γ-HBCD) |
134237-52-8 |
641,70 |
5,471) |
0,00211) |
|
BDE 28 |
41318-75-6 |
406,90 |
5,982) |
0,073) |
|
BDE 47 |
5436-43-1 |
485,79 |
6,552) |
0,001 - 0,0023) |
|
BDE 99 |
60348-60-9 |
564,69 |
7,132) |
0,0093) |
|
BDE 100 |
189084-64-8 |
564,69 |
6,862) |
0,043) |
|
BDE 153 |
68631-49-2 |
643,58 |
7,622) |
0,0013) |
|
BDE 154 |
207122-15-4 |
643,58 |
7,392) |
0,0013) |
|
ATE (TBP-AE) |
3278-89-5 |
370,86 |
5,003) |
208) |
|
pTBX (TBX) |
23488-38-2 |
421,75 |
6,206) |
0,5488) |
|
BATE (TBP-BAE) |
3728-89-5 |
334,83 |
5,603) |
nenalezeno |
|
PBBZ |
608-90-2 |
472,59 |
5,407) |
1,14 |
|
TBCT |
39569-21-6 |
442,17 |
5,707) |
0,38 |
|
PBT |
87-83-2 |
486,62 |
6,994) |
0,0009355) |
|
PBEB |
85-22-3 |
500,64 |
6,766) |
0,0358) |
|
DPTE (TBP-DBPE) |
35109-60-5 |
530,67 |
6,303) |
nenalezeno |
|
HBBZ (HBB) |
87-82-1 |
551,49 |
6,116) |
0,000118) |
|
PBBA |
59947-55-1 |
556,67 |
nenalezen |
nenalezeno |
|
EHTBB (EH-TBB, TBB) |
183658-27-7 |
550,93 |
7,736) |
nenalezeno |
|
BTBPE |
37853-59-1 |
687,64 |
9,154) |
0,25) |
|
BEHTBP (BEH-TEBP, TBPH) |
26040-51-7 |
706,14 |
9,346) |
0,00168) |
|
s-DP (s-DDC-CO) |
13560-89-9 |
653,72 |
9,305) |
nenalezeno |
|
a-DP (a-DDC-CO) |
13560-89-9 |
653,72 |
9,305) |
nenalezeno |
|
DPMA |
nenalezen |
nenalezeno |
||
|
aTBECH (α-DBE-DBCH) |
3322-93-8 |
427,80 |
5,503) |
nenalezeno |
|
bTBECH (β-DBE-DBCH) |
3322-93-8 |
427,80 |
5,503) |
nenalezeno |
|
aTBCO (α-TBCO) |
3194-57-8 |
409,70 |
5,286) |
nenalezeno |
|
bTBCO (β-TBCO) |
3194-57-8 |
409,70 |
5,286) |
nenalezeno |
|
HCDBCO (DBHCTD) |
51936-55-1 |
540,76 |
7,626) |
nenalezeno |
1) [26] 2) [27] 3) [28] 4) [29] 5) [30] 6) [31] 7) [32] 8) [33]
7 Pasivní vzorkování hydrofóbních organických látek - rozdělovací pasivní vzorkovače
Rozdělovací pasivní vzorkovače (RPV) jsou konstruovány z hydrofobních polymerních materiálů s vysokou propustností pro nepolární sloučeniny, RPV absorbují nepolární látky z vody, protože ve srovnání s vodou je rozpustnost látek ve vzorkovači mnohem vyšší než ve vodě. Hydrofobní látky s nízkou rozpustností ve vodě se dobře akumulují v RPV, zatímco hydrofilní látky se koncentrují v mnohem menší míře. Po dostatečně dlouhé expozici koncentrace látky v RPV dosáhne dynamické rovnováhy s koncentrací ve vzorkováném prostředí, např. ve vodě. Z rovnovážné koncentrace látky v RPV je možné vypočítat koncentraci ve vodě pomocí rozdělovacího koeficientu vzorkovač-voda (Kpw). Tato koncentrace vyjadřuje koncentraci volně rozpuštěné látky (Cfree), která ale není totožná s celkovou koncentrací látky ve vzorku vody. Celková koncentrace nepolárních látek ve vodě závisí i na koncentraci látky vázané na rozpuštěné koloidy nebo částečky nečistot organické hmoty ve vodě. Volně rozpustná koncentrace Cfree je přímo úměrná chemické aktivitě látky ve vodě, a proto je vhodným parametrem, který popisuje proces akumulace chemických látek do vodních organismů a také jejich distribuci mezi různými složkami životního prostředí.
Při použití RPV se předpokládá termodynamická rovnováha látky mezi vzorkovačem a vodou, ale při praktickém použití vzorkovačů ve vodě je obvykle dosaženo rovnováhy pouze pro látky s log Kpw < 5,5. Pro hydrofobnější látky je přestup látky příliš pomalý, protože sorpční kapacita vzorkovače je příliš velká. Pro dosažení rovnováhy je potřeba doba expozice 2-8 týdnů. V takových případech se odhad Cfree opírá o měření objemu vody, ze kterého vzorkovač in situ extrahuje sledovanou látku během expozice.
Extrahovaný objem vody (nebo vzorkovací rychlost RS, je-li objem vyjádřený za jednotku času) se dá odvodit z rychlosti uvolňování vybraných značených látek přidaných do vzorkovače před expozicí. V principu jde o stanovení rychlosti uvolňování těchto látek, která je kontrolována difúzí. Rychlostní konstanta eliminace prvního řádu, měřená in situ je pro určitou látku stejná, jako je její rychlostní konstanta akumulace, a proto může být použita k výpočtu Cfree i v situacích, kdy vzorkovač není v rovnováze s okolním prostředím. Byly vyvinuty modely a metody pro odhad vzorkovacích rychlostí látek [34-36], jakož i pro měření rozdělovacích koeficientů Kpw [37-39], což umožnuje výpočet Cfree z koncentrace látky ve vzorkovači.
7.1 Dostupné příručky pro použití rozdělovacích pasivních vzorkovačů
Kromě této metodiky byla již publikována řada dokumentů, které představují užitečné zdroje informací o praktickém použití metody pasivního odběru hydrofobních látek ve vodním prostředí s použitím rozdělovacích pasivních vzorkovačů. Specifikem této metody je prezentace metody pro pasivní vzorkování bromovaných zhášečů hoření. V rámci vývoje metody byly stanoveny specifické kalibrační parametry pasivního vzorkovače na bázi silikonové pryže AlteSil, které umožňují kvantitativní stanovení volně rozpuštěné koncentrace zmíněných látek ve vodním prostředí.
|
|
Zdroje dalších informací: Několik návodů a příruček pro praktické použití pasivního vzorkování ve vodním prostředí lze najít v odborné literatuře [22,40-42]. Starší, komerčně dostupný pasivní vzorkovač na bázi semipermeabilních membrán z polyetylenové folie naplněné trioleinem, tzv. SPMD, je popsán v příručce vydané USGS [43]. V roce 2011 byla poprvé vydána technická norma z řady ISO, která harmonizuje pravidla použití pasivního vzorkování v povrchových vodách [1], V roce 2012 byla vydána ICES (International Council for the Exploration of the Sea) příručka pro pasivní vzorkování hydrofobních látek [44]. |
7.2 Výběr odběrového místa
Před zahájením studie s pasivními vzorkovači je potřebné vhodně zvolit odběrová místa pro jejich umístění, která závisí na účelu, za kterým jsou znečišťující látky monitorovány. Pokud má být sledován stav znečištění stopovými látkami ve vodním útvaru, vzorkovače by měly být umístěny mimo směšovacích zón toků s bodovými zdroji znečištění, jako jsou například vypouštěné odpadní vody z průmyslových i komunálních zdrojů, znečištěné přítoky, kontaminované lokality apod. Dále je užitečné získat informace o míře turbulence vodního toku, průtoku, teplotě, vodivosti, pH, hloubce vody, stratifikaci, potenciálu pro tvorbu biofilmů a zákalu v místě expozice vzorkovačů. Zatřetí je potřeba zvážit možnost, že sledované sloučeniny mohou být podrobeny fotolýze slunečním světlem, a pokud existuje takové riziko, ověřit zda vzorkovací zařízení a expoziční podmínky (např. zákal vody, přirozené stínění) budou dostatečně chránit vzorkovače před slunečním zářením. Pokud tomu tak není, může být potřebné realizovat další opatření, aby se zabránilo fotolytickému rozkladu sledovaných látek. Za čtvrté, je potřeba minimalizovat riziko, že budou po dobu expozice vzorkovače mechanicky poškozeny, ukradeny, nebo úmyslně vytaženy z vody. Nakonec je potřeba posoudit, zda je přístup na místo odběru vzorků bezpečný, a zda lze na místě odběru pracovat bez toho, aby bylo zvýšeno riziko kontaminace vzorků při manipulaci.
7.3 Pasivní vzorkovač na bázi elastomeru ze silikonové pryže
Metodika popisuje pasivní vzorkování bromovaných zhášečů hoření z vodního prostředí do rozdělovacích vzorkovačů na bázi silikonové pryže. K pasivnímu vzorkování sledovaných látek dochází difúzí a akumulací do plátů silikonové pryže na bázi polydimethylsiloxanu (PDMS), vložených při vzorkování do vhodného vzorkovacího zařízení, které umožní přímý kontakt pryže se vzorkovaným médiem (vodou), a zároveň chrání vzorkovač před mechanickým poškozením.
Silikonová pryž je komerčně dostupná od různých výrobců, proto je nutné mít na paměti, že rozdělovací koeficienty polymer/voda mohou být mírně odlišné v závislosti na technologii výroby. Silikonová pryž AlteSil silicone [45] je nejčastěji používaným materiálem se spolehlivými publikovanými hodnotami rozdělovacích koeficientů polymer/voda pro skupinu polycyklických aromatických uhlovodíků a polychlorovaných bifenylů [37]. Pomocí těchto hodnot lze tzv. křížovou kalibrací odvodit hodnoty rozdělovacích koeficientů i pro jiné polymerní materiály [46]. Dostupné silikonové materiály lze použít pro pasivní vzorkování jako listy s tloušťkou polymerního filmu od 0,2 do 0,5 mm. Pláty polymeru lze nastříhat na vhodnou velikost a průbojníkem do nich vyrazit malé kruhové otvory, které pak slouží k uchycení plátů do držáku vzorkovacího zařízení. Plochu povrchu vzorkovače lze zvolit na základě předpokládaných koncentrací sledovaných látek v monitorovaném médiu (vodě). Vzorkovací rychlost je přímo úměrná ploše povrchu pasivního vzorkovače [24], a proto zvětšení povrchu vzorkovače umožní dosažení nižších mezí stanovení za určitý čas, nebo umožní rozdělit vzorkovací plochu na víc podílů a použít ji na různé typy chemických analýz. Volba různých kombinací plochy vzorkovače a tloušťky polymerního filmu umožňuje modifikovat akumulační kapacitu vzorkovače, která je pro zvolenou látku daná součinem její rozdělovacího koeficientu v systému polymer/voda a hmotnosti polymerního filmu (Kpw×mp).
Pasivní vzorkování pomocí polymeru na bázi silikonové pryže (PDMS, ale i jiných polymerních materiálů) ve vodě je pro velmi hydrofobní látky (log Kow > 5,5), jakými jsou např. BDE a jiné bromované zhášeče hoření specifické tím, že ustálení termodynamické rovnováhy vzorkovač-voda je za běžných podmínek možné dosáhnout až po velmi dlouhé době (několik měsíců až roků expozice), Koncentraci BDE ve vodě tedy ve většině případů nelze vypočítat pomocí rovnovážné koncentrace ve vzorkovači pomocí rozdělovacího koeficientu polymer-voda (Kpw). Vzorkování se v tomto případě provádí v tzv. kinetickém režimu, kde je třeba pro každou sledovanou látku stanovit přímo v terénu vzorkovací rychlost, tj. objem vody, ze které vzorkovač extrahoval sledovanou látku za jednotku času (např. 1 den). Výhodou tohoto přístupu je integrativní charakter vzorkování, kdy množství akumulované látky ve vzorkovači odráží časově vážený průměr koncentrace ve vzorkovaném vodním útvaru. Kvůli zkrácení nutné doby expozice je nutné dosáhnout maximálních možných vzorkovacích rychlostí.
Do vzorkovače je před expozicí homogenně přidána řada provozních referenčních sloučenin (PRC) [47], které se během expozice postupně uvolňují ze vzorkovače do okolního vodního prostředí. Koncentrace PRC v exponovaném vzorkovači se srovnává s počáteční koncentrací v kontrolním vzorkovači ze stejné šarže, který nebyl exponován ve vodě a byl po dobu expozice terénního vzorkovače skladován v laboratoři (laboratorní kontrolní vzorkovač; 7.12.2).
7.4 Příprava vzorkovačů
7.4.1 Příprava vzorkovačů
Pláty pryže ze silikonového elastomeru, AlteSil průsvitný, lze zakoupit od výrobce Altecweb (www.altecweb.com; Velká Británie) v rozměrech archů 30×30 cm nebo 60×60 cm. Nejčastěji používaným materiálem jsou pláty o tloušťce 0,5 mm. Jsou k dispozici i materiály o jiné tloušťce, ale mohou vyžadovat odlišné podmínky pro extrakci a analýzu sledovaných látek. Pro ůčel přípravy vzorkovačů jsou pláty nařezány na velikost 7×28 cm nebo 5,5×9,0 cm. Lze použít i pláty o jiném rozměru a od jiného výrobce, ale jen v případě, že jsou přesně známé hodnoty rozdělovacích koeficientů sledovaných látek v systému polymer-voda (Kpw)1.
V případě, že je vzorkovač umístěn do dynamického vzorkovacího zařízení popsaného v části 7.5, je při expozici vzorkovač exponován pouze z jedné strany. V tom případě je při maximálním využití místa ve vzorkovacím zařízení možné exponovat současně jen 1 plát polymeru (7×28 cm), který v tomto případě koresponduje s exponovanou plochou vzorkovače A=196 cm2. V případě oboustranné expozice vzorkovače ve vodě je expoziční plocha dvojnásobná.
Silikonová pryž obsahuje oligomery (polymer s krátkým řetězcem), které mohou interferovat s chemickou analýzou. Tyto oligomery musí být odstraněny před použitím materiálu k vzorkování. Pláty proto jsou extrahovány v Soxhletově extraktoru ethylacetátem po dobu nejméně 100 hodin. Provoz Soxhletova extraktoru může být přerušen v noci (např. z důvodu bezpečnostních předpisů), za předpokladu, že pláty jsou po tuto dobu úplně ponořeny v rozpouštědle. Jsou-li listy příliš nahuštěny v Soxhletově extraktoru, účinnost extrakce se může snížit, a v tomto případě se doporučuje, aby extrakční doba byla prodloužena na přibližně jeden týden. Zkouška, zda byly oligomery dostatečně odstraněny, spočívá v náhodném výběru jednoho plátu z šarže a jeho extrakci, jak je popsáno v kapitole 7.8.1. Po odpaření extraktu do sucha by zbytková hmotnost extraktu měla být nevýznamná. V případě, že zbytková hmotnost extraktu po odstranění rozpouštědla je měřitelná, např. více než 1 mg a zbytek se nerozpouští v 1 ml methanolu, čištění polymeru ethylacetátem bylo pravděpodobně nedostatečné. V návaznosti na čistící extrakci jsou pláty polymeru převedeny do láhví se širokým hrdlem, kde se ethylacetát odstraní z plátů namočením do methanolu dvakrát po dobu 8 hodin, za použití přibližně 16 ml methanolu na plát velikosti 7×28 cm.
7.4.2 Přídavek PRC do vzorkovačů
Disipace provozních referenčních látek (PRC) z exponovaných vzorkovačů se používá k výpočtu in situ vzorkovací rychlosti [36]. Možnými kandidáty na PRC látky jsou izotopicky značené polycyklické aromatické uhlovodíky (deuterované PAH) včetně bifenylu a několik kongenerů PCB (1, 2, 3, 10, 14, 21, 30, 50, 55, 78, 104, 145 a 204); pro tyto látky jsou k dispozici i experimentální hodnoty Kpw pro polymer AlteSil [37]. Bylo dokázáno, že PAH nejsou nejvhodnějšími PRC kvůli jejich možné fotodegradaci během expozice. Tuto vlastnost PAH lze ale využít na indikaci možných ztrát sledovaných látek světelným rozkladem. Nezvykle vysoké ztráty (vyšší než ztráty PCB-PRC s podobnou hodnotou Kpw) d12-chrysenu a d12-benzo[e]pyrenu během expozice vzorkovačů mohou indikovat fotodegradaci [48].
Doporučuje se použít minimálně šest PRC pokrývajících rozsah log Kpw hodnot 3,5 až 5,5 v krocích po přibližně 0,3 log jednotkách. Navíc může být zahrnuta jedna PRC látka, která nebude ze vzorkovače uvolněna vůbec (log Kpw > 6) a také látka, u které se očekává, že ze vzorkovače zmizí úplně (log Kpw < 3,3). Množství PRC by mělo být zvoleno tak, aby koncentrace v extraktu nepřekročila rozsah kalibrace, ale i dostatečně vysoká, aby po disipaci ze vzorkovače byla reziduální koncentrace 10% původního množství PRC stále přesně měřitelná. Množství látky, které má být přidáno do vzorkovačů se vypočte jako počet vzorkovačů (celkový počet plátů dělený počtem plátů na jeden vzorkovač) vynásobený množství na vzorkovač. Množství PRC, které je níže uvedenou procedurou přidáno do vzorkovačů, může být až o cca 30% menší než dávkované množství, kvůli ztrátám během procesu dávkování.
Postup, popsaný níže, může být upraven proporcionálně podle množství vzorkovačů. Na dávkování PRC látek do vzorkovačů se používá skleněná lahev 2,5l se širokým hrdlem. K 0,6 litru methanolu se přidá ne více než 0,6 kg předčištěných plátů polymeru (~ 60 plátů o rozměru 14×28×0,05 cm) a roztok PRC v etylacetátu nebo methanolu. Láhev je třepána a postupně se k směsi přidáva voda do finální koncentrace 50% methanolu podle schématu uvedeného v Tabulka 3. I když vysoký podíl přidaných PRC látek je absorbován do silikonového polymeru, malé množství zůstává přítomno v roztoku (50% methanol), který se následně likviduje jako odpad obsahující organická rozpouštědla. Typická variabilita koncentrace PRC mezi jednotlivými pláty je cca. 5%.
Tabulka 3 Schéma pro přípravy vzorkovačů obsahujících PRC sloučeniny
|
Čas |
Objem methanolu (ml) |
Přidaný objem vody (ml) |
Celkový objem vody (ml) |
Obsah vody ve směsi (% v/v) |
Časový krok (h) |
|
0 |
600 |
0 |
0 |
0 |
|
|
24 |
600 |
74 |
74 |
11 |
24 |
|
48 |
600 |
76 |
150 |
20 |
24 |
|
72+ |
600 |
107 |
257 |
30 |
>24 |
|
120+ |
600 |
143 |
400 |
40 |
>48 |
|
168+ |
600 |
200 |
600 |
50 |
>48 |
7.4.3 Potřebné množství vzorků
Každá šarže se skládá ze vzorkovačů pro všechny plánovaná místa odběru v rámci jedné vzorkovací kampaně. Tento počet se zvyšuje o minimálně tři laboratorní kontrolní vzorky (7.12.2), které se neexponují v terénu, ale jsou využívány s cílem zjistit možnou kontaminaci vzorkovačů během přípravy, dále k zjištění počáteční koncentrace PRC látek ve vzorkovačích dané šarže, a též k výpočtu mezí stanovení (LOQ). Dále se doporučuje zahrnout cca 20% terénních kontrolních vzorkovačů (7.12.3). Terénní kontroly jsou vzorkovače, které nejsou nasazeny v terénu ve vodě, ale exponují se na vzduchu během nasazení a vyjmutí exponovaných vzorkovačů. Počet potřebných plátů silikonové pryže (nplát), který je potřebný pro konkrétní terénní kampaň, se vypočítá z počtu míst odběru vzorků (nmíst):
nplát = [1.2nmíst + MAX(nmíst/10,3)] x nplát/vzorkovač (Rovnice 1)
|
|
Pozor! Kvůli opakovatelnosti a vzájemné porovnatelnosti vzorků je důležité, aby série vzorkovačů určená pro jednu terénní kampaň byla zhotovena z materiálu homogenního zložení, a aby množství přidaných PRC látek byla stejná ve všech použitých vzorkovačích. Doporučuje se, aby byl pro každou sérii připravených vzorkovačů proveden test homogenity analýzou PRC látek v náhodně vybraných vzorkovačích. Pro urychlení testu homogenity lze použít rychlých analytických metod, např. tepelné desorpce v kombinaci s plynovou chromatografií. |
7.4.4 Uskladnění vzorkovačů
Po odstranění přebytečného rozpouštědla jsou ještě mokré pláty baleny do vzduchotěsných nádob z tmavého skla (100-250 ml) se šroubovacím víkem, vyloženým hliníkovou fólií nebo fólií z plechu či nerezavějící oceli. Víka se vzduchotěsně uzavřou a sklenice se skladují při - 20°C. Vzorkovače nemusejí být zmrazeny v průběhu transportu, ale měly by být uchovávány v temnu, aby se zabránilo fotolýze deuterovaných polycyklických aromatických uhlovodíků.
7.5 Statické pasivní vzorkování v terénu
Obecná pravidla pro rozmisťování, expozici a vyjímání pasivních vzorkovačů v terénu jsou popsána v normě ČSN EN ISO 5667-23 [1]. Pasivní vzorkovače mohou být nasazeny ve vodě s použitím různých vzorkovacích zařízení. Účelem odběrového zařízení je udržet vzorkovače v požadované poloze, ve vodním sloupci a chránit je před poškozením proudem vody nebo předměty unášenými proudem, povětrnostními podmínkami, lodní dopravou, nebo vodními organismy [41]. Některá zařízení, např. klece z perforovaných ocelových plátů také poskytují zastínění vzorkovačů, čímž snižují riziko fotodegradace sledovaných látek. Pasivní vzorkovače mohou být často snadno nasazeny za použití levných odběrových zařízení, jako jsou mříže z nerezové oceli nebo z pozinkovaného pletiva (viz Obrázek 3, vlevo). Robustnější držáky jsou potřebné při vzorkování pod silnými proudy vody, kdy zařízení musí chránit vzorkovače před mechanickým poškozením. Při použití vzorkovačů v mořské vodě musí být všechny komponenty vyrobeny z materiálů odolných vůči korozi kovů (například nerezová ocel AISI 316 L nebo titanová slitina). Příklady různých vzorkovacích zařízení lze nalézt i v literatuře [41,43,44].

Obrázek 3 Příklady různých způsobů instalace pasivních vzorkovačů na bázi silikonové pryže v terénu.
Vzorkovací zařízení by měla být vybavena upevňovacím okem, které umožní zavěšení vzorkovačů na bóji, na mostním tělese nebo na mole. Uzly mohou být zajištěny stahovacími pásky. Příklad instalace vzorkovače je uveden na Obrázek 6.
7.5.1 Instalace pasivních vzorkovačů v terénu
Při rozmísťování vzorkovačů v terénu platí všeobecná pravidla uvedená v normě ČSN EN ISO 5667-23 Jakost vod - Odběr vzorků - Část 23: Návod pro pasivní odběr vzorků v povrchových vodách [1].
7.5.1.1 Materiál potřebný na instalaci pasivních vzorkovačů
-
Vzorkovací zařízení - držák vzorkovače
-
Vzorkovače v označených transportních vzorkovnicích z tmavého skla s širokým hrdlem a s šroubovacím uzávěrem s vložkou z nerezového ocelového plechu (viz obr. 4)
-
Programovatelný teplotní záznamník (logger)
-
Dvě pinzety s tupými konci
-
Čistý nerezový pekáč nebo tác na manipulaci se vzorkovači
-
Plastové stahovací pásky
-
Ultračistá voda
-
Nylonové lano
-
Kotva nebo závaží na ukotvení vzorkovačů ke dnu
-
Bóje nebo plovák
-
Zařízení pro měření teploty, vodivosti a pH vody
-
Odběrové zařízení na odběr vzorků vody - kbelík na laně nebo vzorkovnice na tyči
-
Vinylové rukavice
7.5.1.2 Postup rozmísťování vzorkovačů
1. Připravte si všechen materiál potřebný k instalaci vzorkovačů (7.5.1.1).
2. Otevřete vzorkovnici s terénní kontrolou (7.12.3), pomocí pinzety vyjměte kontrolní vzorkovač a položte jej na nerezový tác (pozor, je potřeba zabezpečit, aby vzorkovače neodfoukl vítr). Zaznamenejte čas do odběrového protokolu (viz část 10) (Obrázek 4).
3. Pomocí pinzety vyjměte vzorkovač ze vzorkovnice a pomocí stahovacích pásků jej upevněte na držák vzorkovacího zařízení (Obrázek 5).
4. K držáku vzorkovacího zařízení upevněte automatický záznamník teploty a aktivujte ho (Obrázek 18).
5. Po založení všech plátů silikonové pryže (vzorkovače) do držáku vzorkovacího zařízení, upevněte vzorkovací zařízení pomocí lana k břehu (příklad viz Obrázek 6 a 7) a vzorkovací zařízení ponořte co nejrychleji do vody.
6. Vzorkovací zařízení se ukotví vhodně k říčnímu nebo jezernímu břehu nebo také ke dnu v místě odběru vzorků a ponoří se pod hladinu pomocí bóje nebo plováku (příklad viz Obrázek 6 a 7).
7. Uzavřete všechny prázdné vzorkovnice a odložte je na čistém místě v laboratoři - budou zase použity při vyjmutí vzorkovačů po expozici.
8. Vložte pomocí pinzety terénní kontrolu (7.12.3) zpátky do její vzorkovnice. Zaznamenejte čas ukončení instalace vzorkovačů. Terénní kontrola by měla být transportována zpátky do laboratoře a skladována při -20°C.

Obrázek 4 Příprava pasivních vzorkovačů na instalaci v terénu. Vzorkovnice na transport a uskladnění vzorkovače je na obrázku vlevo nahoře.

Obrázek 5 Příprava pasivních vzorkovačů na instalaci v terénu
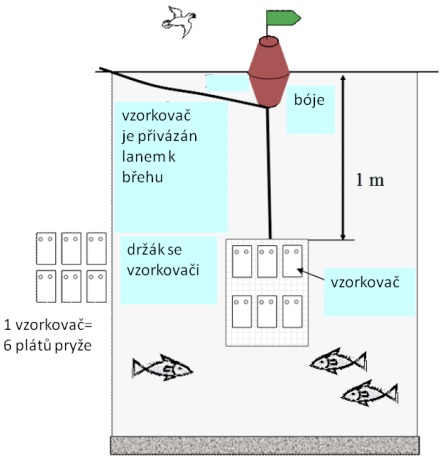
Obrázek 6 Příklad instalace vzorkovacího zařízení pro statickou expozici pasivních vzorkovačů v terénu. Vzorkovač může být v případě silného proudění vody ukotven o dno pomocí kotvy nebo závaží (tato varianta není na obrázku).

Obrázek 7 Příklad instalace vzorkovacího zařízení pro statickou expozici pasivních vzorkovačů v terénu.

Obrázek 8 Pasivní vzorkovač před (obr. vlevo) a po (obr. vpravo) 28 - denní expozici v povrchové vodě.

Obrázek 9 Vyjmutí vzorkovačů po expozici a jejich čištění po expozici na místě pomocí vody odebrané z místa odběru.

Obrázek 10 Vkládání vzorkovačů do vzorkovnice po odběru pomocí pinzety.
7.5.2 Vyjímání vzorkovačů
Při vyjímání vzorkovačů z vody po expozici platí všeobecná pravidla uvedená v normě ČSN EN ISO 5667-23 Jakost vod - Odběr vzorků - Část 23: Návod pro pasivní odběr vzorků v povrchových vodách [1].
7.5.2.1 Materiál potřebný při vyjímání pasivních vzorkovačů po expozici
-
Transportní vzorkovnice, v kterých byly vzorkovače transportovány na odběrové místo (viz obr. 4)
-
Dvě pinzety s tupými konci
-
Čistý nerezový pekáč nebo tác na manipulaci se vzorkovači
-
Nylonová drátěnka (extrahovaná v metanolu)
-
Ultračistá voda
-
Skleněná kádinka
-
Zařízení pro měření teploty, vodivosti a pH vody
-
Odběrové zařízení na odběr vzorků vody - kbelík na laně nebo vzorkovnice na tyči
-
Vinylové rukavice
-
Papírové ubrousky na osušení vzorkovačů
7.5.2.2 Postup vyjímání vzorkovačů po expozici
1. Otevřete vzorkovnici s terénní kontrolou (7.12.3), pomocí pinzety vyjměte kontrolní vzorkovač a položte jej na čistý nerezový tác. Zaznamenejte čas do odběrového protokolu (viz část 10) (Obrázek 4).
2. Vyjměte vzorkovací zařízení z vody. Zkontrolujte, zda vzorkovače během expozice nebyly poškozeny.
3. Proveďte fotodokumentaci exponovaných vzorkovačů po jejich vyjmutí z vody (Obrázek 8).
4. Pomocí pinzety vyjměte exponovaný vzorkovač a položte jej do čistého nerezového pekáče naplněného lokální vodou (Obrázek 9).
5. Použitím vody z odběrového místa a nylonové drátěnky očistěte vzorkovače od nárůstu biofilmu za co nejkratší dobu.
6. Osušte vzorkovače pomocí papírového ubrousku.
7. Vložte pomocí pinzety terénní kontrolu (7.12.3) a exponované vzorkovače zpátky do jejich označených vzorkovnic.
8. Zaznamenejte čas ukončení instalace vzorkovačů.
9. Vzorkovače by měly být transportovány zpátky do laboratoře a skladovány při -20°C.
V závislosti na ročním období a místě expozice vzorkovače mohou být čisté nebo úplně zarostlé nárosty řas nebo jiných vodních organismů. Pokud je povrch vzorkovače silně porostlý nárůstem biofilmu, měl by se před uskladněním vzorkovačů odstranit co nejúplněji. Doporučuje se dokumentovat fotografií situaci exponovaných vzorkovačů po jejich vyjmutí z vody. Čištění vzorkovačů se nejlépe provádí ihned po vyjmutí z vody pomocí měkké nylonové drátěnky (jaká je používána běžně v kuchyni - nylonová drátěnka bez pěnové houby se před použitím promyje methanolem a pak ultračistou vodou) a vodou odebranou v místě vzorkování. Po dobu čištění je vzorkovače nutno udržovat co nejvíce ponořeny do vody. Čištění by mělo být provedeno v co nejkratším možném čase, např. méně než 5 minut. Po vyčištění jsou vzorkovače vysušeny suchým papírovým ubrouskem. Poté se vzorkovače vloží se do stejné vzorkovnice, ve které byly přineseny na místo odběru a vzorkovnice se vzduchotěsně uzavřou. Vzorkovnice se umístí do chlazeného transportního kontejneru bez přístupu světla a transportují se co nejrychleji do laboratoře. Vzorkovače, které jsou téměř čisté, se nejprve otřou namočenou papírovou utěrkovu, následně se vysuší suchým papírovým ubrouskem a přenesou do stejné vzorkovnice, ve které byly přineseny na místo odběru.
|
|
Pozor! Čištění pasivních vzorkovačů je nejlépe provést bezprostředně po vyjmutí z vody použitím vody z vzorkovaného vodního útvaru. Ponoření vzorkovačů do vody z místa odběru minimalizuje jejich expozici z ovzduší a související ztráty látek nebo kontaminaci vzorkovačů. Ztráta sledovaných látek je přímo úměrná trvání procesu čištění na vzduchu, ale nikoli v případě, že jsou vzorkovače ponořeny ve vodě. Voda z odběrového místa obsahuje sledované látky v podobných koncenracích, jakým byl vzorkovač vystaven během expozice. Proto je lokální voda vhodnější na čištění než například destilovaná voda z laboratoře. |
7.6 Dynamické pasivní vzorkování v terénu
Tuto variantu vzorkovacího zařízení lze použít v případě, že doba odběru je časově omezená. V takovém případě by bylo riziko, že klasické statické pasivní vzorkování neumožní navzorkovat dostatečné množství sledovaných látek. Zařízení lze úspěšně využít i v tocích nebo jezerech s nízkou přirozenou rychlostí proudění vody. Pomalé proudění vody kolem vzorkovače způsobuje nízké vzorkovací rychlosti látek, jejichž akumulace je kontrolována difúzí v mezní difúzní vrstvě vody; v případě použití vzorkovačů na bázi silikonové pryže do této kategorie patří většina hydrofobních látek s log KOW > 3. V případě použití tohoto typu zařízení nehrozí fotolytický rozklad sledovaných látek po akumulaci do vzorkovače a v důsledku rychlého proudění vody nehrozí ani zarůstání vzorkovače (tzv. biofouling).
7.6.1 Vzorkovací zařízení
Principem zařízení je, stejně jako při statickém pasivním vzorkování, akumulace BDE, dalších bromovaných zhášečů hoření a jiných hydrofobních látek z vody do tenké vrstvy (100-500 µm) silikonové pryže. Přestup látek do vzorkovače je urychlován (kvůli zkrácení nutné doby expozice pro dosažení nízkých hodnot limitu kvantifikace) turbulentním proudem vody po povrchu vrstvy vzorkovací gumy. Proudění vody v expoziční komoře je zabezpečováno výkonným čerpadlem (9 m3 h-1), proto je k provozu zařízení nutný zdroj elektrické energie (220 V). Vzorkovače jsou při expozici umístěny v průtokové komoře z inertního materiálu (nerezová ocel; Obrázek 15).
Během provozu průtoková komora zůstává otevřená ze dvou stran. Zúžená, nátoková strana komory je napojena na ponorné čerpadlo (Obrázek 12), které slouží k čerpání vody objemem komory během vzorkování. Během provozu, voda z čerpadla proudí vysokou rychlostí komorou a na opačné straně proudí ven úzkým obdélníkovým otvorem. Ochranná plechová “stříška” je umístěna před tímto otvorem. Stříška slouží k svedení proudu vody do stran a dolů a zabraňuje tím nekontrolovanému tryskání vystupující vody nahoru.
Dvě stěny komory (14×28 cm) se sestávají ze síta vyrobeného z perforovaného plechu z nerezové oceli s čtvercovými oky o velikosti cca 10 mm. Během vzorkování se z vnějších stran komory na síto ukládají pláty/listy polymerního materiálu pasivního vzorkovače (Obrázek 13). Po umístění vzorkovačů se tyto strany komory uzavřou dvěma víky z nerezové oceli. Víka zůstávají na svém místě během provozu vzorkovače.

Obrázek 11 Dynamické pasivní vzorkovací zařízení. Horní obrázek: zařízení, dolní obrázek: zařízení připojené na ponorné čerpadlo. Zařízení se skládá z nerezové komory hranolovitého tvaru o rozměrech 14×28×1 cm, Vzorkovače z plátů silikonové pryže jsou umístěny na sítu z nerezového plechu a komora je uzavřena dvěma víky. Během vzorkování v komoře proudí voda, která je do ní vháněna ponorným čerpadlem (dole vpravo). Voda v komoře proudí lineární rychlostí cca. 1-2 m s-1. Vzorkovací zařízení zůstává po dobu expozice úplně ponořeno do vody na místě odběru vzorků.
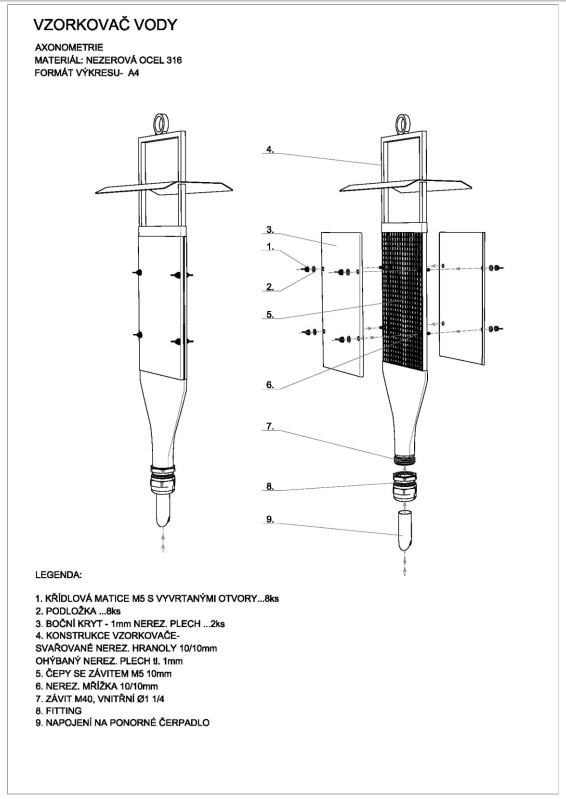
Obrázek 12 Zařízení pro dynamické pasivní vzorkování.
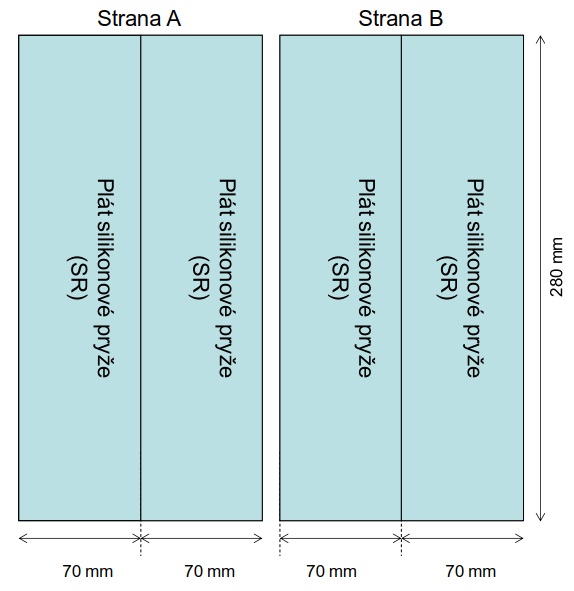
Obrázek 13 Umístění pasivních vzorkovačů v průtokové komoře při vzorkování. Strany A a B průtokové komory jsou označeny písmeny. Pláty mohou mít tloušťku 100-500 µm; v závislosti na designu vzorkování.
7.6.2 Obsluha dynamického vzorkovacího zařízení
7.6.2.1 Materiál, zařízení a přístroje
Před vlastním začátkem vzorkování je potřeba mít k dispozici nejméně dvě ponorná čerpadla (jedno jako záložní) o výkonu 500W (průtok 9 m3 h-1). K připojení čerpadla ke zdroji elektrického napětí (220 V) je využíván voděodolný kabel o délce nejméně 20 m. Další pomůcky nutné pro umístění vzorkovacího zařízení do toku jsou lana, karabiny, štrouby a kabelové vázací pásky. Dále je vzorkovací zařízení osazeno ponornými záznamníky teploty vody a intenzity osvitu, které lze programovat (četnost záznamu teploty a osvitu) i aktivovat automaticky na začátku vzorkování. Pro transport pasivních vzorkovačů včetně potřebného množství expozičních a terénních kontrolních vzorkovačů je potřeba připravit přenosný chladicí box s 250 ml uzavřenými vzorkovnicemi. V neposlední řadě jsou při manipulaci se vzorkovači používány dvě pinzety z nerezové oceli s tupými konci, čistý tácek z nerezového plechu (obalený v hliníkové fólii a skladována na čistém místě), vinylové rukavice, papírové utěrky pro čištění vzorkovačů. K záznamu pH a vodivosti je třeba použít přenosný pH-metr, konduktometr a k dokumentaci vzorkování fotoaparát.
|
|
Pozor! Vzorkovač vyžaduje zdroj elektrické energie s napětím 220V v dosahu odběrového profilu pro pohon ponorného čerpadla, které je součástí odběrového zařízení. Když je zařízení v provozu, je zde nebezpečí úrazu elektrickým proudem. Je třeba dbát zvýšené opatrnosti a vyvarovat se kontaktu s jakoukoli mokrou částí zařízení, zatímco je čerpadlo připojeno ke zdroji elektrického proudu. |
7.6.3 Montáž vzorkovače do vzorkovacího zařízení - začátek odběru
Při montáži je potřeba se ujistit, že materiál, který je používán, je čistý. Nejprve se připraví všechno potřebné nářadí a zařízení pro montáž vzorkovačů. Vzorkovače by měly být montovány do vzorkovacího zařízení těsně před expozicí. Pro montáž plátů silikónové pryže do vzorkovacího zařízení je nutno použít pinzety s tupými konci. Vzorkovače se před montáží do zařízení rozloží na tácku z nerezového plechu. Záznam o vzorkování zaznamenávejte do formuláře o odběru (viz kapitola 10).
1. Připravte si všechen materiál pro odběr vzorků (viz 7.5.1.1)
2. Odpojte čerpadlo od zdroje elektrické energie.
3. Pouze poprvé - jen v případě, že čerpadlo není již namontováno k zařízení, připevníte vzorkovací zařízení k čerpadlu.
4. Zaznamenejte začátek doby montáže.
5. Otevřete vzorkovnici s vzorkovači a umístěte je pomocí pinzety na připravený čistý nerezový plech.
6. Uvolněte šrouby na víku vzorkovacího zařízení (Obrázek 14). Zajistěte, aby se šrouby neztratily při manipulaci.
7. Uložte pasivní vzorkovač do zařízení podle Obrázek 16.
8. Uzavřete průtokovou komoru s vzorkovači víkem, použijte 4 šrouby. Otočte vzorkovací zařízení tak, aby strana B byla nahoru.
9. Umístění vzorkovačů v průtokové komoře by mělo být provedeno podle Obrázek 13.
10. Ochraňte všechny šrouby proti uvolnění provlečením plastových kabelových stahovacích pásků skrze otvory v křídelkách matic na obou stranách komory, jak je znázorněno na Obrázek 17.
11. Upevněte ponorný automatický záznamník teploty (Obrázek 18) k rámu vzorkovacího zařízení, např. na tyči těsně nad výstupem proudu vody z komory pomocí kabelových stahovacích pásků. V protokolu zapište kód záznamníku, který byl použit při nasazení. Tento kód je vidět na zadní straně záznamníku a je jedinečný pro každý záznamník. Automatický záznam by měl být předem naprogramován tak, aby se záznam automaticky spustil v čase umístění vzorkovače do vody nebo dřív. Záznamník by měl být naprogramován pro záznam teploty a intenzity osvitu světla cca každých 5 minut, nebo podle potřeby. Paměť a kapacita baterie musí umožnit provoz bez přerušení po celou dobu vzorkování. Po úspěšném startu záznamníku na začátku odběru záznamník zůstává připojen k vzorkovacímu zařízení a není potřeba žádná jiná manipulace s ním, s výjimkou občasného setření okénka senzoru světla papírovým ubrouskem pokaždé, když je zařízení vytáhnuto z vody. Také je třeba kontrolovat funkčnost záznamníku (u některých záznamníků funkčnost indikuje blikání diody). Záznamník se odmontuje ze zařízení na konci odběru.
12. Zavěšte vzorkovací zařízení na lano, které bude použito pro osazení zařízení v terénu. Hloubka expozice vzorkovacího zařízení pod hladinou vody by měla být udržována konstantní během expozice, cca 1 m pod hladinou. Ujistěte se, že zařízení zůstane ponořeno i v silném proudu vody a že při vzorkování nebude narážet o překážky v toku nebo o břeh. Také se ujistěte, že zařízení je uvázáno pevně a bezpečně (dvojité upevnění ocelovým a nylonovým lanem). Zařízení by mělo být zabezpečeno i proti odcizení.
13. Připojte elektrický kabel zařízení do zásuvky - čerpadlo se zapne, je-li ponořeno ve vodě.
14. Celé zařízení musí být po dobu expozice ponořeno do vody a čerpadlo by mělo být v provozu.
15. Zaznamenejte čas začátku expozice vzorkovače.
16. Vraťte terénní kontrolu (7.12.3) zpět do své nádoby. Terénní kontroly skladujte po dobu expozice vzorkovače dobře uzavřené, v temnu a chladu, ideálně při -20°C.
17. Vyplňte protokol o odběru vzorků podle vzoru v části 10.
7.6.4 Demontáž vzorkovače - konec odběru
1. Připravte si materiál pro odběr vzorků
2. Odpojte čerpadlo od zdroje elektrické energie.
3. Při manipulaci se vzorkovači by měly být použity vinylové rukavice.
4. Zaznamenejte čas začátku demontáže vzorkovače.
5. Vytáhněte vzorkovací zařízení z vody a umístěte ho vodorovně na čistou plochu (např. podlaha pokrytá dostatečně velkým kusem hliníkové fólie v místech, kde se zařízení dotýká země. Umístěte zařízení do vodorovné polohy s komorou stranou A nahoru.
6. Připravte si plech/tác pro uložení vzorkovačů po jejich vyjmutí z vzorkovacího zařízení. Jako první opláchněte plech vodou z vzorkovaného vodního útvaru.
7. Zkontrolujte, zda ponorný záznamník teploty je stále aktivní (bliká LED dioda). Pokud vzorkování pokračuje po výměně vzorkovačů, záznamník vyměňte pouze v případě, že není aktivní.
8. Otevřete vzorkovnici s terénní kontrolou (7.12.3).
9. Uvolněte šrouby víka zařízení na straně A a otevřete jedno víko na krabici (Obrázek 14, Obrázek 15)
10. Otevřete označené prázdné vzorkovnice 250 ml pro exponované vzorkovače (stejná vzorkovnice, ve které byl vzorkovač transportován na místo odběru).
11. Vyjměte vzorkovač ze vzorkovacího zařízení pomocí pinzety (Obrázek 16).
12. Dokumentujte fotografií situaci exponovaného vzorkovače. Poznamenejte v protokolu, pokud bylo něco neobvyklého.
13. Umístěte exponované vzorkovače na plech.
14. Osušte vzorkovače papírovým ubrouskem a vložte je pomocí pinzet do připravených vzorkovnic. Manipulace by měla být provedena v co nejkratším čase.
15. Otočte vzorkovací zařízení tak, aby strana B byla nahoru a opakujte postup v bodech 9-14 a uzavřete vzorkovnici pro transport vzorkovačů do laboratoře.
16. Uzavřete vzorkovnice s terénními blanky a poznamenejte do protokolu čas ukončení manipulace se vzorkovači.
17. V případě, že vzorkování pokračuje novou etapou, namontujte do vzorkovacího zařízení další sadu vzorkovačů pro příští vzorkovací etapu podle 7.6.3.
18. Vyplňte protokol o odběru vzorků (0). - GPS souřadnice, teplota vzduchu, teplota vody, pH, vodivost atd.
19. Exponované vzorkovače umístěné zpátky v transportních vzorkovnicích by měly být uloženy ve tmě, a co nejdříve přeneseny do mrazničky, kde se skladují při -20°C až do analýzy nebo odeslání do laboratoře.

Obrázek 14 Otevírání a uzavírání víka vzorkovacího zařízení při manipulaci se vzorkovači.

Obrázek 15 Vzorkovací zařízení s otevřeným víkem na jedné straně.

Obrázek 16 Montáž vzorkovače na bázi silikonové pryže AlteSil do vzorkovacího zařízení pro dynamické pasivní vzorkování (použít pinzetu)

Obrázek 17 Plastové stahovací pásky na ochranu matic proti uvolnění při expozici vzorkovače v terénu.

Obrázek 18 Ponorný záznamník teploty - připevní se pomocí stahovacího pásku na rám vzorkovacího zařízení při jeho expozici ve vodě.

Obrázek 19 Zařízení pro dynamické pasivní vzorkování během instalace. Ponorné čerpadlo (viditelné na spodním okraji zařízení na levé straně) žene proud vody velkou rychlostí do průtokové komory nad ním. Voda stříká tryskem z komory a proud vody je tlumen ochrannou stříškou nad ústím komory. Během provozu je celé zařízení úplně ponořeno do vody. Na obrázku vpravo je zařízení povytaženo z vody kvůli lepší viditelnosti.
7.7 Odeslání vzorků k analýze
Exponované vzorkovače by měly být zaslány do laboratoře na zpracování v co nejkratším čase. Během přepravy se doporučuje udržovat vzorky při nízké teplotě použitím tepelně izolovaných přepravních kontejnerů a chladících elementů. Je-li požadována kontrola teploty během přepravy, mohou být přidány do balíčku záznamníky teploty. Při odesílání vzorků by měla přijímající laboratoř být vždy předem informována. Na zásilce je potřeba uvést fyzickou adresu, ne P.O. Box. Je vhodné na štítku spolu s adresou uvést i kontaktní telefonní číslo. Odběrová zařízení, která nemusí být transportována expresně, mohou být odeslána odděleně od vzorkovačů pravidelnou poštovní službou, která je obvykle levnější.
7.8 Laboratorní zpracování vzorků
7.8.1 Extrakce vzorkovačů
Všechny vzorky musí být během celého zpracování označeny a nesmí dojít k jejich záměně. Pokud byly vzorkovače uskladněny v mrazničce, měly by být vyndány s dostatečným předstihem a nechány ustálit na laboratorní teplotu. Poté se vyjmou jednotlivé pláty pryže čistou pinzetou s tupým koncem, osuší se čistým papírovým ubrouskem, aby se odstranili zbytky vody ulpělé na povrchu plátů.
Pomocí pinzety se listy silikonové pryže s hmotností cca 10 g vloží do 100 ml patrony (v případě větší celkové hmotnosti vzorkovače je nutno použít větší objem extraktční patrony a extraktoru), která je umístěna do těla Soxhletova extraktoru (Obrázek 20). Identickým způsobem jako je zacházeno s exponovanými pasivními vzorkovači, jsou v jedné sadě extrahovány kontrolní vzorkovače (7.12.2) a procesní slepý vzorek neobsahující vzorek silikonové pryže (7.12.1).
Přebytečná voda ze vzorku silikonové pryže se odstraní osušením vzorkovačů papírovým ubrouskem. Vnitřní standardy pro stanovení výtěžnosti extrakce se přidají nakapáním na pláty silikonové pryže vložené do komory Soxhletova extraktoru na začátku extrakce. Referenční vzorkovače (7.12.2) a slepé vzorky (7.12.1) se zpracují stejným způsobem jako ostatní vzorky. Vzorky pasivních vzorkovaču jsou před vlastní extrakcí obohaceny roztokem extrakčních vnitřních standardů (RIS) 50 µl roztoku 13C značených standardů BDE dle tabulky (případně dalších látek, které mají být v extraktech stanoveny).
Stejné množství roztoku standardů RIS, které je dávkováno do všech vzorků, je nutné rovněž připravit i jako referenci (100% výtěžnost) a změřit v jedné sadě s analyzovanými vzorky. Pro extrakci vzorků silikonové pryže se do 250 ml baňky s kulatým dnem vloží vyčištěné varné kamínky a přidá se 100 ml methanolu pro stopovou analýzu. Extrakce sloučenin je poté prováděna po dobu 8 hodin v methanolu za použití Soxhletovy extrakce.
Tabulka 4. Vnitřní standardy pro určení výtěžnosti extrakce BDE (anglicky recovery internal standards; RIS):
|
roztok RIS |
látka |
RIS koncentrace (ng ml-1) |
dávkovaný objem (µl) |
množství dávkované na vzorek (ng) |
|
RIS BDE |
směs 13C BDEs1 |
10 |
50 |
2 |
1 případně i dalších značených standardů bromovaných zhášečů hoření
|
|
Pozor! Extrakce silikonové pryže nepolárními rozpouštědly se nedoporučuje, protože tato rozpouštědla způsobují značné bobtnání plátů polymeru (ethylacetát do 200 % a hexan do 400 % původního objemu) a také může dojít k nežádoucí extrakci oligomerů, které nebyly odstraněny při přípravě vzorkovačů. Doporučuje se otestovat výtěžnost extracke analytů před použitím procedury na reálných vzorcích (viz 7.12.5). Během varu methanolu může dojít k rozkladu některých labilních látek. Ve všech fázích zpracování vzorků by měla být dodržována mimořádná opatrnost, aby se zabránilo vypařování extraktu vzorku dosucha, protože obsah matrice (množství koextrahované organické hmoty) v extraktech vzorků je příliš nízký, než aby mohl působit jako protektant (angl. keeper). V případě, že je používána pro výměnu rozpouštědla azeotropická destilace, extrakt nemusí být redukován na velmi malý objem. |
Po extrakci je nutné vzorky pryže vyndat z těla Soxhletova extraktoru, umístit je na nerezový tácek a nechat přes noc odpařit zbytek rozpouštědla. Po odpaření do konstantní hmotnosti jsou jednotlivé proužky silikonové gumy zváženy a hmotnost zaznamenána.
7.8.2 Extrakce za studena
Jinou metoda pro extrakci silikonové pryže je extrakce rozpouštědlem při laboratorní teplotě. Pláty se přenesou do Erlenmeyerovy baňky o objemu 300 nebo 500 ml se skleněnou zátkou, přidá se methanol (přibližně 10-násobek objemu silikonové pryže) a baňka se třepe mírně 8 hodin. Následně se extrakce opakuje s čerstvým rozpouštědlem po dobu dalších 8 hodin a následně jsou oba extrakty spojeny.
|
|
Pozor! Uvedený postup extrakce za studena je na rozdíl od kontinuální extrakce podle Soxhleta vsázkový proces. Aby došlo k úplné extrakci analytů, je potřeba několika extrakčních kroků. Pravidlem je, že několik po sobě jdoucích extrakčních kroků s menším objemem rozpouštědla je účinnější než jednokroková extrakce s větším objemem rozpouštědla. Použití extrakce za studena se doporučuje pouze v případě, že extrakce podle Soxhleta není použitelná např. kvůli tepelné labilitě analytů. |
7.8.3 Redukce objemu rozpouštědla
Odpaření methanolu z extraktu je možné udělat různými způsoby. Jako nejefektivnější snížení objemu extraktu se ukazuje způsob destilace rozpouštědla s použitím Kuderna Danish odparky (Obrázek 21), která umožňuje snížení objemu až na 1,5 mL se součastnou výměnou rozpouštědel nebo s uchováním původního rozpouštědla. Použití kombinací rozpouštědel, které ve směsi vytvářejí pozitivní azeotrop [49] může být vhodné pro snížení teploty varu směsi [44]. Tabulky složení azeotropních směsí různých rozpouštědel jsou dostupné na webových stránkách [49]. Bod varu extrakčního rozpouštědla lze snížit i použitím extrakce podle Soxhleta za sníženého tlaku.

Obrázek 20 Soxhletova extrakce naskládaných plátů silikonové pryže

Obrázek 21 Kuderna-Danish odpařovací aparatura pro snížení objemu extraktu
Nejprve je methanol odpařen varem na cca 2 ml, v dalším kroku je kvantitativně převeden pomocí skleněné Pasteurovy pipety do předem zvážené baňky s kónickým dnem o objemu 100 ml. Do baňky jsou přidány varné kamínky a 20 ml hexanu. Následně je potřeba odpařit zbylý methanol a zredukovat objem hexanu na finálních 1,5 ml. K tomu je opět použita Kuderna Danish aparatura a objem je kontrolován vážením baňky s extraktem. Na závěr je objem pod jemným proudem dusíku snížen přesně na 1 ml a alikvotován. 250 µl je naváženo do předem zvážených a označených 2 ml vialek a je dále čištěn nedestruktivním postupem. Zbylých 750 µl je ponecháno v baňce a je dále čištěno destruktivní metodou (viz níže).
7.8.4 Čištění extraktu pro stanovení BDE a HBCD
Pro stanovení BDE a HBCD se se alikvot extraktu (cca 75%) přečistí za pomoci kolonové sloupcové chromatografie se silikagelem obohaceným kyselinou sírovou. Kolonku je nutno připravit tak, že se do skleněné kolony vloží kousek přečištěné vaty a skleněnou tyčinkou se upěchuje na spodu kolony tak, aby výška sloupce vaty byla přibližně 0,5 - 1 cm a sorbent nepropadával kolonou. Do kolony se nad vatu nasype 1 g čištěného a aktivovaného silikagelu (extrahovaný v DCM a 12 hodin vypečený při teplotě 150°C) Dále se do kolony nasype 8 g 44% H2SO4 v silikagelu připraveného smícháním 100 g aktivovaného silikagelu a 44 ml (79g) kyseliny sírové v baňce s kulatým dnem. Skleněnou tyčinkou se poklepe na kolonu, aby došlo k usazení silikagelu. Na vrch se nasype 1 g neaktivovaného silikagelu a znovu se tyčinkou poklepe na kolonu. Nejprve je kolonka kondicionovaná 20 ml směsí hexan:DCM (1:1), poté se nanese alikvot vzorku. Vialka se dvakrát vypláchne čistým rozpouštědlem. Na kolonu se nalije 30 ml směsi n-hexan:dichlormetan 1:1, který se jímá do 100 ml baňky s kónickým dnem. Následně je ke vzorkům přidánu 50 µl injekčního standardu PCB-121 o koncentraci 0,2 µg ml-1 a roztok je nutno odpařit za použití Kuderna-Danish aparatury asi na 1 ml. Extrakt je následně nutno převést do hexanu přidáním 20 ml hexanu a následným odpařením pomocí Kuderna-Danish aparatury na cca 1,5-2 ml. Objem hexanu je následně redukován za použití jemného proudu dusíku, až na 1 ml. Extrakt je nutné na závěr kvantitativně převést do GC kónickým minivialek, odpařit na cca 50 µl pod proudem dusíku při teplotě 30°C a cílové látky analyzovat použitím GC-MS.
7.8.5 Čištění extraktu pro stanovení nových bromovaných zhášečů hoření (NBFR)
Alikvot 250 µl extraktu (25%) je čištěn nedestruktivním čištěním. Pro každý vzorek se připraví sloupcová chromatografická kolona tak, že se do skleněné kolony dá přečištěná vata a skleněnou tyčinkou se upěchuje na spodu kolony tak, aby výška sloupce vaty byla přibližně 0,5 - 1 cm a sorbent nepropadával kolonou. Dále se do kolony nasype 5 g aktivovaného silikagelu (extrahovaného v DCM a 12 hodin vypečeného při teplotě 150 °C). Kolonu je neprve nutno ekvilibrovat pomocí 15 ml diethyletheru (DEE) a následně 15 ml hexanu. 250 µl extraktu v hexanu se aplikuje na kolonu a cílové sloučeniny se eluují 40 ml 100% DEE do 100 ml baňky s kónickým dnem. Následně je do roztoku přidáno 50 µl injekčního standardu (IS; terfenyl, 4000 ng/ml v toluenu) a roztok je nutno odpařit za použití Kuderna-Danish aparatury asi na 1 ml. Extrakt v DEE je nutno převést do hexanu přidáním 20 ml hexanu a následným odpařením destilací na cca 1,5-2 ml. Objem hexanu je následně redukován za použití jemného proudu dusíku na 1 ml. Extrakt je nutné na závěr kvantitativně převést do 2 ml kónickým minivialek pro plynovou chromatografii, odpařit na 0,5 ml a cílové analyty analyzovat použitím GC-MS.
7.9 Instrumentální analýza
7.9.1 Instrumentální analýza BDE a NBFR
Pro stanovení PBDEs a NBFRs je využita separace analytů v příslušné frakci pomocí plynové chromatografie s použitím kapilárních kolon, detekce pozitivních fragmentů po elektronové ionizaci hmotnostní spektrometrií (rozlišení ≥ 10 000, resp. ≥ 5 000 pro stanovení BDE 209) a potvrzení přítomnosti analytu a stanovení hmotnostního podílu nebo koncentrace vyhodnocením HRGC/HRMS záznamů využitím přidaných 13C-značených vnitřních standardů. Konkrétně jsou PBDEs and NBFRs analyzovány použitím plynového chromatografu (GC) Agilent 7890A který je vybaven kolonou 15 m × 0,25 mm × 0,1 µm Restek RTX-1614. Po separaci jsou látky unášeny do hmotnostního spektrometru s vysokým rozlišením (HRMS) Waters Micromass AutoSpec Premier high. Hmotnostní spektrometr je nastaven v positivním ionizačním módu (EI+) a pro záznam detekovaných iontů je nastaven mód vybraných iontů (anglicky selected ion monitoring; SIM), které jsou uvedeny v Tabulka 5 a 6. Na kolonu je dávkován alikvot 3 µL ve formě bez dělení toku při teplotě 280 °C (250°C pro NBFRs). Jako hnací plyn je použito helium (He) s průtokem 1 ml·min-1. Teplotní program je nastaven na počátku na 80 °C (1 min), potom teplota roste rychlostí 20 °C·min-1 až do 250 °C, a následně 1,5 °C·min-1 do 260 °C, kde je teplota 2 min podržena. Na závěr teplota stoupá rychlostí 25 °C·min-1 do 320 °C (4,5 min pozdržena) Jednotlivé analyty byly sledovány v režimu vybraných iontů (SIR).
Tabulka 5 Sledované ionty při stanovení BDE hmotnostní spektrometrií s vysokým rozlíšením
|
Názvy PBDEs |
Retenční čas (min) |
Kvantifikační hmota |
Konfirmační hmota |
|
BDE 28 |
8,17 |
405,8027 |
407,8007 |
|
BDE 47 |
9,21 |
485,7112 |
483,7132 |
|
BDE 66 |
9,35 |
485,7112 |
483,7132 |
|
BDE 100 |
10,01 |
563,6216 |
565,6197 |
|
BDE 99 |
10,28 |
563,6216 |
565,6197 |
|
BDE 85 |
10,85 |
563,6216 |
565,6197 |
|
BDE 154 |
11,23 |
643,5302 |
641,5322 |
|
BDE 153 |
11,81 |
643,5302 |
641,5322 |
|
BDE 183 |
14,16 |
721,4407 |
723,4387 |
|
BDE 209 |
22,55 |
799,3335 |
797,3355 |
|
Dávkovací standard |
|||
|
13C-BDE 77 |
9,56 |
497,7513 |
495,7533 |
|
Interní standard |
|||
|
13C-BDE 28 |
8,16 |
417,8429 |
419,8409 |
|
13C-BDE 47 |
9,20 |
497,7513 |
495,7533 |
|
13C-BDE 100 |
10,00 |
575,6618 |
577,6598 |
|
13C-BDE 99 |
10,27 |
575,6618 |
577,6598 |
|
13C-BDE 154 |
11,22 |
655,5703 |
653,5723 |
|
13C-BDE 153 |
11,80 |
655,5703 |
653,5723 |
|
13C-BDE 183 |
14,15 |
733,4808 |
735,4788 |
|
13C-BDE 209 |
22,54 |
811,3737 |
809,3757 |
Tabulka 6 Sledované ionty při stanovení NBFR hmotnostní spektrometrií s vysokým rozlíšením.
|
Názvy NBFRs |
Retenční čas (min) |
Kvantifikační hmota |
Konfirmační hmota |
|
ATE |
5,95 |
369,8027 |
371,8027 |
|
BATE |
10,10 |
331,7693 |
329,7714 |
|
p-TBX |
9,85 |
340,7999 |
342,7979 |
|
DPMA |
12,70 |
344,9353 |
379,9041 |
|
PBEB |
13,86 |
499,6266 |
501,6247 |
|
PBT |
13,13 |
485,6111 |
487,6090 |
|
DPTE |
15,45 |
529,6372 |
531,6353 |
|
HBB |
15,48 |
551,5038 |
549,5059 |
|
HCDBCO |
18,92 |
267,9285 |
269,9265 |
|
EHTBB |
19,07 |
420,6720 |
418,6740 |
|
BTBPE |
23,80 |
358,7928 |
356,7984 |
|
s-DP |
24,67 |
271,8102 |
273,8072 |
|
a-DP |
25,06 |
271,8102 |
273,8072 |
|
BEHTBP |
24,69 |
464,6618 |
462,6638 |
|
DBDPE |
29,69 |
484,6032 |
486,6012 |
|
α-TBECH |
8,93 |
266,9207 |
268,9187 |
|
β-TBECH |
9,24 |
266,9207 |
268,9187 |
|
β-TBCO |
10,11 |
266,9207 |
268,9187 |
|
α-TBCO |
11,12 |
266,9207 |
268,9187 |
|
γ,δ - TBECH |
10,48 |
266,9207 |
268,9187 |
|
Dávkovací standard |
|||
|
13C-BDE 77 |
17,78 |
497,7513 |
495,7533 |
|
Extrakční interní standard |
|||
|
13C HBB |
15,51 |
555,5260 |
557,5240 |
|
13C BTBPE |
23,84 |
364,8129 |
362,8149 |
|
13C sDP |
24,67 |
276,8269 |
278,8240 |
|
13C aDP |
25,06 |
276,8269 |
278,8240 |
|
13C DBDPE |
26,69 |
493,6246 |
491,6267 |
Tabulka 7 Meze detekce analytického stanovení BDE
|
Látka |
Mez detekce (pg μl-1) |
|
BDE 28 |
0,40 |
|
BDE 47 |
0,30 |
|
BDE 66 |
0,50 |
|
BDE 100 |
0,20 |
|
BDE 99 |
0,30 |
|
BDE 85 |
0,40 |
|
BDE 154 |
0,50 |
|
BDE 153 |
0,90 |
|
BDE 183 |
1,10 |
|
BDE 209 |
4,00 |
Tabulka 8 Meze detekce analytického stanovení NBFR
|
Názvy NBFRs |
Mez detekce (pg μl-1) |
|
ATE |
0,40 |
|
α,β,γ,δ -TBECH |
0,54 |
|
BATE |
0,16 |
|
TBCO |
1,52 |
|
p-TBX |
0,05 |
|
DPMA |
0,16 |
|
PBEB |
0,07 |
|
PBT |
0,08 |
|
DPTE |
0,65 |
|
HBB |
0,04 |
|
HCDBCO |
5,01 |
|
EHTBB |
0,18 |
|
BTBPE |
0,15 |
|
s-DP |
0,10 |
|
a-DP |
0,07 |
|
BEHTBP |
0,16 |
|
DBDPE |
6,95 |
Pro kvantifikaci BDE a NBFR ve vzorcích je použito roztoků kalibračních standardů. Výtěžnost metody je ošetřena přídavkem směsného interního standardu izotopicky značených látek ke vzorkovacímu médiu před extrakcí. Absolutní množství analytů ve finálním roztoku pro GC/HRMS analýzu je pak korigováno přídavkem izotopicky značeného dávkovacího standardu (13C BDE 77) po zpracování vzorku do finálního objemu. Instrumentální detekční limity jsou stanoveny na základě poměru signál/šum nejnižšího kalibračního bodu (viz Tabulky 7 a 8).
7.9.2 Instrumentální analýza HBCD
Vybrané stereoizomery hexabromocyklododekanu (α-HBCD, β-HBCD, γ-HBCD) jsou ve vzorcích stanovovány metodou vysoko účinné kapalinové chromatografie s tandemovou hmotnostní detekcí. Separace jednotlivých složek probíhá na reverzně fázové analytické koloně Phenomenex Luna C-18 která je schopná efektivně oddělit jednotlivé analyty i interferující látky nacházející se ve vzorku. Kvantifikace analytů je založena na použití isotopicky značeného interního standardu γ-HBCD, který je přidáván ke vzorku v automatickém dávkovači kapalinového chromatografu. Jako mobilní fáze se pro separaci cílových analytů použije vodný roztok 1 mM octanu amonného o pH 4 (složka A) a acetonitril s přídavkem 1 mM octanu amonného (složka B). Průtok mobilní fáze je 0,25 ml min-1. Pro analýzu je nastřikováno 10 μL vzorku rozpuštěného v acetonitrilu. Teplota kolony je udržována na 30 °C.
Pro detekci cílových látek je použit tandemový hmotnostní spektrometr vybaveným iontovým zdrojem typu elektrosprej s dostatečnou citlivostí. Jednotlivé parametry pro nastavení iontového zdroje jsou uvedeny v Tabulka 9. Typické hodnoty nastavení hmotnostního spektrometru jsou uvedeny v Tabulka 10. Pro záznam signálu všech sledovaných stereoizomerů HBCD jsou používány stejné mateřské i dceřiné hmoty. Signál je sledován v módu ScheduledMRM. Pozorovací okno je nastaveno na 90 sekund.
Tabulka 9 Parametry iontového zdroje (typické hodnoty pro AB Sciex QTrap 5500)
|
typ iontového zdroje |
ESI |
|
polarita |
negativní |
|
kapilární napětí (V) |
4000 |
|
teplota sušícího plynu (°C) |
450 |
|
tlak sušícího plynu (Gas1, psi) |
40 |
|
tlak zmlžovacího plynu (Gas2, psi) |
40 |
|
Curtain Gas (psi) |
15 |
Tabulka 10 Parametry nastavení hmotnostního spektrometru (typické hodnoty pro AB Sciex QTrap 5500)
|
Q1 (m/z) |
Q3 (m/z) |
retenční čas (min) |
deklasterizační potenciál (DP, V) |
vstupní potenciál (EP, V) |
výstupní potenciál (CXP, V) |
kolizní energie (V) |
|
640,5 |
79,0 |
10,5-11,4 |
-105 |
-10 |
-10 |
-48 |
|
640,5 |
80,9 |
10,5-11,4 |
-105 |
-10 |
-10 |
-48 |
Při kalibraci systému je postupně dávkováno 10 μL každého kalibračního roztoku na kolonu. V automatickém dávkovači dochází během nástřiku k přidání značeného interního standardu γ HBCD (13C12H18Br6). K vyjádření kalibrační závislosti a výpočtu koncentrací HBCD v neznámých vzorcích je následně užito relativních odezvových faktorů.
7.10 Interpretace výsledků měření
Výpočet koncentrace sledované látky ve vodě z množství ve vzorkovači zahrnuje několik kroků, které jsou podrobně popsány níže. Pro odhad koncentrace sledované látky z jejího množství v pasivním vzorkovači je potřeba znát vzorkovací rychlost RS (specifický parametr pro každou látku, který vyjadřuje ekvivalentní objem vody, navzorkovaný za jednotku času) a rozdělovací koeficient látky v systému vzorkovač-voda Kpw [50].
|
|
Pozor! Součástí metodiky je praktický uživatelský nástroj vytvořený v MS Excel, který umožňuje kalkulaci vzorkovacích rychlostí pasivního vzorkování a výpočet koncentrací BDE a jiných hydrofobních látek ve vodní fázi z jejich množství akumulovaných v pasivním vzorkovači. Návod na použití této výpočtové pomůcky pro zpracování dat z pasivních vzorkovačů na bázi silikonové pryže (AlteSil) je uveden v části 12 této metodiky. Níže uvedené ilustrativní příklady kalkulace jsou rovněž uvedeny v pomocném nástroji. |
Ve zkratce se uplatňuje tento postup:
1. Vypočítá se vzorkovací rychlost sledované látky z frakce PRC látek, které jsou zadrženy ve vzorkovači (tj. poměr mezi koncentrací PRC na konci a na začátku expozice). Malé hodnoty zachycené frakce PRC poukazují na vysoké hodnoty vzorkovací rychlosti a naopak.
2. Vzorkovací rychlosti PRC se pak použijí pro výpočet koncentrace dalších analytů ve vodě. Kromě komplexního modelu, který je popsán níže, lze použít i přibližné (jednodušší) modely pasivního vzorkování pro limitní případy, kdy vzorkovač je v stavu daleko od rovnováhy nebo blízko k rovnováze.
3. Ověří se, zda akumulace sledovaných látek není limitována difúzí ve vrstvě polymeru vzorkovače.
4. Z množství látky akumulované ve vzorkovači, doby expozice, vzorkovací rychlosti a rozdělovacího koeficientu látky v systému vzorkovač-voda se vypočítá pomocí ověřeného modelu koncentrace látky ve vodě.
7.10.1 Výpočet vzorkovací rychlosti RS
Extrahovaný objem vody (nebo vzorkovací rychlost RS, je-li objem vyjádřen za jednotku času) lze pro každou látku odvodit z rychlosti uvolňování vybraných značených látek (tzv. provozních referenčních látek, PRC, 7.12.4); přidaných do vzorkovače před expozicí. V principu jde o stanovení rychlosti uvolňování těchto látek, která je kontrolována difúzí v mezní vrstvě vody. Rychlostní konstanta eliminace prvního řádu, měřená in situ je pro určitou látku stejná, jako je její rychlostní konstanta akumulace. Při interpretaci dat jsou použity stávající modely a metody pro odhad vzorkovacích rychlostí látek [35,51,52], což umožňuje výpočet koncentrace ve vodě z koncentrace látky ve vzorkovači.
In situ vzorkovací rychlosti lze vypočítat z frakce PRC látek zadržených ve vzorkovači po expozici (f) podle [44]:

kde N0 je množství PRC látky přidáno do referenčního vzorkovače (7.12.2), Nt je množství ve vzorkovači po expozici, RS je (ekvivalentni) vzorkovací rychlost (1 d-1), t je doba expozice vzorkovače (d), mp je hmotnost vzorkovače (kg), a KPW (1 kg-1) je rozdělovací koeficient v systému vzorkovač-voda.
Mez detekce PRC ve vzorkovači může záviset na množství dalších sloučenin přítomných v extraktu ze vzorkovače. Proto všechny odezvy PRC látek v chromatografickém záznamu by měly být pečlivě zkontrolovány na možné interference, zejména v případě, že koncentrace PRC látky v extraktu je nízká. Každý chromatografický pík PRC, pro který nebyla zjištěna žádná interference s jinými látkami v záznamu je přijatelný pro další zpracování. Pro použití PRC dat v níže popsaném modelu lze zahrnout i výsledky měření, které jsou pod mezí stanovení.
|
|
Pozor! Protože zadržená frakce PRCs f ve vzrorkovači je poměr množství, není nutno kalibrovat měřicí přístroj na stanovení absolutních množství PRC látek. Je postačující demonstrovat linearitu signálu přístroje v závislosti na dávkovaném množství PRC. Za účelem výpočtu hodnot f je postačující poměr ploch chromatografických píků (korigovaných na odezvu vnitřního standardu) v exponovaném a referenčním vzorkovači. |
Vzorkovací rychlost sledované látky může být kontrolována transportem látky přes hraniční difúzní vrstvu vody (WBL-ovládaný transport) nebo transportem v polymeru (membránou ovládaný transport).
Pro účel hodnocení, zda je vzorkování ovládáno membránou, je nutno znát hodnoty difúzních koeficientů sledovaných látek v polymeru vzorkovače (viz kapitola 15). Membránou ovládaný transport je nutno zvážit jenom v některých výjimečných případech, např. pro velice krátké doby expozice (<1 týden) a v případě, že je odpor k přestupu látek v hraniční difúzní vrstvě vody nízký, např. při velmi vysokých rychlostech proudění vody (>10 m s-1). V naprosté většině případů, látky, u kterých je transport ovládaný membránou, dosahují během expozice rovnovážné koncentrace. Orientačním pravidlem je, že membránou je transport do vzorkovače na bázi silikonové pryže kontrolován především u látek, jejichž hodnota log Kow < 3.5. Výjímečně tomu může být tak i u látek s vyššími hodnotami Kow, a to v případě velmi vysokých rychlostí proudění vody. Hodnotícím kritériem, že pro sledovanou látku není nutno uvažovat odpor vůči transportu v membráně, je platnost nasledující rovnice:

kde Rs je vzorkovací rychlost pro PRC látku se stejnou molární hmotností, jako má sledovaná látka, A je plocha povrchu vzorkovače, Dp je hodnota difúzního koeficientu sledované látky v polymeru vzorkovače (viz hodnoty v kapitole 15), Kpw je rozdělovací koeficient sledované látky v systému polymer-voda (viz hodnoty v kapitole 15) a δm je polovina tloušťky filmu polymeru, který je exponován ve vodě po obou stranách, nebo celková tloušťka polymeru, jestli je plát polymeru exponován pouze z jedné strany.
Rusina a kol. (2007, 2010) [34,53] dokázali, že vzorkovací rychlost látek pod kontrolou mezní difúzní vrstvy vody mírně klesá s narůstající molární hmotností látky (M):

kde FA je parametr, který závisí na lokálních hydrodynamických podmínkách. Model zohledňuje pokles difúzních koeficientů látek ve vodě s molární hmotností. Protože fyzikální význam parametru FA je poměrně abstraktní a těžko uchopitelný, je praktické vypočítat vzorkovací rychlost RS pro látku s molární hmotností M= 300 g mol-1 z rovnice 4.
Výsledkem kombinace rovnic 2 a 4 je modelová rovnice, která umožňuje výpočet vzorkovacích rychlostí pod kontrolou mezní difúzní vrstvy vody z molárních hmotností a zadržených frakcí PRC látek metodou nejmenších čtverců podle [51]:

kde frakce PRC látky ve vzorkovači (f) je závisle proměnnou,(Kpw × M0,47) je nezávisle proměnnou a FA je regresní koeficient. Kpw (l kg-1) je rozdělovací koeficient látky v systému polymer (např. AlteSil/voda) pro PRC látky, dostupný z reference [37], M je molární hmotnost PRC látky, mp je hmotnost vzorkovače a t je expoziční čas.
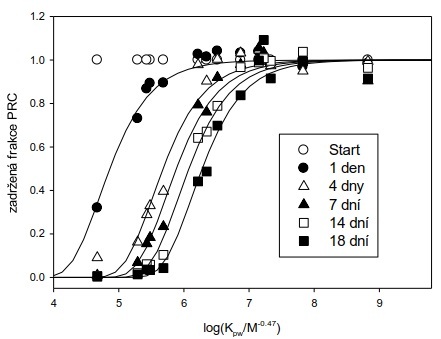
Obrázek 22 Zadržené frakce PRC látek jako funkce parametru logKpw × M0,47 po 0-20 dnech expozice silikonové pryže ve vodě v otevřeném systému. Modelové křivky, které opisují výměnu látky mezi vzorkovačem a vodou, kontrolovanou mezní difúzní vrstvou vody Rs=FA × M-0,47 jsou vykresleny jako plné čáry. Upraveno podle [54].
Obrázek 22 ukazuje příklad modelových křivek nelineární regrese zadržené frakce PRC (f) jako funkce parametru (Kpw × M0,47) podle rovnice 5. Po delší době expozice vzorkovače se křivky posouvají k vyšším hodnotám Kpw. Po nejdelší době expozice, tj. 20 dní látky s hodnotami log(Kpw × M0,47) až do 5,5 se úplně vyplaví ze vzorkovače, co značí, že sledované látky z vodního prostředí se stejnou nebo nižší hodnotou log(Kpw × M0,47) během expozice dosáhly distribuční rovnováhy mezi vzorkovačem a vodním prostředím. Na opačném konci spektra jsou látky s log(Kpw × M0,47) větší než 7, co znamená, že pro ně vzorkovač pracuje v lineárním režimu a odhad jejich koncentrací ve vodní fázi Cw závisí pouze na vzorkovací rychlosti RS.
7.10.2 Výpočet koncentrace ve vodní fázi
Koncentrace látky ve vodní fázi Cw se vypočítá podle [22,55]:

Praktické příklady výpočtu jsou uvedeny v kapitolách 7.11.2.1 a 7.11.2.2.
7.11 Kalibrační parametry vzorkovače
Za účelem přepočítání množství akumulované chemické látky ve vzorkovači na koncentraci ve vodě je potřebné znát parametry pasivního vzorkovače pro sledované látky: a) rozdělovací koeficienty látek v systému polymer-voda, zejména pro látky s hodnotou log KOW < 6, kde je předpoklad, že během expozice dojde v systému vzorkovač-voda k ustálení rovnováhy a b) difúzní koeficienty látek v polymerním materiálu vzorkovače, aby bylo jasné, zda přestup látek do vzorkovače je kontrolován jejich difuzí v polymeru, nebo difuzí v mezní vrstvě vody na povrchu vzorkovače.
7.11.1 Rozdělovací koeficient vzorkovač-voda (KPW)
Hodnota rozdělovacího koeficientu látky v systému vzorkovač-voda (KPW) kvantifikuje poměr koncentrace sledované látky v materiálu vzorkovače a její volně rozpuštěné koncentrace ve vodné fázi v rovnovážném stavu. Hodnoty KPW jsou potřebné pro přepočet koncentrace látek v pasivním vzorkovači na koncentraci ve vodní fázi. Stanovení se provádí v laboratorních podmínkách měřením koncentračního poměru látky ve vzorkovači, do kterého byly přidány sledované látky, a v zvoleném objemu vody po ustálení distribuční rovnováhy vzorkovače s vodní fází.
Součástí předložené metodiky jsou Kpw hodnoty bromovaných zhášečů hoření v systému AlteSil/voda (kapitola 13), které byly stanoveny jako součást řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA.
|
|
Zdroje dalších informací: Teorie rozdělovacího pasivního vzorkování a dostupná kalibrační data Teorie a modelování rozdělovacího pasivního vzorkování je detailně popsaná v pracích Huckinsem a kol. [22], Booijem a kol, (2007) [24] a přehled byl publikován i Lohmannem a kol. (2012) [56]. Rusina a kol. (2007, 2010) [34,53] demonstrovali, že vzorkovací rychlosti látek akumulovaných pod kontrolou mezní difúzní vrstvy vody mírně klesají s narůstající molární hmotností. Booij a Smedes (2010) [36] odvodili metodu pro odhad in situ vzorkovacích rychlostí vzorkovačů pomocí PRC látek. Hodnoty rozdělovacích koeficientů v systému polymer-voda KPW pro mnohé látky (nikoli však bromované zhášeče hoření) jsou dostupné z pulbikací Smedese a kol. (2009) [37], Yatese a kol. [57], Jonkera a kol., (2015) [58], a kompilace dat z různých zdrojů je dostupná z publikace Difilippo a Eganhouse (2010) [38]. Pro hodnocení, zda akumulace látek do vzorkovače je kontrolována difůzí látek v polymerním materiálu vzorkovače jsou dostupná publikovaná data difúzních koeficientů různých látek (nikoli však bromovaných zhášečů hoření) v různých silikonových polymerech v pracích Rusins a kol. (2010) [59] a Narváez Valderrama (2016) [60], Pro charakterizaci nových polymerů, pro které nebyly hodnoty Kpw dosud publikovány, je možno použít rozdělovacích rovnováh v systému polymerpolymer jako základ pro zjištění rozdílů v distribučních vlastnostech polymerů pro různé látky, a také pro odhad Kpw hodnot pro nové polymerní materiály[46]. |
|
|
Pozor! Přesné hodnoty Kpw jsou důležité pro PRC látky a látky, které dosahují rovnováhy během expozice (cca s log Kpw<5). Pro tyto látky není vypočítaná koncentrace ve vodě závislá na vzorkovací rychlosti, ale vypočítá se z poměru koncentrace ve vzorkovači a rozdělovacího koeficietu Kpw. Použití přesných hodnot Kpw není nezbytné pro látky, které se akumulují do vzorkovače v linerární fázi vzorkování (viz kapitola 5). V tomto případě lze hodnoty Kpw aproximovat pomocí lineární regrese závislosti logKpw od logKow. |
7.11.2 Difúzní koeficienty zhášečů hoření v silikonovém elastomeru
V laboratorních experimentech byly stanoveny difúzní koeficienty látek v polymerním materiálu vzorkovače při teplotě 20°C metodou vrstvení filmů [59] (Obrázek 23). Testovány byly tyto látky: 6 kongenerů polybromovaných difenyleterů (BDE), 19 nových zpomalovačů hoření (NBFR), 3 isomery hexabromcyklododekanu (HBCD), dechloran plus (DP) a tetrabrombisfenol A (TBBA) a pro ověření správnosti metody i 6 kongenerů PCB, pro které již byla data byla publikována [59].
Součástí metodiky jsou difúzní koeficienty BDE a dalších bromovaných zhášečů hoření v materiálu silikonové pryže AlteSil (kapitola 13), které byly stanoveny jako součást řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA.
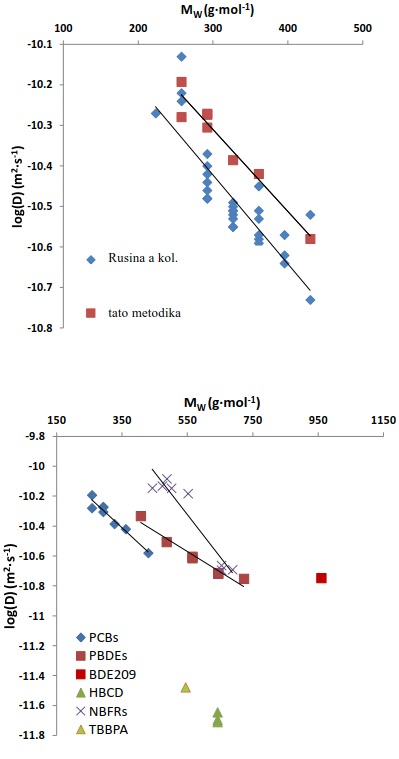
Obrázek 23 Experimentálně stanovené difúzní koeficienty PCB (a) a různých bromovaných zpomalovačů hoření (b) v elastomeru na bázi silikonové pryže Altesil při teplotě 20°C v této studii a v studii Rusiny a kol. [59] a jejich závislost na molekulové hmotnosti (Mw).
7.11.2.1 Příklad 1, Stanovení koncentrace volně rozpuštěné koncentrace bromovaných difenyletherů v povrchové vodě pomocí vzorkovacího zařízení pro dynamické pasivní vzorkování
Příklad ilustruje stanovení volně rozpuštěné koncentrace bromovaných difenyletherů (BDE) v povrchové vodě v lokalitě, která není přímo zatížena bodovým zdrojem znečištění, a kde je předpoklad, že jediným zdrojem BDE ve vodě je atmosferická depozice ze vzdálených zdrojů.
Pasivní vzorkovač ze silikonové pryže AlteSil s rozměry 14×28 cm o tloušťce 0,5 mm a hmotnosti 22,36 g byl exponován od 12.5.2015 do 23.10.2015 v povrchové vodě v rybníku Starý v Pohořelicích.
Doba expozice byla 164 dní. Teplota vody po dobu vzorkování kolísala mezi 10°C a 30°C. Do vzorkovače byly před expozicí přidány v množství 70-700 ng na vzorkovač provozní referenční látky (PRC) - polychlórované bifenyly, které se nevyskytují v technických směsích: PCB (1, 2, 3, 10, 14, 21, 30, 50, 55, 78, 104, 145 a 204)) postupem uvedeným v kapitole 7.4.2.
Tabulka 11 Provozní referenční látky, jejich rozdělovací koeficienty log Kpw [37], molární hmotnosti a procento PRC zbylé ve vzorkovači po 164-denní expozici v povrchové vodě v rybníku Starý v Pohořelicích
|
Provozní referenční látka (PRC) |
M (g mol-1) |
logKpw (1 kg-1) |
Frakce f zadržených PRC |
|
PCB 1 |
188,7 |
4,22 |
1% |
|
PCB 2 |
188,7 |
4,41 |
2% |
|
PCB 3 |
188,7 |
4,36 |
2% |
|
PCB 10 |
223,1 |
4,55 |
4% |
|
PCB 14 |
223,1 |
5,14 |
40% |
|
PCB 21 |
257,5 |
5,43 |
45% |
|
PCB 30 |
257,5 |
5,24 |
70% |
|
PCB 50 |
292,0 |
5,70 |
52% |
|
PCB 55 |
292,0 |
6,00 |
87% |
|
PCB 78 |
292,0 |
6,05 |
70% |
|
PCB 104 |
326,4 |
6,17 |
78% |
|
PCB 145 |
360,9 |
6,65 |
86% |
|
PCB 204 |
429,8 |
7,59 |
100% |
V exponovaném vzorkovači, a dále v laboratorním a terénním kontrolním vzorkovači byly po expozici stanoveny koncentrace PRC látek a bromovaných difenyletherů, konkrétně kongenery čísel 28, 47, 99, 100, 153 a 154. Z poměru koncentrace jednotlivých PRC látek v exponovaném vzorkovači a v laboratorní kontrole (7.12.2) je nejdříve vypočítaná frakce f jednotlivých PRC látek, zbylých ve vzorkovači po expozici (Tabulka 11). Následnou optimalizací pomocí nelineární regrese f podle rovnice 5 je získána optimalizovaná hodnota parametru FA=274 ± 45, což koresponduje s hodnotou parametru vzorkovací rychlosti (pro látku s molární hmotností M=300 g mol-1) Rs = 18,8 ± 3,1 l d-1.
Koncentrace kongenéru BDE 28 ve vodní fázi Cw se vypočítá nasledovně:
Vzorkovací rychlost Rs (BDE 28)= 274×407-0,47=16,3 l d-1 pro kongener BDE 28 je dána modelem Rs= B×M-0,47 [36]. Zbývá ještě ověřit, zda pro sledovanou látku není nutno uvažovat odpor vůči transportu ve vrstvě silikonové pryže. Podle rovnice 3 je vzorkovací rychlost ve vrstvě pryže Rs (polymer, BDE28):
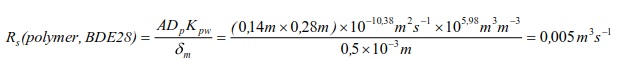
Rs(polymer, BDE28) = 0,005m3s-1 = 408398 l d-1
Z výpočtu vyplývá, že přestup BDE28 v polymeru je cca třicettisíckrát větší v polymeru, než v mezní difúzní vrstvě vody. Akumulace BDE 28 do vzorkovače je tedy ovládána difúzí v mezní difúzní vrstvě vody a pro výpočet koncentrace ve vodě lze tedy použít vzorkovací rychlosti odhadnuté pomocí PRC.
Koncentrace kongeneru BDE 28 ve vodní fázi Cw se tedy vypočítá:

|
Np = 40 pg |
je množství BDE 28 v exponovaném vzorkovači |
|
Nf = <1 pg |
je množství BDE 28 v terénní kontrole |
|
Kpw = 105,98 l kg-1 |
je rozdělovací koeficient vzorkovač/voda |
|
B = 264 d-1 |
je optimalizovaný parametr z modelu [36] |
|
mp = 22,4 g = 0,022 kg |
je hmotnost vzorkovače |
|
M = 406,9 g mol-1 |
je molární hmotnost BDE 28 |
|
t = 164 dní |
je doba expozice vzorkovače |
|
Rs= 16,3 l d-1 |
je vzorkovací rychlost, vypočítaná podle vzorce FA×M-0,47 |
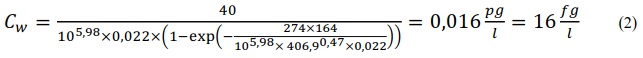
Obdobným způsobem se vypočítá koncentrace ve vodní fázi Cw dalších látek, které tvoří skupinu prioritních látek spadajících pod bromované difenylethery podle Směrnice Evropského parlamentu a Rady 2013/39/EU [61]; tj, kongenery čísel 28, 47, 99, 100, 153 a 154.

Obrázek 24. Frakce PRC látek ve vzorkovači po expozici jako funkce log (KpwM0,47). Fit modelové funkce [51] je zobrazen jako plná čára,
Tabulka 12 Koncentrace bromovaných difenyletherů ve vzorkovači v povrchové vodě v rybníku Starý v Pohořelicích vypočítaná z koncentrace v pasivním vzorkovači na bázi silikonové pryže po 164denní expozici
|
Látka |
log Kow |
log Kpw |
M (g mol-1) |
Np (pg) |
Nf(pg) |
RS (l d-1) |
DEQ1 |
Cw (fg l-1) |
|
BDE 28 |
6,24 |
5,98 |
407 |
40 |
<1 |
16,3 |
0,08 |
16 |
|
BDE 47 |
6,8 |
6,49 |
486 |
240 |
13 |
14,9 |
0,02 |
93 |
|
BDE 100 |
7,09 |
6,97 |
565 |
20 |
3 |
14,0 |
0,01 |
8 |
|
BDE 99 |
7,38 |
7,15 |
565 |
52 |
11 |
14,0 |
0,01 |
18 |
|
BDE 154 |
7,62 |
7,44 |
644 |
14 |
1 |
13,1 |
0,003 |
6 |
|
BDE 153 |
7,86 |
7,42 |
644 |
5 |
3 |
13,1 |
0,002 |
1 |
|
SUMA |
141 |
|||||||
Koncentrace sumy kongenerů bromovaných difenyletherů je tedy 141 fg l-1 (femtogramů BDE na litr vody), tj, 1,41×10-13 g l-1. Takové nízké koncentrace nebylo dosud možné v povrchových vodách kvantitativně stanovit žádnou dostupnou technikou.
7.11.2.2 Příklad 2. Stanovení koncentrace volně rozpuštěné koncentrace bromovaných difenyletherů v odpadní vodě pomocí vzorkovacího zařízení pro dynamické pasivní vzorkování
Příklad ilustruje stanovení volně rozpuštěné koncentrace bromovaných difenyletherů (BDE) ve vyčištěné odpadní vodě z komunální čistírny odpadních vod v Brně-Modřicích, kde je předpoklad zatížení různými zdroji znečištění.
Pasivní vzorkovač ze silikonové pryže AlteSil s rozměry 14×28 cm o tloušťce 0,5 mm a hmotnosti 22,25 g byl exponován od 2.6.2015 do 1.9.2015 ve vyčištěné odpadní vodě z komunální čistírny odpadních vod v Brně-Modřicích.
Doba expozice byla 112 dní. Teplota vody po dobu vzorkování kolísala mezi 19°C a 23°C. Do vzorkovače byly před expozicí přidány v množství 70-700 ng na vzorkovač provozní referenční látky (PRC) - PCB (1, 2, 3, 10, 14, 21, 30, 50, 55, 78, 104, 145 a 204) postupem uvedeným v kapitole 7.4.2.
V exponovaném vzorkovači, a dále v laboratorním a terénním kontrolním vzorkovači byly po expozici stanoveny koncentrace PRC látek a bromovaných difenyletherů, konkrétně kongenery čísel 28, 47, 99, 100, 153 a 154.
Z poměru koncentrace jednotlivých PRC látek v exponovaném vzorkovači a v laboratorní kontrole (7.12.2) vypočítáme frakci f jednotlivých PRC látek, zbylých ve vzorkovači po expozici (Tabulka 13).
Následnou optimalizací pomocí nelineární regrese f podle rovnice (19) bylo získáno FA=158 ± 17, což koresponduje s hodnotou parametru vzorkovací rychlosti (pro látku s molární hmotností M=300 g mol-1) Rs = 10,9 ± 1,2 l d-1. Ke snížení vzorkovací rychlosti zařízení oproti maximální dosažitelné hodnotě cca, 80 l d-1 docházelo v důsledku častého částečného zanášení nasávací hlavice čerpadla zařízení vláknitými řasami. Hlavice byla po dobu expozice čištěna cca, v 2-týdenních intervalech. Sledovaný vliv na vzorkovací rychlost lze vysvětlit zpomalením proudění vody v zařízení vlivem mechanického zanesení a kromě nižších akumulovaných množství látek, které jsou vzorkovány v kinetickém režimu, a související citlivosti zařízení nemá vliv na stanovení výsledné hodnoty koncentrace látky.
Tabulka 13 Provozní referenční látky, jejich rozdělovací koeficienty log Kpw [37], molární hmotnosti a procento PRC zbylé ve vzorkovači po 112 denní expozici ve vyčištěné odpadní vodě z čistírny odpadních vod v Brně-Modřicích.
|
Provozní referenční látka (PRC) |
M (g mol-1) |
logKpw (l kg-1) |
Frakce f PRC zadržené ve vzorkovači po expozici |
|
PCB 1 |
188,7 |
4,22 |
2% |
|
PCB 2 |
188,7 |
4,41 |
5% |
|
PCB 3 |
188,7 |
4,36 |
5% |
|
PCB 10 |
223,1 |
4,55 |
27% |
|
PCB 14 |
223,1 |
5,14 |
58% |
|
PCB 21 |
257,5 |
5,43 |
79% |
|
PCB 30 |
257,5 |
5,24 |
85% |
|
PCB 50 |
292,0 |
5,70 |
68% |
|
PCB 55 |
292,0 |
6,00 |
93% |
|
PCB 78 |
292,0 |
6,05 |
85% |
|
PCB 104 |
326,4 |
6,17 |
86% |
|
PCB 145 |
360,9 |
6,65 |
93% |
|
PCB 204 |
429,8 |
7,59 |
100% |

Obrázek 25. Frakce PRC látek ve vzorkovači po expozici jako funkce log (KpwM0,47), Optimalizovaná modelová funkce [51] je zobrazena jako plná čára.
Vzorkovací rychlost pro kongener BDE 28 je dána modelem Rs= FA×M-0,47 [36], tj, RS(BDE 28)= 158×407-0,47=9,4 l d-1. Zbývá ještě potvrdit, že pro sledovanou látku není nutno uvažovat odpor vůči transportu ve vrstvě silikonové pryže, což lze ověřit stejným způsobem, jak je popsáno v kapitole 7.11.2.1. Z výpočtu vyplývá, že přestup BDE28 v polymeru je cca čtyřicettisíckrát větší v polymeru, než v mezní difúzní vrstvě vody. Akumulace BDE 28 do vzorkovače je tedy ovládána difúzí v mezní difúzní vrstvě vody a pro výpočet koncentrace ve vodě lze tedy použít vzorkovací rychlosti odhadnuté pomocí PRC.
Koncentrace kongenéru BDE 28 ve vodní fázi Cw se vypočítá podle rovnice (20):
|
Np = 1369 pg |
je množství BDE 28 v exponovaném vzorkovači |
|
Nf = <1 pg |
je množství BDE 28 v terénní kontrole |
|
Kpw = 105,98 l kg-1 |
je rozdělovací koeficient vzorkovač/voda |
|
B = 158 d-1 |
je optimalizovaný parametr z modelu [36] |
|
mp = 22,3 g = 0,023 kg |
je hmotnost vzorkovače |
|
M = 406,9 g mol-1 |
je molární hmotnost BDE 28 |
|
t = 112 dní |
je doba expozice vzorkovače |
|
Rs = 9,4 l d-1 |
je vzorkovací rychlost, vypočítaná podle vzorce FA×M-0,47 |

Obdobným způsobem se vypočítá koncentrace ve vodní fázi Cw dalších látek, které tvoří skupinu prioritních látek spadajících pod bromované difenylethery podle Směrnice Evropského parlamentu a Rady 2013/39/EU [61]; tj, kongenery čísel 28, 47, 99, 100, 153 a 154.
Koncentrace sumy kongenerů bromovaných difenyletherů je tedy 48,73 pg l-1, tj, 4,87×10-11 g l-1. Porovnáním výsledků měření ve vyčištěné odpadní vodě je zřejmé, že zatížení odpadní vody bromovanými difenylétery i po vyčištění komunální čistírnou odpadních vod, která efektivně odstraňuje znečištění nutrienty, je cca. třistakrát vyšší než v povrchové vodě nezatížené přímým zdrojem kontaminace. I přesto jsou koncentrační úrovně BDE v oblasti, kterou lze jen ztěží změřit pomocí přímé analýzy vzorků vody. Vzhledem k bioakumulaci BDE v tkáních vodních živočichů však tyto koncentrace mohou představovat toxikologické riziko, což je potřeba zhodnotit v dalším výzkumu.
Tabulka 14 Koncentrace bromovaných difenyletherů ve vzorkovači v povrchové vodě ve vyčištěné odpadní vodě z čistírny odpadních vod v Brně-Modřicích vypočítaná z koncentrace v pasivním vzorkovači na bázi silikonové pryže po 112 denní expozici.
|
Látka |
logKow |
logKpw |
M |
Np (pg) |
Nf(pg) |
RS (l d-1) |
DEQ1 |
Cw (pg l-1) |
|
BDE 28 |
6,24 |
5,98 |
407 |
1369 |
<1 |
9,4 |
0,032 |
1,32 |
|
BDE 47 |
6,8 |
6,49 |
486 |
24574 |
8 |
8,7 |
0,009 |
25,39 |
|
BDE 100 |
7,09 |
6,97 |
565 |
2901 |
3 |
8,1 |
0,004 |
3,21 |
|
BDE 99 |
7,38 |
7,15 |
565 |
15559 |
11 |
8,1 |
0,002 |
17,20 |
|
BDE 154 |
7,62 |
7,44 |
644 |
592 |
1 |
7,6 |
0,001 |
0,69 |
|
BDE 153 |
7,86 |
7,42 |
644 |
787 |
3 |
7,6 |
0,001 |
0,92 |
|
SUMA |
48,73 |
|||||||
1 Podle rovnice
7.12 Zajištění a řízení kvality (QA/QC)
Pro zabezpečení kvality monitorování pomocí pasivního vzorkování je zapotřebí řada opatření řízení kvality. Patří mezi ně analýza rozpouštědel a použitých činidel (činidel pro slepé stanovení), kontroly, terénní kontroly a zařízení pro určení výtěžnosti. Porovnání činidel pro slepé stanovení, laboratorních a terénních kontrol může pomoci identifikovat možné zdroje kontaminace a podniknout potřebná opatření k zajištění kvality.
7.12.1 Činidlo pro slepé stanovení (reagent blank)
Podle normy ČSN EN ISO 5667-23 [1] se takto označuje alikvotní objem činidla, používaného při úpravě pasivních vzorkovacích zařízení, který se po nasazení vzorkovacího zařízení analyzuje za účelem jakéhokoli znečištění použitými činidly. Množství látky, nalezené v tomto typu slepého vzorku je možno odečíst od množství nalezeného v exponovaných vzorkovačích, laboratorních a terénních kontrolách.
7.12.2 Laboratorní kontrola
Pojem laboratorní kontroly není přímo definován v normě ČSN EN ISO 5667-23 [1], Laboratorní kontrola označuje pasivní vzorkovací zařízení pro řízení kvality, určené pro zaznamenávání jakékoliv chemické látky akumulované v pasivních vzorkovacích zařízeních během výroby, sestavování (montáže), skladování a následné analýzy. Slouží též k stanovení počáteční koncentrace provozních referenčních látek (PRC) ve vzorkovači, který nebyl exponován v terénu (N0). Procento PRC zůstávající ve vzorkovači po expozici se stanoví jako podíl množství PRC v exponovaném vzorkovacím zařízení k množství v laboratorní kontrole (N0). Pro vzájemnou porovnatelnost dat mezi exponovaným vzorkovačem a
laboratorní kontrolou je nutné, aby laboratorní kontrolní vzorky byly připraveny v jedné homogenní várce spolu se vzorkovači určenými pro terénní nasazení. Množství analyzovaných látek v laboratorních kontrolních vzorcích by v ideálním případě mělo být porovnatelné s množstvím nalezeným v činidle pro slepé stanovení. Výsledky stanovení sledovaných látek v laboratorních kontrolách lze použít pro odhad meze detekce (LOD) nebo meze stanovení (LOQ) metody. Za tímto účelem se množství analytu nalezené v laboratorní kontrole nebo v instrumentálním slepém vzorku dosadí do rovnice 5. Pokud je koncentrace sledované sloučeniny v laboratorní kontrole mnohem vyšší než v činidle pro slepé stanovení (v slepém vzorku), postup přípravy vzorkovače by měl být kriticky zhodnocen a měla by být identifikována a odstraněna příčina těchto zvýšených koncentrací [14].
|
|
Pozor! Vzhledem k tomu, že hodnoty LOQ pro koncentrace vody jsou vypočteny s použitím vzorkovací rychlosti, která je specifická pro každý odběr, hodnoty LOQ jsou taky specificky vázané na konkrétní odběr. Integrační charakter pasivního vzorkování často umožňuje snížit LOQ prodloužením expoziční doby vzorkovače. |
7.12.3 Terénní kontrola
Podle normy ČSN EN ISO 5667-23 [1] označuje pojem terénní kontrola pasivní vzorkovací zařízení pro řízení kvality, určené pro zaznamenávání jakékoliv chemické látky akumulované v pasivních vzorkovacích zařízeních během výroby, sestavování (montáže), skladování, dopravy, rozmístění, vyjmutí a následné analýzy.
Terénní kontrolní vzorky mohou obsahovat vyšší koncentrace sledované látky než laboratorní kontrolní vzorky, zvláště pokud jsou vzorkovače osazovány ve vysoce kontaminovaných oblastech v blízkosti továren, dálnic, na palubách lodí, nebo když je instalace vzorkovačů prováděna v oblasti se zvýšeným znečištěním ovzduší. Vzhledem k tomu, že kontaminace terénních kontrolních vzorků je specifická pro konkrétní odběr, nedoporučuje se obecně používat tyto vzorky řízení kvality pro stanovení průměrné hodnoty slepých stanovení nebo mezí stanovení. Terénní kontroly by mělo být především použity ke kvalitativnímu posouzení kontaminace z ovzduší během přepravy a procesu nasazení/vyjmutí vzorkovačů v terénu. Zvýšené koncentrace analytů v terénních kontrolách může naznačit potřebu revidovat/změnit postup instalace a vyjmutí pasivních vzorkovačů v terénu.
7.12.4 Provozní referenční látka (performance reference compound; PRC)
Podle normy ČSN EN ISO 5667-23 [1] se jako provozní referenční látka označuje látka, která se před expozicí přidává do vzorkovacího zařízení, a která má takovou afinitu ke vzorkovacímu zařízení, že v něm během expozice ubývá a neruší odběr vzorků a analytické postupy. Pro získání informace o kinetice akumulace znečišťujících látek v místě odběru vzorků se používají rychlosti úbytku (odstranění) PRC.
7.12.5 Zařízení pro určení výtěžnosti (recovery spike)
Podle normy ČSN EN ISO 5667-23 [1] se takto označuje pasivní vzorkovací zařízení, k němuž byla přidána známá hmotnost standardu pro určení analytické výtěžnosti, které se používá ke stanovení výtěžnosti znečišťující látky z pasivních vzorkovacích zařízení po expozici.
7.12.6 Použití kontrolních a slepých vzorků
Množství sledovaných látek, naměřených v činidle pro slepé stanovení (7.12.1) může být odečteno od množství změřeného v exponovaných vzorcích, laboratorních (7.12.2) a terénních kontrolních vzorcích (7.12.3). Množství sledované látky v laboratorní kontrole by mělo být nejlépe podobné množství změřenému v činidle pro slepé stanovení. Výsledky měření laboratorních kontrolních vzorků se mohou použít k odhadu meze detekce a meze stanovení metody (LOD/LOQ). Pokud jsou množství sledované látky v laboratorní kontrole mnohem vyšší než v činidle pro slepé stanovení, postup přípravy vzorkovače by měl být kriticky posouzen a měly by být identifikovány a odstraněny příčiny těchto zvýšených koncentrací (a následné vyšší LOD/LOQ).
Korekce množství sledované látky v exponovaném vzorkovači (Nt) použitím laboratorní kontroly (N0) není založeno na jednoduchém odčítání. U sloučenin, které dosáhnou během expozice rovnováhy mezi vzorkovačem a vodou, množství sledované sloučeniny po expozici nebude ovlivněno množstvím, které bylo ve vzorkovači v čase jeho konstrukce, tj, množstvím přítomným v laboratorní kontrole. Naproti tomu, pro velmi hydrofobní sloučeniny s vysokou akumulační kapacitou (Kpw×mp), jejich množství ve vzorkovači po expozici je dáno součtem množství v laboratorní kontrole a množství akumulovaného během expozice [62].
Odečítání množství analytu nalezeného v kontrolním vzorku může být provedeno pro analyty, které byly v lineární fázi vzorkování během expozice, což lze vyvodit z údajů o eliminaci PRC látek. Odečítání terénní kontroly (Nf) by nemělo být prováděno pro sloučeniny, které dosahují během expozice (částečné) rovnováhy, protože množství zjištěné v exponovaných vzorkovačích může být nižší než ve vzorcích terénního kontrolního vzorku, v důsledku částečného vyplavení kontaminace (přítomné ve vzorkovači před jeho terénní expozicí) v průběhu expozice[14,63]. Důvodem je, že sloučeniny jsou uvolňovány z vzorkovače, pokud jejich počáteční koncentrace ve vzorkovači je vyšší než jejich rovnovážné koncentrace, a pokud jejich doba ekvilibrace je podobná, nebo kratší než je doba expozice vzorkovače. Vývoj koncentrace analytu ve vzorkovači (Np), v kterém nedochází k další kontaminaci během transportu a manipulace při instalaci/deinstalaci v terénu lze popsat obecnou rovnicí [24,64]:
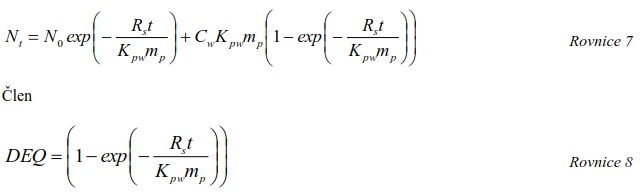
se označuje jako stupeň dosažení rovnováhy pro sledovanou látku mezi vzorkovačem a vzorkovaným médiem (vodou; DEQ).
První člen součtu představuje uvolňování sledované látky ze vzorkovače, pokud byla přítomna ve vzorkovači už při jeho výrobě v množství (No), Množství No je možno stanovit analýzou laboratorní kontroly (7.12.2). Tento člen je možno interpretovat jako (časově závislou) koncentraci látky v slepém vzorku, kterou je možno odečíst z množství látky stanovené v exponovaném vzorkovači. Pro látky, pro které se rovnováha mezi vzorkovačem a vodou ustanovuje rychle, je tento člen po jisté době rovný nule. Naopak, pro látky, které dosahují rovnováhu v soustavě vzorkovač-voda pomalu, zůstává tento člen po dobu expozice vzorkovače konstantní, tj, rovný N0.
V případě, že během transportu a manipulace se vzorkovači dochází k jejich kontaminaci, je možné odečíst hodnotu množství látky v terénní kontrole Nf a v laboratorní kontrole N0 od množství stanoveného v exponovaném vzorkovači Nt podle rovnice:
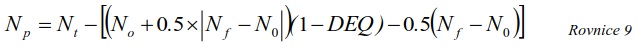
Tento výpočet vychází z úvahy, že ke kontaminaci terénní kontroly nedochází jednorázově během manipulace, transportu a skladování vzorkovače, ale neustále a konstantně během těchto operací. V čase výroby byl vzorkovač kontaminován množstvím látky. N0 a k tomuto množství přibude během operací transportu na místo odběru a rozmísťování vzorkovače množství 0,5×(Nf-N0), tj, polovina rozdílu množství látky v terénní kontrole vůči laboratorní kontrole. Stejné množství látky přibude v terénní kontrole při vyjímání vzorkovače a jeho transportu zpátky do laboratoře, tj, 0,5×(Nf-N0). Z množství kontaminace, kterou vzorkovač obsahuje na počátku terénní expozice, j, N0+0,5×(Nf-N0) se však během vzorkování část kontaminace uvolní do vzorkované vody, t,j, [N0+0,5×(Nf-N0)] ×(1-DEQ).
Orientačním pravidlem zůstává, že je akceptovatelné, když je množství látky v laboratorní nebo terénní kontrole menší než 10% množství přítomného v exponovaném vzorkovači. V takovém případě není nutná ani korekce množství látky v exponovaném vzorkovači.
7.12.7 Řízení kvality v přípravě vzorků na toxikologickou analýzu
Řízení kvality pro pasivní vzorkovače, které jsou určeny pro toxikologické analýzy je podobné těm pro chemickou analýzu. Laboratorní kontrolní vzorky (7.12.2) a terénní kontrolní vzorky (7.12.3) jsou zpracovány společně s exponovanými vzorkovači a zachází se s nimi stejně jako s ostatními vzorky. Slepé vzorky (7.12.1) se zpracují stejně jako ostatní vzorky, ale neobsahují polymerní materiál vzorkovače. Zatímco výtěžnost toxicity je dobrý způsob, jak testovat pro obecnou použitelnost metodou extrakce, dalšího čištění a zpracování vzorků, v případě nedostatečné výtěžnosti očekávaného toxického efektu v zpracovaném vzorku je problematické dopátrat se příčiny [39]. Proto se doporučuje, aby kromě testu výtěžnosti toxicity, byly analyzovány i vzorky pro stanovení výtěžnosti (7.12.5). Sada sloučenin, používaných k monitorování výtěžnosti metody by měla obsahovat takové chemické látky, o kterých je známo, že způsobují toxický efekt, sledovaný v extraktech vzorkovačů zvoleným toxikologickým testem. Tento přístup pomůže identifikovat skupiny látek a jejich vlastnosti, které by mohly být zodpovědné za nedostatečnou účinnost extrakce látek způsobujících sledovaný toxický účinek [65].
Protože PRC látky (7.12.4) se kvůli možné interferenci s biotesty nesmí používat ve vzorkovačích, které jsou určeny pro toxikologickou analýzu, vzorkovací rychlosti se nedají přímo odvodit z dat získaných analýzou těchto vzorkovačů. V tomto případě je nutno použít nepřímé metody stanovení vzorkovací rychlosti. Na tento účel se použijí vzorkovače s přidanými PRC látkami, stejných rozměrů, jako mají vzorkovače pro toxikologickou analýzu. Po expozici se ve vzorkovačích zanalyzuje úbytek PRC látek a odvozená vzorkovací rychlost (podle postupu uvedeného v kapitole 7.10) se aplikuje i na vzorkovače určené pro toxikologickou analýzu.
7.13 Reportování
Zpráva o získaných odhadech koncentrace ve vodné fázi by měla obsahovat informace o místě expozice, způsobu odběru vzorků, údaje o použitých metodách analýzy vzorků a souvisejících vzorcích řízení kvality, jakož i podrobnosti o výpočtech, které byly použity. Tato informace je důležitá, aby umožnila uživatelům data přepočítat v případě, že by budoucnosti byly zavedeny nové metody výpočtu koncentrací ve vodní fázi, nebo byly dostupné kvalitnější kalibrační parametry [44]. Norma ČSN ISO 56667-23 [1] specifikuje minimální rozsah informací, které by měly být uvedeny ve zprávě.
8 Popis novosti a uplatnění metodiky
Metodika je inovativní v několika aspektech. Poprvé je v ní systematicky představen postup pasivního vzorkování stopových množství bromovaných zhášečů hoření, který zahrnuje přípravu vzorkovačů, jejich nasazení v terénu, laboratorní zpracování, doporučené postupy chemické analýzy a výpočty koncentrací sledovaných látek ve vodním prostředí. Podle našich vědomostí jsou v ní poprvé na světě publikovány kalibrační parametry (difúzní a rozdělovací koeficienty) pasivního vzorkovače na bázi silikonové pryže AlteSil potřebné pro odběr BDE, HBCD a další bromované zhášeče hoření. Zcela nový je i v metodice uvedený postup dynamického pasivního vzorkování (viz kapitola 7.6) a uživatelská pomůcka v prostředí MS Excel pro výpočet koncentrací látek ve vodní fázi z množství sledované látky ve vzorkovači.
Tato metodika má pomoci uživatelům pasivního vzorkování, kteří chtějí realizovat pasivní odběr vzorků bromovaných zhášečů hoření nebo jiných hydrofobních kontaminantů vodního prostředí ve svém výzkumu nebo při monitorování znečišťujících látek. Je určena pro uživatele pasivních vzorkovačů, zejména pro firmy a instituce zabývající se kvalitou a znečištěním vodního ekosystému. V podmínkách ČR jsou to zejména podniky povodí, Český hydrometeorologický ústav a společnosti zodpovědné za kvalitu pitné vody.
Metodika je určena i pro orgány státní správy, zejména Ministerstva životního prostředí. Metodika přispívá nejen k plnění Koncepce monitoringu perzistentních organických polutantů (POPs), ale i k zpracování a využití dat o POPs v ČR a rovněž také k implementaci Stockholmské úmluvy o perzistentních organických polutantech. Pro sledování efektivity opatření Stockholmské ůmluvy v delším časovém horizontu byl ustaven další instrument, a to Globální monitorovací plán (GMP) SÚ, který určuje, které matrice je třeba prioritně monitorot. Mezi tyto klíčové matrice patří pro všechny zahrnuté látky volné ovzduší, mateřské mléko a krev, pro více rozpustné látky pak také voda. U vody jako nové matrice GMP je třeba ověřit, které ze současně používaných odběrových technik jsou nejvhodnější pro sledování látek. Ačkoli několik monitorovací programů bylo již vytvořeno s cílem posoudit dlouhodobé trendy znečišťujících látek ve vnitrozemských povrchových a pobřežních vodách, koordinované mezinárodní aktivity zaměřené na vytvoření globální monitorovací sítě ve vodním prostředí začaly jen velmi nedávno. Z podnětu Lohmanna a Muira [66,67] se v současnosti vytváří mezinárodní monitorovací síť AQUA-GAPS, program na monitorování persistentních organických látek v globálních vodách pomocí pasivního vzorkováni2. Předložená metodika může hrát důležitou roli jako nástroj používaný mezinárodní komunitou při provozu této nové monitorovací sítě.
Metodika má i významně přispět i k implementaci Vodní rámcové směrnice [68]. Bromované difenylethery a hexabromcyklododekan jsou aktuálně zařazeny na seznam prioritních nebezpečných látek [61]. Pasivní vzorkovače lze využít jako doplňkové metody jak pro situační, tak i pro provozní a průzkumné monitoringy [69,70]. Metodika může být vhodně využita při hodnocení chemického stavu vodních útvarů podle Evropské směrnice 2013/39/EU [61], k analýze jejich dlouhodobých trendů v monitorovaných vodních ůtvarech s cílem hodnocení účinnosti přijatých opatření vedoucích ke snížení výskytu bromovaných zhášečů hoření a dalších hydrofobních persistentních látek ve vodním prostředí. Směrnice 2013/39/EU zmiňuje potřebu vývoje nových nástrojů skýtajících potenciál pro budoucí využití, jako je pasivní odběr vzorků, pro monitorování prioritních a specifických znečišťujících látek ve vodním prostředí. Evropská asociace laboratoří NORMAN (www.norman-network.net) v spolupráci s komunitou vědců zabývajících se problematikou znečištění vod chemickými látkami SOLUTIONS (www.solutionsproject.eu/) formulovala stanovisko k plánované aktualizaci Vodní rámcové směrnice v roce 2019 [71]. Jedním z hlavních doporučení v stanovisku je návrh na doplnění stávajícího monitoringu hydrofobních bioakumulativních látek pasivním vzorkováním za účelem snížení nejistot vzorkování a jednoznačnější klasifikace stavu vodních útvarů. K naplnění tohto cíle má sloužit i tato metodika.
9 Literatura
[1] ČSN EN ISO 5667-23 Jakost vod - Odběr vzorků - Část 23: Návod pro pasivní odběr vzorků v povrchových vodách, Úřad pro Tech. Norm. Metrol. a Státní Zkušebnictví. (2011). http://www.tzbinfo.cz/normy/csn-en-iso-5667-23-2011-09.
[2] P. Mayer, J. Tolls, L. Hermens, D. Mackay, Equilibrium Sampling Devices, Environ. Sci. Technol. 37 (2003) 184A-191A.
[3] EU, Directive 2000/60/EC of the European parliament and of the council of 23 October 2000 establishing a framework for community action in the field of water policy., Off. J. Eur. Union. L327 (2000) 1-72.
[4] EU, Directive 2008/105/EC of the the European parliament and of the council of 16 December 2008 on environmental quality standards in the field of water policy., Off. J. Eur. Union. L348 (2008) 84-96. http://eurlex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:348:0084:0097:EN:PDF.
[5] EU, Directive 2013/39/EU of the European Parlament and of the Council of 12 August 2013 amending Directives 2000/60/EC and 2008/105/EC as regards priority substances in the field of water policy, Off. J. Eur. Union. L226 (2013) 1-17.
[6] B. Vrana, I.J. Allan, R. Greenwood, G.A. Mills, E. Dominiak, K. Svensson, et al., Passive sampling techniques for monitoring pollutants in water, TrAC Trends Anal. Chem. 24 (2005) 845- 868.
[7] F. Stuer-Lauridsen, Review of passive accumulation devices for monitoring organic micropollutants in the aquatic environment, Environ. Pollut. 136 (2005) 503-524. doi:10.1016/j.envpol.2004.12.004.
[8] G. Ouyang, J. Pawliszyn, Configurations and calibration methods for passive sampling techniques, J. Chromatogr. A. 1168 (2007) 226-235. doi:10.1016/j.chroma.2007.01.133.
[9] A. Kot-Wasik, B. Zabiegała, M. Urbanowicz, E. Dominiak, A. Wasik, J. Namieśnik, Advances in passive sampling in environmental studies, Anal. Chim. Acta. 602 (2007) 141-163. doi:10.1016/j.aca.2007.09.013.
[10] J. Namieśnik, B. Zabiegała, A. Kot-Wasik, M. Partyka, A. Wasik, Passive sampling and/or extraction techniques in environmental analysis: a review., Anal. Bioanal. Chem. 381 (2005) 279- 301. doi:10.1007/s00216-004-2830-8.
[11] F.A. Esteve-Turrillas, A. Pastor, V. Yusà, M. de la Guardia, Using semi-permeable membrane devices as passive samplers, TrAC - Trends Anal. Chem. 26 (2007) 703-712. doi:10.1016/j.trac.2007.05.006.
[12] T. Lobpreis, B. Vrana, K. Dercová, Innovative approach to monitoring organic contaminants in aqueous environment using passive sampling devices, Chem. List. 103 (2009) 548-558.
[13] M.J. Lydy, P.F. Landrum, A.M. Oen, M. Allinson, F. Smedes, A.D. Harwood, et al., Passive sampling methods for contaminated sediments: state of the science for organic contaminants., Integr. Environ. Assess. Manag. 10 (2014) 167-78. doi:10.1002/ieam.1503.
[14] R. Lohmann, K. Booij, F. Smedes, B. Vrana, Use of passive sampling devices for monitoring and compliance checking of POP concentrations in water, Environ. Sci. Pollut. Res. 19 (2012) 1885- 1895.
[15] B. Vrana, E.L.M. Vermeirssen, I. Allan, J. Kohoutek, K. Kennedy, G. Mills, et al., Passive sampling of emerging compounds in the environment: state of the art and perspectives, (2010). http://www.norman-network.net/sites/default/files/files/Events/2009/2009May27-PraguePassiveSampling/norman_position_paper_pas_sampling.pdf.
[16] G.A. Mills, B. Vrana, I. Allan, D.A. Alvarez, J.N. Huckins, R. Greenwood, Trends in Monitoring Pharmaceuticals and Personal-Care Products in the Aquatic Environment by Use of Passive Sampling Devices, Anal. Bioanal. Chem. 387 (2007) 1153-1157.
[17] H. Söderström, R.H. Lindberg, J. Fick, Strategies for monitoring the emerging polar organic contaminants in water with emphasis on integrative passive sampling, J. Chromatogr. A. 1216 (2009) 623-630. doi:10.1016/j.chroma.2008.08.030.
[18] K. Booij, Performance of passive samplers for monitoring priority substances., (2009). http://www.ices.dk/reports/MHC/2009/MCWG09.pdf.
[19] K. Booij, C.D. Robinson, R.M. Burgess, P. Mayer, C.A. Roberts, L. Ahrens, et al., Passive sampling in regulatory chemical monitoring of nonpolar organic compounds in the aquatic environment., Environ. Sci. Technol. 50 (2016) 3-17. doi:10.1021/acs.est.5b04050.
[20] OSPAR Joint Assessment and Monitoring Programme (JAMP) 2014−2021. Update 2015
(Agreement 2014−02) , London, 2015., (2015). http://www.ospar.org/documents?d=32988.
[21] C. Miège, N. Mazzella, I. Allan, V. Dulio, F. Smedes, C. Tixier, et al., Position paper on passive sampling techniques for the monitoring of contaminants in the aquatic environment - Achievements to date and perspectives, Trends Environ. Anal. Chem. 8 (2015) 20-26. doi:10.1016/j.teac.2015.07.001.
[22] J.N. Huckins, J.D. Petty, K. Booij, Monitors of Organic Chemicals in the Environment: Semipermeable Membrane Devices, Springer, New York, USA, 2006.
[23] R. Greenwood, G.A. Mills, B. Vrana, I. Allan, R. Aguilar-Martínez, G. Morrison, Monitoring of priority pollutants in water using Chemcatcher passive sampling devices, in: R. Greenwood, G. Mills, B. Vrana (Eds.), Compr. Anal. Chem. Vol. 48, Elsevier, Amsterdam, 2007: pp. 199-229.
[24] K. Booij, B. Vrana, J.N. Huckins, Theory, modelling and calibration of passive samplers used in water monitoring, in: R. Greenwood, G. Mills, B. Vrana (Eds.), Compr. Anal. Chem. 48. Passiv. Sampl. Tech. Environ. Monit., Elsevier, Amsterdam, 2007: pp. 141-169. doi:10.1016/S0166526X(06)48007-7.
[25] Å. Bergman, A. Rydén, R.J. Law, J. de Boer, A. Covaci, M. Alaee, et al., A novel abbreviation standard for organobromine, organochlorine and organophosphorus flame retardants and some characteristics of the chemicals, Environ. Int. 49 (2012) 57-82. doi:10.1016/j.envint.2012.08.003.
[26] Risk assessment: Hexabromocyclododecane, Off. Off. Publ. Eur. Communities. (2008). https://echa.europa.eu/documents/10162/661bff17-dc0a-4475-9758-40bdd6198f82 (accessed September 21, 2016).
[27] An Exposure Assessment of Polybrominated Diphenyl Ethers, U.S. Environ. Prot. Agency. (2010) 110. https://ofmpub.epa.gov/eims/eimscomm.getfile?p_download_id=496489.
[28] J.B. Kharlyngdoh, A. Pradhan, S. Asnake, A. Walstad, P. Ivarsson, P.-E. Olsson, Identification of a group of brominated flame retardants as novel androgen receptor antagonists and potential neuronal and endocrine disrupters, Environ. Int. 74 (2015) 60-70. doi:10.1016/j.envint.2014.09.002.
[29] P. López, S.A. Brandsma, P.E.G. Leonards, J. de Boer, Optimization and development of analytical methods for the determination of new brominated flame retardants and polybrominated diphenyl ethers in sediments and suspended particulate matter, Anal. Bioanal. Chem. 400 (2011) 871-883. doi:10.1007/s00216-011-4807-8.
[30] P. Guerra, E. Eljarrat, D. Barceló, Determination of halogenated flame retardants by liquid chromatography coupled to mass spectrometry, TrAC Trends Anal. Chem. 30 (2011) 842-855. doi:10.1016/j.trac.2011.01.018.
[31] Scientific Opinion on Emerging and Novel Brominated Flame Retardants (BFRs) in Food, EFSA J. 10 (2012) 2908. doi:10.2903/j.efsa.2012.2908.
[32] PubChem, (n.d.). https://pubchem.ncbi.nlm.nih.gov/ (accessed September 21, 2016).
[33] M. Harju, E.S. Heimstad, D. Herzke, T. Sandanger, S. Posner, F. Wania, Current state of knowledge and monitoring requirements - Emerging “new” brominated flame retardants in flame retarded products and the environment, (2008). http://www.miljodirektoratet.no/old/klif/publikasjoner/2462/ta2462.pdf (accessed September 21, 2016).
[34] T.P. Rusina, F. Smedes, M. Koblizkova, J. Klanova, Calibration of silicone rubber passive samplers: experimental and modeled relations between sampling rate and compound properties., Environ. Sci. Technol. 44 (2010) 362-7. doi:10.1021/es900938r.
[35] B. Vrana, G.A. Mills, M. Kotterman, P. Leonards, Modelling and field application of the Chemcatcher passive sampler calibration data for the monitoring of hydrophobic organic pollutants in water, (2006). doi:10.1016/j.envpol.2006.04.030.
[36] K. Booij, F. Smedes, An improved method for estimating in situ sampling rates of nonpolar passive samplers., Environ. Sci. Technol. 44 (2010) 6789-94. doi:10.1021/es101321v.
[37] F. Smedes, R.W. Geertsma, T. Van Der Zande, K. Booij, Polymer-water partition coefficients of hydrophobic compounds for passive sampling: Application of cosolvent models for validation, Environ. Sci. Technol. 43 (2009) 7047-7054.
[38] E.L. Difilippo, R.P. Eganhouse, Assessment of PDMS-water partition coefficients: Implications for passive environmental sampling of hydrophobic organic compounds, Environ. Sci. Technol. 44 (2010) 6917-6925.
[39] S.E. Hale, T.J. Martin, K.-U. Goss, H.P.H. Arp, D. Werner, Partitioning of organochlorine pesticides from water to polyethylene passive samplers, Environ. Pollut. 158 (2010) 2511-2517.
[40] R. Greenwood, G.A. Mills, B. Vrana, Passive sampling techniques in environmental monitoring, Elsevier, Amsterdam, 2006.
[41] R.M. Burgess, Guidelines for Using Passive Samplers to Monitor Organic Contaminants at Superfund Sediment Sites. EPA/600/R-11/115, Washington, DC, 2012. https://cfpub.epa.gov/si/si_public_record_report.cfm?dirEntryId=238596 (accessed August 21, 2016).
[42] R. Grabic, K. Grabicová, G. Fedorova, O. Golovko, T. Randák, Metodika sledování kontaminace povrchových vod organickými cizorodými látkami pomocí pasivních vzorkovačů. Edice metodik ; 158. Technologická řada, Jihočeská univerzita v Českých Budějovicích, Fakulta rybářství a ochrany vod, Vodňany, 2015.
[43] Guidelines for the Use of the Semipermeable Membrane Device (SPMD) and the Polar Organic Chemical Integrative Sampler (POCIS) in Environmental Monitoring Studies, (n.d.). . http://pubs.usgs.gov/tm/tm1d4/pdf/tm1d4.pdf.
[44] F. Smedes, K. Booij, Guidelines for passive sampling of hydrophobic contaminants in water using silicone rubber samplers, International Council for the Exploration of the Sea, Copenhagen, 2012. http://info.ices.dk/pubs/times/times52/120621 TIMES 52 Final.pdf.
[45] Altec Products Ltd, (n.d.). http://www.altecweb.com/.
[46] D. Gilbert, G. Witt, F. Smedes, P. Mayer, Polymers as Reference Partitioning Phase: Polymer Calibration for an Analytically Operational Approach To Quantify Multimedia Phase Partitioning, Anal. Chem. 88 (2016) 5818-5826. doi:10.1021/acs.analchem.6b00393.
[47] ČSN EN ISO 5667-3 Kvalita vod - Odběr vzorků - Část 3: Konzervace vzorků vod a manipulace s nimi, Úřad pro Tech. Norm. Metrol. a Státní Zkušebnictví. (2013). http://www.technicke-normycsn.cz/technicke-normy/92459-nahrady-757051-csn-en-iso-5667-3.html.
[48] I.J. Allan, G. Christensen, K. Bæk, A. Evenset, Photodegradation of PAHs in passive water samplers, Mar. Pollut. Bull. 105 (2016) 249-254. doi:10.1016/j.marpolbul.2016.02.018.
[49] Azeotrope tables, (n.d.). https://en.wikipedia.org/wiki/Azeotrope_tables.
[50] K. Booij, H.M. Sleiderink, F. Smedes, Calibrating the Uptake Kinetics of Semipermeable Membrane Devices using Exposure Standards., Environ. Toxicol. Chem. 17 (1998) 1236-1245.
[51] K. Booij, F. Smedes, An improved method for estimating in situ sampling rates of nonpolar passive samplers, Environ. Sci. Technol. 44 (2010) 6789-6794.
[52] T.P. Rusina, F. Smedes, M. Koblizkova, J. Klanova, Calibration of silicone rubber passive samplers: Experimental and modeled relations between sampling rate and compound properties, Environ. Sci. Technol. 44 (2010) 362-367.
[53] T. Rusina, F. Smedes, J. Klanova, K. Booij, I. Holoubek, Polymer Selection for Passive Sampling: a Comparison of Critical Properties, Chemosphere. 68 (2007) 1344-1351.
[54] B. Vrana, L. Komancová, J. Sobotka, Calibration of a passive sampler based on stir bar sorptive extraction for the monitoring of hydrophobic organic pollutants in water, Talanta. 152 (2016) 90-97. doi:10.1016/j.talanta.2016.01.040.
[55] K. Booij, B. Vrana, J. Huckins, Theory, modelling and calibration of passive samplers used in water monitoring, … Environ. Monit. 48 (2007) 141-169. doi:10.1016/S0166-526X(06)48007-7.
[56] R. Lohmann, K. Booij, F. Smedes, B. Vrana, Use of passive sampling devices for monitoring and compliance checking of POP concentrations in water., Environ. Sci. Pollut. Res. Int. 19 (2012) 1885-95. doi:10.1007/s11356-012-0748-9.
[57] K. Yates, I. Davies, L. Webster, P. Pollard, L. Lawton, C. Moffat, Passive sampling: Partition coefficients for a silicone rubber reference phase, J. Environ. Monit. 9 (2007) 1116-1121.
[58] M.T.O. Jonker, S.A. van der Heijden, M. Kotte, F. Smedes, Quantifying the Effects of Temperature and Salinity on Partitioning of Hydrophobic Organic Chemicals to Silicone Rubber Passive Samplers., Environ. Sci. Technol. (2015). doi:10.1021/acs.est.5b00286.
[59] T. Rusina, F. Smedes, J. Klanova, Diffusion coefficients of polychlorinated biphenyls and polycyclic aromatic hydrocarbons in polydimethylsiloxane and low-density polyethylene polymers, J. Appl. Polym. Sci. 116 (2010) 1803-1810.
[60] J.F. Narváez Valderrama, K. Baek, F.J. Molina, I.J. Allan, Implications of observed PBDE diffusion coefficients in low density polyethylene and silicone rubber., Environ. Sci. Process. Impacts. 18 (2016) 87-94. doi:10.1039/c5em00507h.
[61] Evropská_unie, SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY 2013/39/EU ze dne 12. srpna 2013, kterou se mění směrnice 2000/60/ES a 2008/105/ES, pokud jde o prioritní látky v oblasti vodní politiky, Úřední Věstník Evr. Unie. L226 (2013) 1-17.
[62] B. Vrana, P. Popp, A. Paschke, G. Schuurmann, Membrane-enclosed sorptive coating. An integrative passive sampler for monitoring organiccontaminants in water, Anal. Chem. 73 (2001) 5191-5200.
[63] G. Durell, T. Røe Utvik, S. Johnsen, T. Frost, J. Neff, Oil well produced water discharges to the North Sea. Part I: Comparison of deployed mussels (Mytilus edulis), semi-permeable membrane devices, and the DREAM model predictions to estimate the dispersion of polycyclic aromatic hydrocarbons, Mar. Environ. Res. 62 (2006) 194-223.
[64] B. Vrana, P. Popp, A. Paschke, G. Schüürmann, Membrane-enclosed sorptive coating. An integrative passive sampler for monitoring organic contaminants in water, Anal. Chem. 73 (2001) 5191-5200.
[65] W. Brack, S. Ait-Aissa, R.M. Burgess, W. Busch, N. Creusot, C. Di Paolo, et al., Effect-directed analysis supporting monitoring of aquatic environments - An in-depth overview, Sci. Total Environ. 544 (2016) 1073-1118. doi:10.1016/j.scitotenv.2015.11.102.
[66] R. Lohmann, D. Muir, Global aquatic passive sampling (AQUA-GAPS): Using passive samplers to monitor POPs in the waters of the world, Environ. Sci. Technol. 44 (2010) 860-864. doi:10.1021/es902379g.
[67] D. Muir, R. Lohmann, Water as a new matrix for global assessment of hydrophilic POPs, TrAC - Trends Anal. Chem. 46 (2013) 162-172. doi:10.1016/j.trac.2012.12.019.
[68] Evropská_unie, SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY 2000/60/ES ze dne 23. října 2000, kterou se stanoví rámec pro činnost Společenství v oblasti vodní politiky, Úřední Věstník Evr. Unie. L 327 (2000) 275-346.
[69] G. Hanke, P. Lepom, P. Quevaviller, eds., COMMON IMPLEMENTATION STRATEGY FOR THE WATER FRAMEWORK DIRECTIVE (2000/60/EC) Technical Report - 2009 - 025 Guidance Document No. 19 GUIDANCE ON SURFACE WATER CHEMICAL MONITORING UNDER THE WATER FRAMEWORK DIRECTIVE, Office for Official Publications of the European Communities, Luxembourg, 2009.
[70] V. Dulio, M. Carere, G. Hanke, S. Polesello, M. David, C. Sollazzo, et al., Guidance document No. 25 Guidance on chemical monitoring of sediment and biota under the Water Framework Directive, Office for Official Publications of the European Communities, Luxembourg, 2010. doi:10.2779/43586.
[71] W. Brack, V. Dulio, M. Ågerstrand, I. Allan, R. Altenburger, M. Brinkmann, et al., Towards the review of the European Union Water Framework management of chemical contamination in European surface water resources, Sci. Total Environ. 576 (2017) 720-737. doi:10.1016/j.scitotenv.2016.10.104.
10 Protokol o odběru vzorků (vzor)
Označení vzorkovače: _________________________________________________________
|
Odběrová lokalita |
||
|
Číslo záznamníku teploty vody: |
ZAČÁTEK ODBĚRU Instalace vzorkovače |
KONEC ODBĚRU Deinstalace vzorkovače |
|
Odběrový technik |
||
|
GPS Zeměpisná šířka |
||
|
GPS Zeměpisná délka |
||
|
Datum a čas odběru |
||
|
Doba manipulace se vzorkovači (expozice terénní kontroly na vzduchu) |
||
|
Označení použitého terénního kontrolního vzorkovače |
||
|
Vodivost vody |
||
|
pH vody |
||
|
Teplota vody |
||
|
Teplota vzduchu |
||
|
Fotografický snímek - čas snímku |
||
11 Protokol o provozu dynamického vzorkovacího zařízení po dobu expozice vzorkovače (vzor)
|
Odběrová lokalita, označení vzorkovače |
|||||
|
Odběrový technik |
Čerpadlo ZAPNUTO Datum a čas |
Čerpadlo VYPNUTO Datum a čas |
Zařízení vytaženo z vody OD Datum a čas |
Zařízení vytaženo z vody DO Datum a čas |
Poznámka- důvod zásahu |
12 Návod na zpracování dat z pasivních vzorkovačů na bázi silikonové pryže (AlteSil) pomocí nástroje v MS Excel
Součástí metodiky je praktický uživatelský nástroj vytvořený v MS Excel, který umožňuje kalkulaci vzorkovacích rychlostí pasivního vzorkování a výpočet koncentrací BDE a jiných hydrofobních látek ve vodní fázi z jejich množství akumulovaných v pasivním vzorkovači na bázi silikonové pryže AlteSil.
|
|
Pozor! Nástroj se nachází v souboru rs_v3_CZ_s_priklady.xlsx a tvoří jako samostatná příloha součást této metodiky.
|
12.1 Organizace dat pro výpočet vzorkovacích rychlostí RS (list RS kalkulace Altesil MW)
Shromážděte všechna data z jedné datové sady, spolu s potřebnými metadaty o době expozice a hmotnosti vzorkovačů.
Zvolte si krátké kódové označení (ID vzorku) pro každý vzorek.
Oddělte data s výsledky analýz provozních referenčních látek (PRC).
Názvy sloučenin jsou uvedeny v sloupcích, ID vzorků v řádcích
1. řádek ID vzorků, laboratorních a terénních kontrolních vzorků
2. řádek hmotnost vzorkovače
3. řádek doba expozice vzorkovače
4. řádek zůstává prázdný
5. řádek tento a další řádky obsahují výsledky analýz PRC látek
atd…
Zkratky názvů látek musí odpovídat zkratkám uvedeným v listu "SR_Kpw"
Následně vypočítejte frakci (procento) PRC látek zadrženou po expozici ve vzorkovači.
fEXPERIMENT = Nt/N0
Podělte množství PRC v exponovaném vzorkovači průměrem nebo mediánem hodnot PRC z kontrolních vzorkovačů (laboratorní kontrola), Výsledné hodnoty by měly být z intervalu 0 do 1, nebo alespoň ne výrazně vyšší než 1.
Připrav tabulku uspořádanou, jak je uvedeno výše.
Otevři list „Rs kalkulace Altesil MW“
Připravenou tabulku zkopírujte do modré oblasti jako hodnoty
Otevřete doplňek „Řešitel“
Přidejte podmínku, že všechny hodnoty parametru „FA“ mají být vyšší než 0,
Nastavte cílovou buňku $D$26
Nastavte proměnné buňky $F23:$W$23
Stiskni tlačítko “Řešit”
Řešitel nyní najde optimální hodnoty parametru FA, takže modelované hodnoty se nejlépe shodují s naměřenými hodnotami f
Výběrem různých vzorků v buňce “J21” lze vizuálně kontrolovat výsledky optimalizace pro různé vzorky. Jasně odlehlé hodnoty mohou být jednoduše odstraněny nebo označeny apostrofem v buňce, aby se vyloučily z optimalizace. V případě potřeby zopakujte postup optimalizace pomocí doplňku Řešitel.
Tabulka 15 vysvětluje parametry, které jsou vypočteny nelineární regresí metodou nejmenších čtverců, Dobré datové soubory vykazují relativní směrodatnou odchylku cvFA kolem 0,1, ale je možné dosáhnout i přesnější hodnoty cca, 0,05. Pro nízké hodnoty vzorkovacích rychlostí RS naopak hodnota cvFA může dosáhnout až 30%, V případě pochybnosti je možno optimalizaci parametru FA provést i použitím jiného software, V takovém případě je potřeba použít funkci

pro výpočet modelových hodnot a použít funkci Řešitel nebo jiný statistický program, který umožňuje nelineární regresi,
FA optimalizovatelný parameter
t doba expozice vzorkovače v dnech
mp hmotnost vzorkovače v kg
Kpw rozdělovací koeficient látky v systému polymer-voda v 1 kg-1
M molární hmotnost analyzované látky v g mol-1
Tabulka 15 Příklad výstupu modelu výpočtu vzorkovacích rychlostí RS
|
Výstup modelu |
ID vzorku Příklad 1 |
||
|
odhad FA |
FA |
274,5 |
Optimalizovatelný parametr |
|
SE FA |
sFA |
44,8 |
Směrodatná odchylka parametru FA |
|
cvFA |
0,16 |
Relativní směrodatná odchylka |
|
|
Optimizer SSQ |
SSQ |
0,073 |
Součet čtverců odchylek naměřených a modelových hodnot |
|
zbytková standardní odchylka |
sFit |
0,110 |
Zbytková standardní odchylka optimalizace |
|
Počet stupňů volnosti Df |
F Df |
6 |
Počet stupňů volnosti modelu |
|
RS pro M=300 |
Rs300 |
18,8 |
Vzorkovací rychlost RS pro modelovou sloučeninu s M=300 |
|
Smerodatná odchylka hodnoty Rs |
sRs |
3,1 |
Smerodatná odchylka hodnoty RS |
|
Vw pri M=300 |
Vzorkovaný objem |
3084 |
Extrahovaný objem vody VW pro modelovou sloučeninu s M=300 |
|
t |
Doba expozice (d) |
164 |
|
|
mp |
hm, vzorkovače kg |
0,0224 |
12.2 Výpočet koncentrace látky ve vodní fázi (Data Cw)
Koncentraci sledované látky ve vodní fázi lze vypočítat pomocí optimalizované hodnoty FA:
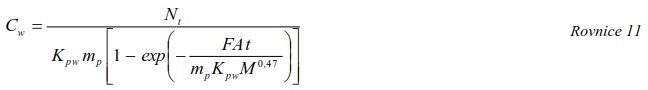
Jednotka koncentrace ve vodě Cw je vstupní jednotka hmotnosti na l, obyčejně ng - výsledek je pak v ng l-1,
Je užitečné nejdříve vypočítat tzv. stupeň dosažení rovnováhy (DEQ):

Hodnota DEQ = 1 značí, že pro sledovanou látku byla dosažena rovnováha mezi vzorkovačem a vodou. Čím více je hodnota DEQ vzdálena od 1, tím víc je pro sledovanou látku systém vzorkovač-voda vzdálen od rovnováhy. Všimněte si, že až do DEQ 0,5 je akumulace označována za lineární fázi vzorkování. Parametr DEQ je možno použít k vyjádření vzorce pro výpočet koncentraci látky ve vodě jednodušší formou:

Vypočítané hodnoty Cw lze ověřit manuálním výpočtem pro některé látky s nízkou nebo naopak vysokou hodnotou DEQ za použití zjednodušených vzorců, které jsou použitelné pro tyto případy, Pro látku, kde DEQ=1 je látka blízko rovnováhy a koncentraci CW lze odhadnout:

Koncentraci Cw pro látky s DEQ menším než 0,2 lze aproximovat:

Porovnání těchto výsledků s výsledky vypočítanými použitím úplného modelu ukáže možné chyby výpočtu nebo v použitých jednotkách.
13 Stanovení rozdělovacích koeficientů bromovaných zhášečů hoření v soustavě silikonová pryž-voda (KPW)
13.1 Princip metody
Hodnota rozdělovacího koeficientu látky v systému vzorkovač-voda (KPW) kvantifikuje poměr koncentrace sledované látky v materiálu vzorkovače a její volně rozpuštěné koncentrace ve vodné fázi v rovnovážném stavu. Hodnoty KPW jsou potřebné pro přepočet koncentrace látek v pasivním vzorkovači na na koncentraci ve vodné fáze. Stanovení se provádí v laboratorních podmínkách měřením koncentračního poměru látky ve vzorkovači, do kterého byly přidány sledované látky, a v zvoleném objemu vody po ustálení distribuční rovnováhy vzorkovače s vodní fází. K stanovení pravdivé hodnoty rozdělovacího koeficienta KPW je důležité použít ultračisté vody, která neobsahuje částice nebo rozpuštěnou organickou hmotu. Přítomnost částic nebo koloidů ve vodě by mohla zvyšovat koncentraci sledovaných sloučenin adsorpcí a zkreslovat tím výsledek měření.
13.2 Stanovení Kpw
Pro měření KPW byly použity malé vzorkovače zhotovené ze silikonového elastomeru AlteSil (~ 1 g, 90×40×0,25 mm), do kterých byly dávkovány sledované sloučeniny (BDE, HBCD a další bromované zhášeče hoření). Množství látek se pohybovalo od 100 do 300 ng na vzorkovač. K zajištění homogenní distribuce látek v elastomeru byly vzorkovače ponořeny do methanolu a přidány roztoky standardů. Za neustálého protřepávání pak byla postupně ke směsi přidávána voda, čímž se snižovala rozpustnos látek v metanolu a zvyšovala se jejich sorpce do polymeru AlteSil. Výsledná koncentrace metanolu v směsi je nižší než 50% a za těchto podmínek jsou sledované sloučeniny do značné míry sorbovány na polymer, Následně se methanol vymyl vodou a vzorkovače byly připraveny na stanovení Kpw. Z každého plátu polymeru byly průbojníkem vyraženy 3 kusy o průměru 5 mm, které sloužily k stanovení počáteční koncentrace látek v polymeru. Vzorkovač obsahující sledované látky byl pak upevněn na tyč z nerezové oceli a inkubován s 2 litry ultračisté vody v aparatuře (Obrázek 26) po dobu 8 týdnů na orbitální třepačce při 140 otáčkách za minutu.

Obrázek 26 Aparatura pro stanovení hodnot rozdělovacího koeficientu bromovaných zhášečů hoření v soustavě silikonová pryž AlteSil-voda (KPW)
Po ustálení rovnováhy byly vzorkovače vyjmuty a podíl polymeru byl po přídavku extrakčního vnitřního standardu extrahován dvakrát 20 ml směsí aceton/hexan (50/50) po dobu 2 hodin. Spojené extrakty byly odpařeny mikrodestilací pomocí Kuderna Danish (KD) odpařovací aparatury na objem cca 1ml a po přídavku instrumentálního vnitřního standardu a 100µl nonanu byl extrakt dále redukován na 100 µl pod proudem dusíku a přenesen do minivialky s insertem.
Dílčí vzorek vody (1,5 l) byl po přídavku extrakčního vnitřního standardu dvakrát extrahován dichlormethanem. Po snížení objemu extraktu pomocí KD odpařovací aparatury byly extrakty dále zpracovány stejným způsobem jako extrakty silikonové pryže. Pro oba typy vzorků (silikonová pryž i voda) byly zpracovány i vzorky pro slepé stanovení (reagent blanky). Všechny extrakty byly analyzovány instrumentálními metodami popsanými výše v metodice a koncentrace sledovaných látek ve vzorcích byly vypočítány pomocí izotopové zřeďovací metody.
Pro analýzu TBBPA a izomerů HBCD byla provedena samostatná extrakce vzorků. Vzorek vody o objemu 40 ml byl po přídavku extrakčního vnitřního standardu extrahován dvakrát směsí dichlormetan/hexan (80/20) a po redukci objemu byl extrakt převeden do acetonitrilu použitím azeotropické destilace směsi acetonitril s hexanem. Podíl vzorku silikonové pryže byl extrahován acetonitrilem a zakoncentrován na 1 ml. Extrakty byly analyzovány kapalinovou chromatografií v kombinaci s tandemovou hmotnostní spektrometrií a koncentrace sledovaných látek ve vzorcích byly vypočítány pomocí izotopové zřeďovací metody.
Koncentrace sledovaných látek v extraktech vzorkovače a vody byly převedeny na jednotky ng kg-1 (vzorkovač) a ng l-1 (vodní fáze), Hodnoty rozdělovacího koeficientu KPW byly vypočítány jako:

Vypočítané hodnoty logKPW jsou uvedeny v Tabulka 16.
Obrázek 27 ilustruje porovnání experimentálních hodnot log Kpw pro BDE a další bromované zhášeče hoření s hodnotami jejích rozdělovacích koeficientů v soustavě oktanol-voda (logKow). Pro dvě sledované látky nebyla nalezena publikovaná hodnota logKOW. Jelikož rozdělovací koeficient logKOW je považován za míru hydrofobicity látky, očekává se přímý vztah mezi naměřenou hodnotou logKPW a logKOW. Tento vztah nemusí ale platit pro všechny látky, protože vlastnosti oktanolu a silikonového elastomeru se liší. Nicméně pro většinu látek s hodnotou logKPW menší než 7 je pozorována dobrá závislost na logKOW, Kromě specifických vlastností některých látek, které vybočují z trendu závislosti KPW na hydrofobicitě je potřeba zohlednit i skutečnost, že publikované hodnoty logKOW jsou také často zatíženy značnou nejistotou. Pro látky s naměřenou hodnotou logKPW > 7 koncentrace ve vodní fázi po ustálení rovnováhy dosahovaly hodnot blízkých mezím stanovení, nebo mohly být zatíženy chybou kvůli vlivu tzv. třetí fáze (látky sorbované na koloidy nebo částice). Čím hydrofobnější je látka (t,j, čím vyšší je její hodnota KPW), tím menší množství třetí fáze je potřeba na ovlivnění volně rozpuštěné koncentrace ve vodní fázi. Naštěstí pro použití pasivního vzorkováni k výpočtu volně rozpuštěných koncentrací látek s logKPW>7 není tato hodnota potřebná, protože tyto látky jsou příliš hydrofobní a vzorkovače pro ně nedosahují rovnováhu s vodním prostředím. V tomto případě je odhad koncentrace ve vodní fázi založen pouze na odhadu vzorkovací rychlosti z uvolňování PRC látek.
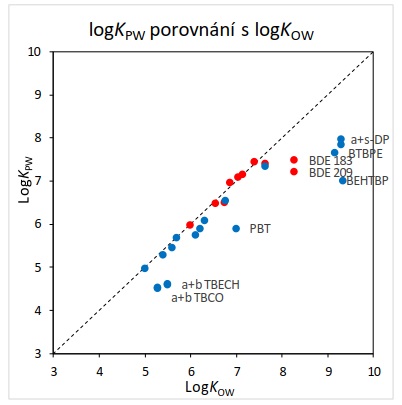
Obrázek 27 Porovnání naměřených hodnot rozdělovacích koeficientů bromovaných zhášečů hoření v soustavě silikonová pryž-voda (KPW) s hodnotami jejich rozdělovacích koeficientů v systému oktanol-voda (KOW)
14 Stanovení difúzních koeficientů bromovaných zhášečů silikonové pryži AlteSil (Dp)
14.1 Princip metody
Hodnoty difúzního koeficientu Dp byly vypočítány z distribuce koncentrace látky mezi 6 vrstev silikonové pryže po známé době difúze numerickým řešením podle 2. Fickova zákona. V kapitole 15 jsou naměřené hodnoty difúzního koeficientu bromovaných zhášečů hoření v materiálu silikonové pryže AlteSil. Experimentální hodnoty Dp se nachází i v souboru Difuzni_koeficienty _Br_latky_v_silikonu_Altesil_data.xlsx a tvoří jako samostatná příloha součást této metodiky.
14.2 Stanovení difúzních koeficientů
Difúzní koeficienty bromovaných zhášečů hoření byly stanoveny z distribuce látek v pěti na sobě navrstvených plátech silikonové pryže AlteSil po jisté době inkubace.
Hodnoty difúzního koeficientu byly vypočítány z distribuce koncentrace látky mezi 5 vrstev silikonové pryže po známé době difúze numerickým řešením podle 2. Fickova zákona podle postupu uvedeného v práci Rusina a kol. (2010) [59]. V kapitole 15 jsou naměřené hodnoty difúzního koeficientu bromovaných zhášečů hoření v materiálu silikonové pryže AlteSil.

Obrázek 28. Distribuce BDE 28 v 6 naskládaných vrstvách 0,5 mm tlustých plátů pryže AlteSil po různé době inkubace při 20°C.
15 Hodnoty rozdělovacích koeficientů bromovaných zhášečů hoření v soustavě silikonová pryž AlteSil-voda (KPW) a jejich difúzních koeficientů v silikonové pryži AlteSil při 20°C (Dp)
Tabulka 16 Bromované zhášeče hoření: Rozdělovacích koeficienty v soustavě silikonová pryž AlteSil-voda (KPW) a jejich difúzních koeficientů v silikonové pryži AlteSil při 20°C (logDp)
|
Zkratka |
CAS |
M (g mol-1) |
log KOW |
log Kpw1 (l kg-1) |
logDp2 (m2 s-1) |
|
aHBCD (α-HBCD) |
134237-50-6 |
641,70 |
5,07 |
4,58 |
-11,70±0,02 |
|
bHBCD (β-HBCD) |
134237-51-7 |
641,70 |
5,12 |
4,96 |
-11,48±0,01 |
|
gHBCD (γ-HBCD) |
134237-52-8 |
641,70 |
5,47 |
5,30 |
-11,70±0,04 |
|
BDE 28 |
41318-75-6 |
406,90 |
5,98 |
5,98 |
-10,32±0,01 |
|
BDE 47 |
5436-43-1 |
485,79 |
6,55 |
6,49 |
-10,51±0,01 |
|
BDE 99 |
60348-60-9 |
564,69 |
7,13 |
7,15 |
-10,60±0,01 |
|
BDE 100 |
189084-64-8 |
564,69 |
6,86 |
6,97 |
-10,59±0,01 |
|
BDE 153 |
68631-49-2 |
643,58 |
7,62 |
7,42 |
-10,68±0,01 |
|
BDE 154 |
207122-15-4 |
643,58 |
7,39 |
7,44 |
-10,70±0,01 |
|
BDE 209 |
1163-19-5 |
959,17 |
8,27 |
7,21 |
-10,74±0,01 |
|
ATE (TBP-AE) |
3278-89-5 |
370,86 |
5,00 |
4,97 |
-10,21±0,04 |
|
pTBX (TBX) |
23488-38-2 |
421,75 |
6,20 |
5,90 |
nestanoven |
|
BATE (TBP-BAE) |
3728-89-5 |
334,83 |
5,60 |
5,47 |
nestanoven |
|
PBBZ |
608-90-2 |
472,59 |
5,40 |
5,28 |
-10,12±0,02 |
|
TBCT |
39569-21-6 |
442,17 |
5,70 |
5,68 |
-10,10±0,02 |
|
PBT |
87-83-2 |
486,62 |
6,99 |
5,90 |
-10,08±0,02 |
|
PBEB |
85-22-3 |
500,64 |
6,76 |
6,55 |
-10,15±0,03 |
|
DPTE (TBP-DBPE) |
35109-60-5 |
530,67 |
6,30 |
6,09 |
nestanoven |
|
HBBZ (HBB) |
87-82-1 |
551,49 |
6,11 |
5,74 |
-10,22±0,02 |
|
PBBA |
59947-55-1 |
556,67 |
nenalezen |
6,14 |
nestanoven |
|
EHTBB (EH-TBB, TBB) |
183658-27-7 |
550,93 |
7,73 |
nestanoven |
nestanoven |
|
BTBPE |
37853-59-1 |
687,64 |
9,15 |
7,65 |
-10,71±0,01 |
|
BEHTBP (BEH-TEBP, TBPH) |
26040-51-7 |
706,14 |
9,34 |
7,02 |
nestanoven |
|
s-DP (s-DDC-CO) |
13560-89-9 |
653,72 |
9,30 |
7,97 |
-10,64±0,01 |
|
a-DP (a-DDC-CO) |
13560-89-9 |
653,72 |
9,30 |
7,85 |
-10.68±0,01 |
|
DPMA |
nenalezen |
6,90 |
-10.42±0,03 |
||
|
aTBECH (α-DBE-DBCH) |
3322-93-8 |
427,80 |
5,50 |
4,62 |
nestanoven |
|
bTBECH (β-DBE-DBCH) |
3322-93-8 |
427,80 |
5,50 |
4,60 |
nestanoven |
|
aTBCO (α-TBCO) |
3194-57-8 |
409,70 |
5,28 |
4,51 |
nestanoven |
|
bTBCO (β-TBCO) |
3194-57-8 |
409,70 |
5,28 |
4,54 |
nestanoven |
|
HCDBCO (DBHCTD) |
51936-55-1 |
540,76 |
7,62 |
7,35 |
nestanoven |
1 Kpw hodnoty bromovaných zhášečů hoření v systému AlteSil/voda byly experimentálně stanoveny jako součást řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA
2 Dp hodnoty bromovaných zhášečů hoření v systému AlteSil/voda byly experimentálně stanoveny jako součást řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA
Experimentální hodnoty Kpw se nachází i v souboru Kpw_rozdelovaci_koeficienty_Altesil_voda.xlsx a tvoří jako samostatná příloha součást této metodiky.
1 Přílohou předložené metodiky jsou Kpw hodnoty bromovaných zhášečů hoření v systému AlteSil/voda, které byly stanoveny jako součást řešení projektu „Emergentní polutanty ve složkách životního prostředí“ (TB030MZP001) podpořeného TA ČR v rámci programu BETA.
2 Mezinárodní expertní skupina se střetla na organizační schůzi na Jinan University v Guangzhou, Čínská lidová republika, 21.-22. ledna 2016.




