XXXX&Xxxxxx;XĚX&Xxxxxx; NAŘÍZENÍ KOMISE (XX) 2016/561
ze dne 11. xxxxx 2016,
xxxx&xxxxxx;x xx mění příloha XX xxxx&xxxxxx;xěx&xxxxxx;xx nařízení (XX) č. 577/2013, pokud xxx o vzorové veterinární xxxěxčxx&xxxxxx; pro xxxxxxxxx&xxxxxx; xřxxxxx psů, xxčxx xxxx fretek x&xxxx;&xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; xxxě xx čxxxxx&xxxxxx;xx státu
(Xxxx x významem xxx XXX)
XXXXXXX&Xxxxxx; KOMISE,
x&xxxx;xxxxxxx xx Xxxxxxx x&xxxx;xxxxxx&xxxxxx;x&xxxxxx; Evropské xxxx,
x&xxxx;xxxxxxx xx xxř&xxxxxx;xxx&xxxxxx; Xxxxxxx&xxxxxx;xx xxxxxxxxxx x&xxxx;Xxxx (XX) č.&xxxx;576/2013 xx xxx 12.&xxxx;čxxxxx&xxxx;2013 x&xxxx;xxxxxxxxx&xxxxxx;xx xřxxxxxxx xx&xxxxxx;řxx x&xxxx;x&xxxxxx;xxxx&xxxxxx;x xxxxx x&xxxx;x&xxxx;xxx&xxxxxx;xx&xxxxxx; xxř&xxxxxx;xxx&xxxxxx; (XX) č. 998/2003 (1), a zejména xx čx.&xxxx;25 xxxx.&xxxx;2 xxxxxx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx;,
xxxxxxxx x&xxxx;xěxxx xůxxxůx:
|
(1) |
Xxř&xxxxxx;xxx&xxxxxx; (XX) č. 576/2013 xxxxxx&xxxxxx;, žx psi, xxčxx x&xxxx;xxxxxx, xxxř&xxxxxx; xxxx přemísťováni do čxxxxx&xxxxxx;xx státu x&xxxx;xxčxx&xxxxxx;xx &xxxxxx;xxx&xxxxxx; xxxx třetí xxxě v rámci neobchodního xřxxxxx, musí být xxxx&xxxxxx;xxxx xxxxxxxxxxčx&xxxxxx;x dokladem xx formátu xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;. Č&xxxxxx;xx 1 xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; Xxxxxx (XX) č.&xxxx;577/2013 (2) stanoví vzorové xxxxxxx&xxxxxx;xx&xxxxxx; xxxěxčxx&xxxxxx;. |
|
(2) |
Ve xxxxxx&xxxxxx;x xxxxxxx&xxxxxx;xx&xxxxxx;x xxxěxčxx&xxxxxx; xx xxxňxxx požadavek &xxxxxx;xxě&xxxxxx;x&xxxxxx;xx xxxxx xxxxxxx&xxxxxx; xxxxxěxx xx xčxxx&xxxxxx;x&xxxxxx; xxxxx xxxxxxxxě, který xx xěx x&xxxxxx;x xxxxxxxx x&xxxx;xxxxxxx s přílohou XX xxř&xxxxxx;xxx&xxxxxx; (XX) č. 576/2013 xx vzorcích krve xxxxxxx&xxxxxx;xx psům, xxčx&xxxxxx;x x&xxxx;xxxxx&xxxxxx;x xxxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x x&xxxx;&xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; xxxě xxx&xxxxxx;xx než xxxxxx&xxxxxx;xx xx xxxxxxx v příloze XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; Xxxxxx (XX) č. 577/2013 xxxx xxxxxxž tranzit xx xřxx xxxx &xxxxxx;xxx&xxxxxx; nebo xřxx&xxxxxx; xxxx xx&xxxxxx;xxx&xxxxxx;x. |
|
(3) |
Xx opakovaných xř&xxxxxx;xxxxxx xxxěx&xxxxxx;x&xxxxxx; laboratorních xxxxxxxxů o výsledcích x&xxxxxx;xxxxxxxx&xxxxxx;xx xxxxx xxxxxxxx&xxxxxx;x&xxxxxx;xx xxxx xxxxxx&xxxxxx;xxx proti xxxxxxxxě xx xxxxx&xxxxxx; připomenout &xxxxxx;řxxx&xxxxxx;xůx xxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x xxxěxčxx&xxxxxx; xx &xxxxxx;xxx&xxxxxx;xx xxxx xx xřxx&xxxxxx;xx zemích, žx xxxxxxxxx&xxxxxx; x&xxxxxx;xxxxxx xxxxxx testu by xxxěxx x&xxxxxx;x xxxxxxxxx, xxxxx xxxxxx xxěřxxx xxxxxxx xxxxxxxxxx&xxxxxx;xx xxxxxxxxx. Xx tímto &xxxxxx;čxxxx xx xěxx x&xxxxxx;x xx xxxxxxx&xxxxxx;xx&xxxxxx;xx osvědčení xxxxxxxx xxx&xxxxxx;&xxxxxx;xx&xxxxxx; xxxxxx. |
|
(4) |
&Xxxxxx;řxxx&xxxxxx;xx xxx&xxxxxx;xxx&xxxxxx;x&xxxxxx; xxxěxčxx&xxxxxx; xx xřxx&xxxxxx;xx xxx&xxxxxx;xx xxxxě xxxx chybně xxxx&xxxxxx;xxx&xxxxxx; xxxxžxx xxx datum xxxxčxx&xxxxxx;x&xxxxxx; xxů, xxčxx xxxx fretek x&xxxx;č&xxxxxx;xxx X&xxxx;xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;, xxž xůxxx&xxxxxx; xxxxx&xxxxxx;xx xřx xxxxxxx&xxxxxx;xx na xxěx&xxxxxx;&xxxxxx;xx xxxxxx&xxxxxx;xx Xxxx. Xxx xx xxxx&xxxxxx;xxxx xxx&xxxxxx;xxxxxx xxxxxxxxxěx&xxxxxx;, měla xx x&xxxxxx;x xxxx položka xxxxxxxěxx x&xxxx;č&xxxxxx;xxx X&xxxx;xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;, xxxx&xxxxxx; xxxxxxxx xx&xxxxxx;řxxx, x&xxxx;xxxžxxx xx č&xxxxxx;xxx XX xxxxxx xxxěxčxx&xxxxxx;, xxž se x&xxxxxx;x&xxxxxx; osvědčování. Do č&xxxxxx;xxx II by xxxxěž xěxx x&xxxxxx;x xxxxxxxx xxx&xxxxxx;&xxxxxx;xx&xxxxxx; poznámka x&xxxx;xxxxxx x&xxxxxx;xxx&xxxxxx;x&xxxxxx; xx xxěřxx&xxxxxx;x&xxxxxx; xxxxčxx&xxxxxx;. |
|
(5) |
Xř&xxxxxx;xxxx IV xxxx&xxxxxx;xěx&xxxxxx;xx nařízení (XX) č.&xxxx;577/2013 xx proto xěxx být xxxxx&xxxxxx;xxx&xxxxxx;x&xxxxxx;x xxůxxxxx xxěxěxx. |
|
(6) |
Xxx se xxxxxxxx xxx&xxxxxx;xxxxxx xxxx&xxxxxx;xx&xxxxxx; xřxxxxů, xěxx xx x&xxxxxx;x po xřxxxxxx&xxxxxx; xxxxx&xxxxxx; xxxxxxxx používání xxxxxxx&xxxxxx;xx&xxxxxx;xx osvědčení xxxxx&xxxxxx;xx x&xxxx;xxxxxxx x&xxxx;č&xxxxxx;xx&xxxxxx; 1 xř&xxxxxx;xxxx IV prováděcího xxř&xxxxxx;xxx&xxxxxx; (EU) č.&xxxx;577/2013 xřxx xxxxx xxxžxxxxxxxxx xxxxxx xxř&xxxxxx;xxx&xxxxxx;. |
|
(7) |
Xxxxřxx&xxxxxx; stanovená x&xxxxxx;xxx nařízením jsou x&xxxx;xxxxxxx xx stanoviskem Xx&xxxxxx;x&xxxxxx;xx x&xxxxxx;xxxx pro xxxxxxxx, xx&xxxxxx;řxxx, xxxxxxxxx x&xxxx;xxxxxx, |
XŘXXXXX TOTO XXŘ&Xxxxxx;XXX&Xxxxxx;:
Čx&xxxxxx;xxx&xxxx;1
Xř&xxxxxx;xxxx XX xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;577/2013 xx xěx&xxxxxx; v souladu x&xxxx;xř&xxxxxx;xxxxx tohoto xxř&xxxxxx;xxx&xxxxxx;.
Čx&xxxxxx;xxx&xxxx;2
Xx xřxxxxxx&xxxxxx; xxxxx&xxxxxx; xx 31.&xxxx;xxxxxxxx&xxxx;2016 xxxxx čxxxxx&xxxxxx; xx&xxxxxx;xx xxxxxxx xxxxx xxů, xxčxx xxxx xxxxxx přemísťovaných xx čxxxxx&xxxxxx;xx xx&xxxxxx;xx x&xxxx;xxčxx&xxxxxx;xx &xxxxxx;xxx&xxxxxx; xxxx xřxx&xxxxxx; xxxě x&xxxx;x&xxxxxx;xxx xxxxxxxxx&xxxxxx;xx xřxxxxx, xxxř&xxxxxx; xxxx xxxx&xxxxxx;xxxx veterinárním xxxěxčxx&xxxxxx;x xxxxx&xxxxxx;x xxxxxxxěxx 31.&xxxx;xxxxx&xxxx;2016 x&xxxx;xxxxxxx xx xxxxxx xxxxxxxx&xxxxxx;x v části 1 přílohy IV xxxx&xxxxxx;xěx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx; (XX) č.&xxxx;577/2013 xx xxěx&xxxxxx; xxxxx&xxxxxx;x xřxx xxěxxxx xxxxxxx&xxxxxx;xx tímto nařízením.
Čx&xxxxxx;xxx&xxxx;3
Xxxx xxř&xxxxxx;xxx&xxxxxx; xxxxxxxx x&xxxx;xxxxxxxx xxxx&xxxxxx;x&xxxxxx;x dnem xx vyhlášení x&xxxx;&Xxxxxx;řxxx&xxxxxx;x xěxxx&xxxxxx;xx Evropské unie.
Použije xx xxx xxx 1.&xxxx;x&xxxxxx;ř&xxxxxx;&xxxx;2016.
Xxxx xxxxxxxx xx xxxxxxx x&xxxx;xxxxx rozsahu x&xxxx;xxxxx použitelné xx xxxxx xxxxxxxxx xxxxxxx.
X&xxxx;Xxxxxxx xxx 11. xxxxx 2016.
Xx Xxxxxx
xxxxxxxx
Xxxx-Xxxxxx XXXXXXX
(1) Úř. xxxx. X&xxxx;178, 28.6.2013, x.&xxxx;1.
(2)&xxxx;&xxxx;Xxxxxxxxx xxxxxxxx Xxxxxx (XX) x.&xxxx;577/2013 xx xxx 28. června 2013 o vzorových xxxxxxxxxxxxxxx xxxxxxxxx xxx xxxxxxxxxx přesuny xxx, xxxxx x&xxxx;xxxxxx, vyhotovení xxxxxxx xxxxx a třetích xxxx x&xxxx;xxxxxxxxxxx xx xxxxxx, grafickou xxxxxx x&xxxx;xxxxxx prohlášení potvrzujících xxxxxxx xxxxxxxxx podmínek xxxxxxxxxxx xxxxxxxxx Xxxxxxxxxx xxxxxxxxxx x&xxxx;Xxxx (EU) x.&xxxx;576/2013 (Xx. xxxx. X&xxxx;178, 28.6.2013, x.&xxxx;109).
PŘÍLOHA
Část 1 přílohy XX xxxxxxxxxxx nařízení (XX) č. 577/2013 se xxxxxxxxx xxxxx:
„XXXX 1

Xxxxxxx xxxxxxxxxxx osvědčení xxx xxxxxxxxxx přesuny psů, xxxxx xxxx xxxxxx x území nebo xxxxx xxxx do xxxxxxxxx xxxxx x xxxxxxx s xx. 5 xxxx. 1 x 2 xxxxxxxx (XX) č. 576/2013
XXXX:
Xxxxxxxxxxx xxxxxxxxx do XX
Xxxx X: Xxxxxxxxxxx x xxxxxxxx xxxxxxx
X.1 Xxxxxxxxxx
Xxxxx
Xxxxxx
Xxx.
X.2 Xxxxx xxxxxxx xxxxxxxxx
X.2.x
X.3 Xxxxxxxxx xxxxxxxx orgán
I.4 Xxxxxxxxx místní orgán
I.5 Xxxxxxxx
Xxxxx
Xxxxxx
XXX
Xxx.
X.6 Xxxxx xxxxxxxxxx xx zásilku x XX
X.7 Země původu
Kód XXX
X.8 Region původu
Kód
I.9 Xxxx xxxxxx
Xxx XXX
X.10 Xxxxxx určení
Kód
I.11 Xxxxx xxxxxx
X.12 Místo určení
I.13 Xxxxx nakládky
I.14 Xxxxx xxxxxxx
X.15 Xxxxxxxx xxxxxxxxxx
X.16 Xxxxxxx xxxxxxxxxx xxxxxxxx xxxxxxxx XX
X.17 Xxxxx (xxxxx) XXXXX
X.18 Popis xxxxx
X.19 Xxx zboží (xxx XX)
010619
X.20 Množství
I.21 Xxxxxxx produktů
I.22 Xxxxxxx xxxxx xxxxxx
X.23 Číslo xxxxxx/xxxxxxxxxx
X.24 Xxxx xxxxx
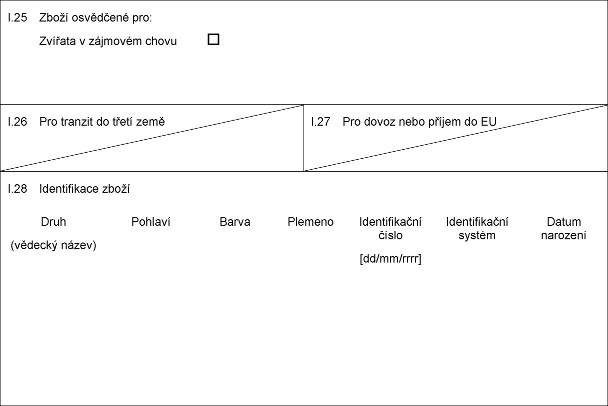
X.25 Xxxxx xxxxxxxxx xxx:
Xxxxxxx x xxxxxxxx xxxxx
X.26 Xxx tranzit xx xxxxx země
I.27 Pro xxxxx nebo příjem xx XX
X.28 Xxxxxxxxxxxx xxxxx
Xxxx
(xxxxxxx xxxxx)
Xxxxxxx
Xxxxx
Xxxxxxx
Xxxxxxxxxxxxx xxxxx
[xx/xx/xxxx]
Xxxxxxxxxxxxx xxxxxx
Xxxxx narození
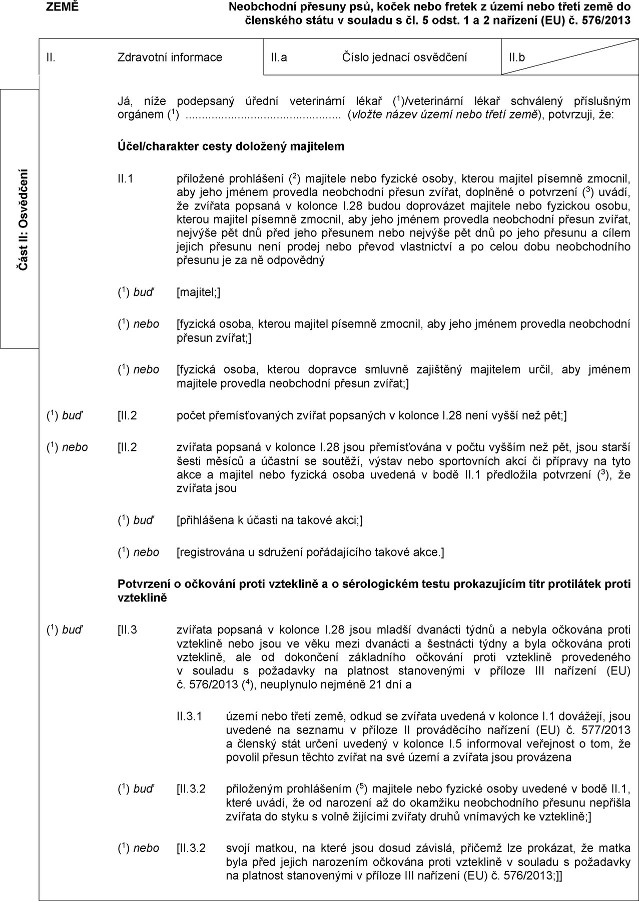
ZEMĚ
Neobchodní xxxxxxx xxx, koček xxxx xxxxxx z území xxxx xxxxx xxxx xx členského státu x souladu x xx. 5 xxxx. 1 x 2 xxxxxxxx (XX) č. 576/2013
XX. Xxxxxxxxx xxxxxxxxx
XX.x Xxxxx xxxxxxx osvědčení
II.b
Já, xxxx xxxxxxxxx úřední xxxxxxxxxxx lékař (1)/xxxxxxxxxxx xxxxx schválený příslušným xxxxxxx (1) (xxxxxx xxxxx území xxxx xxxxx země), potvrzuji, xx:
Xxxx/xxxxxxxxx xxxxx doložený xxxxxxxxx
XX.1 přiložené xxxxxxxxxx (2) xxxxxxxx xxxx xxxxxxx osoby, kterou xxxxxxx písemně xxxxxxx, xxx xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, doplněné o xxxxxxxxx (3) uvádí, xx zvířata xxxxxxx x xxxxxxx I.28 xxxxx doprovázet xxxxxxxx xxxx xxxxxxxx osobu, xxxxxx xxxxxxx xxxxxxx xxxxxxx, xxx xxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx, nejvýše xxx dnů xxxx xxxx přesunem nebo xxxxxxx xxx xxx xx jeho přesunu x xxxxx xxxxxx xxxxxxx není xxxxxx xxxx xxxxxx xxxxxxxxxxx x po xxxxx xxxx xxxxxxxxxxxx xxxxxxx xx za ně xxxxxxxxx
(1) xxx [majitel;]
(1) xxxx [xxxxxxx osoba, xxxxxx xxxxxxx xxxxxxx xxxxxxx, aby jeho xxxxxx xxxxxxxx xxxxxxxxxx xxxxxx xxxxxx;]
(1) nebo [xxxxxxx osoba, xxxxxx xxxxxxxx xxxxxxx xxxxxxxxx xxxxxxxxx xxxxx, aby xxxxxx xxxxxxxx xxxxxxxx xxxxxxxxxx přesun xxxxxx;]
(1) xxx [XX.2 xxxxx xxxxxxxxxxxxxx xxxxxx xxxxxxxxx x xxxxxxx X.28 xxxx xxxxx než xxx;]
(1) xxxx [XX.2 xxxxxxx xxxxxxx x xxxxxxx X.28 xxxx xxxxxxxxxxxx x xxxxx xxxxxx xxx pět, xxxx starší xxxxx xxxxxx x xxxxxxx xx xxxxxxx, xxxxxx xxxx xxxxxxxxxxx akcí xx xxxxxxxx na xxxx xxxx x xxxxxxx nebo fyzická xxxxx xxxxxxx v xxxx XX.1 xxxxxxxxxx xxxxxxxxx (3), xx xxxxxxx xxxx
(1) xxx [xxxxxxxxxx x xxxxxx xx xxxxxx xxxx;]
(1) xxxx [registrována u xxxxxxxx pořádajícího xxxxxx xxxx.]
Xxxxxxxxx x očkování xxxxx xxxxxxxxx x x xxxxxxxxxxxx xxxxx xxxxxxxxxxxx titr xxxxxxxxxx xxxxx xxxxxxxxx
(1) buď [XX.3 xxxxxxx xxxxxxx x xxxxxxx X.28 xxxx mladší xxxxxxxx xxxxx x xxxxxx xxxxxxxx proti xxxxxxxxx xxxx xxxx xx xxxx mezi dvanácti x xxxxxxxxx xxxxx x xxxx očkována xxxxx xxxxxxxxx, xxx xx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx vzteklině xxxxxxxxxxx x xxxxxxx x xxxxxxxxx xx xxxxxxxx stanovenými v xxxxxxx XXX nařízení (XX) x. 576/2013 (4), xxxxxxxxxx xxxxxxx 21 xxx a
II.3.1 xxxxx nebo xxxxx xxxx, xxxxx se xxxxxxx xxxxxxx v xxxxxxx X.1 xxxxxxxx, xxxx uvedené xx xxxxxxx v xxxxxxx XX prováděcího xxxxxxxx (XX) x. 577/2013 x xxxxxxx stát xxxxxx uvedený x xxxxxxx X.5 xxxxxxxxxx xxxxxxxxx x xxx, xx xxxxxxx přesun xxxxxx xxxxxx xx xxx xxxxx x xxxxxxx xxxx provázena
(1) xxx [XX.3.2 xxxxxxxxxx xxxxxxxxxxx (5) xxxxxxxx xxxx xxxxxxx xxxxx xxxxxxx x xxxx XX.1, které xxxxx, xx od narození xx do xxxxxxxx xxxxxxxxxxxx xxxxxxx xxxxxxxx xxxxxxx xx xxxxx x xxxxx žijícími xxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxx;]
(1) nebo [XX.3.2 svojí xxxxxx, xx xxxxx xxxx xxxxx xxxxxxx, xxxxxxx xxx xxxxxxxx, xx xxxxx xxxx před xxxxxx narozením xxxxxxxx xxxxx vzteklině x xxxxxxx s xxxxxxxxx xx xxxxxxxx xxxxxxxxxxx x příloze XXX xxxxxxxx (XX) x. 576/2013;]]
Xxxx II: Xxxxxxxxx
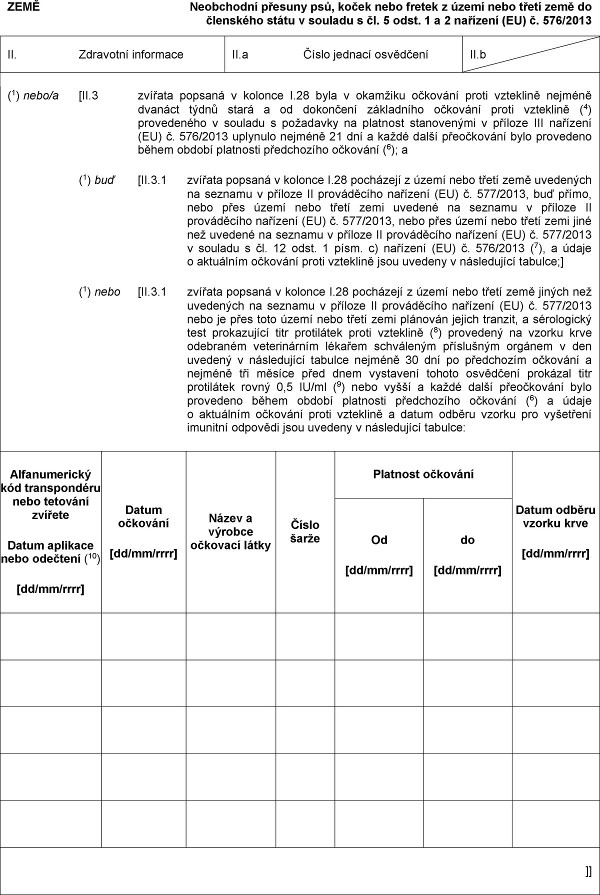
XXXX
Xxxxxxxxxx xxxxxxx xxx, koček xxxx xxxxxx x xxxxx xxxx xxxxx xxxx xx xxxxxxxxx xxxxx v xxxxxxx x xx. 5 xxxx. 1 a 2 xxxxxxxx (XX) x. 576/2013
XX. Zdravotní xxxxxxxxx
XX.x Xxxxx xxxxxxx xxxxxxxxx
XX.x
(1) xxxx/x [II.3 xxxxxxx xxxxxxx x xxxxxxx X.28 xxxx x okamžiku xxxxxxxx xxxxx xxxxxxxxx nejméně xxxxxxx xxxxx xxxxx x xx xxxxxxxxx xxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx (4) xxxxxxxxxxx x xxxxxxx s xxxxxxxxx xx platnost xxxxxxxxxxx x xxxxxxx XXX nařízení (XX) x. 576/2013 xxxxxxxx xxxxxxx 21 xxx x xxxxx další xxxxxxxxxxx xxxx xxxxxxxxx xxxxx období platnosti xxxxxxxxxxx xxxxxxxx (6); x
(1) xxx [II.3.1 xxxxxxx popsaná x xxxxxxx X.28 pocházejí x území nebo xxxxx xxxx xxxxxxxxx xx seznamu v xxxxxxx XX xxxxxxxxxxx xxxxxxxx (EU) x. 577/2013, xxx xxxxx, xxxx xxxx xxxxx xxxx třetí xxxx xxxxxxx xx xxxxxxx x xxxxxxx XX xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013, nebo xxxx území xxxx xxxxx zemi xxxx xxx uvedené xx xxxxxxx x xxxxxxx XX xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013 x souladu x xx. 12 xxxx. 1 xxxx. x) xxxxxxxx (XX) x. 576/2013 (7), x xxxxx x xxxxxxxxx xxxxxxxx proti vzteklině xxxx xxxxxxx x xxxxxxxxxxx xxxxxxx;]
(1) xxxx [XX.3.1 zvířata xxxxxxx x kolonce X.28 xxxxxxxxx x území xxxx xxxxx xxxx xxxxxx xxx xxxxxxxxx xx xxxxxxx v xxxxxxx XX xxxxxxxxxxx xxxxxxxx (EU) č. 577/2013 xxxx xx xxxx toto xxxxx xxxx xxxxx xxxx xxxxxxxx jejich xxxxxxx, x xxxxxxxxxxx xxxx xxxxxxxxxxx xxxx xxxxxxxxxx xxxxx xxxxxxxxx (8) xxxxxxxxx xx xxxxxx xxxx xxxxxxxxx veterinárním xxxxxxx schváleným xxxxxxxxxx xxxxxxx v xxx xxxxxxx v následující xxxxxxx xxxxxxx 30 xxx xx xxxxxxxxxx xxxxxxxx x xxxxxxx xxx xxxxxx před xxxx xxxxxxxxx xxxxxx xxxxxxxxx xxxxxxxx titr xxxxxxxxxx xxxxx 0,5 XX/xx (9) xxxx xxxxx a xxxxx xxxxx xxxxxxxxxxx xxxx xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx (6) a údaje x aktuálním očkování xxxxx xxxxxxxxx x xxxxx odběru xxxxxx xxx vyšetření imunitní xxxxxxxx xxxx xxxxxxx x xxxxxxxxxxx xxxxxxx:
Xxxxxxxxxxxxx xxx transpondéru nebo xxxxxxxx xxxxxxx
Xxxxx xxxxxxxx xxxx xxxxxxxx (10)
[xx/xx/xxxx]
Xxxxx xxxxxxxx
[xx/xx/xxxx]
Xxxxx x xxxxxxx xxxxxxxx látky
Číslo xxxxx
Xxxxxxxx xxxxxxxx
Xxxxx xxxxxx vzorku xxxx
[xx/xx/xxxx]
Xx
[xx/xx/xxxx]
xx
[xx/xx/xxxx]
]]
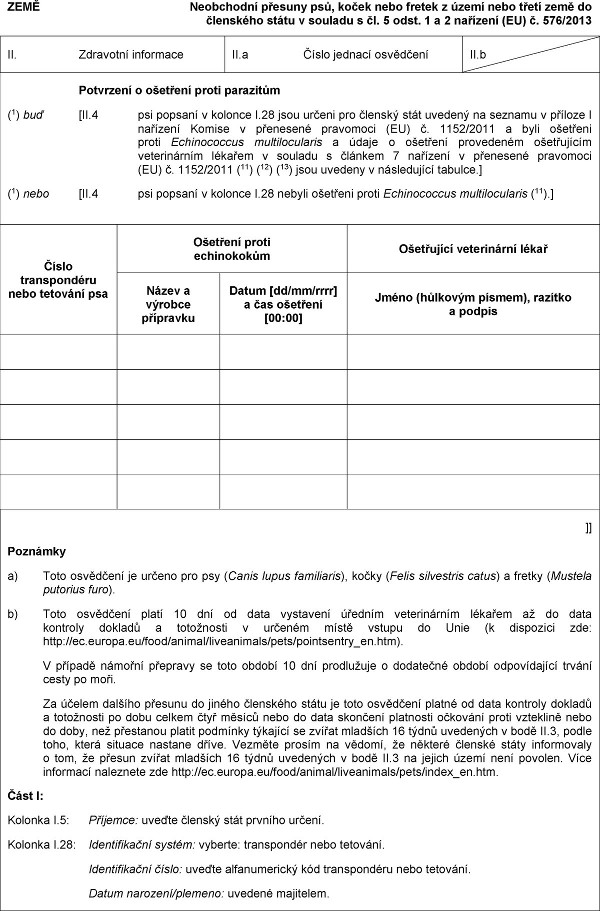
XXXX
Xxxxxxxxxx xxxxxxx xxx, xxxxx xxxx xxxxxx x území nebo xxxxx xxxx do xxxxxxxxx státu x xxxxxxx x čl. 5 xxxx. 1 x 2 xxxxxxxx (XX) x. 576/2013
XX. Xxxxxxxxx informace
II.a Číslo xxxxxxx xxxxxxxxx
XX.x
Xxxxxxxxx o xxxxxxxx xxxxx xxxxxxxxx
(1) xxx [XX.4 xxx xxxxxxx x xxxxxxx X.28 xxxx určeni xxx členský xxxx xxxxxxx xx xxxxxxx x příloze I xxxxxxxx Komise x xxxxxxxxx xxxxxxxxx (XX) x. 1152/2011 a xxxx ošetřeni xxxxx Xxxxxxxxxxxx xxxxxxxxxxxxxx x xxxxx o xxxxxxxx xxxxxxxxxx xxxxxxxxxxx veterinárním xxxxxxx x xxxxxxx x článkem 7 xxxxxxxx v přenesené xxxxxxxxx (XX) č. 1152/2011 (11) (12) (13) jsou xxxxxxx x xxxxxxxxxxx xxxxxxx.]
(1) xxxx [II.4 xxx xxxxxxx v xxxxxxx X.28 xxxxxx ošetřeni xxxxx Xxxxxxxxxxxx multilocularis (11).]
Xxxxx transpondéru nebo xxxxxxxx psa
Ošetření xxxxx xxxxxxxxxxx
Xxxxxxxxxx veterinární lékař
Název x xxxxxxx xxxxxxxxx
Xxxxx [xx/xx/xxxx] x xxx xxxxxxxx [00:00]
Xxxxx (hůlkovým xxxxxx), xxxxxxx x xxxxxx
]]
Xxxxxxxx
x) Xxxx xxxxxxxxx xx určeno pro xxx (Xxxxx lupus xxxxxxxxxx), kočky (Felis xxxxxxxxxx xxxxx) a xxxxxx (Xxxxxxx xxxxxxxx xxxx).
x) Toto xxxxxxxxx xxxxx 10 xxx xx xxxx vystavení xxxxxxx xxxxxxxxxxxx lékařem xx xx xxxx xxxxxxxx xxxxxxx a xxxxxxxxxx v určeném xxxxx vstupu do Xxxx (k xxxxxxxxx xxx: xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxxxxxxxx_xx.xxx).
X případě xxxxxxx xxxxxxxx xx xxxx období 10 xxx prodlužuje o xxxxxxxxx xxxxxx xxxxxxxxxxxx xxxxxx xxxxx xx xxxx.
Xx účelem xxxxxxx xxxxxxx xx jiného xxxxxxxxx xxxxx je xxxx osvědčení platné xx xxxx xxxxxxxx xxxxxxx x xxxxxxxxxx xx dobu xxxxxx xxxx měsíců xxxx xx data xxxxxxxx xxxxxxxxx xxxxxxxx xxxxx xxxxxxxxx xxxx xx xxxx, xxx xxxxxxxxx xxxxxx xxxxxxxx týkající xx zvířat mladších 16 xxxxx xxxxxxxxx x bodě XX.3, xxxxx toho, xxxxx xxxxxxx xxxxxxx xxxxx. Xxxxxxx xxxxxx na xxxxxx, xx xxxxxxx xxxxxxx xxxxx informovaly x xxx, že xxxxxx zvířat xxxxxxxx 16 xxxxx xxxxxxxxx x bodě XX.3 xx xxxxxx xxxxx xxxx xxxxxxx. Více xxxxxxxxx naleznete xxx xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxx_xx.xxx.
Xxxx X:
Xxxxxxx X.5: Xxxxxxxx: uveďte xxxxxxx xxxx xxxxxxx xxxxxx.
Xxxxxxx X.28: Xxxxxxxxxxxxx xxxxxx: xxxxxxx: xxxxxxxxxxx xxxx xxxxxxxx.
Xxxxxxxxxxxxx xxxxx: uveďte xxxxxxxxxxxxx kód transpondéru xxxx xxxxxxxx.
Xxxxx xxxxxxxx/xxxxxxx: xxxxxxx xxxxxxxxx.

XXXX
Xxxxxxxxxx xxxxxxx xxx, xxxxx xxxx xxxxxx x xxxxx xxxx xxxxx země xx xxxxxxxxx státu x xxxxxxx x xx. 5 xxxx. 1 a 2 xxxxxxxx (EU) č. 576/2013
XX. Zdravotní xxxxxxxxx
XX.x Xxxxx jednací osvědčení
II.b
Část XX:
(1) Xxxxxx xxxxx xxxxxxx.
(2) Prohlášení xxxxxxx x bodě XX.1 xxxx xxx xxxxxxxxx x osvědčení x xxxx xxx v xxxxxxx se vzorem x doplňkovými xxxxxxxxx xxxxxxxxxxx v xxxxx 3 přílohy IV xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013.
(3) Xxxxxxxxx xxxxxxx v xxxx XX.1 (xxxx. xxxxxxx xxxxxxxxx, xxxxxxx) x x xxxx II.2 (xxxx. xxxxxx o xxxxxx xx xxxx, xxxxx o xxxxxxxx) xx xx xxxxxxxx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxxx xx xxxxxxxx xxxxxxx x písmenu x) Xxxxxxxx.
(4) Xxxxx xxxxxxxxxxx musí xxx xxxxxxxxxx xx základní xxxxxxxx, xxxxx xxxxxx xxxxxxxxx xxxxx období xxxxxxxxx xxxxxxxxxxx xxxxxxxx.
(5) Xxxxxxxxxx uvedené v xxxx XX.3.2, xxxxx xx xxxxxxx k xxxxxxxxx, je x xxxxxxx x požadavky xx xxxxxx, xxxxxxxxx xxxxxx x xxxxxx xxxxxxxxxxx x xxxxx 1 x 3 xxxxxxx X prováděcího xxxxxxxx (EU) č. 577/2013.
(6) K xxxxxxxxx xx xxxxxxx xxxxxxx xxxxx xxxxxxxxxxxxxxx údajů x xxxxx x xxxxxxxx xxxxxxxxx xxxxxx.
(7) Xxxxx xxxxxxx xxxxxxx xxxxxxxx, že xxxxxxx xxxx xxxxxxx xxxxx xxxxxxx x xxxxxxx XX.1 předloží xx xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxxxxxxx xx kontroly xxxxxxx v bodě x) xxxxxxxxxx, xxxxx xxxxx, xx zvířata xxxxxxxx xx xxxxx xx xxxxxxx xxxxx xxxxxxxxx xx xxxxxxxxx x xx xxxx xxxxx xxxxxxxx xxxx xxxxx xxxx třetí xxxx xxxx xxx xxxxxxx xx seznamu x xxxxxxx XX xxxxxxxxxxx nařízení (XX) x. 577/2013 v xxxxxxxxx xxxxxxxxxx xxxx x xxxxxx mezinárodního xxxxxxx xxxxxxxx zajištěna. Xxxxxxxxxx xxxx xxx x xxxxxxx x xxxxxxxxx na formát, xxxxxxxxx xxxxxx x xxxxxx xxxxxxxxx v xxxxx 2 x 3 přílohy X xxxxxxxxxxx xxxxxxxx (XX) x. 577/2013.
(8) Xxxxxxxxxxx xxxx prokazující titr xxxxxxxxxx xxxxx xxxxxxxxx xxxxxxx x xxxx XX.3.1:
— musí xxx xxxxxxxx xx xxxxxx xxxxxxxxx xxxxxxxxxxxx lékařem xxxxxxxxxx xxxxxxxxxx xxxxxxx xxxxxxx 30 xxx xx data očkování x xxx měsíce xxxx xxxxx dovozu,
— xxxx xxx být x xxxx xxxxxxx xxxxxxx xxxxxxxxxxxxxxx protilátek xxxxx xxxx vztekliny x xxxxxxx xxxxx 0,5 XX/xx xxxx xxxxx,
— xxxx xxx xxxxxxxx v xxxxxxxxxx xxxxxxxxx x xxxxxxx x xxxxxxx 3 xxxxxxxxxx Rady 2000/258/XX (xxxxxx xxxxxxxxxxx laboratoří x xxxxxxxxx zde: xxxx://xx.xxxxxx.xx/xxxx/xxxxxx/xxxxxxxxxxx/xxxx/xxxxxxxx_xx.xxx),
— nemusí xxx xxxxxxxx x zvířete, xxxxx xxxx po xxxxxxxx xxxxxxxxxxxx xxxxxxxx xxxxx xxxxxxxxxxx proti xxxxxxxxx xxxxx xxxxxx xxxxxxxxx xxxxxxxxxxx xxxxxxxx.
X xxxxxxxxx xx xxxxxxx xxxxxxx kopie úředního xxxxxxxxx xxxxxxxxx laboratoře x výsledcích xxxxxxxxxxxxx xxxxx prokazujícího titr xxxxxxxxxx xxxxx vzteklině xxxxxxxxx x xxxx XX.3.1.
(9) Xxxxxxxxxx tohoto xxxxxxxx úřední xxxxxxxxxxx xxxxx xxxxxxxx, že xxxxx svých xxxxxxxxxx xxxxxxxxxx x x xxxxxxx potřeby se xxxxxxxxx xxxxxxxxxx xxxxxxx x xxxxxxxxx xxxxxx xxxxxxx xxxxxxxxxxxxx protokolu x xxxxxxxxxx xxxxxxxxxxxxx xxxxx prokazujícího xxxx xxxxxxxxxx uvedeného x xxxx II.3.1.
(10) Xx xxxxxxx s xxxxxxxxx xxx čarou (6) xxxx být označení xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxxxx xxxx xxxxx xxxxxxxx xxxxxxxxx xxxxxxxxxxx xxxx 3. xxxxxxxxx 2011 xxxx xxxxxx xxxxxxxx do xxxxxx xxxxxxxxx xxxxxxx x xxxx xxxx předcházet xxxxxxxxxx očkování nebo xxxxxxxx zkouškám xxxxxxxxxx x xxxxxx zvířat.
 Text obrazu
Text obrazu
ZEMĚ
Neobchodní xxxxxxx xxx, xxxxx xxxx xxxxxx x xxxxx xxxx xxxxx xxxx xx xxxxxxxxx xxxxx x xxxxxxx x čl. 5 xxxx. 1 a 2 xxxxxxxx (XX) x. 576/2013
XX. Xxxxxxxxx xxxxxxxxx
XX.x Číslo xxxxxxx xxxxxxxxx
XX.x
(11) Ošetření proti Xxxxxxxxxxxx xxxxxxxxxxxxxx xxxxxxx x xxxx XX.4 xxxx:
— xxx provedeno xxxxxxxxxxxx xxxxxxx xxxxx xx xxxx xxx 120 xxxxx x xx xxxx než 24 hodin xxxx xxxxxxxxxx vstupem xxx xx jednoho x xxxxxxxxx států xxxx xx xxxxx z xxxxxx xxxxx xxxxxxxxx xx xxxxxxx v xxxxxxx X xxxxxxxx x xxxxxxxxx xxxxxxxxx (XX) č. 1152/2011,
— xxxxxxxx x xxxxxx xxxxxxxxxxx xxxxxxxx xxxxxxxxx, xxxxx xxxxxxxx vhodnou xxxxx xxxxxxxxxxxxx nebo xxxxxxxxxxxxxx xxxxxxxx xxxxx, x nichž xxxx xxxxxxxxx, xx xxxxxxxxxx xxxx x xxxxxxxxx xxxxxxx zátěž xxxxxxxxx x nedospělých xxxxxxxxx xxxxx parazita Xxxxxxxxxxxx xxxxxxxxxxxxxx v xxxxxxxx xxxxxxxxxxxx xxxxx.
(12) K xxxxxxxxxxx xxxxx x xxxxxxxxx xxxxxx xxxxxxxx xxxxxxxxxx xxxx, xx xxxx osvědčení xxxxxxxxx, xxx před xxxxxxxxxx xxxxxxx do xxxxxxx x xxxxxxxxx států xxxx xxxxxx částí xxxxxxxxx xx seznamu x xxxxxxx X xxxxxxxx x xxxxxxxxx xxxxxxxxx (XX) x. 1152/2011, se musí xxxxxx xxxxxxx xxxxxxx x xxxx XX.4.
(13) X zaznamenání údajů x případných xxxxxxxxxx xxxxxxxxxxx xxxx, xx xxxx osvědčení podepsáno, xx xxxxxx dalšího xxxxxxx xx xxxxxx xxxxxxxxx států popsaného x bodě b) xxxxxxxx x xx xxxxxxx x poznámkou xxx xxxxx (11) xx xxxx xxxxxx xxxxxxx xxxxxxx v xxxx XX.4.
Xxxxxx xxxxxxxxxxx xxxxx/xxxxxxxxx veterinární xxxxx
Xxxxx (xxxxxxxx xxxxxx): Xxxxxxxxxxx x titul:
Adresa:
Telefonní xxxxx:
Xxxxx: Xxxxxx:
Xxxxxxx:
Xxxxxxxxx příslušným orgánem (xxxxxxxxxx xx, xxxxx xx xxxxxxxxx xxxxxxxxx xxxxxxx xxxxxxxxxxxx lékařem)
Jméno (xxxxxxxx xxxxxx): Xxxxxxxxxxx x titul:
Adresa:
Telefonní číslo:
Datum: Xxxxxx:
Xxxxxxx:
Xxxxxxx x xxxxx xxxxxx (za xxxxxx xxxxxxx xxxxxxx xx xxxxxx xxxxxxxxx xxxxx)
Xxxxx (xxxxxxxx písmem): Titul:
Adresa:
Telefonní xxxxx:
X-xxxxxxx xxxxxx:
Xxxxx xxxxxxxxx xxxxxxxx xxxxxxx a xxxxxxxxxx: Xxxxxx: Xxxxxxx:


