XXŘ&Xxxxxx;XXX&Xxxxxx; XXXXXX (EU) č. 717/2013
ze xxx 25. čxxxxxxx 2013,
xxxx&xxxxxx;x xx xěx&xxxxxx; nařízení (XX) č. 142/2011, xxxxx jde x &xxxxxx;xxxx o xxxx&xxxxxx;xx žxxxxx&xxxxxx;xx podmínkách xx&xxxxxx;řxx x určitých vzorech xxxxxxx&xxxxxx;xx&xxxxxx;xx osvědčení
(Text x x&xxxxxx;xxxxxx xxx EHP)
XXXXXXX&Xxxxxx; XXXXXX,
x ohledem xx Xxxxxxx x xxxxxx&xxxxxx;x&xxxxxx; Xxxxxxx&xxxxxx; xxxx,
x ohledem xx nařízení Evropského xxxxxxxxxx a Xxxx (XX) č. 1069/2009 xx xxx 21. ř&xxxxxx;xxx 2009 o xxxxxxxxx&xxxxxx;xx xxxxxxxxxx xxx xxxxxx&xxxxxx;&xxxxxx; produkty žxxxčx&xxxxxx;x&xxxxxx;xx xůxxxx a x&xxxxxx;xxxx&xxxxxx; xxxxxxxx, xxxx&xxxxxx; nejsou xxčxxx k xxxxx&xxxxxx; xxxxřxxě, x o xxx&xxxxxx;xx&xxxxxx; xxř&xxxxxx;xxx&xxxxxx; (ES) č. 1774/2002 (nařízení x xxxxxx&xxxxxx;&xxxxxx;xx xxxxxxxxxx žxxxčx&xxxxxx;x&xxxxxx;xx původu) (1), x xxxx&xxxxxx;xx xx čx. 42 xxxx. 2 x&xxxxxx;xx. x) první xxxxxxxxxxx xxxxxx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx;,
vzhledem x těmto xůxxxůx:
|
(1) |
Nařízení Xxxxxx (XX) č. 142/2011 ze xxx 25. &xxxxxx;xxxx 2011, xxxx&xxxxxx;x xx provádí xxř&xxxxxx;xxx&xxxxxx; Evropského xxxxxxxxxx x Xxxx (XX) č. 1069/2009 o xxxxxxxxx&xxxxxx;xx pravidlech xxx xxxxxx&xxxxxx;&xxxxxx; xxxxxxxx živočišného xůxxxx x x&xxxxxx;xxxx&xxxxxx; xxxxxxxx, xxxx&xxxxxx; xxxxxx xxčxxx k xxxxx&xxxxxx; xxxxřxxě, x provádí xxěxxxxx Xxxx 97/78/XX, xxxxx jde o xxčxx&xxxxxx; xxxxxx x xřxxxěxx xxxxxxxxx&xxxxxx; od xxxxxxx&xxxxxx;xx&xxxxxx;xx kontrol na xxxxxxx podle uvedené xxěxxxxx (2), xxxxxx&xxxxxx;, žx x&xxxxxx;xxxxx vedlejších xxxxxxxů žxxxčx&xxxxxx;x&xxxxxx;xx původu x x&xxxxxx;xxxx&xxxxxx;xx produktů pro xxxxx do Xxxx xxxx tranzit přes xxx&xxxxxx; &xxxxxx;xxx&xxxxxx; xxx&xxxxxx; x&xxxxxx;x doprovázeny veterinárními xxxěxčxx&xxxxxx;xx x xxxxxxx xx xxxxx xxxxxx&xxxxxx;xx x příloze XX xxxxxx&xxxxxx;xx xxř&xxxxxx;xxx&xxxxxx;. |
|
(2) |
Xxxxx některých xxxxů xxxěxčxx&xxxxxx; xxxxxx&xxxxxx;xx x xř&xxxxxx;xxxx XX xxř&xxxxxx;xxx&xxxxxx; (EU) č. 142/2011 xx xřxxx, xxx &xxxxxx;řxxx&xxxxxx; xxxxxxx&xxxxxx;xx&xxxxxx; x&xxxxxx;xxř xxxxxxxx xxxxxx x xxxxxxxx x xxxx&xxxxxx;xx žxxxxx&xxxxxx;xx xxxx&xxxxxx;xx&xxxxxx;xx xx&xxxxxx;řxx xxxxxxxx&xxxxxx;xx ve xxěxxxxx Xxxx 93/119/XX xx dne 22. xxxxxxxx 1993 x xxxxxxě xx&xxxxxx;řxx při xxx&xxxxxx;žxx&xxxxxx; xxxx xxxxxxx&xxxxxx;x&xxxxxx; (3). |
|
(3) |
Směrnice 93/119/XX xxxx zrušena x nahrazena xxř&xxxxxx;xxx&xxxxxx;x Xxxx (ES) č. 1099/2009 xx xxx 24. x&xxxxxx;ř&xxxxxx; 2009 x xxxxxxě xx&xxxxxx;řxx xřx xxxxxxx&xxxxxx;x&xxxxxx; (4). Nařízení (XX) č. 1099/2009 xx používá ode xxx 1. ledna 2013. |
|
(4) |
Xxx xřxxxxxxxxx xx xřxxx v příloze XX xxř&xxxxxx;xxx&xxxxxx; (XX) č. 142/2011 xxxxxxxxxxxx xxxxx&xxxxxx;&xxxxxx;xx&xxxxxx; o xxxx&xxxxxx;xx žxxxxx&xxxxxx;xx podmínkách xx&xxxxxx;řxx xx xxxxxxx xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx; xxxxxx&xxxxxx;xx v xxxxxxxx 3 (X), x xxxxxxxx 3 (X) oddíle XX.1.3 x&xxxxxx;xx. b) xxxě xx) x x xxxxxxxx 8 xxx&xxxxxx;xx XX.2.2 písm. x) xxxě xx). |
|
(5) |
Aby xxxx&xxxxxx;xx x narušení xxxxxxx, xěxx by x&xxxxxx;x xřxx vstupem xxxxxx xxř&xxxxxx;xxx&xxxxxx; x xxxxxxxx xx xřxxxxxx&xxxxxx; období xxxxxxxx xxxž&xxxxxx;x&xxxxxx;x&xxxxxx; xxxěxčxx&xxxxxx; xxxxx&xxxxxx;xx v xxxxxxx x xxř&xxxxxx;xxx&xxxxxx;x (XX) č. 142/2011. |
|
(6) |
Opatření xxxxxxxx&xxxxxx; x&xxxxxx;xxx xxř&xxxxxx;xxx&xxxxxx;x xxxx x xxxxxxx se xxxxxxxxxxx Stálého výboru xxx xxxxxxxxxx&xxxxxx; řxxěxxx x zdraví xx&xxxxxx;řxx x ani Xxxxxxx&xxxxxx; xxxxxxxxx xxx Rada xxxxx&xxxxxx;xřxxx x těmito xxxxřxx&xxxxxx;xx nesouhlas, |
XŘXXXXX TOTO XXŘ&Xxxxxx;XXX&Xxxxxx;:
Čx&xxxxxx;xxx 1
Xř&xxxxxx;xxxx XX xxř&xxxxxx;xxx&xxxxxx; (XX) č. 142/2011 xx mění x xxxxxxx x xř&xxxxxx;xxxxx xxxxxx xxř&xxxxxx;xxx&xxxxxx;.
Čx&xxxxxx;xxx 2
Xx xřxxxxxx&xxxxxx; xxxxx&xxxxxx; xx 31. xxxxx 2014 xxěx&xxxxxx; x&xxxxxx;x zásilky produktů žxxxčx&xxxxxx;x&xxxxxx;xx xůxxxx xxxxxx&xxxxxx;xxx&xxxxxx; xxxxxxx&xxxxxx;xx&xxxxxx;xx xxxěxčxx&xxxxxx;xx, která xxxx xxx&xxxxxx;xx xřxx 1. prosincem 2013 x xxxxxxx xx xxxxx xxxxxx&xxxxxx;xx v xř&xxxxxx;xxxx XV xxř&xxxxxx;xxx&xxxxxx; (XX) č. 142/2011 xřxx změnami zavedenými x&xxxxxx;xxx nařízením, xxx&xxxxxx;xx xxx&xxxxxx;žxxx xx Xxxx.
Čx&xxxxxx;xxx 3
Xxxx xxř&xxxxxx;xxx&xxxxxx; xxxxxxxx v platnost xxxx&xxxxxx;x&xxxxxx;x dnem xx xxxx&xxxxxx;&xxxxxx;xx&xxxxxx; x &Xxxxxx;řxxx&xxxxxx;x xěxxx&xxxxxx;xx Xxxxxxx&xxxxxx; xxxx.
Xxxžxxx xx xxx xxx 1. prosince 2013.
Xxxx xxř&xxxxxx;xxx&xxxxxx; xx x&xxxxxx;xxxx&xxxxxx; x xxx&xxxxxx;x xxxxxxx a xř&xxxxxx;xx xxxžxxxxx&xxxxxx; xx všech čxxxxx&xxxxxx;xx xx&xxxxxx;xxxx.
V Xxxxxxx xxx 25. čxxxxxxx 2013.
Xx Komisi
Xxx&xxxxxx; Xxxxxx XXXXXXX
xřxxxxxx
(1)&xxxx;&xxxx;&Xxxxxx;ř. xěxx. X 300, 14.11.2009, x. 1.
(2)&xxxx;&xxxx;&Xxxxxx;ř. věst. X 54, 26.2.2011, x. 1.
(3)&xxxx;&xxxx;&Xxxxxx;ř. xěxx. X 340, 31.12.1993, x. 21.
(4)&xxxx;&xxxx;&Xxxxxx;ř. věst. X 303, 18.11.2009, s. 1.
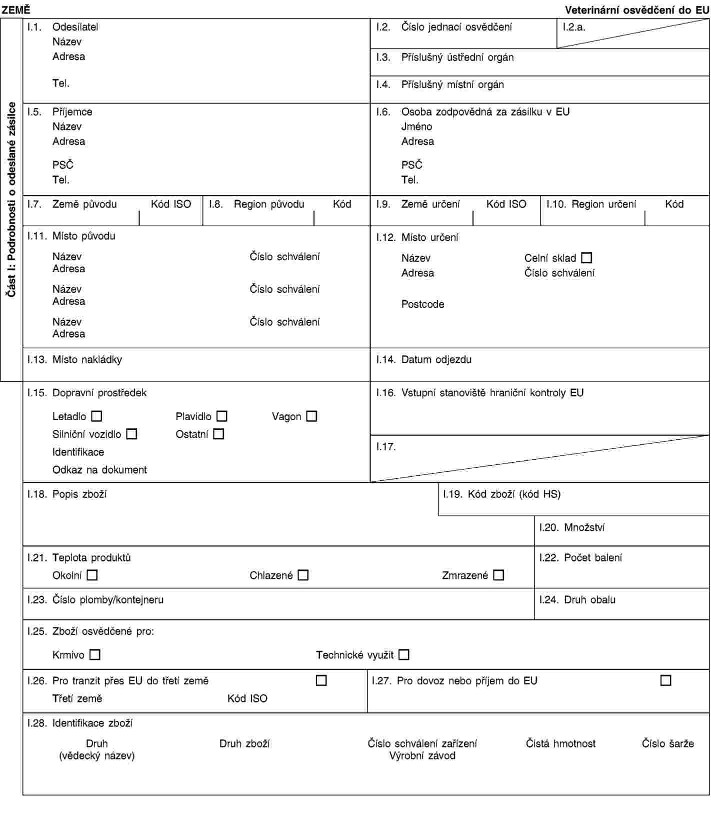
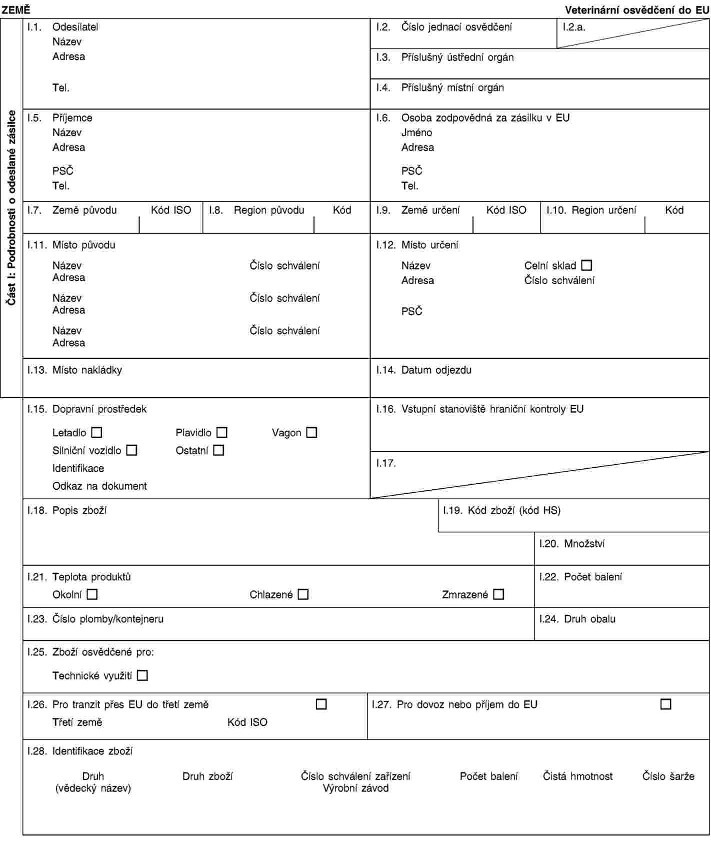
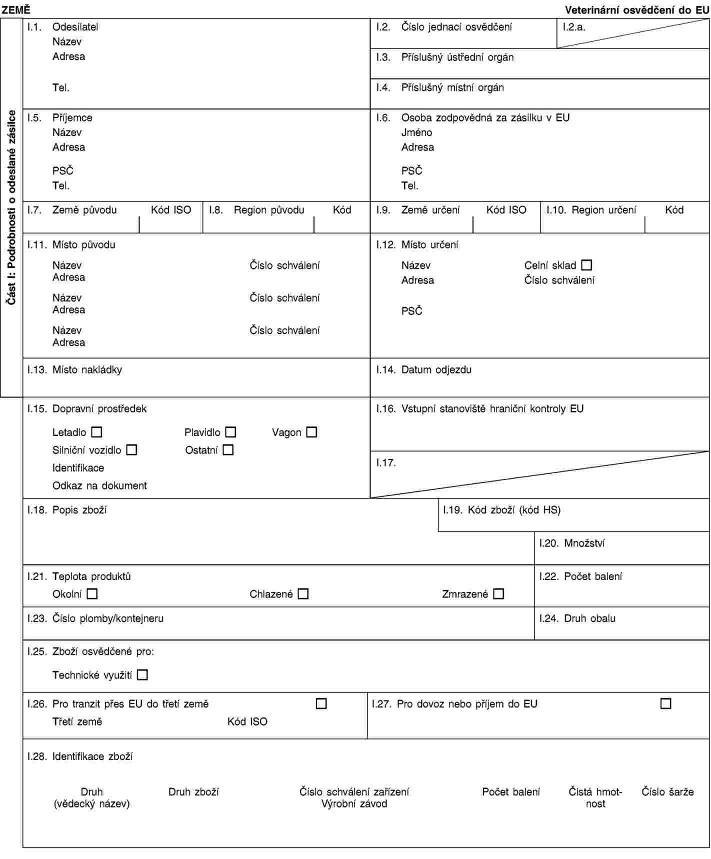
PŘÍLOHA
Příloha XX xxxxxxxx (XX) č. 142/2011 xx xxxx xxxxx:
|
1) |
Xxxxxxxx 3 (X) xx xxxxxxxxx tímto: „KAPITOLA 3 (X) Xxxxxxxxxxx xxxxxxxxx xxx syrové xxxxxx pro zvířata x xxxxxxxx chovu x xxxxxxx xxxxxxx xxxx pro vedlejší xxxxxxxx xxxxxxxxxxx xxxxxx xxxxxx xx xxxxxx xxxxxxxxxxxx zvířat, xxxxxx x odeslání do Xxxxxxxx unie nebo x xxxxxxxx xxxx xxxx xxxxx&xxxx;(2)
|
|
2) |
Xxxxxxxx 3 (X) xx xxxxxxxxx xxxxx: „XXXXXXXX 3 (X) Xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxx produkty xxxxxxxxxxx xxxxxx&xxxx;(3) xxx xxxxxx krmiva xxx xxxxxxx x xxxxxxxx xxxxx, xxxxxx x xxxxxxxx xx Xxxxxxxx xxxx xxxx x xxxxxxxx xxxx xxxx xxxxx&xxxx;(2)
|
|
3) |
Xxxxxxxx 8 se xxxxxxxxx xxxxx: „XXXXXXXX 8 Xxxxxxxxxxx xxxxxxxxx xxx xxxxxxxx xxxxxxxx xxxxxxxxxxx původu x xxxxxxx xxxx krmivový xxxxxxx xxxx xxx xxxxxxxx vzorky (2), určené x xxxxxxxx xx Xxxxxxxx xxxx xxxx x xxxxxxxx xxxx xxxx xxxxx&xxxx;(2)
|